Max Plank determina que para la luz
ΔE = h ν
donde ν es la frecuencia de la luz y h es la constante de Plank
h = 6.62 10 -34 Js
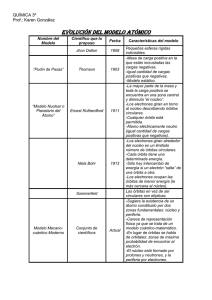
En 1913 Niels Bohr, desarrolló su modelo atómico de acuerdo a cuatro postulados
fundamentales:
1. Los electrones orbitan el átomo en órbitas circulares a las que corresponden niveles
discretos y cuantizados de energía. Por tanto, no todas las órbitas están permitidas, tan
sólo un número finito de éstas.
2. Los electrones pueden saltar de un nivel electrónico a otro sin pasar por estados
intermedios.
3. El salto de un electrón de un nivel cuántico a otro implica la emisión o absorción de un
único cuanto de luz (fotón) cuya energía corresponde a la diferencia de energía entre
ambas órbitas.
4. Las órbitas permitidas tienen valores discretos o cuantizados del momento angular orbital
L de acuerdo con la siguiente ecuación: L = n h/2π
Postulado 1: los electrones giran en órbitas estables alrededor del núcleo sin
absorber o emitir energía radiante.
Por tanto, la fuerza electromagnética actúa como centrípeta:
F e=
Keqq'
r2
e2
F e =K e 2
r
como q = carga del electrón e-, queda
2
La fuerza centrípeta será
2
Igualándolas:
Ke
m v
e
= e
2
r
r
F c=
mv
r donde m es la masa del electrón me
2
r=
y despejando
K e e2
mev2
Postulado 4: Sólo son posibles las órbitas en que el momento angular es múltiplo
de h/2π
Para órbitas circulares el momento angular L = r p = r mv
Si debe ser múltiplo de h/2π y la masa de lo que gira es la masa del electrón, me,
entonces:
L = n h/2π y por tanto, L = r me v = n h/2π
v =n
Despejando v tenemos:
r=
Como el postulado 1 implica que
2
h
ℏ v 2 =n 2 ℏ
=n
r 2 m e2
2 pi rm e
rm e
K e e2
mv
2
2 2
sustituimos v2 en esta expresión:
K e e r me
r=
m e n 2 ℏ2
Cuando n=1, r = 0.0529 nm , el radio de Bohr
2
r =n 2
y despejando
2
ℏ
=a n 2
2
K e e me
Postulado 3: Al saltar de órbita, absorbe o emite energía según los quantos de
Plank.
ΔE = h ν
Es decir, el incremento de energía será
1
e2
E =E c E p= m e v 2−K e
2
r
Para un electrón, la energía total es
2
2
2
m v
e
e
2
K e 2= e
m
v
=
K
e
e
r
r
r
Pero en el postulado 1 hemos visto que
luego
y por tanto
1
e2
e2
e2
E = K e − K e =−K e
2
r
r
2r y si sustituimos el radio del postulado 2:
2
ℏ
r =n 2
=a n 2
K ee2 me
tenemos que
2
2
4
e K e e me
m e 1
e2
1
E =−K e =−K e
=−K e 2 e 2 2 =−b 2
2 2
2r
2n ℏ
2ℏ n
n
Si un electrón salta ente dos órbitas de números cuánticos n1 y n2, la energía emitida o
absorbida será:
ΔE = E2 -E1 =
−K e 2 m e e 4
2 ℏ2
K e2 m e e 4 1
1
1
1
−
=
2
2
2
2−
n2
n1
2ℏ
n 1 n 22
= hν
Este resultado coincidía con el que los espectroscopistas habían encontrado en los
espectros del hidrógeno ya que, como para la luz su velocidad c es c= λ ν , podemos
escribir:
K e2 m e e 4 1
1
1
1
1/λ = ν/c =
2
2 − 2 =R
2−
2 ℏ c h n 1 n2
n 1 n 22
donde R es la constante de Rydberg