Gases Líquidos llenar
Anuncio
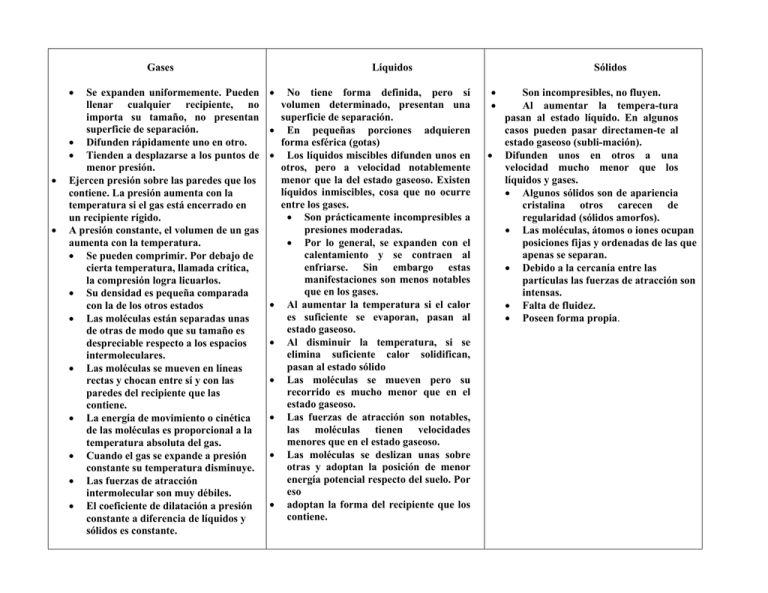
Gases Se expanden uniformemente. Pueden llenar cualquier recipiente, no importa su tamaño, no presentan superficie de separación. Difunden rápidamente uno en otro. Tienden a desplazarse a los puntos de menor presión. Ejercen presión sobre las paredes que los contiene. La presión aumenta con la temperatura si el gas está encerrado en un recipiente rígido. A presión constante, el volumen de un gas aumenta con la temperatura. Se pueden comprimir. Por debajo de cierta temperatura, llamada crítica, la compresión logra licuarlos. Su densidad es pequeña comparada con la de los otros estados Las moléculas están separadas unas de otras de modo que su tamaño es despreciable respecto a los espacios intermoleculares. Las moléculas se mueven en líneas rectas y chocan entre sí y con las paredes del recipiente que las contiene. La energía de movimiento o cinética de las moléculas es proporcional a la temperatura absoluta del gas. Cuando el gas se expande a presión constante su temperatura disminuye. Las fuerzas de atracción intermolecular son muy débiles. El coeficiente de dilatación a presión constante a diferencia de líquidos y sólidos es constante. Líquidos No tiene forma definida, pero sí volumen determinado, presentan una superficie de separación. En pequeñas porciones adquieren forma esférica (gotas) Los líquidos miscibles difunden unos en otros, pero a velocidad notablemente menor que la del estado gaseoso. Existen líquidos inmiscibles, cosa que no ocurre entre los gases. Son prácticamente incompresibles a presiones moderadas. Por lo general, se expanden con el calentamiento y se contraen al enfriarse. Sin embargo estas manifestaciones son menos notables que en los gases. Al aumentar la temperatura si el calor es suficiente se evaporan, pasan al estado gaseoso. Al disminuir la temperatura, si se elimina suficiente calor solidifican, pasan al estado sólido Las moléculas se mueven pero su recorrido es mucho menor que en el estado gaseoso. Las fuerzas de atracción son notables, las moléculas tienen velocidades menores que en el estado gaseoso. Las moléculas se deslizan unas sobre otras y adoptan la posición de menor energía potencial respecto del suelo. Por eso adoptan la forma del recipiente que los contiene. Sólidos Son incompresibles, no fluyen. Al aumentar la tempera-tura pasan al estado líquido. En algunos casos pueden pasar directamen-te al estado gaseoso (subli-mación). Difunden unos en otros a una velocidad mucho menor que los líquidos y gases. Algunos sólidos son de apariencia cristalina otros carecen de regularidad (sólidos amorfos). Las moléculas, átomos o iones ocupan posiciones fijas y ordenadas de las que apenas se separan. Debido a la cercanía entre las partículas las fuerzas de atracción son intensas. Falta de fluidez. Poseen forma propia.