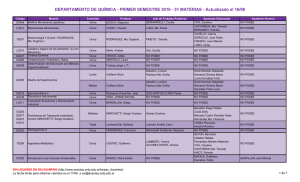
Absorbancia - OCW-UV
Anuncio
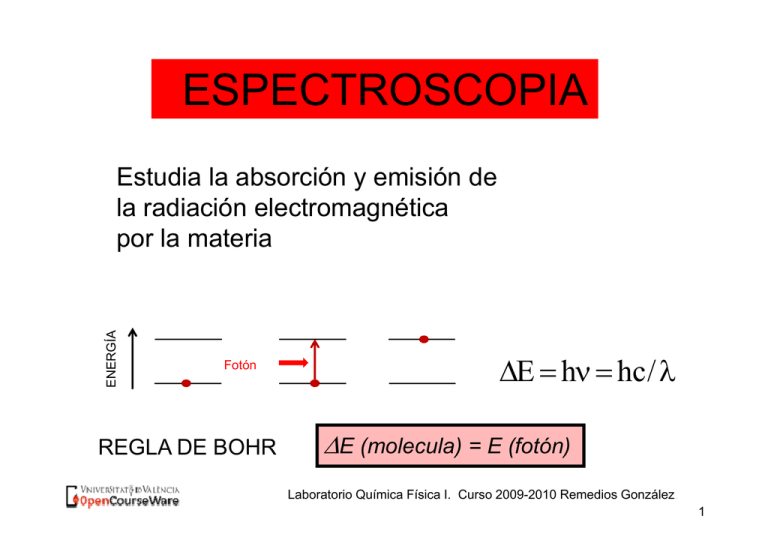
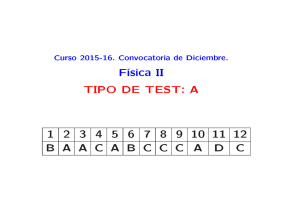
ESPECTROSCOPIA ENERGÍA A Estudia la absorción y emisión de la radiación electromagnética por la materia Fotón REGLA DE BOHR E h hc/ E ((molecula)) = E ((fotón)) Laboratorio Química Física I. Curso 2009-2010 Remedios González. 1 Esquema q de niveles de energía g INFRARROJO MICROÓNDAS E ENERGÍA A UV VISIBLE UV-VISIBLE Electrónica Vibracional Rotacional Traslacional Laboratorio Química Física I. Curso 2009-2010 Remedios González. 2 Espectro p electromagnético g Rayos gamma 10-3 Rayos X Ultravioleta 10-2 101 Visible 102 Infrarrojo 105 microondas Radio 108 1010 Longitud de onda (nm) Espectro visible . UV Violeta Azul Verde Amarillo h hc / hc Naranja Rojo IR 1/ Laboratorio Química Física I. Curso 2009-2010 Remedios González. 3 Diagrama de orbitales moleculares O2 MOs 2p 2p 2 2p E 2p 2p 2s 2s 2s Laboratorio Química Física I. Curso 2009-2010 Remedios González. 4 NARANJA DE METILO FENOLTALEINA O OH OH C - O C 1 - O - O C C - O C O O Forma básica (amarilla) C O O O - O C O - C O 2 OH - O 3 Laboratorio Química Física I. Curso 2009-2010 Remedios González. 5 BENCENO Diagrama de OM Laboratorio Química Física I. Curso 2009-2010 Remedios González. 6 •Cromóforos: moléculas que absorben en el visible FOTÓN e- Moléculas del p pigmento g Clorofila Laboratorio Química Física I. Curso 2009-2010 Remedios González. 7 Absorbancia - Color La longitud de onda a la que absorben determina el color. 600-640 nm 640-700 nm 560-600 nm 400 450 nm 400-450 480-560 nm 450-480 nm Un sistema que absorbe a 500 nm se ve rojo 8 Laboratorio Química Física I. Curso 2009-2010 Remedios González. ESPECTROFOTOMETRÍA Técnica cuantitativa que permite relacionar la cantidad de una sustancia con la cantidad de luz absorbida. LEY de LAMBERT-BEER LAMBERT BEER L cantidad La tid d d de lluz absorbida b bid d depende d d de: - La energía de la radiación. - La naturaleza de la muestra. que incide la radiación. - El número de moléculas sobre el q Laboratorio Química Física I. Curso 2009-2010 Remedios González. 9 Ley de Beer Lambert I sample concentration, C I0 dI I c dx IT pathlength, l I dI I 0 Camino óptico, óptico l I ln c l I0 I l 0 c dx I log c l I0 Laboratorio Química Física I. Curso 2009-2010 Remedios González. 10 Ley de Beer Lambert I log c l I0 I = Intensidad c = concentración molar (M) l = camino óptico (cm) T = Transmitancia I T I0 I A log I0 A = Absorbancia = coeficiente de absorción molar (M-1cm-1). ) Depende de A c l Laboratorio Química Física I. Curso 2009-2010 Remedios González. 11 Abssorban ncia Espectro de absorción 1.0 max 0.5 max 0 200 400 600 ) nm) Laboratorio Química Física I. Curso 2009-2010 Remedios González. 12 Lámpara Monocromador Colimador Prisma Fotomultiplicador Deuterio: UV Wolframio:Visible Señal eléctrica ESQUEMA GENERAL DE UN EQUIPO MONO HAZ Laboratorio Química Física I. Curso 2009-2010 Remedios González. 13