m - OCW-UV
Anuncio

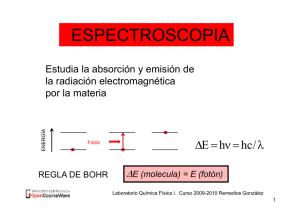
PROPIEDADES COLIGATIVAS. COLIGATIVAS ELEVACION DEL PUNTO DE EBULLICION DE UN LÍQUIDO EN PRESENCIA DE UN SOLUTO NO VOLATIL Laboratorio de Química Física I 2009-2010 Remedios González Luque 1 OBJETIVOS 1. Determinación de la constante ebulloscópica de la acetona. 1 ¿Qué 1.¿Q é ess la l constante nst nt ebulloscópica? b ll s ópi ? 2 Determinación de masas moleculares por 2. ebulloscopía. 2.- ¿Por qué podemos determinar masas moleculares por ebulloscopía? 3 Determinación 3. D t i ió d de coeficientes fi i t d de V Van`t `t ANTES DE RESPONDER Hoff 3.- ¿Qué es el coeficiente de Van’t Hoff? Laboratorio de Química Física I 2009-2010 VOLVAMOS AL TÍTULO Remedios González Luque 2 PROPIEDADES COLIGATIVAS ELEVACION DEL PUNTO DE EBULLICION DE UN LIQUIDO EN PRESENCIA DE UN SOLUTO NO VOLATIL ¿Qué son propiedades coligativas? ¿Porqué se eleva el punto de ebullición del disolvente al añadir un soluto no volatil? Laboratorio de Química Física I 2009-2010 Remedios González Luque 3 PROPIEDADES COLIGATIVAS COLIGATIVAS. • Propiedades que dependen sólo del número de partículas de soluto en un solvente y no de la identidad del soluto. • Disminución de la presión de vapor • Aumento de la temperatura de ebullición • Descenso de la temperatura de fusión • Presión P ió osmótica óti Laboratorio de Química Física I Remedios González Luque Disoluciones-4 ¿Porqué aumenta la temperatura de ebullición? Descenso de la presión de vapor de un disolvente DISOLUCION BINARIA IDEAL no electrolítica l lí i de d un solo componente volatil P T Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-5 P < Po P Disolvente puro Pv 1 atm Te > Te Disolución Te o Teo Te T Te>0 ¿Cómo está relacionada Te y la concentración? Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-6 Te = Te Te* = Ke m ¿Qué es Te Te* OBJETIVO 1 ,,Ke y m?? Ke Te Te* / m K e cte ebulloscópica del disolvente Cuestión 4 Ke *2 e RT MA H *A ( vap) 1000 ¿Cómo conseguiremos los objetivos 1 y 2? m T Te Te* / Ke (J / mol K ) K 2 kg unidades K e K kg mol1 J / mol mol m= OBJETIVO 2 m sto (g ) / M sto (g / mol) n sto kg dte kg dte Laboratorio de Química Física Laboratorio de Química Física I I 2009-2010 Remedios González Luque Disoluciones-7 ¿Cuál es el tercer objetivo? Propiedades coligativas: soluciones de electrolitos NaCl Na+ +ClConcentración total de “partículas de soluto” i m i= nº de moles de iones por mol de electrolito. iNaCl = 2 ¿Cómo está relacionada Te y la concentración en una disolución de un electrolito? Laboratorio Laboratoriode deQuímica QuímicaFísica Física II 2009-2010 Remedios González Luque Disoluciones-8 Descenso de la temperatura de ebullición. Disolución de electrolito Te = i Ke m ¿Cómo conseguiremos OBJETIVO 3 ell objetivo bj i 3 ? i = Te Ke m Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-9 ¿¿En que q consiste nuestra experiencia? p Medir temperaturas de ebullición d di de disoluciones l i de d solutos l no volátiles l il iónicos y no iónicos de diferente concentración Determinación de la constante ebulloscópica de la acetona. 58.0 Tebulliciión, oC ¿Cuál es el OBJETIVO 1? 56.3 0 macetalilida t lilid Experimento con soluciones de acetanilida en acetona a P = 1 atm atm.. Laboratorio de Química Física II 2009-2010 Remedios González Luque Disoluciones-10 OBJETIVO 1 Determinación de la constante ebulloscópica de la acetona. acetona Ke T Te Te* / m m= Te m sto (g ) / M sto (g / mol) n sto kgg dte kgg dte * Te ¿Qué necesitamos para determinar Ke ? msto mdte Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-11 ¿Cómo vamos a determinar estas magnitudes? g * Te Medimos laTemperatura de ebullición de la acetona Te Medimos la Temperatura de ebullición de la disolución acetona acetona- acetonitrilo I T Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-12 msto Calculamos la masa de acetonitrilo mdte Calculamos la masa de acetona ¿Pesamos la acetona? NO ¿Qué Q p pesamos? mll mv ' ll m … … … m sto m - m ll ' ll macet = m 'll - mV - msto Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-13 ¿Cómo medimos las temperaturas de ebullición? ¿Cómo y cuando pesamos? ¿Cómo tiene que estar el matraz? Limpio y seco con un imán y 8 ó 9 perlas de ebullición b lli ió y con d dos ttapones ¿Dónde se coloca el matraz para pesarlo? Sobre una base de corcho. ¿Cuánta acetona se añade? ¿Cómo se mide el volumen de acetona? mV 40 mL de acetona Laboratorio de Química Física I 2009-2010 Remedios González Luque 14 ¿Qué hacemos a continuación? Colócar el matraz en el sistema de reflujo. I T MEDIR LA TEMPERATURA DE EBULLICIÓN DE LA ACETONA: CALIBRAR ¿Qué hacemos para obtener mll? Retirar el matraz de la placa , quitar la sonda y tapar inmediatamente el matraz. Enfriar y secar el matraz Pesarlo sobre la base de corcho. Laboratorio de Química Física I 2009-2010 m Remedios González Luque 15 ¿Cómo obtenemos m’ll? … … … Pesar en un vaso de precipitado un poco más de un gramo de acetanilida … … … Introdúcir en el matraz … … … … … … Pesar sobre la base de corcho: ' ll m Laboratorio de Química Física I 2009-2010 Remedios González Luque 16 ¿Cómo medimos la temperatura de ebullición de la disolución? Colocar el matraz en el sistema de reflujo y medir la temperatura de ebullición b lli ió d de lla di disolución, l ió Teb.. I T ¿Q é hacemos ¿Qué h m s a continuación? ntin ión? Repetir cinco veces los pasos 5, 5 6y7 (experiencias 2, 3, 4, 5 y 6). ¿En que consiste el paso 5? Laboratorio de Química Física I 2009-2010 Remedios González Luque 17 Obtener m (2) ¿Qué hacemos para obtener mll? Retirar el matraz de la placa , quitar la sonda y tapar inmediatamente el matraz. Enfriar y secar el matraz Pesarlo sobre la base de corcho. … … … m (2) ¿ Que diferencia hay entre mll en la experiencia (1) y mll en esta experiencia (2)? EN LA EXPERIENCIA 1 NO HABÍA SOLUTO. ¿Q Que diferencia f hay y entre m’ll en la experiencia p (1) ( ) y mll en esta experiencia (2)? Se ha evaporado parte de acetona al medir Te de la disolución. Laboratorio de Química Física I 2009-2010 Remedios González Luque 18 ¿Qué hacemos a continación? Obtener m’ll (2) ¿Cómo obtenemos m’ll? … … … … … … Pesar en un vaso de precipitado un p poco más de un gramo g de acetanilida Introducir en el matraz … … … … … Pesar: ¿ Que diferencia hay entre m’ll en esta experiencia (2) y en la experiencia (1)? Ahora está el soluto de la adición anterior msto total = ∑ msto Laboratorio de Química Física I 2009-2010 … … … …… … ' ll m Remedios González Luque 19 ¿Qué hacemos a continuación? Medimos M dim s la l temperatura t mp t de d ebullición b lli ión de la disolución (2) I T Repetir cinco veces los pasos 5, 6 y 7 (experiencias 3, 4, 5 y 6). Las experiencias 3, 4, 5 y 6 son como la 2 ¿Cómo organizamos los datos? Laboratorio de Química Física I 2009-2010 Remedios González Luque 20 Tabla 1 mV (g)= M Magnitudes i d medidas did = Exp. ' (g) (g) m m ll ll msto (g) mstototal (g) macet (g) nsto total (mol) Teb* ((ºC) C) = mB Teb (mol/kg) (ºC) T (ºC) 1 2 3 4 5 6 ¿Cuál es el objetivo j q que q queremos alcanzar? Laboratorio de Química Física I 2009-2010 Remedios González Luque 21 Tabla 1 Exp. mV (g)= m ll (g) mll' (g) msto (g) mstototal (g) macet (g) nsto total (mol) Teb* (ºC) = mB Teb (mol/kg) (ºC) T (ºC) 1 2 3 4 5 6 Determinación de la constante ebulloscópica de la acetona. ¿Qué es mB ? Ke T Te / mB m sto total ( g ) / M sto ( g / mol ) n sto mB = m acet ( kg ) m acet ( kg ) ¿Qué magnitudes necesitamos para calcular mB ? mstototal y macet Laboratorio de Química Física I 2009-2010 Remedios González Luque 22 mv ' ll mll m … … … … … … …… … ¿Cómo calculamos mstototal y macet? msto total = ∑ msto mB = m sto total (g ) / M sto (g / mol) m acet (kg ) macet = m sto m - m ll ' ll m 'll - mV - msto total Laboratorio de Química Física I 2009-2010 Remedios González Luque 23 OBJETIVO 2 DETERMINACION DE MASAS MOLECULARES LE L E POR EBULLOSCOPÍA E LL Te = Ke m Ke m Te Te* / Ke m= Te m sto (g ) / M sto (g / mol) Te* kg dte ¿Qué necesitamos para determinar Msto ? msto mdte Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-24 ¿Cómo vamos a determinar estas magnitudes? g Determinada p previamente Ke * Te y Te msto y mdte mv M did experimentalmente Medidas i t l t I Calculadas mll ' ll m … … … Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-25 T ¿Cómo medimos las temperaturas de ebullición? ¿Cómo y cuando pesamos? ¿Cómo obtenemos mv? ¿Cómo tiene que estar el matraz? Limpie y seque el matraz con un imán y 8 ó 9 perlas de ebullición. Pesar, sobre una base de corcho, el matraz con las perlas, el iman y dos tapones. mV. Añada al matraz unos 40 mL de acetona Laboratorio de Química Física I 2009-2010 Remedios González Luque 26 Colóque el matraz en el sistema de reflujo. T I MIDA LA TEMPERATURA DE EBULLICIÓN DE LA ACETONA: CALIBRAR ¿Cómo obtenemos mll? Retire el matraz de la p placa , quite la sonda y tape inmediatamente el matraz. Enfríe f el matraz y séquelo q Pés l ssobre Péselo b lla b base s d de corcho. h Laboratorio de Química Física I 2009-2010 m Remedios González Luque 27 ¿Cómo obtenemos m’ll? … … … Pese en un vaso de p precipitado p 3.5 g de sustancia desconocida X I t dú Introdúzcalo l en ell matraz t Péselo: … … … … … … ' ll … … … m Laboratorio de Química Física I 2009-2010 Remedios González Luque 28 Vuelva a colocar el matraz en el sistema de reflujo y comience una nueva medida. I T Cuando la temperatura se mantenga constante determine la temperatura de ebullición b lli ió de d la l disolución, di l ió Teb. Repita todo el procedimiento para obtener otra medida. medida ¿Cómo organizamos los datos? Laboratorio de Química Física I 2009-2010 Remedios González Luque 29 Tabla 2. exp mV(g) m ll (g) m 'll (g) msto(g) macet(g) Teb*((ºC) C) Teb ((ºC) C) T ((ºC) C) 1ª 2ª 2 n sto m sto (g) / M sto (g / mol) mB = m acet (kg ) m acet (kg ) Te = Ke mB M sto (g / mol) K e (K kg / mol) m sto (g ) T(K) m acet (kg k ) ¿Cómo calculamos msto y macet? Laboratorio de Química Física I 2009-2010 Remedios González Luque 30 m sto m - m ll ' ll mv mll ' ll m … … … macet = m - mV - msto ' ll m acet m ll - m v Laboratorio de Química Física I 2009-2010 Remedios González Luque 31 OBJETIVO 3 DETERMINACION DE COEFICIENTES DE VAN’T HOFF Te = i Ke m Ke i Te Te* / Ke m m= Te m sto (g ) / M sto (g / mol) kg dte Te* ¿Qué necesitamos para determinar i ? msto mdte Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-32 ¿Cómo vamos a determinar estas magnitudes? g Ke * Te y T bl Tablas Medida experimentalmente Te msto y mdte mv I T calculadas mll ' ll m … … … Laboratorio de Química Física I 2009-2010 Remedios González Luque Disoluciones-33 ¿Cómo medimos las temperaturas de ebullición? ¿Cómo y cuando pesamos? ¿Cómo obtenemos mv? ¿Cómo tiene que estar el matraz? Limpie CON AGUA y seque el matraz con un imán y 8 ó 9 perlas de ebullición. Pesar, sobre una base de corcho, el matraz con las perlas, el iman y dos tapones. mV. Añada al matraz unos 30 mL de agua Laboratorio de Química Física I 2009-2010 Remedios González Luque 34 Colóque el matraz en el sistema de reflujo. T MIDA LA TEMPERATURA DE EBULLICIÓN Ó DEL AGUA: CALIBRAR I ¿Cómo obtenemos mll? Retire el matraz de la placa , (CUIDADO QUEMA!!!) quite la sonda y tape el matraz. Enfríe el matraz y séquelo Pés l ssobre Péselo b lla b base s d de corcho. h Laboratorio de Química Física I 2009-2010 m Remedios González Luque 35 ¿Cómo obtenemos m’ll? NaCl N 2SO4 Na AlCl3 … … … Pese en un vaso de precipitado l sall necesaria la i para obtener bt una disolución 0.5 m Introdúzcala en el matraz … … … … … … Péselo: … … … ' ll m Laboratorio de Química Física I 2009-2010 Remedios González Luque 36 Vuelva a colocar el matraz en el sistema de reflujo y comience una nueva medida. I Cuando la temperatura se mantenga m g constante determine m la temperatura de ebullición de la disolución,, T Teb. eb Repita R it ttodo d ell procedimiento di i t con las otras sales ¿Cómo organizamos los datos? Laboratorio de Química Física I 2009-2010 Remedios González Luque 37 Tabla 3. Teb*(ºC)= Sal mV(g) m ll(g) m 'll (g) msto(g) magua(g) nsto(mol) mB(mol/kg) Teb ((ºC) C) T ((ºC) C) 1 2 3 Treal Te T i Tnoelec K e mB * e Treal Te – Te* Tnoelec Te = Ke mB n sto m sto (g ) / M sto (g / mol) mB = m agua (kg ) m agua (kg ) Laboratorio de Química Física I 2009-2010 Remedios González Luque 38 m sto m - m ll ' ll mv mll ' ll m … … … magua = m - mV - msto ' ll m agua m ll - m v Laboratorio de Química Física I 2009-2010 Remedios González Luque 39