Tema 8
Anuncio

Capítulo 8. Estructura electrónica de moléculas diatómicas
1) Aproximación de Born-Oppenheimer
Suponiendo que los núcleos y electrones poseen masas puntuales
y
despreciando
las
interacciones
spin-órbita
y
otras
consideraciones relativistas, el hamiltoniano de un sistema de
N núcleos y n electrones es:
Ĥ = T̂N + T̂e + VNe + V̂ee + V̂NN
T̂N = -
h2
2
V̂Ne
N
1
∇ 2A
∑
A =1 M A
T̂e = -
ZA e2
= -∑∑
rAi
A =1 i =1
N
[8.1]
n
n
V̂ee = ∑ ∑
i =1 j> i
h2 n 2
∑ ∇i
2 m i =1
e2
rij
ZA ZB e2
=∑∑
rAB
A =1 B > A
N
V̂NN
M. Born y J. R. Oppenheimer propusieron tratar separadamente
los movimientos nucleares y electrónicos. Ya que los electrones
se mueven mucho más rápidos que los núcleos, se puede
considerar que los núcleos permanecen fijos mientras los
electrones se mueven entre ellos.
El primer término de la ecuación [8.1] se anula y el último
toma un valor constante. La ecuación de Schrödinger se puede
escribir como:
(Ĥ
el
+ VNN ) Ψ = E Ψ
[8.2]
El hamiltoniano electrónico ( Ĥ el ) engloba los términos 2, 3 y 4
de la ecuación [8.1]. VNN especifica la repulsión entre núcleos
que, como se ha dicho anteriormente, es contante.
La función
funciones:
de
onda
se
pueden
desglosar
Ψ (r1, rA) = Ψel (r1 , rA) ΨN (rA)
como
producto
de
[8.3]
Ψel(ri, rA) es la función de onda electrónica que describe el
movimiento de los electrones para una determinada posición de
los núcleos. ΨN(rA) es la función de onda nuclear que depende
sólo de las coordenadas nucleares y que es constante si se
supone que los núcleos están fijos.
(Ĥ el + V̂NN ) Ψel ΨN = E Ψel ΨN
ΨN Ĥ el Ψel + ΨN V̂NN Ψel = E Ψel ΨN
Ĥ el Ψel = (E - V̂NN ) Ψel = E el Ψel
Capítulo 8. Moléculas Diatómicas
[8.4]
1
Para obtener las curvas energía-distancia se supone una
configuración fija de los núcleos y se resuelve la ecuación de
Schrödinger. Se repite el proceso pasa diferentes distancias
internucleares.
La energía electrónica se utiliza como energía potencial del
movimiento de los núcleos.
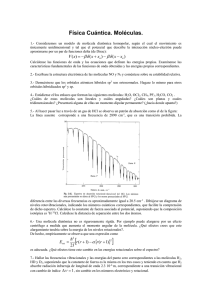
E(eV)
est. excit.
Fig. 8.1.
Curvas
electrónica
O. antienlazante
De
de
O. enlazante
energía
de
los
primeros
estados
electrónicos
de
la
molécula de H2
Re
1
2
3
R(Å)
Ecuación de Schrödinger para los nucleos:
Ĥ N ΨN = E ΨN
[4.5]
E es la energía total
electrónica y nuclear).
de
la
molécula
(incluye
la
energía
2) Molécula de ion hidrógeno
La molécula más sencilla que puede existir es la molécula de
ion hidrógeno H +2
e
ra
Fig. 8.2.
Molécula de H +2
rb
r
θ
R
a
El hamiltoniano es:
O
z
b
H=φ
h 2 2 e2 e2 e2
∇ - - +
2m
ra rb R
[8.6]
El sistema no tiene simetría esférica (no es un sistema de
fuerzas centrales) por lo que Ĥ y L̂2 no conmutan.
Ĥ y L̂ z
comunes.
conmutan.
Capítulo 8. Moléculas Diatómicas
Tienen
conjunto
2
de
funciones
propias
Cambiando a coordenadas elípticas confocales pueden encontrarse
las soluciónes exactas de la ecuación diferencial H ψ = E ψ
Coordenadas elípticas confocales:
ξ=
ra + rb
R
η=
ra − rb
R
φ
Cada nivel de energía está doblemente degenerado (excepto para
m=0) → (E=f(m2))
El nombre de las funciones de onda (orbitales moleculares)
depende del valor de |m|=λ el número cuántico del que depende
r
L z (ya no existe l).
λ
orbital
0
σ
1
π
2
δ
3
ϕ
4
γ
Re = 1.9972 bohrs = 1.06 Å
De = 0.1026 hartree = 2.79 eV = 64.4 kcal/mol
3) Métodos aproximados
Existen dos métodos aproximados para resolver la ecuación de
Schrödinger de un sistema molecular:
•
Orbitales Moleculares(OM): Se trata la molécula como si
fuera un átomo. Se fijan los núcleos y se resuelve la
ecuación de Schrödinger de una forma aproximada. Los
electrones se colocan en los orbitales moleculares obtenidos
(deslocalizados a toda la molécula)
•
Enlaces de Valencia (EV): Se parte de los átomos separados.
Se van acercando y se consideran las interacciones que se
forman.
Comparación de los métodos:
•
Ambos métodos conducen a resultados similares.
•
OM es más riguroso y sencillo, pero conduce a expresiones
matemáticas complejas.
•
EV es más intuitivo y permite
mediante conocimientos químicos.
Capítulo 8. Moléculas Diatómicas
3
simplificar
los
cálculos
•
Ambos métodos resuelven la ecuación de Schrödinger de forma
aproximada, empleando el método variacional.
4) Molécula de ion hidrógeno por Orbitales Moleculares
Hay que resolver la ecuación de Schrödinger del sistema:
h 2 2 e2 e2 e2
∇ - - + Ψ = E Ψ
ra rb R
2m
[8.7]
La ecuación se resuelve utilizando el método variacional.
La función variacional de prueba se obtiene como combinación
lineal de orbitales atómicos (aproximación CLOA)
4.1) Estado fundamental
4.1.1) Cálculo de la energía
Para el estado fundamental la función puede ser:
ϕ = ca Ψ1sa + cb Ψ1sb = ca 1sa + cb 1sb
W=
[8.8]
∫ ϕ * Ĥϕ dτ ≥ E
∫ ϕ * ϕ dτ
Ĥ (c a 1s a + c c 1s b ) = c a Ĥ 1s a + c b Ĥ 1s b
ϕ * Ĥ ϕ = c a2 1s a Ĥ 1s a + c a c b 1s a Ĥ 1s b + c b c a 1s b Ĥ 1s a + c b2 1s b Ĥ 1s b
*
= Haa = Integral de Coulomb = Hbb
*
= Hab = Integral de enlace o resonancia = Hba
∫ 1s a Ĥ 1s a dτ
∫ 1s a Ĥ 1s b dτ
∫ ϕ * ϕ dτ = c ∫ 1s
2
a
∫ 1s
a
a
1s a dτ + 2 c a c b ∫ 1s a 1s b dτ + c b2 ∫ 1s b 1s b dτ
1s a dτ = ∫ 1s b 1s b dτ = 1
W=
∫ 1s
a
1s b dτ =Sab(Integral de Solapamiento)
c a2 H aa + 2 c a c b H ab + c b2 H bb
c a2 + 2 c a c b S ab + c b2
[8.9]
∂W
∂W
= 0 y
= 0
Hay que minimizar W con respecto a ca y cb:
∂c a
∂c b
Capítulo 8. Moléculas Diatómicas
4
∂W ( 2c a H aa + 2c b H ab )(c a2 + 2c a c b S ab + c b2 ) − ( 2c a + 2c b S ab )(c a2 H aa + 2c a c b H ab + c b2 H bb )
=
=0
∂c a
(c a2 + 2c a c b S ab + c b2 ) 2
∂W ( 2c a H aa + 2c b H ab ) − ( 2c a + 2c b S ab )W
=
=0
∂c a
(c a2 + 2c a c b S ab + c b2 )
Ecuaciones seculares:
ca(Haa – W) + cb(Hab – WSab) = 0
[8.10]
ca(Hab – WSab) + cb(Hbb – W) = 0
Determinante secular:
( H aa − W ) 2 = ( H ab − WS ab ) 2
W1 =
H aa + H ab
1 + S ab
H aa − W
H ab − WS ab
→
W2 =
H ab − WS ab
=0
H bb − W
[8.11]
( H aa − W ) = ±( H ab − WS ab )
H aa − H ab
1 − S ab
[8.12]
Hay que calcular los valores de Haa y Hab
h2 2 e2 e2 e2
H aa = ∫ 1s a ∇ - - + 1s a dτ
2
m
ra rb R
h2 2 e2
1
s
∫ a - 2 m ∇ - ra 1s a dτ = E0 (E orb. 1s del átomo de hidrógeno)
e2
1
s
∫ a - rb 1s a dτ = K (energía de atracción promedio del núcleo y
el electrón, descrito por 1sa )
e2
e2
∫ 1s a R 1s a dτ = R (repulsión entre núcleos)
H aa = E 0 + K +
e2
R
[8.13]
h 2 2 e2 e2 e2
H ab = ∫ 1s a ∇ - - + 1s b dτ
ra rb R
2m
h 2 2 e2
1
s
∫ a - 2 m ∇ - rb 1s b dτ = E0 Sab
Capítulo 8. Moléculas Diatómicas
5
e2
1
s
∫ a - ra 1s b dτ = J (integral de canje) (J<0, depende del
solapamiento entre los dos O.A.)
J no tiene interpretación clásica, surge del hecho de que el
electrón puede estar descrito por 1sa o por 1sb
e2
e2
∫ 1s a R 1s b dτ = R S ab
H ab = (E 0 +
e2
)S ab + J
R
[8.14]
Al sustituir [8.13] y [8.14] en W1 y W2
W1 = E 0 +
e2 K + J
= W + = OM enlazante
+
R 1 + S ab
W2 = E 0 +
e
K−J
= W − = OM antienlazante
+
R 1 − S ab
[8.15]
2
Fig.
8.3.
Niveles
energéticos de W+ y W-
1
2
3
1=
W-
↑
S=e
W+
− Zr
Z 2 R 2
1 + Zr +
3
Capítulo 8. Moléculas Diatómicas
entre núcleos
K−J
<0
1 − S ab
K+J
3=
<0
1 + S ab
2=
↑
E0
6
e2
(repulsión
R
Figura 8.4. Representación de la integral de
solapamiento para dos orbitales 1 s hidrogenoides
Sab tiene un valor pequeño
→
1 ± Sab ≈ 1
J = e − Zr (1 + Zr )
K=
1
1
− e − 2 R 1 +
R
R
R/a0
1
2
4
6
J
0,74
0,41
0,092
0,0174
K
(a0/R-0,271)
(a0/R-0,027)
(a0/R-4,2.10-4)
(a0/R-7,2.10-6)
Fig. 8.5. Curva de energía potencial-distancia de la molécula H2+
e2 K + J
e2
≈ K , W1 = E 0 +
= W+
+
R
R 1 + S ab
Capítulo 8. Moléculas Diatómicas
W+ ≈ E0 + J
7
W+
≈
E0
–
J
4.1.2) Orbitales Moleculares
Al sustituir W+ y W- en las ecuaciones seculares se pueden
calcular los coeficientes de la combinación lineal de cada OM.
Para el OM enlazante, se obtiene:
H + H ab
c a H aa − aa
1 + S ab
H + H ab
+ c b H ab − aa
S ab = 0
1 + S ab
H + H aa S ab − H aa − H ab
c a aa
1 + S ab
H + H ab S ab − H aa S ab + H ab S ab
+ c b ab
1 + S ab
= 0
c a ( H aa S ab − H ab ) + c b ( H ab − H aa S ab ) = c a ( H aa S ab − H ab ) − c b ( H aa S ab − H ab ) = 0
ca = cb
ϕ+= ca(1sa + 1sb)
→
[8.16]
La constante ca se calcula normalizando el OM.
∫c
2
a
(
)
(1s a + 1s b ) 2 dτ = c a2 ∫ 1s a2 dτ + 2∫ 1s a 1s b dτ + ∫ 1s b2 dτ = c a2 (1 + 2S ab + 1) = 1
1
2(1 + S ab )
Para el OM antienlazante se obtendría por un proceso análogo:
ca =
ca = - cb
ca =
→
ϕ-= ca(1sa - 1sb)
[8.17]
1
2(1 − S ab )
ϕ+
1sa
1sb
1sa
ϕ-
-1sb
(ϕ + ) 2
(ϕ − ) 2
+
+
-
Fig. 8.6. Orbitales enlazante y antienlazante de la molécula de H +2
Capítulo 8. Moléculas Diatómicas
8
Nombre: λ = 0
→
σ
ϕ+(gerade, simétrico con respecto a la inversión) = σ 1s
g
ϕ-(ungerade, antisimétrico con respecto a la inversión)= σu∗1s
4.1.3) Resultados y refinamientos
a) Resultados
Si se sustituyen en las ecuaciones anteriores las funciones 1s
1s a =
1 Z
πa
Se obtiene:
3/ 2
e − Zra / a (Z = 1)
1s b =
1 Z
πa
3/ 2
e − Zrb / a (Z = 1)
Re = 2.45 bohrs
(2.00 valor experimental)
De = 1.78 eV
(2.79 valor experimental)
b) 1er refinamiento. Carga efectiva (ζ)
El electrón se encuentra sometido a una carga nuclear superior
a Z=1.
1 ζ
1s a =
πa
3/ 2
e
1 ζ
1s a =
π a
− ζra / a
3/ 2
e − ζrb / a
La carga efectiva es un parámetro variacional y se calcula:
∂E
=0
∂ζ
Los resultados obtenidos son:
Re = 2.02 bohrs
De = 2.35 eV
ζ = 1.24
c) 2º refinamiento. Polarización de los OA
La presencia cercana del núcleo b polariza los orbitales del
átomo a, y viceversa.
Los OA serán:
ϕ a = 1s a + λ ( 2p z ) a
ϕ b = 1s b + λ( 2p z ) b
La función variacional de prueba será: ϕ = c a ϕ a + c b ϕ b
1 ζ 1s
1s a =
π a
3/ 2
e
− ζ 1 s ra / a
Los resultados son:
Capítulo 8. Moléculas Diatómicas
1 ζ 2p
( 2p z ) a =
4 2π a
Re = 2.01 bohrs
De = 2.73 eV
ζ1s = 1.246
9
5/ 2
ra e
− ζ 2 p ra / 2 a
cos θ
ζ2p = 2.965
λ = 0.138
Para mejorar los resultados
variacionales más complejas.
4.2) Estados excitados
habría
que
emplear
funciones
Cuando al disociarse la molécula obtenemos H(2s) + H+, se toma
para la función de onda de prueba variacional:
ϕ = ca 2sa + cb 2sb
El tratamiento es análogo al estado fundamental.
ϕ+ = ca (2sa + 2sb ) OM enlazante
W+ ; ca = cb
1
2(1 + S ab )
ca =
[8.18]
(donde S ab = ∫ 2s a 2s b dπ )
ϕ- = ca (2sa - 2sb ) OM antienlazante [8.19]
W- ; ca = - cb
1
2(1 − S ab )
ca =
Haa y Hab son como en [8.13] y [8.14]. E0 es ahora la energía
del OA hidrogenoide 2s.
En los nuevos orbitales: m = 0 ; λ = 0
ϕ+(gerade) = σg2s
→
σ
ϕ-(ungerade) = σu*2s
En los siguientes estados excitados sólo se combinan los que
tengan igual simetría. (2p0)a con (2p0)b, (2px)a con (2px)b y
(2py)a con (2py)b.
-
+
+
σu*2p
-
+
-
+
z
(2pz)a
(2pz)b
+
-
Fig. 8.7. Interacción
de orbitales 2pz
Capítulo 8. Moléculas Diatómicas
σg2p
10
-
En estos orbitales: m = 0; λ = 0
ϕ+(gerade) = σg2p
→
σ
ϕ-(ungerade) = σu*2p
+
πg*2p
+
+
-
+
z
(2px)a
(2px)b
+
Fig. 8.8. Interacción
de orbitales 2px
πu2px
En estos orbitales: |m| = 1; λ = 1 → π
ϕ+(ungerade) = πu2px
ϕ-(gerade) = πg*2px
Los OM πu2py y πg*2py obtenidos por combinación lineal de los 2py
son análogos a los anteriores pero girados 90° .
La combinación lineal de OA tipo d, da OM tipo δ.
Los OM tipo σ, π y δ tienen respectivamente 0, 1 y 2 planos
nodales que contienen el eje internuclear.
La energía de los OM para H +2 es:
σg1s<σu*1s<σg2s<σu*2s<πu2px=πu2py<σg2p<πg*2px=πg*2py<σu*2p
Capítulo 8. Moléculas Diatómicas
11
5) Molécula de hidrógeno por Orbitales Moleculares
Fig. 8.9.
2
r12
1
r1a
Molécula de hidrógeno
r2a
r1b
r2b
a
b
R
El Hamiltoniano molecular es:
Ĥ = −
h 2 2 h 2 2 e2 e2 e2 e2 e2 e2
∇1 −
∇2 −
−
−
−
+
+
2m
2m
r1a r1b r2a r2b r12 R
[8.20]
La función σg1s(1)σg1s(2) es una función variacional aceptable.
Al ser un sistema con dos electrones la función de onda ha de
ser antisimétrica, tiene que ser un determinante de Slater.
La función de onda OM aproximada para el estado fundamental de
la molécula de hidrógeno es:
Ψ=
1 σ g 1s(1) α(1) σ g 1s(1) β(1)
= σ g 1s σ g 1s
2 σ g 1s(2) α(2) σ g 1s(2) β(2)
[8.21]
Ecuación similar a la [1.19] para el átomo de He.
Los resultados obtenidos son:
Re = 0.73 A
De = 3.49 eV
(0.74 exp)
(4.75 exp)
6) Orbitales Moleculares de moléculas diatómicas homonucleares
Para otras moléculas diatómicas homonucleares se sigue el mismo
criterio que al formar los átomos, se van rellenando los OM por
orden de energía, teniendo en cuenta que cada OM puede
repetirse dos veces, una para la función de spín α y otra β.
En muchos casos el orden energético de los OM es el mismo que
el obtenido en la molécula de ion hidrógeno.
Ejemplo 8.1. Determine la configuración electrónica del N2 y calcule el diagrama de OM
Solución:
La molécula de N2 tiene 14 electrones:
Capítulo 8. Moléculas Diatómicas
12
(σ
σg1s)2(σ
σu*1s)2(σ
σg2s)2(σ
σu*2s)2(π
πu2p)4(σ
σg2p)2
Fig. 8.10.
↑
↑
↑
2px
2py
2pz
↑↓
↑
↑
↑
2px
2py
2pz
Diagrama
de
los
orbitales moleculares
↑↓
↑↓
de la molécula de
nitrógeno.
↑↓
↑↓
↑↓
↑↓
2s
2s
↑↓
↑↓
↑↓
↑↓
1s
1s
Na
Nb
Para el O2 y el F2 hay una modificación en la energía de los
OM. Su configuración es:
O2 : KK (σg2s)2(σu*2s)2(σg2p)2(πu2p)4(πg*2p)2
F2 : KK (σg2s)2(σu*2s)2(σg2p)2(πu2p)4(πg*2p)4
Orden de enlace =
n° elect. enlazantes - n° elect. antienlazantes
2
[8.22]
Tabla 8.1. Configuración electrónica de moléculas diatómicas.
Configuración
Moléc.
H
+
2
H2
He +2
He 2
Li 2
O.Enl. De(eV)
1/2
2.8
(σ
σg1s)1
Re(Å)
1.06
Término
2
Σ g+
1
4.75
0.742
1
Σ g+
(σ
σg1s)2(σ
σu*1s)1
1/2
3
1.08
2
Σ u+
(σ
σg1s)2(σ
σu*1s)2
0
1.1
2.67
1
Σ g+
(σ
σg1s)2
KK(σ
σg2s)
1
2
Be 2
B2
KK(σ
σg2s)2(σ
σu*2s)2
0
KK(σ
σg2s)2(σ
σu*2s)2(π
πu2p)2
1
2.9
1.59
C2
KK(σ
σg2s)2(σ
σu*2s)2(π
πu2p)4
2
6.4
1.24
1
Σ g+
N +2
KK(σ
σg2s)2(σ
σu*2s)2(π
πu2p)4(σ
σg2p)1
5/2
8.9
1.12
2
Σ g+
KK(σ
σg2s)2(σ
σu*2s)2(π
πu2p)4(σ
σg2p)2
3
9.9
1.10
1
Σ g+
5/2
6.8
1.12
2
Πg
N2
O +2
KK(σ
σg2s)2(σ
σu*2s)2(σ
σg2p)2(π
πu2p)4(π
πg*2p)1
Capítulo 8. Moléculas Diatómicas
13
3
Σ g− ?
O2
KK(σ
σg2s)2(σ
σu*2s)2(σ
σg2p)2(π
πu2p)4(π
πg*2p)2
2
5.2
1.21
3
Σ g−
F2
KK(σ
σg2s)2(σ
σu*2s)2(σ
σg2p)2(π
πu2p)4(π
πg*2p)4
1
1.6
1.42
1
Σ g+
7) OM de moléculas diatómicas heteronucleares
Al construir los OM como CLOA la aproximación más sencilla es
utilizar solo los OA que tengan energías similares y simetría
adecuada.
Tabla 8.2. Nomenclatura de términos energéticos
Mol. homonucleares
Heteron.
At. separados
Por simetría
σg1s
1σg
1σ
*
σg 1s
1σu
2σ
σg2s
2σg
3σ
*
σg 2s
2σu
4σ
πu2p
1πu
1π
σg3s
3σg
5σ
*
πg 2p
1πg
2π
*
σu 2p
3σu
6σ
Ejemplo 8.2. Calcule la configuración electrónica de la molécula de CO.
Solución:
Hay una gran similitud con la molécula de N2 (son isoelectrónicas). La combinación de
OA es análoga. La molécula no tiene centro de simetría.
La molécula presenta 14 electrones, su configuración electrónica es:
(1σ)2(2σ)2(3σ)2(4σ)2(1π)4(5σ)2
→
Orden de enlace = 3
Los enlaces están polarizados: la contribución de los OA de ambos átomos no es la
misma. 1σ = cC 1sC + cO 1sO
(cC ≠ cO)
;
HCC ≠ HOO
Capítulo 8. Moléculas Diatómicas
14
6σ
σ
Fig. 8.11.
2π
π
↑
Diagrama
↑
↑↓ ↑
↑
de
los
orbitales moleculares
de la molécula de CO.
↑↓
5σ
σ
↑↓
↑↓
1π
π
↑↓
↑↓
1π
4σ
σ
↑↓
↑↓
+
3σ
σ
↑↓
↑↓
C
2σ
σ
↑↓
-
↑↓
C
O
1σ
σ
O
Ejemplo 8.3. Calcule la configuración electrónica de la molécula de HF
Solución:
Los OA 1s y 2s del F tienen menor energía que el 1s del H.
El OA 2pz del F tiene energía similar al 1s del H. Los dos tienen m =0.
Se forma la combinación lineal de orbitales 2pz del F y1s del H.
La minimización de la integral variacional dá dos conjuntos de valores de los
coeficientes que producen los OM enlazantes y antienlazantes:
3σ = c1 1s + c2 2pz
4σ = c3 1s – c4 2pz
Capítulo 8. Moléculas Diatómicas
15
Fig. 8.12.
Diagrama
de
los
orbitales moleculares
de la molécula de HF.
4σ
↑
1s
↑↓
↑↓
↑
2pz
↑↓ ↑↓
2py 2px
↑↓
3σ
H
↑↓
2σ
↑↓
2s
↑↓
1σ
↑↓
1s
H
F
F
8) Símbolo de los estados
Cada conjunto de OM degenerados forma una subcapa molecular.
•
Subcapa σ consta de 1 OM, describe 2 electrones
•
Subcapa π consta de 2 OM, describe 4 electrones
•
Subcapa δ consta de 2 OM, describe 4 electrones
•
Subcapa ϕ consta de 2 OM, describe 4 electrones
Dada una configuración electrónica molecular, son posibles
diferentes estados de energía dependiendo del acoplamiento de
spines y momentos angulares orbitales. (acoplamiento similar al
LS)
Ĥ conmuta con L̂ z y Ŝ z .
Λ = | M|
M es la suma de los m individuales.
0
Σ
Λ
Nombre
Multiplicidad: 2S+1
ML=ml1+ml2+…
MS=ms1+ms2+…
H2
(1sg)2
1
Π
2
∆
Término:
σ
ml=0;
S=0, MS=0;
Λ
π ml=+1;
S=1/2, MS=+1/2;
ml1=0 ml2=0
MS=+1/2-1/2=0
Capítulo 8. Moléculas Diatómicas
2 S +1
3
Φ
16
ML=0
S=0
S=1, MS=+1,0
1
Σ
He2+
B2
(1σg)2(1σu)1
ml1 = 0 ms1 = + 1/2
ml2 = 0 ms2 = - ½
ml3 = 0ms3 = + ½ ML=0, MS= + ½ (S=1/2)
2
Σ
(1σg)2(1σu)2(2σg)2(2σu)2(1πu)1(1πu)1
↑
↓
↑ .
↓ .
ML = 0
ML = 0
MS= +1
MS= -1
↑
↓
↓↑
↓ .
↑ .
ML = 0
ML = 0
ML=+2
ML=-2
MS =
MS =
MS =
MS =
.
↓↑
0
0
0
0
3
Σ
1
Σ
1
∆
9) Funciones de onda de SCF, de Hartree-Fock
El método de Hartree-Fock se puede aplicar a moléculas para
determinar su energía y función de onda, de una manera similar
que a átomos polieelectrónicos.
Los orbitales de HF se determinan mediante la resolución de las
ecuaciones de Hartree-Fock:
F̂ φ i = ε i φ i
[8.23]
F̂ es el operador de Haretree-Fock o de Fock.
Roothaan demostró que los OM de HF puede expresarse como
combinación de un conjunto completo de funciones llamadas
funciones de base.
Una base completa podría ser la formada por todos los OA de los
átomos que intervienen, ocupados y no ocupados.
Para abreviar se puede tomar una base mínima, formado por los
OA ocupados.
Los OA que contribuyen a un OM dado depende de las propiedades
de simetría del OM.
b
φ i = ∑ c si χ s
( b → ∞ )
s =1
Capítulo 8. Moléculas Diatómicas
17
[8.24]
En teoría χs debe ser un conjunto infinito de funciones. En la
práctica
se
emplea
un
número
finito
de
funciones
convenientemente elegidas.
La ecuación [4.23] se transforma en:
F̂
Σ csi χs= Σ csi F̂
χs = εi Σ csi χs
[8.25]
Multiplicando por χr e integrando:
b
∑
csi ( Frs – εi Srs ) = 0
(r = 1, 2, 3, … b)
[8.26]
Srs = < χr χs >
[8.27]
s =1
Frs = < χr | F̂
| χs >
La ecuación de Roothaan [4.26] indica que se tienen un
conjunto de b ecuaciones homogéneas. Para que exista una
solución distinta de cero, el determinante de Roothaan de los
coeficientes debe ser cero
det ( Frs - εi Srs ) = | Frs - εi Srs | = 0
[8.28]
Después de acabar todo el proceso iterativo se obtienen unos OM
que son una aproximación a los de HF, ya que se ha utilizado
una base mínima. El producto antisimetrizado de estos OM da la
función de onda de campo autoconsistente (SCF).
Ejemplo 8.4: Cálculos en base mínima de la molécula de HF
Solución:
Base mínima para FH : F1s, F2s, F2pz F2px, F2py y H1s.
La molécula tiene diez electrones. Por esa razón la función de onda del estado
fundamental de la molécula de HF es un determinante de Slater de 10x10.
φ (1)α (1)
φ (1)β(1)
φ (1)α (1) φ (1)β (1)
1
1
2
2
φ ( 2 )α ( 2 )
φ ( 2 )β( 2 )
...
...
1
1
φ ( 3 )α ( 3 )
φ ( 3 )β( 3 )
...
...
1
1
φ ( 4 )α ( 4 )
φ ( 4 )β( 4 )
...
...
1
1
φ ( 5 )α ( 5 )
φ ( 5 )β( 5 )
...
...
1
1
Ψ =N
φ ( 6 )α ( 6 )
φ ( 6 )β( 6 )
...
...
1
1
φ ( 7 )α ( 7 )
φ ( 7 )β( 7 )
...
...
1
1
φ ( 8 )α ( 8 )
φ ( 8 )β( 8 )
...
...
1
1
φ ( 9 )α ( 9 )
φ ( 9 )β(19 )
...
...
1
1
φ (10 )α (10 ) φ (10 )β(10 )
...
...
1
1
φ (1)α (1)
5
...
φ (1)β(1)
5
...
...
...
...
...
...
...
...
...
...
...
...
...
...
...
φ (10 )α (10 ) φ (10 )β(10 )
5
5
En notación abreviada: Ψ = φ 1 φ 1 φ 2 φ 2 φ 3 φ 3 φ 4 φ 4 φ 5 φ 5
Cada orbital φi se obtiene como combinación lineal de orbitales atómicos (aproximación
CLOA)
φ = c 1 φ 1s + c 2 φ 2s + c 3 φ 2p x + c 4 φ 2p y + c 5 φ 2p z + c 6 φ 1s (se obtienen 6 OM)
Capítulo 8. Moléculas Diatómicas
18
1) φ1 = 1.000 φ1s F (OA)
φ1s + 0.914 φ2s + 0.00 φ2px + 0.00 φ2py + 0.09 φ2π z + 0.15
2) φ2 =-0.018φ
φ1sH
σ)
(E2 = - 23.54 eV) (σ
3) φ3 = - 0.41 φ2s + 0.00 φ2px + 0.00 φ2py + 0.71 φ2pz + 0.52 φ1s
(E3 = - 17.09 eV) (σ
σ)
4) φ4 = 0.00 φ2s + 1.00 φ2px + 0.00 φ2py + 0.000 φ2pz + 0.00 φ1s
(E4 = - 16.14 eV) (OA)
5) φ5 = 0.00 φ2s + 0.00 φ2px + 1.00 φ2py + 0.000 φ2pz + 0.00 φ1s
(E5 = - 16.14 eV) (OA)
σ*)
6) φ6 (E6 = 3.61 eV) (orbital virtual) (σ
(OM obtenidos mediante el método PM3)
A la mezcla de dos o más OA en un mismo átomo se llama hibridación.
Estos orbitales deslocalizados a toda la molécula son los denominados orbitales
canónicos, que son las soluciones de la ecuación de Hartree-Fock [8.23].
Desde el punto de vista químico puede interesar obtener unos OM que permitan
visualizar la formación de enlaces. En el determinante de Slater se pueden sumar o
restar colunmas sin que su valor se vea modificado. Si se hace esa modificación se
pueden obtener los orbitales localizados.
En la molécula de HF los orbitales naturales son:
• φ1 = 1.000 φ1s (OA).
• φ2 = 0.502 φ2s + 0.575 φ2pz + 0.645 φ1s (E2 = - 22.16 eV) (OM).
• φ3 = - 0.753 φ2s - 0.657 φ2pz (E3 = - 17.09 eV) (OA híbrido).
Capítulo 8. Moléculas Diatómicas
19
• φ4 = - 0.152 φ2py + 0.988 φ2px (E4 = - 15.98 eV) (OA híbrido)
• φ5 = 0.988 φ2py - 0.152 φ2px (E5 = - 15.98 eV) (OA híbrido)
Estos orbitales localizados coinciden con los orbitales clásicos formados por:
• OM enlazantes localizados entre dos átomos
• OA de capa interna
• OA de pares de electrones solitarios
Ejemplo 8.5: Cálculos en base mínima de la molécula de CO.
Solución:
Base mínima para CO : O1s, O2s, O2pz O2px, O2py, C1s, C2s, C2pz C2px, C2py .
La molécula tiene 14 electrones. Por esa razón la función de onda del estado
fundamental de la molécula de HF es un determinante de Slater de 14x14.
En notación abreviada: Ψ = φ 1 φ 1 φ 2 φ 2 φ 3 φ 3 φ 4 φ 4 φ 5 φ 5 φ 6 φ 6 φ 7 φ 7
Los orbitales canónicos ocupados son:
• φ1 = 1.000 φ1sC (OA).
• φ2 = 1.000 φ1sO (OA).
• φ3 = 0.402 φ2sC + 0.333 φ2pxC + 0.829 φ2sO - 0.199 φ2pxO (E3 = - 38.33 eV) (OM).
• φ4 = 0.586 φ2sC + 0.069 φ2pxC - 0.469 φ2sO - 0.656 φ2pxO (E4 = - 20.62 eV) (OM).
• φ5 = - 0.004 φ2pyC + 0.516 φ2pzC - 0.007 φ2pyO + 0.857 φ2pzO (E5 = - 15.35 eV) (OM).
• φ6 = 0.516 φ2pyC + 0.004 φ2pzC + 0.857 φ2pyO + 0.007 φ2pzO (E6 = - 15.35 eV) (OM).
• φ7 = 0.643 φ2sC - 0.592 φ2pxC + 0.042 φ2sO + 0.482 φ2pxO (E7 = - 13.16 eV) (OM)
Ejemplo 8.6: Cálculos en base mínima de la molécula de N2.
Solución:
La molécula tiene 14 electrones. Por esa razón la función de onda del estado
fundamental de la molécula de N2 es un determinante de Slater de 14x14.
Los OM canónicos ocupados son:
• φ1 = 1.000 φ1sN1 (OA)
• φ2 = 1.000 φ1sN2 (OA)
• φ3 = 0.583 φ2sN1 + 0.399 φ2pxN1 + 0.583 φ2sN2 – 0.399 φ2pxN2 (E3 = - 30.44 eV)
• φ4 = 0.624 φ2sN1 - 0.333 φ2pxN1 - 0.624 φ2sN2 - 0.333 φ2pxN2 (E4 = - 15.35 eV)
• φ5 = 0.271 φ2pyN1 + 0.653 φ2pzN1 + 0.271 φ2pyN2 + 0.653 φ2pzN2 (E5 = - 14.40 eV)
• φ6 = 0.653 φ2pyN1 - 0.271 φ2pzN1 + 0.653 φ2pyN2 - 0.271 φ2pzN2 (E6 = - 14.40 eV)
• φ7 = - 0.399 φ2sN1 + 0.583 φ2pxN1 - 0.399 φ2sN2 - 0.583 φ2pxN2 (E7 = - 13.79 eV)
Los OM localizados son:
• φ1 = 1.000 φ1sN1 (OA)
• φ2 = 1.000 φ1sN2 (OA)
• φ3 = 0.333 φ2sN1 + 0.624 φ2pxN1 + 0.333 φ2sN2 – 0.624 φ2pxN2 (E3 = - 26.89 eV) (OM σ)
• φ4 = - 0.882 φ2sN1 + 0.471 φ2pxN1 (E4 = - 16.35 eV) (OA híbrido en N1)
• φ5 = 0.882 φ2sN2 + 0.471 φ2pxN2 (E5 = - 16.35 eV) (OA híbrido en N2)
• φ6 = 0.271 φ2pyN1 + 0.653 φ2pzN1 + 0.271 φ2pyN2 + 0.653 φ2pzN2 (E5 = - 14.40 eV) (OM π)
• φ7 = 0.653 φ2pyN1 - 0.271 φ2pzN1 + 0.653 φ2pyN2 - 0.271 φ2pzN2 (E6 = - 14.40 eV) (OM π)
Capítulo 8. Moléculas Diatómicas
20
10) Molécula de hidrógeno por Enlaces de Valencia (EV)
Cuando los átomos están separados:
Función de prueba variacional:
f1 = 1sa(1).1sb(2)
f2 = 1sa(2).1sb(1)
ϕ = c1 f1 + c2 f2
ó
[8.29]
Al minimizar la integral variacional respecto a las constantes
se obtiene un sistema de ecuaciones seculares y un determinante
secular.
La función espacial que describe el enlace entre los dos H es:
ϕ+ = c1[1sa(1)1sb(2)+1sa(2)1sb(1)]
1
c1 =
2(1 + S 12 ) 2
[8.30]
S 12 = ∫ f 1 f 2 dτ
Ya que el sistema tiene dos electrones, la función de onda
total debe ser antisimétrica. Es la denominada función de
enlace de Heitler-London:
ϕ+ = c1[1sa(1)1sb(2)+1sa(2)1sb(1)][α(1)β(2)-α(2)β(1)]
Resultados:
[8.31]
Re = 0.80 Å
De = 3.20 eV
La función de Heitler-London puede representarse como:
ϕ HL = ϕ cov =
φ 1sH1 (1)α (1)φ 1SH 2 ( 2)β( 2) φ 1sH1 (1)β(1)φ 1sH 2 ( 2)α ( 2)
=
φ 1sH1 ( 2)α( 2)φ 1sH 2 (1)β(1) φ 1sH1 ( 2)β( 2)φ 1sH 2 (1)α(1)
También se pueden tener en cuenta
funciones de onda iónicas H-H+ son:
ϕ aion =
φ 1sH1 (1)α(1) φ 1sH1 (1)β(1)
= φ 1sH1 φ 1sH1
φ 1sH1 ( 2)α( 2) φ 1sH1 ( 2)β( 2)
ϕ bion =
φ 1sH 2 (1)α(1) φ 1sH 2 (1)β(1)
= φ 1sH 2 φ 1sH 2
φ 1sH 2 ( 2)α( 2) φ 1sH 2 ( 2)β( 2)
{φ
especies
1sH 1
φ 1sH 2 − φ 1sH1 φ 1sH 2
iónicas.
La función total es: ϕ ev = c 1 ϕ cov + c 2 ϕ aion + c 3 ϕ bion = N(ϕ cov + λϕ ion )
c1 > c2 = c3
( λ = 0.25)
Capítulo 8. Moléculas Diatómicas
21
Las
[8.32]
}
11) Comparación de las dos teorías
El desarrollo de la parte espacial de
exceptuando la constante de normalización a:
[8.21]
conduce,
φOM = 1sa(1)1sa(2)+1sa(1)1sb(2)+1sa(2)1sb(1)+1sb(1)1sb(2)
la parte espacial de [8.31] es:
ϕHL = c1[1sa(1)1sb(2)+1sa(2)1sb(1)]
Hay dos términos de diferencia
Ha-Hb
1sa(1)1sa(2)
-
Ha-Hb
1sa(1)1sb(2)
Ha Hb +
1sa(2)1sb(1)
+
Ha Hb -
1sb(1)1sb(2)
Para mejorar la función de EV hay que introducir las formas iónicas:
φEV = 1sa(2)1sb(1)+1sa(1)1sb(2)+λ[1sa(2)1sa(1)+1sb(1)1sb(2)]
[8.33]
φEV es la función de resonancia iónico-covalente.
Resultados:
λ = 0.25
De = 4.02 eV.
Para mejorar la función de OM hay realizar cálculos post-HF.
Una posibilidad es realizar interacción de configuraciones.
La configuración fundamental para el H2 es (σg1s)2. Otra sería
(σu*1s)2 = [1sa(1)-1sb(1)][1sa(2)-1sb(2)]
φOM=[1sa(1)+1sb(1)][1sa(2)+1sb(2)]+γ[1sa(1)-1sb(1)][1sa(2)-1sb(2)]
[8.34]
Las ecuaciones [8.33] y [8.34] coinciden si λ =
Capítulo 8. Moléculas Diatómicas
22
1+ γ
1− γ
12) Método de EV en otras moléculas
En todas las moléculas hay que considerar la función de onda
covalente y la función iónica.
Para la molécula de HF:
La función de Heitler –London o covalente es:
ϕ HL = ϕ cov =
φ 1s (1)α (1)φ 2p ( 2)β( 2) φ 1s (1)β(1)φ 2p ( 2)α( 2)
=
φ 1s ( 2)α( 2)φ 2p (1)β(1) φ 1s ( 2)β( 2)φ 2p (1)α(1)
{φ
1s
φ 2 p − φ 1s φ 2 p
La función de onda iónica F-H+ es:
ϕ aion =
φ 2p (1)α(1) φ 2p (1)β(1)
= φ 2p φ 2p
φ 2p ( 2)α( 2) φ 2p ( 2)β( 2)
La función de onda iónica F+H- es:
ϕ bion =
φ 1s (1)α(1) φ 1s (1)β(1)
= φ 1 s φ 1s
φ 1s ( 2)α( 2) φ 1s ( 2)β( 2)
La función total será: ϕ ev = c 1 ϕ cov + c 2 ϕ aion + c 3 ϕ bion
ϕ ev = c 1 ϕ cov + c 2 ϕ aion + c 3 ϕ bion = N(ϕ cov + λϕ ion )
(c2>>>c3)
La constante λ es una medida de la polaridad del enlace.
Capítulo 8. Moléculas Diatómicas
23
}