1 NOMBRE: CURSO: FECHA: NOTA: IMBA DPTO DE QUIMICA
Anuncio

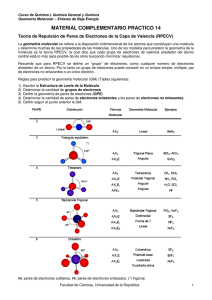
1 IMBA DPTO DE QUIMICA PROF. Prof. María Paz Bórquez NOMBRE: FECHA: A.E: Clasificar enlaces usando el criterio de ubicación de los elementos en la tabla periódica ( electronegatividades) Reconocer las formas tridimensionales que presentan ciertas moléculas. CURSO: NOTA: Geometría Molecular La estructura de Lewis nos señala solamente los pares de electrones que participan en los enlaces (enlazantes) y los pares electrónicos sin compartir alrededor de un átomo (no enlazantes). Sin embargo, las moléculas son tridimensionales y sus átomos puede que no estén en un solo plano. Es útil conocer la distribución tridimensional de los átomos de una molécula, es decir, su geometría molecular, puesto que influye en sus propiedades físicas y químicas. Por lo tanto, geometría molecular de una molécula (o ión) es la disposición de los átomos en el espacio. La geometría molecular puede predecirse fácilmente basándonos en la repulsión entre pares electrónicos, gracias al modelo de RPEV (Modelo de Repulsión de los pares de electrones de valencia), donde el átomo central es el de menor electronegatividad y en él los pares de electrones (los que participan en los enlaces y los no enlazantes), provocan que la molécula adopte una geometría tal que la repulsión electrostática sea mínima. El mejor acomodo es el que minimiza las repulsiones entre ellos. Los pasos para predecir geometrías moleculares con el modelo RPEV son los siguientes: 1. Identificar el átomo central 2. Dibujar la estructura de Lewis de la molécula o ión. 3. En el átomo central ubicar los pares de electrones –compartidos y libres- de manera que experimenten la mínima repulsión. 4. Considerar los enlaces múltiples de la misma manera que los enlaces simples para la determinación de la geometría promedio. El método de Gilliespie se usa para determinar la forma espacial de las moléculas unidas por enlaces covalentes. Fórmula General de cualquier molécula: AXnEm Donde: A: Átomo central de la molécula X: Átomo o grupo de átomos unidos al átomo central de la molécula (ligandos) n:Número de ligandos. E: Pares de electrones solitarios que no participan en los enlaces m: Número de pares de electrones solitarios o no enlazantes. 2 Geometrías de los pares electrónicos en función del número de pares de electrones N° de pares electrónicos Pares enlazantes Pares no enlazantes Fórmula 2 2 0 AX2 Geometría Geometría Ángulos de enlace Ejemplo 180° BeCl2 120° BF3 Menor a 120° SO2 109,5° CH4 Menor a 109º NH3 Menor a 109º H2O Lineal 3 3 0 AX3 Trigonal plana o triangular Angular 3 2 1 AX2E Tetraédrica 4 4 4 3 0 1 AX4 AX3E Piramidal Trigonal Angular 4 2 2 AX2E2