FUNDAMENTACIÓN QUÍMICA PARA LA PREPARACIÓN DE SOLUCIONES ACUOSAS
Actividad
Semana 4: Concentración de las soluciones
Estimado(a) estudiante:
Recuerde que este proceso es autónomo, es decir, usted es responsable de su aprendizaje ya que debe dedicar
2 horas diarias (como mínimo) al estudio de los temas y al desarrollo de las actividades propuestas por el
tutor.
Recuerde que la actividad, será evaluada según los criterios de evaluación que se encuentran en la descripción
del curso y que el valor porcentual de la semana 4 es del 20 % sobre el valor total del curso. (100%)
Actividad 1 Cálculos y esquemas de preparación de soluciones químicas
Puntos a lograr 0−100
Valor porcentual en la semana 100%
Examine el Botón Documentos, en el encontrará el material de apoyo para esta actividad; el documento se
titula: Disoluciones; además consulte el botón de Enlaces Externos en donde hallará direcciones electrónicas
que contienen información sobre las disoluciones químicas, sus propiedades, cálculos empleados, y formas de
preparación.
Realice los cálculos necesarios para preparar las siguientes soluciones:
• 100 mL de NaOH (hidróxido de sodio) al 10 % en masa/volumen partir del reactivo solidó puro de
laboratorio.
• 1000 mL de HCl (acido clorhídrico) 10 % en masa de densidad 1,050 g/mL, a partir de de un acido
que posee 37 % en masa y una densidad de 1,390 g/mL.
• 100 ml de NaOH (hidróxido de sodio) 0,1 normal a partir del reactivo solidó puro de laboratorio.
• 500 mL de HCl (acido clorhídrico) 0,1 N a partir de un acido que se encuentra a una concentración de
37 % y posee una densidad de 1,390 g/mL.
Describa el proceso, y elabore el esquema de preparación según se muestra en el siguiente ejemplo:
Preparar 1000 mL de acido nítrico HNO3 al 20 % en masa de concentración cuya densidad debe ser 1,115
g/mL a partir de acido nítrico HNO3 concentrado 64 % en masa cuya densidad es 1,390 g/mL.
Se tiene que determinar el volumen de ácido concentrado que se debe tomar para poder preparar los 1000 mL
de solución de acido nítrico HNO3 al 20 % en masa, donde:
Vd x Cd x Dd
Vc =
Cc x Dc
1
Vc = 1000 ml x 20% x 1.115 g/ml =
64 % x 1,390 g/ml
Esto quiere decir que se deben tomar 250,67 mL de HNO3 al 64 % colocarlos en un balón aforado de 1000
mL (el cual debe tener un Volumen de agua destilada 100 mL aproximados) y completar el volumen de 1000
mL con agua destilada hasta la línea de aforo.
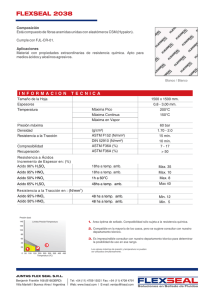
Esquema de preparación:
• 250,67 mL de HNO3 al 64 %
• En un balón aforado de 1000 mL el cual debe tener un volumen de agua destilada (100 mL aproximados )
• El recipiente utilizado, con el disolvente (se emplea un frasco lavador con agua destilada )
• El agua de lavado en el matraz aforado.
• El matraz aforado.
• El matraz aforado.
• Se completa el volumen requerido hasta la línea de aforo.
Debe enviar la actividad por la herramienta que le indique el tutor, para revisión y posterior retroalimentación.
250,67, mL de HNO3
2
Lavar
3
Vertir
4
Tapar
Agitar
5
6
Aforar
1
Tomar
Colocar
7
2