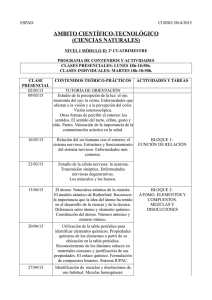
3º E.S.O. Contenidos mínimos UNIDAD 1: LA CIENCIA, LA
Anuncio

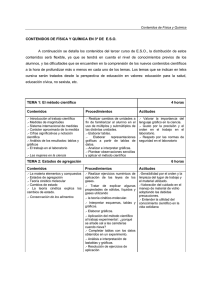
FÍSICA Y QUÍMICA 3º ESO F/Q CONTENIDOS Y CRITERIOS EVALUACIÓN MINIMOS 3º E.S.O. ● CONTENIDOS MÍNIMOS UNIDAD 1: LA CIENCIA, LA MATERIA Y SU MEDIDA La medida: el S.I. de unidades (múltiplos y submúltiplos), la notación científica, instrumentos de medida. Errores absoluto y relativo Elaboración, representación e interpretación de gráficas. Análisis de gráficas a partir de datos experimentales La densidad. UNIDAD 2: ESTADOS FÍSICOS Leyes de los gases: ley de Boile-Mariotte, ley de Gay-Lussac y ley de Charles Teoría cinético-molecular. Estados de agregación de la materia. Estructura interna de los tres estados Cambios de estados: interpretación a partir de la teoría cinético-molecular. UNIDAD 3 : SISTEMAS MATERIALES. SUSTANCIAS PURAS Y MEZCLAS Concepto de sistema material. Clasificación. Sustancias puras (elementos y compuestos) y mezclas (homogéneas y heterogéneas). Métodos de separación de mezclas (filtración, decantación, cristalización, destilación, separación magnética, cromatografía…) Disoluciones. Concepto de soluto y disolvente. Disoluciones diluidas, concentradas y saturadas. Concentración de disoluciones: % masa, % volumen y gramos/litro La solubilidad: propiedad característica. Curvas de solubilidad-temperatura UNIDAD 4: NATURALEZA ELÉCTRICA DE LA MATERIA. EL ÁTOMO Partículas subatómicas: protones, electrones y neutrones. Sus propiedades. Modelos atómicos de Thomson, Rutherford y Bohr. Número másico y número atómico. Representación de un átomo. Estructura en capas de la corteza atómica: introducción al concepto de configuración electrónica. Isótopos e iones. Clasificación de los elementos: Sistema periódico actual (Grupos y períodos). Elementos químicos más comunes: Símbolo UNIDAD 5: UNIÓN ENTRE ELEMENTOS Tendencia de los átomos a alcanzar la configuración de gas noble: Regla del octeto Formación de iones monoatómicos. Enlace iónico. Estructura de red tridimensional de los compuestos iónicos. Enlace metálico. Estructura de red tridimensional de los metales. Representación Lewis. Enlace covalente: compartición de electrones. Enlace covalente sencillo, doble y triple. Representación de moléculas sencillas mediante notación Lewis Propiedades que caracterizan a las sustancias según su enlace: temperaturas de fusión y ebullición, solubilidad y conductividad eléctrica. Masa molecular. Compuestos más habituales: nombre y fórmula UNIDAD 6: LOS CAMBIOS QUÍMICOS Cambio físico y cambio químico Conservación de la masa en los cambios químicos: Ley de Lavoisier. Interpretación de las reacciones químicas en términos de reordenación de átomos para formar nuevas agrupaciones. Concepto de mol. Número de Avogadro. Ecuaciones químicas. Ajuste de una ecuación química. Interpretación de una ecuación química ajustada. - Significado estequiométrico de las ecuaciones químicas. Cálculos estequiométricos elementales - Estudio de algunas reacciones de interés: ácido-base, combustión. . . UNIDAD 7: ELECTRICIDAD Fenómenos electrostáticos: tipos de carga eléctrica. Unidad de carga eléctrica: el culombio. Fuerzas entre cargas eléctricas: Ley de Coulomb. Elementos de un circuito eléctrico. Concepto de intensidad de corriente y diferencia de potencial eléctrico: unidades. Resistencia de un conductor. Asociación de resistencias (serie y paralelo): resistencia equivalente Relación entre intensidad, diferencia de potencial y resistencia: ley de Ohm Concepto de potencia. Potencia eléctrica. Unidades. Energía en los circuitos eléctricos. ● CRITERIOS MÍNIMOS DE EVALUACIÓN UNIDAD 1: LA CIENCIA, LA MATERIA Y SU MEDIDA - Conocer y utilizar correctamente las unidades del sistema internacional correspondientes a las distintas magnitudes vistas - Realizar e interpretar una gráfica sencilla utilizando datos experimentales. - Calcular errores absolutos y relativos de medidas realizadas - Catalogar una magnitud como fundamental o derivada. - Reconocer la densidad como una propiedad característica de la materia. - Resolver ejercicios elementales en los que aparezca el concepto de densidad. UNIDAD 2: LOS ESTADOS FÍSICOS - Describir las propiedades y comportamiento de la materia en los diversos estados de agregación. - Deducir el estado físico de una sustancia a partir de sus temperaturas de fusión y ebullición. - Utilizar la teoría cinético-molecular para describir el comportamiento de los distintos estados físicos y los cambios de estado - Resolver ejercicios elementales en los que sea necesario aplicar las diferentes leyes de los gases empleando si fuera necesario los correspondientes cambios de unidades. - Representar e interpretar gráficas en las que se relacionan dos de las tres variables que caracterizan el comportamiento de los gases (presión, volumen y temperatura) UNIDAD 3: SISTEMAS MATERIALES. SUSTANCIAS PURAS Y MEZCLAS - Clasificar los sistemas materiales en sustancias puras y mezclas, las mezclas en homogéneas (disoluciones) y heterogéneas, las sustancias puras en elementos y compuestos, identificando y diferenciando unos y otros, dando ejemplos de cada clase y aplicando sus diferencias a la resolución de cuestiones teórico-prácticas. - Describir los distintos métodos físicos de separación - Diseñar estrategias o procesos de separación en etapas para separar las sustancias componentes de sistemas materiales heterogéneos y homogéneos sencillos, usando los métodos físicos de separación más adecuados. - Saber expresar la composición de una disolución en % masa, % en volumen y en gramos por litro. - Resolver ejercicios numéricos sencillos relativos a las diversas formas en las que se expresan las concentraciones de las disoluciones - Interpretar gráficas solubilidad-temperatura de diferentes sólidos en agua UNIDAD 4: NATURALEZA ELÉCTRICA DE LA MATERIA. El ÁTOMO - Describir los modelos atómicos de Dalton, Thomson, Rutherford y Borh. - Completar tablas de datos sobre las partículas constituyentes de diversos isótopos; determinar A, Z, y la representación simbólica del isótopo. - Determinar y expresar simbólicamente el número de electrones presentes en cada capa de un átomo a partir de su valor de Z (sólo para valores de Z comprendidos entre 1 y 20), - Calcular la masa atómica de un elemento conocidas las masas atómicas relativas de sus isótopos - Conocer las principales aplicaciones de los isótopos radiactivos - Saber el símbolo y nombre de los elementos más comunes (elementos representativos y los principales de los de transición) UNIDAD 5: UNIÓN ENTRE ELEMENTOS - Explicar a un nivel elemental cómo se forman las distintas clases de enlace (iónico, covalente y metálico) - Distinguir entre átomo, molécula y cristal - Predecir qué tipo de enlace se dará entre dos átomos de Z comprendido entre 1 y 20, y escribir la fórmula del compuesto correspondiente, indicando algunas de las propiedades (puntos de fusión y ebullición, solubilidad y conductividad eléctrica) que lo caracterizarán. - Calcular masas moleculares de compuestos conocidas las correspondientes masas atómicas. - Nombrar y formular los compuestos químicos más importantes (Agua, amoniaco, ácido sulfúrico, sal, glucosa, ozono, agua oxigenada, metano, butano, dióxido de carbono,…) UNIDAD 6: LOS CAMBIOS QUÍMICOS. - Enunciar la ley de Lavoisier y aplicarla a la realización de ejercicios, - Determinar masas molares de diversas sustancias, aplicando el concepto de mol a la realización de ejercicios que relaciones el número de moles y masa de un existente en una sustancia. - Aplicar a la resolución de cuestiones la relación entre el número de moles y el de partículas. - Describir las reacciones químicas como un proceso de reordenación de átomos para formar nuevas moléculas. - Ajustar correctamente por tanteo ecuaciones químicas sencillas. - Interpretar el significado de la ecuación ajustada de una reacción química sencilla, deduciendo a partir de ella las proporciones de la reacción en moles y en unidades de masa y aplicando dichas proporciones a la realización de sencillos cálculos estequiométricos. UNIDAD 7: ELECTRICIDAD - Predecir el comportamiento de cuerpos cargados frente a otros cuerpos. - Aplicar la Ley de Coulomb a la resolución de ejercicios sencillos - Distinguir las magnitudes de intensidad de corriente, diferencia de potencial y resistencia de un conductor - Calcular la resistencia equivalente a asociaciones de resistencias en serie y en paralelo - Representar e interpretar apropiadamente circuitos sencillos de corriente continua explicando cómo habría que conectar en ellos amperímetros y voltímetros para medir intensidades y diferencias de potencial. - Aplicar la Ley de Ohm a la determinación de las magnitudes eléctricas en circuitos sencillos de corriente continua con asociaciones de resistencias en serie o en paralelo - Aplicar los conceptos de potencia eléctrica, diferencia de potencial e intensidad de corriente, así como las relaciones entre ellos, a la resolución de ejercicios. - Explicar las transformaciones energéticas que tienen lugar en un circuito elemental.