Descarga - FUNDAMENTOS DE QUIMICA
Anuncio
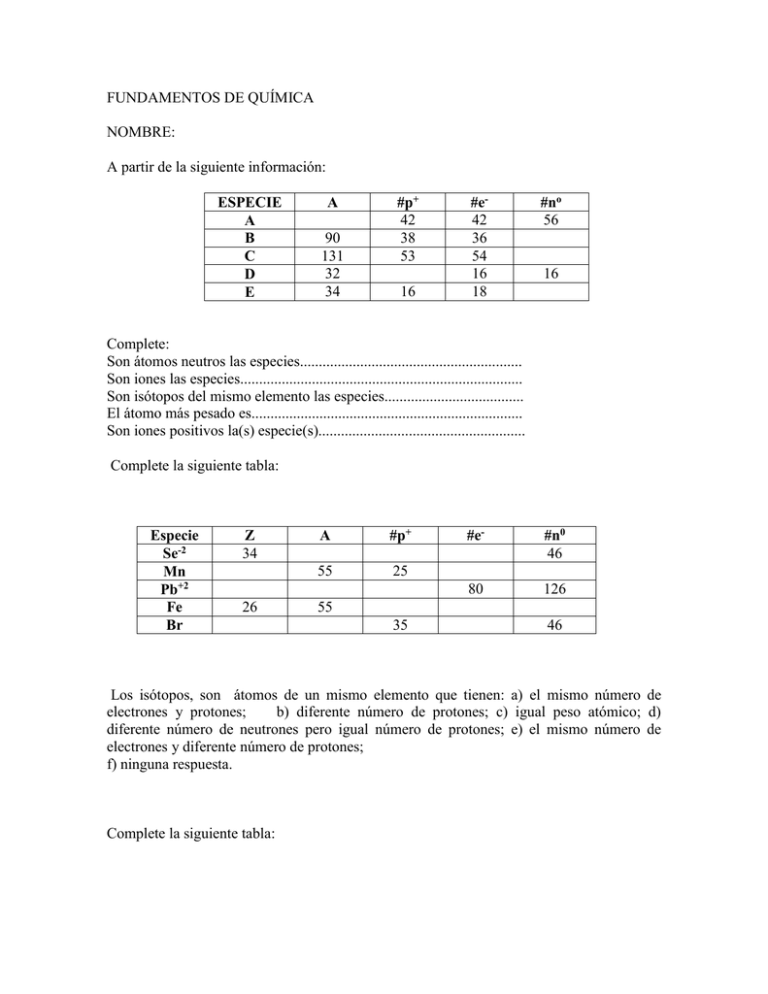
FUNDAMENTOS DE QUÍMICA NOMBRE: A partir de la siguiente información: ESPECIE A B C D E A 90 131 32 34 #p+ 42 38 53 16 #e42 36 54 16 18 #no 56 16 Complete: Son átomos neutros las especies........................................................... Son iones las especies........................................................................... Son isótopos del mismo elemento las especies..................................... El átomo más pesado es........................................................................ Son iones positivos la(s) especie(s)....................................................... Complete la siguiente tabla: Especie Se-2 Mn Pb+2 Fe Br Z 34 26 A #p+ 55 25 #e- #n0 46 80 126 55 35 46 Los isótopos, son átomos de un mismo elemento que tienen: a) el mismo número de electrones y protones; b) diferente número de protones; c) igual peso atómico; d) diferente número de neutrones pero igual número de protones; e) el mismo número de electrones y diferente número de protones; f) ninguna respuesta. Complete la siguiente tabla: Especie Se-2 Mn Pb+2 Fe Br Z 34 26 A #p+ 55 25 #e- #n0 46 80 126 55 35 46 En la naturaleza existen 19 átomos de 17Cl35 por cada 6 átomos de 17Cl37. Si las masas atómicas de estos isótopos son 34.97uma y 36.97uma respectivamente, calcular: a) el porcentaje de abundancia de cada isótopo; b) el peso atómico promedio del elemento. Las masas atómicas de los dos isótopos estables del cobre 29Cu63 y 29Cu65 son 62,93 uma y 64,93 uma respectivamente. Determine: cuántos átomos del isótopo más liviano de cobre existen en 200 g de bronce., si el bronce contiene un 75% en peso de cobre y el peso atómico del cobre es 63,55. Una muestra de 500 mg de analgésico contiene 266 mg de aspirina (C9H8O4), determine: a) el porcentaje de aspirina en el analgésico; b) los gramos de carbono; c) el número de átomos gramo de hidrógeno que existe en una tableta de analgésico de 0,611g. Cierto insecticida contiene 28% en peso de anhídrido arsénico (As2O5). Determine el número de átomos de arsénico contenidos en 1,0 g de insecticida. El análisis de un compuesto químico de fórmula X2SO3 revela que contiene 38,09% en peso de oxígeno, determine el peso atómico de X Para el compuesto AB2O3, se conoce que 3x1018 átomos del elemento A tienen una masa de 0,0002 g; el porcentaje en peso del elemento B en el compuesto es del 39.1%. Determinar en 500 g del compuesto: a) la masa de A; b) las moles de oxigeno Cuando 6,25 g de carbonato de sodio (Na2CO3) reaccionan con ácido, se forma anhídrido carbónico CO2 y 10,02 g de la sal correspondiente NaXO3. Determine el peso atómico de X Un compuesto de fórmula X4P2O7 tiene en su composición 23,31% en peso de fósforo, determine: a) el peso atómico de X; b) las moléculas de X4P2O7 en 400 g de compuesto. Pesos atómicos: P = 31; O = 16 La combustión de 0,15 g de un compuesto orgánico que contiene C, H Y O produce 0,1296 g de anhídrido carbónico, 0, 1326 g de agua y 0,1238 g de monóxido de carbono. Determinar la fórmula molecular del compuesto si su peso molecular aproximado es 98.


