PRACTICA 5 - Colegio México Nuevo
Anuncio

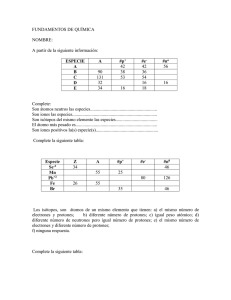
COLEGIO MÉXICO NUEVO 3° DE SECUNDARIA EXPLORACIÓN DE LOS FENÓMENOS NATURALES QUÍMICA EXPLORACIÓN No. 5 Nombre: ________________________________Grupo:____________ Clave: _________Fecha:_________ “ELEMENTAL, MI QUERIDO WATSON” INTENCIÓN PEDAGÓGICA: Valorar la importancia de la presencia o ausencia de elementos químicos y/o electrolitos en el cuerpo humano. OBSERVACIÓN Lee el siguiente fragmento: Una historia elemental Descubrir la existencia de las sustancias elementales ha sido una increíble hazaña que le ha tomado a la humanidad toda su historia. Contrario a lo que se cree, las sustancias elementales son menos estables que las compuestas. Si dejáramos, en algún lugar de la Tierra, todas las sustancias elementales separadas en "montoncitos" (y no volviéramos a tocarlas ni a hacerles nada), en unos cuántos años habrían reaccionado entre sí y, en consecuencia, ya no encontraríamos más que trazas de las sustancias elementales originales y una gran variedad de sustancias compuestas. Cuando el hombre apareció en el planeta, encontró una infinidad de materiales (madera, aire, rocas, agua de mar, etcétera) formados, en realidad, por la mezcla de muchas sustancias, casi todas ellas, compuestas. En esa confusión, descubrir y encontrar las sustancias elementales, supuso dos tareas de una enorme dificultad: 1º Separar las sustancias que se encontraban mezcladas en los materiales conocidos. 2º Realizar, con ellas, miles y miles de reacciones de descomposición hasta llegar a las más simples. En la actualidad, con todos los conocimientos de la época y los veloces adelantos tecnológicos, estas tareas requieren de equipos caros y sofisticados y de la habilidad y preparación de profesionistas muy calificados: los químicos. Así y todo, los humanos conocemos desde la antigüedad las siguientes sustancias elementales: azufre, carbono, cobre, estaño, hierro, mercurio, oro, plata y plomo. Desde entonces hasta 1700 d. C. sólo se pudieron descubrir 5 elementos: antimonio, arsénico, bismuto, fósforo y zinc. En la segunda mitad del siglo XVIII, 15 elementos más fueron encontrados. Entre ellos, el hidrógeno, el nitrógeno y el oxígeno. El descubrimiento de estos 3 gases fue, sin lugar a dudas, el preámbulo que dio origen a la química como ciencia. Durante el siglo XIX y la primera mitad del siglo XX, se descubrieron el resto de las 92 sustancias elementales existentes en la naturaleza. Entre ellas, los misteriosos y elusivos gases nobles. Son 6: helio, neón, argón, kriptón, xenón y radón. Estas sustancias son las únicas (de las 92) cuyos átomos pueden existir en forma aislada. Todas las demás sustancias elementales tienen que formar pequeñas moléculas (racimos de átomos unidos entre sí) o enormes redes (complicados entramados hechos a partir de la unión de átomos) puesto que sus átomos aislados no son estables. Vale la pena mencionar que el descubrimiento del helio fue, en cierta medida, un hallazgo extraterrestre. En 1868, mediante un telescopio acoplado a un espectroscopio, Pierre Jules Janssen, un astrónomo francés, observó en la luz proveniente del Sol una línea amarilla que no pertenecía al espectro de ningún elemento conocido. Dos años después, su colega, el astrónomo inglés Joseph Norman Lockyer, se aventuró a afirmar que esa línea era emitida por un elemento desconocido al que llamó helio (de la palabra griega helios que significa "Sol"). Aunque en la naturaleza sólo hay 92 elementos, en la actualidad, se conocen 118. ¿De dónde han salido los demás? Fácil... ¡el hombre los ha creado! El origen de los elementos Los átomos de una sustancia elemental son todos iguales. Además, los átomos de cada elemento son diferentes. Por lo tanto, en las sustancias compuestas hay átomos de un elemento unidos con átomos de otros elementos. Todos los átomos (sean del elemento que sea) tienen una parte positiva (los protones) concentrada en un núcleo, rodeada por una parte negativa (los electrones). Lo que hace distinto a un átomo de otro (y, por tanto, a un elemento de otro) es el número de protones. A este número se le llama número atómico y corresponde con la posición que ocupan los elementos en la tabla periódica. Además de los protones, en los núcleos atómicos hay otras partículas sin carga eléctrica llamadas neutrones. Modificar el número de protones de los átomos no es cosa fácil. Para ello se requiere de reacciones nucleares. Por eso, los alquimistas fracasaron en su empeñoso afán por transmutar la materia. Sin embargo, en las estrellas las reacciones nucleares se dan de manera natural. En las estrellas como el Sol, los núcleos de hidrógeno se transforman constantemente en núcleos de helio. La energía que se libera de este proceso ha impedido (durante 5 mil millones de años) que el Sol se colapse debido a la atracción gravitacional. Y se sabe que hay suficiente hidrógeno en su interior para mantenerlo así otros 5 mil millones de años. En las Gigantes Rojas (que es en lo que se va a convertir nuestro amado Sol cuando se le acabe el hidrógeno), a partir de los núcleos de helio, se forman los elementos cuyo número atómico va desde 3 hasta 26, es decir, desde el litio hasta el hierro. Del cobalto al uranio (92 protones), los núcleos no liberan energía al formarse; más bien la absorben. Por eso, no es posible que se formen en las Gigantes Rojas sino que se producen en las espectaculares explosiones estelares conocidas como Novas y Supernovas. Los elementos terrícolas En los años 50, los científicos de la época crearon los elementos 93, 94, 95, 96, 97, 98, 99, 100 y 101. Esto se logró mediante dos tipos de reacciones nucleares: el decaimiento beta y la captura alfa. En el primero, se bombardean núcleos de elementos pesados con neutrones. Cada neutrón capturado se transforma en un protón y un electrón (partícula beta). Como resultado se crea un nuevo elemento con un protón de más, es decir, con el siguiente número atómico al del elemento original. En el segundo, los núcleos pesados son bombardeados con núcleos de helio (partículas alfa) haciendo que el número atómico se incremente dos unidades cada vez. De 1958 a 1974, se sintetizaron desde el elemento 102 hasta el 106. Para ello, bombardearon los núcleos recién creados con iones de elementos ligeros como el boro. Para lograrlo, se requirió el desarrollo de grandes aceleradores de partículas. Más allá del elemento 106, fue imposible crear nuevos núcleos con esta técnica. En 1974, un grupo de investigadores dirigidos por Yuri Oganessian en Dubna, Rusia descubrieron una técnica que podía servir para la síntesis de nuevos elementos. Se les ocurrió invertir los papeles: usar como proyectiles a los núcleos pesados y como blanco a los iones de elementos ligeros. Esto permitía colisiones "frías" que no liberaban tanta energía dando tiempo a que se estabilizaran los nuevos núcleos. Esta técnica se empezó a utilizar a partir de 1975 cuando se abrió el UNILAC (Universal Linear Accelerator) en Darmstadst, Alemania con el cual se podía acelerar incluso los iones más pesados hasta alcanzar las más altas energías. Con este poderoso equipo, el grupo alemán dirigido por Peter Armbruster logró a principios de los 80 sintetizar los elementos 107, 108 y 109. Hubo que esperar hasta 1996 para crear los elementos 110, 111 y 112. Finalmente, en los últimos 6 años, entre el grupo ruso y el grupo alemán, han logrado sintetizar los elementos 113, 114, 115, 116, 117 y 118. En 1869 Mendeleiev y Lothar Meyer (de forma simultánea e independiente) aprovecharon los conocimientos y trabajos existentes sobre clasificación de los elementos según sus propiedades, encontrando que si éstos se ordenaban según aumentaba el peso atómico, cada cierto número de elementos se repetían las propiedades químicas y físicas o bien variaban de forma regular y sistemática. Esto les llevó a realizar una clasificación de los elementos en orden creciente de su masa atómica y de tal forma que en columna se correspondieran los elementos de propiedades semejantes. Mendeleiev observó que en su clasificación debía dejar algunos "huecos' vacíos ya que no se conocían elementos que correspondieran a las propiedades de esa posición, posteriormente predijo con gran exactitud la existencia y propiedades de esos elementos que luego fueron descubiertos (algunos de ellos viviendo aún Medeleiev). Otros de los aciertos de Mendeleiev fue anteponer como criterio de clasificación las propiedades químicas y físicas de los elementos, antes que su peso atómico en dos parejas de elementos, Co-Ni y Te-I (él supuso que sus pesos atómicos estaban mal calculados, ya que sus valores eran muy próximos). En realidad la clasificación actual sigue un orden creciente de Z, es decir del número atómico, que equivale al número de protones del elemento, lo cual está relacionado con el peso o masa atómica ya que ésta aumenta al aumentar Z (salvo raras excepciones debido al porcentaje de los distintos isótopos del elemento). De los ejemplos realizados de configuración electrónica se puede observar que los elementos que se encuentran en una misma columna o grupo periódico tienen la misma configuración electrónica en su último nivel, de ello se deduce que las propiedades químicas dependen de la configuración electrónica del elemento. Una reflexión elemental Sabemos que el número de elementos, que pudiéramos preparar los humanos, no puede ser infinito. ¿Sin embargo, qué tan lejos podremos llegar? Horizontes 2000, 5 (10) 35-39 http://tablaperiodica.educaplus.org/ http://www.lenntech.es/periodica/tabla-periodica.htm http://mangasverdes.es/2009/03/11/top-50-tablas-periodicas-divertidas-o-sorprendentes/ - ¿Qué opinas de la lectura? Menciona las dos tareas importantes que se tuvieron que realizar para descubrir y encontrar las sustancias elementales? Escribe diez elementos que se mencionan en la lectura ¿Cuáles fueron las aportaciones de Mendeleiev y Meyer en la clasificación de elementos? ¿Por qué es importante conocer las propiedades de los elementos? Escribe tú opinión acerca de la reflexión elemental. PROBLEMA: ¿Por qué es importante la presencia o ausencia de electrolitos funcionamiento de nuestro cuerpo? y elementos químicos para el buen SESIÓN 1/3 PLANTEAMIENTO DE LA HIPÓTESIS Realiza una investigación para contestar las preguntas que les surgieron y puedan proponer una hipótesis, Planteamiento de la hipótesis: INVESTIGACIÓN DOCUMENTAL Realicen una investigación documental para verificar sus hipótesis, así como el material, sustancias y medidas de seguridad que requieran para comprobarla. SESIÓN 2/3 ACTIVIDAD EXPERIMENTAL DISEÑO EXPERIMENTAL SUGERIDO POR LOS ALUMNOS De acuerdo a su investigación que harán para comprobar su hipótesis, investigar materiales, procedimiento, medidas de seguridad y tratar de manera adecuada los desechos. Antes de realizarlo consulten a su maestro (a) para que los oriente sobre algunos aspectos técnicos. EXPERIMENTACIÓN REPORTE DE TU ACTIVIDAD EXPERIMENTAL Realiza un diagrama de flujo del proceso de la importancia de la presencia o ausencia de electrolitos y elementos químicos para el buen funcionamiento de nuestro cuerpo. Anota tus observaciones con todo detalle SESIÓN 3/3 SISTEMATIZACIÓN, PRESENTACIÓN DE TUS RESULTADOS En esta fase es preciso ordenar todos los datos para distinguir y separar los elementos del problema y hallar las relaciones que guardan entre sí, así como si se tuvieron que hacer alguna modificación del proceso. A partir de su experiencia comenten la importancia de los electrolitos y elementos en el cuerpo humano Nombre del Electrolito Nombre del elemento Símbolo Función en el cuerpo humano SOCIALIZACIÓN DE RESULTADOS Y VERIFICACIÓN DE LA HIPÓTESIS Comentar en plenaria: Importancia de la construcción del conocimiento científico en química gracias al aporte de otras áreas como la física. Importancia de la estructura y organización de la Información física y química de la Tabla Periódica. Importancia de consumir en la dieta diaria los elementos necesarios para el buen funcionamiento del organismo APLICALO A TU VIDA (CONCLUSIONES) CONSERVA TU REPORTE CON BIBLIOGRAFÍA PARA TU CARPETA DE EVIDENCIAS.