Química General - Pagina nueva 1
Anuncio

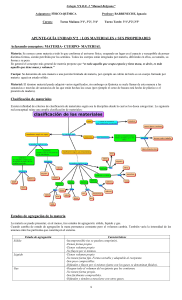
DEFINICIONES Materia: es cualquier cosa que ocupa espacio y posee Masa. Es frecuente que se relacione al peso con la masa, pero en esta definición no son equivalentes. Masa: es una medida de la Cantidad de Materia Elemento: es una sustancia que no puede descomponerse en otras más simples. (Ejemplos: Oxígeno, Nitrógeno, Carbón) Compuesto: es una sustancia formada por dos o más elementos en proporciones Definidas. (Ejemplos: Cloruro de Sodio, Agua, Sacarosa). Fase: es una porción físicamente distinta de Materia que es Uniforme en su Composición y Propiedades. (Podemos decir que una fase la constituye una porción de sustancia pura). Mezcla: es la combinación de 2 o más sustancias puras cuya composición es variable (Ejemplos: Plástico, Vidrio, Aire, Piedras, Agua y Aceite, etc) Mezcla Heterogénea: es una mezcla no uniforme y consiste de partes que son físicamente distintas (Piedras en Agua, Agua y Aceite, etc). Mezcla Homogénea: es una mezcla uniforme en su Totalidad y suele llamarse solución (Ejemplo: Aire, Sal en Agua). Las Aleaciones (Mezcla de Metales) son soluciones sólidas. Cambios Físicos: son cambios que no involucran la obtención de nuevas especies químicas. (Ejemplo: Cambios de Estado, Disolución, Cristalización, Filtración, Fragmentación). Cambios Químicos: son cambios que implican la transformación de una sustancia en otras sustancias. (Ejemplo: Combustión, Oxidación, Polimerización, Neutralización de Acidos y Bases, Precipitación, Formación de Complejos, Explosiones, etc.). Propiedades Extensivas: Propiedades que dependen de la Cantidad de Sustancia (Por ejemplo: Calor, Energía, Peso, Volumen, Longitud, Area) Propiedades Intensivas: Propiedades que no dependen de la Cantidad de la Sustancia (Por ejemplo: Densidad, Punto de Fusión, Indice de Refracción, Punto de Ebullición, Temperatura). Evaporación (o Vaporización): Proceso de Cambio de Estado de Líquido a Vapor. Equilibrio: Una Condición en la cual las velocidades de las dos tendencias opuestas son iguales. Condensación: Proceso de Cambio de Estado de Vapor a Líquido Sublimación: Proceso en el cual un sólido pasa directamente al estado de vapor sin pasar por el estado líquido Punto de Fusión: Temperatura a la cual la Fase Sólida se encuentra en equilibrio con la Fase Líquida Punto de Ebullición: Temperatura a la cual la Presión de Vapor que escapa del Líquido es igual a la Presión Exterior Punto de Ebullición Normal: Temperatura a la cual la Presión de Vapor de un Líquido es 760 mm de Hg (Presión Atmosférica al Nivel del Mar) Termoquímica: Rama de la Química que trata de los cambios de energía involucrados en cambios físicos y químicos. Temperatura Crítica: Temperatura por encima de la Cual es imposible licuar un Gas independientemente de la Presión Aplicada. Presión Crítica: Presión requerida para licuar un Gas a la Temperatura Crítica. Calor Específico: Cantidad de Calor requerida para elevar la Temperatura de 1 g de una sustancia en 1 °C Caloría: Cantidad de Calor requerida para elevar la Temperatura de 1 g de Agua de 14.5 a 15.5 °C Calor Latente de Fusión: Cantidad de Calor que se necesita para transformar 1 g de una sustancia sólida en líquida Calor Latente de Vaporización: Cantidad de Calor que se necesita para transformar 1 g de un líquido en Vapor Capacidad Calorífica: Cantidad de Calor requerida para elevar la Temperatura de una masa dada en 1 °C (=[masa]*[calor específico]) Fuerza Dipolo - Dipolo: Fuerza Intermolecular causada por la Atracción mutua de polos de cargas opuestas de las Moléculas polares vecinas. Fuerzas de London: Fuerzas Intermoleculares originadas por atracciones entre dipolos Instantáneos. Dipolos Instantáneos: Dipolo fluctuante y Temporal inducido en las Moléculas por el movimiento de los electrones. Puente de Hidrógeno: Atracción Intermolecular que se presenta entre Moléculas en las cuales el Hidrogeno está unido a un átomo pequeño altamente electronegativo (que tiende a atraer electrones, generalmente N, O y F). Presión de Vapor: Presión del Vapor que emana de un líquido al establecerse el equilibrio (Velocidad de Evaporación = Velocidad de Condensación) a una temperatura dada. Equilibrio:Una Condición en la cual las velocidades de las dos tendencias opuestas son iguales. Cristalización: Proceso de Formación de Cristales a partir de una Solución SobreSaturada. Disolvente: Componente que se halla en mayor cantidad en una Solución. Soluto: Componente o componentes que se hallan en menor cantidad en una Solución. Concentración: Cantidad de Soluto disuelto en una cantidad dada de Disolvente Solución Saturada: Solución cuya concentración es la Solubilidad del Soluto. Solución No-Saturada: Solución cuya concentración es menor que la Solubilidad del Soluto. Solución Sobre Saturada: Solución cuya concentración es mayor que la Solubilidad del Soluto (es un sistema inestable). Solubilidad: Concentración Máxima de Soluto en una Solución a una temperatura dada. Destilación: Proceso de Separación de una Solución líquida en sus componentes mediante evaporación y condensación.