2009_Loayza_Química orgánica- Práctica 1- Propiedades generales de los compuestos orgánicos.pdf
Anuncio

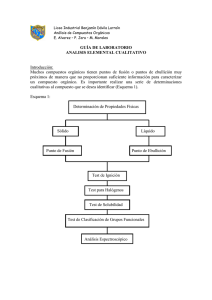
FACULTAD DE INGENIERIA CARRERAS: INGENIERÍA AGROINDUSTRIAL Y AGRONEGOCIOS INGENIERÍA EN INDUSTRIAS ALIMENTARIAS CURSO: QUIMICA ORGANICA PROFESORA: LILLYAN LOAYZA G. COORDINADORA: LILLYAN LOAYZA G. PRACTICA N°1 PROPIEDADES GENERALES DE LOS COMPUESTOS ORGANICOS I. OBJETIVOS: 1. Diferenciar compuestos orgánicos de los inorgánicos. 2. Reconocer las propiedades de los compuestos orgánicos 3. Identificar cualitativamente la presencia de algunos elementos en las sustancias orgánicas. II. MATERIALES Tubos de ensayo Acido benzoico Mechero Urea Pinzas para tubos Hidróxido de sodio 3 N Oxido de cobre Cocinilla con agitación Tapón de jebe Acetato de plomo 1% Tubo de desprendimiento Sulfato ferroso al 10% Pipetas de 1, 2, 5 y 10 ml. Nitrato de plata 1% Piceta con agua destilada Disulfuro de carbono Hidróxido de bario 0.03 g/ml Equipo de seguridad: lentes protectores Sacarosa III. PROCEDIMIENTO A. Determinación de la presencia de Carbono e Hidrógeno 1. Colocar 0.5 g de la muestra en un tubo de ensayo seco y agregarle 1 g de óxido de cobre en polvo. 2. Tape el tubo de ensayo con un tapón, provisto de un tubo de desprendimiento, que desemboque en una solución de hidróxido de bario (Fig. 1). 1 3. Someter el tubo al calor sobre un mechero y observar si la solución de hidróxido de bario se enturbia o precipita, lo que indicaría la presencia de carbono. La formación de gotas de agua en las paredes de la parte superior del tubo, indica la presencia de hidrógeno. B. Solubilidad o miscibilidad de sólidos y líquidos a) Solubilidad de líquidos Disponer de 4 tubos de ensayo y agregarles 1 ml de muestra, luego a cada uno de ellos añadir 3 ml de los solventes según la tabla. Tubo Agua x Solvente Cloroformo CS2 1 2 x 3 x Agitar y observar si se forma una o dos fases. Registrar los resultados. b) Solubilidad de sólidos: Disponer de tubos de ensayo y agregarles 0.1 g de cada muestra, luego a cada uno de ellos añadir 5 ml de los solventes según la tabla. Muestra Agua NaOH Urea x x Sacarosa x x Ac. Benzoico x x Agitar y observar si se disuelven. Registrar los resultados. Si no se disuelven, calentar los tubos en baño maría a 50°C y observar. C. Identificación de azufre, nitrógeno y halógenos 1. Azufre: Tome 1 mL muestra en un tubo de ensayo. Agregue 3 gotas de acetato de plomo al 1%. La aparición de un precipitado oscuro se considera positivo para presencia de azufre. 2. Nitrógeno Tome 1 ml de muestra y agregue 5 gotas de solución de sulfato ferroso al 10%. 2 La aparición del color azul (Azul de Prusia) se considera positiva para presencia de nitrógeno. 3. Halógenos Tome 1 mL de muestra. Agregue 5 gotas de nitrato de plata al 1%. La presencia de un precipitado blanco es positiva para presencia de cloro. IV. RESULTADOS A. Determinación de la presencia de Carbono e Hidrógeno Muestra Enturbiamiento (Si/No) Formación de agua (Si/No) Observaciones B. Solubilidad o miscibilidad de sólidos y líquidos Miscible/Inmiscible Agua Cloroformo CS2 Soluble/Insoluble en Agua Soluble/Insoluble en NaOH Urea Sacarosa Ac. benzoico C. Identificación de azufre, nitrógeno y halógenos Muestra Azufre V. Precipitado (Si/No) y Color Nitrógeno Halógenos DISCUSIONES Con respecto a los resultados encontrados, discuta sobre la solubilidad de compuestos y las reacciones químicas involucradas en las identificaciones. VI. CUESTIONARIO 1. Explique la prueba de fusión sódica y para qué se utiliza. 2. Indique la importancia de los elementos estudiados en la estructura de los compuestos orgánicos. 3