Taller Unidad 4
Anuncio

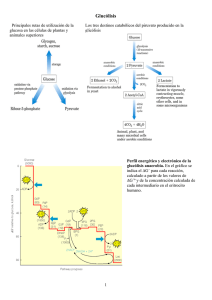
Objetivos de aprendizaje 1- La célula como un sistema termodinámico: Sistema, entorno y universo. Primera y segunda ley de la termodinámica. La energía libre como energía capaz de efectuar trabajo (G =H - TS). Relación entre el equilibrio y la energía libre estándar (Go = RTlnKeq). 2- Termodinámica de las reacciones catalizadas por enzimas. Energía libre de activación y efecto de catalizadores, G de activación. Ley de acción de masas, orden de una reacción. Teoría del estado de transición. 3- Cinética enzimática. Cinética química. Definición de enzima. Formación del complejo enzima-sustrato. Ecuación de Michaelis-Menten. Significado de Vm, Km, Ks y constante catalítica. Efecto del pH y la temperatura sobre la actividad enzimática. Gráfico de doble recíprocas: determinación de Vm y Km. Inhibidores. 4- Control de la Actividad Enzimática: Modulación alostérica, covalente y mediada por proteólisis. Enzimas alostéricas: velocidad en función de concentración de sustrato, efecto homotrópico y heterotrópico. 5-Metabolismo intermediario: Rutas centrales del metabolismo energético celular. Anabolismo y catabolismo. Estructura y propiedades del ATP. Topografía del metabolismo: principales organelos y compartimientos celulares, asociación de estructuras y funciones celulares. . Problemas 1- Dada la siguiente reacción: k1 k2 E + S ES E + P k-1 Siendo k1 = 1 x 107 M-1s-1, k-1 = 1 x 102 s-1 y k2 = 3 x 102 s-1 Calcular: a) Ks b) Km c) ¿Cuándo Ks se aproxima al valor de Km? 2- Considerando una enzima con cinética Michaeliana, ¿qué fracción de Vmax se observa cuando [S] = 2 Km, [S] = 6 Km, y [S] = 10 Km ? 3- Los siguientes resultados fueron obtenidos a partir de una reacción catalizada enzimáticamente: [S] (mM) v (mol/l/min) 0.50 8.0 0.75 10.0 1.00 11.4 1.50 13.0 2.00 15.0 a) Estimar gráficamente Vmax y Km b) Estimar k2 (kcat) si la concentración de enzima fue de 8 nM c)¿Cuál sería la velocidad de reacción a [S] = 600 M y a [S] = 1200 M? d) Estas velocidades de reacción fueron obtenidas en presencia de una concentración 8 x 10-9 M de la enzima. ¿Cuál sería la velocidad de reacción para [S] = 10 mM si la concentración de enzima hubiese sido 1 x 10-8 M ? Justifique su respuesta. 4- El sustrato de una enzima es el anión de un ácido débil A- (pKa=4.5). El sitio activo de la enzima contiene un residuo de histidina (pKa=6.5) que tiene que estar protonado para la catálisis enzimática. ¿Cuál es la zona de pH óptimo de la reacción? Justifique su respuesta. 5- Un microgramo de una enzima pura (PM = 92.000) catalizó una reacción a una velocidad máxima de 0.50 moles/min bajo determinadas condiciones de pH y temperatura. Calcular: a) Constante catalítica de la enzima (kcat) b) ¿Cuánto dura un ciclo catalítico? 6- Muchas reacciones enzimáticas se inhiben por el producto de la reacción. Utilizando los siguientes datos de la inhibición causada por el acetaldehído sobre la oxidación del etanol catalizada por la alcohol deshidrogenasa, determinar: a) el tipo de inhibición que se produce b) los valores de Km, Vmax y Ki. Etanol (mM) Acetaldehído (mM) v (mol/min) 20.0 - 19.5 30.0 - 21.3 50.0 - 23.3 100.0 - 24.9 20.0 4.0 11.6 30.0 4.0 14.3 50.0 4.0 17.6 100.0 4.0 21.2 7- Calcule la variación de energía libre de hidrólisis del ATP a pH 7 y 25 oC bajo condiciones de estado estacionario (tal como existen en las células), en las cuales las concentraciones de ATP, ADP y Pi son mantenidas en 1.0 mM, 0.1 mM y 10 mM, respectivamente. 8- La variación de energía libre estándar de la hidrólisis de ATP a 25oC y pH 7 es -7.7 kcal/mol. Se sabe que la variación de la energía libre estándar de la hidrólisis de glucosa-6-fosfato en las mismas condiciones es -3.13 kcal/mol. Calcule la variación de energía libre estándar para la reacción que cataliza la hexoquinasa: GLUCOSA + ATP GLUCOSA-6-P + ADP 9- Saccharomyces cereviseae (levadura) es un organismo eucariótico unicelular que se caracteriza por tener como principal ruta catabólica la fermentación alcohólica. En esta vía la glucosa se degrada hasta etanol y anhídrido carbónico: Glucosa 2Etanol + 2CO Go = - 47 kcal/mol 2 a) ¿Qué tipo de sistema termodinámico es la levadura: cerrado, abierto o aislado? b) ¿Qué cosas necesita la levadura del entorno y cuáles son eliminadas hacia el entorno? c) ¿En qué se utiliza la energía libre de la fermentación alcohólica? d) ¿Cuántos moles de ATP se formarían por mol de glucosa oxidado a etanol y CO 2 en condiciones estándar? e) En estado estacionario las levaduras tiene una concentración de glucosa de 5 mM y de etanol y dióxido de carbono de 50 y 5 M, respectivamente. Las concentraciones de ATP, ADP y Pi son mantenidas en 1.0 mM, 0.1 mM y 10 mM, respectivamente. ¿Cuántos moles de ATP se podrían formar por mol de glucosa oxidado en estas condiciones? ¿Cuántos moles de ATP se formarían por mol de glucosa si el rendimiento de la fermentación alcohólica es del 31%? 10- Representamos la energía libre de la isomerización de la glucosa 6 fosfato (G-6-P) en fructosa 6 fosfato (F-6-P) catalizada por la glucosa-fosfato isomerasa: G-6-P F-6-P G (kCal) F-6-P: 0 0,34 0,5 1 G-6-P: 1 0,66 0,5 0 a) Utilizando el gráfico, calcule la constante de equilibrio, Keq, y Gº para la reacción descrita, considerando la temperatura como 25ºC. b) Si se tienen iguales cantidades de G-6-P y F-6-P y se agrega la enzima, ¿hacia donde se desplaza la reacción? c) ¿Cuál será el G real de esta reacción en la célula si las concentraciones intracelulares medidas en estado estacionario de G-6-P y F-6-P son de 83 y 14 M respectivamente? 11- El paso a través de la membrana de compuestos polares es posible gracias a la presencia de proteínas transportadoras en la membrana. La glucosa ingresa a las células a través de transportadores específicos denominados GLUT. Considerando que la concentración plasmática de glucosa es de 5 mM y la intracelular es 0.15 mM, calcule la variación de energía libre de la entrada de glucosa al interior de la célula. ¿Como se denomina este proceso? 12- El costo energético de transportar iones a través de una membrana depende en parte de la diferencia de potencial eléctrico entre ambas caras de la membrana. Calcule la variación de energía libre de la salida de Ca2+ desde el interior de la célula hacia el medio extracelular, considerando los siguientes datos: [Ca2+] intracelular: 0.1 μM, [Ca2+] extracelular: 3 mM, el potencial de membrana de la membrana plasmática de -50 mV, a 37ºC. Explique como ocurre y como se denomina este proceso.