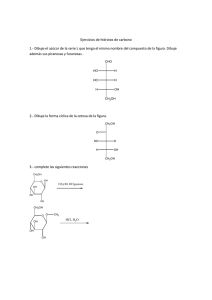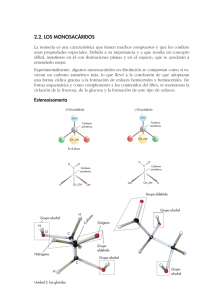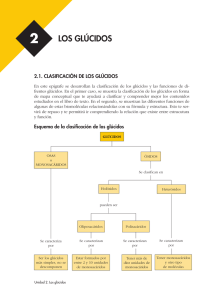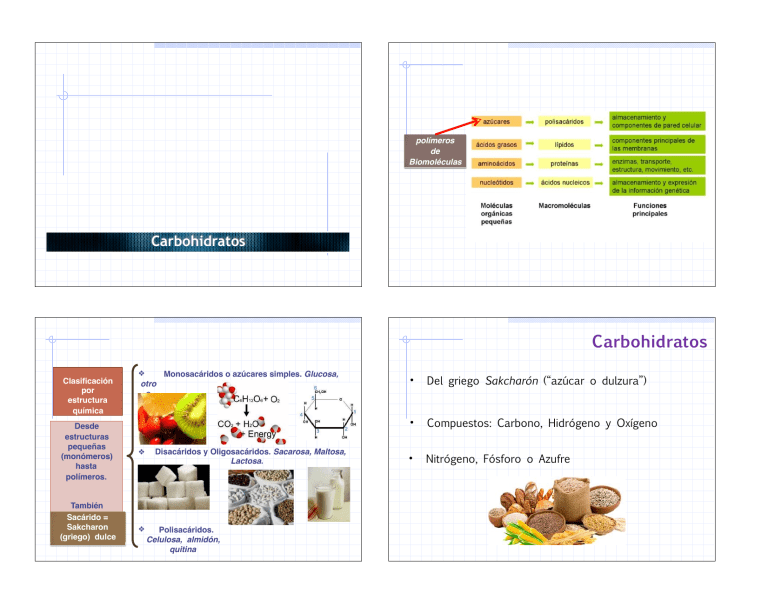
polímeros de Biomoléculas Carbohidratos Carbohidratos ❖ Clasificación por estructura química Desde estructuras pequeñas (monómeros) hasta polímeros. También contienen N,=P y Sacárido S Sakcharon (griego) dulce otro s. ❖ ❖ Monosacáridos o azúcares simples. Glucosa, fructosa, entre Disacáridos y Oligosacáridos. Sacarosa, Maltosa, Lactosa. Polisacáridos. Celulosa, almidón, quitina • Del griego Sakcharón (“azúcar o dulzura”) • Compuestos: Carbono, Hidrógeno y Oxígeno • Nitrógeno, Fósforo o Azufre Carbohidratos Son las moléculas más ampliamente distribuidas en la naturaleza Funciones: Almacenamiento de energía Estructura celular Clasificación ▪ Monosacáridos ▪ Disacáridos ▪ Oligosacáridos ▪ Polisacáridos Se encuentran distribuidos en plantas y animales Monosacáridos • • • Aldosas Triosas • Cetosas No pueden ser hidrolizados Azúcares simples • • Triosas (CH2O)n Grupo carbonilo externo • Gliceraldehído Grupo carbonilo interno • Tautómeros Dihidroxiacetona Clasificación Número de átomos de carbono que contienen Polihidroxialdehídos (aldosas) Polihidroxicetonas (cetosas) Número de átomos de carbono Aldosa cetosa Tres Aldotriosa Cetotriosa Cuatro Aldotetrosa Cetotetrosa Cinco Aldopentosa Cetopentosa Seis Aldohexosa Cetohexosa Siete Aldoheptosa Cetoheptosa Ocho Aldooctosa Cetooctosa Tautómeros Grupos funcionales Grupo hidroxil o Grupo carbonil o (aldehíd o) Gliceraldehído, Aldotriosa Grupo carbonil o (cetona) Dihidroxicetona Cetotriosa Enantiómeros Proyección de Fischer Nomenclatura R-S HC H HC O C OH O Rectus Derecha OH H CH2OH CH2OH R-(+)-Glicerialdehído HC OH- a la derecha OH- a la izquierda En la naturaleza predominan los monosacáridos de la serie D Sinister Izquierda HO HC O C H HO Diastereómeros Monosacáridos pueden tener más de 1 C quiral 2 C quirales Existan 2 tipos de estereoisómeros 4 estereoisómeros S-(-)-Glicerialdehído Tetrosas Aldotetrosas Molécula con «n» centros quirales tendrá 2n No son imágenes especulares H CH2OH CH2OH Configuración absoluta O O H O H CH2OH Tetrosas Cetosa 4 carbonos 1 C quiral Cetosa deriva del de la correspondiente aldosa Inserción de las letras «ul» r i t r o s a Hexosas 6 átomos de C o Glucosa o Fructosa o Galactosa o Manosa D-(-)-Eritrosa CHO Adición de un C Aldopentosas o 3 centros quirales o 8 estereoisómeros o 4 pares de enantiómeros 1 par de enantiómeros E Pentosas H CHO H OH HO H H OH H OH H OH H O CH2OH D-(-)-Ribosa CH2OH CH2OH C C O OH Cetopentosas H OH o 2 centros quirales CH2OH o 4 estereoisómeros D-Ribolosa o 2 pares de enantiómeros H HO O CH2OH CH2OH D-(-)-Arabi C HO OH H H H O H CH2OH CH2OH L-Xilulosa D-Fructos Estructuras de anillo Formación de un hemiacetal «Reacción entre un aldehído y un alcohol» «Proyección de Haworth» o 99 % azúcares se encuentran en forma de anillos o Estructura del azúcar o pH o Disolvente o Temperatura Anillos de pentosa Los hemiacetales de cinco miembros se denominan formas furanosa -El carbono portador denomina anomérico. de los dos oxígenos se 1 CHO H H H 2 3 4 La ciclación a la forma furanosa involucra este grupo hidroxilo OH OH OH 5 CH2OH H 4 5 CH2OH H H H 1 OH 3 OH O Un rotación sobre el Eje C(3)-C(4) H 2 OH O H H H 1 3 OH 2 OH O Los hemiacetales de sies miembros se denominan piranosas 1 CHO H HO Confórmero eclipsado de D-Ribosa D-Ribosa 4 Anillos de hexosa H 5 HOH2C Confórmero de D-Ribosa susceptible de formar la furanosa H H 2 3 4 OH D-glucosa (el grupo hidroxilo en la posición C5 es el que produce la piranosa) H OH 5 OH 6 CH2OH 5 H HOH2C O H H H H HOH2C O H H H OH OH O H O HOH2C H H OH OH OH β-D-Ribofuranosa α-D-Ribofuranosa H H OH 4 OH H H 1 OH OH H 3 H 2 O Rotación sobre el enlace C4-C5 OH H OH 6 HOH2C 5 OH H H H 4 OH H 1 OH 3 2 OH H 6 CH2OH O CH2OH OH H OH β-D-Ribofuranosa α-D-Ribofuranosa CH2OH O H H H HO OH H CH2OH O H H OH H H OH OH H α-D-glucopiranosa β-D-glucopiranosa OH H HO H H OH β-D-glucopiranosa α-D-glucopiranosa Mutarrotación OH α-D-glucopiranosa β-D-glucopiranosa O H H OH OH H H CH2OH H HO H OH HO OH α-D-glucopiranosa β-D-glucopiranosa O H • • • • Glucosa Fructosa Monosacárido más abundante Se encuentra en diferentes frutas y hortalizas Dextrosa Se obtiene de la hidrólisis controlada del almidón. • Se encuentra principalmente en jugos de diversas frutas y en las mieles • Azúcar reductor • Levorrotatorio, se le designa con el nombre de levulosa Galactosa Derivados de los monosacáridos Ésteres de fosfato • Cerebrósidos y los gangliósidos, indispensables en los tejidos nerviosos del cerebro. • No se encuentra libre en la naturaleza Se da por la reacción entre el ácido fosfórico H y un azúcar: H H H HO O HO HO H2O3PO H2O3PO H3PO4 O H2O3PO H H OH H H H OH D-gliceraldehído-3-fosfato β-D-glucosa-1-fosfato β-D-glucosa-6-fosfato α-D-Fructosa-6-fosfato OPO3H2 H OPO3H2 Desoxiazúcares El grupo hidrógeno. hidroxilo se remplaza por un CHO H Aminoazúcares El grupo hidroxilo se reemplaza por un grupo amino -Ejemplos: H H H OH HOH2C OH H O HO HO O OH H3C NHCCH3 OH O N-acetil-D-glucosamina CH2OH Componente del polisacárido quitina H2N HO L-Daunosamina Fármaco anticancerígeno 2-Desoxi-D-ribosa Los derivados de 2-desoxi-D-ribosa, llamados desoxiribonucleótidos, son unidades fundamentales del ácido desoxiribonucléico (ADN). Polioles Alditoles Estos compuestos se forman cuando los grupos aldehído o cetona de los azúcares se reducen y se produce el correspondiente hidroxilo. Reducción del grupo carbonilo Disacáridos GLUCOSIDOS Eliminación de una molécula de agua entre OH 1. Dos monómeros específicos del azúcar que lo forman anomérico y OH de otro compuesto (O-glucósido) 2. Los carbonos que intervienen en la unión 3. El orden de las dos unidades monoméricas, en el caso de que sean distintos 4. La configuración anomérica del grupo hidroxilo Nomenclatura Extremo no reductor (izquierda) y abreviaturas (Ara,Fru,Fuc, Gal, Glc, Lyx, Man, Rib, Xyl) Prefijos α- o enantioméricas D- para formas anoméricas Enlace O-glucosídico Entre dos -OH de dos monosacáridos y p y f para anillos de piranosa o furanosa Átomos de paréntesis enlace (X glucósídico; y) número entre α-Glucosídico si el primer monosacárido es α β-Glucosídico si el primer monosacárido es β Eliminación de agua Disacáridos Azúcar de malta Maltosa Grano germinado de cebada que se utiliza en la elaboración de la cerveza Dos monosacáridos Se obtiene por hidrólisis de almidón y glucógeno Son solubles en agua Posee dos moléculas de glucosa unidas por enlace tipo α(1-4) Dulces y cristalizables Es el azúcar de la leche de los mamíferos Lactosa Leche de vaca contiene del 4 al 5% de lactosa Se encuentra formada por la unión β-D-galactopiranosa (galactosa) α/β-D-glucopiranosa (glucosa). Azúcar de mesa Caña de azúcar Remolacha azucarera Disacárido no reductor Sacarosa β (1-4) α-glucopiranosa y β-fructofuranosa (1-2) Polisacáridos Estos pueden tener dos papeles importantes: Más de 10 monosacáridos Azúcares de reserva energética Homopolisacáridos Almidón 1. Estructural : celulosa en las plantas, quitina en insectos Glucógeno Heteropolisacáridos 2. Almacenamiento energético de carbono: almidón en plantas, glucógeno en animales. Heparina Almidón DE RESERVA Reserva propio de los vegetales Almidón Amilosa (10-20%) y Amilopectina (80-90 %) Amilosa Amilopectina Glucógeno Semillas y tejidos vegetales Tubérculos de papa Cerales α-D-Glucopiranosa Almidón Tipo de enlace Amilosa: Cadena lineal α (1-4) Amilopectina α (1-4) y α (1-6) Ramificación cada 20 ó 30 unidades. HIDRÓLISIS DEL ALMIDÓN ALMIDÓN DEXTRINAS MALTOSA Ataque por enzimas en extremo no reductor Glucógeno Origen animal Hígado y en los músculos Molécula muy similar a la amilopectina; pero con mayor abundancia de ramificaciones Glucógeno Celulosa Plantas Componente estructural de la pared de las células vegetales Polímero lineal de glucosa , que por hidrólisis parcial produce celobiosa (2 unidades de D-glucosa con enlaces glucosídico (β-1,4) α (1-4) y Indigerible → fibra dietética α (1-6) Celulosa β(1- 4) Quitina Grupo amino acetilado N-acetil-β-D-glucosamina (1-4)