Subido por
notificacionescr
Preguntas de Práctica de Bioquímica: Cinética e Inhibición Enzimática
Anuncio
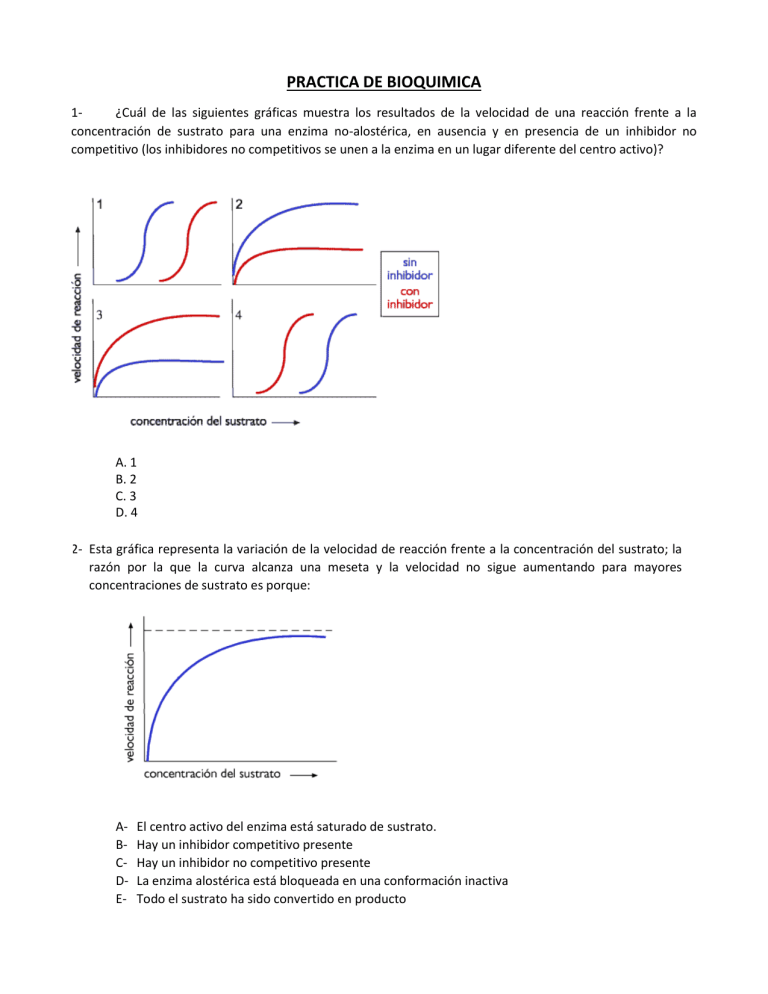
PRACTICA DE BIOQUIMICA 1¿Cuál de las siguientes gráficas muestra los resultados de la velocidad de una reacción frente a la concentración de sustrato para una enzima no-alostérica, en ausencia y en presencia de un inhibidor no competitivo (los inhibidores no competitivos se unen a la enzima en un lugar diferente del centro activo)? A. 1 B. 2 C. 3 D. 4 2- Esta gráfica representa la variación de la velocidad de reacción frente a la concentración del sustrato; la razón por la que la curva alcanza una meseta y la velocidad no sigue aumentando para mayores concentraciones de sustrato es porque: 3- 4ABCDE- El centro activo del enzima está saturado de sustrato. Hay un inhibidor competitivo presente Hay un inhibidor no competitivo presente La enzima alostérica está bloqueada en una conformación inactiva Todo el sustrato ha sido convertido en producto 3- En la presencia de alcohol deshidrogenasa, la velocidad de reducción del acetaldehido a etanol aumenta a medida que lo hace la concentración de acetaldehido. Eventualmente la velocidad de reacción alcanza un máximo, donde posteriores aumentos de la concentración de acetaldehido no tienen efecto. ¿Por qué? ABCD- Todas las moléculas de alcohol deshidrogenasa están unidas a moléculas de acetaldehido. A altas concentraciones de acetaldehido, la energía de activación de la reacción desciende La enzima ya no es específica para el acetaldehido Para altas concentraciones de acetaldehido, el cambio en energía libre de la reacción disminuye. 4- Para estudiar la dependencia de la v frente a [S] de una reacción catalizada enzimáticamente, una cantidad constante de enzima se adiciona a una serie de medios de reacción de 10 ml de volumen conteniendo diferente [S]. Las velocidades iniciales de reacción se han determinado midiendo el número de moles de producto formado por minuto, obteniéndose los siguientes resultados: [S](moles/litro) 5 x 10-2 v0(µmoles/min.) 0,25 5 x 10-3 0,25 5 x 10-4 0,25 5 x 10-5 0,20 5 x 10-6 0,071 5 x 10-7 0,0096 Empléese el cálculo numérico para responder a las siguientes cuestiones: a) ¿Cuál es la Vmax. para esta [E]?. b) ¿Cuál es la Km de ésta enzima?. 5- La cinética de una enzima viene medida como función de la [S] en ausencia y presencia del inhibidor a una [I]=10-4 M. A partir de los siguientes resultados: [S]x10-5 M v0 (µmoles/min.) sin I v0 (µmoles/min.) con I 0,3 10,4 2,1 0,5 14,5 2,9 1 22,5 4,5 3 33,8 6,8 9 40,5 8,1 a) Representar 1/V0 frente a 1/[S]. b) Calcular Vmax. y Km en ausencia y presencia de inhibidor. c) ¿Qué tipo de inhibición es esta? 6- ¿Qué información puede obtenerse a partir de una representación de Lineweaver-Burk cuando la recta corta al eje X en –40 (mol/l)-1? 7- Calcular la Km y la Vmax sabiendo que la recta obtenida en una representación Lineweaver-Burk corta al eje de ordenadas en 1/V = 5x103 (mol/min)-1 y la pendiente de la recta es 120 min/L. 8- Se han obtenido los siguientes resultados al estudiar los efectos del pH sobre la actividad de la fosfatasa alcalina procedente de una muestra de hueso. Determinar a qué pH tiene la enzima una afinidad mayor por el sustrato. 9- Al representar por el método de los dobles inversos la cinética de la enzima fosfatasa alcalina (en una suspensión de 8 µg/ml) y en presencia de p-nitrofenil fosfato, se obtiene una recta que corta el eje de ordenadas en 1/300 min/µmol, y una pendiente de 0,05 min/L. Calcular: a) Vmax; b) Km 10- La actividad de una lipasa es inhibida por un ácido. Los resultados de velocidades para diferentes concentraciones de sustrato en ausencia y presencia del ácido se muestran en la tabla. ¿Qué tipo de inhibidor es? Calcular los parámetros cinéticos Km y Vmax.









