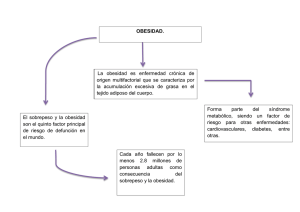
Descarga PDF - Asociación Psiquiátrica Mexicana
Anuncio

CONSENSO Y GUÍA DE LA ASOCIACIÓN PSIQUIATRICA MEXICANA PARA EL MONITOREO Y MANEJO DE LAS ALTERACIONES CARDIOMETABÓLICAS SECUNDARIAS AL USO DE PSICOFÁRMACOS EDITOR Dr. Wazcar Verduzco Fragoso AUTORES Dr. Carlos Aviña Cervantes Médico Psiquiatra. Instituto Nacional de Neurología y Neurocirugía “Manuel Velasco Suárez”. Dra. Claudia Becerra Palars Coordinadora Clínica de Trastornos del Afecto Instituto Nacional de Psiquiatría "Ramón de la Fuente" Dr. Alejandro de Jesús Caballero Romo. Médico Psiquiatra. Instituto Nacional de Psiquiatría “Ramón de la Fuente”. Coordinador de la Clínica de la Conducta Alimentaria. Profesor Titular del Curso de Posgrado en Trastornos de la Conducta Alimentaria. Dr. Alejandro Díaz Anzaldúa Médico Psiquiatra, Médico Internista.Coordinador Vespertino del Servicio de Consulta Externa, Instituto Nacional de Psiquiatría “Ramón de la Fuente Muñiz”, Secretaria de Salud, México. Profesor de Pregrado y Posgrado, Departamento de Psicología Médica, Psiquiatría y Salud Mental, Facultad de Medicina, Universidad Nacional Autónoma de México. Lic Nut. Blanca Lilia Gómez Tello Nutrióloga Asistente de Investigación Universidad Autónoma Metropolitana - Xochimilco Dr. César González González Médico Psiquiatra, con subespecialidad en Psicogeriatria e investigación y clinimetría en psiquiatría. Jefe de Investigación del Instituto Jalisciense de Salud Mental. Investigador asociado “A” de la Secretaría de Salud. Lic. Nut. Ana Alicia Hernández Báez Nutrióloga. Especialista en nutrición de paciente con enfermedad terminal. Candidato a maestro por el Centro de Investigaciones en Alimentación y Desarrollo. Consultante en nutrición del paciente oncológico en la práctica privada. Dr. Miguel Herrera Estrella Médico Psiquiatra. Hospital Psiquiátrico Fray Bernardino Álvarez . Centro de Investigación Pro Salud Mental, Dr. Fernando López Munguía Psiquiatra Forense Subdirector Médico de Hospitalización en el Hospital Psiquiátrico “Fray Bernardino Álvarez” de la Secretaría de Salud. Profesor Titular de Psiquiatría Forense en la Facultad de Medicina, Universidad Nacional Autónoma de México. Perito en Psiquiatría en diversos ámbitos legales. Presidente Electo de la Asociación Psiquiátrica Mexicana, A.C. Bienio 2010-2011 Dr. Eduardo Ángel Madrigal de León Médico Psiquiatra y Psicoterapeuta. Profesor Investigador Titular B del Centro Universitario de Ciencias de la Salud de la Universidad de Guadalajara. Subdirector de Desarrollo Institucional del Instituto Jalisciense de Salud Mental. Dra. Marcela de la A. Martínez González Médico Psiquiatra, Hospital Psiquiátrico Fray Bernardino Álvarez. Diplomado en Psiquiatría en Hospital General. Dr. Humberto Nicolini Sánchez Médico psiquiatra, Doctor en Ciencias Médicas. Postgrado en Ciencias Genómicas de la Universidad Autónoma de la Ciudad de México y Hospital Psiquiátrico Fray Bernardino Álvarez, SS. Dra. M. Magdalena Ocampo Regla. Médico Psiquiatra. Instituto Nacional de Psiquiatría “Ramón de la Fuente”. Clínica de la Conducta Alimentaria Dra. Martha Ontiveros Uribe Médico psiquiatra. Subdirectora del Servicio de Hospitalización, Instituto Nacional de Psiquiatría “Ramón de la Fuente Muñiz”, Secretaria de Salud, México. Profesora de Pregrado y Posgrado, Departamento de Psicología Médica, Psiquiatría y Salud Mental, Facultad de Medicina, Universidad Nacional Autónoma de México. Presidenta de la Asociación Psiquiátrica Mexicana, bienio 2008-2009 Dra. Soledad Rodríguez-Verdugo M. Médico Psiquiatra. Instituto Nacional de Psiquiatría Ramón de la Fuente. Directora de Enseñanza e Investigación SESAM Sonora. Dr. Francisco Romo Nava Médico Adscrito a la Clínica de Trastornos del Afecto Instituto Nacional de Psiquiatría "Ramón de la Fuente" Lic. Nut. Rita Salgado Flores Nutrióloga. Instituto Nacional de Psiquiatría “Ramón de la Fuente”. Servicio de Nutrición. Dr. Felipe Vázquez Estupiñán Médico psiquiatra y Maestro en Ciencias Médicas. Hospital de Especialidades CMN-SXXI Profesor Titular del Curso de Especialización en Psiquiatría. Dr. Wazcar Verduzco Fragoso Médico Psiquiatra, Psicoterapeuta. Adscrito al Hospital de Psiquiatria “Dr. Hèctor H. Tovar Acosta”, IMSS. Coordinador de la Sección Académica de Esquizofrenia de la Asociación Psiquiátrica Mexicana (APM). Coordinador de Secciones Académicas de la APM. Profesor de Pregrado y Posgrado, Departamento de Psicología Médica, Psiquiatría y Salud Mental, Facultad de Medicina, Universidad Nacional Autónoma de México. Dr. Sergio Villaseñor Bayardo Médico Psiquiatra y Antropólogo. Profesor Investigador Titular B del Centro Universitario de Ciencias de la Salud de la Universidad de Guadalajara. Miembro del Sistema Nacional de Investigadores, nivel I. ASESORES Dr. Marino Fernández Martínez Médico Endocrinólogo Lic. Dulce Marisol Boy Ayala Lic. en Nutrición REVISORES Dr. Enrique Camarena Robles Médico Cirujano con la especialidad en Psiquiatría General, Psiquiatría Infantil de la Adolescencia y en Psicoterapia Psicoanalítica. Profesor en cinco universidades nacionales y tres internacionales. Ex-Coordinador Nacional de Programa de Salud Mental y Psiquiatría en el Instituto Mexicano del Seguro Social. Ex-Presidente de la Asociación Psiquiátrica Mexicana, bienio 2000-2001 Ex-Director General de los Servicios de Salud Mental de la Secretaria de Salud del Gobierno Federal, México. Ex-Coordinador Zonal de la Región México Centro América y el Caribe de la Asociación Mundial de Psiquiatría. Secretario Administrativo de la Asociación Psiquiátrica de América Latina, 2006-2012. Médico adscrito del Hospital de Psiquiatría “Dr. Héctor H. Tovar Acosta”, Instituto Mexicano del Seguro Social, México. Dr. Fernando Corona Hernández Mèdico Psiquiatra. Adscrito al Servicio de Hospitalización, 3er. piso, Hospital Psiquiatrico “Fray Bernardino Alvarez”. Secretaria de Salud, México. Adscrito al Hospital de Psiquiatría “Dr. Héctor H. Tovar Acosta”, Instituto Mexicano del Seguro Social. México. Dr. Enrique Chávez León Médico psiquiatra. Profesor de Pregrado y Posgrado, Departamento de Psicología Médica, Psiquiatría y Salud Mental, Facultad de Medicina, Universidad Nacional Autónoma de México. Coordinador del Área Clínica de la Escuela de Psicología, Universidad Anáhuac México Norte. Secretario de Publicaciones, Asociación Psiquiátrica Mexicana Secretario de Actividades Científicas, Asociación Psiquiátrica Mexicana Dr. Octavio Escobedo Islas Médico internista. Adscrito al Hospital de Psiquiatría “Dr. Héctor H. Tovar Acosta”, Instituto Mexicano del Seguro Social. México. Adscrito al servicio de Medicina Interna Hospital General “Xoco”, Servicios de Salud del GDF. Socio Colegiado del Colegio de Medicina Interna de México Dra. Socorro González Gonzalez Médico Psiquiatra, Adscrita al Servicio de Hospitalización, 3er. piso, Hospital Psiquiatrico “Fray Bernardino Alvarez”. Secretaria de Salud, México. Dr. Omar Kawas Valle Médico psiquiatra. Profesor del Departamento de Psiquiatría del Hospital Universitario de la Universidad Autónoma de Nuevo León, Monterrey, Nuevo León. México. Vicepresidente del Capítulo Mexicano de la Sociedad Internacional de Trastornos Bipolares (ISBD) Dr. Amado Nieto Caraveo Médico psiquiatra, Maestría en Ciencias Médicas. Secretario Académico, Profesor e Investigador de la Universidad Autónoma de San Luis Potosí, México. Dr. Jesús Ramírez Bermúdez Médico Psiquiatra. Jefe de Enseñanza, Instituto Nacional de Neurología y Neurocirugía “Manuel Velasco Suárez”, Secretaría de Salud, México. Profesor de los cursos de especialización en Psiquiatría y del posgrado para médicos especialistas en Neuropsiquiatría. Facultad de Medicina. División de Estudios de Posgrado de la Universidad Nacional Autónoma de México. “CONSENSO Y GUÍA DE LA ASOCIACIÓN PSIQUIÁTRICA MEXICANA PARA EL MONITOREO Y MANEJO DE LAS ALTERACIONES CARDIOMETABÓLICAS SECUNDARIAS AL USO DE PSICOFÁRMACOS” PRESENTACIÓN Este Consenso y Guía son resultado de la inquietud generalizada en el gremio de la psiquiatría por la presencia de efectos indeseables cardiometabólicos secundarios al uso de antipsicóticos, por lo cual el Coordinador de la Sección Académica de Esquizofrenia de la Asociación Psiquiatrica Mexicana (APM) determinó la conveniencia de realizar un Consenso y Guía para el monitoreo y manejo de dichas alteraciones, contando para ello con el completo apoyo de la Dra. Martha Ontiveros Uribe, presidenta de la APM, quien considero la pertinencia de hacerlo extensivo al uso de psicofármacos en general. También se contó con el apoyo incondicional del Dr. Enrique Camarena Robles, quien en su calidad de Secretario Administrativo de la Asociación Psiquiatrica de América Latina (APAL), igualmente otorgo el aval de dicha asociación para realizar esta actividad. Así, se presentan los resultados del Consenso realizado por la APM para su aplicación a población mexicana, incluyendo recomendaciones generales dirigidas al especialista en psiquiatría, organizadas como lineamientos prácticos para el monitoreo y manejo de los pacientes con alteraciones metabólicas y cardiovasculares secundarias al uso de psicofármacos. Estos lineamientos capacitan al psiquiatra para realizar medidas de prevención, detección y tratamiento, guiándole en la toma de decisiones para el manejo eficaz de las alteraciones mencionadas. PRESENTACIÓN APM La Asociación Psiquiátrica Mexicana se congratula de la elaboración de este importante, actual y sumamente útil “Consenso y guía para el monitoreo y manejo de las alteraciones metabólicas y cardiovasculares secundarias al uso de psicofármacos”. Es un documento importante, actual y útil porque en el mundo y lamentablemente en México se han incrementado y son un verdadero problema de salud pública el sobrepeso, la obesidad, y la diabetes. Los psiquiatras debemos estar preparados para detectar y manejar en forma multidisciplinaria estos problemas, pero sobre todo debemos tratar de PREVENIRLOS. Sabemos que todos los medicamentos no psiquiátricos y psiquiátricos potencialmente pueden producir efectos secundarios, debemos conocerlos, advertir de ellos al paciente y a sus familiares, e implementar programas de farmacovigilancia para intentar prevenirlos. De ahí la enorme utilidad de este Consenso en el que participan distinguidos psiquiatras pertenecientes a la Asociación Psiquiátrica Mexicana (APM), verdaderos expertos en los temas que desarrollaron, y que laboran en las Instituciones Psiquiátricas más representativas de nuestro país. Este trabajo ha sido posible gracias a la labor, el esfuerzo y dedicación del Editor Dr. Wázcar Verduzco Fragoso, Representante de las Secciones Académicas de APM en el Bienio 2008 – 2009, quien convocó a todos los participantes, revisó y organizó el material. Ha sido relevante la participación del Dr. Alejandro Díaz Anzaldúa quien además de ser psiquiatra es médico internista egresado del Instituto Nacional de Nutrición Salvador Zubirán, y colaboró para que el Consenso fuera el resultado del trabajo de un equipo multidisciplinario. Un agradecimiento al Dr. Enrique Camarena Robles Ex – Presidente de APM y actual Presidente Electo de la Asociación Psiquiátrica de Americana Latina quien brindo todo su apoyo a este proyecto. Felicidades a Todos los Autores por el excelente trabajo realizado. Y nuestro agradecimiento al Laboratorio Psicofarma que estuvo siempre presente en la organización de las reuniones de trabajo que se requirieron para lograr la publicación de esta obra, que será de gran utilidad en la práctica clínica psiquiátrica y redundará en el bienestar de nuestros pacientes. Dra. Martha Patricia Ontiveros Uribe Presidenta Asociación Psiquiátrica Mexicana Bienio 2008 - 2009 PRESENTACIÓN APAL Desde hace aproximadamente 40 años la psiquiatría ha venido dando un giro hacia el conocimiento más profundo de la neurobiología del SNC. El andamiaje detallado del tipo de receptores, neurotransmisores y funciones específicas de los neuromóduladores cerebrales ha crecido en forma exponencial. También es cierto que el crecimiento y desarrollo en el campo de la psicofarmacología y a la par de los primeros avances mencionados ha sido similar. Si bien nadie niega la importancia de estos avances, debemos reconocer que han aparecido nuevos e insospechados “fantasmas” en la práctica clínica terapéutica. El entusiasmo por la eficacia de los psicofármacos queda opacado al paso del tiempo por la presencia de efectos colaterales que no habían sido identificados al inicio de su uso clínico cotidiano. Este es el caso de las alteraciones cardiometabólicas, que se han dado en diversas proporciones, con los psicofármacos que hoy se encuentran disponibles en el mercado. Se fue descubriendo que el incremento de peso, y a la postre la presencia del síndrome metabólico venía a complicar el tratamiento. La experiencia hoy en día ya es amplia y hemos aprendido a usar con cautela estos medicamentos. Sabemos que nuestra intervención temprana en base a la psicoeducación, el control estrecho de indicadores como el peso, la hiperlipidemia y la glucosa son imprescindibles para un buen y exitoso tratamiento. Por otro lado pareciera que algunos aspectos de la genética de nuestros pueblos viene a empeorar el panorama en cuanto el mayor riesgo de desarrollar diabetes mellitus. Todos estos hechos nos llevan a reflexionar y disertar sobre el tema. Un grupo de expertos de diversas disciplinas relacionadas con el síndrome metabólico trabajaron en coordinación con destacados psiquiatras mexicanos para desarrollar este consenso que viene a enriquecer las publicaciones de la Asociación Psiquiátrica de América Latina y de una de sus más pujantes miembros, la Asociación Psiquiátrica Mexicana. El trabajo en este campo es efervescente, y se continuará en la tarea de desarrollar publicaciones en español ricas en contenido y profundidad, que estén a la par de las mejores publicaciones del mundo. Un reconocimiento a todos los profesionales que unieron sus esfuerzos para desarrollar esta tarea. Atte Dr. Enrique Camarena Robles Vicepresidente de la Asociación Psiquiátrica de América Latina OBJETIVOS Evaluar y adoptar una posición con respecto a las alteraciones metabólicas y cardiovasculares secundarias al uso de psicofármacos, utilizando como método para lograr este objetivo el “Consenso”. El consenso debe ser útil para sensibilizar al médico y ayudarle a distinguir las situaciones de riesgo de las que simplemente requieren monitorización por el uso psicofármacos, debiendo, entonces, contribuir al uso prudente de los mismos. Por lo tanto, el consenso no debe ser contemplado por el clínico como confuso ni debe invitarle a prescindir de algunos fármacos, sino que debe considerarle una herramienta valiosa para orientarle en el análisis riesgo/beneficio que obligatoriamente implica cualquier prescripción, teniendo siempre presente que el bienestar total del paciente es el objetivo final con cada decisión sobre tratamiento. De tal manera, este documento pretende favorecer que los psiquiatras tengan más presente la salud física de las personas a las que atienden., en las que si bien el tratamiento de la enfermedad psiquiátrica es medular y se debe brindar atención a las comorbilidades médicas, se debe estar alerta a los eventos adversos que pudieran llevar a la falta de apego al tratamiento o a su suspensión prematura. Para alcanzar estos objetivos los consensos son idóneos porque poseen las siguientes virtudes: Son acuerdos conciliadores. Enriquecen las experiencias y los conocimientos de otros y con otros. Reconocen las diferencias regionales. Fomentan el desarrollo científico. Logro de un grupo de expertos y no de un solo individuo. METODOLOGÍA UTILIZADA Se utilizó el consenso formal1 como la parte esencial del trabajo en el que participaron psiquiatras mexicanos con vasta experiencia clínica. Este se caracteriza metodològicamente como se refiere a continuaciòn: Se reúne un grupo de expertos para realizar recomendaciones durante una conferencia estructurada de dos días y medio de duración. Inicialmente los expertos presentan la evidencia. A continuación, se genera una discusión abierta durante una sesión plenaria. Posteriormente, un subgrupo elabora las guías durante una sesión cerrada. Finalmente otro grupo de expertos revisa las pruebas y diseña las guías. Como precedente para el desarrollo de este trabajo se consideraron el “Consensus development conference on antipsychotic drugs and obesity and diabetes”, publicado en el J Clin Psychiatry 2004; 65: 267-72, en el que participaron la American Diabetes Association; American Psychiatric Association; American Association of Clinical Endocrinologists; North American Association for the Study of Obesity, así como la Conferencia “Mount Sinai” sobre monitoreo médico publicado por Marder y cols. el año 2004, y las “Food and Drug Administration recommendations for atypical antipsychotics, September 2003”. Las actividades fueron coordinadas por el Dr. Wàzcar Verduzco Fragoso, responsable del índice general del trabajo y de la búsqueda electrónica en OVID de los artículos relacionados con los objetivos del presente documento, mismo con que se dio inició a la tarea, para la cual se conformó un grupo de psiquiatras para encomendarles el desarrollo de los contenidos, y otro grupo para fungir como revisores. Para ello, se identificó a médicos con amplia experiencia clínica y que además manifestaran su interés en participar en este proyecto y que cumplieran con el siguiente perfil: 1 Ser médicos con entrenamiento formal completo en la especialidad de psiquiatría, endocrinología o medicina interna, en una institución nacional o extranjera reconocida. Tener experiencia mayor de cinco años en la atención de enfermos que padecen trastornos mentales. Tener práctica privada y/o institucional en el sistema de salud mexicano (IMSS, ISSSTE, SSA, etc.). Aceptar participar en dos reuniones académicas de tres días de duración convocadas ex profeso para el desarrollo del Consenso. No presentar conflicto de intereses. Perry S, Kalberer JT Jr. The NIH consensus-development program and the assessment of health-care Technologies: the first two years. N Eng J Med 1980, 303: 169-172. En la siguiente etapa se llevaron a cabo dos reuniones de trabajo, la primera en la Cd. de México los días 7 y 8 de agosto con la participación de 11 psiquiatras, 1 endocrinólogo y 2 nutriólogas, en la que se aprobaron los contenidos del documento, basados en el Curso “Importancia del síndrome metabólico en el abordaje integral del enfermo mental”, coordinado por el Dr. Alejandro Díaz Anzaldùa en el Instituto Nacional de Psiquiatría “Ramón de la Fuente Muñiz”. También en esta reunión el Coordinador presento la información relacionada con las “Alteraciones metabólicas secundarias al uso de psicofármacos”, en tanto que el Dr. Díaz Anzaldùa y los asesores presentaron la relacionada con “El vínculo entre el Sx Metabólico y la Psiquiatría”, “La evaluación y seguimiento de los parámetros metabólicos”, “El manejo farmacológico de los trastornos metabólicos en el paciente psiquiátrico”.y “El manejo nutricional de los trastornos metabólicos en el paciente psiquiátrico”. Durante la sesión final de la reunión: Se realizó discusión plenaria Se asignaron tareas por equipos de trabajo para la elaboración del borrador del documento final, el cual debía cumplir con las siguientes características: o o o o o o o o Objetivo. Ser claro y breve. Proporcionar recomendaciones prácticas. Basarse en información actualizada. Ser flexible para permitir la aplicación del juicio médico. Contemplar la posibilidad de su implementación en la práctica clínica cotidiana. Ser pertinente. Ser oportuno. La distribución de los médicos participantes en cinco equipos de trabajo se determino en base a su experiencia profesional, a cada equipo le correspondió la elaboración de determinados contenidos del documento. La segunda reunión se efectúo en la Cd. de San Miguel de Allende, Gto., los días 4 a 6 de septiembre de 2009, con la participación de doce psiquiatras, mas cuatro que enviaron su material correspondiente, y dos nutriólogas, trabajándose con el material aportado por cada equipo. En cada mesa se nombró un moderador y se procedió a la lectura crítica y análisis del documento base, efectuándose los cambios y/o adecuaciones al texto conforme a los señalamientos de los participantes y el consenso de la mesa, para así concluir con el borrador final del documento. Por cada 120 minutos de trabajo se efectuó un receso de 30 minutos Al final de la jornada se llevo a cabo una discusión abierta en sesión plenaria. La última etapa consistió en la revisión, edición e impresión del material. RESULTADOS A partir del análisis del manuscrito se elaboraron el algoritmo y las tablas de monitoreo sugeridas para el seguimiento y manejo de las alteraciones cardiometabólicas secundarias al uso de psicofármacos que acompañan al presente Documento. PROPÓSITO Y DECLARACIÓN DE INTENCIONES La información contenida en el documento incluye experiencias personales y de grupos específicos de profesionales pertenecientes a diferentes instituciones de salud mexicanas. La medicina basada en evidencia ha sido el sustento y marco de referencia en la elaboración del documento, recurriéndose para ello a sistemas de información, como OVID, incluyéndose revisiones de artículos, revisiones monográficas, y metanálisis. Cada participante se comprometió a aportar su experiencia y opinión sin permitir sesgos por intereses diferentes a los científicos y a los que exigen las buenas prácticas clínicas. Por su estructura, la guía debe manejarse con flexibilidad, por lo que las recomendaciones contenidas pueden ser en todo caso lineamientos generales para orientar a los médicos psiquiatras y no psiquiatras que ejercen la práctica clínica tanto en instituciones públicas como privadas, o bien, en su consultorio, con la finalidad de favorecerles una eficiente toma de decisiones que conlleve un óptimo desempeño profesional. Octubre de 2009. DR. WAZCAR VERDUZCO FRAGOSO COORDINADOR, COMPILADOR Y EDITOR DEL CONSENSO Y GUÍA AGRADECIMIENTOS: Dra. Martha Ontiveros Uribe Presidenta de la Asociación Psiquiatrica Mexicana Bienio 2008-2009 Dr. Enrique Camarena Robles Secretario Administrativo de la Asociación Psiquiatrica de América Latina. Presidente electo de la APAL 2010-2011 Dr. Fernando López Murguía Presidente electo de la Asociación Psiquiatrica Mexicana Bienio 2010-2011. Dr. Alejandro Díaz Anzaldùa Coordinador del Curso “Importancia del síndrome metabólico en el abordaje integral del enfermo mental”. Instituto Nacional de Psiquiatría “Ramón de la Fuente”, SS. A Psicofarma Que en todas las etapas aportó el apoyo administrativo y financiero para la culminación de este proyecto. CONTENIDOS TEMA PAGINA 1.- INTRODUCCIÓN 16 2.- CONCEPTOS GENERALES Y FISIOPATOGENIA DEL SÍNDROME METABÓLICO. 18 CONSECUENCIAS EN EL METABOLISMO DE LA GLUCOSA, LOS LÍPIDOS Y CARDIOVASCULARES 3.- ASPECTOS GENÉTICOS DEL SÍNDROME METABÓLICO Y LA OBESIDAD 19 IMPLICADOS EN LOS TRASTORNOS MENTALES. 3.1 La Obesidad: Ejemplo de una enfermedad genéticamente compleja. 19 3.2 Epigenética en gemelos discordantes 27 3.3 Obesidad y Psicopatología 29 4.- LOS EFECTOS SECUNDARIOS DE TIPO METABÓLICO DE LOS 30 ANTIPSICÓTICOS 4.1 Mecanismos del aumento de peso 32 32 4.1.1 Monoaminas 4.1.2 Histamina 33 33 4.1.3 Serotonina 34 4.1.4 Hormonas 34 4.1.5 Neuropéptidos y citocinas 34 4.2 Aumento de peso con los antipsicóticos típicos o de primera generación 35 4.2.1 Los efectos del aumento de peso: La resistencia a la insulina 35 4.2.2 Alteraciones de la glucosa en pacientes tratados con antipsicóticos 37 4.2.3 Dislipidemia 37 4.2.4 El síndrome metabólico 39 5.- EFECTOS METABÓLICOS DE LOS ANTIDEPRESIVOS 39 5.1 Introducción 40 5.2 Antidepresivos aumento de peso y obesidad 40 5.2.1 Antidepresivos tricíclicos 42 5.2.2 Inhibidores de la monoaminooxidasa (IMAOS) 42 5.2.3 Inhibidores selectivos de la recaptura de serotonina (ISRS) 43 5.2.4 Inhibidores de la recaptura de serotonina y norepinefrina 43 5.2.5 Otros antidepresivos 44 5.3 Antidepresivos y diabetes mellitus 44 5.3.1 Mecanismo de acción 46 5.4 Conclusiones 47 6.- EFECTOS METABÓLICOS DE LOS ESTABILIZADORES DEL ÁNIMO 47 6.1 Introducción 47 6.2. Litio 48 6.2.1. Incremento de peso 49 6.2.2. Mecanismos del incremento de peso por litio6.2.3 Distiroidismo 50 6.2.3 Distiroidismo 51 6.2.3.1 Mecanismos de acción del litio sobre tiroides 51 6.3 Anticonvulsivantes 52 6.3.1. Carbamazepina 53 6.3.1.1 Mecanismos del incremento de peso por carbamazepina 54 6.4. Valproato 54 6.4.1. Incremento de peso por valproato 6.4.2. Mecanismos del incremento de peso por valproato 6.4.3. Efectos Metabólicos por valproato 6.4.4. Mecanismos de los efectos metabólicos por valproato 6.5 Alteraciones endocrinas probablemente involucradas por el uso de anticonvulsivantes 6.5.1. Osteoporosis 6.5.2. Síndrome de Ovario Poliquístico 6.6 Gabapentina 6.7. Lamotrigina 6.8 Vigabatrina 6.9. Topiramato 7.- PSIQUIATRÍA Y SÍNDROME METABÓLICO 7.1 El vínculo entre el síndrome metabólico y la psiquiatría 8.- ASPECTOS METABÓLICOS CEREBRALES DE LAS CONDUCTAS ALIMENTARIAS RELACIONADAS CON LA OBESIDAD 9.- MANEJO FARMACOLÓGICO Y NUTRICIONAL DE LOS TRASTORNOS METABÓLICOS EN EL PACIENTE PSIQUIÁTRICO 9.1 Manejo Farmacológico 9.1.1. Orlistat 9.1.2. Nizatadina, Ranitidina y Famotidina 9.1.3. Topiramato 9.1.4. Reboxetina 9.1.5. Metformina 9.1.6 Sibutramina 10.- MANEJO NUTRICIONAL DE LOS TRASTORNOS METABÓLICOS Y CARDIOVASCULARES EN EL PACIENTE PSIQUIÁTRICO 10.1 Trastornos Metabólicos 10.1.2. Diabetes Mellitus tipo 2 10.1.2.1 Recomendaciones dietéticas 10.1.3. Enfermedad Cardiovascular 10.1.3.1 Recomendaciones dietéticas 11.- CONCLUSIONES Y RECOMENDACIONES ¿PSIQUIATRA O ENDOCRINÓLOGO? 12.- ANEXOS 12.1 Propuesta de manejo integral de las alteraciones metabólicas 12.2 Modelos para el manejo de las alteraciones metabólicas TABLA 12.3.1 Evaluación y seguimiento de los parámetros metabólicos y cardiovasculares. TABLA 12.3.2 Evaluación y seguimiento de los parámetros metabólicos y cardiovasculares. TABLA 12.3.3 Evaluación y seguimiento de los parámetros metabólicos y cardiovasculares. TABLA 12.4. Formato para el seguimiento del Síndrome Metabólico 12.5 ALGORITMO DE TRATAMIENTO POR ETAPAS DEL SÍNDROME METABÓLICO 13.- REFERENCIAS BIBLIOGRAFICAS 56 56 56 58 58 58 59 59 60 60 61 62 65 67 67 67 68 68 68 68 69 70 70 70 70 71 72 75 77 77 78 79 80 81 82 83 85 1.- INTRODUCCIÓN Las personas con enfermedades mentales graves tienen una menor esperanza de vida que la población general (1-13), su riesgo de mortalidad es dos a tres veces mayor (13) y presentan casi el doble de riesgo para fallecer por padecimientos cardiovasculares (1-13). Dentro de la Psiquiatría esto ha generado una preocupación ascendente puesto que este grupo de pacientes tienen una mayor probabilidad de cursar con sobrepeso, tabaquismo, hiperglucemia, resistencia a la insulina, diabetes, hipertensión y dislipidemia, no obstante, su acceso a recibir atención médica y de calidad es limitado (7, 14, 15, 16). Estos factores de riesgo cardiometabólicos se atribuyen parcialmente a un estilo de vida no saludable, lo que implica una dieta desordenada y sedentarismo, sin embargo, es evidente que los psicofármacos provocan por sí mismos una serie de efectos metabólicos de especial importancia en la medida en que remiten al síndrome metabólico, constelación de factores clínicos que se asocian a un aumento del riesgo de diabetes y de enfermedad cardiovascular (17). El aumento de peso inducido por los psicofármacos se relaciona con esos cambios metabólicos mencionados y recientes investigaciones indican que pueden alterar el metabolismo de la glucosa independientemente de incrementos en el volumen de tejido adiposo corporal. Por lo tanto, la exposición de los pacientes a fármacos que producen un aumento de peso tiene implicaciones que van mucho más allá de lo meramente estético, para erigirse en un factor de riesgo cardiovascular. Conocido este riesgo hay que plantearse si hay un lugar para la prevención y el diagnóstico precoz. La evidencia disponible revela una demora entre la advertencia del médico respecto a la aparición de los efectos adversos metabólicos por el uso de psicofármacos y la implementación de prácticas de monitoreo, existiendo además diferencias significativas en cuanto a los lineamientos para su manejo en las guías disponibles para tal fin (17). Las guías más recientes sobre el uso de psicofármacos sugieren llevar a cabo evaluaciones regulares a fin de investigar cambios significativos en el peso corporal, hiperglicemia, alteraciones en el perfil de lípidos y otros cambios metabólicos. Actualmente, se favorece el cambio de psicofármaco sobre cualquier otro tipo de intervención y se desconoce si el uso preventivo de estatinas u otros agentes pudiesen disminuir el riesgo de desarrollar Síndrome Metabólico, aunque su uso en personas con esquizofrenia, si bien no lo contrarrestan, constituyen un tratamiento eficaz y seguro contra la dislipidemia grave (18, 19). Así, la literatura abunda sobre la aplicación de programas conductuales de estilo de vida y dietéticos originalmente diseñados para pacientes obesos sin patología psiquiátrica. Aunque estos abordajes son promisorios, se deben adaptar tomando en cuenta las características de esta población. FACTORES DE RIESGO QUE CONTRIBUYEN A LAS ALTERACIONES METABÓLICAS Y CARDIOVASCULARES Genético Tabaquismo Comorbilidad médica Riesgo metabólico Polifarmacia Psicofármacos Hábitos dietéticos Actividad física Trastornos mentales 2.- CONCEPTOS GENERALES SOBRE EL SINDROME METABOLICO CONSECUENCIAS SOBRE EL METABOLISMO DE LA GLUCOSA, LOS LÍPIDOS Y CARDIOVASCULARES. El síndrome metabólico constituye un grupo de alteraciones metabólicas que se asocian con un aumento en el riesgo cardiovascular, este incluye alteraciones en el metabolismo de la glucosa, obesidad abdominal, alteraciones de los lípidos plasmáticos e hipertensión arterial (1). Este grupo de signos ha sido reconocido por muchos años como el síndrome X o el síndrome de resistencia a la insulina (2). Existe un debate permanente en torno al empleo de este término (3-9), sus causas no están bien dilucidadas, pero la adiposidad visceral y la resistencia a la insulina juegan un papel central. Las definiciones más comúnmente utilizadas son las del Grupo para el Tratamiento de los Adultos III (ATP III) del Programa Nacional para Educación sobre el Colesterol (NCEP, por sus siglas en inglés (5,10), y el AT III-A con adaptaciones que fue propuesto por la American Heart Association posterior a que la American Diabetes Association redujera la cifra de glucosa en ayunas a 100 mg/100 ml (4, 6). Una definición más reciente es la de la Internacional Diabetes Federation (4, 8), la cual destaca la importancia del perímetro de la cintura, utilizando criterios más estrictos y específicos de etnias y razas. Una declaración conjunta de la American Diabetes Association y de la European Association for the Study of Diabetes llegó a la conclusión de que el síndrome metabólico se ha definido de una manera imprecisa, que hay una incertidumbre en torno a su patogenia y que existen considerables dudas con respecto a su utilidad como un marcador de riesgo para enfermedad cardiovascular, recomendando que hasta no llevar a cabo mayores investigaciones, el médico deberá de evaluar y manejar todos los factores de riego independientemente de que los pacientes cumplan o no con los criterios para su diagnóstico (11, 12). De tal manera, se debe considerar que el concepto de síndrome metabólico llegó a la bibliografía psiquiatrita para apoyar a los psiquiatras e enfocarse mas en este riesgo en los pacientes tratados con psicofármacos (13, 14, 15). 3.- ASPECTOS GENÉTICOS DEL SÍNDROME METABÓLICO Y LA OBESIDAD IMPLICADOS EN LOS TRASTORNOS MENTALES 3.1 La Obesidad: Ejemplo de una enfermedad genéticamente compleja. Uno de los fenotipos que cumple con las características para considerarle dentro de las enfermedades denominadas genéticamente complejas es el de la obesidad. Entre esas características se consideran una elevada frecuencia en la población y una etiología multifactorial. En cuanto a los factores genéticos, debe mostrar una marcada heterogeneidad, es decir, múltiples mecanismos como efecto determinado por genes únicos (p. ej., la leptina), sumatoria de los efectos de varios genes (p. ej., herencia poligénica), así como la presencia de formas genéticas que interactúan con el medio ambiente (epigenética). Todas estas variedades han sido encontradas en la obesidad humana, con lo que se cumple cabalmente con la definición de una enfermedad “compleja” desde la perspectiva genética. En este sentido, al comienzo del siglo XXI, la obesidad y la diabetes tipo 2 han alcanzado proporciones de pandemia. La obesidad es el resultado de un balance energético positivo mantenido a lo largo del tiempo que se caracteriza por la acumulación excesiva de grasa corporal en el tejido adiposo que compromete la salud del individuo (1). Actualmente la obesidad se ha convertido en un serio problema de salud pública a nivel mundial debido a su elevada prevalencia (> de 25 %), su alarmante incremento en niños (2, 3), su estrecha vinculación con las principales causas de morbimortalidad y sus consecuencias psicológicas y sociales. En los últimos años, el interés por la obesidad ha incrementado de manera importante debido a que es un factor de riesgo para enfermedades frecuentes como la ateroesclerosis, alteraciones metabólicas como la resistencia a la insulina, diabetes mellitus, alteraciones de los lípidos, hipertensión arterial, padecimientos oncológicos (cáncer de colon, mama, ovario y próstata), así como trastornos gastrointestinales (4). La obesidad se puede clasificar en tres grupos: la etiológica, la dependiente del Índice de Masa Corporal (IMC), y por su disposición topográfica debida a su acumulación (5). La clasificación más utilizada en la clínica para el diagnóstico de la obesidad, se establece con base en el IMC, el cual se calcula dividiendo el peso de la persona en kilogramos entre su talla elevada al cuadrado: Kg /m2. Usando este fenotipo se han realizado varios estudios de mapeo del genoma con la aportación de mas de 400 genes candidatos y un gen llamado “FATO” (6) sin embargo, la obesidad es un fenotipo mucho mas complejo, siendo causada por perturbaciones en el balance en la ingesta de alimentos y el gasto de energía, el cual es regulado por un sistema fisiológico que requiere la integración de varias señales periféricas y una coordinación central en el cerebro. En este sentido, se han propuesto diferentes rutas de neurotransmisión que pueden estar involucradas con la ingesta de alimentos y se han estudiado los genes pertenecientes a dichas cascadas metabólicas. Dentro de los genes candidatos que han mostrado asociación genética con la obesidad se encuentran principalmente los implicados en diferentes vías metabólicas que participan en: a) control de la ingesta de alimentos, b) gasto energético y c) metabolismo de lípidos y carbohidratos (7, 8). Muchas de las hormonas que participan en estas diferentes vías metabólicas son sintetizadas en el Sistema Nervioso Central (SNC) y junto con las hormonas periféricas que son sintetizadas en el resto del organismo, como en el tejido adiposo y tracto gastrointestinal principalmente, dan como resultado un balance entre la energía gastada, la energía almacenada y la energía ingerida. Dado que el SNC tiene un papel central sumamente importante en estos balances energéticos, se ha observado que varios pacientes obesos presentan, al mismo tiempo, alguna enfermedad psiquiátrica y algunos factores temperamentales como la compulsividad, la impulsividad y la neurosis, los cuales a su vez pueden contribuir al desarrollo de tendencias a comer en exceso (9) o de la anorexia nerviosa (10, 11). Se han realizado estudios de ligamiento cuyos locus corresponden a áreas de codificación que traducen rasgos, entre los cuales sobresalen la obsesividad, la reactividad al estrés y las emociones negativas. Los dos primeros endofenotipos están estrechamente relacionados con la desregulación del sistema serotoninérgico. En el caso de las emociones negativas, la baja densidad de receptores dopaminèrgicos D2 puede estar relacionada con la tendencia a comer cuando se está expuesto a ellas, entonces se expresaría preferencialmente con una mayor tendencia a presentar atracones, y a desarrollar obesidad y sobrepeso. Por otro lado, la vía de la leptina es una de las primeras rutas y de las mejor descritas involucradas en el control del peso corporal. Así, entre los genes involucrados en los trastornos de la conducta alimentaria y la obesidad, y que también se encuentran asociados a enfermedades psiquiátricas se encuentran los transportadores de serotonina y dopamina. Hoy en día, para contrarrestar la obesidad, no solo se requiere de consumir lo que nutre al organismo, realizar actividad fìsica y dejar de consumir alimentos con alto contenido energético y bajo valor nutritivo (carbohidratos y grasas), ya que se ha constatado que ciertos trastornos psiquiátricos vienen acompañados de determinadas conductas alimentarias desadaptativas, por lo tanto, se debe tomar en cuenta que también es cuestión de tener la capacidad volitiva o resiliencia para modificar un estilo de vida poco saludable, lo cual probablemente exista un ingrediente genético en la estructuración de la cognición. El proceso por el cual surge la necesidad de ingerir alimento depende, en parte, de la liberación, recaptura, y la unión a su receptor de dopamina en la neurona posináptica (12). Se sabe que los niveles extracelulares de dopamina en el cerebro dependen de dos procesos: su liberación tónica y en respuesta a un estimulo (13). El comer provoca liberación de dopamina, la cual puede estar relacionada con aspectos del apetito y la búsqueda de alimento (14). Se ha reportado que la señalización de la dopamina en el hipotálamo vía neuronas situadas en los nùcleos dorsomedial y arcuato parecen inhibir la ingesta de alimentos (15). Finalmente, la concentración sináptica de los neurotransmisores está determinada no sólo por la tasa de su liberación en las terminales nerviosas, sino también por su tasa de recaptura en la hendidura sináptica. Este segundo proceso es dependiente de proteínas transportadoras especificas que median la recaptura del neurotransmisor, la expresión de la cual puede ser influenciada por factores metabólicos y hormonales (16). Figura 1. La liberación de la dopamina en el espacio intersináptico. Por lo anterior, el transportador de dopamina juega un papel importante en las neuronas dopaminérgicas. El transportador de dopamina (también llamado transportador activo de dopamina, DAT, SLC6A3) es una proteína que atraviesa la membrana plasmática donde se une el neurotransmisor; el DAT provee el principal mecanismo a través del cual la dopamina es retirada de la sinapsis, transportándola del espacio intersináptico de regreso a la neurona presináptica. El DAT está presente en el área perisináptica de las neuronas dopaminèrgicas en áreas del cerebro donde la señalización es común. Debido a que el DAT determina la señal de la dopamina, se encuentra implicado en un número de trastornos mentales relacionadas con ella, como hiperactividad y déficit de atención, enfermedad bipolar, depresión, y alcoholismo. El gen que codifica para la proteína del DAT humano (hDAT) se encuentra en el cromosoma 5p1.5.3., y consiste de 15 exones codificantes, y tiene una longitud aproximadamente de 64 kbp. Figura 2. Gen del transportador de dopamina. Grafica donde se muestra el gen y la distancia entre sus 15 exones representados en cuadros rojos. Con respecto a los elementos que regulan la expresión del gen DAT se han identificado numerosas secuencias potencialmente regulatorias pero no han sido reconocidas como un núcleo promotor como tal. El gen del DAT humano (hDAT) no cuenta con una caja TATA ni con una caja CAAT. En su lugar, existe un alto contenido local de CG y varios sitios SP1 que podrían servir para el inicio de la transcripción del gen DAT. Sin embargo, existe evidencia de un sitio de inicio de transcripción de hDAT que puede ser consistente para ensamblar la maquinaria de transcripción. En su lugar existe una región conservada de la secuencia TAAGA posicionada a -32 pb en relación al sitio de inicio de la transcripción, que puede servir, aunque esto no ha sido confirmado experimentalmente. Se han identificado varios sitios de unión al factor de transcripción nurr1. El factor de transcripción nurr1, incrementa la actividad transcripcional del gen hDAT, el cual es consistente con la presencia de varios elementos de respuesta a NGFI-B putativos. También hay elementos de silenciamiento restrictivos de neuronas (NBRE) o motivos relacionados dentro del promotor que pueden contribuir a la extraordinaria especificidad celular de la expresión del DAT in vivo (17). Hasta el momento existen muy pocos reportes donde se asocian los patrones de metilación del promotor del DAT con alguna enfermedad, uno de ellos ha analizado el patrón de metilación del DNA en la región promotora del gen DAT en relación al consumo de alcohol. Comparados con los controles, se encontró una significativa hipermetilación del promotor del DAT en los sujetos alcohólicos (Mann-Whitney U-test: p=0.001). Se demostró que la regulación epigenética del promotor del DAT se encuentra alterado en pacientes alcohólicos (18). Otro estudio (19) analizó como en los cambios epigenéticos resultantes de la metilación del DNA del DAT se ve afectada su expresión en la esquizofrenia y en la enfermedad bipolar. Hay evidencia de que tanto la hipermetilación como la hipometilación en las regiones reguladoras del gen juegan un papel crítico en definir la funcionalidad en ambos padecimientos. Se ha demostrado que la serotonina (5-HT) es capaz de modificar aspectos normales del comportamiento, tales como los patrones de ingesta de alimentos, la actividad sexual, la agresividad, y también parece estar implicada en procesos fisiológicos como la regulación de la respiración, el sueño, la función cardiovascular, la temperatura del cuerpo, la percepción del dolor, la función gastrointestinal y la liberación de hormonas (20). Se plantea que el efecto de la serotonina en la saciedad y en la ingesta de los alimentos es controlado principalmente por dos receptores, el 5-HT1B y el 5-HT2C. El gen del transportador de serotonina en humanos es encontrado en el cromosoma 17, en el sitio 17q11.1–q12. Figura 3. Gen del transportador de serotonina. Grafica donde se muestra el gen y la distancia entre sus 13 exones representados en cuadros rojos. Los efectos totales en el control del apetito por la dopamina y la serotonina son anorexigénicos, y en ambas vías la importancia de sus respectivos transportadores es esencial para el control de la ingesta de alimentos, por lo que se puede considerar que el conocer los patrones de metilación en las regiones reguladoras de los genes transportadores de dopamina y serotonina contribuya a la explicación molecular de la condición patológica de la obesidad y de esta manera acrecentar el conocimiento fisiopatológico molecular de la obesidad y de ciertos trastornos compulsivos sobre el control de la alimentación. Por otra parte, la leptina (del griego leptos que significa delgado) es una proteína de 16 kDa que juega un papel clave en la regulación del ingreso y gasto de energía, incluyendo el hambre y el metabolismo. La hipótesis acerca de la existencia de un circuito de retroalimentación endocrina que incluye factores que circulan en proporción al contenido de grasa corporal y actúan en el cerebro para regular el hambre fue confirmada por el descubrimiento de esta hormona en 1994 (21). La leptina está codificada en el gen LEP, se sintetiza principalmente en los adipositos y forma parte de un complejo mecanismo de señales hormonales que involucran al hipotálamo. La leptina secretada por el tejido adiposo, circula en el torrente sanguíneo a niveles que son proporcionales a la cantidad de grasa corporal (energía) almacenada, y a través de su receptor (LEPR), ubicado en las neuronas del hipotálamo (núcleo arcuato), inhibe la síntesis del neuropéptido “Y” (NPY) y la proteína relacionada con el agouti (AGPR), que son sintetizadas exclusivamente por un grupo de neuronas orexigénicas ubicadas en el núcleo arcuato. Por otro lado, en un grupo de neuronas localizadas adyacentemente a las neuronas NPY/AGPR, la leptina al unirse a su receptor estimula la síntesis de proopiomelanocortina (POMC) y del transcrito regulado por cocaína y anfetamina (CART). Entonces, la activación del NPY y AGPR tienen efecto orexigénico, lo cual significa que promueven la ingesta de alimentos e inhiben el consumo de calorías, mientras que la POMC y el transcrito regulado por cocaína y anfetamina (CART) tienen el efecto opuesto, es decir, inhiben la ingesta de alimentos (anorexigénicos) y promueven el gasto energético. La proopiomelanocortina es un precursor de varios neuropéptidos, es activado a través de modificaciones post-traduccionales, principalmente por las enzimas proconvertasa-1 (PC-1) y proconvertasa 2 (PC-2), generándose diferentes tipos de la hormona estimulante de melanocitos (α-MSH, β-MSH y γ-MSH), así como los péptidos adrenocorticotrofina (ACTH), y β-endorfina (22). El gen LEP, se encuentra localizado en el brazo largo del cromosoma 7 en la región 31.1 y contiene 3 exones (2 de ellos codificantes), codifica para un péptido glucosilado de 167 aa que incluye una secuencia de unión a el receptor de la leptina de 21 aminoácidos. La estructura tridimensional de la leptina tiene una conformación de cuatro á-hélices antiparalelas conectadas. Un puente disulfuro entre dos residuos de cisteínas (Cys96-Cys 146) en el carboxilo terminal de la leptina y otra al inicio de una de las asas han mostrado ser importantes para el plegamiento de la estructura y la unión de su receptor. Cualquier mutación en los residuos de cisteína hace a la proteína biológicamente inactiva. Aunque la leptina es principalmente producida y secretada en el torrente sanguíneo por los adipocitos del tejido adiposo blanco, esta no es la única fuente potencial de esta hormona. La placenta, la mucosa gástrica, la médula espinal, el epitelio mamario, el músculo esquelético, la hipófisis, el hipotálamo y el hueso han mostrado también ser capaces de producir pequeñas cantidades de leptina en algunas circunstancias. Promotor Intrones Figura 4. Gen Leptina. Se muestra en cuadros rojos sus 3 exones y las distancias entre ellos, siendo no codificante el exón 1. El promotor cuenta con una caja TATA y una secuencia C/EBP-α, importante para la unión de un factor de transcripción del gen de leptina. La complejidad de la regulación del peso corporal pone en evidencia la importancia de dilucidar los mecanismos que pueden conducir a la pérdida de la homeostasis nutricional. Así, la identificación y caracterización de los factores epigenéticos de los genes asociados con la obesidad y sus co-morbilidades es sin duda la mejor vía para incrementar el conocimiento de su etiopatogénes, sin embargo, queda aún por determinar la importancia epigenética versus componentes no genéticos (ambiente) en su etiología. Los perfiles epigenéticos pueden representar la liga entre un factor ambiental y las diferencias fenotípicas en la obesidad, de modo que es una herramienta muy poderosa en la caracterización y el impacto de los factores ambientales en ella. La epigenética literalmente significa “afuera” o “encima” de la genética convencional. La regulación epigenética gira en torno a la estructura del genoma en la cromatina y su efecto regulador sobre la expresión de los genes. Se consideran procesos de regulación epigenéticos todos aquellos que influyen tanto de manera normal como anormal en la expresión heredable de los genes sin que ocurran cambios en la secuencia del ADN. Así, mientras cada organismo tiene un solo genoma, el mismo individuo puede tener múltiples epigenómas, los cuales pueden diferir del tipo de célula y de tejido, y pueden cambiar durante el tiempo de vida del organismo. Las modificaciones epigenéticas más conocidas y que pueden cambiar la estructura de la cromatina incluyen la metilación del DNA y la modificación de histonas, proteínas que forman complejos para la remodelación de la cromatina, y los microRNAs. La modificación epigenética mas estudiada en humanos es la metilación de la citocina localizada dentro del dinucleótido CpG. La metilación del DNA tiene un papel importante en el control de la actividad génica y la arquitectura del núcleo de la célula Fig. 5: Esquema de las modificaciones epigenéticas que se llevan a cabo en la cromatina. Las hebras de DNA están envueltas alrededor de los octameros de DNA, formando nucleosómas. 3.2 Epigenética en gemelos discordantes Los estudios en gemelos han sido y son, un instrumento para estimar la importancia relativa de la genética versus componentes no genéticos o ambientales en la etiología de las enfermedades multifactoriales humanas. La explicación que subyace en los estudios clásicos en gemelos es la presunción de que los gemelos monocigotos son genéticamente idénticos, mientras los gemelos dicigotos en promedio comparten el 50 % de la segregación de sus genes, y son tan genéticamente diferentes o similares como lo son los hermanos ordinarios. A pesar de lo anterior, los gemelos monocigotos frecuentemente presentan muchas diferencias fenotípicas, tales como la susceptibilidad a enfermedades y un amplio rango de rasgos antropomórficos. Existe una creciente evidencia de que los gemelos monocigotos pueden diferir debido modificaciones genéticas postcigóticas, epigenéticas, y factores ambientales prenatales, por consiguiente se cuestiona la presunción de la similaridad epigenética o genética que subyace en el modelo clásico de gemelos. Por ejemplo Fraga y cols. (23) demostraron que existe una diferencia en la metilación del DNA y la acetilación de las histonas de manera global y locus-especifico en pares de gemelos monocigótos jóvenes y pares de gemelos monocigótos adultos, y demostraron que en los pares de gemelos monocigótos jóvenes son esencialmente indistinguibles en sus marcas epigenéticas, mientras en pares de gemelos monocigótos mayores tienen variaciones epigenéticas sustanciales en varios tejidos (op. cit.). El grado de discordancia en el patrón epigenético estuvo relacionado con las diferencias ambientales (aumentando de acuerdo al estilo de vida y el tiempo que pasaron juntos los gemelos) entre los gemelos. Además, las diferencia en la expresión de genes en los pares de gemelos mayores fue cuatro veces mayor que lo observado en los pares de gemelos jóvenes (op. cit.). La discordancia en gemelos monocigótos en enfermedades complejas, crónicas, no mendelianas tales como esquizofrenia, esclerosis múltiple, obesidad o asma podrían aumentar como un resultado de una cadena de eventos epigenéticos desfavorables en el gemelo afectado. Durante la embriogénesis, la infancia y la adolescencia, hay una amplia oportunidad para los efectos multidireccionales de diferenciación de tejidos, factores estocásticos, hormonas y probablemente algunos factores ambientales (nutrición, medicación, adicciones, etc.) para la acumulación en solo uno de los dos gemelos idénticos de ciertos cambios epigenéticos que darían susceptibilidad a padecer alguna enfermedad (24). Entonces se puede considerar como buen modelo de estudio para conocer las diferencias epigenéticas en pares de gemelos como varían las modificaciones epigenéticas en genes de interés implicados en el desarrollo de la obesidad. En este sentido, la utilización de estudios epigenéticos para los genes leptina, FATO, transportador de serotonina y transportador de dopamina y encontrar las diferencias de metilación en las islas CpG de acuerdo a su índice de masa corporal y tratar de explicar si existe una relación de la metilación con el fenotipo obeso, puede resultar una estrategia muy interesante. 3.3 Obesidad y Psicopatología Aunque la obesidad es fácil de identificar, es sumamente difícil de definir en el aspecto psicológico. Esto nos puede llevar a una inevitable controversia, ya que supone enfrentar y asumir el hecho de que no existe una definición única, sino múltiples definiciones, que a su vez responde a la existencia de muy diversas teorías etiológicas de la obesidad como son la teoría energética, la neuroquímica, la genética, la celular, la endócrina, la ambiental y finalmente las teorías psicológicas. Se han propuesto tres mecanismos fisiopatológicos para este abordaje: 1) La obesidad puede ser un factor de riesgo de otros trastornos, 2) Puede ser un síntoma de otras condiciones patológicas y 3) Puede ser el estado final de regulaciones homeostáticas, como puede suponerse, en los dos primeros casos, y a este se le ha asociado frecuentemente con psicopatología (25, 26). Diversas clasificaciones han señalado a tres mecanismos del patrón alimentario asociado al ajuste emocional: a) la actividad oral funciona como un mecanismo de adaptación ante la presencia de signos de ansiedad, tensión, tristeza y frustración; b) el hambre reemplaza situaciones de excitación, melancolía o ira y c) la comida actúa como una “sustancia adictiva” para hacer frente a la carencia de ajuste social (25). La consideración de que diferentes estados disfòricos conducen a una conducta de sobre ingesta (y la consiguiente obesidad) se sitúa en todas las teorías psicosomáticas formuladas desde la publicación del ya clásico trabajo de Kaplan y Kaplan en 1957. La sobre ingesta sería, según esta teoría, una conducta aprendida por el paciente con finalidades ansiolíticas o, dicho de otra manera, que busca reducir la activación secundaria a estados emocionales internos. Sin embargo, si bien parecía claro que la sobre ingesta sería el resultado del stress, la relación entre ansiedad e ingesta debería ser curvilínea, de manera que grados bajos de activación incrementarían la ingesta, mientras que los elevados tendrían una capacidad inhibidora de la ingesta y que el obeso mantendría la alteración de la ingesta no por su capacidad ansiolítica, sino porque el alimento actuaría como un refuerzo positivo de esa conducta. Las condiciones del ambiente en que se desenvuelve un paciente influirán en su percepción en cuanto a su funcionamiento, así como al propio bienestar psicológico, físico o social, especialmente por las características de una enfermedad estigmatizada por la sociedad como es la obesidad. La sociedad es hostil con los individuos que tienen sobrepeso. Históricamente, la sociedad ha creído que la perdida de peso es una cuestión de fuerza de voluntad. Los individuos obesos han sido considerados como débiles y poco motivados. En una revisión de la literatura (27), encontraron que la mayoría de los candidatos a cirugía de derivación gástrica informaron que habían sido tratados irrespetuosamente por los médicos debido a su obesidad. Es un hecho que, independientemente del grado de obesidad la preocupación por la comida se puede conectar con la insatisfacción de la imagen corporal y el desarrollo de practicas riesgosas como son las dietas restrictivas, que pueden conducir al desarrollo de trastornos de la conducta alimentaria, situación que causa, favorece y mantiene el problema de obesidad. Durante muchos años se ha mantenido la teoría de que los obesos son personas que tienen problemas afectivos o de personalidad que intentan aliviar mediante la conducta de comer. Esto, aunado a las condiciones ambientales, culturales y sociales en que se desenvuelve un paciente, influye en su funcionamiento y bienestar psicológico, físico y social. Una vez analizados de manera general los aspectos genéticos implicados en los trastornos mentales y su relación con la obesidad es claro que se debe considerar este factor al abordar el sobrepeso y la obesidad secundarios al uso de psicofármacos. 4.- LOS EFECTOS SECUNDARIOS DE TIPO METABÓLICO DE LOS ANTIPSICÓTICOS Los beneficios de los antipsicóticos han extendido su uso en el manejo de otras patologías psiquiátricas, de alta incidencia en adultos, pero también en niños y adolescentes, como son el trastorno bipolar, el trastorno generalizado del desarrollo, el trastorno obsesivo compulsivo, los trastornos de conducta, los tics y los trastornos de la alimentación, donde junto con disminuir la sintomatología juegan un rol en la neuroprotección (1). Dados los avances descritos, el desafío que ahora introduce el uso de los fármacos antipsicóticos tiene que ver con las condiciones de morbimortalidad de estos pacientes y las alteraciones metabólicas que los psicofármacos pueden generar. En el caso de la esquizofrenia, se ha descrito una expectativa de vida reducida en 20% comparado con la población general. En esta mayor mortalidad destaca la evidencia de que 2/3 de la población que presenta esquizofrenia fallece por enfermedad coronaria, esto último asociado a un aumento de la prevalencia de patologías como obesidad, diabetes mellitus (DM) y dislipidemia (2,3). Más del 50% de los habitantes de los Estados Unidos de América tienen sobrepeso, esto ha aumentado al doble en los últimos 20 años (4), una situación muy similar sucede en México, donde en cerca del 25% de los casos de obesidad son relacionados con el uso de medicamentos (5). En el 2003 se realizó una encuesta diseñada para ser representativa de las comunidades más pobres del país y esta mostró que la prevalencia combinada para sobrepeso y obesidad era del 60% en mujeres y del 50% en hombres (6). El estimado del índice de masa corporal (IMC) en personas que padecen una enfermedad mental como por ejemplo esquizofrenia o trastorno bipolar es mayor que el de la población general, esto podría estar asociado al uso crónico de antipsicóticos (7). El efecto en el aumento de peso, aparentemente varía según el antipsicótico, esto se debe a su diverso perfil de acción en los sistemas de neurotransmisión serotoninérgico, histaminérgico, dopaminérgico (8). Diversas variables se han asociado con el aumento de peso secundario a antipsicóticos, como la genética, edad, duración del tratamiento, estimulación del apetito, el IMC inicial, un estilo de vida sedentario, descuido por la imagen corporal y menores recursos económicos; la identificación de estas podría ayudar a detectar factores de riesgo y así elucidar la patogénesis del sobrepeso (9). Dada la enorme prevalencia de las enfermedades cardiovasculares en la población general, las variables metabólicas asociadas, que pueden influir en el peor pronóstico de los pacientes psiquiátricos cobran un elevado interés. Basados en estos antecedentes, algunos países han hecho recomendaciones sobre su uso y las precauciones que se deben seguir en pacientes que van a recibir antipsicóticos, en especial en tratamientos prolongados (10-12). 4.1 Mecanismos del aumento de peso Los mecanismos neurobiológicos que regulan el consumo de energía pueden mediar sus efectos de forma central o periférica, la mayoría de los estudios existentes, describen que el aumento de peso mediado por los antipsicóticos se da por cambios en los neurocircuitos que participan en el consumo de alimentos. 4.1.1 Monoaminas El hipotálamo lateral en el sitio crítico para la regulación del peso, las acciones de las monoaminas a este nivel son el paradigma mas estudiado en el aumento de peso inducido por antipsicóticos, por ejemplo en estudios con ratas se ha demostrado que la infusión de monoaminas a este nivel provoca una disminución en el apetito, efecto que es revertido cuando se da una infusión de antipsicóticos típicos (13). También se ha hipotetizado que algunos agentes anorexigénicos como la sibutramina producen sus efectos a través de un incremento en la disponibilidad de serotonina y norepinefrina a ese mismo nivel del hipotálamo (14). Otras monoaminas como la dopamina han sido involucradas en la saciedad, ya que se ha visto que la amantadina contrarresta el efecto de la olanzapina en el aumento de peso (15). Sin embargo las evidencias apuntan más hacia la histamina y la serotonina (16-17). 4.1.2 Histamina Varios antipsicóticos pueden bloquear los receptores a histamina, especialmente el subtipo H1. La activación de receptores a histamina en el hipotálamo está asociado con los centros de la saciedad, es decir, su bloqueo fomenta la hiperfagia y un consecuente aumento de peso (16). El aumento de peso asociado al uso de antipsicóticos tiene correlación con su afinidad por el receptor H1 (18). Dentro de este grupo, la olanzapina es la que cuenta con la mayor afinidad para bloquear los receptores H1, seguida por la clozapina, la risperidona, clorpromazina, tioridazina, haloperidol, y sertindol. Wirshing y cols. demostraron una relación logarítmica entre la afinidad a los receptores H1 y la ganancia de peso (19). Esto podría explicar porque hay un riesgo reducido para el aumento de peso con otros antipsicóticos como el aripiprazol y la ziprasidona (20). La quetiapina es un análogo de la clozapina que tiene relativamente alta afinidad a los receptores de histamina lo cual puede fomentar el aumento de peso con su uso (21). 4.1.3 Serotonina La serotonina esta asociada con la cantidad y las características del alimento que es consumido. La activación de receptores de serotonina en el núcleo paraventricular reduce la ingesta de alimentos ricos en grasa pero con un mínimo efecto sobre la ingesta de proteínas y carbohidratos. La estimulación de los receptores de serotonina 5HT2C por medio de la fluramina es el mecanismo por el cual se induce la supresión del apetito (21). Los fármacos que bloquean el receptor 5HT2c incrementan el consumo de alimentos pero también se ha observado que fomentan resistencia a la insulina y desarrollo de intolerancia a la glucosa lo que sugiere que la serotonina también tiene efectos en la secreción de insulina por el páncreas actuando en los receptores de éste órgano y a través de el Sistema Nervioso Central (22). La clozapina y la olanzapina tienen una alta afinidad para los receptores de Serotonina 5HT2A y 5HT2C. La Risperidona tiene una notable afinidad por los receptores 5HT2A y HT2C21 4.1.4 Hormonas Se ha considerado principalmente a la prolactina, la cual podría promover el aumento de peso al disminuir la sensibilidad a la insulina o a través de una disrupción en el equilibrio entre andrógenos y estrógenos (23). 4.1.5 Neuropéptidos y citocinas La clozapina incrementa los niveles de algunas citocinas como el factor de necrosis tumoral alfa (TNF ) , la interleucina 2 y leptina, lo cual induce síndrome metabólico y aumento de peso. (24). La leptina actúa a nivel del hipotálamo regulando el gasto de energía, el eje neuroendocrino y el apetito, se postula que los antipsicóticos atípicos en especial la clozapina y la olanzapina producen una desensibilización en el sistema nervioso de la señal de la leptina (25). El aumento de leptina con quetiapina es modesto y mínimo con risperidona (26). 4.2 Aumento de peso con los antipsicóticos típicos o de primera generación El incremento del depósito de grasa subcutánea y abdominal (27), así como el aumento de peso se produce desde las primeras semanas del uso de estos medicamentos, siendo progresivo y mantenido en terapias a largo plazo, alcanzando en ciertos casos niveles de obesidad. Los hallazgos muestran que el efecto es mayor con algunos de estos medicamentos. Los que más se han asociado con esto son los de baja potencia, como la clorpromazina y la tioridazina, en comparación con lo de alta potencia como el haloperidol y la trifluoperazina, al parecer esto es debido a las propiedades particulares de los primeros para bloquear el receptor histaminèrgico (28). 4.2.1 Los efectos del aumento de peso: La resistencia a la insulina Las causas de la resistencia a la insulina podrían agruparse en las debidas a factores genéticos y obesidad (29). En pacientes con resistencia a la insulina relacionada a la obesidad el efecto antilipolítico de esta hormona esta disminuido (30). La secreción de insulina depende del volumen de grasa (31), su deficiencia y alteraciones en el receptor en ratones han mostrado una marcada obesidad así como hiperinsulinemia e hiperglicemia (32). Para resumir se podría concluir que como una respuesta fisiológica para equilibrar el incremento a la resistencia a la insulina para la homeostasis de los carbohidratos, se incrementa la secreción de la misma que favorece el aumento del peso corporal (33). 4.2.2 Alteraciones de la glucosa en pacientes tratados con antipsicóticos Este término se refiere a los estados interrelacionados: diabetes mellitus, intolerancia a la glucosa y glucosa en ayunas elevada. Dichas alteraciones fueron detectadas incluso antes de la era farmacológica (34) Ryan detectó elevación de la glicemia en 15% de pacientes con primer brote de esquizofrenia, previo al inicio de tratamiento farmacológico (35). Estas alteraciones se asociarían a un aumento de la grasa intrabdominal y a niveles elevados de insulina y cortisol. Estos hallazgos plantean que la esquizofrenia se acompaña de alteraciones metabólicas previas al uso de medicamentos, las que condicionarían un mayor riesgo de desarrollar DM. Desde la mitad de la década de los sesenta está reportado de forma consistente que la prevalencia de diabetes mellitus tipo 2 estaba significativamente elevada en los pacientes esquizofrénicos tratados con fenotiazinas (36,37). Desde 1994 se ha incrementado el número de casos reportados de diabetes mellitus tipo 2 durante la administración de antipsicóticos atípicos o de segunda generación (38,39). La frecuencia de diabetes mellitus 2 es significativamente mayor durante la administración de antipsicóticos de segunda generación, en especial clozapina y olanzapina comparado con los típicos o de primera generación (40). Los hallazgos en los estudios, son diversos, por ejemplo hay estudios que indican un riesgo relativo de padecer diabetes para clozapina, olanzapina y para risperidona (41,42). En la mayoría de los estudios se ha reportado hiperglicemia en pacientes esquizofrénicos que reciben antipsicóticos de primera generación (43,44). En un estudio publicado en 2001 se encontró que los niveles de glucosa eran mayores en pacientes tratados con olanzapina que en los que recibieron haloperidol (p=0.0001) o risperidona (p=0.06) (45), en otro se reporto que los pacientes tratados con olanzapina y clozapina tenían cifras de glucosa mayores que los esquizofrénicos tratados con otros antipsicóticos atípicos (46) y en un tercer estudio realizado con la prueba de tolerancia a glucosa se demostró que pacientes tratados con olanzapina y clozapina tenían cifras mayores de glucosa post-carga, que los tratados con risperidona y quetiapina (47). Sertindol, ziprasidona y aripiprazol parecen tener un efecto menor en el metabolismo de los carbohidratos, de hecho varios estudios han reportado una disminución en los niveles de glucosa después del cambio de clozapina y olanzapina a alguno de estos tres antipsicóticos (46,48,49). Tanto la clozapina como la olanzapina tienen un efecto directo sobre la secreción de insulina, lo cual no se ha demostrado con antipsicóticos típicos. La inducción de hiperinsulinemia e hiperlipidemias es probablemente dependiente de la concentración sérica de la clozapina y olanzapina, por lo cual puede observarse reversión de la diabetes en algunos pacientes tras descontinuar el tratamiento (26). También se han comunicado casos de hiperglicemia severa y cetoacidosis diabética en forma precoz y no explicada por alza en el peso, principalmente con olanzapina y clozapina (50), lo que ha permitido plantear un efecto directo de estos fármacos sobre la función de la célula beta pancreática. 4.2.3 Dislipidemia La aparición de hipertrigliceridemia e hipercolesterolemia se ha reportado desde la introducción de la fenotiazinas como la clorpromazina (51), sin embargo las butirofenonas como el haloperidol han demostrado un efecto neutral en los lípidos (52). De forma similar a lo observado en la glucosa, el efecto de los antipsicóticos atípicos en los niveles sanguíneos de lípidos parece ser negativo, ejemplificando esto tenemos algunos estudios que han mostrado niveles elevados de triglicéridos en pacientes tratados con clozapina que en pacientes tratados con otros antipsicóticos atípicos (53, 54, 55). También se ha demostrado un aumento significativo de los triglicéridos y el riesgo 5 veces mayor de dislipidemia en el tratamiento con olanzapina, de hecho se considera a este último con riesgo mayor que la risperidona (56,57). Recientes reportes, han señalado a la quetiapina como un medicamento que podría ocasionar hiperlipidemia en mayor proporción de lo reportado con otros atípicos como la risperidona, ziprasidona, aripiprazol (58). Se han reportado casos de aumento agudo de triglicéridos con el uso de clozapina y olanzapina considerándose a tales casos como una urgencia (58, 59). 4.2.4 El síndrome metabólico Particularmente los pacientes con esquizofrenia tienen una alta prevalencia del síndrome metabólico, mencionándose incluso cifras tan altas como el 37% (60). Varios estudios han demostrado que las alteraciones metabólicas están presentes incluso antes de iniciar el tratamiento farmacológico. A pesar de dichas evidencias, muchos autores creen que estas alteraciones podrían estar asociadas a el uso de antipsicóticos, en especial los de segunda generación o atípicos, en especial por que el aumento de peso, diabetes y cambios en el metabolismo de carbohidratos, así como alteraciones en el metabolismo de lípidos han sido reportados con el inicio del uso de estos fármacos, de hecho no todos los antipsicóticos tienen el mismo perfil de alteraciones metabólicas. Se ha encontrado evidencia que vincula inflamación crónica con insulinorresistencia y aumento del riesgo cardiovascular (61). Citokinas mediadoras de la respuesta inflamatorias están asociadas a insulinorresistencia, disfunción endotelial y enfermedad ateroesclerótica (62, 63, 64, 65). En este sentido es posible asociar la hipótesis que postula que la esquizofrenia correspondería a una patología mediada por un proceso inflamatorio (66, 67, 68). Parece razonable relacionar estos antecedentes planteando que los mediadores inflamatorios presentes en los pacientes esquizofrénicos estén vinculados a las alteraciones detectadas en el metabolismo de la glucosa y la sensibilidad a insulina (66). 5.- EFECTOS METABÓLICOS DE LOS ANTIDEPRESIVOS 5.1 Introducción El acelerado proceso de urbanización experimentado por los países iberoamericanos, junto con la adopción de los estilos de vida occidental generalizada en todas las clases sociales, dio origen a un aumento en la prevalencia de sobrepeso, obesidad, diabetes mellitus y síndrome metabólico en la población en general (1). Aunada a la obesidad, síndrome metabólico y dislipidemia, la diabetes mellitus causa el 46 % de las muertes registradas en nuestros países (2). Conocemos el impacto de estas patologías en la población general pero su presencia en la población que padece un trastorno mental o que esta siendo tratada con psicofármacos es poco conocida. Para dar un ejemplo, son escasos los estudios que analizan la relación entre depresión y el síndrome metabólico; Los trastornos crónicos como la esquizofrenia y el trastorno esquizoafectivo, y el trastorno bipolar son las patologías mejor estudiadas. No obstante hay algunos estudios donde se ha encontrado que el síndrome metabólico se presenta en el 52.9 % de las mujeres y el 40 % de los hombres que padecen depresión.(3) En el ámbito de la depresión, se ha encontrado una importante asociación entre el estrés crónico y alteraciones del eje hipotálamo-hipófisis- adrenal en la génesis de la obesidad visceral y de sus consecuencias: resistencia a la insulina, tolerancia anormal a la glucosa e hipertensión arterial. Este autor propone que los condicionantes psicosociales (ansiedad, depresión) son determinantes en la aparición del síndrome junto con otros factores ambientales y genéticos. (4) Otros estudios describen una relación recíproca entre depresión y síndrome metabólico: las mujeres con mayores índices de depresión, tensión y ansiedad aumentaron el riesgo de desarrollar síndrome metabólico (5). Kinder reportó que las mujeres jóvenes con historia de al menos un episodio depresivo tenían el doble de probabilidades de padecer síndrome metabólico en comparación con aquellas que no habían padecido depresión. La depresión en las mujeres esta mas asociada a la hipertensión arterial e hipertrigliceridemia, pero en los hombres dicha asociación fue débil sin alcanzar significancia estadística. El contenido de grasa intrabdominal fue el doble en las mujeres depresivas que en los controles sanos.(6) Esta información hace manifiesta la asociación existente entre la depresión y el síndrome metabólico. Sin embargo, no toma en consideración los efectos metabólicos de los medicamentos antidepresivos. El tratamiento de la depresión en los países iberoamericanos se ha centrado básicamente en el uso de inhibidores selectivos de la recaptura de serotonina, inhibidores mixtos de la recaptura de amina y en último lugar los antidepresivos tricíclicos. Existe suficiente evidencia científica de que el aumento de peso es un problema frecuente durante el tratamiento a corto y largo plazo de la depresión, además de ser una de las causas de incumplimiento terapéutico. En el presente capítulo analiza los efectos de la medicación antidepresiva sobre el aumento de peso, la diabetes mellitus y la hiperlipidemia. 5.2 Antidepresivos , aumento de peso y obesidad La mayoría de los fármacos antidepresivos se asocian a un incremento de peso, con variabilidad individual incluso entre los mismos grupos farmacológicos. Los antidepresivos pueden aumentar el apetito e inducir apetencia por los hidratos de carbono con conductas más gratificantes respecto a la alimentación, como síntomas de la mejora de la depresión. (7) En la tabla 1 se muestran los antidepresivos mas comúnmente asociados a cambios en el peso corporal. (8) Tabla1. Cambios en el peso asociados al uso de antidepresivos. Medicación Efecto sobre el peso Amitriptilina ++++ Imipramina +++ Notriptilina No claro Protriptilina No claro Timipramina No claro Desimipramina Sin cambios Fenelcina + Tranilcipromida Sin cambios Isocarboxacida - Mirtazapina +++ Citalopram No claro Fluoxetina No claro Sertralina No claro Trazodona No claro Fluvoxamina Desconocido Paroxetina Desconocido Venlafaxina Sin cambios Bupropion - Nefazadona - - pérdida; + pequeño aumento; + + +aumento moderado; + + + + gran aumento 5.2.1 Antidepresivos tricíclicos Los efectos de la amitriptilina sobre la masa corporal han sido ampliamente investigados. En dos estudios: uno en el que se incluyo 51 mujeres que tomaban amitriptilina se documentó el aumento de 4 kg. de peso en promedio. En el otro, el aumento promedio fue de 7 kg., y el 73 % de los participantes informaron de un incremento en el deseo por los dulces. La amitriptilina se asocia con un aumento de peso en muestras con una gama de pacientes que tienen desde bajo peso a obesidad. La imipramina se estudio en un ensayo sobre control de peso realizado durante 16 semanas en 52 personas con depresión. Se observó un aumento promedio de 2 kg., y el 15 % de los participantes en el estudio aumentaron más de 6 kg. de peso.(9) En un estudio prospectivo doble ciego, las personas que tomaron imipramina tendieron a un mayor deseo por comer pero no experimentaron ningún cambio en el peso. En otro estudio, se documentó que la mitad de los pacientes tratados con imipramina presentaron un cambio de peso de mas del 5% o menos, y solo el 13.3% experimentaron una ganancia de peso mayor al 10%. (10) La desimipramina ha mostrado tener menor influencia sobre el peso. En algunos estudios se ha reportado un discreto incremento en el peso de los respondedores al tratamiento con el medicamento (11), mientras que en otros estudios no se han reportado incrementos en el peso. (12) En el caso de la nortriptilina, se ha documentado que el incremento de peso es similar al que se obtiene durante el tratamiento con paroxetina.(13) En un ensayo de 30 semanas con nortriptilina, siete de los 29 participantes (24%) perdieron peso. Dieciséis de los participantes (55%) ganaron peso, pero el incremento se consideró clínicamente relevante para solo cinco de ellos. (14) 5.2.2 Inhibidores de la monoaminooxidasa (IMAOS) Los IMAOS tienen menor probabilidad de producir aumento de peso que los tricíclicos. La fenelcina tiene mayor probabilidad que la tranilcipromina de inducir aumento de peso como un efecto asociado a la mayor apetencia por los hidratos de carbono y la generación de edema. La pérdida de apetito y peso puede ocurrir con la isocarboxacida. El moclobemide se ha asociado a una disminución de peso del 0.6 kg. o a no producir cambio en el peso. (8) 5.2.3 Inhibidores selectivos de la recaptura de serotonina (ISRS) El uso de los ISRS se han asociado cambios mínimos en el peso y en la disminución del apetito, aunque existen diferencias entre los agente que componen este grupo. Un estudio realizado por Fava y cols(15), reportó que los pacientes tratados con paroxetina presentaron un incremento significativo de peso, y los pacientes tratados con fluoxetina y sertralina presentaron un incremento modesto y no significativo De hecho la fluoxetina y la sertralina, asociados a otros fármacos como la sibutramina o la metformina se han considerado como una terapia potencial para la obesidad. (16) Con la paroxetina respecto a las alteraciones en el peso existe controversia, dado que en diferentes estudios se ha visto que tiene un efecto similar a los antidepresivos tricíclicos al producir aumento de peso en los pacientes. El citalopram puede no producir cambios significativos sobre el índice de masa corporal. En un ensayo controlado con placebo en tratamiento a corto plazo, que incluían mas de 1000 pacientes, el citalopram se asoció con una pérdida de 0.5 kg. en comparación con los 0.2 kg. ganados en el grupo placebo. Durante los seis meses de tratamiento con citalopram, el aumento promedio de peso fue menor a un kilogramo, cerca del año de tratamiento, el incremento fue de 1.5 kg. en promedio. Otros ISRS como la fluvoxamina y el escitalopram no se han asociado a cambios de peso. (17) 5.2.4 Inhibidores de la recaptura de serotonina y norepinefrina: Los medicamentos de acción dual parecen estar relacionados en menor grado con la aparición de alteraciones metabólicas. En el caso de venlafaxina, se ha reportado incluso una asociación con una disminución del peso durante el tratamiento agudo de la depresión.(18) La duloxetina, no se ha relacionado con cambios significativos en el peso durante el tratamiento agudo cuando se le ha comparado con placebo, aunque en el tratamiento a largo plazo (52 semanas), se ha asociado a un discreto incremento de peso comparado con el placebo. (19) La información clínica relacionada con el efecto del milnacipran es aún escasa, aunque la evidencia en modelos animales y los reportes hasta el momento parecen ser similares a los documentados con lo que se ha reportado con los otros antidepresivos duales. 5.2.5 Otros antidepresivos La mirtazapina se ha asociado con un incremento del apetito y del peso. El mecanismo de este efecto no se conoce bien. Se ha informado de un aumento medio de alrededor de 2 kg. después de las seis semanas de tratamiento. Se ha demostrado una relación dosis dependiente entre mirtazapina y el incremento del apetito y del peso. La trazodona se estudió en 243 pacientes y se asocio con un aumento de peso de hasta 0.5 kg por estimulación del apetito. El Bupropion (anfebutamona) se ha asociado a una disminución de peso durante el tratamiento agudo, y este beneficio persiste durante la fase de continuación del tratamiento. La disminución de peso promedio se ha reportado de hasta 1.5 kg.(20) La reboxetina se ha asociado a un menor incremento de peso comparado a paroxetina. Existen estudios que han reportado un menor incremento de peso con la adición de reboxetina en pacientes tratados con antipsicóticos que aquellos en tratamiento solo con antipsicóticos. (21, 22) 5.3 Antidepresivos y diabetes mellitus Son pocos estudios que asocian el uso de antidepresivos con la Diabetes Mellitus, la revisión de la literatura científica gira en torno a los beneficios que se tienen con la prescripción de estos fármacos en las alteraciones metabólicas propias de la depresión. En un estudio abierto realizado por Derijks y cols.(23), se documentó que en pacientes con diagnóstico de diabetes mellitas a quienes se les inició un antidepresivo ISRS presentaron menores requerimientos de insulina a lo largo del seguimiento que los pacientes diabéticos que no utilizaron ISRS (2.8% vs. 18.3%). Estos datos contrastan con el estudio de seguimiento de 15 años donde se incluyeron 165,958 pacientes que tomaban antidepresivos en dosis moderadas o altas mas de 2 años, se presentaron 11,243 casos de diabetes, se observó un riesgo incrementado de 84% de padecer diabetes. El incremento del riesgo fue particularmente notable con los ISRS en especial la paroxetina y con los antidepresivos tricíclicos. La ganancia de peso explicaba en mucho la relación entre antidepresivos y diabetes mellitus. (24) 5.3.1 Mecanismo de acción Los mecanismos involucrados en las alteraciones metabólicas inducidas por los antidepresivos, aún son claros. Cada antidepresivo difiere en sus mecanismos de acción comparado con los otros grupos de los antidepresivos. Por ejemplo, los antidepresivos tricíclicos producen aumento de peso más a menudo que los inhibidores de la monoaminooxidasa. El mecanismo de acción y las alteraciones bioquímicas asociadas, cambios en niveles de la leptina y el factor de necrosis tumoral, están siendo investigados.(18, 25) Existe evidencia que apunta a que el factor de necrosis tumoral alfa es modificado durante el tratamiento con antidepresivos. Algunos autores lo han propuesto como un posible marcador sensible y específico (aún nivel experimental) del incremento de peso inducido por antidepresivos.(18) Los medicamentos tricíclicos, podrían considerarse como uno de los grupos de antidepresivos mas relacionados con un incremento de peso. Se ha propuesto que el incremento de peso pudiera estar relacionado a su actividad anticolinérgica. En parte, se ha relacionado como efectos como la sequedad de boca lleva a un consumo excesivo de bebidas de alto contenido calórico. Se ha informado de una apetencia por los dulces entre los pacientes que toman amitriptilina, nortriptilina e imipramina. El bloqueo de la noradrenalina, dopamina y serotonina en la terminación presináptica y las interacciones con los receptores muscarínicos, colinérgicos, alfa1-adrenérgicos e histamínicos caracterizan el perfil de efectos colaterales de los fármacos tricíclicos.(17) En experimentos con animales, se ha observado que la alteración de los receptores de serotonina influye en el comportamiento alimentario. La fluoxetina, actuando en el hipotálamo, produce saciedad y puede alterar el consumo de carbohidratos. Otro estudio limitado a poblaciones especiales como es el caso de las mujeres con síndrome climatérico y obesidad ha demostrado que el uso de fluoxetina modifica el patrón de adaptación metabólica durante el tratamiento para reducción de peso (5, (17). Las nuevas generaciones de antidepresivos se han asociado con cambios sobre el peso en distintas formas. (17) En el caso de milnacipran, se han reportado en modelos animales una supresión significativa de la ingesta alimenticia por efectos de la supresión del apetito. Mas aún, el milnacipran no se ha asociado a incrementos de glucosa y otros péptidos relacionados con el control del apetito. (26) A nivel molecular, el uso de mirtazapina se ha visto involucrado con alteraciones en los transportadores de glucosa (GLUT 4 Y GLUT 5). La disfunción en dichos receptores se ha asociado a alteraciones metabólicas. (27, 28) 5.4 Conclusiones Dado que la evidencia científica existente se centra en el aumento de peso con el uso de los antidepresivos, podemos hacer conjeturas del posible impacto sobre el metabolismo de la glucosa y por ende del aumento de la dislipidemia, sin embargo la medicina es una ciencia inexacta y nuestros procedimientos deben basarse en la evidencia científica disponible, por lo que en el campo de las complicaciones metabólicas de los antidepresivos la investigación deberá centrarse en: a) encontrar la relación del uso de antidepresivos e intolerancia a la glucosa-diabetes mellitus. b) establecer la asociación entre la hiperlipidemia-dislipidemia y el tratamiento farmacológico de la depresión. La investigación en este campo apenas inicia, y hay un nicho de oportunidades con el registro, y sistematización del monitoreo para la vigilancia de los cambios metabólicos atribuidos a los antidepresivos, que podrían conducirse en estudios de seguimiento a largo plazo (cohorte) que no implicarían grandes gastos para su desarrollo. Tabla 2.- Incremento de peso documentado con antidepresivos. Modificada de Wise (19) Medicamento Cambio en peso Medicamento Cambio en peso medicamento cambios (rango en kg) amitriptilina + 1.7 a +7.3 (rango en kg) en peso citalopram - 0.6 a -3.8 moclobemida -0.6 a 0 desimipramina - 1 a + 1.9 fluoxetina - 4.8 a 0 fenelcina + 6.8 doxepina + 1.2 a 2.7 fluvoxamina - 3.5 a + 0.1 tranilcipromina + 1.9 a 6.8 imipramina + 1.2 a 2.6 paroxetina -0.4 a + 5.1 trazodona - 1.2 a + 0.5 maprotilina 0 a + 1.8 sertralina -0.8 a + 0.6 venlafaxina -1a0 nortriptilina + 2.2 a 4.1 bupropion -0.7 a – 1.5 desvenlafaxina -0.4 a 0 mirtazapina + 1.5 a 2.9 duloxetina -0.5 a + 1.1 milnacipran pendiente 6.- EFECTOS METABÓLICOS DE LOS ESTABILIZADORES DEL ÁNIMO 6.1 Introducción El aumento de peso y otras alteraciones metabólicas se han asociado a esquizofrenia, trastorno bipolar y otros padecimientos mentales (1, 2). La aparición de alteraciones metabólicas puede ser un problema severo cuando se utilizan medicamentos psicotrópicos, por múltiples causas, como su contribución a la falta de apego al tratamiento por parte de los pacientes, lo que se traduce en un peor pronóstico y mayor número de hospitalizaciones (3). El aumento de peso también se asocia con una mayor prevalencia de comorbilidad médica como el síndrome metabólico, diabetes mellitus, dislipidemia, enfermedades cardiovasculares, alteraciones en vesícula biliar, y algunos tipos de cáncer (4). En el caso de los estabilizadores del estado del ánimo (EA) como son el litio, y anticonvulsivantes (valproato, carbamazepina y lamotrigina) estos deben de ser consideradas, ya que se han asociado con alteraciones metabólicas similares a las reportadas con medicamentos antipsicóticos y mayores a las reportadas con antidepresivos (5). En padecimientos como el trastorno bipolar donde el tratamiento con EA es necesario a largo plazo, las consecuencias de las alteraciones metabólicas se tornan de mayor relevancia. El objetivo de esta sección es revisar evidencia relevante de los efectos metabólicos de los estabilizadores del ánimo. 6.2. Litio El litio se ha usado clínicamente desde 1950 como un tratamiento antimaníaco y para la profilaxis de los episodios afectivos en el trastorno bipolar. Desde entonces, se ha utilizado como potenciador del tratamiento antipsicótico en la esquizofrenia y de los antidepresivos en trastornos de ansiedad y depresivo unipolar. Los pacientes que utilizan litio requieren de tomarlo a largo plazo, lo que hace indispensable conocer sus posibles efectos secundarios, entre los que destacan sus efectos metabólicos (6). 6.2.1. Incremento de peso Los pacientes con trastornos mentales como la esquizofrenia y el trastorno bipolar son más propensos al sobrepeso que la población general. Un número considerable de estudios han confirmado de forma inequívoca que el tratamiento crónico con litio se asocia con un incremento significativo en el peso. Keck y McElroy (7), analizaron cuatro estudios clínicos controlados y encontraron que tres reportaron un aumento de peso con el tratamiento con litio. La diferencia de aumento de peso entre los estudios realizados, fue de 5 kg en un periodo de 2 años en 11% de los pacientes participantes a 10 kg. en dos tercios de los participantes después de varios años de tratamiento. Llegándose a reportar hasta 30 kg. en casos individuales. La incidencia del aumento significativo de peso (>5% del peso inicial), es alta, se ha reportado hasta en un 62% de los pacientes en tratamiento con litio. En estudios realizados en población clínica generalmente se encuentra una incidencia más alta que en ensayos clínicos, reportando que el 64% de los pacientes en tratamiento con litio incrementaron más de 10 kg. de peso corporal (6). Un estudio doble ciego controlado con placebo para evaluar los efectos de litio en el aumento de peso, reportó un incremento de más de 4.5kg a dos años de tratamiento en el 61% de los pacientes, comparado con el 8% de aquellos tratados con placebo (8). Se ha encontrado que en pacientes tratados con litio la obesidad clínicamente relevante esta presente en 20 – 25% después de varios años de tratamiento. Esto es especialmente cierto para el incremento extremo de peso (>20 kg), que ocurre frecuentemente en mujeres. Los pacientes con un peso elevado pre- existente se encuentran en mayor riesgo de incrementar aún más de peso. Los resultados de los estudios, parecen poder explicarse por la comorbilidad con otros padecimientos, por el uso concurrente de otros medicamentos psicotrópicos y por periodos más largos de seguimiento (6). El incremento de peso parece ocurrir principalmente en los primeros dos años y posteriormente es menor a pesar de continuar con la ingesta de litio. Las mujeres, al parecer, se ven más afectadas que los hombres, no obstante estos datos no han sido consistentes en la literatura. Una menor edad al inicio del tratamiento, y la coadministración de antidepresivos parecen conferir un mayor riesgo de incremento de peso durante el tratamiento con litio. El aumento de peso coloca al individuo en un riesgo adicional de desarrollar hipertensión arterial, diabetes mellitus tipo 2, eventos vasculares cerebrales y otras enfermedades cardiovasculares. Es relevante considerar que la presencia de estos efectos adversos puede llevar al paciente a pérdida del apego a tratamiento y acarrear graves consecuencias (6). 6.2.2. Mecanismos del incremento de peso por litio A pesar de los numerosos estudios realizados, los mecanismos involucrados en el incremento de peso inducido por litio permanecen ocultos. Algunos mecanismos documentados que pudieran explicar el aumento de peso inducido por litio incluyen efectos parecidos a la insulina en el metabolismo de carbohidratos y grasas, generando una mayor absorción de glucosa en el tejido adiposo (9). Es posible también que el litio tenga un efecto sobre las señales hipotalámicas relacionadas con la estimulación del apetito. En un estudio realizado por Atmaca y cols. (10) se encontró que la leptina, una hormona producida por los adipocitos encargada de regular la ingesta de alimentos y balance energético, al proveer de información al hipotálamo sobre la cantidad de grasa corporal, pudiera estar implicada en el aumento de peso secundario a litio. Es pertinente recordar que durante el tratamiento con litio puede ocurrir la retención de líquidos y contribuir con el incremento de peso (11). Además, los pacientes llegan a presentar sed, y pueden llegar a saciarla por medio de la ingesta de bebidas de alto contenido calórico. Se han llegado a documentar cambios en la preferencia de alimentos llevando a la ingesta de exceso de energía en forma de sucrosa. eee La mayor frecuencia de obesidad en mujeres ha sugerido un papel de las hormonas reproductivas. En relación a este tema, se han llevado a cabo mediciones del efecto del litio sobre una variedad de hormonas, el único hallazgo significativo ha sido sobre el incremento en los niveles séricos de TSH (12). 6.2.3 Distiroidismo A pesar de que previamente se ha declarado que el hipotiroidismo clínicamente relevante no es más frecuente en pacientes tratados con litio, ahora se conoce bien que este tratamiento puede inhibir la liberación de hormona tiroidea e inducir bocio (13). Cuando se ha comparado a poblaciones de pacientes con el diagnóstico de trastorno bipolar en tratamiento con litio y aquellos libres de litio, se ha encontrado que los primeros tienen mayores índices de hipotiroidismo (6.3%-10.8% vs. 28.0%-32.1%) (14). Se ha reportado también que existe una mayor prevalencia de hipotiroidismo franco y subclínico en pacientes que toman litio. Las definiciones de hipotiroidismo que se han utilizado han sido basadas en criterios bioquímicos: Tiroxina libre anormalmente baja y hormona estimulante de tiroides (TSH) anormalmente elevada para hipotiroidismo, y TSH basal elevada con tiroxina libre normal para enfermedad subclínica (13). La prevalencia de hipotiroidismo ha variado del 8 al 19% de los pacientes en tratamiento con litio, comparado con la prevalencia de 0.5-1.8% de la población general. La prevalencia para hipotiroidismo subclínico en pacientes tratados con litio ha sido reportada del 23% contra el 10.4% en la población general (15). En un estudio retrospectivo realizado por Fagiolini y cols. (16), se encontró que el 36% de los pacientes con diagnóstico de trastorno bipolar tipo I que habían recibido litio para el tratamiento de mantenimiento desarrollaron niveles anormales de TSH y/o índice de tiroxina libre. Los pacientes con función tiroidea anormal pasaron más tiempo en la fase aguda de tratamiento, y obtuvieron puntajes más altos en la escala de Hamilton para depresión durante la fase de mantenimiento. El tiempo de uso de litio y el desarrollo de disfunción tiroidea correlacionaron positivamente. Kusalic y cols (17) reportaron en un estudio de seguimiento de pacientes en tratamiento con litio a largo plazo (n=101), que todos los pacientes que tuvieron el antecedente de un familiar en primer grado afectados por un padecimiento tiroideo desarrollaron un inicio acelerado del hipotiroidismo (3.7 años después del inicio del tratamiento con litio) comparado con aquellos que no contaban con ese antecedente familiar (8.6 años después del inicio del tratamiento con litio). Encontró también que las mujeres mayores de 60 años son más frecuentemente afectadas por hipotirodismo que las de menor edad. Consistente con lo anterior, en uno de los pocos y más recientes estudios prospectivos realizados, Kirov y cols. (18) reportó que el hipotiroidismo es más frecuente en mujeres que en hombres durante el tratamiento con litio (25.8% vs 8.7%) y se incrementa con la edad, ya que al llegar a los 65 años, el riesgo en mujeres incrementó a 50%. Se documentó que el 17% de las mujeres padecieron hipotiroidismo inducido por litio. El aumento de peso durante el primer año de tratamiento con litio se ha reportado como un predictor de hipotiroidismo inducido por litio (19). Otros factores de riesgo para el desarrollo de hipotiroidismo inducido por litio son; un incremento basal en TSH, altos niveles séricos de litio (20), preexistencia de autoanticuerpos (21, 22), los primeros dos años de tratamiento (solo en mujeres) (23), dieta deficiente en yodo (24), y ciclado rápido en trastorno bipolar (25). 6.2.3.1 Mecanismos de acción del litio sobre tiroides Se sabe que el litio se concentra en la glándula tiroides, donde interfiere en varios de los pasos necesarios para la producción de hormonas tiroideas. Inhibe la captación de yodo y se piensa que altera la estructura de la tiroglobulina, interfiere con el acoplamiento de los residuos de yodotirosina para formar yodotironina. También inhibe la secreción de hormonas tiroideas, un efecto que pudiera ser explicado por la interferencia en la polimerización de tubulina.(26, 27). También se considera que el litio tiene una influencia sobre las acciones periféricas de las hormonas tiroideas por medio de interferir con la conversión de T4 a la forma activa T3 de la hormona tiroidea (28). 6.3 Anticonvulsivantes El uso de los anticonvulsivantes dentro de la Psiquiatría se encuentra ampliamente difundido, siendo su principal uso en el Trastorno Afectivo Bipolar. El valproato, en todas sus formulaciones disponibles (valproato de sodio, valproato semi-sódico, ácido valproico, valproato de magnesio), la carbamazepina y la lamotrigina se encuentran incluidos como las opciones terapéuticas. Dichas sustancias son recomendadas en las guías de tratamiento farmacológico internacionales actuales y autorizadas por las distintas instancias de salud en diversos países, tanto para tratamiento agudo como para el de mantenimiento y el profiláctico. Este grupo de medicamentos tiene mecanismo de acción compartidos en el funcionamiento neurobiológico y algunos de ellos con mecanismos de acción específicos que pueden estar o no relacionados con sus efectos a nivel metabólico. Dentro de los efectos adversos que han generado una atención especial y recomendaciones de vigilancia con un “advertencia” por parte de la Federación de Drogas y Alimentos de Estados Unidos, con el valproato se debe vigilar los efectos sobre la función hepática, riesgo de teratogenicidad y contribución al desarrollo de pancreatitis. Mientras que con la carbamazepina la vigilancia debe dirigirse al desarrollo de discrasias sanguíneas, o alteraciones hematológicas. Con la lamotrigina el principal cuidado se ha relacionado con la presentación de reacciones alérgicas dermatológicas que puedan evolucionar a síndromes severos como el Stevens Jonson (29). 6.3.1. Carbamazepina La carbamazepina es un anticonvulsivo considerado como opción de tratamiento en algunos padecimientos neurológicos y mentales. Dentro de los efectos secundarios reportados por el uso de carbamazepina están el edema, hiponatremia, hipo osmolaridad e incremento de peso (causado por retención de líquidos). Aún así, se considera que la carbamazepina pudiera inducir incremento de peso por medio de depósito de grasa. El incremento de peso durante la administración de carbamazepina ha sido escasamente reportado; un estudio de 300 pacientes documentó un incremento de peso del 2% (30), del 9% en otro estudio de 480 pacientes (31), y 14% en un estudio de 300 sujetos. También se ha reportado obesidad en el 25% de los pacientes en tratamiento con carbamazepina. Existen reportes de casos donde cuatro pacientes desarrollaron un incremento abrupto en el apetito e ingesta de alimentos que resultó en una ganancia de 7 a 15 kg en un periodo de 2 meses, reversible sólo después de unos meses de haber descontinuado el tratamiento y cambiado por valproato de magnesio (32). Un estudio retrospectivo comparó el efecto sobre el peso de valproato y carbamazepina en el tratamiento de la epilepsia. En un estudio de 20 pacientes se encontró un máximo de incremento de peso, después de 3 a 189 meses de tratamiento continuo, un incremento de < 5% en 12 pacientes, 5-10% en 6, >10% en 3 sujetos en tratamiento con carbamazepina. Durante el tratamiento con valproato, se encontró que el incremento de peso de < 5% ocurrió en 20, del 5-10% en 17, y de >10% en 33 de 70 pacientes. Un estudio aleatorizado, doble ciego para investigar el efecto del tratamiento adyuvante de carbamazepina o tiagabina en pacientes con el diagnóstico de epilepsia que tomaban fenitoina, encontró que los pacientes asignados a tratamiento con carbamazepina tuvieron un incremento de 2.6 kg después de 16 semanas de tratamiento, pero aquellos en tratamiento con tiagabina perdieron 0.88 kg. (33). En un estudio realizado por Vieweg y cols.(34), se evaluó a pacientes hospitalizados que incrementaron su peso anormalmente en tratamiento con antipsicóticos y carbamazepina o litio. Se encontró que los antipsicóticos, pero no el litio o lacarbamazepina, contribuyeron con el incremento de peso. Corman y cols. (35) encontraron que cerca de la mitad de los pacientes tratados con carbamazepina incrementaron su peso, lo que contrasta con un estudio abierto realizado en trastorno bipolar donde no se documentó un incremento significativo de peso durante un periodo de 6 meses de tratamiento (36). Un estudio realizado por Coxhead y cols. (37), examinó el cambio de peso a lo largo de 12 meses en pacientes en tratamiento con litio o que fueron cambiados a tratamiento con carbamazepina. Los autores reportaron un incremento en el peso de 4 kg. en los pacientes en tratamiento con litio y una perdida de 3.1 kg. en los pacientes tratados con carbamazepina. Hasta el momento se considera que el incremento de peso inducido por carbamazepina, al menos en trastorno bipolar es improbable. En un estudio controlado doble ciego realizado en pacientes con trastorno bipolar vírgenes a tratamiento, se documentó que los pacientes que recibieron carbamazepina presentaron mayor incremento de apetito que los tratados con litio (33% vs. 17% respectivamente), pero el peso no fue evaluado (38). 6.3.1.1 Mecanismos del incremento de peso por carbamazepina Se han discutido posibles mecanismos para explicar el incremento de peso inducido por carbamazepina tales como la estimulación del apetito, retención de líquidos, cambios en el perfil de lípidos y producción de edema. Se ha comprobado que no ocurre hiperglicemia con el uso del medicamento (39). 6.4. Valproato Los efectos terapéuticos del valproato se relacionan con su acción sobre los sistemas de monoaminas y con la señalización intracelular. Un ejemplo es el efecto sobre el ciclo de los fosfoinositoles, a través de la inhibición de la proteina cinasa C y la inhibición de la enzima glicógeno sintetasa 3-B. Se ha demostrado de igual forma que el valproato disminuye la síntesis de dopamina durante el episodio agudo de manía con un incremento compensatorio de la densidad del receptor D2 (40,41). El valproato disminuye la liberación de glutamato, el neurotransmisor excitatorio principal, así como tiene acciones sobre el receptor de glutamato NMDA. El valproato potencia los efectos del neurotransmisor inhibitorio GABA al incrementar su síntesis e inhibir su metabolismo. Así mismo el Valproato disminuye la descarboxilasa de histidina, un regulador negativo de la expresión genética, lo que puede explicar parcialmente su efecto sobre el aumento de la síntesis de GABA y su efecto teratogénico. El perfil de efectos adversos del valproato difiere del resto de los anticonvulsivantes. En la Tabla no 1 se resumen los principales efectos secundarios relacionados con el valproato. Tabla 3 Efectos secundarios comunes del valproato Sistema Efectos Secundarios Gastrointestinal Nausea, diarrea, irritación gástrica, disfunción hepática, pancreatitis Hematológico Anemia, Leucopenia, Trombocitopenia Neurológico Ataxia, confusión, síntomas extrapiramidales, tremor, sedación Reproductivo Síndrome de Ovario Poliquístico, teratogénesis con defectos del cierre de tubo neural, exposición intrauterina con disminución de coeficiente intelectual. Diversos Letargia, edema periférico, rash, Síndrome de Stevens Johnson, perdida de cabello, aumento de peso. † Modificada de Peter M Haddad , Amlan Das, Muhammad Ashfaq & Angelika Wieck A review of valproate in psychiatric practice. Expert Opin. Drug Metab. Toxicol. 200; 5(5):539-551. Los efectos adversos más frecuentes asociados con el Valproato son los síntomas gastrointestinales, la sedación y el tremor. Estos efectos normalmente son leves y se incrementan con dosis altas (42). También se puede presentar elevación de transaminasas hepáticas y de la enzima deshidrogenasa láctica, al principio del tratamiento. Normalmente dichos efectos secundarios son leves y no requieren más que vigilancia, la hepatotoxicidad severa tiene una incidencia de 1 en 20,000 (43, 44). Dentro de otros efectos secundarios, se encuentran la trombocitopenia, leucopenia, anemia macrocitica que pueden tener un curso variable, de forma transitoria, recurrente o persistente. La mayoría de ellos son reversibles al disminuir la dosis de valproato (45). 6.4.1. Incremento de peso por valproato El incremento de peso con valproato es común. En un ensayo clínico controlado a 47 semanas, el 17.9% de los pacientes con valproato presentó un incremento de por lo menos 7% de su peso basal. No obstante, en el análisis estadístico (Last Observation Carried forward), se pudo haber subestimado la ganancia de peso. Así mismo en estudios que compararon el aumento de peso con el uso de valproato solo vs la combinación de valproato con algún antipsicótico de segunda generación, se observó que el incremento de peso es mayor cuando se da el tratamiento de forma combinada (46, 47). 6.4.2. Mecanismos del incremento de peso por valproato Dentro de los mecanismos para el incremento de peso se ha descrito la probable correlación con los elevados niveles de ácidos grasos libres (AGL) Al realizar la comparación entre sujetos tratados con valproato y sujetos obesos sin valproato, los niveles de estos AGL son similares en ambos grupos, sin embargo los pacientes obesos presentaron la tendencia a tener niveles más elevados de los AGL, lo que puede estar en relación con la disponibilidad incrementada de los mismos y que pueda existir una competencia entre los AGL con el Valproato en la unión a la albumina, lo que conlleve a un incremento en la secreción de insulina que a su vez pudiera generar el incremento en el apetito y resultar por lo tanto en el aumento de peso reportado con el valproato (48). 6.4.3. Efectos Metabólicos por valproato Resulta incierto hasta la actualidad si es que el valproato puede ocasionar efectos adversos asociados con el Síndrome Metabólico. En dos estudios se observó de forma más común la presencia de resistencia a la insulina y/o dislipidemias en pacientes con epilepsia tratados con valproato que con otros anticonvulsivantes (49, 50). Sin embargo en estudios realizados comparando antipsicóticos de segunda generación vs. valproato no han logrado demostrar evidencia alguna de problemas metabólicos y aumento de peso. (46). 6.4.4. Mecanismos de los efectos metabólicos por valproato Aunque la ganancia de peso es un efecto secundario común del tratamiento con valproato, originalmente ésta se relacionó con la presencia de hiperinsulinemia y síndrome de ovario poliquístico en mujeres con epilepsia, sin embargo los niveles elevados de insulina se han reportado también en sujetos sanos que participan en protocolos consumiendo valproato. Fue recientemente reportado que el valproato puede inhibir el metabolismo de la insulina en el hígado, lo que puede resultar en incremento de las concentraciones séricas de insulina en la circulación periférica (51). Sin embargo se ha sugerido también que el valproato puede inducir la secreción de insulina directamente desde las células beta del páncreas. No obstante, esta secreción podría ser independiente del aumento de peso. Se ha llegado a considerar que el aumento de la secreción de insulina puede preceder el incremento de peso y a su vez este incremento puede generar la obesidad abdominal y la llamada dislipidemia aterogénica, que consiste en la disminución de lipoproteínas de alta densidad, la elevación de la presión sanguínea y la resistencia a la insulina con o sin intolerancia a la glucosa. Esto se ha presentado principalmente en mujeres con obesidad y epilepsia tratadas con valproato (52,53). En un estudio realizado con el objetivo de evaluar si la hiperinsulinemia asociada al valproato se relacionaba con otros cambios metabólicos y con el aumento de peso, con otros efectos adversos del valproato y con el síndrome metabólico, se analizaron 50% de sujetos con monoterapia con valproato y 45% de sujetos controles sanos. Se encontró que los pacientes tratados con valproato tenían niveles de insulina circulante más elevados en relación con el índice de masa corporal, niveles de ácido úrico y triglicéridos más elevados y menores concentraciones de lipoproteínas de alta densidad. No se encontró diferencia significativa en la frecuencia de síndrome metabólico entre los sujetos tratados con valproato vs. el grupo control. Se concluyó que los niveles elevados de insulina no son una consecuencia de la obesidad. Esta hiperinsulinemia si se relacionó con cambios desfavorables en perfil de lípidos, hiperuricemia y tremor. Dentro de los mecanismos que se proponen como subyacentes para la hiperinsulinemia asociada al valproato se menciona el que el valproato puede inducir la producción de insulina por las células beta resultando en niveles de insulina más elevados. Por otro lado el valproato puede interferir en el metabolismo hepático de la insulina lo que puede generar concentraciones séricas de insulina elevadas que favorezca el incremento de peso (52). Otras teorías implican que los niveles más altos de ácido úrico han sido reportados con el uso de valproato en comparación con otros medicamentos inductores hepáticos (54). En general la hiperuricemia ocurre frecuentemente en sujetos con obesidad, resistencia a la insulina o dislipidemia debido a que la insulina estimula la reabsorción de sodio y ácido úrico en los túbulos proximales (55). Remarcando que el papel del ácido úrico como un mediador de la hipertensión y de la enfermedad renal es incierto, se le han atribuido efectos antioxidantes pero por otro lado, se ha demostrado que la alteración que ocasiona en el funcionamiento endotelial puede predecir el futuro desarrollo de hipertensión (56,57, 58). Se ha descrito también, la asociación de una actividad simpática incrementada en pacientes tratados con valproato que se manifiesta en forma de tremor, que es uno de los efectos secundarios más comunes (59) y que se asocia con niveles más elevados de insulina sérica en comparación con las personas tratadas con valproato que no experimentan tremor (60), sugiriendo que el tremor puede ser debido al incremento de la actividad simpática por la elevación sérica de insulina (61) que también es un factor de riesgo conocido para el incremento de la presión arterial (62). 6.5 Alteraciones endocrinas probablemente involucradas por el uso de anticonvulsivantes 6.5.1. Osteoporosis El uso crónico de algunos anticonvulsivantes ha sido asociado con la disminución de la densidad mineral ósea, esto puede incrementar el riesgo de osteopenia, osteoporosis y fracturas, particularmente en aquellos con una deficiencia en la ingesta diaria de vitamina D o falta de exposición al sol, aunque se desconoce el mecanismo fisiopatológico de este evento adverso (63). 6.5.2. Síndrome de Ovario Poliquìstico La asociación de valproato con Síndrome de Ovario Poliquístico ha generado controversia. Las descripciones se han realizado principalmente en mujeres con trastorno bipolar, quienes tienen un riesgo mayor para el desarrollo de dicho síndrome y que parece verse incrementado por el uso de valproato. En un estudio retrospectivo de mujeres con trastorno bipolar el incremento de la incidencia de Síndrome de Ovario Poliquístico con valproato fue significativamente mayor (10.5% vs 1.4%) vs. otros medicamentos, e incluso algunos casos en donde se retiró el valproato reportaron resolución del síndrome. (64,65) Ante esta posibilidad las guías de tratamiento NICE han recomendado el evitar utilizar valproato para mujeres con trastorno bipolar menores de 18 años (66). Dentro de las alteraciones endocrinas se han descrito niveles elevados de hormona estimulante de tiroides (TSH) en aquellos sujetos tratados con valproato, aunque esta información ha sido controversial, se considera que la obesidad generada por el valproato puede interferir en la secreción, metabolismo y retroalimentación de la misma hormona a través de sus propiedades gabaérgicas al igual que en la población general que presenta obesidad y se observa una elevación de esta hormona (67,68). 6.6 Gabapentina Aunque el uso de la gabapentina como estabilizador del ánimo es controversial, la mayoría de la evidencia científica reporta resultados negativos y de falta de eficacia como agente antimaníaco, su uso sigue siendo difundido como tratamiento coadyuvante para la epilepsia. Se ha reportado que hasta el 25% de los pacientes incrementan mas del 10% de su peso comparado con el peso inicial (69, 70). Un estudio realizado por Wang (71) en pacientes con trastorno bipolar reporto un incremento de peso promedio de 0.9 a 3 kg de peso. 6.7. Lamotrigina La lamotrigina es un medicamento altamente utilizado en el manejo de la depresión bipolar, utilizado como agente profiláctico en la prevención de la recurrencia de los episodios depresivos. La lamotrigina es bien tolerada en general y no se ha asociado con incremento de peso, se le ha descrito como un medicamento sin efectos secundarios sobre el peso. En un estudio aleatorizado a 18 meses en que se compara lamotrigina vs litio vs placebo se reportó el siguiente incremento de peso (lamotrigina 2.2 kg, litio 4.2 kg, placebo 1.2 kg.), la incidencia de un incremento por arriba del 7% en el índice de masa corporal fue del 7% con lamotrigina, 10% con litio y 6% con placebo (72). En otro estudio que se comparó lamotrigina vs placebo en pacientes bipolares cicladores rápidos no se observaron cambios en el peso en el grupo de lamotrigina (73). Se ha reportado incluso pérdida de peso en comparación con litio en el trastorno bipolar I (74). 6.8 Vigabatrina Este medicamento esta diseñado para incrementar el nivel del acido gamaaminobutirico (GABA) en el cerebro. Indicado tanto en el manejo de la epilepsia y recientemente esta siendo estudiado su uso dentro del TB. La ganancia de peso con este medicamento ha sido un hallazgo consistente en los ensayos clínicos preliminares (75,76). En una comparación realizada con carbamazepina se noto igual tolerancia pero mayor incremento de peso con la vigabatrina. (11% vs 5% de incremento vigabatrina vs. carbamazepina) (77). Se ha reportado incremento de hasta 3.7 kg de peso (78). 6.9. Topiramato Aunque en la actualidad el Topiramato no esta indicado dentro de los algoritmos de manejo del trastorno bipolar, es uno de los anticonvulsivantes que se sigue utilizando en otras enfermedades dentro del área de la psiquiatría. Se ha reportado una pérdida de peso del 16 al 20.5% del peso inicial (79). La pérdida de peso se ha reportado en general de 3 a 8 kg. Y se ha descrito como un efecto dosis dependiente en donde a mayor dosis del topiramato, mayor pérdida de peso (80). El topiramato puede ser uno de los agentes útiles en la promoción de la pérdida de peso aunque no exista una indicación oficial del topiramato para los trastornos mentales. Tabla 4.- Incremento de peso reportado con estabilizadores del ánimo (81) Medicamento Cambio en el peso ( rango en kg) Carbamazepina -3.7 a + 4.5 Valproato +1.2 a + 5.8 Lamotrigina -2.5 a + 1.1 Vigabatrina + 3.7 Topiramato -8.9 a -1.1 Gabapentina +0.9 a + 3.3 Litio + 0.7 a + 11. 5 7.- PSIQUIATRÍA Y SÍNDROME METABÓLICO La obesidad, la diabetes, la mortalidad cardiovascular y el síndrome metabólico relacionadas con trastornos mentales severos (TMS) principalmente esquizofrenia y trastorno bipolar, se conocen, al menos parcialmente, desde hace más de trescientos años. Thomas Willis (16211675), médico y neuroanatomista que trabajó en Oxford, Inglaterra, adelantado a su tiempo, describió dos hechos fundamentales: 1) que los pacientes con trastorno mental severo y su descendencia tienen un mayor riesgo de desarrollar diabetes mellitus y 2) que la diabetes se favorece con hábitos alimentarios inadecuados y consumo excesivo de alcohol. El debate sobre el síndrome metabólico en psiquiatría se ha centrado en la existencia o no de efectos de clase de antipsicóticos típicos y atípicos y de los niveles de riesgo que implican los diferentes antipsicóticos, antidepresivos y estabilizadores del ánimo en las modificaciones de peso y la probabilidad particular de cada fármaco de aumentar el riesgo de síndrome metabólico. Se requiere, evitar tratar de sobresimplificar un asunto muy complejo; no puede afirmarse que el uso como primera opción de algunos fármacos en el tratamiento de los trastornos mentales severos resuelva el problema, o que por sí mismo evite la necesidad de realizar exámenes de monitoreo metabólico. Regresando a los principios básicos promovidos por Willis, quien además consolidó el origen cerebral de la Histeria y la importancia de la corteza en la cognición humana, el psiquiatra, a nuestro entender, debe asumir su papel de médico de cuidados primarios del paciente y promover un estilo de vida saludable en base a sus conocimientos de la conducta humana y de las intervenciones que son efectivas para cambiarla. Es muy significativo, como ejemplo, que la mitad del consumo total de cigarrillos en Estados Unidos se atribuya a los pacientes con trastornos psiquiátricos severos (que representan una cifra cercana al 5% de la población). Sin embargo, poco se habla y se publica, en nuestro medio, del manejo de las adicciones en esta población vulnerable. Por otra parte, sigue siendo sumamente baja la proporción de pacientes a los que se les realiza en forma sistemática cálculo del IMC, glucosa en ayunas, perfil de lípidos y medición de la cintura. Por último, una vez que son identificados los riesgos, sólo algunos pacientes son referidos a especialistas de medicina interna o endocrinología, pero la mayor parte de ellos no reciben las intervenciones necesarias para corregir los riesgos. Una de las estrategias frecuentemente usadas en psiquiatría (se calcula que en el 85% de los casos) es recurrir al cambio de medicamentos, es decir, suspender un medicamento al que se le atribuye el incremento de peso o las modificaciones de la glucosa por otro que probablemente no las produzca. Esta práctica tiene el riesgo de reducir la efectividad del tratamiento psicofarmacológico, que para muchos autores constituye el tema central de la seguridad farmacológica (se ha reportado hasta 40% de recaídas en pacientes con cambio de antipsicóticos). El médico psiquiatra tiene la capacidad de hacer las intervenciones en el estilo de vida que pueden abatir el costo en el consumo de medicamentos antihipertensivos, hipoglucemiantes, hipolipemiantes, entre otros. Se ha demostrado que los cambios en los patrones de alimentación y actividad física en pacientes con TMS son efectivos y es posible implementarlos en diversos escenarios clínicos. Las intervenciones dirigidas al personal de salud, familiares y pacientes debe ser motivo de estudio en nuestro medio. 7.1 EL VÍNCULO ENTRE EL SÍNDROME METABÓLICO Y LA PSIQUIATRÍA Es bien conocido que, de acuerdo a la Encuesta Nacional de Salud y Nutrición 2006 (1), aproximadamente el 70% de los mexicanos adultos presentan algún grado de obesidad (incluyendo al sobrepeso), por lo que es prioritario tomar en cuenta esta condición en los pacientes psiquiátricos que acuden a tratamiento. En una evaluación ponderal de una muestra consecutiva de 703 pacientes que acudieron a consulta por primera ocasión en el INPRF en 2008, el 66.8% presentaron sobrepeso u obesidad (datos preliminares no publicados aún). Tomando en cuenta estos datos, es indispensable que el médico psiquiatra evalúe las condiciones ponderales y metabólicas de sus pacientes y, en su caso, hacer el diagnóstico de Síndrome Metabólico (SM), particularmente en aquellos trastornos mentales que requieren manejo psicofarmacológico. La relación entre la obesidad y los trastornos mentales ha sido observada desde hace varios años. Se sabe por ejemplo que el estrés patológico, fenómeno ubicuo en la psicopatología, presenta efectos endocrino-metabólicos. El eje hipotálamo-hipófisis-adrenal (HHA) y el sistema simpático modulan los efectos del estrés percibido a través del sistema nervioso central (SNC) en los órganos periféricos. En esta perspectiva, los incrementos crónicos del cortisol, de las catecolaminas y de la interleucina-6 predisponen al individuo para el desarrollo de la obesidad central (visceral), característica primordial del síndrome metabólico, además de aumentar su susceptibilidad para la hipertensión arterial, la ateroesclerosis, la osteoporosis y la disfunción inmunológica, teniendo como consecuencia el incremento en la morbilidad y la mortalidad cardiovascular. Por otro lado, cada una de las alteraciones hormonales referidas puede, en teoría, estar asociada a una hipersensibilidad específica a los receptores de glucocorticoides de la amígdala o del sistema mesocorticolímbico a nivel del SNC, del sistema cardiovascular, del tejido óseo, del sistema inmune o del tejido adiposo. Existen algunas similitudes entre el estrés patológico y el síndrome depresivo de tipo melancólico. Ambas entidades presentan un aumento en la secreción de catecolaminas y del cortisol, con las alteraciones descritas anteriormente. En el mismo sentido, el antecedente personal de depresión de tipo melancólico se ha asociado con osteoporosis en mujeres premenopáusicas. Se han reportado también incrementos en la presión arterial y en el índice de masa corporal, en una población de varones de edad madura sin síndrome de Cushing, en correlación con el grado de percepción del estrés y con la secreción de cortisol relacionada con el estrés. Desde hace algunos años se ha planteado que la depresión está asociada con el desarrollo de enfermedades cardiovasculares y con la mortalidad en general. Un estudio transversal reportó que un grupo de mujeres con el antecedente de episodio depresivo mayor duplicó su riesgo de cursar con el SM en comparación con aquellas sin dicho antecedente. También se ha observado la asociación de la depresión con marcadores hemostáticos e inflamatorios alterados, tales como elevaciones en la agregación plaquetaria y en la concentración de fibrinógeno, de manera que también, a través de estos procesos, esta entidad psiquiátrica puede estar ligada a las enfermedades cardiovasculares y coronarias. En sentido inverso, cuando se ha calculado el riesgo de presentar ansiedad o depresión en relación al perímetro abdominal de sujetos adultos, un estudio comunitario arrojó un aumento del riesgo para ansiedad de 27% para mujeres y 32% para hombres, y para depresión 51% y 41% respectivamente. Se ha propuesto que la susceptibilidad al estrés y a las alteraciones en la regulación neuroendócrina tiene una predisposición genética importante, lo cual contribuye a la variabilidad y susceptibilidad de los sujetos a los efectos deletéreos que estas pueden causar en su funcionamiento metabólico. Finalmente, las alteraciones crónicas en la regulación simpática y neuroendocrina pueden predisponer a los cambios metabólicos y antropométricos característicos del SM. 8.- ASPECTOS METABÓLICOS CEREBRALES DE LAS CONDUCTAS ALIMENTARIAS RELACIONADAS CON LA OBESIDAD La definición actual de sobrepeso u obesidad requiere de un IMC ≥ a 25 para el primero y ≥ a 30 para la segunda. Si bien la obesidad puede ser entendida como el producto de un desbalance entre la ingestión calórica de un individuo y su nivel de consumo energético, es necesario tomar en cuenta que también influyen factores biológicos como la vulnerabilidad genética de un individuo, factores individuales como un estilo de vida excluyente de la actividad física cotidiana y factores medioambientales como la oferta y la demanda de productos alimenticios con una exagerada concentración calórica. De acuerdo a lo anterior, aunque la obesidad no está clasificada como un trastorno mental, se han descrito alteraciones conductuales que se han asociado a su vez con la obesidad a través de la ingestión calórica no-homeostática elevada y crónica, el Trastorno por Atracón y el Síndrome Nocturno del Comer. En el primero existe la presencia de ingestiones de una gran cantidad de alimentos (superior a lo que un individuo de las mismas características demográficas consumiría en circunstancias similares), realizadas cuando menos dos veces por semana durante un periodo mínimo de seis meses, con pérdida del control y sin conductas compensatorias como vómitos autoinducidos, abuso de laxantes y abuso de diuréticos de acuerdo a los criterios diagnósticos del DSM IV-TR. El segundo se caracteriza porque la mayor parte de la ingestión energética de una persona se lleva a cabo durante las noches, interrumpiendo incluso su periodo de dormir. Es necesario saber que ambas alteraciones conductuales pueden presentarse en personas sin obesidad ni sobrepeso. Por otro lado, se ha documentado que el tratamiento del Trastorno por Atracón puede detener el aumento de peso, aunque también se ha reportado que este no necesariamente disminuye de manera clínicamente significativa el sobrepeso o la obesidad del paciente. De hecho, existen estudios farmacológicos en los que se han probado diferentes medicamentos buscando el control del Trastorno por Atracón (v.g. sibutramina, topiramato), los cuales han arrojado datos favorables en cuanto a la disminución significativa del número de atracones por semana o de días/atracón, sin embargo la disminución ponderal lograda en el periodo de los estudios, generalmente breve, no ha sido destacada. La relación que existe entre la obesidad y el abuso de sustancias ha sido extensamente explorada en estudios de neuroimagen cerebral. Se ha reportado que en sujetos obesos existe una correlación inversamente proporcional entre la disponibilidad de receptores a dopamina y el IMC en el cuerpo estriado. Un interesante y reciente estudio reportó una correlación inversamente proporcional entre la respuesta del estriado dorsal y el IMC en sujetos obesos que portaban el alelo A1 del polimorfismo TaqIA vinculado al gen del receptor a dopamina 2 (DRD2) en sujetos obesos. Estos y otros hallazgos han dado pie a la teoría de que existe un funcionamiento dopaminérgico disminuido en las regiones cerebrales relacionadas con la recompensa a los alimentos (i.e. el estriado dorsal), y que, mediante la ingestión exagerada de alimentos, estos sujetos buscarían compensar esta deficiencia, lo cual a su vez, los predispondría a la obesidad. En este sentido, la evidencia hasta ahora le ha dado sustento a la idea de que la ingestión excesiva de alimentos y el abuso de sustancias están relacionados a través de que ambos fenómenos comparten, desde el punto de vista neuroanatómico y de neurotransmisión, la vía mesolímbica dopaminérgica relacionada tanto con la búsqueda como con la sensibilidad a la recompensa. 9.- MANEJO FARMACOLÓGICO Y NUTRICIONAL DE LOS TRASTORNOS METABÓLICOS EN EL PACIENTE PSIQUIÁTRICO 9.1 Manejo Farmacológico En realidad, el manejo farmacológico depende del tipo de paciente, de su comorbilidad metabólica de base y del desarrollo de complicaciones de ésta índole a lo largo de su tratamiento. Nosotros somos partidarios del manejo preventivo mediante la evaluación basal de los parámetros anteriormente descritos con un enfoque psicoeducativo acerca del tipo de trastorno psiquiátrico en cuestión, información acerca del estilo de vida saludable vs. el nosaludable, el cual debe contemplar aspectos tanto alimentarios como de actividad física. Si a pesar de dichas tácticas preventivas se observa un incremento del IMC > a 30, y/o un incremento del ICC > 1 en hombres o > 0.8 en mujeres se recomienda revisar el tratamiento psicofarmacológico. Los estudios que han considerado el manejo farmacológico adjunto del incremento ponderal en pacientes que toman antipsicóticos (sobretodo de segunda generación), que han incluido a la sibutramina, el topiramato, la metformina, nizatidina, amantadina, reboxetina, han mostrado cierta eficacia en prevenir o revertir en algún grado el aumento ponderal; no obstante pocos estudios han sido aleatorizados y controlados con placebo, además de ser a corto plazo. En el caso de la metformina, la nizatidina y la sibutramina, los resultados han sido contradictorios. Aunque la tolerabilidad de los pacientes a estos fármacos es adecuada, los clínicos pueden utilizar esta alternativa de acuerdo al perfil individualizado de tolerabilidad así como los antecedentes familiares y personales de sobrepeso u obesidad y de alteraciones metabólicas en cada paciente. 9.1.1 Orlistat Es una sustancia que disminuye la absorción de grasa en el intestino. Ha sido probada en pacientes que reciben una variedad de psicofármacos, incluyendo la clozapina. La duración del tratamiento en estos estudios es de 3 a 12 semanas. La pérdida ponderal fue moderada, en un estudio la disminución promedio de de -2.3 ± 5.2 kg/m2. Los efectos adversos de este medicamento son flatulencia, manchado de ropa, urgencia fecal, e incluso incontinencia. 9.1.2. Nizatadina, Ranitidina y Famotidina Son antagonistas de los receptores H2, que disminuyen el hambre probablemente mediante cambios en la secreción gástrica o la interacción con el receptor H1. Datos solo preliminares. 9.1.3. Topiramato Es un antiepiléptico utilizado en el tratamiento del trastorno bipolar, la migraña y el dolor neuropático. Disminuye el hambre mediante la inhibición glutamaérgica. Dos estudios controlados con placebo mostraron resultados prometedores. 9.1.4. Reboxetina Es un antidepresivo inhibidor selectivo de la recaptura de noradrenalina. Se han publicado resultados prometedores en estudios bien diseñados, dos de ellos en pacientes con olanzapina, además de que su potencial antidepresivo y su perfil farmacocinético lo hacen una sustancia a considerar. 9.1.5. Metformina Es una biguanida, que actúa disminuyendo la absorción de glucosa a nivel intestinal, reduce el apetito, disminuye la liberación hepática de glucosa, mejora la sensibilidad de los tejidos a la insulina y no produce hipoglucemia. La metformina ha demostrado en el UKPDS (Estudio longitudinal de Diabetes del Reino Unido) su capacidad para reducir la morbilidad y mortalidad cardiovascular en pacientes con diabetes tipo 2 cuando se compararon por diez años contra dieta. En las guías clínicas internacionales aparece como la primera opción terapéutica en pacientes con diabetes y obesidad. Es un fármaco de bajo costo y cuya prescripción es relativamente sencilla y segura. Es uno de los fármacos más subutilizados y probablemente el secreto mejor guardado del síndrome metabólico en psiquiatría. 9.1.6 Sibutramina Inhibidor de recaptura de serotonina y noradrenalina, que actúa promoviendo la saciedad. No se recomienda en pacientes que toman antidepresivos inhibidores de recaptura de serotonina, o antidepresivos duales, ya que puede provocar síndrome serotoninérgico. En el paciente con enfermedad mental severa puede precipitar, trastornos de ansiedad, aumento en la impulsividad, estados de hipomanía o manía. 10.- MANEJO NUTRICIONAL DE LOS TRASTORNOS METABÓLICOS Y CARDIOVASCULARES EN EL PACIENTE PSIQUIÁTRICO 10.1 Trastornos Metabólicos 10.1.2. Diabetes Mellitus tipo 2 Si bien no todos los obesos son diabéticos, ni todos los diabéticos obesos, la obesidad y la diabetes tipo 2 se asocian independientemente con la insulinorresistencia. Se ha intentado buscar una correlación entre el grado de obesidad, su distribución y la prevalencia de diabetes tipo 2, pero los resultados han sido muy discordantes (1). Se piensa que el depósito de grasa en determinadas regiones tiene efectos más peligrosos que en otras y en ese sentido la grasa peritoneal constituye un área mórbida del cuerpo y el acumulo en esta zona tiene las mayores implicaciones metabólicas y sobre la sensibilidad insulínica. La distribución de la grasa central o visceral, aún sin aumento de peso corporal, se asocia con el Síndrome Metabólico (ídem). El tratamiento dietético constituye un elemento prioritario en el tratamiento de la diabetes, junto con la realización controlada de ejercicio (ídem) En el tratamiento nutricio para este tipo de pacientes, la dieta debe aportar todos los nutrientes esenciales y es necesario individualizar el plan de alimentación de acuerdo a su sexo, nivel socioeconómico, actividad física y costumbres alimentarias (ídem). 10.1.2.1 Recomendaciones dietéticas La nutrición se distribuirá a lo largo del día en 5-6 tomas diarias, los controles glucémicos y otras medidas de control metabólico ayudará al ajuste del tratamiento dietético. La Academia Americana de Pediatría, la Academia Americana Canadiense de Diabetes y la Academia Americana de Dietética recomiendan la siguiente distribución del total de las calorías recomendadas (1): Tabla 5. Distribución Calórica Carbohidratos 50-60% de la energía total Preferible alimentos ricos en fibra soluble y con bajo índice glucémico 25-30% de grasas consumo Ácidos grasos saturados <10% Ácidos grasos poliinsaturados <10% Colesterol <300mg/d Proteínas 12-15% de proteínas Fibra 30-40g/d de fibra o 25g por cada 1000kcal Vitaminas y Minerales Semejante a la población general Grasas Fuente: Hernández R. M., Sastre G. A. Tratado de Nutrición. Capítulo 61. Diabetes Mellitus tipo 2. 1999. La modificación de los estilos de vida es la piedra angular en la prevención y tratamiento de la diabetes mellitus en pacientes obesos, siendo la reducción de peso el que mejor pronostica el desarrollo de la enfermedad. Esta estrategia puede reducir hasta en un 58% el riesgo relativo de desarrollar diabetes mellitus tipo 2 en pacientes obesos con intolerancia a la glucosa, siendo necesaria tan sólo una pérdida de 3 a 4 kilos para ello (2). 10.1.3. Enfermedad Cardiovascular La dieta es uno de los factores ambientales mejor establecidos y puede constituirse en un importante factor de riesgo para el desarrollo de la aterosclerosis ya que es el principal factor exógeno que influye sobre la cantidad y composición de los lípidos y las lipoproteínas que circulan en la sangre (3). Se ha demostrado que las dietas hipercalóricas se acompañan de elevación de la trigliceridemia y colesterolemia ya que estimulan la producción hepática de las partículas VLDL y triglicéridos apoB (3). El tratamiento dietético de todas las formas de dislipidemias deberá tomar en consideración el balance calórico. Reducir el exceso de peso corporal es la medida más eficaz para corregir la hipertrigliceridemia, además de elevar las lipoproteínas de alta densidad (3). 10.1.3.1 Recomendaciones dietéticas Las grasas son un importante factor dietético regulador del metabolismo lipídico. El efecto de la grasa dietética sobre el colesterol sanguíneo dependerá de los efectos parciales de los ácidos grasos saturados, poliinsaturados y monoinsaturados (3). Tabla 6 . Distribución de calorías Carbohidratos 50-60% Proteína 10-20% Fibra 30-40g/día Grasas < 35% de la ingesta calórica total Ácidos grasos saturados ≤10%, en hipercolesterolemias graves <7% Ácidos grasos poliinstaurados 10% Ácidos grasos monoinsaturados 15% Alcohol 25-30g/día Fuente: Hernández R. M, Sastre G. A. Tratado de Nutrición. Capítulo 67. Dieta, lípidos y ateroesclerosis.1999. Se ha observado que el enriquecimiento de la dieta con antioxidantes naturales (frutas y verduras) puede proteger a los ácidos grasos poliinsaturados de la oxidación. Las recomendaciones dietéticas generales son: 1. Reducción del sobrepeso a través de una reducción en la ingesta calórica y actividad física. 2. Disminución de la ingesta de grasa al 30% de la energía total. 3. Reducción del colesterol en la alimentación <300mg/día. 4. Consumo de carbohidratos complejos y alimentos ricos en fibras, como cereales, leguminosas, frutas y verduras. 5. Consumo moderado de alcohol. Se debe explicar al paciente que los medicamentos prescritos o algunas características de la enfermedad, como la ansiedad, pueden ocasionar que el apetito aumente y haya preferencia especialmente por carbohidratos simples, pero que el medicamento o la patología psiquiátrica no son los que ocasionan directamente el aumento de peso, sino que están fuera de un balance entre la ingesta y el gasto energético. En general, los medicamentos antipsicóticos que bloquean los receptores de histamina, serotonina y dopamina tienden a asociarse con ganancia ponderal, así como los antidepresivos tricíclicos que tienen efectos sobre el metabolismo basal y la temogénesis de los alimentos (4). El paciente debe desear un cambio de hábitos, entender que es necesaria una modificación en el estilo de vida y que dicha modificación requiere esfuerzo y constancia. En el tratamiento nutricio se recomienda utilizar aspectos de un modelo cognitivo-conductual (5) en el que se emplean las siguientes estrategias: 1. Controlar el estímulo: que el paciente intente identificar qué desencadena la pérdida del control con la alimentación y busque en la medida de sus posibilidades distractores que le ayuden a manejarlo. 2. Técnicas cognitivas: éstas están orientadas a manejar los pensamientos negativos que aparecen tanto en el desarrollo como en el manejo de la obesidad. 3. Incremento y potenciación de hábitos de ejercicio. En este aspecto se debe considerar el estado físico del paciente y hacer énfasis en que el ejercicio se incremente en tiempo e intensidad de manera paulatina y se realice de 4 a 6 veces por semana para obtener beneficios. 4. Aspectos educacionales acerca de la obesidad: a) Se le debe brindar información al paciente sobre la etiología de la enfermedad y explicar que aunque el factor genético no es modificable, los factores ambientales son modificables o al menos moldeables. b) Hablar sobre la relativa ineficacia a largo plazo de las dietas muy restrictivas o que omiten grupos de alimentos, que son percibidas como esfuerzos transitorios y al volver a los patrones de alimentación habituales se recupera al menos todo el peso perdido, el llamado “rebote”. c) El riesgo de la restricción alimentaria intensa puede favorecer el desarrollo de atracones. d) Las consecuencias de la obesidad en aspectos de morbi-mortalidad. Insistir que el acompañar la pérdida de peso con el ejercicio moderado disminuye el riesgo de diabetes o enfermedad cardiovascular (5). Por último, es importante hacer énfasis en el tratamiento interdisciplinario del paciente psiquiátrico, debido a que la mayoría de los medicamentos y las características mismas de la enfermedad favorecen el sobreconsumo, la intervención del nutriólogo se recomienda paralela a la del psiquiatra y no esperar a que el paciente presente problemas con el control de peso para solicitar la intervención nutricional. 11.- CONCLUSIONES Y RECOMENDACIONES ¿PSIQUIATRA O ENDOCRINÓLOGO? El incremento paralelo de la frecuencia de obesidad y síndrome metabólico es un fenómeno mundial, ocupando México ya el segundo lugar en número de población obesa; ambas son entidades complejas y heterogéneas con un fuerte contenido genético, cuya expresión esta influida por factores ambientales, sociales, culturales y económicos, a los cuales debemos sumar otros como lo es el caso de uso de psicofármacos en población psiquiatrita, razòn por la que los médicos psiquiatras deben de estar particularmente alertas a las alteraciones metabólicas, aún si no constituyen la queja inicial del paciente. En este sentido, la prevención debería de ser decisiva, pues para evitar un aumento de peso, las intervenciones dirigidas al tipo de alimentación en lo particular y al cambio en el estilo de vida en lo general deberían iniciarse paralelamente al inicio del tratamiento, tomando en cuenta que la mayoría de los pacientes con enfermedad mental severa tienen acceso limitado a una atención médica integral, lo que implica menor oportunidad para la detección del riesgo cardiovascular que la esperada para la población no psiquiátrica (1 -4). Puesto que no hay consenso acerca de quién debe asumir la responsabilidad de cubrir esas necesidades de atención médica de los pacientes psiquiátricos se tiene como resultado una ineficacia persistente para ofrecerles un servicio asistencial apropiado, ya que los psiquiatras se enfocan en la eficacia del tratamiento de la psicopatología (5). Antes de iniciar el tratamiento debe de realizarse una evaluación de los factores de riesgo cardiometabólico y efectuar su seguimiento, para lo cual una herramienta sencilla es la medición del perímetro de la cintura conjuntamente con una glicemia en ayunas (100% de sensibilidad) (6). Las intervenciones sobre el estilo de vida, hábitos dietéticos, incremento de la actividad física y la suspensión del tabaquismo son las medidas de primera elección para disminuir el riesgo de enfermedad cardiovascular en personas con síndrome metabólico (7). Una disminución del 10% en las concentraciones de colesterol produce una disminución del 30% en dicho riesgo; una disminución de la tensión arterial del 4-6% lo disminuye un 15%; la suspensión del tabaquismo una disminución del 50-70% en su prevalencia; el mantener un índice de masa corporal por debajo de 25 lo disminuye de un 35-55% (7). La actividad física (20 minutos de marcha vigorosa al día) también produce una disminución del riesgo del 35 al 55% (7), debido a que previene y trata la hipertensión arterial (8, 9), la obesidad (10), las alteraciones de la curva de tolerancia a la glucosa y la diabetes (11), así como la dislipidemia (12). Estos datos también son aplicables a las personas con trastornos mentales severos y si bien no se dispone de ningún estudio que confirme que los efectos favorables a corto plazo de las intervenciones en el estilo de vida produzcan un cambio a largo plazo (13, 14) son un componente importante de los programas multidisciplinarios en los pacientes a quienes se prescriben psicofármacos, debiendo adaptar la actividad física a las experiencias previas de los pacientes, su actitud hacia la misma, sus preferencias personales y sus objetivos. En los últimos años diversos grupos (15-22) han establecido directrices para la detección y seguimiento de los factores de riesgo que nos ocupan, sin que estas se hayan vuelto cotidianas en la práctica clínica de forma sistemática (23, 24). Hoy día se está elaborando una actualización europea al respecto (25, 26), y es de esperar que en este 2009 se publique una actualización del documento de consenso de la ADA/APA del año 2004 (14). De tal manera, este Consenso pretende normar criterios y proponer lineamientos aplicables a nuestra población, esperando contribuir a que en nuestro país nos acerquemos a esa meta, recomendando entonces que si un paciente presenta alteraciones metabólicas después de comenzar el tratamiento psicofarmacológico, se debe considerar su cambio por uno que muestre menor asociación con esas alteraciones, así como instaurar el tratamiento apropiado para disminuir la tensión arterial, la hiperglicemia y la hiperlipidemia, en colaboración, si es posible, con el médico familiar o general del paciente, o del especialista cuando así se considere. 12.- ANEXOS 12.1 PROPUESTA DE MANEJO INTEGRAL DE LAS ALTERACIONES METABÓLICAS 12.2 MODELOS PARA EL MANEJO DE LAS ALTERACIONES METABÓLICAS • • • • • • • PSIQUIATRA INTERNISTA ENDOCRINÓLOGO COMPARTIDO GUÍAS DE TRATAMIENTO PACIENTES REQUIEREN ESTAR BIEN INFORMADOS MÉDICOS REQUIEREN ESTAR BIEN INFORMADOS TABLA 12.3.1 . Evaluación y seguimiento de los parámetros metabólicos y cardiovasculares. Basal Semana 4 Semana 8 Semana 12 Trimestral Anual IMC X X X X X Circunferencia Abdominal X X X X X Presión Arterial X X X X X Glucosa en ayunas X X X Lípidos en ayunas X X X BASADA EN: 1. GUIDELINES FOR THE USE OF ATYPICAL ANTIPSYCHOTICS IN ADULTS. Department of Public Health Community Behavioral Health Sciences. Community Health Network of San Francisco, San Francisco General Hospital. 2. ADA Screening Guidelines for Patients on Second-Generation Antipsychotics. 3. Antipsychotic Drug Guidelines. Western Australian Psychotropic Drugs Comitte Version 3 August 2006. TABLA 12.3.2 Evaluación y seguimiento de los parámetros metabólicos y cardiovasculares. BASAL EKG SEGUIMIENTO Depende de los factores de riesgo. Prolongación segmento QTc. Cada 3-6 meses. Para pacientes diagnosticados con diabetes, Glucosa sérica en ayunas. la hemoglobina glucosilada (HbAIc) debe ser medida cada 3-6 meses para monitorizar el control glicémico. BHC Presión arterial Urea y Electrolitos PFH IMC Índice Cintura-Cadera Cada 3-6 meses. Si el conteo de neutrofilos es < 1.5 x 109/L el tratamiento debe detenerse y consultar a hematólogo. Frecuente durante la titulación de la dosis. Cada 6 meses si hay factores para arritmia cardiaca (c/Ca++ y Mg++). Depende de la presencia de signos y síntomas hepáticos o de resultados basales. Cada 3 meses. Revisar tratamiento si IMC > 30 kg/m2 Cada 3 meses. Revisar tratamiento si el ICC > 1 en hombres o > 0.8 en mujeres. Antipsychotic Drug Guidelines. Western Australian Psychotropic Drugs Comitte Version 3 August 2006. TABLA 12.3.3 Evaluación y seguimiento de los parámetros metabólicos cardiovasculares. Basal Semana 4 Semana 8 Semana 12 Historia Familiar X IMC X Circunferencia Abdominal Presión Arterial Cada 3 meses Anual X X X X X X X X X X Glucosa en ayunas X X X Lípidos en ayunas X X X ADA Screening Guidelines for Patients on Second-Generation Antipsychotics. 1. ADA. Diabetes Care. 2004;27(2):596-601. 2. ADA. Diabetes Care. 2007;30(suppl 1):S4-S41. 3. Adult Treatment Panel. JAMA. 2001;285(19):2486-2497. y TABLA 12.4. Formato para el seguimiento del Síndrome Metabólico. Considerar Síndrome Metabólico si están presentes tres o más criterios. MEDICION CRITERIOS DE RIESGO BASAL __/__/__ __/__/__ __/__/__ __/__/__ __/__/__ Mujeres Circunferencia > 80 cm. Abdominal Hombres > 90 cm. Triglicéridos ≥150 mg/dL Mujeres < 50 mg/dL Colesterol HDL Hombres < 40 mg/dL Presión Arterial≥ 130/85 mmHg Glucosa en ayunas ≥ 100 mg/dL Modificado de: http://www.cqaimh.org/stable/pdf/tool_metabolic.pdf 12.5 ALGORITMO DE TRATAMIENTO POR ETAPAS DEL SÍNDROME METABÓLICO Paciente portador de marcadores tempranos del síndrome metabólico Paciente con sospecha de síndrome metabólico Intolerancia a la glucosa Intolerancia a la glucosa No Sí Inicie cambios en el estilo de vida, alimentación saludable y ejercicio. Valoración anual Inicie cambios en el estilo de vida, alimentación saludable y ejercicio. Inicie tratamiento farmacológico* - Acarbosa - Metformina - Sibutramina - Orlistat Revalore la eficacia del tratamiento a los seis meses. Ajuste la dosis o cambie de fármaco. * De acuerdo a valoración individual. Elaboro: Dr. Octavio Escobedo Islas Evaluación clínica integral Presencia de uno o más factores de riesgo cardiovascular o de diabetes (componentes clínicos). Hipertensión arterial: >140/90 mm Hg Obesidad central: Índice cintura cadera (ICC) Dislipidemia: (triglicèridos ≥ 200 mg/dL). Acantosis nigricans Poliquistosis ovàrica Hiperuricemia Hiperinsulinemia Sospecha síndrome metabólico, alto riesgo cardiovascular y de diabetes. Sí No Continúe con el tratamiento farmacológico de los factores de riesgo asociados (componentes clínicos) Pacien - Inicie acuerdo - Contro síndrom - Evite aument - Inicie - Tratam - Bajar - Ejerci - Diabe de resis en la se - Inhibi - Bigua - Sulfon - Secret - Insulin Tratami - Cambios en el estilo de vida, alimenta - Hipertensiòn arterial. - IECA, calcioantagonistas. - Bloqueadores de receptores AT IL. - Dislipidemias: estatinas, fibratos.. - Obesidad: sibutramina, orlistat. - Hiperuricemia: alopurinol. Síndrome metabólico Escrutinio en personas familiares de diabetes Presencia de uno o más factores de Sedentarismo Tabaquismo Multiparidad o menopausia Triglicéridos en ayuno: > 1 Hiperinsulinemia Tensión arterial normal alta Edad > 45 años ò < 45 añ Marcadores: Sobrepeso. Indìce cintura cedera. Elaboro: Dr. Octavio Escobedo I. 13.- REFERENCIAS BIBLIOGRAFICAS 1.- INTRODUCCION 1. Brown S. Excess mortality of schizophrenia. A meta-analysis. Br J Psychiatry 1997; 171:5028. 2. Brown S, Inskip H, Barraclough B. Causes of the excess mortality of schizophrenia. Br J Psychiatry 2000; 177:212-7. 3. Capasso RM, Lineberry TW, Bostwick JM et al. Mortality in schizophrenia and schizoaffective disorder: an Olmsted County, Minnesota cohort: 1950-2005. Schizophr Res 2008; 98:287-94. 4. Arney CP, Jones L, Woolfson RF. Medical comorbidity in women and men with schizophrenia: a population-based controlled study. J Gen Intern Med 2006; 21:1133-7. 5. Colton CW, Manderscheid RW. Congruencies in increased mortality rates, years of potential life lost, and causes of death among 20 World Psychiatry (Ed Esp) 7:1 2009 public mental health clients in eight states. Prev Chronic Dis 2006; 3:A42. 6. De Hert M, Mckenzie K, Peuskens J. Risk factors for suicide in young people suffering from schizophrenia: a long term followup study. Schizophr Res 2001; 47:127-34. 7. Fleischhacker W, Cetkovich-Bakmas M, De Hert M et al. Comorbid somatic illnesses in patients with severe mental disorders: clinical, policy, and research challenges. J Clin Psychiatry 2008; 69:514-9. 8. Hennekens CH, Hennekens AR, Hollar D et al. Schizophrenia and increased risks of cardiovascular disease. Am Heart J 2005; 150:1115-21. 9. Joukamaa M, Heliovaara M, Knekt P. Mental disorders and causespecific mortality. Br J Psychiatry 2001; 179:498-502. 10. Lawrence DM, Holman CD, Jablensky AV et al. Death rate from ischaemic heart disease in Western Australian psychiatric patients 1980-1998. Br J Psychiatry 2003; 182:31-6. 11. Ösby U, Correia N, Brandt L et al. Mortality and causes of death in schizophrenia in Stockholm county, Sweden. Schizophr Res 2000; 45:21-8. 12. Ösby U, Correia N, Brandt L et al. Time trends in schizophrenia mortality in Stockholm County, Sweden: cohort study. BMJ 2000; 321:483-4. 13. Saha S, Chant D, Mcgrath J. A systematic review of mortality in schizophrenia: is the differential mortality gap worsening over time? Arch Gen Psychiatry 2007; 64:1123-31. 14 Newcomer JW. Second-generation (atypical) antipsychotics and metabolic effects: a comprehensive literature review. CNS Drugs 2005; 19:1-93. 15. Cradock-O’Leary J, Young AS, Yano EM et al. Use of general medical services by VA patients with psychiatric disorders. Psychiatr Serv 2002; 53:874-8. 16. Druss BG, Bradford WD, Rosenheck RA et al. Quality of medical care and excess mortality in older patients with mental disorders. Arch Gen Psychiatry 2001; 58:565-72. 17.- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). Journal of the American Medical Association. 2001; 285: 2486-97. 18 De Hert M, Kalnicka D, van Winkel R et al. Treatment with rosuvastatin for severe dyslipidemia in patients with schizophrenia and schizoaffective disorder. J Clin Psychiatry 2006;67: 1889-96. 19Hanssens L, De Hert M, van Winkel R et al. Pharmacological treatment of severe dyslipidaemia in patients with schizophrenia. Int J Clin Psychopharnacol 2007; 22:43-9. 2.- ASPECTOS GENÉTICOS DEL SÍNDROME METABÓLICO Y LA OBESIDAD IMPLICADOS EN LOS TRASTORNOS MENTALES 1.- O’Brien P, Dixon J. Weight loss and late complications-the international experience. Am J. Surg 2002; 184:42S-45S. 2.- Triano RP y KM Flegal. Overweight children and adolescents: description, epidemiology, and demographics. Pediatrics 1998;101:497-504. 3.- Floddmark CE, Bissau I, Moreno LA, Pietrobelli A & Widhalm K New insights into the field of children and adolescents´ obesity: the European perspective. International Journal of Obesity and related Metabolic Disorders 2004; 28:1189-1196. 4.- Calle EE, Thun MJ, Petrelli JM, Rodriguez C, Heath CW JR. Body-mass index and mortality in a prospective cohort of US adult. N Engl J Med 1999; 341:1097-105. 5.- M. Barbany y M. Foz (2002). Obesidad: concepto, clasificación y diagnóstico. Anales Sis San Navarra 2002; 25(Suppl): 7-16. 6.- Gerken T et al., Science 2007 7.- Perusse L, Bouchard C. Gene-diet interactions in obesity. Am J Clin Nutr 2000; 72(Suppl):1285S-1290S. 8.- Snyder EE y Bouchard C. The human obesity gene map: the 2004 update. Obes. Res. 2005; 13:381-490. 9.- Yanovsk SZ, Nelson JE, Dubbert BK, Spitzer RL: Association of binge eating disorder and psychiatry comorbidity in obese subjects. Am J Psychiatry 1993; 150:1472-1479. 10.- Mitchel J. Specker S., de Zwaan M., Comorbidity and medical complications of bulimia nervosa. Journal of Clinicla Psychiatry 1991; 52:13-20. 11.- Striegel-Moore RH, Leslie D, Petrill SA, Garvin V, Rosenheck RA. One-year use and cost of inpatient and outpatient services among female and male patients with an eating disorder: Evidence from a national database of health insurance claims. International Journal of Eating Disorders 2000; 27:381-389. 12.- Wise RA. Role of brain dopamine in food reward and reinforcement. Philosophical Transactions of the Royal Society, Series B: Biological Sciences 2006;361:1149–1158. 13.- Grace AA. The tonic/phasic model of dopamine system regulation and its implications for understanding alcohol and psychostimulant craving. Addiction 2000; 95(supp 2):s119–128. 14.- Berridge KC. Food reward: Brain substrates of wanting and liking. Neuroscience and Biobehavioral Reviews 1996; 20:1–25. 15.- Schwartz M.: Nature, 2000; 404(6778):661-671. 16.- Figlewicz, D. Endocrine regulation of neurotransmitter transporters. Epilepsy Res. 1999; 37:203-210. 17.- Sacchetti P, Brownschidle LA, Granneman JG, Bannon MJ. Characterization of the 5'flanking region of the human dopamine transporter gene. Brain Res Mol Brain Res. 1999; 74(12):167-74. 18.- Hillemacher T., Frieling H., Hartl T., Wilhelm J., Kornhuber J., Bleich S. Promoter specific methylation of the dopamine transporter gene is altered in alcohol dependence and associated with craving. J of Psychiatric Research, 2008. 19.- Abdolmaleky HM, Smith CL, Zhou JR, Thiagalingam S. Epigenetic alterations of the dopaminergic system in major psychiatric disorders. Methods Mol Biol. 2008; 448:187-212. 20.- Lucki, I. The spectrum of behaviors influenced by serotonin. Biol Psychiatry 1998; 44:15162. 21.- Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature 1994; 372:425-432. 22.- Raffin-Sanson M.L., de Keyzer Y. and Bertanga X. Proopiomelanocortin, a polypeptide precursor with multiple functions: from physiology to pathological conditions. Europ J of End 2003; 149 79-90. 23.- Fraga MF, Ballestar E, Paz MF, Ropero S, Setien F, Ballestar ML, Heine-Suner D, Cigudosa JC, Urioste M, Benitez J, Boix-Chornet M, Sanchez-Aguilera A, Ling C, Carlsson E, Poulsen P, Vaag A, Stephan Z, Spector TD, Wu YZ, Plass C, Esteller M Epigenetic differences arise during the lifetime of monozygotic twins. Proc Natl Acad Sci USA 2005; 102:10604– 10609. 24.- Wong AH, Gottesman II, Petronis A Phenotypic differences in genetically identical organisms: the epigenetic perspective. Hum Mol Genet 2005; 14:R11–R18. 25.- Camarena B, Rubinskis E, Santiago H, Montiel F,Cruz C, González-Barranco J, Nicolini H. 5HTT serotonin receptor molecular genotypes in obese females with impulsivity. Molecular Psychiatry. 2002: 7(8): 829-830. 26.- Camarena B, Rubinskis E, Cruz C, Gónzalez-Barranco J, Nicolini H. Family-based association study between MAO-A gene and obesity: implications for psychopharmacogenetic studies. Neuropsychobiology 2004; 49(3):126-129. 27.- Zhao G, Ford ES, Dhingra S, Li C, Strine TW, Mokdad AH. Depression and anxiety among US adults: associations with body mass index. Int J Obes. 2009; 33(2): 257-266. 3.- CONCEPTOS GENERALES SINDROME METABOLICO 1. Sacks F, et al. Metabolic Syndrome: Epidemiology and consequences Journal of clinical Psychiatry 2004; 65 (suppl 18):3 -12. 2. Haffner S, et al. Prospective analysis of the insulin-resistance syndrome (syndrome X). Diabetes 1992; 41: 715-722. 3. Reaven GM. Syndrome X: review. Blood Pressure 1992; 4(Suppl.):13-6. 4. Alberti KGMM, Zimmet P, Shaw J. Metabolic syndrome – a new world-wide definition. A consensus statement from the International Diabetes Federation. Diabetic Med 2006; 23:46980. 5. Expert Panel on Detection and Evaluation of Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation and treatment of high blood cholesterol in adults (Adult Treatment Panel III). Journal of the American Medical Association 2001; 285:2486-97. 6. Grundy SM, Cleeman JI, Daniels SR et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/ National Heart, Lung, and Blood Institute Scientific Statement. Circulation 2005; 112:2735-52. 7. International Diabetes Federation. The IDF consensus worldwide definition of the metabolic syndrome. Brussels: International Diabetes Federation, 2005. 8. Sarafidis PA, Nilsson PM. The metabolic syndrome: a glance at its history. J Hypertension 2006; 24:621-6. 9. Byrne CD, Wild SH. The global burden of the metabolic syndrome and its consequences for diabetes and cardiovascular disease. In: Byrne CD, Wild SH (eds). The metabolic syndrome. West Sussex: Wiley, 2005:1-42. 10. World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications, pt 1: Diagnosis and classification of diabetes mellitus. Geneva, Switzerland: World Health Organization; 1999: 1-59. 11. Gale E. The myth of the metabolic syndrome. Diabetologica 2005; 48:679-83. 12. Kahn R, Buse J, Ferrannini E et al. The metabolic syndrome: time for a critical appraisal. Joint statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2005; 28:2289-304. 13. Newcomer JW. Antipsychotic medications: metabolic and cardiovascular risk. J Clin Psychiatry 2007; 68(Suppl. 4):8-13. 14. Newcomer J. Metabolic syndrome and mental Illness. Am J Manag Care 2007; 13:170- 77. 15. Rosen J, Wirshing D. Diabetes and the metabolic syndrome in mental health. Philadelphia: Lippincott, 2008. 4.- LOS EFECTOS SECUNDARIOS DE TIPO METABÓLICO DE LOS ANTIPSICÓTICOS 1. Ramón de la Fuente Muñiz. Libro Homenaje México, UNAM, 2005. 2. Bertolote J, Gorry MC. Early intervention and recovery for young people with early psychosis: Consensus statement. B J Psychiatry 2005; 187 (Suppl 33): 53-9. 3. Alvarado R, Erazo C, Poblete C. ¿Es factible y útil la detección precoz como estrategia de salud pública para el primer episodio de psicosis? Rev Chil Salud Pública 2006; 10: 15863. 4. Yanovski J, et al. Recent advances in basic obesity research. Journal of the American Medical Association 1999; 282: 1504-1506. 5. Young JL, et al. Medication compliance in schizophrenia: codification and update. Bulletin of the American Academy of Psychiatry Law 1986; 14: 105-122. 6. Fernald L, et al. High prevalence of obesity among the poor in Mexico. Journal of the American Medical Association 2004, 291: 2545-2546. 7. Allison D, et al. Antipsychotic-induced weight gain: A comprehensive research synthesis. American Journal of Psychiatry. 1999; 11:1686-1696. 8. Briej D, et al. Chronic treatment with neuroleptic drugs and weight gain. Dissertation abstracts international 1985, 45: 3653. 9. Jones B, et al. Weight change and atypical antipsychotic treatment in patients with schizophrenia. Journal of Clinical Psychiatry 2001, 62 (suppl 2): 41-44. 10. Lieberman J, Stroup S, McEnvoy J, Swartz M et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005; 353: 1209-23. 11. Findling R, McNamara N. Atypical antipsychotic in the treatment of children and adolescents: clinical applications. J Clin Psychiatry 2004; 65 (Suppl 6): 30-44. 12. Goff D, Cather C, Evis D et al. Medical morbidity and mortality in schizophrenia. Guidelines for psychiatrist. J Clin Psychiatry 2005; 66: 183-94. 13. Leibowitz S, et al. Neurochemical systems of the hypothalamus: control of feeding and drinking behaviour and water-electrolyte excretion. En: Handbook of the hypothalamus, vol 3 1980: 299-438. 14. Jackson H, et al. Comparison of the effects of sibutramine and other monoamine reuptake inhibitors on food intake in the rat. British Journal of Pharmacology 1997; 121: 17581762 15. Floris M, et al. Effect of amantadine on weight gain during olanzapine treatment: European Neuropsychopharmacology 2001;11:181-181 16. Tacott L, et al. Eating disorder and epilepsy in mice lacking 5-HT2c serotonin receptors, Nature 1995;374:542-546. 17. Newcomer, John W. M.D. Abnormalities of Glucose Metabolism Associated With Atypical Antipsychotic Drugs. J Clin Psychiatry 2004; 65[suppl 18]:26-46. 18. Kroeze. WK, Hufeisen SJ, Popodak BA, et al. H1-Histamine receptor affinity predicts Short-term weight gain for typical and atypical antipsychotic drugs. Neuropsychopharmacology 2003; 28:519-526. 19. Wirshing DA, Wirshing WC, Kysar L. Et al. Novel antipsychotics: comparison of weight gain liabilities. J Clin Psychiatry, 1999; 60:358-363. 20. Shapiro.DA, Renock. Arrington E., et al. Aripiprazole, a novel atypical antipsychotic drug with a unique and robust pharmacology. Neuropsychopharmacology 2003; 28:1400-1411. 21. Wirshing Donna, M.D. Schizophrenia and Obesity: Impact of antipsychotic medications. J Clin Psychiatry 2004; 65[suppl 18]:13-26. 22. Kyriaki G Brain insulin: regulation, mechanisms of action and functions. Cell Mol Neurobiol 2003; 23:1-25. 23. Baptista T, et al. Body weight gain induced by antipsychotic drugs: mechanisms and management. Acta Psychiatric Scandinavica 1999; 100: 3-13. 24. Haack M, et al. Plasma levels of cytokines and soluble cytokine receptors in psychiatric patients upon hospital admission: effects of confounding factors and diagnosis. Journal of Psychiatric research 1999; 33: 407-418. 25. Melkersson K, et al. Elevated levels of insulin, leptin and blood lipids in olanzapine- treated patients with schizophrenia and related psychosis. Journal of Clinical Psychiatry. 1999; 60:556-557. 26. Melkersson K, Dahl M-L. Adverse Metabolic Effects Associated With Atypical Antipsychotics, Drugs. 2004; 64(7):701-723. 27. Zhang Z, Yao Z, Liu W, Fang Q, Reynolds G. Effects of antipsychotics on fat deposition and changes in leptin and insulin levels. B J Psychiatry. 2004; 184:58-62. 28. Wirshing D, et al. Novel antipsychotic: comparison of weight gain liabilities. Journal of Clinical Psychiatry 1999;.60:358-363. 29. Kellerer M, et al. Insulin signal transduction: possible mechanisms for insulin resistance. Expert of Clinical Endocrinology Diabetes 1999; 107:97-106. 30. Kishi K, et al. Bradykinin directly triggers GLUT4 translocation via an insulin independent pathway. Diabetes 1998; 47:550-558. 31. Friedman J, et al. Leptin and the regulation of body weight in mammals. Nature. 1998; 395: 763-770. 32. Chen H, et al. Evidence than the diabetes gene encodes the leptin receptor: identification of a mutation in the leptin receptor gene in db/db mice. Cell. 1996; 84: 491-495. 33. Baptista T, et al. Obesity and related metabolic abnormalities during antipsychotic drug administration: Mechanisms, management and research perspectives. Pharmacopsychiatry 2002; 35:205-219. 34. Dynes J, et al. Diabetes in schizophrenia and diabetes in nonpsychotic medical patients. Diseases of the nervous system 1969; 30: 341-344. 35. Ryan M, Collins P, Thakore J. Impaired fasting glucose tolerance in first-episode, drug naïve patients with schizophrenia. Am J Psychiatry 2003; 160: 284-9. 36. Korenyi C, et al. Chlorpromazine induced diabetes. Diseases of the nervous system 1968; 29:827-827. 37. Thonnard-Neumann E, et al. Phenothiazines and diabetes in hospitalized women. American Journal of Psychiatry 1968; 124:978-982. 38. Liebzeit K, et al. New onset diabetes and atypical antipsychotics: European Neuropsychopharmacology 2001; 11:25-32. 39. Mir T, et al Atypical antipsychotics and hyperglycemia. International Clinical Psychopharmacology 2001; 16:63-73. 40. Hagg S, et al. Prevalence of diabetes and impaired glucose tolerance in patients treated with clozapine compared with patients treated with conventional depot neuroleptics medications. Journal of Clinical Psychiatry 1998; 59:294-299. 41. Mahmoud R, et al. Differential effects of antipsychotics on type II diabetes: findings from a large health plan database. Presented at the 39th annual meeting of the American College of Neuropsychopharmacology. Dec. 10-14 2000. 42. Cavazzoni P, et al. A pharmacoepidemiological study of diabetes mellitus and antipsychotic treatment in the US. Presented at the 41th annual meeting of the New Clinical Drug Evaluation Unit, May 28-31, 2001 Phoenix, Arz. 43. Brambilla F, et al. Neuroendocrine effects of haloperidol therapy in chronic schizophrenia. Psychopharmacologia 1975; 44:17-22. 44. Brambilla F, et al. Glucose-insulin metabolism in chronic schizophrenia. Diseases of the nervous system 1976; 37:8-103. 45. Kinon B, et al. Long-term olanzapine treatment: weight change and weight-related health factors in schizophrenia. Journal of Clinical Psychiatry 2001; 62:92-100. 46. Haupt D, et al. Hyperglycemia and antipsychotic medication. Journal of Clinical Psychiatry 2001; suppl 27: 15-26. 47. Henderson D, et al. Atypical antipsychotic agents and glucose metabolism. Presented at the 40th annual meeting of the new clinical drug evaluation unit 2000 Boca Raton Fla., US. 48. Henderson D, et al. Clinical experience with insulin resistance, diabetic ketoacidosis and type 2 diabetes mellitus in patients treated with atypical antipsychotics. Journal of Clinical Psychiatry 2001; suppl 27: 10-14 49. Kinsbury S, et al. The apparent effects of ziprasidone on plasma lipids and glucose. Journal of Clinical Psychiatry 2001; 62: 347-349. 50. Rojas P, Arancibia P, Bravo V, Varela S. Diabetes mellitus inducida por olanzapina. Caso clínico. Rev Méd Chile 2001; 129: 1183-5. 51. Baptista T, et al. Endocrine and metabolic profile in the obesity associated to typical antipsychotic drug-administration. Pharmacopsychiatry 2001; 46: 829-834 52. Meyer J, et al. Effects of atypical antipsychotics on weight and serum lipid levels. Journal of clinical psychiatry 2001; 62: 27-34 53. Ghaeli P, et al. Serum triglyceride levels in patients treated with clozapine. Am J Health Syst Pharm 1996; 53: 2079-2081. 54. Lund B, et al. Clozapine use in patients with schizophrenia and the risk of diabetes, hyperlipidemia and hypertension. Archives of general psychiatry 2001; 58: 1172-1176. 55. Spivak B, et al. Diminished suicidal and aggressive behavior, high plasma norepinephrine levels, and serum triglyceride levels in chronic neuroleptic-resistant schizophrenic patients maintained on clozapine. Clinical Neuropharmacology 1998; 21: 245250. 56. Melkerson K, et al. Elevated levels of insulin, leptin and blood lipids in olanzapine- treated patients with schizophrenia or related psychoses. Journal of clinical psychiatry 2000;61:742-749. 57. Bouchard R, et al. Atypical antipsychotics and cardiovascular risk in schizophrenic patients. Journal of clinical psychiatry 2001; 21:110-111. 58. de Leon J. A clinical study of the association of antipsychotics with hyperlipidemia. Schizophr Res . 2007; 92(1-3): 95-102. 59. Clozapine-induced severe mixed hyperlipidemia: a case report General Hospital Psychiatry. 2009 Vol 31, Issue 1. 60. Sacks F, et al. Metabolic Syndrome: Epidemiology and consequences Journal of clinical Psychiatry 2004; 65 (suppl 18):3 -12. 61. Haffner S, et al. Prospective analysis of the insulin-resistance syndrome (syndrome X). Diabetes 1992; 41: 715-722. 62. National cholesterol education program expert panel on detection, evaluation and treatment of high blood cholesterol in adults (adult treatment panel III). Executive summary of the third report of the national cholesterol education program (NCEP) Expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult treatment panel III). Journal of the American Medical Association. 2001; 285: 2486-2497. 63. World Health Organization. Definition, diagnosis and classification of diabetes mellitus and its complications, pt 1: Diagnosis and classification of diabetes mellitus. Geneva, Switzerland: World Health Organization; 1999: 1-59. 64. Schwartz E, Reaven P. Molecular and signaling mechanisms of atherosclerosis in insulin resistance. Endocrinol Metab Clin N Am 2006; 35: 524-54. 65. Bloomgarden Z. Third annual world congress on the insulin resistance syndrome. Diabetes Care 2006; 29: 1700-06. 66. Heiskanen T, et al. Metabolic syndrome in patients with schizophrenia. Journal of Clinical Pychiatry 2003; 64: 575-579. 67. Hanson D, Gottesman I. Theories of schizophrenia: a genetic-inflammatory-vascular synthesis. BMC Medica Genetics 2005; 6: 7. 68. Fan X, Goff D, Henderson D. Inflammation and schizophrenia. Expert Rev Neurotherapeutics 2007; 7: 789-96. 5.- EFECTOS METABÓLICOS DE LOS ANTIDEPRESIVOS 1. Alegría-Ezquerra E C-VJ, Alegría-Barrero A. Obesidad, síndrome metabólico y diabetes: Implicaciones cardiovasculares y actuación terapéutica. Rev Esp Cardiol. 2008; 61:752-764. 2. Villa AR EM, Mendez-Sánchez N. Estimación y proyección de la prevalencia de obesidad en México a través de la mortalidad por enfermedades asociadas. Gac Med Méx. 2004; 140:21-25. 3. Ribeiro-Teixeira PJ L-RF. The prevalence of metabolic syndrome among psychiatric inpatients in Brazil. Rev Bras Psiquiatr. 2007; 29:330-336. 4. Golden SH. A review of the evidence for a neuroendocrine link between stress, depression and diabetes mellitus. Curr Diabetes Rev. 2007; 3:252-259. 5. Joffre–Velazquez VM G-MG, Saldívar-González A, Lin-Ochoa D, Sosa Herrera J. Enfermedad psiquiátrica y síndrome metabólico. Énfasis en el Trastorno Esquizofrénico. Rev Med Hosp Gen Mex. 2009; 72: 41-49. 6. Kinder LS CM, Palaniappan LP, King AC, Fortmann SP. Depression and the metabolic syndrome in young adults: Findings from the Third National Health and Nutrition examination Survey. Psychosom Med. 2004; 66:316-322. 7. Aronne LJ, Segal KR. Weight gain in the treatment of mood disorders. J Clin Psychiatry. 2003; 64 Suppl 8:22-29. 8. Drieling T, Biedermann NC, Scharer LO, Strobl N, Langosch JM. [Psychotropic drug- induced change of weight: a review]. Fortschr Neurol Psychiatr. 2007; 75:65-80. 9. Fernstrom MH, Krowinski RL, Kupfer DJ. Chronic imipramine treatment and weight gain. Psychiatry Res. 1986; 17:269-273. 10. Frank E, Kupfer DJ, Bulik CM, Levenson JA. Imipramine and weight gain during the treatment of recurrent depression. J Affect Disord. 1990;20:165-172. 11. Levitt AJ, Joffe RT, Esche I, Sherret D. The effect of desipramine on body weight in depression. J Clin Psychiatry. 1987; 48:27-28. 12. Stern SL, Cooper TB, Johnson MH, Jones BA, Nelson LD, Smeltzer DJ. Lack of weight gain under desipramine. Biol Psychiatry. 1987; 22:796-797. 13. Weber E, Stack J, Pollock BG, Mulsant B, Begley A, Mazumdar S, et al.: Weight change in older depressed patients during acute pharmacotherapy with paroxetine and nortriptyline: a double-blind randomized trial. Am J Geriatr Psychiatry. 2000; 8:245-250. 14. Paradis CF, Stack JA, George CJ, Miller MD, Pollock BG, Rifai AH, et al. Nortriptyline and weight change in depressed patients over 60. J Clin Psychopharmacol. 1992;12:246-250. 15. Fava M, Judge R, Hoog SL, Nilsson ME, Koke SC. Fluoxetine versus sertraline and paroxetine in major depressive disorder: changes in weight with long-term treatment. J Clin Psychiatry. 2000; 61:863-867. 16. Guimaraes C, Pereira LR, Iucif Junior N, Cesarino EJ, de Almeida CA, de Carvalho D, et al. Tolerability and effectiveness of fluoxetine, metformin and sibutramine in reducing anthropometric and metabolic parameters in obese patients. Arq Bras Endocrinol Metabol. 2006; 50:1020-1025. 17. Vanina Y, Podolskaya A, Sedky K, Shahab H, Siddiqui A, Munshi F, et al. Body weight changes associated with psychopharmacology. Psychiatr Serv. 2002; 53:842-847. 18. Kraus T, Haack M, Schuld A, Hinze-Selch D, Koethe D, Pollmacher T. Body weight, the tumor necrosis factor system, and leptin production during treatment with mirtazapine or venlafaxine. Pharmacopsychiatry. 2002; 35:220-225. 19. Wise TN, Perahia DG, Pangallo BA, Losin WG, Wiltse CG. Effects of the antidepressant duloxetine on body weight: analyses of 10 clinical studies. Prim Care Companion J Clin Psychiatry. 2006; 8:269-278. 20. Gadde KM, Parker CB, Maner LG, Wagner HR, 2nd, Logue EJ, Drezner MK, et al. Bupropion for weight loss: an investigation of efficacy and tolerability in overweight and obese women. Obes Res. 2001; 9:544-551. 21. Poyurovsky M, Isaacs I, Fuchs C, Schneidman M, Faragian S, Weizman R, et al. Attenuation of olanzapine-induced weight gain with reboxetine in patients with schizophrenia: a double-blind, placebo-controlled study. Am J Psychiatry. 2003; 160:297-302. 22. Poyurovsky M, Fuchs C, Pashinian A, Levi A, Faragian S, Maayan R, et al. Attenuating effect of reboxetine on appetite and weight gain in olanzapine-treated schizophrenia patients: a double-blind placebo-controlled study. Psychopharmacology (Berl). 2007; 192:441-448. 23. Derijks HJ, Janknegt R, Heerdink ER, De Koning FH, Krekels MM, Looij BJ, et al. Influence of antidepressant use on glycemic control in patients with diabetes mellitus: an openlabel comparative study. J Clin Psychopharmacol. 2009; 29:405-408. 24. Andersohn F, Schade R, Suissa S, Garbe E. Long-term use of antidepressants for depressive disorders and the risk of diabetes mellitus. Am J Psychiatry. 2009; 166:591-598. 25. Himmerich H, Zimmermann P, Ising M, Kloiber S, Lucae S, Kunzel HE, et al. Changes in the hypothalamic-pituitary-adrenal axis and leptin levels during antidepressant treatment. Neuropsychobiology. 2007; 55:28-35. 26. Nonogaki K, Nozue K, Kuboki T, Oka Y. Milnacipran, a serotonin and norepinephrine reuptake inhibitor, induces appetite-suppressing effects without inducing hypothalamic stress responses in mice. Am J Physiol Regul Integr Comp Physiol. 2007; 292:R1775-1781. 27. Dykens JA, Jamieson JD, Marroquin LD, Nadanaciva S, Xu JJ, Dunn MC, et al. In vitro assessment of mitochondrial dysfunction and cytotoxicity of nefazodone, trazodone, and buspirone. Toxicol Sci. 2008;103:335-345. 28. Heiser P, Singh S, Krieg JC, Vedder H. Effects of different antipsychotics and the antidepressant mirtazapine on glucose transporter mRNA levels in human blood cells. J Psychiatr Res. 2006; 40:374-379. 6.- EFECTOS METABÓLICOS DE LOS ESTABILIZADORES DEL ÁNIMO 1. Allison DB, Fontaine KR, Heo M, Mentore JL, Cappelleri JC, Chandler LP, et al. The distribution of body mass index among individuals with and without schizophrenia. J Clin Psychiatry. 1999; 60(4):215-20. 2. McElroy SL, Frye MA, Suppes T, Dhavale D, Keck PE, Jr., Leverich GS, et al. Correlates of overweight and obesity in 644 patients with bipolar disorder. J Clin Psychiatry. 2002; 63(3):207-13. 3. Zimmermann U, Kraus T, Himmerich H, Schuld A, Pollmacher T. Epidemiology, implications and mechanisms underlying drug-induced weight gain in psychiatric patients. J Psychiatr Res. 2003;37(3):193-220. 4. Masand PS. Weight gain associated with psychotropic drugs. Expert Opin Pharmacother. 2000; 1(3):377-89. 5. Schwartz TL, Nihalani N, Jindal S, Virk S, Jones N. Psychiatric medication-induced obesity: a review. Obes Rev. 2004; 5(2):115-21. 6. Livingstone C, Rampes H. Lithium: a review of its metabolic adverse effects. J Psychopharmacol. 2006; 20(3):347-55. 7. Keck PE, McElroy SL. Bipolar disorder, obesity, and pharmacotherapy-associated weight gain. J Clin Psychiatry. 2003; 64(12):1426-35. 8. Peselow ED, Dunner DL, Fieve RR, Lautin A. Lithium carbonate and weight gain. J Affect Disord. 1980; 2(4):303-10. 9. Garland EJ, Remick RA, Zis AP. Weight gain with antidepressants and lithium. J Clin Psychopharmacol. 1988; 8(5):323-30. 10. Atmaca M, Kuloglu M, Tezcan E, Ustundag B. Weight gain and serum leptin levels in patients on lithium treatment. Neuropsychobiology. 2002; 46(2):67-9. 11. Chen Y, Silverstone T. Lithium and weight gain. Int Clin Psychopharmacol. 1990; 5(3):217-25. 12. Baptista T, Lacruz A, de Mendoza S, Guillen MM, Burguera JL, de Burguera M, et al. Endocrine effects of lithium carbonate in healthy premenopausal women: relationship with body weight regulation. Prog Neuropsychopharmacol Biol Psychiatry. 2000; 24(1):1-16. 13. Grandjean EM, Aubry JM. Lithium: updated human knowledge using an evidence-based approach: part III: clinical safety. CNS Drugs. 2009;23(5):397-418. 14. Zhang ZJ, Qiang L, Kang WH, Tan QR, Gao CG, Zhang FG, et al. Differences in hypothyroidism between lithium-free and -treated patients with bipolar disorders. Life Sci. 2006; 78(7):771-6. 15. Kleiner J, Altshuler L, Hendrick V, Hershman JM. Lithium-induced subclinical hypothyroidism: review of the literature and guidelines for treatment. J Clin Psychiatry. 1999; 60(4):249-55. 16. Fagiolini A, Kupfer DJ, Scott J, Swartz HA, Cook D, Novick DM, et al. Hypothyroidism in patients with bipolar I disorder treated primarily with lithium. Epidemiol Psichiatr Soc. 2006;15(2):123-7. 17. Kusalic M, Engelsmann F. Effect of lithium maintenance therapy on thyroid and parathyroid function. J Psychiatry Neurosci. 1999; 24(3):227-33. 18. Kirov G, Tredget J, John R, Owen MJ, Lazarus JH. A cross-sectional and a prospective study of thyroid disorders in lithium-treated patients. J Affect Disord. 2005; 87(2-3):313-7. 19. Henry C. Lithium side-effects and predictors of hypothyroidism in patients with bipolar disorder: sex differences. J Psychiatry Neurosci. 2002; 27(2):104-7. 20. Gracious BL, Findling RL, Seman C, Youngstrom EA, Demeter CA, Calabrese JR. Elevated thyrotropin in bipolar youths prescribed both lithium and divalproex sodium. J Am Acad Child Adolesc Psychiatry. 2004; 43(2):215-20. 21. Bocchetta A, Bernardi F, Burrai C, Pedditzi M, Loviselli A, Velluzzi F, et al. The course of thyroid abnormalities during lithium treatment: a two-year follow-up study. Acta Psychiatr Scand. 1992; 86(1):38-41. 22. Bocchetta A, Mossa P, Velluzzi F, Mariotti S, Zompo MD, Loviselli A. Ten-year follow-up of thyroid function in lithium patients. J Clin Psychopharmacol. 2001; 21(6):594-8. 23. Johnston AM, Eagles JM. Lithium-associated clinical hypothyroidism. Prevalence and risk factors. Br J Psychiatry. 1999;175:336-9. 24. Deodhar SD, Singh B, Pathak CM, Sharan P, Kulhara P. Thyroid functions in lithium- treated psychiatric patients: a cross-sectional study. Biol Trace Elem Res. 1999; 67(2):151-63. 25. Gyulai L, Bauer M, Bauer MS, Garcia-Espana F, Cnaan A, Whybrow PC. Thyroid hypofunction in patients with rapid-cycling bipolar disorder after lithium challenge. Biol Psychiatry. 2003; 15;53(10):899-905. 26. Burrow GN, Burke WR, Himmelhoch JM, Spencer RP, Hershman JM. Effect of lithium on thyroid function. J Clin Endocrinol Metab. 1971; 32(5):647-52. 27. Wolff J. Effects of lithium on thyroid gland function. Neurosci Res Program Bull. 1976; 14(2):178-80. 28. Terao T, Oga T, Nozaki S, Ohta A, Otsubo Y, Yamamoto S, et al. Possible inhibitory effect of lithium on peripheral conversion of thyroxine to triiodothyronine: a prospective study. Int Clin Psychopharmacol. 1995; 10(2):103-5. 29. Rapoport, S.I., et al., Bipolar disorder and mechanisms of action of mood stabilizers, Brain Res. Rev. 2009;,doi:10.1016/j.brainresrev.2009.06.003 30. Richens A, Davidson DL, Cartlidge NE, Easter DJ. A multicentre comparative trial of sodium valproate and carbamazepine in adult onset epilepsy. Adult EPITEG Collaborative Group. J Neurol Neurosurg Psychiatry. 1994; 57(6):682-7. 31. Mattson RH, Cramer JA, Collins JF. A comparison of valproate with carbamazepine for the treatment of complex partial seizures and secondarily generalized tonic-clonic seizures in adults. The Department of Veterans Affairs Epilepsy Cooperative Study No. 264 Group. N Engl J Med. 1992; 327(11):765-71. 32. Lampl Y, Eshel Y, Rapaport A, Sarova-Pinhas I. Weight gain, increased appetite, and excessive food intake induced by carbamazepine. Clin Neuropharmacol. 1991; 14(3):251-5. 33. Hogan RE, Bertrand ME, Deaton RL, Sommerville KW. Total percentage body weight changes during add-on therapy with tiagabine, carbamazepine and phenytoin. Epilepsy Res. 2000; 41(1):23-8. 34. Vieweg V, Godleski L, Hundley P, Harrington D, Yank G. Antipsychotic drugs, lithium, carbamazepine, and abnormal diurnal weight gain in psychosis. Neuropsychopharmacology. 1989; 2(1):39-43. 35. Corman CL, Leung NM, Guberman AH. Weight gain in epileptic patients during treatment with valproic acid: a retrospective study. Can J Neurol Sci. 1997; 24(3):240-4. 36. Ketter TA, Kalali AH, Weisler RH. A 6-month, multicenter, open-label evaluation of beaded, extended-release carbamazepine capsule monotherapy in bipolar disorder patients with manic or mixed episodes. J Clin Psychiatry. 2004; 65(5):668-73. 37. Coxhead N, Silverstone T, Cookson J. Carbamazepine versus lithium in the prophylaxis of bipolar affective disorder. Acta Psychiatr Scand. 1992; 85(2):114-8. 38. Hartong EG, Moleman P, Hoogduin CA, Broekman TG, Nolen WA. Prophylactic efficacy of lithium versus carbamazepine in treatment-naive bipolar patients. J Clin Psychiatry. 2003; 64(2):144-51. 39. Torrent C, Amann B, Sanchez-Moreno J, Colom F, Reinares M, Comes M, et al. Weight gain in bipolar disorder: pharmacological treatment as a contributing factor. Acta Psychiatr Scand. 2008; 118(1):4-18. 40.- Löscher W. Basic pharmacology of valproate: a review after 35 years of clinical use for the treatment of epilepsy. CNS Drugs 2002; 16(10):669-94. 41.- Yatham LN, Liddle PF, Lam RW, et al. PET study of the effects of valproate on dopamine D(2) receptors in neuroleptic- and mood-stabilizer-naive patients with nonpsychotic mania. Am J Psychiatry 2002; 159(10):1718-23. 42.- Bowden CL, Janicak PG, Orsulak P, et al. Relation of serum valproate concentration to response in mania. Am J Psychiatry 1996; 153(6):765-70. 43.- Perucca E. Pharmacological and therapeutic properties of valproate: a summary after 35 years of clinical experience. CNS Drugs 2002; 16(10):695-714. 44.-. Back DJ, Orme ML. Pharmacokinetic drug interactions with oral contraceptives. Clin Pharmacokinet 1990;1 8(6):472-84. 45.- Peter M Haddad, Amlan Das, Muhammad Ashfaq & Angelika Wieck. A review of valproate in psychiatric practice. Expert Opin. Drug Metab Toxicol. 2009; 5(5):539-551.46.- Tohen M, Ketter TA, Zarate CA, et al. Olanzapine versus divalproex sodium for the treatment of acute mania and maintenance of remission: a 47-week study. Am J Psychiatry 2003; 160(7):126371.47.- Drieling T, Biedermann NC, et al. Efficacy of quetiapine monotherapy in rapid-cycling bipolar disorder in comparison with sodium valproate. J Clin Psychopharmacol 2008; 28(5):55560.48.- Vorum H, Gram L, Honore´ B. Valproate and palmitate binding to serum albumin in valproate treated patients: relation to obesity. Epilepsy Res 1993; 16:55–64.49.- Kim JY, Lee HW. Metabolic and hormonal disturbances in women with epilepsy on antiepileptic drug monotherapy. Epilepsia 2007; 48(7):1366-70. 50.- Pylvänen V, Knip M, Pakarinen AJ, et al. Fasting serum insulin and lipid levels in men with epilepsy. Neurology 2003; 0(4):571-4.51.Pylva¨nen V, Pakarinen A, Knip M, Isoja¨rvi JIT, Characterization of insulin secretion in valproate treated patients with epilepsy. Epilepsia 2006 [in press]. 52.- Luef GJ, Lechleitner M, Bauer G, et al. Valproic acid modulates islet cell insulin secretion: a possible mechanism of weight gain in epilepsy patients. Epilepsy Res 2003; 55:53–8. 53.- Reaven GM. Banting Lecture 1988: role of insulin resistance in human disease. Diabetes 1988; 37:1595–607. 54.- Ring HA, Heller AJ, Marshall WJ, et al. Plasma uric acid in patients receiving anticonvulsant monotherapy. Epilepsy Res 1991; 8:241–4. 55.- Quinones Galvan A, Natali A, et al. Effect of insulin on uric acid excretion in humans. Am J Physiol 1995; 268:E1–5. 56.- Davies KJ, Sevanian A, Muakkassah-Kelly SF, et al. Uric acid–iron ion complexes: a new aspect of the antioxidant functions of uric acid. Biochem J 1986; 235:747–54. 57.- Waring WS, Webb DJ, Maxwell SR. Uric acid as a risk factor for cardiovascular disease. Q J Med 2000; 93:707–13. 58.- Selby JV, Friedman GD, Quesenberry Jr CP. Precursors of essential hypertension: pulmonary function, heart rate, uric acid, serum cholesterol, and other serum chemistries. Am J Epidemiol 1990; 131:1017–27. 59.- Karas BJ, Wilder BJ, Hammond EJ, et al. Valproate tremors. Neurology 1982; 32:428–32. 60.- Virpi Pylva¨nen , Arto Pakarinen, Mikael Knip, Jouko Isoja¨rvi Insulin-related metabolic changes during treatment with valproate in patients with epilepsy Epilepsy & Behavior 2006; 8:643–648. 61.- Bray GA. Medical consequences of obesity. J Clin Endocrinol Metab 2004; 89:2583–9. 62.- Goalstone ML, Natarajan R, Standley PR, et al. Insulin potentiates platelet-derived growth factor action in vascular smooth muscle cells. Endocrinology 1998; 139:4067–72. 63.- Pack AM, Gidal B, Vazquez B. Bone disease associated with antiepileptic drugs. Cleve Clin J Med. 2004; 71 2:S42-8. 64.- Rasgon NL, Altshuler LL, Fairbanks L, et al. Reproductive function and risk for PCOS in women treated for bipolar disorder. Bipolar Disord 2005; 7:246-59. 65.- Joffe H, Cohen LS, Suppes T, et al. Longitudinal follow-up of reproductive and metabolic features of valproate-associated polycystic ovarian syndrome features: a preliminary report. Biol Psychiatry 2006; 60(12):1378-8131. 66.- National Institute for Health and Clinical Excellence 2006. Bipolar disorder. The management of bipolar disorder in adults, children and adolescents, in primary and secondary care. Clinical Guideline 38. Available from: www.nice.org.uk Comprehensive UK guideline reviewing the management of bipolar disorder including pharmacological and psychological interventions. 67.- Isojarvi JI, Pakarinen AJ, Myllyla VV. Thyroid function with antiepileptic drugs. Epilepsia 1992;33:142–8. 68.- Pinkney JH, Kepelman PG. Endocrine determinants of obesity. In: Bray GA, Bouchard C, editors. New York: Marcel Dekker; 2004. p. 655–69. 69.- DeToledo JC, Toledo C, DeCerce J, Ramsay RE. Changes in body weight with chronic, high-dose gabapentin therapy. Ther Drug Monit 1997;19:394–396. 70.- Baulac M, Cavalcanti D, Semah F, Arzimanoglou A, Portal JJ. Gabapentin add-on therapy with adaptable dosages in 610 patients with partial epilepsy: an open, observational study. The French Gabapentin Collaborative Group. Seizure 1998; 7:55–62. 71.- Wang PW, Santosa C, Schumacher M, Winsberg ME, Strong C, Ketter TA. Gabapentin augmentation therapy in bipolar depression. Bipolar Disord 2002; 4:296–301. 72.- Calabrese JR, Bowden CL, Sachs G et al. A placebo-controlled 18-month trial of lamotrigine and lithium maintenance treatment in recently depressed patients with bipolar I disorder. J Clin Psychiatry 2003; 64:1013–1024. 73.- Torrent C, Amann B, Sa´ nchez-Moreno J, Colom F, Reinares M, Comes M, Rosa AR., Scott J, Vieta E. Weight gain in bipolar disorder: pharmacological treatment as a contributing factor. Acta Psychiatr Scand 2008: 118: 4–18. 74.- Bowden CL, Calabrese JR, Ketter TA, Sachs GS, White RL, Thompson TR. Impact of lamotrigine and lithium on weight in obese and nonobese patients with bipolar I disorder. Am J Psychiatry 2006; 163:1199–1201. 75.- Remy C, Beaumont D. Efficacy and safety of vigabatrin in the long-term treatment of the refractory epilepsy. Br J Clin Pharmacol 1989; 27 Suppl.1: S125-9. 76.- Tartara A, Manni R, Galimberti CA, et al. Six-year follow-up study on the efficacy and safety of vigabatrin in patients with epilepsy. Acta Neurol Scand 1992; 86: 247-51. 77.- Chadwick D. Safety and efficacy of vigabatrin and carbamazepine in newly diagnosed epilepsy: a multicentre randomised double-blind study. Vigabatrin European Monotherapy Study Group. Lancet 1999; 354 (9172): 13-9. 78.- Guberman A, Bruni J. Long-term openmulticentre, add-on trial of vigabatrin in adult resistant partial epilepsy. The Canadian Vigabatrin Study Group. Seizure 2000; 9 (2): 112-8. 79.- T. L. Schwartz, N. Nihalani, S. Jindal, S. Virk and N. Jones Psychiatric medication-induced obesity: a review obesity reviews 2004; 5, 115–121. 80.’ Cantu TG, Korek JS. Monoamine oxidase inhibitors and weight gain. Drug Intell Clin Pharm 1988; 22: 755–759. 81.- Drieling T, Biedermann NC, Scharer LO, Strobl N, Langosch JM [Psychotropic drug- induced change of weight: a review]. Fortschr Neurol Psychiatr. 2007; 75:65-80. 7.- PSIQUIATRÍA Y SÍNDROME METABÓLICO. EL VÍNCULO ENTRE EL SÍNDROME METABÓLICO Y LA PSIQUIATRÍA 1. Olaiz-Fernández G, Rivera-Dommarco J, Shamah-Levy T, Rojas R, Villalpando- Hernández S, Hernández-Avila M, Sepúlveda-Amor J. Encuesta Nacional de Salud y Nutrición 2006. Cuernavaca, México: Instituto Nacional de Salud Pública, 2006. 2. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults ((Adult Treatment Panel III). Journal of the American Medical Association. 2001; 285 3. Colagiuri S, Brand Miller JC. The metabolic syndrome: from inherited survival trait to a health care problem. Exp Clin Endocrinol Diabetes. 1997; 105 Suppl 2:54-60. 4. Ford ES, Giles WH, Dietz WH. Prevalence of the metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey. Journal of the American Medical Association. 2002; 287:356-359. 5. Chrousos GP. The role of stress and the hypothalamic-pituitary-adrenal axis in the pathogenesis of the metabolic syndrome: neuro-endocrine and target tissue-related causes. International Journal of Obesity. 2000; 24, Suppl. 2, S50-S55. 6. Kinder LS, Carnethon MR, Palaniappan LP, King AC, Fortmann SP. Depression and the metabolic syndrome in young aduts: findings from the Third National Health and Nutrition Examination Survey. Psychosom Med. 2004; 66:316-322. 7. Carney RM, Rich MW, TeVelde A, Saini J, Clark K, Freedland KE. The relationship between heart rate, heart rate variability and depression in patients with coronary artery disease. J Psychosom Res. 1988; 32:159-164. 8. Appels A, Bar FW, Bar J, Bruggeman C, De Baets M. Inflamation, depressive symptomatology, and coronary artery disease. Psychosom Med. 2000; 62:601-605. 9. Rivenes AC, Harvey SB, Mykletun A: The relationship between abdominal fat, obesity, and common mental disorders: results from the HUNT study. J Psychosom Res. 2009; 66(4):269-75. 8.- ASPECTOS METABÓLICOS CEREBRALES DE LAS CONDUCTAS ALIMENTARIAS RELACIONADAS CON LA OBESIDAD. 1. Gautier, J. F., Chen, K., Salbe, A. D., Bandy, D., Pratley, R. E., Heiman, M., Ravussin, E., Reiman, E. M. & Tataranni, P. A. Differential brain responses to satiation in obese and lean men. Diabetes. 2000; 49, 838–846. 2. Goldstein, R. Z. & Volkow,N.D. Drug addiction and its underlying neurobiological basis: neuroimaging evidence for the involvement of the frontal cortex. Am. J. Psychiatry. 2002; 159, 1642–1652. 3. Volkow,N.D.&O’Brien, C. P. Issues forDSM-V: should obesity be included as a brain disorder? Am. J. Psychiatry. 2007; 164, 708–710. 4. Volkow, N. D. & Wise, R. A. How can drug addiction help us understand obesity? Nat. Neurosci. 2005; 8, 555–560. 5. Volkow, N. D. et al. “Nonhedonic” food motivation in humans involves dopamine in the dorsal striatum and methylphenidate amplifies this effect. 2002; Synapse 44, 175–180. 6. Volkow, N. D. et al. Brain dopamine is associated with eating behaviors in humans. Int. J. Eat. Disord. 2003; 33, 136–142. 7. Volkow ND, Wang GJ, Fowler JS, Telang F. Overlapping neuronal circuits in addiction and obesity: evidence of systems pathology. Philos Trans R Soc Lond B Biol Sci. 2008; 363(1507):3191-200, 8. Stice E, Spoor S, Bohon C, Small DM. Relation between obesity and blunted striatal response to food is moderated by TaqIA A1 allele. Science. 2008; 322(5900):449-52. 9.- MANEJO FARMACOLÓGICO Y NUTRICIONAL DE LOS TRASTORNOS METABÓLICOS EN EL PACIENTE PSIQUIÁTRICO. 1. Angelescou I, Klawe C, Benkert O. Orlistat in the treatment of psychopharmacologically induced weight gain. J Clin Psychopharmacol. 2000; 20(6). 2. Carpenter LL, Schecker JM, Sinischalchi J, et al. A case series describing orlistat use in patients on psychotropic medications. Med Health R I. 2004; 87(12). 3. Pavlovic ZM. Orlistat in the treatment of clozapine-induced hyperglycemia and weight [letter]. Eur Psychiatry. 2005; 20(7). 4. Ko YH, Joe SH, Kim SH. Topiramato as an adjuntive treatment with atypical antipsychotics in schizophrenic patients experiencing wieght gain. Clin Neuropharmacol, 2005; 28(4). 5. Nickel MK, Nickel C, Muehlbacher M, et al. Influence of topiramate on olanzapine-treated adiposity in women: a random, double-blind, placebo-controlled study. J Clin Psychopharmacol. 2005; 25(3). 6. Poyurovsky M, Isaacs I, Fuchs C, et al. Attenuation of olanzapine-induced weight gain with reboxetine in patients with schizophrenia: a double-blind, placebo-controlled study. Am J Psychiatry. 2003; 160:297-302. 7. Poyurovsky M, Fuchs C, Pashinian A. Attenuating effect of reboxetine on appetite and weight gain in olanzapine-treated schizophrenia patients: a double-blind, placebo-controlled study. Psychopharmachology. 2007; 192(3). 8. 10.- http://www.salud.gob.mx/unidades/cdi/documentos/DOCSAL7520.pdf MANEJO NUTRICIONAL DE LOS TRASTORNOS METABÓLICOS Y CARDIOVASCULARES EN EL PACIENTE PSIQUIÁTRICO. 1. Hernández R. M., Sastre G. A. Tratado de Nutrición. Capítulo 61. Diabetes Mellitus tipo 2. Ed. Díaz de Santos, Madrid, España. 1999: 957-973. 2. Chinchilla M.A. Nuevas Generaciones en Neurociencias. Obesidad y Psiquiatría. Capítulo 6. Obesidad y Psicopatología. Ed. MASSON, Barcelona, España. 2005: 43-49 3. Hernández R. M, Sastre G. A. Tratado de Nutrición. Capítulo 67. Dieta, lípidos y ateroesclerosis. Ed. Díaz de Santos. 1999: 1035-1044. 4. Goossens G.H. The role of adipose tissue dysfunction in the pathogenesis of obesity-related insulin resistance. Physiology & Behavior 94 (2008) 206–218 5. Chinchilla M.A. Nuevas Generaciones en Neurociencias. Obesidad y Psiquiatría. Capítulo 14. Psicoeducación en el tratamiento de la obesidad. Ed. MASSON, Barcelona, España. 2005: 43-49 11.- CONCLUSIONES Y RECOMENDACIONES 1. Fleischhacker W, Cetkovich-Bakmas M, De Hert M et al. Comorbid somatic illnesses in patients with severe mental disorders: clinical, policy, and research challenges. J Clin Psychiatry 2008;69:514-9. 2. Newcomer JW. Second-generation (atypical) antipsychotics and metabolic effects: a comprehensive literature review. CNS Drugs 2005;19:1-93. 3. Cradock-O’Leary J, Young AS, Yano EM et al. Use of general medical services by VA patients with psychiatric disorders. Psychiatr Serv 2002;53:874-8. 4. Druss BG, Bradford WD, Rosenheck RA et al. Quality of medical care and excess mortality in older patients with mental disorders. Arch Gen Psychiatry 2001;58:565-72. 5. De Hert M , Schreurs V , Vancampfort D , Van Winkel R Síndrome metabólico en personas con esquizofrenia: una revisión. Revista oficial de la Asociación Mundial de Psiquiatría (WPA) Edición en Español 2009; 7(1):l 16-23. 6. Straker D, Correll CU, Kramer-Ginsberg E et al. Cost-effective screening for the metabolic syndrome in patients treated with second generation antipsychotic medications. Am J Psychiatry 2005;162:1217-21. 7. Hennekens CH, Hennekens AR, Hollar D et al. Schizophrenia and increased risks of cardiovascular disease. Am Heart J 2005;150:1115-21. 8. Fagard R. Exercise characteristics and the blood pressure response to dynamic physical training. Med Sci Sports Exerc 2001;33:484-92. 9. Pescatello LS, Franklin BA, Fagard R et al. Exercise and hypertension. Med Sci Sports Exerc 2004;36:533-53. 10. Blair SN, Brodney S. Effects of physical inactivity and obesity on morbidity and mortality: current evidence and research issues. Med Sci Sports Exerc 1999;31:S646-62. 11. Lambers S, Van Laethem C, Van Acker K et al. Influence of combined exercise training on indices of obesity, diabetes and cardiovascular risk in type 2 diabetes patients. Clin Rehabil 2008;22:483-92. 12. Saltin B, Helge JW. Metabolic capacity of skeletal muscles and health. UgeskrLaeger 2000;162:59-64. 13. Faulkner G, Cohn TA. Pharmacologic and nonpharmacologic strategies for weight gain and metabolic disturbance in patients treated with antipsychotic medications. Can J Psychiatry 2006;51:502-11. 14. Faulkner G, Cohn T, Remington G. Interventions to reduce weight gain in schizophrenia. Schizophr Bull 2007;33:654-6. 15. Barnett AH, Mackin P, Chaudhry I et al. Minimising metabolic and cardiovascular risk in schizophrenia: diabetes, obesity and dyslipidaemia. J Psychopharmacol 2007;21:357-73. 16. Citrome L, Yeomans D. Do guidelines for severe mental illness promote physical health and well-being? J Psychopharmacol, 2005;19:102-9. 17. Cohn TA, Sernyak MJ. Metabolic monitoring for patients treated with antipsychotic medications. Can J Psychiatry 2006;51:492-501. 18. De Hert M, Van Eyck D, De Nayer A. Metabolic abnormalities associated with second generation antipsychotics: fact or fiction? Development of guidelines for screening and monitoring. Int Clin Psychopharmacol 2006;21(Suppl. 2):11-5. 19. De Nayer A, De Hert M, Scheen A et al. Conference report: Belgian consensus on metabolic problems associated with secondgeneration antipsychotics. Int J Psy Clin Pract 2005;9:130-7. 20. Marder SR, Essock SM, Miller AL et al. Physical health monitoring of patients with schizophrenia. Am J Psychiatry 2004;161:1334-49. 21. Sernyak MJ. Implementation of monitoring and management guidelines for second generation antipsychotics. J Clin Psychiatry 2007;68:14-8. 22. van Winkel R, De Hert M, Van Eyck D et al. Screening for diabetes and other metabolic abnormalities in patients with schizophrenia: evaluation of incidence and screening methods. J Clin Psychiatry 2006;67:1493-500. 23. Buckley PF, Miller D, Singer B et al. Clinicians’ recognition of the metabolic adverse effects of antipsychotic medications. Schizophr Res 2005;79:281-8. 24. Newcomer JW, Nasrallah HA, Loebel AD. The atypical antipsychotic therapy and metabolic issues national survey. J Clin Psychopharmacol 2004;24:1-6. 25. Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice. European guidelines on cardiovascular disease prevention in clinical practice: executive summary. Eur J Cardiovasc Prev Rehabil 2007;14(Suppl. 2):E1-40. 26. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. Eur Heart J 2007;28:88-136.