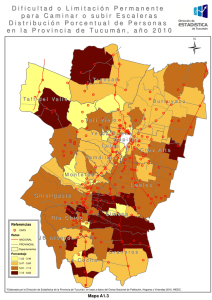
+ Consenso Argentino de Hepatocarcinoma 2015
Anuncio

ASOCIACIÓN ARGENTINA PARA EL Comisión Directiva Dra. Alejandra Villamil Presidente Dr. Adrián Gadano Vice Presidente Dr. Sebastián Ferreti Secretario Dr. Federico Piñero Prosecretario Dra. Estela Manero Tesorera Dr. Fernando Cairo Protesorero Vocales titulares: Dr. Manuel Mendizabal Dra. Sara Chao Dr. Andrés Bruno Vocales suplentes Dra. Gisela Gualano Dra. Claudia D’Amico Dr. Diego Arufe Órgano de Fiscalización Titular: Dra. M. Teresa Magdalena de Schroder Suplente: Dra. Cristina Cañero Velasco 2 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Introducción El hepatocarcinoma es la segunda causa de muerte relacionada al cáncer en el mundo. Lamentablemente, la incidencia y mortalidad de esta enfermedad se han incrementado en los últimos años a nivel mundial y, de acuerdo con estimaciones epidemiológicas, se espera que continúe en aumento debido a la epidemia de obesidad en la región y a la mayor incidencia de cirrosis en la cohorte infectada por HCV hace 2-4 décadas. En la Argentina no existen datos firmes acerca de la incidencia del hepatocarcinoma, aplicabilidad de los tratamientos y sobrevida obtenida tras su aplicación. A pesar del avance en el conocimiento de aspectos moleculares del hepatocarcinoma, de la accesibilidad a herramientas para el diagnóstico temprano, del refinamiento de la técnica quirúrgica y del trasplante, poco es lo que se ha podido hacer en cuanto al impacto sobre la mortalidad global de este tumor, por lo que sigue siendo un problema de salud pública en todo el mundo. En los últimos años se ha avanzado en forma sustancial en varios aspectos de esta patología como es la estadificación de los pacientes, el mejor entendimiento de la fisiopatología de la hepatocarcinogenesis y el desarrollo de nuevos procedimientos de diagnóstico y tratamiento. Otros aspectos requieren aún mucha mejora e investigación como incrementar el numero de pacientes con diagnóstico en estadios tempranos, la caracterización del perfil biológico o molecular del hepatocarcinoma, la disponibilidad de tratamientos mas eficaces para pacientes con enfermedad avanzada, entre otros. Este particular escenario motivó a la Asociación Argentina para el Estudio de las Enfermedades del Hígado (AAEEH) a convocar por primera vez el Consenso Argentino de Hepatocarcinoma. Este consenso tiene como objetivo apoyar a los médicos y personal sanitario, como así también a pacientes y otros actores que participan en el proceso de toma de decisiones, a mejorar el manejo del paciente con hepatocarcinoma. Agradecemos a la comisión directiva de la AAEEH la confianza depositada en nosotros para coordinar este importante evento. Eduardo Fassio Coordinador 1er CAH Guillermo Mazzolini Coordinador 1er CAH AAEEH • 3 ASOCIACIÓN ARGENTINA PARA EL 4 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Coordinadores Generales Eduardo Fassio Guillermo Mazzolini Jefe de la Sección Hepatología - Hospital Nacional Prof. Alejandro Posadas - El Palomar Provincia de Buenos Aires. Docente Adscripto de la Universidad de Buenos Aires - C.A.B.A. Staff Servicio de Hepatología. Prof. Titular Fisiopatología - Hospital Universitario Austral, Facultad de Ciencias Biomédicas, Universidad Austral - CONICET - Pilar - Provincia de Buenos Aires. Secretarias Generales María Soledad Alonso Carolina Zulatto Médica de la Sección Hepatología del Hospital Nacional Prof. Alejandro Posadas - El Palomar Provincia de Buenos Aires. Médica de la Sección Hepatología del Hospital Nacional Prof. Alejandro Posadas - El Palomar Provincia de Buenos Aires. Coordinadores de Módulos Bernardo Frider Juan A. Sordá Director del Departamento de Hepatología de la Universidad Maimónides - C.A.B.A Jefe División Gastroenterología - Hospital de Clínicas - Universidad de Buenos Aires - C.A.B.A. Gustavo Romero Hugo Tanno Jefe Sección Hepatología - Hospital de Gastroenterología Dr. Carlos Bonorino Udaondo - C.A.B.A. Director del Postgrado en Gastroenterología - Facultad de Medicina - UNR. Jefe de Unidad - Hospital Provincial del Centenario - Rosario Santa Fe. Secretarias de Módulos Silvia Frías y trasplantados hepáticos - San Salvador de Jujuy. Médica de Planta del Servicio de Hepatología y Gastroenterología del Hospital Ramos Mejía C.A.B.A. Marcela Sixto Jefa Sección Hepatología – Hospital José M. Cullen – Santa Fe. Patricia Gallardo Médica Especialista en Hepatología - Instituto de Seguros de Jujuy y Ministerio de Salud de la Provincia de Jujuy - Presidente de la Fundación Sayani para pacientes con enfermedades hepáticas Carolina Zulatto Médica de la Sección Hepatología del Hospital Nacional Prof. Alejandro Posadas - El Palomar Provincia de Buenos Aires. AAEEH • 5 ASOCIACIÓN ARGENTINA PARA EL Responsables de los temas Gabriel Aballay Alejandra Avagnina Médico de Planta - Unidad de Trasplante Hepático - Hospital General de Agudos Dr. Cosme Argerich - Sub Jefe Unidad de Trasplante Hepático Sanatorio de la Trinidad Mitre - C.A.B.A. Jefe Servicio Patología. Jefe de División Patología Quirúrgica, Departamento de Patología - CEMIC - Hospital de Clínicas José de San Martín - Universidad de Buenos Aires - C.A.B.A. Raúl Adrover Juan C. Bandi Médico Hepatólogo - Hospital San Roque de Gonnet - Centro de Hepatología de La Plata Provincia de Buenos Aires. Médico de Planta de la Unidad de Hepatología y Trasplante del Hospital Italiano de Buenos Aires C.A.B.A. José Allevato Fernando Barreyro Especialista y referente en Hepatología Clínica CEMIC - Instituto Norpatagónico de Gastroenterología - Neuquén. Investigador Asistente CONICET, Facultad de Ciencias Exactas, Químicas y Naturales. Universidad Nacional de Misiones – Misiones. Daniel Alvarez Fernando Bessone Jefe de la Sección Ecografía de la Fundación Favaloro - C.A.B.A. Profesor Titular de Gastroenterología, Facultad de Medicina de Rosario - Jefe del Servicio de Gastroenterología y Hepatología, Hospital Provincial del Centenario - Rosario - Provincia de Santa Fe. Beatriz Ameigeiras Coordinadora del Grupo de Hepatología del Hospital Ramos Mejía - C.A.B.A. Margarita Anders Médica de Planta Unidad de Trasplante Hepático del Hospital Alemán - C.A.B.A. Oscar Andriani Cirujano Hepatobiliar - Iecur - C.A.B.A. Victoria Ardiles Médica Asociada - Servicio de Cirugía General - Coordinadora del Departamento de Cirugía - Médica del Área de Investigación no esponsoreada - Departamento de Investigación Hospital Italiano de Buenos Aires - C.A.B.A. Mario Arzeno Ex-Jefe de la Unidad de Hígado y Alcoholismo HIGA Oscar Alende - Mar del Plata - Provincia de Buenos Aires. 6 Andrea Bosaleh Patóloga Infantil y de Adulto - Médica Responsable del Banco de Tumores Pediátrico Hospital de Pediatría Prof. Dr. Juan P. Garrahan – C.A.B.A. Gustavo Braslavsky Subjefe del Programa de Trasplante Hepático Hospital General de Agudos Dr. Cosme Argerich - C.A.B.A. Andrés Bruno Médico Hepatólogo del Hospital General de Agudos Dr. Cosme Argerich - Universidad Maimónides - Instituto Médico Alexander Fleming - C.A.B.A. Fernando M. Cairo Director Instituto Buenos Aires de Gastroenterología y Hepatología - Subjefe de Trasplante Hepático Hospital El Cruce - Provincia de Buenos Aires. Staff Unidad de Trasplante Hospital Británico - C.A.B.A. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Cristina Cañero Velasco Valeria Descalzi Médica de Planta del Servicio de Gastroenterología, Hepatología y Nutrición, Médica Hepatóloga Infantil, Médica Docente autorizada UBA, Médica Docente Maestría de Gastroenterología y Hepatología Pediátrica de USAL - C.A.B.A - Hospital de Niños de San Justo - Provincia de Buenos Aires. Jefa de Hepatología de la Unidad de Trasplante Hepático. Instituto de Trasplante Multiorgánico. Hospital Universitario Fundación Favaloro C.A.B.A. Marcela Carballido Oncología Clínica Staff - Hospital de Gastroenterología Dr. Carlos Bonorino Udaondo – C.A.B.A. Melisa Dirchwolf Especialista en Clínica Médica - Hepatología (A.A.E.E.H.). Ex-Concurrente del Servicio de Hepatopatías Infecciosas del Hospital Francisco J. Muñiz - C.A.B.A. Claudio Estepo Rodolfo Cattaneo Hepatólogo - Médico de Planta - Hospital Donación F. Santojanni - C.A.B.A. Jefe Servicio de Gastroenterología, Endoscopía Digestiva y Hepatología - Hospital Rawson Córdoba. Hugo Fainboim Nora Cejas Jefe de la Unidad 4 - Hepatopatías Infecciosas del Hospital Francisco J. Muñiz - C.A.B.A. Hepatóloga del Programa de Trasplante Hepático del Hospital General de Agudos Dr. Cosme Argerich.- C.A.B.A. José Luis Fernández Sara Chao Nora C. Fernández Médico de Planta Servicio de Gastroenterología y Hepatología - HIGA Pte. Perón de Avellaneda Provincia de Buenos Aires. Jefa de Sección Hepatología - Hospital Británico de Buenos Aires - C.A.B.A. Daniel E. Cocozzella Médico de Planta Hospital San Roque de Gonnet y Coordinador de Hepatología Hospital Italiano de La Plata - Provincia de Buenos Aires. Luis Colombato Jefe de Servicio de Gastroenterología - Hospital Británico de Buenos Aires - C.A.B.A. Ariel Cubilla Hepatólogo Sanatorio Güemes. Centro Integral de Gastroenterología - C.A.B.A. Sebastián Ferretti Médico de Planta - Servicio de Gastroenterología y Hepatología Hospital Centenario de Rosario. Médico de Planta - Servicio de Gastroenterología, Hepatología y Trasplante Hepático - Sanatorio Parque - Rosario - Santa Fe. Sebastián Figueroa Hepatólogo, Coordinador de UN.HE.VI. (Unidad de Hepatitis Virales) del Hospital Oñativia - Salta. Médico de Planta - Servicio de Radiología Hospital Nacional Prof. Alejandro Posadas - El Palomar - Provincia de Buenos Aires. Bernardo Frider Jorge Daruich Adrián Gadano Jefe Sección Hepatología - Hospital de Clínicas José de San Martín, Universidad de Buenos Aires. GEDyT (Gastroenterología Diagnóstica y Terapéutica) - C.A.B.A. Jefe de la Sección Hepatología - Hospital Italiano de Buenos Aires - C.A.B.A. Director del Departamento de Hepatología de la Universidad Maimónides - C.A.B.A AAEEH • 7 ASOCIACIÓN ARGENTINA PARA EL Omar Galdame Shigeru Kozima Hepatólogo de Planta de Hepatología y Trasplante Hepático - Hospital Italiano de Buenos Aires. C.A.B.A. Jefe de División Radiología del Hospital General de Agudos “Dr. Cosme Argerich” y Jefe de Departamento de Imágenes de CEMIC - C.A.B.A. Adriana García Diana Krasniansky Médica de Staff del Hospital Británico de Buenos Aires y del Hospital Italiano de Buenos Aires C.A.B.A. Daniel García Médica Especialista en Clínica Médica, Gastroenterología, Hepatología y Trasplante Hepático - Coordinadora de Hepatología Hospital Durand - Staff Hepatología Sanatorio Güemes C.A.B.A. Jefe de Servicio Hepatología - Sanatorio Julio Méndez - C.A.B.A. Graciela Landeira Mercedes García Lombardi Médica de Planta de la Sección Hepatología Hospital Nacional Prof. Alejandro Posadas - El Palomar - Provincia de Buenos Aires. Jefa de Unidad Oncología - Hospital de Niños Dr. Ricardo Gutiérrez - C.A.B.A. Ricardo García Mónaco Profesor Titular de Radiología, UBA - Jefe de Servicio de Diagnóstico por Imágenes del Hospital Italiano de Buenos Aires - Jefe Sección Radiología Vascular e Intervencionista - C.A.B.A. Carlos Garrocho Machado Jefe del Servicio de Gastroenterología y Hepatología - Hospital Centro de Salud Zenon Santillán – Tucumán. Esteban González Ballerga Jefe Consultorio Externo Hospital de Clínicas José de San Martín, Universidad de Buenos Aires - C.A.B.A. Fernando Gruz Médico de Planta de la Unidad de Hepatología y Trasplante Hepático - Hospital Universitario Fundación Favaloro - C.A.B.A. Gisela Gualano Médica de Planta de la Sección Hepatología Hospital Nacional Prof. Alejandro Posadas - El Palomar - Provincia de Buenos Aires. Diana Levi Ex-Médica de Planta de la Sección Hepatología del Hospital de Gastroenterología Dr. Carlos Bonorino Udaondo - C.A.B.A. Oscar Mandó Director de Asistencia Médica - CEMIC - Jefe Sección Hepatología, Departamento Medicina CEMIC. Prof. Asociado Medicina I y II - Instituto Universitario CEMIC (IUC) - CEMIC (Centro de Educación Médica e Investigaciones Clínica “Norberto Quirno”) – C.A.B.A. Estela Manero Médica de Planta de la Sección de Hepatología - Servicio de Gastroenterología - Hospital de Clínicas José de San Martín - Universidad de Buenos Aires - C.A.B.A. Ricardo Mastai Jefe de la Unidad de Trasplante y Hepatología del Hospital Alemán - C.A.B.A. Lucas Mc Cormack Jefe de Cirugía Hepática y Trasplante - Hospital Alemán - C.A.B.A. Carlos Guma Manuel Mendizabal Jefe del Servicio de Gastroenterología del Hospital Eva Perón (Ex-Castex) - Provincia de Buenos Aires. Médico de Planta - Unidad de Hígado y Trasplante Hepático, Hospital Universitario Austral - Pilar - Provincia de Buenos Aires. 8 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Silvia Mengarelli Gustavo Podestá Jefa de Servicio de Clínica Médica y Sección de Hepatología. Profesora Adjunta de la Cátedra de Clínica Médica I - Hospital San Roque - Ministerio de Salud de la Provincia de Córdoba - Facultad de Ciencias Médicas, Universidad Nacional de Córdoba – Córdoba. Jefe del Departamento de Cirugía del Hospital Universitario Austral - Pilar - Provincia de Buenos Aires. Carlos Miguez Médico de Planta - Sección Hepatología del Hospital de Gastroenterología Dr. Carlos Bonorino Udaondo - C.A.B.A. Eduardo Mullen Médico de Planta del Servicio de Patología Hospital Italiano de Buenos Aires - C.A.B.A. Daniel Poncino Médico de Planta - Servicio Hepatología Sanatorio Julio Méndez - C.A.B.A. Sebastián Raffa Médico de Planta de la Unidad de Hígado y Trasplante Hepático - Hospital Universitario Fundación Favaloro - C.A.B.A. María Virginia Reggiardo Médico de la Sección Hepatología - Hospital de Gastroenterología Dr. Carlos Bonorino Udaondo - C.A.B.A. Docente de la Carrera de postgrado de Gastroenterología y Hepatología Universidad Nacional de Rosario. Servicio de Gastroenterología y Hepatología Unidad de Hígado - Hospital Provincial del Centenario Rosario - Santa Fe. Federico Orozco Ezequiel Ridruejo Médico de Planta - Unidad de Hepatología y Trasplante Hepático - Hospital Alemán - C.A.B.A. Médico de Staff - Sección Hepatología, Departamento de Medicina. Centro de Educación Médica e Investigaciones Clínicas Norberto Quirno “CEMIC” - C.A.B.A. - Unidad de Hepatología y Trasplante Hepático - Hospital Universitario Austral - Pilar - Provincia de Buenos Aires. Alberto Muñoz Guillermo Ortiz Especialista en Gastroenterología - Experto en Hepatología - Hepatólogo (A.A.E.E.H.) - Jefe de Hepatología Clínica del Servicio de Trasplante Hepático del Sanatorio Allende - Córdoba Florencia Perazzo Oncóloga Clínica CEMIC - Presidente de la Asociación de Oncología Clínica - C.A.B.A. Gustavo Romero Jefe Sección Hepatología - Hospital de Gastroenterología Dr. Carlos Bonorino Udaondo - C.A.B.A. Andrés Ruf Jefe Servicio - Hospital Italiano - Mendoza Unidad de Trasplante Hepático - Hospital Británico de Buenos Aires - C.A.B.A. Juan P. Perotti Gabriela Ruffillo Especialista en Diagnóstico por Imágenes Hospital Universitario Austral - Pilar - Provincia de Buenos Aires. Médica de Planta de la Sección Hepatología Hospital Nacional Prof. Alejandro Posadas - El Palomar - Provincia de Buenos Aires. Federico Piñero Pablo Sánchez Médico Hepatólogo - Unidad de Hígado y Trasplante Hepático - Hospital Universitario Austral - Pilar - Provincia de Buenos Aires. Jefe de Departamento de Cirugía Abdominal y Proctología - Instituto de Oncología Ángel Roffo C.A.B.A. Roberto Pérez Ravier AAEEH • 9 ASOCIACIÓN ARGENTINA PARA EL Teresa Schroder Guillermo Tsariktsian Médica de Planta de la Unidad 4 - Hospital Francisco J. Muñiz - C.A.B.A. Médico Coordinador Sección Hepatología Clínica del Hospital General de Agudos Dr. Cosme Argerich - C.A.B.A. Marcelo Silva Jefe de Hepatología y Trasplante Hepático del Hospital Universitario Austral - Pilar - Provincia de Buenos Aires. Carlos Vigliano María Ester Sirotinsky Alejandra Villamil Director Centro de Estudios Digestivos - CEDIG Comodoro Rivadavia - Chubut. Médica de Planta Sección de Hígado y Trasplante Hepático - Hospital Italiano de Buenos Aires C.A.B.A. Jefe de Servicio Anatomía Patológica - Hospital Universitario Fundación Favaloro - C.A.B.A. Juan A. Sordá Jefe División Gastroenterología - Hospital de Clínicas - Universidad de Buenos Aires - C.A.B.A. Juan C. Spina Médico Especialista en Diagnóstico por Imágenes - Hospital Italiano de Buenos Aires y Hospital Británico de Buenos Aires - C.A.B.A. Francisco Suárez Anzorena Jefe de División de Radiología Intervencionista del Departamento de Imágenes del Hospital de Clínicas José de San Martín - Universidad de Buenos Aires - C.A.B.A. 10 Mariano Volpacchio Jefe de Resonancia del Área de Cuerpo del Centro de Diagnóstico Dr. Enrique Rossi. Jefe de Tomografía Computada del Hospital de Clínicas José de San Martín - C.A.B.A. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Módulo Epidemiología AAEEH • 11 ASOCIACIÓN ARGENTINA PARA EL 12 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Epidemiología en el mundo Dres Luis Colombato, Beatriz Ameigeiras, Roberto Pérez Ravier Dimensión del problema: El HCC es un problema mayor de Salud Publica Mundial: es el 5to cáncer más frecuente y segundo como causa de muerte por neoplasia. La incidencia crece desde que existe registro: actualmente es de 16/100.000 habitantes por año. Representa 7% de todos los cánceres (1). En hepatología, constituye el 95% de las neoplasias hepáticas y la 1ª causa de muerte por enfermedad hepática (2). Ocupa un lugar preponderante entre las indicaciones de trasplante hepático. Epidemiologia general. El mayor factor de riesgo de HCC es la presencia de cirrosis, de cualquier etiología (ej. hemocromatosis, déficit de α−1antitripsina, hepatitis autoinmune, CBP). Sin embargo, la epidemiología del HCC en el mundo está determinada por 3 etiologías dominantes: la hepatitis por virus B (HBV), responsable de 54% de los casos, la hepatitis C (HCV) 31% y la cirrosis alcohólica: 15% (1-4). Un tercio de los pacientes cirróticos desarrolla HCC, (incidencia anual: 1 a 8%) predominante en sexo masculino 2 a 4:1. El pico de incidencia se alcanza a los 65 años. A mayor fibrosis hepática, mayor presión portal y severidad de la cirrosis, mayor probabilidad de HCC (2,3-5). En hepatitis B, los factores de riesgo de HCC son la elevada viremia, HBeAg+ y el genotipo C. En hepatitis C, el riesgo mayor es el genotipo 1 (2-5). En hepatitis C y alcohol, el desarrollo de HCC ocurre sobre cirrosis establecida (riesgo: 15 a 20:1 y 10:1 vs controles, respectivamente) (1,3). En hepatitis B, en cambio, el riesgo de HCC lo confiere la infección por virus B y no el estadio cirrótico (100:1 vs individuo no infectado), lo que explica que 15-20% de los casos de HCC en pacientes con hepatitis B ocurren en fase no-cirrótica. La curación de hepatitis C y negativización de viremia en hepatitis B con tratamiento antiviral no anula el riesgo de HCC en pacientes F3 y cirróticos. Factores con impacto en la epidemiología Aflatoxina B1 del hongo Aspergillus flavus. Contamina granos, cereales, legumbres y frutos secos. Es el factor ambiental más importante. Produce una mutación característica en el gen supresor de tumores p53 (3). Actúa como cocarcinógeno. En hepatitis B aumenta la incidencia de HCC 9 veces (900%). Se le atribuye un rol en la temprana edad de aparición de HCC en Africa y Asia. Se ha reportado incidencia de HCC aumentada 4 veces en individuos con aflatoxina B1 en orina en ausencia de otro factor etiológico (4). Un cambio de alimentación libre de aflatoxina programado en Jiangsu (China) parece haber contribuido a disminuir la incidencia de HCC (3). Síndrome metabólico. La esteatohepatitis no alcohólica (EHNA) puede evolucionar a cirrosis y HCC. Por su parte la obesidad (IMC >35) aumenta la mortalidad por HCC en 5 veces. Una variante del gen adiponutrina, asociada a EHNA aumenta la posibilidad de HCC en 12 veces (9). Este hallazgo confirma el potencial carcinogénico del sindrome metabólico/EHNA y explica la posibilidad de desarrollo de HCC en hígado graso sin cirrosis. La diabetes mellitus duplica el riesgo de HCC en todas las etiologías de cirrosis (8). Asimismo, 20% de pacientes con HCV asocian EHNA lo cual aumenta el riesgo de desarrollar HCC. Mecanismo carcinogénico. Cada etiología de HCC tiene mecanismos carcinogénicos propios: HBV, aflatoxina, y EHNA producen mutaciones por acción directa, (indepen dientes de la presencia de cirrosis) cada uno con distinta tasa de transformación neoplásica. Más aún, se ha descripto un patrón y topografía de integración del genoma viral distinto en HBV, responsable de HCC de comienzo temprano (i.e. < 30 años) (2-6). AAEEH • 13 ASOCIACIÓN ARGENTINA PARA EL Coexistencia de etiologías: La coinfección HBV/ HDV incrementa el riesgo de HCC de 2 a 6 veces, la coinfección HBV/HCV de 2 a 4 veces y la de HBV + alcohol 2 a 4 veces. Distribución geográfica heterogénea. La mayor incidencia de HCC corresponde a áreas endémicas de infección por HBV. El 85% del total de HCC ocurre en Asia, África subsahariana y Melanesia. China registra la mitad de todos los HCC. Senegal, Gambia y Corea del Sur presentan elevada incidencia anual >30 casos/100.000. Más de 70% de los HCC están ligados a HBV y 20% a HCV en estas regiones. La transmisión vertical e infantil del HBV y la aflatoxina condicionan el desarrollo de HCC en población joven. En cambio, Norteamérica, el norte de Europa y Oceanía presentan baja incidencia de HCC (5/100.000), el cual se asocia a HCV en 60-70%, alcohol en 20% y HVB en 10-20%. Dinámica de las tendencias epidemiológicas Japón. La incidencia de HCC aumentó durante 2 décadas, a expensas de HCC asociado a HCV (genotipo 1b), lo que contrasta con la baja prevalencia de HCV en población general (1.4%). El subanalisis poblaciónal según edad identifica niveles epidémicos de HCV, (7% de prevalencia de HCV e incidencia de HCC >150/100.000) en el grupo etario entre 70 y 79 años. El estudio filogenético de la variante viral involucrada (secuenciación nucleotídica) permitió definir 2 periodos de propagación de la infección HCV: el primero en los 1920s asociado a tratamiento de Schistosoma japonicum y otro en los 1940s asociado a la guerra mundial y a incremento de intervenciones parenterales (12). Taiwan. Zona endémica de HBV. Tiene un lugar en la Historia de la Medicina por la exitosa prevención primaria de HCC mediante vacunación HBV (ademas de haber demostrado por primera vez la etiología viral de una neoplasia) (10). En la actualidad el Programa Nacional de tratamiento antiviral HCV/HBV redujo la incidencia de HCC 14 14% y la mortalidad por HCC en 24% entre 2000 y 2011 (11). Sur de Europa. Registra aumento de la incidencia de HCC (10.5/100.000) asociado a HCV. La proporción etiológica actual es HCV 70%, HBV 10-15%, alcohol 20%. El estudio filogenético comprobó que el virus C circuló epidémicamente entre 194060, sobre todo en Italia, Francia y España (12). El periodo de propagación viral se ubica en los 1940s coincidiendo con la guerra civil española, segunda guerra mundial, el uso de agujas compartidas en vacunas y penicilina e intervenciones médicas. Esta diseminación del HCV precedió en 2 décadas a la ocurrida en los demás países. Contrasta con la baja incidencia de HCC en el Norte de Europa y Dinamarca en particular, la cual ofrece cifras de HCC inferiores a las esperables, hecho que se ha atribuido a severo alcoholismo continuo y aumento de muerte por complicaciones de cirrosis. América del Norte. La etiología de HCC está asociada a HCV en 50-60%, HBV 20% y alcohol 20% (1). Actualmente registra un ascenso de HCC asociado a HCV genotipo 1a. El estudio filogenético viral ubica la propagación del HCV en EEUU entre 1950-1970 (12), lo cual coincide con (a) estudios demográficos que señalan a la generación de “baby boomers”, (nacidos entre 1945 y 1965 que representan el 27% de la población pero comprenden 75% de las hepatitis C), (b) con el aspecto epidemiológico de incremento de inyección parenteral, UDE y transfusiones. Otros 2 factores concurren al aumento de la incidencia de HCC: la epidemia de obesidad, sindrome metabólico y EHNA con evidencia creciente de HCC asociado a EHNA como único factor etiológico o como cofactor de HCV. Por último, la inmigración asiática e hispana, registra tasas de HCC superiores a la de la población norteamericana. HCC es el cáncer con mayor incremento de incidencia en contraste con el descenso de las restantes neoplasias. El Hospital de Veteranos reporta que 67% de los HCC se asocian a HCV + EHNA y que la mortalidad por HCC se triplicó entre 2001-2013 (de 13 a 37/100.000) (14) . Se estima que el pico de incidencia de HCC por HCV ocurrirá en 2020-21 en EEUU y 2032 en Canadá. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Referencias 1. European Association for the Study of the Liver, European Organisation for the Research and Treatment of Cancer. “EASL-EORTC Clinical Practice guidelines: Management of hepatocellular carcinoma” J Hepatol 2012;56:908-943 2. Nault JC. Pathogenesis of hepatocellular carcinoma according to aetiology” Best Practice & Research Clinical Gastroenterology 2014:28;937-947 3. El Serag HB. Hepatocellular carcinoma. N Engl J Med 2011;365:11181127 8. El–Serag HB, Hampel H and Javadi F. The association between diabetes and hepatocellular carcinoma: a systematic review of epidemiologic evidence. Clin Gastroenterol Hepatol 2006;4:369–380. 9. Liu YL, Patman GL, Leathart JB, et al. Carriage of PNPLA3 rs738409 C>G polymorphism confers an increased risk of non alcoholic fatty liver disease associated HCC. J Hepatol 2014;61:75-81. 10. Beasley RP. Hepatitis B virus. The major etiology of hepatocellular carcinoma. Cancer 1988;61:1942-1956. 4. Fattovich G, Stroffolini T, Zagni I, et al. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology 2004;127:S35–S50 11. Chiang C, Yang Y, Chen J, et al. Significant reduction in end-stage liver diseases burden through the national viral hepatitis therapy program. Hepatology 2015;61:1154-1162. 5. El–Serag HB and K. Inhard Rudolph. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology 2007;132:2557–2576. 12. Yan H, Yang Y, Zangh L, et al. Characterization of genotype and integration patterns of hepatitis B virus in early- and late- onset HCC. Hepatology 2015;61:1821-1831. 6. Londoño MC, Abraldes JG, Altamirano J, et al. Clinical trial watch: Reports from the AASLD Liver Meeting, Boston, November 2014. J Hepatol 2015;62:1196-1203 13. Tanaka Y, Kurbanov F, Mano S, et al. Molecular tracing of the global hepatitis C virus epidemic predicts regional patterns of hepatocellular carcinoma mortality. Gastroenterology 2006;130:703–714 7. Calle E, Rodriguez C, Walker-Thurmond K, et al. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med 2003;348:1625-1638 14. Beste SA, Leipertz SL, Green PK, et al. Trends in the burden of cirrhosis and hepatocellular carcinoma by underlying liver disease in US Veterans from 2001-2013. Gastroenterology 2015 (in press). 1 2 AAEEH • 15 ASOCIACIÓN ARGENTINA PARA EL 16 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Epidemiología del Hepatocarcinoma en Argentina y America Latina Dres Gabriela Ruffillo, Carlos Garrocho Machado, María Esther Sirotinsky El hepatocarcinoma (HCC) es la segunda causa de muerte por cáncer entre los hombres en los países en vías de desarrollo, y la sexta causa en los países más desarrollados. Según datos del programa GLOBOCAN 2012, de la International Agency for the Research on Cancer, de la Organización Mundial de la Salud, durante el año 2012 se registraron 782.500 nuevos casos de cáncer hepático primario y 745.500 muertes, teniendo China aproximadamente el 50 % del total del número de casos y muertes (1). Los principales factores de riesgo son la hepatitis B, hepatitis C y la cirrosis por alcohol. La incidencia de HCC y la mortalidad asociada están aumentando en países de América como resultado de un envejecimiento de la cohorte infectada por hepatitis C hace 3-4 décadas, y se espera un continuo aumento en el mediano plazo de casos asociados a hígado graso no alcohólico (HGNA) como consecuencia de la epidemia de obesidad (2). hombres. Las causas principales fueron HCV y alcohol. En otro estudio del mismo país, se analizó una serie de 127 pacientes con HCC, aunque los estudios etiológicos sólo se completaron en 71 pacientes. Se observó hepatitis C en 60% (aislada en 45%, asociada a alcohol en 15%), hepatitis B en 8%, coinfección HBV-HCV en 13% y alcoholismo como único factor en 8% (6). En una encuesta retrospectiva realizada en 19 centros de Brasil se analizó la etiología en 287 pacientes con HCC, observándose que 42% eran portadores de HBsAg, 27% tenían anti-HCV, 4% de ellos, coinfección HCV-HBV e historia de alcoholismo crónico en 37% (7). La información acerca de la prevalencia e incidencia y factores de riesgo para HCC en Latinoamérica (LA) es escasa. Se considera que la incidencia es baja (3) y esto se relaciona con una baja prevalencia de portadores crónicos de HBV en la mayoría de sus países (4). Otro estudio de Brasil, más reciente, evaluó aspectos epidemiológicos en 1405 pacientes con HCC de diversas regiones de dicho país. Se demostró un predominio de la hepatitis C, con más de 55% de los casos en las zonas sur y sureste, mientras que en el norte y noroeste estaba presente en menos de 50% de los casos, seguido por la hepatitis B (22-25%). En cambio, en la región medio-occidental el HBV fue la principal etiología (40%), seguida por HCV (30%) (8) . La diferencia en las etiologías del HCC refleja probablemente la prevalencia variable del HBV en Brasil, existiendo un área hiperendémica en la cuenca del Amazonas (9). En un estudio realizado en México, fue analizado el HCC como causa de muerte. Hallaron un incremento de la tasa de mortalidad general por HCC de 4.1/100.000 en el año 2000 a 4.7/100.000 en el 2006 (5). La mortalidad fue mayor en la población de más de 60 años, con mayor proporción de Un reciente estudio prospectivo epidemiológico de Brasil (10) evaluó la incidencia de HCC y factores de riesgo en una gran cohorte de pacientes cirróticos con un seguimiento por diez años (1998-2008). Sobre 884 pacientes con cirrosis compensada, 72 (8.1%) desarrollaron HCC con una media de AAEEH • 17 ASOCIACIÓN ARGENTINA PARA EL tiempo para el diagnostico de 21 meses. Se halló que la incidencia anual fue del 2.9%, con una incidencia acumulativa de 14.3% a los cinco años. Al considerar los diferentes grupos etiológicos, la incidencia acumulativa a 5 años fue de 16.9% en hepatitis C, 15.3% en la hepatitis B, 5.7% en cirrosis alcohólica, 4% en la esteatohepatitis no alcohólica y 7.9% para el grupo de misceláneas. La edad media en el tiempo del diagnóstico fue de 57 años, con mayor incidencia para el sexo masculino que para el femenino (10). En Chile, en una serie de 50 pacientes con HCC se demostró hepatitis C en 48% (11). En Perú, entre 136 pacientes con HCC, se observo hepatitis B en 63% (12). Recientemente, la Asociación Latinoamericana para el Estudio del Hígado (ALEH) organizó un estudio prospectivo con el objetivo primario de conocer la prevalencia de las diferentes etiologías de hepatopatía en pacientes con HCC de sus países miembros. Los objetivos secundarios fueron describir la estadificación y analizar qué porcentaje de pacientes accedían a tratamiento. El enrolamiento de pacientes se extendió durante 18 meses, período en el cual se registraron 240 pacientes con HCC de 9 diferentes países, principalmente de Argentina, Brasil, Venezuela y Colombia (13). Los rasgos demográficos fueron similares a los descriptos en Occidente, con una edad mediana de 64 años (rango intercuartil 5772) y un predomino del género masculino (72.5%, con una relación masculino: femenino de 2.6). En 205 casos (85.4%), los pacientes tenían una cirrosis subyacente. Las etiologías de hepatopatía crónica más frecuentemente observadas en el estudio prospectivo de la ALEH de Fassio et al fueron hepatitis C, presente en 38% de los casos, alcoholismo crónico en 28%, criptogénica en 15%, hepatitis B en 14% (13). No hubo diferencias significativas en la edad de presentación entre los principales grupos etiológicos. En cambio, se observaron diferencias en la relación de sexos: masculino en 94%, 93% y 85% de los casos atribuibles a alcohol, HCV más alcohol y HBV, respectivamente; comparado con 59% y 60% de aquellos secundarios a hepatitis C “pura” y cirrosis criptogénica, respectivamente (p < 0.001) (13). 18 Situación en Argentina Según datos extraídos de la página web del programa GLOBOCAN, la incidencia anual de cáncer hepático en ambos sexos en Argentina fue de 4.7/100000 habitantes en el año 2008 y de 4.6/100000 habitantes en el año 2012 (1) Sin embargo, estos datos son muy limitados, están basados en los certificados de defunción, que pueden no ser tan precisos en nuestro medio; y no permiten aseverar si se están produciendo cambios en la incidencia. Desde hace pocos años, existe un Instituto Nacional del Cáncer en Argentina, pero no se ha organizado por el momento un registro dedicado a casos de HCC. Con respecto a la prevalencia relativa de las diferentes etiologías entre los casos de HCC, un primer estudio retrospectivo efectuado por Findor et al. analizó este aspecto en una serie de 216 pacientes estudiados en 9 centros terciarios, dedicados a la Hepatología (14). Se observó un predominio de la hepatitis crónica C, presente en 39% de los casos (asociado a alcoholismo crónico en 20%), seguido de la hepatitis crónica B, en 20% (asociado a alcoholismo crónico en 7%), alcoholismo crónico como único factor de riesgo en 16%, criptogénica en 12% y porcentajes menores para la hepatitis autoinmune, hemocromatosis y cirrosis biliar primaria. Son hallazgos llamativos en este estudio la alta prevalencia de hepatitis B (en un país con una baja prevalencia de portadores crónicos del HBV) y el bajo porcentaje de cirrosis alcohólica. Los datos podrían tener el sesgo de haber investigado una población muy seleccionada por la participación de centros terciarios, muy especializados; y además, por tratarse de un estudio retrospectivo (14). Con la intención de evitar el sesgo de la inclusión exclusiva de pacientes de centros terciarios, en el segundo estudio retrospectivo realizado en el país, se invitó a participar a 30 centros de hospitales generales, Servicios de Gastroenterología y de Hepatología, distribuidos en todo el país (10 de la ciudad de Buenos Aires, 20 de 8 diferentes provincias); con el objetivo primario de describir los rasgos demográficos de los pacientes con HCC de Argentina y sus factores etiológicos. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Finalmente, aceptaron participar 15 centros (8 de Buenos Aires y gran Buenos Aires, 7 del interior del país). Se analizó una serie de 587 pacientes consecutivos con HCC, con edad mediana de 62 años (rango intercuartil 55–68), género masculino en 72%, cirrosis subyacente en 93% (15). Las 2 causas principales de hepatopatía crónica fueron alcoholismo crónico, presente en 42% de los casos y hepatitis C, observada en 40%; seguidas por la hepatitis B, en 13% y la cirrosis criptogénica, en 9%. No se observaron diferencias significativas en la edad de presentación entre los diferentes grupos etiológicos. En cambio, el porcentaje de género masculino fue significativamente mayor en los grupos de cirrosis alcohólica (93%), HCV más alcohol (94%) y hepatitis B (87%), que en los de cirrosis criptogénica (63%) y hepatitis C (49%) (p < 0.01) (15). Un hallazgo interesante de este estudio es que, al separar a los pacientes en 2 grupos, aquellos incluídos por centros de trasplante hepático versus enrolados por sitios que no hacían trasplante, se demostró una diferencia significativa en las principales etiologías: HCV y alcohol estaban presentes en 53 y 16% de los casos, respectivamente, en los centros de trasplante; y en 34 y 48% en los de no trasplante (15). Este resultado explica los hallazgos del primer estudio, de Findor et al: aunque la hepatitis C y la cirrosis alcohólica son las 2 causas más frecuentes de HCC en nuestro país, cuando la serie es recopilada por hepatólogos, suele haber un franco predominio del HCV; mientras que si comprende también a hospitales generales, aumenta la frecuencia de casos de cirrosis alcohólica. Sin embargo, este estudio también puede tener los déficits de una evaluación retrospectiva. En el estudio prospectivo coordinado por la ALEH durante 18 meses, 90 pacientes fueron incluídos desde Argentina. Entre ellos, 44% tenían hepatitis C; 35%, alcoholismo crónico; 14%, cirrosis criptogénica/ esteatohepatitis no alcohólica; 9%, hepatitis B. Al tratarse de un estudio prospectivo con inclusión de casos incidentes durante el período, estos porcentajes podrían ser los que mejor reflejen la realidad actual de nuestro medio. Finalmente, otro estudio retrospectivo, observacional y descriptivo fue realizado en la región de la Patagonia, incluyendo 83 pacientes con HCC, 79.5% varones, con una edad media de 62 años (rango 47-83). El 98% de los pacientes presentaban cirrosis hepática. La etiología de la cirrosis fue alcohólica en 51%, HCV en 28%, criptogénica en 8%, HBV en 5% y porcentajes menores de cirrosis biliar primaria, hemocromatosis y HCV más alcohol (16). Según las bases de datos de la DEIS (Dirección de Estadística e Información de Salud), entre las causas de muerte por cáncer según las regiones geográficas en el año 2013, el cáncer de hígado y vías biliares ocupó el 7° lugar para la zona del NOA y el 8° para la región de Cuyo (17). Se puede concluir afirmando que en Argentina, el HCC se observa principalmente en pacientes con cirrosis asociada a hepatitis crónica C y a alcoholismo crónico, entre ambas causas representan aprox. 76 % de los casos, ocupando la cirrosis criptogénica el 3° lugar y la hepatitis crónica B el 4° lugar, como ocurre en países con baja endemicidad del HBV. La edad en el tiempo del diagnóstico es entre los 60-70 años, siendo más común en hombres (relación de sexos M:F 2.6). No se cuenta con datos certeros sobre cambios en la incidencia. En el resto de países de América Latina, aunque los datos son limitados, la mayoría de los casos de HCC se originan en la cirrosis por HCV o por alcohol, con la excepción de Perú y algunas regiones de Brasil, donde aumenta la prevalencia de hepatitis B. AAEEH • 19 ASOCIACIÓN ARGENTINA PARA EL Referencias 1. Torre LA, Bray F, Siegel RL, et al. Global Cancer Statistics, 2012. Ca Cancer J Clin 2015;65:87-108. 2. Méndez Sánchez N, Ridruejo E, Alves de Mattos A, et al. Latin American Association for the Study of the Liver (LAASL) Clinical Practice Guidelines: Management of Hepatocellular Carcinoma. Ann Hepatol 2014;13(supl.1): S4-S40. 3. Bosch Fx, Ribes J, Díaz M, Cléries R. Primary liver cancer: worldwide incidence and trends. Gastroenterology 2004;127(Suppl.1):S5-S16. 4. Fay OH. Hepatitis B in Latin America: epidemiological patterns and eradication strategy. The Latin American Regional Study Group. Vaccine 1990;8 Suppl:S100-S106. 5. Méndez Sánchez N, Villa AR, Vazquez Elizondo G, et al. Mortality trends for liver cancer in Mexico from 2000 to 2006. Ann hepatol 2008;7:226-229. 6. Mondragón Sánchez R, Garduño López Al, Hernández Castillo E, et al. Hepatocellular carcinoma and hepatitis C in México. Hepatogastroenterology 2005; 52:1159-1162. 7. Goncalves CS, Pereira FE, Gayotto LC. Hepatocellular carcinoma in Brazil: report of a national survey (Florianopolis, SC, 1995). Rev Inst Med Trop Sao Paulo 1997;39:165-70. 8. Paranaguá Vezozzo DC, Ono SK, Alvarado Mora MV, et al. Epidemiology of HCC in Brazil: incidence and risk factors in a ten-year cohort. Ann Hepatol 2014;13:386-393. 9. Parana R, Almeida D. HBV epidemiology in Latin America. J Clin Virol. 2005;349:S130–133. 10. Carrilho FJ, Kikuchi L, Branco F. Clinical and epidemiological aspects of hepatocellular carcinoma in Brazil. Clinics (Sao Paulo) 2010;65:12851290. 11. Muñoz G, Velazco M, Thiers V, et al. Prevalence and genotypes of hepatitis C virus in blood donors and in patients with chronic liver disease and hepatocarcinoma in a Chilean population. Rev Med Chil 1998;126:1035-1042. 12. Ruiz E, Almonte M, Pizarro R, et al. Hepatitis B and C virus infection as risk factors for hepatocarcinoma in Perú: case and control study. Rev Gastroenterol Peru 1998;18:199-212. 13. Fassio E, Diaz S, Santa C, et al. Etiology of hepatocellular carcinoma in Latin America: prospective, multicenter, international study. Ann Hepatol 2010;9:63-69. 14. Findor JA, Tanno H, Villamil F, et al. Risk factors in hepatocellular carcinoma in Argentina. Hepatology 1998; 28:760A. 15. Fassio E, Míguez C, Soria S, Palazzo F, Gadano A, Adrover R, Landeira G, et al. Etiology of hepatocellular carcinoma in Argentina: results of a multicenter retrospective study. Acta Gastroenterol Latinoamer 2009; 39:47-52. 16. Sirotinsky ME, Mármol LA, Allevato JA, et al. Carcinoma hepatocelular en la Patagonia Argentina. Acta Gastroenterol Latinoamer 2013; 43(Supl.1):S7 17. Instituto Nacional de cáncer. Bases de datos de la DEIS Argentina 2013. 1 2 20 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Hepatocarcinogénesis y Factores de Riesgo en Hepatocarcinoma por Virus B de Hepatitis Dres Hugo Fainboim Manuel Mendizabal, Alberto Muñoz Se considera que, en el mundo, aproximadamente el 50% de los hepatocarcinomas (HCC) están relacionados al virus B de la hepatitis (HBV). Este porcentaje varía considerablemente en diferentes áreas geográficas, de acuerdo a la prevalencia de portadores crónicos del HBV en las mismas (1,2). En nuestro país, considerado de baja endemicidad para el HBV, la prevalencia de HCC es menor a la descripta en zonas de alta endemicidad, como los países del sudeste asiático (3). En un estudio retrospectivo sobre 551 pacientes con HCC realizado en Argentina, el HBV fue la tercera causa de HCC, por detrás del virus C y el consumo de alcohol (4). El HBV como causa de HCC se observó en el 10% de los pacientes; la asociación de HBV y alcohol en un 2.2% y de HBV-HCV en 1.7%; por lo tanto, el HBV estuvo presente, ya sea solo o asociado a otras etiologías, en el 14.1% de los HCC. La edad media fue de 60 años con un rango intercuartil de 51 a 67.5 años y un franco predominio de hombres: 87.3%. En otro estudio (5) , en centros de trasplante hepático, la presencia del HBV se observó en el 11% de los pacientes (141 pacientes con HCC). En nuestro medio, se desconocen los porcentajes de incidencia de HCC en la población infectada por HBV. El mecanismo oncogénico del HBV se encuentra asociado a dos vías: indirecta y directa. La primera está relacionada con la forma continua o recurrente de fases de necroinflamación, con la consecuente promoción al pasaje de hepatitis crónica a cirrosis. Esta vía es la más importante, pues el 80-90% de los HCC se presentan en estadío de cirrosis. Por la otra vía, el virus “per se” puede causar HCC en ausencia de cirrosis por la capacidad de integrarse al genoma del huésped permitiendo la persistencia viral, la inducción de alteraciones genéticas y la producción de proteínas como la X y la pre-S-S truncadas, todas con poder oncogénico (6). Factores de riesgo para facilitar el desarrollo de HCC: Cirrosis: es el factor de riesgo más importante. A diferencia de lo que ocurre en países orientales, la incidencia en países occidentales está evaluada en pocos estudios y con escasa cantidad de pacientes. Los datos muestran una incidencia de HCC en cirrosis de 2.2 por 100 personas/año versus 0.02 y 0.3 en portadores inactivos y en hepatitis crónica, respectivamente (7). En Buenos Aires, en un estudio prospectivo realizado en portadores inactivos, la incidencia fue del 0% (8). Edad: En pacientes con cirrosis, la edad mayor a 40 años está fuertemente asociada a riesgo de HCC. Esto podría deberse al tiempo habitualmente requerido para el desarrollo de cirrosis (1). Sexo: El riesgo es mayor en hombres que en mujeres, con una relación hombre/mujer que oscila entre 2/1 a 4/1 (1). Alcohol/Diabetes/ Obesidad/Esteatosis: Todos ellos favorecen el desarrollo de HCC, quizás por la producción de fibrosis por el alcohol y/o el síndrome metabólico (9-12) . Historia familiar: el antecedente de HCC en familiares de primer grado aumenta riesgo 2 a 3 veces para el desarrollo de HCC (13). Factores relacionados al virus: HBV-DNA y HBsAg cuantitativo: En el estudio REVEAL se realizó el seguimiento de portadores de HBV no cirróticos durante una mediana de 11.4 años. La incidencia de HCC fue: 108/100000 personas/año en pacientes con carga viral (CV) <300 cps/ml versus 962/100.000 en pacientes con CV entre 100.000 -999.900 cps / ml versus 1152/100.000 en CV >1.000.000 cps/ ml (14). Los niveles de HBsAg pueden ser útiles en pacientes HBeAg (-) con HBV-DNA < 2000 UI/ml: los que presentan HBsAg > 1000 UI/ml tienen 13,5 veces más riesgo de HCC en relación a los que presentan HBsAg por debajo de 1000 UI/ml (15). AAEEH • 21 ASOCIACIÓN ARGENTINA PARA EL Genotipos: El genotipo C es el más relacionado con el HCC pero, en nuestro país, está solamente asociado a inmigrantes del Sudeste asiático. En relación a nuestro genotipo prevalente (F), hay pocos datos bibliográficos y experiencia en nuestro medio como para establecer una relación; sólo en Alaska se observó una posible asociación de este genotipo y HCC (16). Coinfección: La coinfección con HIV y con virus D pueden provocar aceleración en la aparición del HCC (17). Para la asociación con HCV, su importancia es menos clara (18). los diferentes grupos (24). Los más utilizados son los descriptos en la siguiente tabla. Estos scores tienen en general un valor predictivo negativo mayor al 95% para los siguientes 3 años. Es necesario desarrollar fórmulas para aquellos pacientes que se encuentren bajo tratamiento médico. Temas pendientes • Rol del genotipo F en la incidencia de HCC. Por el contrario hay factores que disminuirían la progresión a HCC: Los más mencionados son: Ingesta de café (19), dieta mediterránea (20), uso de estatinas (21) y tratamiento con análogos nucleós/ tidos (22,23). Teniendo en cuenta los factores independientes de riesgo mencionados, se han desarrollado diferentes scores pronósticos, que permitirían adecuar los tiempos de controles en • Necesidad de conocer datos de incidencia de HCC en nuestro país en diferentes poblaciones. • Conocer el rol de de los diferentes “scores” en nuestra población y en pacientes tratados con análogos nucleos/tidos. • Incorporar los resultados de la elastografía hepática en los diferentes scores pronósticos. Referencias 1. Nguyen VT, Law MG, Dore GJ. Hepatitis B related hepatocellular carcinoma: epidemiological characteristics and disease burden. J Viral Hepat 2009;16:453–463. 2. Sherman M. Hepatocellular carcinoma: epidemiology, risk factors, and screening. Semin Liv Dis 2005;25:143-154. 3. Kemp W, Pianko S, Nguyen S, Bailey MJ, Roberts SK. Survival in hepatocellular carcinoma: impact of screening and etiology of liver disease. J Gastroenterol Hepatol 2005;20:873-881. 4. Fassio E, Míguez C, Soria S, et al. Etiology of hepatocellular carcinoma in Argentina: results of a multicenter retrospective study. Acta Gastroenterol Latinoamer 2009;39:47-52 5. Piñero F, Andriani O, de Ataide EC. Liver Transplantation for Hepatocellular Carcinoma: Results from a First Multicenter Latin-American Cohort Study. ILTS 21st Annual International Congress. Julio 2015 6. Bréchot C, Gozuacik D, Murakami Y, Paterlini-Bréchot P. Molecular bases for the development of hepatitis B virus (HBV)-related hepatocellular carcinoma (HCC). Semin Cancer Biol 2000;10:211–231. 7. Fattovich G, Bortolotti F, Donato F. Natural history of chronic hepatitis B: special emphasis on disease progression and prognostic factors. J Hepatol 2008;48:335–352. 8. Paz S, Alvarez E, Schroder T, et al. History of hepatitis B chronic inactive carriers: lack of reactivation, progression and hepatocarcinoma during the follow up. AASLD 2012 P 317 13. Volk M, Lok A. Is family history of liver cancer a risk factor for hepatocellular carcinoma? J Hepatol 2009;50:247-248. 14. Chen CJ, Yang HI, Su J, Jen CL, You SL, Lu SN, Huang GT, Iloeje UH, REVEAL-HBV Study Group. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA. 2006;295:65-73. 15. Tseng TC, Liu CJ, Yang HC, et al. High levels of hepatitis B surface antigen increase risk of hepatocellular carcinoma in patients with low HBV load. Gastroenterology 2012;142:1140–1149. 16. Livingston S, Simonetti J, McMahon B, et al. Hepatitis B virus genotypes in Alaska native people with hepatocellular carcinoma: preponderance of genotype F. J Infect Dis 2007; 195:5–11. 17. Bonacini M, Louie S, Bzowej N, Wohl AR. Survival in patients with HIV infection and viral hepatitis B or C: a cohort study. AIDS 2004;18:2039– 2045. 18. Zarski JP, Bohn B, Bastie A, Pawlotsky JM, Baud M, Bost-Bezeaux F, et al. Characteristics of patients with dual infection by hepatitis B and C viruses. J Hepatol 1998;28:27–33. 19. Gelatti U, Covolo L, Franceschini M, et al Coffee consumption reduces the risk of hepatocellular carcinoma independently of its aetiology: a case-control study. J Hepatol 2005;42;528-534. 20. Turati F, Trichopoulos D, Polessei J, et al. Mediterranean diet and hepatocellular carcinoma. J Hepatol 2014;60:606-611. 9. Lin CW, Lin CC, Mo LR, et al. Heavy alcohol consumption increases the incidence of hepatocellular carcinoma in hepatitis B virus –related cirrhosis. J Hepatol 2013;58:730-735. 21. Tsan YT, Lee CH, Wang JD, et al Statins and the risk of hepatocellular carcinoma in patients with hepatitis B virus infection. J Clin Oncol 2012;30:623-630. 10. Marchesini G. Diabetes and hepatocellular cancer risk: Not only a matter of hyperglycemia. Hepatology 2012;55:1298–1300. 22. Papatheeodoridis GV, Lampertico P, Manolakopoulos S, et al. Incidence of hepatocellular carcinoma in chronic hepatitis B patients receiving nucleos(t)ide therapy: A systematic review. J Hepatol 2010;53:348-356. 11. Wang P, Kang D, Cao W, Wang Y, Liu Z. Diabetes mellitus and risk of hepatocellular carcinoma: a systematic review and meta-analysis. Diabetes Metab Res Rev 2012;28: 109-122. 12. Welzel TM, Graubard BI, Zeuzem S, El-Serag HB, Davila JA, McGlynn KA. Metabolic syndrome increases the risk of primary liver cancer in the United States: a study in the SEER-Medicare database. Hepatology 2011;54:463-471. 22 23. Hosaka T, Suzuki F, Kobayashi M, Seko Y, Kawamura Y, Sezaki H, et al. Long term entecavir treatment reduces hepatocellular carcinoma incidence in patients with hepatitis B virus infection. Hepatology 2013;58:98–107. 24. Wong VW, Janssen HL. Can we use HCC risk scores to individualize surveillance in chronic hepatitis B infection? J Hepatol 2015;63:722-732. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 1 2 AAEEH • 23 ASOCIACIÓN ARGENTINA PARA EL 24 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Hepatocarcinogénesis y Factores de Riesgo en Hepatocarcinoma por HCV Dres Jorge Daruich, Teresa Schroeder, Raúl Adrover Introducción oncogénicos, entre los que se encuentra el HCV . Si bien los mecanismos por los cuales el HCV contribuye al desarrollo del HCC no están claramente dilucidados, si existe consenso en que su acción tumorogénica se produciría a través de mecanismos directos (factores virales) e indirectos (respuesta inflamatoria y fibrosis del huésped). Un mejor conocimiento de los procesos involucrados en los portadores crónicos del HCV, en la evolución al HCC, permitiría adoptar conductas preventivas para evitar su desarrollo (7) . Se asume que el orden temporal en el cual se producen las alteraciones genéticas durante la hepatocarcinogénesis comienza con la inflamación crónica, y eventualmente, cirrosis que lleva a alteraciones fenotípicas de los hepatocitos, y a éstos, posteriormente, a un estadio de displasia. Este proceso preneoplásico se desarrolla en un lapso estimado de entre 10 y 30 años, y al HCC en los 5 años siguientes a la formación de los nódulos displásicos (8). (6) Desde antes de la descripción del virus C de la hepatitis (HCV), en 1980, cuando aún se la reconocía como hepatitis No A No B, la infección crónica por este virus se vinculó con el desarrollo de hepatocarcinoma (HCC). Estudios posteriores a nivel global, incluso muy recientes, confirmaron aquellas primeras observaciones (1-5). En la actualidad, no caben dudas de que el HCV es uno de los más importantes agentes etiológicos del HCC. La mayoría de los casos de HCC se presentan en los pacientes con hepatitis crónica C en estadio de cirrosis (Fibrosis 4 – F4), aunque en un porcentaje que en algunas series alcanza hasta un 17%,se puede observar en estadio de fibrosis avanzada(F3) (2). La cirrosis por HCV se asocia con una incidencia anual de HCC entre 1% y 7% (2). Martel et al, en un meta-análisis de 119.006 casos de enfermos con HCC obtenidos de la revisión de 260 estudios de 50 países (la Argentina, entre estos) publicados entre 1989 y 2014, muestran que la proporción de HCV en HCC aumentó de manera significativa en Occidente en la última década. Este incremento es más evidente en algunos países como Alemania, Estados Unidos, Brasil, Taiwán, Egipto y Pakistán, mientras que en otros, como Japón e Italia, se observa un descenso de los casos atribuibles al HCV (5). Hepatocarcinogénesis del HCV Se estima que alrededor del 11% de los cánceres en humanos están asociados a virus Mecanismo directo de hepatocarcinogénesis del HCV El HCV es un virus RNA monocatenario de polaridad positiva, que codifica proteínas estructurales (PS) (core, E1 y E2) y no estructurales (PNS) (p7, NS2, NS3, NS4A, NS4B, NS5A y NS5B). El ciclo viral está limitado al citoplasma y no está regulado por el splicing del RNA nuclear. El HCV no tiene capacidad para integrarse al genoma del huésped, y debido a ello, para persistir viable debe mantener una replicación continua. En la compleja interacción entre el virus y las proteínas del huésped, éstas reaccionan promoviendo inflamación, fibrosis y, finalmente, cirrosis. AAEEH • 25 ASOCIACIÓN ARGENTINA PARA EL Algunas de las PS y PNS del HCV al actuar directa o indirectamente sobre el genoma del huésped generan una inestabilidad genética con activación de mutaciones oncogénicas, inactivación de genes supresores de tumores y desregulación de vías de transmisión de señales (7-13). En los hepatocitos, donde cumple diversas funciones, el microRNA122 (miR-122) se expresa de manera abundante. Para acumularse en las células infectadas, el HCV RNA interactúa a través de la región 5´ no codificante con el miR-122. Este último, por lo tanto, es esencial para el ciclo replicativo del HCV. Se ha observado que el secuestro del miR-122 se asocia con una disminución significativa de la replicación del HCV, y por ello, se ha propuesto como blanco para el diseño de drogas antivirales (9) . En ratones inmunodeficientes, la disminución o pérdida de miR-122 se asocia con desarrollo tumoral, crecimiento e invasión; a su vez, la reconstitución de su expresión revierte estos cambios (10). En ratones, la sobreexpresión artificial de las proteínas core, NS3 y NS5A genera proliferación celular, transformación, crecimiento independiente y formación de tumores. Estos hallazgos sugieren una activación directa de vías moleculares oncogénicas (8). La proteína core inhibe los genes supresores de tumores TP53, TP73, y Retinoblastoma 1 (RB1) (11). Las proteínas NS3 y NS5A también inhiben al TP53 (12). La NS5B bloquea a la proteína asociada al RB1 (13). Por otro lado, las proteínas core, E2, NS5A y NS5B activan la cascada de las kinasas RAF/MAPK/ERK y E2F1, que se asocia con el desarrollo de HCC vía angiogénesis y con tumores más agresivos. Sorafenib, inhibidor multikinasa, actúa inhibiendo la RAF kinasa y otros receptores de kinasas provocando una disminución de la proliferación celular tumoral así como una inhibición de la angiogénesis mediante la inhibición del factor de crecimiento vascular endotelial (VEGF) (14). En ratones transgénicos, la sobreexpresión del factor de crecimiento epidérmico (EGF) produce HCC (15). El HCV per se puede inducir el incremento del EGF. Se ha comprobado también una sobreexpresión del EGF, vía su receptor (EGFR), tanto en el HCC como en el hígado no tumoral de pacientes con elevado riesgo de recidiva post-resección así como en enfermos con riesgo de desarrollar HCC. 26 En modelos animales, erlotinib (inhibidor de la EGFR tirosinkinasa), provoca una atenuación del EGFR que se acompaña tanto de una reducción de la fosforilación de las células hepáticas estrelladas como del número total de éstas, así como también de una disminución de la proliferación hepatocitaria y de la injuria celular, previniendo la progresión a la cirrosis y el desarrollo de HCC (16-17) . El HCC es un tumor muy vascularizado. La sobreexpresión del VEGF y de factores de crecimiento de fibroblastos (FGFs) se asocia con una enfermedad más agresiva. También, los FGFs se han identificado como un factor predictivo de recidiva post-resección (18). Mecanismo indirecto de hepatocarcinogénesis del HCV Los mecanismos por los cuales la inflamación crónica por HCV evoluciona al HCC no se conocen exactamente (7-8). Se ha comprobado que la injuria inflamatoria crónica inmunomediada es necesaria, e incluso suficiente -ya que no se requieren otros potenciales mecanismos-para generar la aparición del HCC (7-8,19). A su vez, la fibrosis secundaria a la inflamación se asocia con la aparición del HCC (19) . El HCV infecta a muchas células (hepatocitos, monocitos y linfocitos, entre otras). Las proteínas core y NS estimulan la fibrogénesis en las células estrelladas hepáticas a través de la expresión de mediadores profibrogénicos como el factor de crecimiento transformante beta 1 (TGF-β1), el procolágenoα1 y citokinas proinflamatorias (IL-8, MCP-1 y RANTES) determinando una fibrosis progresiva en un microambiente prooncogénico (20) . En algunas publicaciones se le asigna un rol importante al factor nuclear-κB (NF-κB) en la inmunidad antitumoral gravitante en la hepatocarcinogénesis, aunque otros hallazgos no lo avalan (21-22). Esta controversia también incluye a lo observado con la interleukina 6 (IL-6), implicada en un mecanismo inflamatorio evolutivo similar al NF-κB (21-22). De todas maneras, la cirrosis, independientemente de su etiología genera un microambiente que sirve de sustrato para la formación de clones neoplásicos al facilitar las aberraciones genéticas y celulares (19). Por otro lado, la respuesta viral sostenida al tratamiento L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 en los pacientes con cirrosis HCV, se asocia con una disminución significativa aunque no con la desaparición del riesgo relativo de HCC (23-25). acceso sencillo a la terapia antiviral (8-14). Otra área de estudio relacionada con genes del huésped, investigada a través del GWAS son el EGF y la patatin fosfolipasa A3 (PNPLA3). El estudio de polimorfismo rs4444903 del EGF mostró que aquellos individuos con cirrosis HCV con el SNP AG y GG tenían un riego relativo incrementado de 4 veces de desarrollar HCC al compararlos con aquellos con el SNP AA (26). EL estudio del polimorfismo rs738409 del gene PNPLA3 mostró resultados controvertidos (27). Conclusiones Factores de riesgo en HCC por HCV Los factores de riesgo implicados en la evolución al HCC en enfermos con HCV son la cirrosis (o fibrosis avanzada), edad > 50 años con 30 años de infección crónica HCV, primoinfección HCV en >50 años, sexo masculino, tiempo prolongado de infección, sobrepeso, diabetes mellitus, alcoholismo, coinfección con los virus HBV y/o HIV, αfeto proteína elevada, hipertransaminasemia, esteatosis, genotipo HCV 1b, infección HBV oculta y las razas afroamericana y asiática (28-30). En los enfermos con estos factores de riesgo se debe implementar un programa de vigilancia eficaz que incluya una adecuada educación para el manejo de las comorbilidades así como un programa de • El HCV no tiene capacidad para integrarse al genoma del huésped. Para persistir viable debe mantener una replicación permanente. • La acción carcinogenética del HCV se produciría a través de la acción conjunta de mecanismos directos (factores virales) e indirectos (respuesta inflamatoria y fibrosis del huésped). • Algunas de las PS y PNS del HCV al actuar directa o indirectamente sobre el genoma del huésped generan una inestabilidad genética con activación de mutaciones oncogénicas, inactivación de genes supresores de tumores y desregulación de vías de transmisión de señales. • El orden temporal en el cual se producen las alteraciones genéticas durante la hepatocarcinogénesis comienzan con la inflamación crónica, y eventualmente, cirrosis que lleva a alteraciones fenotípicas de los hepatocitos, y a éstos, posteriormente, a un estadio de displasia y, finalmente, al HCC. • EN los enfermos con HCV con factores de riesgo es clave la implementación de programas de vigilancia. Referencias 1. Kiyosawa K, Akahane Y, Nagata A, et al. Hepatocellular carcinoma after non-A, non-B hepatitis. Am J Gastroenterol 1984;79:777–781. 2. El-Serag HB. Hepatocellular carcinoma. N Engl J Med 2011;365:1118–1127. 3. Fassio E, Miguez C, Soria S, et al. Etiology of hepatocellular carcinoma in Argentina: results of a multicenter retrospective study. Acta Gastroenterol Latinoamer 2009;39:47-52. 4. Méndez Sánchez N, Ridruejo E, Alves de Matto A, et al. Latin American Association for the Study of the Liver (ALEH) Clinical Practice Guidelines: Management of Hepatocellular Carcinoma. Ann Hepatol 2014; 13 (Suppl 1):s4-s40. 5. Martel C, Maucort-Boulch D, Plummer M, Franceschi S. Worldwide relative contribution of hepatitis B and C viruses in hepatocellular carcinoma. Hepatology 2015; DOI: 10.1002/hep.27969. 6. Ajiro M, Zheg Z-M. Oncogenes and RNA splicing of human tumor viruses. Emerg Microbes Infect 2014; doi:10.1038/emi.2014.62. 7. Lemon SM, McGivern DR. Is Hepatitis C Virus Carcinogenic? Gastroenterology 2012;142:1274-1278. 8. Lin MV, King LY, Chung RT. Hepatitis C virus-associated cancer. Annu Rev Pathol 2015;10:345-370. 9. Jopling CL, Yi M, Lancaster AM, et al. Modulation of hepatitis C virus RNA abundance by a liver-specific microRNA. Science 2005;309:1577–1581. 10. Coulouarn C, Factor VM, Andersen JB, et al. Loss of miR-122 expression in liver cancer correlates with suppression of the hepatic phenotype and gain of metastatic properties. Oncogene 2009;28:3526–3536. 11. Machida K, Liu JC, McNamara G, et al. Hepatitis C virus causes uncoupling of mitotic checkpoint and chromosomal polyploidy through the Rb pathway. J Virol 2009;83:12590–12600. 12. Deng L, Nagano-Fujii M, et al. NS3 protein of hepatitis C virus associates with the tumour suppressor p53 and inhibits its function in an NS3 sequence-dependent manner. J Gen Virol 2006;87:1703–1713. 13. Munakata T, Nakamura M, Liang Y, et al. Down-regulation of the Retinoblastoma tumour suppressor by the hepatitis C virus NS5B RNA dependent RNA polymerase. Proc Natl AcadSci U S A 2005;102: 18159– 18164. 14. Zhao LJ, Wang L, Ren H, et al. Hepatitis C virus E2 protein promotes human hepatoma cell proliferation through the MAPK/ERK signalling pathway via cellular receptors. Exp Cell Res 2005;305:23–32. 15. Tonjes RR, Lohler J, O’Sullivan JF, et al. Autocrine mitogen IgEGF cooperates with c-myc or with the Hcs locus during hepatocarcinogenesis in transgenic mice. Oncogene 1995;10:765–768. AAEEH • 27 ASOCIACIÓN ARGENTINA PARA EL 16. Diao J, Pantua H, Ngu H, et al. Hepatitis C virus induces epidermal growth factor receptor activation via CD81 binding for viral internalization and entry. J Virol 2012;86:10935–10949. 23. Morgan RL, Baack B, Smith BD, et al. Eradication of hepatitis C virus infection and the development of hepatocellular carcinoma. A metaanalysis of observational studies. Ann Intern Med 2013;158:329-337. 17. Fuchs BC, Hoshida Y, Fuji T, et al. Epidermal growth factor receptor inhibition attenuates liver fibrosis and development of hepatocellular carcinoma. Hepatology 2014;59:1577–1590. 24. Aleman S, Rahbin N, Weiland O, et al. A risk for hepatocellular carcinoma persists long-term after sustained virologic response in patients with hepatitis C–associated liver cirrhosis. Clin Infect Dis 2013;57:230-236. 18. Imura S, Miyake H, Izumi K, et al. Correlation of vascular endothelial cell proliferation with microvessel density and expression of vascular endothelial growth factor and basic fibroblast growth factor in hepatocellular carcinoma. J Med Investig 2004;51:202–209. 25. Cruz Pereira O, Feld JJ. Sustained virologic response for patients with hepatitis C–related cirrhosis: A major milestone, but not quite a cure. Clin Infect Dis 2013;57:237-239. 19. Hoshida Y, Fuchs BC, Bardeesy N, et al. Pathogenesis and prevention of hepatitis C virus-induced hepatocellular carcinoma. J Hepatol 2014; 61:S79-S90. 20. Matsuzaki K, Murata M, YoshidaK, et al. Chronic inflammation associated with hepatitis C virus infection perturbs hepatic transforming growth factor β signaling, promoting cirrhosis and hepatocellular carcinoma. Hepatology 2007; 46:48–57. 21. Pikarsky E, Porat RM, Stein I, et al. NF-κB functions as a tumour promoter in inflammation-associated cancer. Nature 2004;431:461–466. 22. Joo M, Hahn YS, Kwon M, et al. Hepatitis C virus core protein suppresses NF-κB activation and cyclooxygenase-2 expression by direct interaction with IkappaB kinase beta. J Virol 2005;79:7648–7657. 28 26. Valenti L, Rumi M, Galmozzi E, et al. Patatin-like phospholipase domaincontaining 3 I148M polymorphism, steatosis, and liver damage in chronic hepatitis C. Hepatology2011;53:791–799. 27. Singal AG, Manjunath H, Yopp AC, et al. The effect of PNPLA3 on fibrosis progression and development of hepatocellular carcinoma: a meta-analysis. Am J Gastroenterol 2014;109:325–334. 28. Benvegnù L, Gios M, Boccato S, Alberti A. Natural history of compensated viral cirrhosis: a prospective study on the incidence and hierarchy of major complications. Gut 2004;53;744-749. 29. Grebely J, Dore GJ. What is killing people with hepatitis C virus infection? Semin Liver Dis 2011;31:331–339 30. Westbrook RH, Dusheiko G. Natural history of hepatitis C. J Hepatol 2014;61:S58-S68. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Hepatocarcinogénesis y Factores de Riesgo en Hepatocarcinoma por Cirrosis Alcohólica Dres Daniel García, Mario Arzeno, Carlos Míguez Introducción El alcohol etílico (OHet) es considerado por la International Agency for Research on Cancer (IARC) dependiente de la Organización Mundial de la Salud (OMS) un carcinógeno directo(1). En Argentina, junto con la hepatitis C, es la principal causa de hepatocarcinoma (HCC)(2). Epidemiología de la Exposición al Alcohol en el Mundo y en Argentina Según el informe de la OMS en 20143, el promedio mundial de consumo per cápita en mayores de 15 años fue de 6,2 litros/año, el cual corresponde a 13,5 gramos de OHet puro por día. El continente con mayor consumo per cápita es Europa con un promedio de 10,9 litros/año en mayores de 15 años y de 16,8 sólo en consumidores habituales seguido por las Américas con 8,4 y 13,6 litros/año respectivamente. Argentina se ubica en el 4º lugar en las Américas con un consumo de 9,3 litros/año (hombres 13,6 y mujeres 5,2) en mayores de 15 años y de 15,8 litros/año (hombres 19,5 y mujeres 10,9) en consumidores de los últimos 12 meses (58,8%), correspondiendo a una ingesta promedio de OHet de 33 gramos/ día(3). El OHet es la droga psicoactiva más frecuentemente consumida en nuestro país, particularmente en la población de adolescentes y adultos jóvenes(4). El consumo excesivo de OHet provoca accidentes de todo tipo, violencia física, conductas sexuales riesgosas, neoplasias, pérdida de productividad, serios problemas familiares y sociales, y daño psico-físico-social de la persona(5,6). Es responsable del 4,7% del total de muertes y el 6,7% de los AVADs (año de vida ajustado a discapacidad; en inglés: DALYs) en las Americas(3). Por lo tanto, determinar los patrones de consumo de riesgo en la población y en el individuo que realiza una consulta médica es de suma importancia. Tradicionalmente el consumo de OHet correspondía a la población adulta con un patrón de ingesta regular pero en los últimos 20 años o más, estos patrones se han modificado(7). Se describe un patrón de consumo regular que se considerará excesivo cuando supere en mujeres los 12 gramos/día y en hombres los 24 (consumo regular excesivo o CRE) y otro patrón de consumo episódico que se considerará de riesgo cuando supere en la mujer los 40 gramos y en el hombre los 50 (consumo episódico excesivo (CEE) o “binge drinking”), más frecuente en adolescentes y adultos jóvenes(8). Ambos están vinculados a todas las consecuencias descriptas por la ingesta de OHet, aunque el predominio de cada una de ellas dependerá de cada patrón de consumo. En nuestro país, según la 3º encuesta nacional de factores de riesgo de enfermedades no transmisibles(9) realizada en población de 18 o más años en 2013, el CRE fue de 9,7% (más de 6 veces la prevalencia estimada de infección HCV) y el CEE 10,4% (hombres 17,1%; mujeres 4,4%)(9). En la encuesta realizada en estudiantes del nivel secundario(4) el 42 % de los de 14 o menos años, el 71% de los de 15 y 16, y el 80,7% de los de 17 o más años consumieron OHet durante el último año. No hay datos aún sobre CEE en estos grupos de edad, pero en adultos la mayor prevalencia de este patrón de consumo se observa entre los jóvenes de 18 a 24 años (25,1%). AAEEH • 29 ASOCIACIÓN ARGENTINA PARA EL En toda consulta clínica, independientemente del motivo, debe detectarse el consumo de OHet, nivel y patrón de consumo, incidentes vinculados al consumo, presencia de compromiso hepático y extrahepático y síntomas y/o signos de adicción. La adecuada orientación y contención del paciente que abusa del consumo de OHet, en un enfoque multidisciplinario, permitirá evitar o reducir las consecuencias nocivas de este tóxico(10-12). Alcohol y Enfermedad Hepática Existe numerosa y convincente evidencia de la relación entre la ingesta de OHet, los niveles de consumo y la presencia de enfermedad hepática (13,14) . Más del 90% de los consumidores de 60 gramos o más diarios, presentarán esteatosis hepática y de éstos un 30% desarrollarán fibrosis severa o cirrosis(15). Pero el riesgo de mortalidad por cirrosis alcohólica se incrementa aún con consumos de 12-24 gramos/día y una ingesta igual o mayor a 25 se asocia a un riesgo relativo (RR) significativo (RR 1,9 (IC 1,6-2.3))(14). Desde el punto de vista hepatológico, la recomendación de consumo seguro de OHet es aquella que esté por debajo de estos niveles(8). El hecho de que no todos los que tienen un consumo excesivo desarrollen enfermedad hepática severa, pone en evidencia la existencia de otros factores implicados en su desarrollo. Se han identificado distintos factores asociados a un mayor riesgo como edad, sexo femenino, obesidad, CRE, duración mayor de 5 años del consumo y factores genéticos no vinculados al sexo(15-21). Un mensaje como la “Regla de los 20 gramos” es una forma de comunicación simple y entendible para la población general acerca de un consumo seguro de OHet en relación a los tres tipos de bebida más frecuentemente consumidas en nuestro país. Recomendar a personas sanas (sin comorbilidades) de ambos sexos no consumir más de 200 cm3 de vino o 500 cm3 de cerveza o 60 cm3 de bebidas destiladas por día, logra el objetivo del consumo seguro de OHet. 30 Alcohol y Hepatocarcinoma El cáncer hepático primario (HCC 80% y Colangiocarcinoma 20%) es la 5º causa de cáncer en el mundo en hombres y la 9º en mujeres, siendo el principal factor de riesgo la infección HBV con alta prevalencia en Asia y África (80% del total de casos) (22,23). En Europa y las Américas, donde la incidencia del HCC es menor al 10 por 100.000 habitantes para ambos sexos y todas las edades, los principales factores de riesgo son la infección por HCV y el OHet(21,22). En Latinoamérica, el principal factor de riesgo asociado al HCC es la infección HCV (37,9%), seguida por el OHet (28,3%) y la infección HBV (13,7%)(23). En Argentina el principal factor es el OHet (41,6%) seguido de cerca por la infección HCV (40,5%)(2). De acuerdo al proyecto Globocan 2012 de la IARC, la incidencia anual del cáncer hepático en la Argentina es de 3,3 por 100.000, la prevalencia anual 1,71 y la mortalidad 3,42 % para ambos sexos(22). El OHet tiene un rol independiente en la inducción de cirrosis y HCC. La presencia de cirrosis es el principal factor de riesgo para el desarrollo del HCC en consumidores de OHet, pero existe un 14 a 19% de los consumidores excesivos que lo presentan sin tener cirrosis(25-27). La incidencia anual de HCC en bebedores excesivos es de 0,01%(26), mientras que en cirrosis alcohólica oscila entre 0,2 al 2,0%(28-33). En nuestro medio, la incidencia anual en cirrosis alcohólica compensada fue del 1,8%(34). Independientemente de las comorbilidades, los factores de riesgo asociados a mayor incidencia de HCC por OHet, además de la presencia de cirrosis ya mencionada, son la edad, el sexo, el nivel y el tiempo de consumo y el tabaquismo(35-37). La abstinencia en pacientes con cirrosis alcohólica recién disminuye el riesgo de HCC después de los primeros 5 años de abstinencia(38). En relación a las comorbilidades, la presencia de infección HCV incrementa el riesgo de HCC en comparación con los pacientes con cirrosis alcohólica o por HCV solamente(36,39). El consumo de OHet excesivo en pacientes con hepatitis crónica B incrementa también el riesgo de HCC(36). L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 La presencia de obesidad y diabetes, principales factores de riesgo de hígado graso no alcohólico, y la hemocromatosis aumentan también el riesgo de HCC en cirrosis alcohólica(40-42). Hepatocarcinogénesis por alcohol El OHet es considerado per se, independientemente del tipo de bebida, un carcinógeno causalmente relacionado con tumores malignos de la cavidad oral, faringe, laringe, esófago, hígado, mama, colon y recto de acuerdo a la IARC, en base a la amplia información epidemiológica disponible(1). Los mecanismos de carcinogénesis están relacionados con el metabolismo del OHet siendo los más importantes el stress oxidativo y la cirrosis. El acetaldehído, importante factor en neoplasias extra-hepáticas, en el hígado tiene menos significancia como consecuencia de su efectivo sistema de metabolización, salvo que exista un consumo excesivo o alteraciones genéticas de la acetaldehído deshidrogenasa o la alcohol deshidrogenasa. En estos casos, el acetaldehído en exceso puede interferir con la síntesis y reparación del ADN provocando anormalidades citogenéticas en células eucarióticas(43). El stress oxidativo es un factor importante en hepatocarcinogénesis independientemente de la etiología. La formación de especies reactivas de oxígeno (ROS) por alcohol puede ser debida a tres causas: a) inducción del sistema mono-oxigenasa microsomal CYP2E1dependiente; b) la inducción de esfingomielinasa por el TNFα que incrementa los niveles de ceramida, que conduce a la elevación de los niveles de ROS, y c) la sobrecarga de hierro hepático(43). Las ROS generan productos de peroxidación lipídica como malondialdehído y 4-hidroxinonenal, que pueden reaccionar con bases de ADN formando aductos de ADN altamente mutagénicos(43). La presencia de cirrosis es por sí misma reconocida como preneoplásica por las alteraciones típicamente encontradas en el hígado, como son los nódulos displásicos y los focos de células displásicas que preceden al HCC(44). La administración prolongada de OHet en ratas induce la aparición de células progenitoras hepáticas inicialmente quiescentes, denominadas “células ovales”(45). Las mismas son consideradas como stem cells hepáticas pluripotenciales que preceden al desarrollo de HCC. Las citoquinas TNFα y TGFB1, estimulantes importantes de la proliferación de las células ovales, están elevadas en la enfermedad hepática alcohólica(43). Otros mecanismos implicados en la hepatocarcinogénesis asociados al consumo de OHet son la depleción de ácidos retinoicos, la deficiencia de ADN metilación principalmente por la inhibición de la síntesis de S-adenosilL-metionina (SAMe), la presencia miRNAs y la genotoxicidad(38,43,46). Referencias 1. Secretan B, Striaf K, Baan R, et al. On behalf of the World Health Organization. International Agency for Research on Cancer Monograph Working Group. A review of human carcinogens - Part E: tobacco, areca nut, alcohol, coal smoke, and salted fish. Lancet Oncology 2009, 10(11): 1033-4. http://monographs.iarc.fr/ENG/ Monographs /vol100E/ mono100E-11.pdf 2. Fassio E, Miguez C, Soria S et al. Etiology of hepatocellular carcinoma in Argentina: results of a multicenter retrospective study. Acta Gastroenterol Latinoamer 2009; 39: 47-42 3. Global status report on alcohol and health 2014. World Health Organization. En: http:// www.who.int/substance_abuse/publications/ global_alcohol_report/en/ 4. Sexto estudio nacional sobre consumo de sustancias psicoactivas en estudiantes de enseñanza media 2014. Boletín Nº 1: Patrones y magnitud del consumo: diagnóstico a nivel país. Secretaría de Programación para la Prevención de la Drogadicción y la Lucha contra el Narcotráfico (SEDRONAR). En: http://scripts.minplan.gob.ar/octopus/ archivos.php?file=4115. 5. Global status report on noncommunicable diseases 2010. World Health Organization. En: http://www.who.int/nmh/publications/ncd_report_full_ en.pdf 6. Cremonte M and Cherpitel C. Alcohol intake and risk of injury. Medicina (Buenos Aires) 2014; 74: 287-292. 7. Definición del concepto de consumo intensivo de alcohol adolescente (binge drinking). Adicciones 2011; 23 (1): 3-63 8. EASL clinical practical guidelines: management of alcoholic liver disease. J Hepatol 2012; 57: 399-420. 9. 3º Encuesta nacional de factores de riesgo de enfermedades no transmisibles. En: http://www.msal.gov.ar/ images/stories/publicaciones/ pdf/11.09.2014-tercer-encuentro-nacional-factores-riesgo.pdf 10. Rosón Hernández B. Consumo de riesgo y perjudicial de alcohol. Prevalencia y métodos de detección en la práctica clínica. Galicia Clin 2008; 69 (1): 29-44. 11. O’Shea R, Dasarathy S, McCullough A, and the Practice Guideline Committee of the American Association for the Study of Liver Diseases and the Practice Parameters Committee of the American College of Gastroenterology. Alcoholic liver disease. AASLD practice guidelines. Hepatology 2010; 51(1): 307-28. 12. Arzeno M. Diagnóstico de alcoholismo. Proami 1998; 3º ciclo: 253-271. 13. Corrao G, Bagnardi V, Zambon A and Torchio P. Meta-analysis of alcohol intake in relation to risk of liver cirrhosis. Alcohol & Alcoholism 1998, 33 (4): 381-392. 14. Rehm J, Taylor B, Mohapatra S, et al. Alcohol as a risk factor for liver cirrhosis: a systematic review and meta-analysis. Drug Alcohol Rev 2010; 29: 437–445. 15. Raynard B, Balian A, Fallik D, et al. Risk factors of fibrosis in alcoholinduced liver disease. Hepatology 2002; 35: 635-638. 16. Bellentani S, Saccoccio G, Costa G, et al. and the Dionysos Study Group. Drinking habits as cofactors of risk for alcohol induced liver damage. Gut 1997; 41: 845–850. AAEEH • 31 ASOCIACIÓN ARGENTINA PARA EL 17. Becker U, Deis A, Sorensen T, et al. Prediction of liver disease by alcohol intake, sex, and age: a prospective population study. Hepatology 1996; 23: 1025-9. 18. Sato N, Lindros K, Baraona E, et al. Sex difference in alcohol-related organ injury. Alcohol Clin Exp Res 2001; 25: 40S-45S. 19. Naveau S, Giraud V, Borotto E, et al. Excess weight risk factor for alcoholic liver disease. Hepatology 1997; 25: 108-111. 20. Askgaard G, Grønbæk M, Kjær MS, et al. Alcohol drinking pattern and risk of alcoholic liver cirrhosis: a prospective cohort study. J Hepatol. 2015; 62(5): 1061-7. 21. Monzoni A, Masutti F, Saccoccio G, et al. Genetic determinants of ethanol-induced liver damage. Mol Med 2001; 7: 255-262 22. International Agency for Research on Cancer. World Health Organization. GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence. En: www.globocan.iarc.fr 23. Bosch FX, Ribes J, Díaz M and Cléries R. Primary liver cancer: worldwide incidence and trends. Gastroenterology 2004; 127 (5, Suppl 1): S5-S16. 24. Fassio E, Diaz S, Santa C, et al. Etiology of hepatocellular carcinoma in Latin America: a prospective, multicenter, international study. Ann Hepatol 2010;9:63-9. 25. Fattovich G, Stroffolini T, Zagni I and Donato F. Hepatocellular Carcinoma: incidence and risk factors. Gastroenterology 2004; 127: S35-S50. 26. Nzeako U, Goodman Z and Ishak K. Hepatocellular carcinoma in cirrhotic and noncirrhotic livers. A clinico-histopathologic study of 804 North American patients. Am J Clin Pathol 1996; 105:65-75. 27. Chiesa R, Donato F, Tagger A, et al. Etiology of hepatocellular carcinoma in Italian patients with and without cirrhosis. Cancer Epidemiol Biomarkers Prev 2000; 9:213-216. 28. Kuper H, Ye W, Broomè U, et al. The risk of liver and bile duct cancer in patients with chronic viral hepatitis, alcoholism, or cirrhosis. Hepatology 2001; 34: 714-718. 29. Sorensen H, Friis S, Olsen J, et al. Risk of liver and other types of cancer in patients with cirrhosis: a nationwide cohort study in Denmark. Hepatology 1998; 28: 921-925. 30. Miyakawa H, Izumi N, Marumo F and Satp C. Roles of alcohol, hepatitis virus infection, and gender in the development of hepatocellular carcinoma in patients with liver cirrhosis. Alcohol Clin Exp Res 1996; 20: 91A-94A. 31. Uetake S, Yamauchi M, Itoh S, et al. Analysis of risk factors for hepatocellular carcinoma in patients with HBs Antigen- and anti-HCV antibody-negative alcoholic cirrhosis: clinical significance of prior hepatitis B virus infection. Alcohol Clin Exp Res 2003; 27: 47S–51S. 32 32. Henrion J, Libon E, De Maeght S, et al. Dèpistage du carcinome hèpatocellulaire dans une cohorte de malades porteurs d’une cirrhose d’origine principalement alcoolique. Gastroenterol Clin Biol 2003; 27: 534-539. 33. Toshikuni N, Izumi A, Nishino K, et al. Comparison of outcomes between patients with alcoholic cirrhosis and those with hepatitis C virus-related cirrhosis. J Gastroenterol Hepatol 2009, 24: 1276-83 34. Garcia D, Poncino D, Martinez Artola Y, et al. Incidencia del hepatocarcinoma en pacientes con cirrosis por alcohol y hepatitis C. Acta Gastroent Latinoamer 2005, 35(Supl 2): A62. 35. Jepsen P, Ott P, Andersen P, et al. Risk for hepatocellular carcinoma in patients with alcoholic cirrhosis. A danish nationwide cohort study. Ann Intern Med. 2012; 156: 841-847. 36. Donato F, Tagger A, Gelatti U, et al. Alcohol and hepatocellular carcinoma: the effect of lifetime intake and hepatitis virus infections in men and women. Am J Epidemiol 2002; 155:323–331. 37. Hassan M, Spitz M, Thomas M, et al. Effect of different types of smoking and synergism with Hepatitis C virus on risk of hepatocellular carcinoma in American men and women: Case-control study. Int J Cancer. 2008; 123(8): 1883-1891. 38. Morgan T, Mandayan S and Jamal M. Alcohol and hepatocellular carcinoma. Gastroenterology 2004; 127(5 Suppl 1): S87-96 39. Miyakawa H, Sato C, Tazawa J, et al. A prospective study on hepatocellular carcinoma in liver cirrhosis: respective roles of alcohol and hepatitis C virus infection. Alcohol Alcohol Suppl 1994;29(1):75-9. 40. N’Kontchou G, Paries J, Htar MT, et al. Risk factors for hepatocellular carcinoma in patients with alcoholic or viral C cirrhosis. Clin Gastroenterol Hepatol 2006;4: 1062-8. 41. Balbi M, Donadon V, Ghersetti M, et al. Alcohol and HCV chronic infection are risk cofactors of type 2 diabetes mellitus for hepatocellular carcinoma in Italy. Int J Environ Res Public Health 2010;7: 1366-78. 42. Nahon P, Sutton A, Rufat P, et al. Liver iron, HFE gene mutations, and hepatocellular carcinoma occurrence in patients with cirrhosis. Gastroenterology 2008; 134: 102-10. 43. Seitz HK and Stickel F. Molecular mechanisms of alcohol mediated carcinogenesis. Nat Rev Cancer 2007; 7: 599-612. 44. Kojiro M and Roskams T. Early hepatocellular carcinoma and dysplastic nodules. Semin. Liver Dis 2005; 25, 133-142. 45. Smith P and Yeoh G. Appearance of oval cells in the liver of rats after long-term exposure to ethanol. Hepatology 1996; 23, 145-154. 46. Gao B and Bataller R. Alcoholic liver disease: pathogenesis and new therapeutic targets. Gastroenterology 2011; 141: 1572-1585. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 1 2 AAEEH • 33 ASOCIACIÓN ARGENTINA PARA EL 34 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Hepatocarcinogénesis y Factores de Riesgo en Hepatocarcinoma por Hígado Graso No Alcohólico Dres Daniel Poncino, Esteban González Ballerga, Graciela Landeira Introducción La cirrosis es un factor de riesgo del hepatocarcinoma (HCC) y está presente en el 85% de los pacientes en Latinoamérica (LA) y en el 93% en Argentina (ARG). El 90% de los HCC en general, 86% en LA y 90% en ARG se asocian a un factor de riesgo subyacente conocido. El porcentaje de estos varían según la región en estudio, siendo los más frecuentes, la hepatitis C (HCV), el alcohol y la hepatitis B (HBV). Queda entre un 10-30% agrupado en otras causas dentro de las cuales la cirrosis criptogénica es la más importante. En esta existe una alta prevalencia de obesidad y diabetes, siendo el hígado graso no alcohólico (HGNA) y su variante progresiva la esteatohepatitis no alcohólica (EHNA) la principal causa de HCC en este grupo(1). Actualmente, con la supresión sostenida de la replicación del HBV y la mejor eficacia en la erradicación del HCV como consecuencia de la introducción de nuevos y más efectivos tratamientos, la incidencia de HCC asociado a estos debería ir en disminución. Dada la prevalencia cada vez mayor de HGNA, quedaría este como una de las principales etiologías de enfermedad hepática crónica y HCC superando a la hepatitis C en el futuro. La comprensión de esta realidad significa poner un gran esfuerzo en la prevención y tratamiento del HGNA y así disminuir la incidencia de HCC(1,2,3,4). los porcentajes de cada uno de ellos son 62, 59, 55% respectivamente. Estos porcentajes son muy elevados cuando se los compara por ejemplo con 37% de obesos, 9,8% de diabéticos y 34% de hipertensos en población general de ARG.8,10,14 Hay triple riesgo de mortalidad por cirrosis de etiología no viral ni alcohólica probablemente atribuible a HGNA en pacientes diabéticos6. En estudios de cohorte en USA, Escandinavia, Taiwan y Japón, el HCC es 1 a 2 veces más probable de desarrollarse en personas obesas que en aquellos que no lo eran(16). Epidemiología de la EHGNA La incidencia de HGNA es 31-89/10.000 personas por año en dos estudios de Japón y 29/100.000 en otro inglés(13), con un pico en la 6º década de la vida. La prevalencia de HGNA y EHNA en los países occidentales es de 20-30% y 5.3% respectivamente. En ARG, la prevalencia de esteatosis por ecografía es de 38,8% (307/960)(17). La prevalencia de HGNA en individuos de peso normal era 4 veces más baja que en pacientes obesos. La prevalencia en obesos es del 75%,(15) en obesos mórbidos >90%(13) (en ARG 75% EHNA y 16% cirrosis)(9) y en diabéticos es del 70 %.(4 5). Epidemiología del HCC en HGNA Epidemiología de los factores de riesgo El 91% de los pacientes con HGNA asociado a HCC tienen obesidad, diabetes e hipertensión y Hay amplia evidencia de la asociación de obesidad y diabetes con HCC, lo que aumenta 3 veces la posibilidad de desarrollarlo, pero la exacta prevalencia de HCC en HGNA es desconocida(11). AAEEH • 35 ASOCIACIÓN ARGENTINA PARA EL Dos estudios suecos describen 3 y 5 casos de HCC en cohortes de 129 y 256 pacientes con HGNA seguidos por 13.7 y 21 años, respectivamente(13). Dos estudios indicarían que el riesgo de HCC es menor en EHNA que en HCV. Uno de ellos realizado en Japón, con pacientes con EHNA con fibrosis severa seguidos prospectivamente por 5 años comparados con una población similar de HCV. Observan HCC en 11,3% de 68 y 30,5% de 69 pacientes, respectivamente(11). El otro estudio, norteamericano, informa presencia de HCC en 25/195 (12.8%) de cirróticos por EHNA y 64/315 (20.3 %) de cirróticos por HCV luego de 3,2 años de seguimiento(12). En un reciente estudio de Alemania, que analizó 162 casos de HCC, identificó a la EHNA como la etiología subyacente en el 24% de los pacientes, superando a la hepatitis C, 23,3%, a la hepatitis B, 19,3% y a la enfermedad hepática alcohólica, 12,7%(15). Esto evidenciaría que la EHNA en países desarrollados puede convertirse en la principal fuente de HCC y compensar el impacto de las exitosas medidas en la reducción de la hepatitis C y la incidencia de HCC relacionada con este virus(11). Aunque la fibrosis avanzada aumenta el riesgo de HCC en HGNA aproximadamente 25 veces, existen pruebas sugiriendo que el HCC también se puede desarrollar sobre una esteatosis simple o en EHNA con o sin la presencia de cirrosis. Así lo demuestran varios estudios retrospectivos y prospectivos con seguimiento, pero en un reciente meta-análisis de 61 estudios con diferentes diseños, las cohortes con HGNA sin cirrosis con seguimiento de hasta 2 décadas demostraron mínimo riesgo de HCC, mientras que las cirrosis por HGNA tenían un riesgo incrementado. La asociación entre HGNA y el riesgo de HCC parecería limitarse a los individuos con cirrosis(5). En resumen, la cirrosis aparentemente no se requiere para el desarrollo de HCC relacionado con el HGNA. Sin embargo, el relativamente bajo riesgo de ocurrencia de HCC en un HGNA no cirrótico no justifica el cribado de HCC de toda la población con hígado graso no alcohólico. 36 Hepatocarcinogénesis del HCC en HGNA Existe evidencia epidemiológica convincente de una relación causal entre la EHNA y el HCC. Como sucede en otros tumores malignos, el HCC emerge sobre todo en pacientes con enfermedad hepática crónica y se desarrolla durante años siguiendo la secuencia displasia-carcinoma. Los mecanismos fisiopatológicos del desarrollo del HCC han sido principalmente estudiados en modelos de infección viral crónica como HBV y HCV. En HCC desarrollados sobre pacientes con HGNA, conductores hepáticos oncogénicos como la esteatosis y la inflamación, así como los factores sistémicos tales como la obesidad y la diabetes tipo 2 han sido bien identificados; es bien conocido que aumentan el riesgo de HCC, siendo la explicación biológica de este vínculo incierta(6). Hay 3 mecanismos propuestos de la progresión de HGNA a HCC: 1) Inflamación y microrganismos: La asociación entre inflamación y cáncer es bien conocida y el factor más importante es el factor nuclear kapa B (NFκB) que produce citoquinas pro-inflamatorias, por ejemplo, IL-1β, IL-6, TNFα que ocasiona HGNA, fibrosis y HCC. Una de los potenciales mecanismos involucrados en la inflamación hepática es la traslocación bacteriana. Los microorganismos activan crónicamente a receptores toll-like 4 (TLR-4) que a su vez son activadores del NFκB y además producen un efecto deletéreo sobre las células estelares hepáticas que también liberan mediadores que promueven la progresión de HGNA a HCC. 2) Desorden metabólico: la hiperinsulinemia es un frecuente hallazgo en pacientes con HGNA y hay un fuerte vínculo epidemiológico entre DBT y HCC. La insulina influye en el metabolismo celular a través de caminos como el PI3K (que puede por sí mismo desarrollar HCC en HGNA y es a su vez inhibido por el PTEN, el cual se encuentra disminuido en los HCC por lo que indirectamente potencia al PI3K) y AKT que se encuentra activado en PDGFR en modelos animales y promueve la progresión de HGNA a HCC. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 3) Estrés oxidativo: la acumulación de grasa en los hepatocitos induce la generación de especies oxigeno reactivas que generan peroxidación lipídica que son toxinas genéticas. Estas producen daño del ADN dentro de las células hepáticas que son potenciales disparadores de una transformación maligna de las mismas. Otros estudios implican alteraciones en el metabolismo de la S-adenosilmetionina (SAM) en el desarrollo de la progresión de HGNA a HCC(7). Un estudio identificó que una variante en el gen PNPLA3 (variante l148M) estaba asociado con mayor susceptibilidad a la EHNA. El mismo gen se asoció de forma independiente con un mayor riesgo de fibrosis hepática progresiva y HCC(7). En un meta-análisis de 26 estudios, se encuentra una mayor incidencia de HCC en pacientes con diabetes mellitus, independientemente de la presencia de hígado graso no alcohólico. También la obesidad por sí sola ha sido vinculada a una mayor incidencia de tumores malignos de diversos órganos (colon, endometrio, mama, intestino, e hígado)(4). Adicionalmente, el metabolismo de los ácidos biliares mediado por alteración en la flora intestinal ha sido recientemente implicado en el desarrollo del HCC(6). Referencias 1. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2012; 56: 908–943. 2. Fassio E, Diaz S, Santa C et al. Etiology of hepatocellular carcinoma in Latin America: a prospective, multicenter international study. Ann hepatol 2010; 9: 63-69. 3. Fassio E, Miguez C, Soria S et al. Etiology of hepatocellular carcinoma in Argentina: results of a multicenter retrospective study. Acta Gastroenterol Latinoam 2009; 39: 47-42. 4. Campana B, Semela D, Heim M et al. Non-Alcoholic Fatty Liver Disease changing the prevalence of liver cancer? EMJ Hepatol 2015; 3:12-18. 5. White DL, kanwal F, El- Serag HBl. Association between nonalcoholic fatty liver disease and risk for hepatocellular cancer, based on systematic review. Clin Gastroenterol Hepatol 2012; 10:1342-1359. 6. Byrne C, Targher G. NAFLD: A multisistem disease. J hepatol 2015; 62: s47-s64. 7. Augusto Villanueva. Carcinogenesis and spectrum of hepatic tumors in NASH. EASL Postgraduate course Metabolic liver disease. 8. Yoshitaka Takuma, Kazuhiro Nouso. Carcinogenesis and spectrum of hepatic tumors in NASH. EASL Postgraduate course Metabolic liver disease. World J Gastroenterol 2010; 28: 16: 1436-1441. 10. Yasui K, Hashimoto E, Komorizono Y et al. Characteristics of patients with nonalcoholic steatohepatitis who develop hepatocellular carcinoma. Clinical Gastroenterol Hepatol 2011; 9: 428–433. 11. Baffy G, Brunt EM, Caldwell SH. Hepatocellular carcinoma in nonalcoholic fatty liver disease: An emerging menace. J Hepatol 2012; 56: 1384–1391. 12. Ascha MS, Hanouneh IA, Lopez R et al. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. Hepatology 2010; 51: 1972-1978. 13. Chalasani N, Younossi Z, Lavine J et al. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology 2012;55: 2005-2023. 14. 3º Encuesta nacional de factores de riesgo de enfermedades no transmisibles. En: http://www.msal.gov.ar/images/stories/publicaciones/ pdf/11.09.2014-tercer-encuentro-nacional-factores-riesgo.pdf 15. Ertle J, Dechêne A, Sowa JP et al. Non-alcoholic fatty liver disease progresses to hepatocellular carcinoma in the absence of apparent cirrhosis. Int J Cancer 2011;128:2436–2443. 9. Fernandez, G, Ferraro, A Enfermedad del hígado graso no alcohólico en pacientes con obesidad mórbida que realizan tratamiento quirúrgico de la obesidad-informe preliminar. Acta Gastroenterol Latinoam 2009; 39 S AAEEH • 37 ASOCIACIÓN ARGENTINA PARA EL 1 2 38 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Incidencia del Hepatocarcinoma y Factores de Riesgo en Hepatopatías Autoinmunes Dras. Alejandra Villamil, Estela Manero, Sara Chao Las enfermedades autoinmunes del hígado engloban tres entidades: la hepatitis autoinmune (HAI), la cirrosis biliar primaria (CBP) y la colangitis esclerosante primaria (CEP). En los últimos tiempos la hepatitis autoinmune ha recobrado importancia por el aumento de la incidencia y probablemente por este motivo se ha informado un incremento de la prevalencia del hepatocarcinoma (HCC) en la evolución de esta patología. La hepatitis autoinmune (HAI) es un proceso necroinflamatorio crónico, caracterizado por un aumento de los niveles de aminotranferasas, de la gama globulina, y por la presencia de autoanticuerpos circulantes elevados; los cuales determinan su clasificación en tres tipos principales: HAI tipo 1 (positivo para ANA y/o ASMA); HAI tipo 2 (positivo para LKM) y HAI tipo 3 (positivo para SLP/LP). El tratamiento consiste en la terapia inmunosupresora con corticoides y/o azatioprina, generalmente con respuesta favorable(1). Aunque la etiología parece ser el resultado de una combinación de factores genéticos y ambientales; sigue siendo incierta. Aparentemente, una respuesta inmune contra autoantígenos del hígado inicia y perpetúa el daño hepático. Diferentes factores genéticos interactúan generando susceptibilidad a la HAI, determinando las diversas manifestaciones clínicas y marcando la diferencia en la respuesta al tratamiento. Existe una fuerte asociación dentro del gen HLA DRB1. Las moléculas HLA DR3 (DRB1*03031) y DRB4 (DRB1*0401) confieren susceptibilidad a la HAI tipo 1 en Europa y América del Norte; mientras que HLA DR7 (DRB1*0701) y DR3 (DRB1*0301) se asocian con una susceptibilidad para HAI tipo 2. Los pacientes con DRB1*0701 tienen una forma de enfermedad más agresiva y el pronóstico es desfavorable. En un estudio argentino, Pando y col. encontraron una fuerte asociación con HLA DR4 para las HAI en la población adulta de la Argentina, similar a México y Japón. En cambio, la población pediátrica estudiada (niños de Argentina y Brasil, con HAI tipo 1) mostraron una diferente y fuerte asociación con el haplotipo HLA DRB1*1301 y DQB1*0603 (2). Hasta ahora no se había investigado en relación a la predisposición genética de la hepatopatía autoinmune y el desarrollo de hepatocarcinoma. Umemura y col. realizaron un estudio donde se investigó la presencia de HLA clase I A, B y C y HLA clase II haplotipos DRB1, DQB1 y DPB1, en una cohorte de 156 pacientes de descendencia japonesa, con diagnóstico de HAI tipo1, fueron comparados con 201 sujetos sanos. Los pacientes con diagnóstico de HAI durante enero de 1979 a marzo de 2013 fueron incluidos en este estudio y tuvieron un período medio de seguimiento de 118 meses (rango: 6 a 403 meses). Se observó que los haplotipos DRB1*0405DQB1*0401 estaban asociados significativamente a HAI tipo 1; y además los haplotipos DRB1*08: 03 DQB1 *06:01 se asociaban con falla hepática y los haplotipos DRB1* 15:01 y DRB1 *06:02 con el desarrollo de HCC. El número de pacientes que presentó HCC fue solo de un 4% de la población estudiada, por lo cual son necesarios nuevos estudios para fortalecer esta asociación (3). Clásicamente los factores de riesgo para HCC son principalmente la presencia de cirrosis hepática (independientemente de su etiología), el sexo masculino y la edad (4). Es importante desarrollar este punto con mayor profundidad ya que la baja incidencia de HCC en la hepatopatía autoinmune podría estar ligada a la prevalencia sobre el sexo femenino, pero no es de menor importancia que AAEEH • 39 ASOCIACIÓN ARGENTINA PARA EL en HAI la cirrosis es la forma más frecuente de presentación en los pacientes de mayor edad. La HAI es una enfermedad que afecta predominantemente a mujeres de cualquier edad. Aunque clásicamente se le ha atribuido una curva etárea bimodal con un primer pico de prevalencia en la pubertad y un segundo pico perimenopaúsico alrededor de los 50 años, la mayor incidencia se observa por encima de los 65 años (5). En el estudio de Czaja y Carpenter, donde se compararon pacientes con HAI tipo 1, mayores de 60 años con un grupo de pacientes menores de 30; observaron que en el grupo mayor de 60 años, presentaban una mayor frecuencia de cirrosis al momento del diagnóstico y de asociación con otras comorbilidades probablemente inmunomediadas. La respuesta al tratamiento inmunosupresor era superior y el porcentaje de fracasos terapéuticos solo del 5% en contraposición de un 24% en el grupo menor de 30 años. Esta diferencia entre ambos grupos etarios estaba marcada también por la presencia de HLA DR4 en el grupo de mayores de 60 años y principalmente HLA DR3; pudiendo esto condicionar la diferencia en los gatillos etiológicos y en la respuesta inmunológica (5) . Una falta de concientización de la prevalencia de esta enfermedad y este tipo de presentación puede retardar el diagnóstico de la HAI crónica en la población de mayores con una lenta y silenciosa evolución hacia la cirrosis; y de este modo aplazarse el diagnóstico hasta la aparición del hepatocarcinoma. En cuanto a la probabilidad de padecer una hepatopatía autoinmune las mujeres tienen 10 veces mayor probabilidad que los hombres para CBP y una predisposición 4 veces mayor para hepatitis autoinmune. El mecanismo exacto de esta diferencia entre géneros en la enfermedad hepática autoinmune y autoinmunidad en general, no son claramente conocidos. Sin embargo, tanto la inmunogenética, como las hormonas sexuales juegan un complejo rol interactivo. Los esteroides sexuales alteran el sistema inmune en diferentes niveles: pueden regular la expresión de los genes a través de la respuesta a esteroides, alteran la presentación de antígenos a través de los efectos sobre HLA y modifican el microambiente de las citoquinas. En el caso de la CBP la sobrevida es 40 similar en ambos sexos. Se presenta en la mujer joven con prurito intenso y parece tener una baja tasa de fibrosis comparada, con los hombres. En pacientes con HAI, la tasa de progresión a la cirrosis, la falla al tratamiento y la muerte por falla hepática, es equivalente en mujeres y hombres. Las mujeres tienen menos probabilidad de tener CEP. Más del 60% de pacientes con CEP son hombres. El género no es un factor de riesgo independiente para mortalidad por CEP. El colangiocarcinoma es más frecuente en hombres (6). Con respecto a la patología tumoral existen diferencias entre ambos sexos, en la incidencia de tumores; benignos y malignos. Mientras que los tumores benignos son más frecuentes en mujeres, los tumores malignos son más frecuentes en hombres en una relación 3 a 4 cada 1 mujer. El HCC es el 5° tumor más frecuente en hombres y el 9° en las mujeres; con una tasa de incidencia para hombres de 6.7 por 100.000/habitantes al año comparado con 2.0 por 100.000 para mujeres, según datos de Surveillance, Epidemiology and End Results (SEER). El pico de incidencia ocurre en las mujeres 2 décadas más tarde que en los varones; 4,4 por 100.000/anual a los 65 años y 4,2 por 100.000/anual entre los 45 a 49 años, respectivamente. La diferencia en ambos sexos persiste luego de ajustar los factores confundidores como diagnóstico de hepatitis virales o hepatitis alcohólica, ambas más frecuentes en hombres. En cuanto al manejo del HCC en general y los resultados del tratamiento no hay diferencias significativas relacionadas al sexo, sin embargo hay diferencias en las recomendaciones para la vigilancia según las guías de la Asociación Americana para el Estudio de las Enfermedades del Hígado (AASLD): la vigilancia para HCC debe iniciarse a los 50 años en mujeres asiáticas con infección por virus B y en cambio se recomienda iniciarse a los 40 años en los hombres asiáticos con la misma etiología (7). En el estudio poblacional de Dinamarca sobre incidencia, prevalencia y pronóstico de la hepatitis autoinmune se observó un incremento de la incidencia de hepatitis autoinmune durante el período 1994 al 2012. Los factores adversos para el pronóstico fueron la cirrosis y el género L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 masculino. Se incluyeron 1721 pacientes con hepatitis autoinmune de los cuales 5 presentaron HCC al momento del diagnóstico y 8 pacientes desarrollaron HCC durante el seguimiento. El riesgo acumulado a los 10 años de HCC fue del 0.7% (95% CI 0.3-1.5). La incidencia fue 0.8 por 1000 personas al año (95% CI 0.3-1.5). El sexo masculino y la cirrosis al diagnóstico de HAI también fueron factores de riesgo para desarrollar HCC (8). Si bien, la tasa con la que se presenta es muy baja solo 0,7 % en hombres con fibrosis o cirrosis y no es suficiente para cambiar las recomendaciones actuales (9). Cabe destacar que los estudios poblacionales son necesarios para conocer la real presentación de la HAI; ya que los factores genéticos y ambientales pueden modificar su incidencia y prevalencia y contribuir así al desarrollo de claras recomendaciones. Entre otros estudios, donde se estudió la incidencia de HCC en los pacientes con HAI (10) se encuentra el estudio de Yeoman y col. publicado en 2008 quienes desarrollaron un estudio de cohorte prospectiva; se incluyeron 243 pacientes con un seguimiento promedio de 11 años (rango: 1 -36 años). Observaron que la cirrosis está presente en los pacientes, previamente al desarrollo de HCC y la incidencia de HCC es de 1,1% anual. Se concluyó que el riesgo de desarrollar HCC en HAI es suficiente para recomendar la vigilancia (11) . Sin embargo esto no se acerca al cut–off de 1.5% necesario para el cual la vigilancia de HCC es costo-efectiva. Por lo tanto, no se puede hacer una recomendación para incluir a estos pacientes por el antecedente etiológico de HAI, en un programa de vigilancia según AASLD (7). La CBP es una hepatopatía crónica que afecta mujeres de mediana edad. Histológicamente presenta injuria de los conductos biliares principalmente y hallazgos característicos de colangitis destructiva no supurativa crónica seguido de una pérdida progresiva de los conductos biliares. El diagnóstico se realiza por aumento de fosfatasa alcalina y la presencia de anticuerpos antimitocondriales (AMA) en el 90 -95% de los casos. La evolución natural es hacia una cirrosis biliar irreversible siendo el trasplante hepático el único tratamiento para la falla hepática. Si bien la disfunción hepática es la complicación que frecuentemente marca el pronóstico de la enfermedad; el HCC lo es en el 0.76-5,9% de los pacientes con CBP. De acuerdo a recientes estudios parece ser que la incidencia de complicaciones por HCC se ha incrementado gradualmente en el contexto de la mejoría de los tratamientos y de la sobrevida. Generalmente, el hallazgo de HCC se da en el contexto de un estadio de cirrosis avanzada. Si bien se considera que la CBP puede estar asociada con un incremento del riesgo para algunas neoplasias (cáncer de mama, cáncer de páncreas, etc.) y de HCC, no se ha identificado un factor carcinogénico asociado (12). Harada y col. estudiaron la situación actual de carcinogénesis en pacientes con CBP en Japón. Incluyeron 2946 pacientes con CBP y 2100 pacientes fueron sometieron a biopsia hepática para analizar el estadio histológico. Se excluyeron a los portadores de HBsAg y anti HCV Ig G positivos y con historia de consumo de alcohol por el peso que tienen estas patologías en el desarrollo de HCC. La incidencia de HCC durante el seguimiento fue de 2,4% anual en todo el grupo. La incidencia por género fue 5,1% en hombres y 2.0% en mujeres. La proporción de hombres fue 26,7%. El análisis multivariado de los factores de riesgo asociados con HCC por género, mostró al estadio histológico al momento del diagnóstico de CBP como un factor de riesgo independiente asociado con el desarrollo de HCC en mujeres, pero no así en hombres. El análisis comparativo entre pacientes con CBP con y sin HCC reveló que el género masculino, la edad, los niveles bajos de albúmina, y de colesterol plasmático, el estadio histológico avanzado y un estadio sintomático al momento del diagnóstico de CBP son factores de riesgo para HCC. El pronóstico fue significativamente pobre en los pacientes con HCC con respecto a los que no desarrollaron esta complicación. La incidencia acumulativa de carcinogénesis fue de 6,5% en varones y 2.0% en mujeres durante los 10 años luego del diagnóstico de CBP y esta diferencia entre hombres y mujeres fue estadísticamente significativa (p< 0.0001). La conclusión fue que los hombres tienen mayor riesgo de desarrollar HCC en cualquier estadio de CBP y deberían ser sometidos a un cuidadoso screnning para HCC en estadios tempranos (13). AAEEH • 41 ASOCIACIÓN ARGENTINA PARA EL En Argentina la CBP sigue considerándose una enfermedad de baja frecuencia y no hay información estadística de la real incidencia de CBP para realizar una clara conclusión al respecto. La CEP es un síndrome colestático crónico que se caracteriza por la inflamación y fibrosis difusa de los conductos biliares intrahepáticos y extrahepáticos. Afecta preferentemente a los hombres en el rango etario de 25 a 45 años y se asocia a colitis ulcerosa en el 50 a 75% de los casos. Generalmente es asintomática, se sospecha por la elevación de la fosfatasa alcalina y gamaglutamiltranspeptidasa y se diagnostica mediante una colangiografía retrógrada endoscópica o la colangioresonancia, que muestra el típico aspecto en rosario de la vía biliar. Desde el punto de vista histológico, se observa un infiltrado inflamatorio portal que puede evolucionar a fibrosis periportal. Produce fibrosis progresiva de la vía biliar intra y extrahepática, con estenosis biliares, colestasis progresiva, colangitis y cirrosis biliar primaria. En más del 70% de los casos se encuentra reactividad p-ANCA y un haplotipo HLA DR3 B8 en la mayoría de los pacientes. La hepatopatía evoluciona en forma independiente de la enfermedad intestinal, pudiendo en algunos casos precederla. Los pacientes con CEP tienen riesgo incrementado para desarrollar tumores hepatobiliares (colangiocarcinoma, hepatocarcinoma y carcinoma de vesícula) así como también para desarrollar, cáncer de páncreas y colorrectal. Por lo tanto, se requiere estrategias de vigilancia para el seguimiento de estos pacientes. Para el colangiocarcinoma se recomienda un screening en intervalos anuales con estudios por imágenes, ecografia y/o resonancia más dosaje de CA 19-9 independientemente del estadio de la enfermedad. Estos estudios de imágenes involucran también la detección de cáncer de vesícula y HCC. En estos pacientes el riesgo de colangiocarcinoma es 160 veces mayor que en la población general y el riesgo de HCC para CEP en estadio de cirrosis se ha estimado en 2% anual y estaría incrementado en todos los pacientes con CEP (14). Sin embargo la incidencia de HCC en pacientes con CEP en estadio de cirrosis no ha sido bien estudiada y quienes reúnen mayor experiencia consideran que estaría por debajo del 1,5 % anual, umbral que se requiere para establecer una estrategia de vigilancia (15)(7). Por lo tanto, podemos concluir para las hepatopatías autoinmunes el seguimiento y vigilancia para HCC debe incluir a todos los pacientes con cirrosis utilizando los métodos diagnósticos en el período que acuerde este consenso para otras causas de cirrosis independientemente de la edad y el sexo. Estudios poblacionales de prevalencia e incidencia de las hepatopatías autoinmunes, su pronóstico y la asociación con HCC son necesarios para mejorar en el futuro estas recomendaciones en nuestro medio. Referencias 1. Manns M, Lohse A, Vergani D, Autoimmune hepatitis update 2015 Journal of Hepatology 2015;62:S100-S111. 9. Schramm Ch, Lohse A, Autoimmune Hepatitis on the Rise Journal of Hepatology 2014 vol 60: 478-479. 2. Pando M, Larriba J, Fernández G, et al. Pediatric an adult forms of type 1 autoimmune hepatitis in Argentina: evidence for differential genetic predisposition Hepatology 1999; 30:1374-1380. 10. van Meer S, de Man RA, Siersema PD, van Erpecum KJ, Surveillance for hepatocellular carcinoma in chronic liver disease: Evidence and Controversies. World J Gastroenterol 2013 19(40) 6744-6756. 3. Umemura T, Katsuyama Y, Yoshizawa K. et al 2014 Human Leukocyte Antigen class II Haplotypes affect clinical Characteristics and Progression of Type 1Autoimmune Hepatitis in Japan. PLoS ONE 9(6) e100565. doi:10.1371/journalphone0100565. 11. Yeoman A, Al-Chalab T, Kanami J, and col Evaluation of risk factors in the development of HCC in Autoimmune Hepatitis implications for followup and screening Hepatology 2008; 48: 863-870. 4. Okuda K. Hepatocellular carcinoma. J Hepatol 2000; 32(suppl 1):225237. 5. Villamil A, Factores Pronósticos en la Hepatitis Autoimmune Tipo1 ¿Qué hay de Nuevo? Acta Gastroenterológica Latinoamericana 2006; 36: 94-100. 6. Guy J, Peters M, Liver Disease in Women: The Influence of Gender on Epidemiology, Natural History, and Patients Outcomes. Gastroenterology and Hepatology 2013 Vol 9; 10:633-638. 7. Bruix J, Sherman Management of Hepatocellular carcinoma An Update. Hepatology AASLD Practice Guideline 2010: 1-35 8. Gronbaek L , Vilstrup Hendrik , Jepsen P. Journal of Hepatology 2014 vol 60 : 612-617. 42 12. Liang Y, Yang Z, Zhong R Primary Biliary Cirrhosis and Cancer Risk: A Systematic Review and Meta-analysis Hepatology 2012 56:1409-1417. 13. Harada K, Hirohara J, Yoshiyuki U, Toshiaki N, Yuko K, Hirohito T, Takafumi I, Yasuni N, Incidence of and Risk Factors for Hepatocellular Carcinoma in Primary Biliary Cirrhosis: National Data from Japan Hepatology 2013; 57: 1942-1949. 14. Harnois DM, Gores JG, Ludwig J, Steers JL, LaRusso NE, Wiesner RH. Are patients with cirrhotic stage primary sclerosing cholangitis at risk for the development of hepatocellular cancer? Journal of Hepatology. 1997; 27:512–516. 15. Razumilava N, Gores G, Lindor K, Cancer Surveillance in patients with Primary Sclerosing cholangitis, Hepatology 2011 54(5) 1842-1852. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Profilaxis Primaria y Secundaria del Hepatocarcinoma Hepatocelular Dres Fernando Bessone, Diana Krasniansky, Guillermo Ortiz El hepatocarcinoma hepatocelular (HCC) es el sexto tumor más frecuente en el mundo y la tercer causa de muerte asociada a tumores. Aproximadamente 650.000 personas fallecen anualmente debido a este cáncer hepático y dos tercios de ellas viven en el continente asiático. Debido a que la hepatitis B afecta a 400 millones de personas en el planeta, el HBV es el factor de riesgo más importante y culpable de al menos el 50% de los HCC. Dentro de las estrategias de prevención del HCC debemos distinguir aquellas dirigidas a prevenir los factores de riesgo que pueden contribuir al desarrollo del tumor, como ocurre con la prevención de hepatitis virales (profilaxis primaria), y por otra parte, aquellas medidas realizadas en individuos susceptibles y como parte de una detección temprana (pacientes cirróticos con enfermedad tratada y curada), como ocurre en aquellos casos que recibieron tratamiento para hepatitis (profilaxis secundaria). Existe además una prevención terciaria, que es aquella dirigida a disminuir el riesgo de recurrencia del HCC luego de una resección quirúrgica curativa. Profilaxis primaria El objetivo más importante de la profilaxis primaria es prevenir el HCC en las personas sanas. El abordaje de mayor impacto en este campo, es limitar la infección por HBV utilizando la herramienta más poderosa que es la vacunación anti-hepatitis B. Esta vacunación, que se puso en marcha a partir de 1982, fue inicialmente utilizada solo en grupos de riesgo (homosexuales, dializados, personal de salud, etc). Recien en 1991, la Organización Mundial de la Salud recomendó la vacunación universal contra la hepatitis B incluyéndola en el programa de inmunización de rutina en el neonato, niños o adolescentes. Si bien esta cobertura inicialmente no tuvo un largo alcance, alcanzó el 65% en el año 2007. Actualmente, la vacunación para hepatitis B es parte del Plan Nacional de Inmunización Infantil en 162 paises alrededor del mundo, impactando secundariamente en la disminución de la incidencia del HCC. La prevención en la adquisición del riesgo se relaciona en gran medida con las políticas de salud: buenos niveles sanitarios y de salud poblacional, regulaciones adecuadas para el manejo de carcinógenos ambientales (cloruro de vinilo, infección por Clonorchis sinensis, aflatoxinas), programas de educación para la salud –especialmente en lo referente a drogadicción intravenosa, promiscuidad sexual, alcoholismo y, más precisamente,en el ambiente hospitalario con respecto al conocimiento y respeto de las normas de bioseguridad. La detección temprana y el tratamiento del alcoholismo crónico así como la detección temprana y el manejo oportuno de la sobrecarga de hierro mediante el diagnóstico genético de hemocromatosis son también estrategias de prevención que se realizan en conjunto con el equipo asistencial de salud. Profilaxis secundaria Un papel significativo representa en este campo la terapéutica antiviral de las infecciones crónicas AAEEH • 43 ASOCIACIÓN ARGENTINA PARA EL por HBV y HCV, especialmente en las etapas tempranas previas a la aparición de cirrosis. Existen fuertes evidencias de que una terapia antiviral efectiva dirigida a controlar la infección por HBV y erradicar el HCV, reduce substancialmente el riesgo de HCC. Los resultados de los diferentes ensayos que involucran el tratamiento con interferon en HBV como medida profiláctica para evitar el HCC son controvertidos e inconsistentes, probablemente debido a la falta de supresión total de la replicación viral observada en un importante número de pacientes. En la hepatopatía crónica B, los potentes núcleos(t) idos análogos como entecavir y tenofovir, si bien demostraron en casi todos los estudios disminuir la tasa de HCC no pudieron confirmar su erradicación total. Es importante remarcar que ninguno de estos estudios fue diseñado para evaluar puntualmente el riesgo de aparición del HCC a largo plazo luego de finalizada la terapia antiviral. Si bien es coherente esperar una disminución en la incidencia del HCC luego de frenar la replicación viral y la evolución a cirrosis, todavía quedan varias preguntas por responder, como por ejemplo conocer cual es la resistencia generada por estos compuestos luego de varios años de tratamiento. Con respecto al HCV, la conclusión luego de analizar varios estudios fue que la protección conferida por la RVS fue del 90% con respecto al riesgo de desarrollar HCC. La aparición de este tumor luego de una RVS fue solo confirmada en unos pocos cientos de casos, donde la mayoría de ellos correspondieron a no respondedores a la terapia antiviral, pacientes mayores de 65 años, cirróticos, con alteraciones bioquímicas persistentes, historia de abuso de alcohol y/o enfermedad HBV oculta. Con respecto a la hemocromatosis, se demostró que el screening familiar, el diagnóstico precoz y medidas para evitar la sobrecarga, previnieron la aparición de HCC. Sin embargo, existen insuficientes evidencias para dar firmes recomendaciones sobre alcohol, obesidad, obesidad/sindrome metabólicoy otras enfermedades hepáticas. 44 La prevención en relación a la detección temprana debe realizarse mediante la vigilancia ecográfica cada 6 meses, la cual debe ser solicitada simultáneamente con la determinación plasmática de alfa feto proteína. Este esquema de seguimiento ha sido aceptado y recomendado por diferentes sociedades y consensos alrededor del mundo en pacientes con cirrosis. Conclusiones y controversias La prevención del HCC debe estar dirigida a prevenir la injuria hepática y la progresión a cirrosis. Uno de los mayores objetivos es lograr la vacunación anti-hepatitis B para toda la población. Una meta mucho más difícil de lograr es reducir la tasa de HCC identificando y tratando con terapia antiviral efectiva a todos los casos de hepatitis crónica B. Con respecto al HCV, la transmisión de este virus por fracaso en el método de screening en bancos de sangre o por contaminación intranosocomial, debiera hoy ser inaceptable. El virus todavía se transmite en determinados grupos de hombres que tienen sexo promiscuo con hombres y a través de la adicción a drogas endovenosas compartiendo jeringas. El objetivo prioritario para evitar cualquier situación de contagio es el desarrollo de una vacuna, la cual se encuentra todavía en fase experimental. A pesar de la implementación de una terapia antiviral efectiva, no se ha suprimido definitivamente la aparición de HCC. No sabemos aún cuales serán los futuros resultados utilizando los nuevos antivirales de acción directa. El alcohol como causa principal de cirrosis en varios países continúa siendo un problema mundial. Los últimos 100 años de esfuerzos por controlarlo han dado pobres resultados. La hepatopatía asociada a diabetes, sobrepeso y sindrome metabólico es actualmente reconocida como una causa común de HCC. Estudios futuros probablemente determinarán el obscuro mecanismo de carcinogénesis y si realmente los intentos de revertir la obesidad y la insulinoresistencia podrán lograr la prevención del HCC. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Debido a los vertiginosos cambios en varios de los campos relacionados con el desarrollo de HCC (carcinogénesis, prevención primaria, secundaria y terciaria, terapia biológica y monoclonal, etc), las recomendaciones y consensos debieran ser revisados al menos cada 5 años. Referencias 1. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin 2005;55:74-108. Study Group. Inhibition of Hepatocarcinogenesis by Interferon Therapy. Ann Intern Med 1999;131:174–181. 2. Parkin DM, Bray F, Ferlay J, Pisani P. Estimating the world cancer burden: Globocan 2000. Int J Cancer 2001;94:153-156. 9. Core Working Party for Asia–Pacific Consensus on Hepatitis B and C. Consensus statements on the prevention and management of hepatitis B and hepatitis C in the Asia–Pacific region. J. Gastroenterol. Hepatol. 2000;15:825–841. 3. Han KH, Ahn SH. How to predict HCC development in patients with chronic B viral liver disease? Intervirology 2005;48:23-28. 4. Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat 2004;11:97-107. 5. Zanetti AR, Van Damme P, Shouval D. The global impact of vaccination against hepatitis B: a historical overview. Vaccine 2008;26:6266-6273. 6. Chang MH, Chen CJ, Lai MS et al. Universal hepatitis B vaccination in Taiwan and the incidence of hepatocellular carcinoma in children. Taiwan Childhood Hepatoma Study Group. N. Engl. J. Med. 1997; 336: 1855–1859. 7. Beasley RP. Rocks along the road to the control of HBV and HCC. Ann Epidemiol 2009;19:231-234. 8. Yoshida H, Shiratori Y, Moriyama M et al. Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis C in Japan. IHIT 10. Makuuchi M, Kokuda N, Aril S et al. Development of evidence-based clinical guidelines for the diagnosis and treatment of hepatocellular carcinoma in Japan. Hepatol Res 2008; 38: 37–51. 11. Ueno Y, Sollano JD, Farrell GC. Prevention of hepatocellular carcinoma complicating hepatitis C. J Gastroenterol Hepatol 2009;24:531–536. 12. Morgan TR, Mandayam S, Jamal MM. Alcohol and hepatocellular carcinoma. Gastroenterology 2004; 127: S87–96 13. El-Serag HM, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology 2007;132: 2557–2576. 14. Huo TI, Wu JC, Lee SD. Are alcohol, tobacco and obesity genuine risk factors for hepatocellular carcinoma? J. Hepatol. 2005; 42: 941–943. 15. Caldwell SH, Crespo DM, Kang HS et al. Obesity and hepatocellular carcinoma. Gastroenterology 2004; 127: S97–S103. 1 AAEEH • 45 ASOCIACIÓN ARGENTINA PARA EL 2 46 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Hepatocarcinoma en Hígado no Cirrótico y en Pediatría Dras M. Cristina Cañero Velasco, Andrea Bosaleh, Mercedes García Lombardi Los tumores hepáticos primarios en los niños representan del 1 al 2% de todos los tumores. El hepatoblastoma (HB) es el tumor hepático más común (48%), y el hepatocarcinoma (HCC) es el segundo en frecuencia (27%), le siguen los tumores vasculares y sarcomas. El HCC tiene una incidencia de 0,3 a 0,4 casos por millón por año (23%) y representa una indicación para el trasplante hepático (TH) en niños. Aunque el HCC es más común en los adolescentes (10 a 14 años), ha sido reportado en niños menores de 5 años. La incidencia aumenta con la edad, es más frecuente en el sexo masculino (3 a 1). El HCC es primariamente una enfermedad de comienzo en la edad adulta, solamente un 0,5 a 1 % de los casos ocurren antes de los 20 años. Muchos factores etiológicos han sido relacionados con el desarrollo del HCC incluyendo cirrosis (de variada etiología incluyendo el consumo de alcohol), hepatitis B (HBV) y C (HCV), ingestión de alimentos contaminados con aflatoxinas. En Africa y sudeste asiático, la incidencia puede llegar de 90 a 100 casos por 100,000 habitantes, probablemente debido a la alta prevalencia de la infección crónica por virus B, donde la incidencia es aproximadamente 100 veces mayor que en la población negativa para este virus. La disminución de la infección por B debido a la vacuna universal ha llevado a una reducción de casos en los niños lo cual se reflejará en la población de adultos. Aunque la hepatitis C es un factor de riesgo para el HCC en adultos, es raro en los niños. En la tirosinemia tipo 1, la cirrosis es un hallazgo invariable. Previo a la introducción de la terapia con nitisinone, que previene la aparición de metabolitos citotóxicos junto con una dieta restringida en tirosina y fenilalanina, había un alto riesgo de HCC en niños o en la temprana adolescencia. También el HCC está asociado con la enfermedad por depósito de glucógeno tipos I y IV. Solamente alrededor del 30% de los casos pediátricos de HCC están asociados con cirrosis o con anormalidades hepáticas preexistentes al igual que el déficit de alfa-1-AT que tiene un mecanismo diferente para la carcinogénesis. Ultimamente, se ha sugerido que la colestasis intrahepática familiar progresiva tipo 2 (PFIC2) está asociada con una mutacion del gen ABCB11 que produce una deficiencia en la bomba exportadora de sales biliares (BSEP), y esto representa un específico y no reconocido riesgo para HCC en niños pequeños. En casos de atresia de vías biliares el desarrollo de HCC no está universalmente asociado con cirrosis y en casos de enfermedad de Wilson o con sindromes colestáticos que pueden no estar asociados con cirrosis (enfermedad de Alaguille y PFIC1 y PFIC3) parece no haber predisposición a la transformación maligna. Así, mientras el desarrollo de cirrosis claramente tiene parte en la oncogénesis, la exacta relación permanece no clara. Clínica Los síntomas de HCC en el hígado no cirrótico se acompañan de la presencia de una masa abdominal, son de mejor pronóstico, a veces con ictericia y con baja frecuencia se acompañan de insuficiencia hepática en los tumores de gran tamaño. Además, se pueden presentar con esplenomegalia, hipertensión portal, spiders, etc. El tipo fibrolamelar (FLM) es más frecuente en edades mayores (26,4 años). Los tests de función hepática son anormales en hígados cirróticos. En niños con PFIC2, los niveles de gamaGT son bajos. Se deben solicitar serologías para HBV y HCV, aminoácidos plasmáticos y urinarios, succyl AAEEH • 47 ASOCIACIÓN ARGENTINA PARA EL acetona en orina y el fenotipo para A-1-AT, y la confirmación genética del PFIC2, tirosinemia y enfermedad de Alaguille ante la sospecha de esa enfermedad. La alfafetoproteina (AFP) es un marcador útil para el diagnóstico y el pronóstico del HCC y su nivel es elevado en el 50 a 70% de los pacientes. Valores mayores de 400 ò 500 ng/mL en pacientes con cirrosis sugieren fuertemente el diagnóstico de HCC. Cuando los niveles retornan a valores normales después del tratamiento indican remisión mientras que si persisten anormales alertan la posibilidad de tumor residual o relapse. La variante FLM cursa con AFP normal pero con niveles elevados de vitamina B12 unida a proteínas especialmente a transcobalamina 1, se lo utiliza como marcador para monitorear la respuesta y progresión de la enfermedad. Diagnóstico En la ecografía (US), la apariencia típica del HCC es de una masa grande, heterogenea (hiperecogénica) y vascular. La tomografia computada (TC) da información detallada de los límites anatómicos de los tumores hepáticos. La TC trifásica después de la inyección del contraste muestra al HCC típico en su fase arterial hipervascularizado e hipodenso o isodenso en la fase venosa portal. Esta técnica tiene una sensibilidad del 80 a 85% y una especificidad de 90 a 95%. La RMN es considerada como la determinación de elección debido a que tiene buena definición del tumor y el área de infiltración permitiendo una evaluación precisa de los segmentos comprometidos. La RMN muestra una masa heterogénea (pero hipointensa) en las imágenes de T1 y levemente hipertensa en comparación con el hígado normal en las imágenes en T2. Con contraste, las imágenes muestran un patrón similar a la TC con temprano realce arterial y señales reducidas en intensidad en la fase venosa portal. Estas observaciones tienen importancia para poder estadificar el tumor y para proponer una intervención quirúrgica. La anatomía vascular puede verse y determinar la necesidad de realizar una angiografía. El PET muestra áreas de alto metabolismo que pueden ayudar a encontrar sitios extrahepáticos no 48 detectados (como metástasis o recurrencia de la enfermedad). Biopsia hepática (BH) La BH es necesaria en todos los pacientes sin cirrosis. En caso de cirrosis, el HCC puede a menudo ser diagnosticado por imágenes y aumento de AFP. Sin embargo, la biopsia puede ser requerida en casos dudosos, especialmente con pequeñas lesiones (<2cm). Se debe obtener biopsia de tamaño adecuado para certificar el diagnostico sin complicaciones. La cirrosis parece un factor determinante para niños y adultos y la hepatitis viral es un factor de riesgo para ambos grupos. Como ya hemos explicado, los factores de riesgo en los niños también incluyen depósitos de glucógeno tipo1 y PFIC2 (enf ABCB11). La ausencia del BSEP canalicular se correlaciona bien con las mutaciones ABCB11. Los efectos tóxicos de de las sales biliares intracanaliculares se han postulado como un mecanismo causante de modificaciones genómicas. Las características moleculares y citogenéticas se han estudiado mucho más en adultos que en niños. El HB es inusual en niños mayores de 5 años, puede ocurrir en aquellos de muy bajo peso de nacimiento o como parte de un síndrome multisistémico. El carcinoma tipo fibrolamelar afecta a adolescentes y adultos jóvenes en hígados no cirróticos, la AFP no está elevada. Este tumor tiene grandes células con citoplasma oncocítico eosinofílico en un estroma hialinizado. La apariencia oncocítica es por acumulación de mitocondrias, la inmunohistoquímica se expresa con marcadores biliares y hepatocelulares. En comparación con el HCC convencional, el fibrolamelar muestra menores alteraciones genéticas. Staging clínico: aún no es uniformemente aceptado para niños. El sistema PRETEX desarrollado por la Sociedad Internacional de Estudio del Tumor Hepático (2005) puede ser la mejor vía de comparación de los resultados de estudios en niños. Este sistema divide a los niños en 4 grupos de acuerdo al número de secciones del hígado libres de tumor, la extensión extrahepatica y las metástasis son separadamente clasificadas. El staging por PRETEX estratifica a los pacientes por el más efectivo tratamiento que es la resección quirúrgica. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Tratamiento El manejo clásico de todos los tumores malignos hepáticos consiste en una combinación de quimioterapia y resección quirúrgica. Resección hepática Cuando se presenta un tumor resecable en un niño o adulto joven se recomienda el procedimiento sin PBH, en estas condiciones no se llega a mas del 20% como terapéutica inicial. Pretex I y II son fácilmente resecables por cirugía pero el PRETEX III requiere de profesionales experimentados en resecciones hepáticas, el PRETEX IV son considerados no resecables. El objetivo en la resección quirúrgica del HCC es adquirir una completa extirpación del tumor con márgenes de al menos 1 cm. La US intraoperatoria es importante para determinar el segmento hepático a remover y los planos de resección seguros. El volumen del hígado que puede ser removido se mide con TC o RMN, los ganglios del ligamento hepatoduodenal deben ser revisados ya que tienen un significado efecto en el pronóstico. Después de la resección, la sobrevida a los 5 años es del 35 al 50%, con una tasa de recurrencia del 20 al 30% a los 5 años. Trasplante hepático (TX) su rol en la estrategia de tratamiento permanece bajo los criterios de Milan (tumor <5cm, o no más de 3 tumores y que cada uno no exceda los 3 cm de diámetro) como el limite seguro para el TX. Fue reportada una tasa de sobrevida a 5 años del 70%. No hay estudios prospectivos randomizados comparando resección versus trasplante para HCC en niños, la experiencia publicada con Tx hepático en niños es limitada. Un reciente reporte de Pittsburgh mostró mejoría de la sobrevida en un 60% a los 5 años y se confirmó la negativa influencia del tamaño tumoral y la invasión vascular en el pronóstico del paciente con HCC. Las contraindicaciones para el TX incluyen enfermedad extrahepática y tumor tipo fibrolamelar. Las decisiones deben tomarse al analizar el caso en forma individual. Terapias ablativas La ablación por radiofrecuencia (ARF) y la inyección percutánea de etanol son los métodos más comunes para la ablación tumoral. La ARF es comparable a la extirpacion quirúrgica cuando el tumor es <3 cm, mientras que cuando el tumor es >5cm es mejor la remoción quirúrgica. Poco es conocido acerca de la técnica de ARF en niños con HCC, en estos los tumores tienden a ser >5cm. Las indicaciones de la quimioembolización transarterial (TACE), son iguales en adultos y niños, puede ser un puente al Tx o a la resección en aquellos no resecables. Las ventajas de la TACE consisten en poder pasar grandes concentraciones de drogas citotóxicas en un tumor muy vascularizado por las ramas de la arteria hepática. En niños con HCC la TACE puede ser segura en aquellos sin cirrosis. Quimioterapia (QMT): hay una extensa experiencia con el manejo médico del HCC en adultos y a pesar de ello no hay evidencia publicada que demuestre que esto es un beneficio para la sobrevida del paciente. Respuesta a la terapia puede ser monitoreada por repetir TC ò US y Rx tórax, niveles de AFP, una falla en los niveles de transcobalamina en el fibrolamelar. La sobrevida post Tx hepático en 135 niños fue del 86% al año, 63% a los 5 años y 58% a los 10 años. La causa primaria de muerte fue recidiva o metástasis. El FLM tuvo un 31% de respuesta a la QMT comparado con el 53% en el HCC, con igual sobrevida a los 3 años. Los niños con HCC resecables tienen un buen pronostico de sobrevida independientemente del tipo histológico (50%), mejor que aquellos con HB. Resumen 1. El HCC es un raro pero importante tumor en niños, la incidencia puede bajar por la vacunación de hepatitis B y por la terapia de la Tirosinemia. 2. Aunque el diagnóstico es un desafio y el pronóstico variable, el diagnóstico temprano y la resección completa se asocian con un buen pronóstico. 3. El Tx hepático parece ser una opción viable para seleccionados niños sin metástasis extrahepáticas. AAEEH • 49 ASOCIACIÓN ARGENTINA PARA EL Referencias 1. Moore SW, Davidson A, Hadley GP, et al. Malignant liver tumors in South African children: a national audit. World J Surg 2008;32:1389–1395. 2. Mann JR, Kasthuri N, Raafat F, et al. Malignant hepatic tumours in children: incidence, clinical features and aetiology. Paediatr Perinat Epidemiol 1990;4:276-289. 3. Hall AJ, Winter PD, Wright R. Mortality of hepatitis B positive blood donors in England and Wales. Lancet 1985;1:91-93. 4. Chen WJ, Lee JC, Hung WT. Primary malignant tumour of liver in infants and children in Taiwan. J Pediatr Surg 1988;23:457-461. 5. Chan KL, Fan ST, Tam PK, et al. Paediatric hepatoblastoma and hepatocellular carcinoma: retrospective study. Hong Kong Med J 2002;8:13-17. 6. Brechot C, Pourcel C, Louise A, et al. Presence of integrated hepatitis-B virus DNA in cellular DNA of human hepatocellular carcinoma. Nature 1980;286:533-535. 7. Perilongo G, Pontisso P, Basso G. Can primary cancer of the liver in Western countries be prevented? Pediatric point of view. Med Pediatr Oncol 1990;18:57-60. 8. Chang MH. Hepatitis B virus and cancer prevention. Recent Results Cancer Res 2011;188:75–84. 9. Malik S, Dekio F, Wen JW. Liver transplantation in a child with multifocal hepatocellular carcinoma hepatitis C & management of post-transplant viral recurrence using boceprevir. Pediatr Transplant 2014;18:E64-68. 10. Holme E, Lindstedt S. Nontransplant treatment of tyrosinemia. Clin Liver Dis 2000;4:805-814. 11. McKiernan PJ. Nitisinone in the treatment of hereditary tyrosinaemia type 1. Drugs 2006;66:743-750. 12. Manzia TM, Angelico R, Toti L, et al. Glycogen storage disease type Ia and VI associated with hepatocellular carcinoma: two case reports. Transplant Proc 2011;43:1181–1183. 13. Zen Y, Vara R, Portmann B, et al. Childhood hepatocellular carcinoma: a clinicopathological study of 12 cases with special reference to EpCAM. Histopathology 2014;64:671–682. 14. Bhadri VA, Stormon MO, Arbuckle S, et al. Hepatocellular carcinoma in children with Alagille syndrome. J Pediatr Gastroenterol Nutr 2005;41:676–678. 15. Weinberg AG, Finegold MJ. Primary hepatic tumors of childhood. Hum Pathol 1983;14:512–537. 16. Katzenstein HM, Krailo MD, Malogolowkin MH, et al. Hepatocellular carcinoma in children and adolescents: results from the Pediatric Oncology Group and the Children’s Cancer Group intergroup study. J Clin Oncol 2002;20:2789–2797. 17. Dietrich CF, Ignee A, Trojan J, et al. Improved characterisation of histologically proven liver tumours by tumours by contrast enhanced ultrasonography during the portal venous and specific late phase of SHU 508A. Gut 2004;53:401-405. 18. Kojiro M, Roskams T. Early hepatocellular carcinoma and dysplastic nodules. Semin Liver Dis 2005;25:133-142. 19. Burrel M, Llovet JM, Ayuso C, et al. MRI angiography is superior to helical CT for detection of HCC prior to liver transplantation: an explant correlation. Hepatology 2003;3:1034-1042. 20. Taouli B, Losada M, Holland A, et al. Magnetic resonance imaging of hepatocellular carcinoma. Gastroenterology 2004;127(5 Suppl 1):S144152. 21. Bruix J, Sherman M, Llovet JM, et al. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol 2001;35:421-430. 22. Postovsky S, Elhasid R, Ben Arush MW, et al. Local dissemination of hepatocellular carcinoma in a child after fine-needle aspiration. Med Pediatr Oncol 2001;26:667-668. 23. Mauren KE, Nghiem HV, Marrero JA, et al. Lack of tumor seeding after percutaneous biopsy of hepatocellular carcinoma using coaxial cutting needle technique [abstract]. Am J Roentgenol 2005;184(Suppl 4):37. 24. Portmann BC. Liver biopsy in the diagnosis of inherited metabolic disorders. In: Anthony PP, MacSween RN, editors. Recent advances in histopathology, vol. 13. Churchill Livingstone; 1987. p. 139–159. 25. Seda Neto J, Leite KM, Porta A, et al. HCC prevalence and histopathological findings in liver explants of patients with hereditary tyrosinemia type 1. Pediatr Blood Cancer 2014;61:1584-1589. 26. Angileri F, Morrow G, Roy V, et al. Heat shock response associated with hepatocarcinogenesis in a murine model of hereditary tyrosinemia type I. Cancers (Basel) 2014;6:998–1019. 27. Knisely AS, Strautnieks SS, Meier Y, et al. Hepatocellular carcinoma in ten children under five years of age with bile salt export pump deficiency. Hepatology 2006;44:478–486. 50 28. Vilarinho S, Erson-Omay EZ, Harmanci AS, et al. Paediatric hepatocellular carcinoma due to somatic CTNNB1 and NFE2L2 mutations in the setting of inherited bi-allelic ABCB11 mutations. J Hepatol 2014;61:1178– 1183. 29. Iannelli F, Collino A, Sinha S, et al. Massive gene amplification drives paediatric hepatocellular carcinoma caused by bile salt export pump deficiency. Nat Commun 2014;5:38-50. 30. López-Terrada D, Alaggio R, de Dávila MT, et al. Towards an international pediatric liver tumor consensus classification: proceedings of the Los Angeles COG liver tumors symposium. Mod Pathol 2014;27:472–491. 31. Tanaka Y, Inoue T, Horie H. International pediatric liver cancer pathological classification: current trend. Int J Clin Oncol 2013;18:946–954. 32. Luo JH, Ren B, Keryanov S, et al. Transcriptomic and genomic analysis of human hepatocellular carcinomas and hepatoblastomas. Hepatology 2006;44:1012–1024. 33. Prokurat A, Kluge P, Ko_sciesza A, et al. Transitional liver cell tumors (TLCT) in older children and adolescents: a novel group of aggressive hepatic tumors expressing beta-catenin. Med Pediatr Oncol 2002;39:510–518. 34. Ward SC, Waxman S. Fibrolamellar carcinoma: a review with focus on genetics and comparison to other malignant primary liver tumors. Semin Liver Dis 2011;31:61–70. 35. Aronson DC, Schnater JM, Staalman CR, et al. Predictive value of the pretreatment extent of disease system in hepatoblastoma: results from the International Society of Pediatric Oncology Liver Tumor Study Group SIOPEL-1 study. J Clin Oncol 2005;23:1245–1252. 36. Silberhumer GR, Steininger R, Laengle F, et al. Intraoperative ultrasonography in patients who undergo liver resection or transplantation for hepatocellular carcinoma. Surg Technol Int 2004;12:145–151. 37. Achilleos O, Buist LJ, Kelly DA, et al. Unresectable hepatic tumors in children and the role of liver transplantation. J Pediatr Surg 1996;31:1563–1567 38. Tagge EP, Tagge DU, Reyes J, et al. Resection, including transplantation, for hepatoblastoma and hepatocellular carcinoma: impact on survival. J Pediatr Surg 1992;27:292–297. 39. Iwatsuki S, Starzl TE, Sheahan DG, et al. Hepatic resection vs. transplantation for hepatocellular carcinoma. Ann Surg 991;214:221– 229. 40. Reyes JD, Carr B, Dvorchik I, et al. Liver transplantation and chemotherapy for hepatoblastoma and hepatocellular cancer in childhood and adolescence. J Pediatr 2000;136:795–804. 41. Ikeda M, Okada S, Ueno H, et al. Radiofrequency ablation and percutaneous ethanol injection in patients with small hepatocellular carcinoma: comparative study. Jpn J Clin Oncol 2001;31:297–298. 42. Lo CM, Ngan H, Tso WK, et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 2002;35:1164–1171. 43. Perilongo G, Shafford E, Maibach R, et al. Risk-adapted treatment for childhood hepatoblastoma. Final report of the second study of the International Society of Pediatric Oncology - SIOPEL 2. Eur J Cancer 2004;40:411-421. 44. von Schweinitz D, Burger D, Bode U, et al. Results of the HB-89 Study in treatment of malignant epithelial liver tumors in childhood and concept of a new HB-94 protocol. Klin Padiatr 1994;206:282–288. 45. McAteer JP, Goldin AB, Healey PJ, et al. Hepatocellular carcinoma in children: epidemiology and the impact of regional lymphadenectomy on surgical outcomes. J Pediatr Surg 2013;48:2194–2201. 46. Allan BJ, Wang B, Davis JS, et al. A review of 218 pediatric cases of hepatocellular carcinoma. J Pediatr Surg 2014;49:166–171. 47. Weeda VB, Murawski M, McCabe AJ, et al. Fibrolamellar variant of hepatocellular carcinoma does not have a better survival than conventional hepatocellular carcinoma–results and treatment recommendations from the Childhood Liver Tumour Strategy Group (SIOPEL) experience. Eur J Cancer 2013;49:2698–2704. 48. Pham TH, Iqbal CW, Grams JM, et al. Outcomes of primary liver cancer in children: an appraisal of experience. J Pediatr Surg 2007;42:834– 839. 49. Austin MT, Leys CM, Feurer ID, et al. Liver transplantation for childhood hepatic malignancy: a review of the United Network for Organ Sharing (UNOS) database. J Pediatr Surg 2006;41:182–186 50. Kelly D, Sharif K, Brown RM, Morland B. Hepatocellular Carcinoma in Children. Clin Liver Dis 2015;19:433-447. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 1 AAEEH • 51 ASOCIACIÓN ARGENTINA PARA EL 52 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Módulo Screening y Vigilancia AAEEH • 53 ASOCIACIÓN ARGENTINA PARA EL 54 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Estudios Serológicos en el Screening de Hepatocarcinoma Drs. María Virginia Reggiardo, Rodolfo Cattaneo, Daniel Cocozzella La alfa feto proteína (AFP) es el biomarcador más utilizado en el screening y vigilancia del hepatocarcinoma (HCC), a su vez es el más estudiado (1-3) y con el cual se han cumplido las cinco fases de evaluación de biomarcadores (Estudios preclínicos, estudios de casos y controles, estudios longitudinales retrospectivos, estudios prospectivos y finalmente estudios randomizados controlados para determinar los efectos del biomarcador en la incidencia, morbilidad y mortalidad de la enfermedad) (4-5). El nivel de corte de 20 ng/ml es el valor de AFP con el que se ha obtenido una mejor relación especificidad / sensibilidad (5), este valor ha sido adoptado en la mayoría de los estudios obteniéndose una sensibilidad y especificidad que oscilan entre el 49% y el 71 % y entre el 49% y el 86%, respectivamente, para los tumores menores de 5 cm(6-14). Una revisión sistemática más reciente utilizando este nivel de corte demostró una sensibilidad de 41% a 65% y una especificidad de 80% a 94%(15). Con niveles de corte menores (10.9 ng/ml) la sensibilidad de la AFP para el diagnóstico de HCC en estadio temprano fue de 65% y la especificidad de 82% (16) y los resultados del HALT-C estudio también revelan tasas bajas de sensibilidad y especificidad(17). Los bajos valores de sensibilidad se explican por qué solo una proporción,variable en las distintas series, de tumores tempranos, presentan elevaciones de la AFP. Por otro lado, la baja especificidad se atribuye al aumento de la AFP que se produce en ausencia de HCC principalmente asociado a la actividad de las hepatitis virales, sobre todo en presencia de cirrosis y a veces correlacionado con el aumento de transaminasas, lo que refleja la actividad necroinflamatoria, responsable del aumento de la AFP(18-20).De esto se desprende que la AFP no es recomendable como única metodología de vigilancia, salvo en poblaciones en donde la ultrasonografía(US) no está disponible (21). La combinación de AFP + US cada 6 meses,que es la estrategia utilizada actualmente en nuestro país y recomendada antiguamente (22),está siendo cuestionada desde hace varios años (23,24). Las guías americanas a partir del año 2005(25), incluyendo su última versión 2010(26) y las guías europeas 2012(27) desaconsejan el uso de AFP en la vigilancia y recomiendan la estrategia de US cada 6 meses. Esta recomendación no solo proviene de la baja especificidad y sensibilidad de la AFP sino de estudios que demuestran, que el agregado de la AFP a la US para la vigilancia, aumenta los costos, debido al mayor porcentaje de falsos positivos, que generan la solicitud de estudios por imágenes contrastados (TAC; RMI con scan dinámico), con un leve aumento de la sensibilidad (6-8%)(28-29). Sin embargo, esta postura tampoco es universalmente aceptada, las quías APSL (Asian Pacific Association for the Study of the Liver) (30) así como el NCCN (National Comprehensive Cancer Network)(31) siguen recomendando la estrategia combinada (AFP+US), y lasguías japonesas , recomiendan la combinación de US con biomarcadores, incluyendo la AFP(32). Otros autores, además, sugieren continuar con el uso de la estrategia combinada (5, 33-38). Un estudio reciente de la vida real ha demostrado con la combinación US+AFP una sensibilidad del 90% que fue superior a la US (58%), con un descenso no muy importante de la especificidad, del 92 al 83 %(39). Otro estudio retrospectivo de seguimiento de 1.600 pacientes durante 4.7 años llegó al diagnóstico de 363 HCC,el 59% en estadio temprano o muy temprano. La sensibilidad AAEEH • 55 ASOCIACIÓN ARGENTINA PARA EL de la combinación AFP+US fue del 99%, significativamente superior a la de la US (92%), con una especificidad de 68% algo inferior a la de la US (74.2%) pero que aumentóal 71.5% cuando se utilizó además como criterio, el aumento de la AFP durante el seguimiento (40). En este estudio se observó que en un 8% de los casos, un aumento de la AFP sin hallazgos en la US motivó estudios adicionales que llevaron al diagnóstico de HCC; algo similar fue observado en el estudio HALT-C en donde 6 de 39 HCC (15%) fueron sospechados por un aumento de la AFP con US normal (17), lo que sugiere que la AFP es complementaria a la US. Un dato fundamental a tener en cuenta, cuando se analiza el rol de la AFP en la vigilancia, es queeste es un biomarcador, simple, objetivo, confiable, reproducible, ampliamentedisponible, y de bajo costo. La ecografía en cambio es altamente dependiente de la experiencia del operador, de la calidad del equipamiento utilizado, y de las características del paciente; la seguridad para detectar nódulos pequeños disminuye con la nodularidad del parénquima cirrótico y en pacientes obesos (41). La sensibilidad de la US para detectar HCC temprano fue del 63% en un reciente metaanálisis con un rango entre 23 y 98%, revelando la heterogeneidad del método (29).La sensibilidad de la US para detectar HCC temprano aumenta en centros de referencia con ecografistas altamente capacitados (42) y es por eso que las guías europeas (27) recomiendan el entrenamiento especial de los ecografistas y que la vigilancia debe ser realizada por personal entrenado. La mejoría de la calidad de la US debe ser un objetivo primordial para asegurarse una vigilancia efectiva, sin embargo esta situación ideal puede no ser alcanzada fácilmente en la vida real y en la atención fuera de centros de referencia, y en este contexto la AFP continúa teniendo un papel relevante (5,39). Los estudios de costo beneficio utilizando el modelo de Markov son controvertidos. Para un estudio, la estrategia AFP+US mantiene una relación costo beneficio aceptable si bien no la compara con la US(43). Un estudio que incluye diferentes estrategias (44) concluye que la mejor relación costo beneficio se obtiene con la US, comparada con la combinación, salvo cuando las sensibilidad y la especificidad de la US cae por debajo del 65 y 60%, respectivamente. Otros autores 56 demuestran que el aumento de la expectativa de vida y el costo proveniente de la vigilancia del HCC son más dependientes de los tratamientos instituidos (resección, trasplante hepático) y de las características de la población vigilada, que de la estrategia utilizada para la vigilancia (45). Recientemente, se ha intentado optimizar la sensibilidad y especificidad de la AFP, bajando el nivel de corte(16), adaptándolo a la etiología de la cirrosis y a su estado de actividad o inactividad de la hepatitis, o utilizando la modificación en el tiempo de sus niveles(46-50), esto podría aumentar la efectividad de la combinación, si bien faltan estudios para aplicar estas estrategias de manera generalizada, son útiles para ayudar a definir una situación de discrepancia entra la US y la AFP. Cabe destacar que el principal estudio randomizado controlado demostrando la efectividad de la vigilancia en el HCC utilizóAFP + US (51) y no existen estudios randomizados controlados comparando la estrategia US vs US+AFP que avalen el abandono de la AFP como complemento de la US (52). Con respecto a los otros biomarcadores utilizados, los más estudiados, aunque con mucho menor evidencia que la AFP son, la desgamacarboxiprotrombina (DCP) también denominada Protrombina inducida por la ausencia de Vitamina K (PIVKA), y la AFP-L3 (fracción Lens culinaris agglutinin-reactive de la AFP) ambas estudiadas en fase 2 de desarrollo de biomarcadores (estudio de casos y controles) y con estudios en desarrollo en fase 3 (estudios retrospectivos longitudinales) y si bien los resultados son promisorios no podemos hacer recomendaciones aún (5,53). La introducción de la AFP-L3 ultrasensible parece aumentar la especificidad de este método (54). En conclusión queda clara la necesidad de mejorar la adherencia a la vigilancia del HCC y los métodos utilizados para la misma, mejorando en nuestro país la calidad y accesibilidad a la ecografía y desarrollando nuevos y más seguros biomarcadores. Mientras esto se obtiene consideramos que, reconociendo sus limitaciones, la AFP combinada con la US debería continuar siendo la estrategia recomendada para la vigilancia del HCC en nuestro medio. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Referencias 1. McMahon BJ, Bulkow L, Harpster A, Snowball M, Lanier A, Sacco F, et al. Screening for hepatocellular carcinoma in Alaska natives infected with chronic hepatitis B: a 16-year population based study. Hepatology 2000;32:842–846 2. Sherman M, Peltekian KM, Lee C. Screening for hepatocellular carcinoma in chronic carriers of hepatitis B virus: incidence and prevalence of hepatocellular carcinoma in a North American urban population. Hepatology 1995;22:432–438 3. Lok AS, Lai CL. alpha-Fetoprotein monitoring in Chinese patients with chronic hepatitis B virus infection: role in the early detection of hepatocellular carcinoma. Hepatology 1989;9:110–115 4. Pepe MS, Etzioni R, Feng Z, et al. Phases of biomarker development for early detection of cancer. J Natl Cancer Inst 2001;93:1054–1061. 5. N. Rich, A.G. Singal. Hepatocellular carcinoma tumour markers: Current role and expectations Best Practice & Research Clinical Gastroenterology 2014;28: 843-853 6. Trevisani F, D’Intino PE, Morselli-Labate AM, et al. Serum alphafetoprotein for diagnosis of hepatocellular carcinoma in patients with chronic liver disease: influence of HBsAg and anti-HCV status. J Hepatol 2001;34: 570–575. 7. Ikoma J, Kaito M, Ishihara T, et al. Early diagnosis of hepatocellular carcinoma using a sensitive assay for serum des-gammacarboxyprothrombin: a prospective study. Hepatogastroenterology 2002;49:235–238 8. Kasahara A, Hayashi N, Fusamoto H, et al. Clinical evaluation of plasma des-gammacarboxyprothrombin as a marker protein of hepatocellular carcinoma in patients with tumors of various sizes. Dig Dis Sci 1993;38:2170–6 9. Maringhini A, Cottone M, Sciarrino E, et al. Ultrasonography and alphafetoprotein in diagnosis of hepatocellular carcinoma in cirrhosis. Dig Dis Sci 1988; 33:47–51 10. Mita Y, Aoyagi Y, Yanagi M, et. al. The usefulness of determining desgamma-carboxyprothrombin by sensitive enzyme immunoassay in the early diagnosis of patients with hepatocellular carcinoma. Cancer 1998;82:1643–1648 11. Nomura F, Ishijima M, Horikoshi A, et al. Determination of serum des-gamma-carboxyprothrombin levels in patients with small-sized hepatocellular carcinoma: comparison of the conventional enzyme immunoassay and two modified methods. Am J Gastroenterol 1996;91:1380–1383 12. Nomura F, Ishijima M, Kuwa K, et al. Serum des-gammacarboxyprothrombin levels determined by a new generation of sensitive immunoassays in patients with small-sized hepatocellular carcinoma. Am J Gastroenterol 1999;94:650–654 13. Oka H, Saito A, Ito K, et al. Multicenter prospective analysis of newly diagnosed hepatocellular carcinoma with respect to the percentage of Lens culinaris agglutinin-reactive alpha-fetoprotein. J Gastroenterol Hepatol 2001;16:1378–1383 14. Suehiro T, Sugimachi K, Matsumata T, et al. Protein induced by vitamin K absence or antagonist II as a prognostic marker in hepatocellular carcinoma. Comparison with alpha-fetoprotein. Cancer 1994;73:2464– 2471 15. Gupta S, Bent S, Kohlwes J. Test characteristics of alpha-fetoprotein for detecting hepatocellular carcinoma in patients with hepatitis C. A systematic review and critical analysis. Ann Intern Med 2003;139:46e50. 16. Marrero J.A; Feng, Z, Wang, Y, Nguyen, M.H, et. al. Alphafetoprotein, des-gamma carboxyprothrombin, and lectin-bound alpha-fetoprotein in early hepatocellular carcinoma. Gastroenterology 2008; 137: 110-118. 17. Lok AS, Sterling RK, Everhart JE, et al. Des-gamma-carboxyprothrombin and alpha-fetoprotein for the early detection of hepatocellular carcinoma. Gastroenterology 2010;138:493-502. 18. Di Bisceglie AM, Sterling RK, Chung RT, et al. HALT-C Trial Group. Serum alpha-fetoprotein levels in patients with advanced hepatitis C: results from the HALT-C Trial. J Hepatol 2005;43:434–441. 19. Trevisani F, D’Intino PE, Morselli-Labate AM, P, et al. Serum alphafetoprotein for diagnosis of hepatocellular carcinoma in patients with chronic liver disease: influence of HBsAg and anti-HCV status. J Hepatol 2001;34:570–575. 20. Richardson P, Duan Z, Kramer J, et al. Determinants of serum alphafetoprotein levels in hepatitis C-infected patients. Clin Gastroenterol Hepatol 2012;10:428-33. 21. McMahonBJ, Bulkow L, HarpsterA , et. al. Screening for hepatocellular carcinoma in Alaska natives infected with chronic hepatitis B: a 16-year population-based study. Hepatology 2000; 32: 842-846. 22. Bruix J, Sherman M, et al. Clinical Management of Hepatocellular Carcinoma. Conclusions of the Barcelona-2000 EASL Conference. J Hepatol 2001; 35-421-430 23. Sherman M. Alphafetoprotein: an obituary. J Hepatol 2001; 34: 603605 24. Sherman M. Serological Surveillance for hepatocellular carcinoma. Time to quit. J Hepatol 2010; 52: 614-615 25. Bruix J, Sherman M et al.Management of Hepatocellular Carcinoma. Hepatology 2005; 42: 1208-1236 26. Bruix J, Sherman M; American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update. Hepatology 2011; 53:1020-1022. 27. EASL-EORTC Clinical Practice Guidelines: Management of Hepatocellular Carcinoma. J Hepatol 2012; 56: 908-943 28. Singal A, Volk ML, et al. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther 2009; 30: 37-47 29. Zhang B, Yang B. Combined alpha fetoprotein testing and ultrasonography as a screening test for primary liver cancer. J Med Screen 1999;6:108– 110. 30. Omata M, Lesmana LA, Tateishi R, et al. Asian Pacific Association for the Study of the Liver consensus recommendations on hepatocellular carcinoma. Hepatol Int 2010; 4:439-474 31. National Comprehensive Cancer Network (NCCN). NCCN clinical practice guidelines in oncology: hepatobiliary cancers. Version 2013. Fort Washington (PA):NCCN; 2013 32. Kudo M, Izumi N, Kokudo N, et al, HCC Expert Panel of Japan Society of Hepatology. Management of hepatocellular carcinoma in Japan: Consensus-Based Clinical Practice Guidelines proposed by the Japan Society of Hepatology (JSH) 2010 updated version. Dig Dis. 2011;29:339364 33. El-Serag HB, Davila JA.Surveillance for hepatocellular carcinoma: In whom and how? Ther Adv Gastroenterol 2011; 4: 5-10 34. El- Serag HB. Hepatocellular Carcinoma. N Eng J Med 2011; 365: 11181127 35. Marrero JA, El-Serag HB. Alpha-fetoprotein should be included in the hepatocellular carcinoma surveillance guidelines of the American Association for the Study of Liver Diseases. Hepatology 2011;53:10601061 letter to the editor [author reply 1061e1062]. 36. Wong RJ, Ahmed A, Gish RG. Elevated alpha-fetoprotein. Diferencial Diagnosis. Clin Liver Dis 2015. http://dx.doi.org/10.1016/j. cld.2015.01.005 37. Mehta A, Singal AG. Hepatocellular Carcinoma Surveillance: Does Alpha-Fetoprotein Have a Role? Gastroenterology 2015 Jul 28.pii: S0016-5085(15)01012-4. doi: 10.1053/j.gastro.2015.07.017 38. El-Serag HB, Kanwal F. Alpha Fetoprotein in Hepatocellular Carcinoma Surveillance: Mend It but Do Not End It. Clinical Gastroenterol Hepatol 2013; 11: 441-443 39. SingalAG ,Conjeevaram HS, Volk ML, et al. Effectiveness of Hepatocellular Carcinoma Surveillance in Patients with Cirrhosis. Cancer Epidemiol Biomarkers Prev 2012;21:793-799 40. Chang TS, Wu YC, Tung SY, et al. Alpha-Fetoprotein Measurement Benefits Hepatocellular Carcinoma Surveillance in Patients with Cirrhosis. Am J Gastroenterol 2015; 110: 836-844 41. Davila JA, Morgan RO, Richardson PA, et al. Use of surveillancefor hepatocellular carcinoma among patients with cirrhosis in the United States.Hepatology 2010;52:132–141. 42. Sato T, Tateishi R, Yoshida H, Ohki T, Masuzaki R, Imamura J, et al. Ultrasound surveillance for early detection of hepatocellular carcinoma among patients with chronic hepatitis C. Hepatol Int 2009;3:544–550. 43. Lin, O.S., Keeffe, E.B., Sanders, G.D. and Owens, D.K. Costeffectiveness of screening for hepatocellular carcinoma in patients with cirrhosis due to chronic hepatitis C. Aliment Pharmacol Ther 2004; 19: 1159-1172. 44. Anderson KL, Salomon JA, Chung Raymond et. al. Cost-Effectiveness of Alternative Surveillance Strategies for Hepatocellular Carcinoma in Patients with Cirrhosis. Clin Gastroenterol Hepatol. 2008; 6: 1418– 1424. 45. Patel D, Terrault NA, Yao F, et al. Cost-Effectiveness of Hepatocellular Carcinoma Surveillance inPatients With Hepatitis C Virus–Related Cirrhosis. Clin Gastroenterol Hepatol.2005;3:75–84 46. Lee E, Edward S, Singal AG, Lavieri MS, Volk M. Improving screening for hepatocellular carcinoma by incorporating data on levels of alphafetoprotein, over time. Clin Gastroenterol Hepatol 2013;11:437-440. AAEEH • 57 ASOCIACIÓN ARGENTINA PARA EL 47. Wong G LH, Chan H LY, Tse YK , et al. On-Treatment Alpha-Fetoprotein Is a Specific Tumor Marker for Hepatocellular Carcinoma in Patients With Chronic Hepatitis B Receiving Entecavir. Hepatology 2014; 59: 986-995 51. Zhang BH, Yang BH, Tang ZY. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res ClinOncol 2004;130:417422. 48. Minami T, Tateishi R, Kondo M, et.al.,Serum Alpha-Fetoprotein Has High Specificity for the Early Detection of Hepatocellular Carcinoma After Hepatitis C Virus Eradication in Patients. Systematic Review and Metaanalysis Medicine 2015; 94: 1-6 52. Thompson Coon J, Rogers G, Hewson P, et al. Surveillance of cirrhosis for hepatocellular carcinoma: systematic review and economic analysis. Health Technol Assess 2007; 11: 1-206. 49. El-Sareg HB, Kanwal F, Davila JA et. Al. A New Laboratory Based Algorithm to Predict Development of Hepatocellular Carcinoma in Patients with Hepatitis C and Cirrhosis Gastroenterology. 2014; 146: 1249–1255.Hashem B. El-Serag, FasihaKanwal, Jessica A. Davila, 50. Biselli M, Conti F, GramenziA , et al. A new approach to the use of α-fetoprotein as surveillance test for hepatocellular carcinoma in patients with cirrhosis. Br J Cancer.2015 ; 6: 69-76. 53. Marrero JA, Henley KS; The Role of Serum Biomarkers in Hepatocellular Carcinoma Surveillance. Gastroenterology &Hepatology 2011, 7: 821823 54. Caviglia GP, Abate ML, Petrini E, et. Al. Highly sensitive alpha-fetoprotein, Lens culinaris agglutinin reactive fraction of alpha-fetoprotein and desgammacarboxyprothrombin for hepatocellular carcinoma detection. Hepatology Research 2015:1-6 1 2 58 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Estudios de Imágenes en el Screening de Hepatocarcinoma Dres Daniel Alvarez, Bernardo Frider, Ariel Cubilla Ecografia El progresivo perfeccionamiento de los aparatos de ultrasonografía (US), permiten en la actualidad detectar lesiones focales hepáticas de pequeño tamaño. De esta forma y mediante su empleo pautado en los pacientes de alto riesgo de padecer HCC, se consigue diagnosticar el tumor en fase precoz. Los estudios de seguimiento para la detección precoz del HCC deben estar dirigidos a una población de riesgo bien determinada. Varios estudios epidemiológicos han determinado que los principales factores de riesgo son: varón, edad avanzada, cirrosis hepática de cualquier etiología y elevación de los niveles séricos de AFP. Entre éstas, la cirrosis está considerada como el principal factor de riesgo, por lo que los programas de screening deberían ir dirigidos a estos pacientes (especialmente en cirrosis secundarias a hepatitis B y C ) (1). Desde hace años se ha sugerido que los test más útiles son la determinación de la alfafetoproteina (AFP) y la ecografía, realizados conjuntamente a intervalos determinados, habitualmente cada 6 meses (2). Algunos estudios han determinado que los pacientes con HCC diagnosticados mediante programas regulares de screening (US + AFP cada 6 meses) presentan tumores menos evolucionados y menor sintomatología relacionada con el tumor, que los pacientes, portadores de HCC diagnosticados mediante períodos irregulares de screening. Asimismo, muestran que la detección precoz de esta neoplasia ha incrementado significativamente el número de tumores tributarios de tratamientos con intención radical (3,2). El aspecto ecográfico del HCC es muy variable y suele depender de su momento evolutivo. Así, cuando el tumor mide menos de 3 cm, el patrón ecográfico más habitual es el hipoecoico. En algún caso el HCC puede ser hiperecogénico, siendo entonces de difícil diferenciación con lesiones angiomatosas. Cuando el HCC supera los 3 cm suele mostrarse como una lesión heterogénea (60 %) con o sin cápsula peritumoral. En esta fase también puede tener un aspecto hipoecoico (40 %) o hiperecoico. Al superar los 5 cm, el tumor puede desbordar la cápsula, diseminándose al parénquima adyacente o invadiendo el árbol vascular. Si el tumor alcanza la forma difusa el patrón ecográfico más característico suele ser el heterogéneo y sus límites se hacen imprecisos, aumentando la probabilidad de invasión vascular (hasta un 50 %) (4). La sensibilidad de la ecografía en el diagnóstico de HCC es muy variable según los autores 4594 % (5-6). Por otra parte, la ecografía permite visualizar la posible diseminación del tumor a estructuras vasculares hepáticas, o extrahepáticas (suprarrenales, adenopatías hiliares, etc.). Actualmente existen técnicas complementarias que pueden ayudar a mejorar la rentabilidad diagnóstica de la ecografía: dúplex doppler, doppler color, doppler color potenciado, potenciadores de la señal doppler administrados por vía endovenosa, técnica ecografía de harmónicos, inversión del pulso, harmónicos de tejidos, etc que van dirigidos a delimitar mejor las lesiones y visualizar el tipo de vascularización, lo que puede ayudar a su mejor catalogación, así como determinar la viabilidad o no del tumor después de AAEEH • 59 ASOCIACIÓN ARGENTINA PARA EL haberse realizado un tratamiento (embolización, alcoholización, termocoagulación, etc.). Tomografia Computarlzada De la misma forma que la ecografía, la Tomografía Computarizada (TC) tiene un elevado rendimiento en el diagnóstico y manejo del HCC. Su sensibilidad diagnóstica alcanza el 58-95 % según las series (5). El aspecto del tumor es muy variable. Es importante diferenciar como se muestra en la exploración basal y el comportamiento tras la administración de contraste endovenoso. La mayoría de los HCC suelen ser hipodensos en la exploración basal y algunos pueden ser isodensos con el resto del parénquima hepático adyacente, fundamentalmente los de pequeño tamaño. Se ha descrito que el comportamiento característico tras la administración de contraste es el de una captación precoz del mismo con aumento importante de la densidad tumoral, pero esto solo ocurre en un pequeño porcentaje de los tumores. El resto pueden comportarse de una forma muy variable, ya sea apareciendo hipodensos, permaneciendo isodensos con el resto del parénquima hepático o captar contraste de una forma heterogénea. La TC espiral permite efectuar el estudio dinámico de la lesión en las fases arterial y venosa tras la inyección de contraste endovenoso, lo que aumenta la sensibilidad y especificidad en la detección de lesiones. Existe la posibilidad de realizar exploraciones en 3 D que ayuda a visualizar la vascularización del tumor lo que facilita la resección quirúrgica. La TC tiene además una aplicación muy importante para determinar la diseminación extrahepática del tumor, permitiendo explorar el pulmón y el resto del abdomen, dato importante para poder decidir la terapia del paciente. Asimismo mediante la TC podremos realizar controles evolutivos para valorar la eficacia de los tratamientos aplicados (cirugía, embolización, alcoholización, radio frecuencia etc,). Resonancia Magnética La Resonancia Magnética (RM) es una de las técnicas que se han incorporado más tarde al estudio de las lesiones focales hepáticas, pero que más rápidamente ha evolucionando. En las secuencias potenciadas en TI el HCC puede mostrarse como hipointenso, isointenso o hiperintenso. En las secuencias potenciadas en T2 la mayoría aparece hiperintensos. Con la administración de gadolinio, suele apreciarse una captación fugaz e intensa. Se han estudiando diversos contrastes que son más especificos para algunos tipos de tumores y tejidos, así como catalogar los tumores según el contenido en diferentes sustancias (grasa, metales etc.), y visualizar la estructura vascular del tumor al explorarlos en forma 3 D. También se puede utilizar como la TC en la valoración postratamiento. Referencias 1. Kato Y, Nakata K, Omagari K, et al: Risk ofhepatocellu1ar carcinoma in patients with cirrhosis in Japan. Cancer 74:2234-2238,1994 2. Liver Cancer Study Group of Japan. Primary liver cancer in Japan: clínicopathologic features and 3. Cottone M, Turri M, Caltagirone M et al. Screening for hepatocellular carcinoma in patients with Childs A cirrhosis : an 8 year prospective study by ultrasound and alphafetoprotein. J. Hepatol1994;21:10291034. 60 4. MarotoA, Bru C, Bruix J et al. Características eco gráficas del carcinoma hepatocelular Analisis de una serie de 125 casos. Radiología 1987;29:569-573. 5. Bruneton JN, Laurent F , Drouillard J. Carcinome hepatocellulaire, In JN Bruneton ed. Imagerie des tumeurs du foie. París, Masson 1992. 6. Dodd III D, Miller J, Baron L, Skolnick L. Campbell L. Detection of malignant tumors in end-stage cirrhotic livers: efficacy of sonography as a screeninng technique. AJR 1992 ; 159:727-733. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Programas de Vigilancia para Hepatocarcinoma Dres Andrés Bruno, Gisela Gualano, Silvia Mengarelli Introducción El hepatocarcinoma (HCC) es uno de los tumores más prevalentes a nivel mundial. La incidencia global está aumentando y la mortalidad no ha disminuido, como consecuencia de que la mayoría de pacientes se diagnostican en estadíos intermedio/avanzado, lo que impide la aplicación de tratamientos curativos. Continúa siendo un problema serio de salud pública (1) , lo que justifica la aplicación de un programa de vigilancia con la intención de efectuar el diagnóstico en pacientes asintomáticos en estadío temprano. Un test de screening o cribaje es la aplicación de un estudio diagnóstico para detectar una determinada enfermedad en una población que está en riesgo de desarrollarla, pero que no presenta signos y/o síntomas, mientras que la vigilancia es la aplicación repetida, a intervalos sistematizados, de estos tests. En el hepatocarcinoma, el objetivo principal de un programa de vigilancia es su detección en estadío temprano, etapa en la que se podría aplicar un tratamiento curativo, y así lograr una disminución significativa de la mortalidad (2). La metodología ideal para confirmar la eficacia de un programa de vigilancia es a través de ensayos controlados randomizados (ECRs). Entre ellos, se destaca el trabajo de Zhang et al., que incluyó más de 18.800 individuos portadores crónicos del HBsAg. Se logró una reducción de la mortalidad por HCC en el grupo screening de 37% (3). Varios estudios de cohorte, de Occidente y Oriente, han demostrado que los pacientes con HCC detectados por medio de programas de vigilancia presentan tumores en estadío más temprano (BCLC 0 y A), acceden con mayor frecuencia a tratamientos curativos, y alcanzan una tasa mayor de sobrevida que aquellos que tuvieron un diagnóstico incidental o sintomático (4-8). Pacientes candidatos a incluir en los programas de vigilancia Pacientes cirróticos Child Pugh A-B: la prevalencia de cirrosis entre los pacientes con HCC, particularmente asociada a hepatitis virales, es de 80% a 90%. Sarasin et al. estimaron, basándose en modelos de Markov, que la relación costoefectividad de la vigilancia para HCC mejora a medida que la incidencia del mismo es mayor en una población determinada (4). La vigilancia para HCC está indicada en cirróticos de cualquier etiología, que tengan una incidencia esperada anual mayor o igual que 1.5% (9). Dicha incidencia se cumple principalmente en individuos con cirrosis por hepatitis virales B y C (10-14), en la cirrosis alcohólica, (15) y secundaria a esteatohepatitis no alcohólica (16), también en el estadío de cirrosis de la hemocromatosis hereditaria y de la cirrosis biliar primaria (17,18). En la hepatitis autoinmune, aún en estadío de cirrosis, la ocurrencia de HCC es muy infrecuente (19,20). Pacientes cirróticos Child Pugh C: es un tema a discutir ya que las principales guías internacionales y algunos expertos opinan que si estos pacientes no son potenciales candidatos para un trasplante hepático, la vigilancia para HCC no sería costoefectiva (21,22). Es importante enfatizar que el objetivo de la vigilancia no es sólo lograr la migración del estadío, sino también poder aplicar una terapia curativa y con ello, mejorar la sobrevida. Pacientes no cirróticos: a) hepatitis crónica B, se recomienda en los casos con fibrosis avanzada y/o enfermedad activa; y en aquellos con historia familiar de HCC (22); b) hepatitis crónica C, el riesgo de ocurrencia de HCC tiene una relación directa AAEEH • 61 ASOCIACIÓN ARGENTINA PARA EL con el grado de fibrosis (23). Se sugiere incluir en programas de vigilancia para HCC a aquellos con fibrosis grado 3 de la clasificación de METAVIR. En pacientes con fibrosis hepática basal severa (F3 o F4) con HBV que tienen una supresión persistente de la replicación por estar recibiendo tratamiento antiviral o en aquellos con HCV que hayan alcanzado la erradicación viral luego de la terapia, el riesgo de HCC durante el seguimiento está reducido, pero no completamente abolido y por lo tanto, se recomienda continuar con la vigilancia y no hay evidencia sobre cuándo interrumpir los estudios de screening. En pacientes en lista de espera para THO: en estos casos la vigilancia para HCC tiene mucha importancia ya que, si se detecta un tumor dentro de los criterios de Milán, se le otorga a dicho caso puntaje adicional y prioridad. Por otro lado, si se observara una lesión que excediera dichos criterios, sería motivo de indicar la salida de la lista. Edad: Otro punto que está en discusión y sin consenso. 40% de los casos ya que en el resto se trataría de un flare de hepatitis, etc, o sea se trataría de un falso positivo (25). Por otra parte, si se utilizara un valor de corte mayor (ejemplo, 200 ng/ml) para aumentar su especificidad y valor predictivo positivo, la sensibilidad del método para detectar HCC disminuiría a aprox. 22%. Los bajos porcentajes de sensibilidad, especificidad y también del valor predictivo positivo explican porque el dosaje de AFP no es costo-efectivo en el screening de HCC. Ultrasonografía abdominal (US): Es un estudio no invasivo, aceptado por los pacientes, de costo relativamente bajo y de gran accesibilidad, tiene como desventaja que es dependiente del operador y del equipamiento. Un meta-análisis demostró que la US presenta una sensibilidad y especificidad agrupadas del 94%, la sensibilidad disminuye a 63% en la detección de tumores tempranos. Por otro lado, la sensibilidad fue mayor en estudios donde el intervalo entre US fue ≤ 6 meses. Se analizó la utilidad de agregar el estudio de AFP en conjunción con la US y la diferencia fue no significativa, concluyéndose que no habría beneficio adicional en sumar el estudio de AFP (26,27). Estudios a utilizar en la vigilancia para HCC Alfa-fetoproteína sérica (AFP): es el biomarcador más estudiado. Utilizando el valor de corte propuesto de 20 ng/ml, tiene una baja sensibilidad para detectar HCC (considerando todos los estadíos), oscilando entre 41 y 65% (24). La especificidad también es baja ya que puede elevarse ante brotes de actividad necroinflamatoria (“flares”), especialmente en pacientes con hepatitis crónicas B y C. La AFP tiene un valor predictivo positivo bajo, si se considera una población de pacientes cirróticos con una prevalencia de HCC cercana al 5%, (similar a lo que sucede en la práctica habitual). Si se decidiera incluir este test en la vigilancia, en todos los casos que presenten un nivel de AFP > 20 ng/ml, aunque la ultrasonografía abdominal (US) no mostrara lesión nodular, habría que efectuar un estudio confirmatorio de imágenes contrastado (TC multidetector, multifásica o RNM dinámica). Con estos métodos sólo se detectaría una lesión focal en aproximadamente 62 Conclusiones • Pacientes cirróticos de cualquier etiología o con hepatitis B o C y fibrosis severa, asintomáticos y que están en riesgo de desarrollar HCC, deberían ingresar en un protocolo de vigilancia con el objetivo de detectar dicha complicación en un estadío temprano, en el cual se puedan aplicar los tratamientos curativos como el trasplante hepático, la ablación quirúrgica o por radiofrecuencia y, por ende, reducir la mortalidad. • La vigilancia para detección precoz del HCC debería efectuarse por medio de US, realizada cada 6 meses y por operadores experimentados. • Ante la detección de una lesión nodular en la US, se debería implementar un algoritmo diagnóstico confirmatorio. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Referencias 1. Torre L, Bray F, Siegel R L et al. Global Cancer Statistics 2012. CA Cancer J Clin 2015;65:87-108 2. Prorok PC. Epidemiologic approach for cancer screening. Problems in design and analysis of trials. Am J Pediatr Hematol Oncol 1992;14:117128. 3. Zhang BH, Yang BH, Tang ZY. Randomized controlled trial of sreening for hepatocellular carcinoma. J Cancer Res Clin Oncol 2004;130:417-422. 4. Trevisani F, De Notariis S, Rapaccini G, Farinati F, Benvegnù L, Zoli M, et al. Semiannual and annual surveillance of cirrhotic patients for hepatocellular carcinoma: effects on cancer stage and patient survival (Italian experience). Am J Gastroenterol 2002;97:734-744. 5. Stravitz RT, Heuman DM, Chand N, Sterling RK, Shiffman ML, Luketic VA, et al. Surveillance for hepatocellular carcinoma in patients with cirrhosis improves outcome. Am J Med 2008;121:119-126. 6. Chan ACY, Poon RTP, Ng KKC, Lo CM, Fan ST, Wong J. Changing paradigm in the management of hepatocellular carcinoma improves the survival benefit of early detection by screening. Ann Surg 2008;247:666673. 7. Yang JD, Harmsen WS, Slettedahl SW, Chaiteerakij R, Enders FT, Therneau TM, et al. Factors that affect risk for hepatocellular carcinoma and effects of surveillance. Clin Gastroenterol Hepatol 2011;9:617-623. 8. Van Meer S, de Man RA, Coenraad MJ, Sprengers D.Surveillance for hepatocellular carcinoma is associated with increased survival: Results from a large cohort in Netherlands. J Hepatol 2015 Jun 20. pii: S01688278(15)00403-1. doi: 10.1016/j.jhep.2015.06.012 9. Sarasin FP, Giostra E, Hadengue A. Cost-effectiveness of screening for detection of small hepatocellular carcinoma in Western patients with Child-Pugh class A cirrhosis. Am J Med 1996;101:422-434. 10. Beasley RP, Hwang LY, Lin CC, Chien CS. Hepatocellular carcinoma and hepatitis B virus. A prospective study of 22707 men in Taiwan. Lancet 1981;2:1129-1133 11. Lok AS, Seef LB, Morgan TR, di Bisceglie AM, Sterling RK, Curto TM, et al. Incidence of hepatocellular carcinoma and associated risk factors in hepatitis C-related advanced liver disease. Gastroenterology 2009;136:138-148. 12. Sangiovanni A, Prati GM, Fasani P, Ronchi G, Romeo R, Manini M, et al. The natural history of compensated cirrhosis due to hepatitis C virus: a 17-year cohort study of 214 patients. Hepatology 2006;43:1303-1310. 13. Fattovich G, Pantalena M, Zagni I, Realdi G, Schalm SW, Christensen E. European Concerted Action on Viral Hepatitis (EUROHEP). Effect of hepatitis B and C virus infections on the natural history of compensated cirrhosis: a cohort study of 297 patients. Am J Gastroenterol 2002;97:2886-2895. 14. Ikeda K, Saitoh S, Koida I, Arase Y, Tsubota A, Chayama K, et al. A multivariate analysis of risk factors for hepatocellular carcinogenesis: a prospective observation of 795 patients with viral and alcoholic cirrhosis. Hepatology 1993;18:47-53 15. Mancebo A, González Diéguez ML, Cadahía V, Varela M, Pérez R, Navascués CA, et al. Annual incidence of hepatocellular carcinoma among patients with alcoholic cirrhosis and identification of risk groups. Clin Gastroenterol Hepatol 2013;11:95-101. 16. Ascha MS, Hanouneh IA, López R, Tamimi TAR, Feldstein AF, Zein NN. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. Hepatology 2010;51:1972-1978. 17. Beaton MD, Adams PC. Prognostic factors and survival in patients with hereditary hemochromatosis and cirrhosis. Can J Gastroenterol 2006;20:257-260. 18. Caballería L, Parés A, Castells A, Ginés A, Bru C, Rodés J. Hepatocellular carcinoma in primary biliary cirrhosis: similar incidence to that in hepatitis C virus-related cirrhosis. Am J Gastroenterol 2001;96:1160-1163. 19. Teufel A, Weinmann A, Centner C, Piendl A, Lohse AW, Galle PR, et al. Hepatocellular carcinoma in patients with autoimmune hepatitis. World J Gastroenterol 2009;15:578-582. 20. Yeoman AD, Al-Chalabi T, Karani JB, Quaglia A, Devlin J, Mieli Vergani G, et al. Evaluation of risk factors in the development of hepatocellular carcinoma in autoimmune hepatitis: implications for follow-up and screening. Hepatology 2008;48:863-870. 21. Bruix J, Sherman M. American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update. Hepatology 2011;53:1020-1022. 22. EASL-EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2012;56:908-943. 23. Yoshida H, Shiratori Y, Moriyama M, Arakawa Y, Ide T, Sata M, et al. Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis C in Japan. Ann Intern Med 1999;131:174-181. 24. Gupta S, Bent S, Kohlwes J. Test characteristics of α-fetoprotein for detecting hepatocellular carcinoma in patients with hepatitis C. A systematic review and critical analysis. Ann Intern Med 2003;139:4650 25. Trevisani F, D’Intino PE, Morselli-Labate AM, Mazzella G, Accogli E, Caraceni P, et al. Serum alpha-fetoprotein for diagnosis of hepatocellular carcinoma in patients with chronic liver disease: influence of HBsAg and anti-HCV status. J Hepatol 2001;34:570-575. 26. Singal A, Volk ML, Waljee A, Salgia R, Higgins P, Rogers MAM, et al. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther 2009;30:3747. 27. Santi V, Trevisani F, Gramenzi A, Grignaschi A, Mirici-Cappa F, Del Poggio P, et al. Semiannual surveillance is superior to annual surveillance for the detection of early hepatocellular carcinoma and patient survival. J Hepatol 2010;53:291-297. AAEEH • 63 ASOCIACIÓN ARGENTINA PARA EL 1 2 64 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Módulo Diagnóstico AAEEH • 65 ASOCIACIÓN ARGENTINA PARA EL 66 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 TC en el Paciente Cirrótico con Detección de Nódulo Hepático Dres Adriana García, Juan Spina, Juan Sorda Introducción El Sistema LIRADS (Liver Imaging Reporting And Data System) tiene un objetivo claro y es estandarizar la clasificación de TC y RMI, estandarizar los informes, reducir la variabilidad de interpretación y aumentar la comunicación. Esta clasificación la debemos utilizar en las lesiones Hepáticas de pacientes cirroticos o con otros factores de riesgo para HCC en CT y RMI. Es importante usar con Cada Nódulo en un hígado cirrótico y se debe establecer la categorización LIRADS. Cada Categoría diagnóstica tiene una interpretación Aunque la ecografía es el método de imagen mas frecuentemente empleado para el screening y la vigilancia del HCC en paciente con elevado riesgo, los métodos de diagnostico no invasivo dependen de métodos de imágenes con contraste como la tomografía computada (TC) o la resonancia magnética (RM). Los criterios desde el punto de vista del equipamiento mínimo en cuanto a la tomografía computada para la evaluación de un nódulo hepático en pacientes con cirrosis son los siguientes: 1. Se deben emplear tomógrafos multidetectores, con un mínimo de 8 canales o tomógrafos helicoidales, no se aconseja el empleo de tomógrafos seriales. 2. La dinámica para el empleo del contraste debe seguir la siguiente secuencia: primero cortes sin contraste, luego fase arterial, seguido de la fase portal y de la de equilibrio. 3. para adquirir el tiempo arterial exacto se debe utilizar un software, bolus tracking en la aorta descendente, bomba inyectora, con un total de 130 ml de contraste inyectado a una velocidad de 3 ml por segundo. No se debe realizar estudios con inyección manual. 4. Si el equipo no consta de bolus tracking, entonces, se debe tener reparo en los siguientes tiempos de inyección: fase arterial de 20 segundos, la fase venosa de 50 segundos, y la fase de equilibrio de 120 segundos. En cuanto al tiempo arterial, debe ser en arterial tardío, eso es cuando la vena porta se ve opacificada pero no la vena cava inferior ni las supra-hepáticas. 5. en cuanto a los datos del equipo, este debe cumplir con lo siguiente:tubo de voltaje: 120 kvp; corriente del tubo volumen ec ( 8.0 – 5 mm.); rotacion del tubo : 0,5 s- rot; colimacion : 0.5 mm. x 64; grosor de corte: 0,5-0,4 mm. pitch; fov : large ( 30-36 cm). 6. en cuanto a los criterios para detección de nódulos, se debe considerar:tamaño, crecimiento, realce arterial y lavado del contraste o washout. presencia de capsula. AAEEH • 67 ASOCIACIÓN ARGENTINA PARA EL Tamaño Se debe tener presente la captación en mosaico en tiempo arterial, nódulo dentro de nódulo. 1- nódulo menor a 1 cm. no se categorizan 2- nódulo entre 1 -1,9 cm. 3- nódulo mayor a 2 cm. 4- nódulo mayor a 5 cm Crecimiento del Nodulo en el Seguimiento Crecimiento del nódulo menor o igual del 50 % en 6 meses. Crecimiento del nódulo mayor del 100 % en 6 meses por año. Realce del Nodulo en el Tiempo Arterial y Lavado en Tiempo Venoso Aunque organizaciones como AASLD, EASL, OPTN, APSL, JSH, entre otras, han generado guías para el empleo de criterios diagnósticos para HCC especificando algunos criterios como el realce arterial y el lavado o “washout”, lo que no esta claro son criterios consenso para definir exactamente estos aspectos que pueden generar confusión. Con el fin de generar un sistema para la interpretación y el reporte de los resultados de la TC y RM en pacientes con riesgo de HCC en 2011 se lanzó el sistema LIRADS (Liver Imaging Reporting and Data System) que fue incorporado por muchas guías. LIRADS categoriza a los nódulos hepáticas según criterios como A) WASHOUT, B) CAPSULA, C) CRECIMIENTO en 5 categorías: 1-definitivamente benigno, 2) probablemente benigno, 3) probabilidad intermedia para HCC, 4) probable HCC y 5) HCC definitivo. 1. nódulo hiperdenso en tiempo arterial y nódulo hipodenso en tiempo venoso. LIRADS 1 : 100 % de certeza de nódulo benigno. 2. nódulo hiperdenso en tiempo arterial y nódulo isodenso en tiempo venoso. LIRADS 2 : alta probabilidad de benignidad en la observación. 3. nódulo con realce escaso y progresivo en tiempo arterial y nódulo hiperdenso en tiempo venoso. 4. nódulo hipodenso en tiempo arterial y nódulo hipodenso en tiempo venoso. 5. nódulo hiperdenso en tiempo arterial y nódulo hiperdenso en tiempo venoso. LIRADS 3 : probabilidad intermedia de HCC. Nodulo isodenso o hipodenso menor a 20 mm mas 1 criterio. Nodulo hiperdenso menor a 20 mm no se le suma ningun criterio. LIRADS 4 : alta probabilidad de HCC pero no existe la certeza en un 100 % nodulo menor a 20 mm, isodenso o hipodenso más 2 o más criterios. nodulo menor a 20 mm hiperdenso más 1 solo criterio. nodulo mayor o igual a 20 mm, isodenso o hipodenso más 1 criterio. nodulo mayor o igual a 20 mm hiperdenso no se le suma ningun criterio LIRADS 5: nodulo definitivamente es un HCC nodulo menor a 20 mm hiperdenso más 2 o más criterios. nodulo mayor o igual a 20 mm hiperdenso más 1 o más criterios 68 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 LIRADS 5 v: 100 % de certeza de que se trata de un HCC que invade la vena. Los criterios son : visualizacion de un tejido dentro de la vena, se puede acompañar de realce de ese tejido con el contraste, y un trastorno de perfusion con el contraste. LIRADS 5 g: nodulo crece mas o igual al 50 % en menos de 6 meses. LIRADS lr-m: probablemente maligno no específico para HCC Conclusiones El mayor objetivo del LiRADS es la unificación de términos y la estandarización de los informes médicos en la observación de un hígado cirrotico, por que reduce la variabilidad en la interpretación. Los hallazgos mayores son, diámetro, realce en fase arterial, washout, cápsula y su crecimiento. Existen aspectos controvertidos en el Diagnostico del HCC bajo TC : Es imperativo que los informes de tomografia de un paciente para detección y diagnostico de HCC sean realizados: Primero: con un equipamiento adecuado, este punto, es debatible por lo heterogéneo que es el equipamiento y entrenamiento medico en nuestra realidad de país, no todas las provincias constan con equipos multidetectores, pero es importante que sea así, de lo contrario el paciente debe ser derivado. Segundo: el kilovoltaje del tubo que se expresa como 120 KV, debe ser este valor, ya que con valores menores de kilovoltaje, el HCC será sub diagnosticado, es valido aclarar, ya que muchos centros de diagnóstico para cuidar el tubo de su equipo y mejorar su rendimiento es a costa del diagnóstico. Tercero: es la cantidad de contraste, es muy similar al punto anterior, NO se debe utilizar menos de 130 ml y debe ser con bomba inyectora y cuatro fases. Cuarto: el medico radiólogo, debe tener entrenamiento y un conocimiento actualizado y entrenamiento sobre diagnóstico de HCC, en el informe deben estar presentes: Cantidad de Nódulos, Tamaño, Ubicación (mencionando los segmentos hepáticos involucrados siguiendo la nomenclatura de Couinaud) En mi opinión creo que sería de gran utilidad anexar al informe una hoja con la segmentación hepática de Couinaud y la ubicación de los nódulos de HCC. Esto seria de utilidad para dos puntos, para su seguimiento y para los anátomos patólogos. Quinto: El Informe debe utilizar los LIRADS, y Las Imágenes deben ser entregadas al Paciente en su totalidad mediante un CD. Referencias 1. World Health Organization. International Agency for Research on Cancer. GLOBOCAN. 2008 [updated 2008; cited 2013 24 september 2013]; Available from:http://globocan.iarc.fr. 2. Instituto Nacional do Câncer. Câncer no Brasil. Instituto Nacional do Câncer; 2010; Available from: http://www.inca.gov.br/ cancernobrasil/2010/. 3. El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132(7):2557-76. 4. Fattovich G, Stroffolini T, Zagni I, Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology. 2004;127(5 Suppl 1):S35-50. 5. Chen CJ, Yang HI, Iloeje UH, Group R-HS. Hepatitis B virus DNA levels and outcomes in chronic hepatitis B. Hepatology. 2009;49(5 Suppl):S72-84. 6. Bruix J, Sherman M, American Association for the Study of Liver D. Management of hepatocellular carcinoma: an update. Hepatology. 2011;53(3):1020-2. 7. Purysko AS, Remer EM, Coppa CP, Leao Filho HM, Thupili CR, Veniero JC. LI-RADS: a case-based review of the new categorization of liver findings in patients withend-stage liver disease. Radiographics. 2012;32(7):1977-95. 8. Schwartz LH, Panicek DM, Berk AR, Li Y, Hricak H. Improving communication of diagnostic radiology findings through structured reporting. Radiology. 2011;260(1):174-81. 9. Reiner BI. Medical imaging data reconciliation, part 4: Reconciliation of radiology reports and clinical outcomes data. J Am CollRadiol. 2011;8(12):858-62. 10. Cruite I, Tang A, Sirlin CB. Imaging-based diagnostic systems for hepatocellular carcinoma. AJR Am J Roentgenol. 2013;201(1):41-55. 11. Catalano OA, Choy G, Zhu A, Hahn PF, Sahani DV. Differentiation of malignant thrombus from bland thrombus of the portal vein in patients with hepatocellularcarcinoma: application of diffusion-weighted MR imaging. Radiology. 2010;254(1):154-62. AAEEH • 69 ASOCIACIÓN ARGENTINA PARA EL 12. Sirlin CB. Invited commentary. Radiographics. 2012;32(7):1995-8; discussion 8. 18. Efremidis SC, Hytiroglou P. The multistep process of hepatocarcinogenesis in cirrhosis with imaging correlation.EurRadiol. 2002;12(4):753-64. 13. American College of Radiology. Quality and safety resources: Liver Imaging–Reporting and Data System. Quality and safety resources: Liver Imaging–Reporting andData System.: American College of Radiology; 2012 [updated 01 Jan 2013; cited 2013 24 September]; Available from:http://www.acr.org/Quality-Safety/Resources/LIRADS. 19. Parente DB, Perez RM, Eiras-Araujo A, et al. MR imaging of hypervascular lesions in the cirrhotic liver: a diagnostic dilemma. Radiographics. 2012;32(3):767-87. 14. Petruzzi N, Mitchell D, Guglielmo F, et al. Hepatocellular carcinoma likelihood on MRI exams: evaluation of a standardized categorization system. AcadRadiol. 2013;20(6):694-8. 15. Karimova E FK, Arauz A, Brunt E, Gao F, Heiken J,. Evaluation of OPTN and LIRADS Classifications for Liver Lesions in Transplant Patients with Explant PathologicCorrelation. Radiological Society of North America. Chicago IL: Radiological Society of North America, 2012. 16. Zech CJ, Bartolozzi C, Bioulac-Sage P, et al. Consensus report of the Fifth International Forum for Liver MRI. AJR Am J Roentgenol. 2013;201(1):97-107. 17. Hecht EM, Holland AE, Israel GM, et al. Hepatocellular carcinoma in the cirrhotic liver: gadolinium-enhanced 3D T1-weighted MR imaging as a stand-alone sequencefor diagnosis. Radiology. 2006;239(2):438-47. 70 20. Efremidis SC, Hytiroglou P, Matsui O. Enhancement patterns and signalintensity characteristics of small hepatocellular carcinoma in cirrhosis: pathologic basis anddiagnostic challenges. EurRadiol. 2007;17(11):296982. 21. Sherman M. The radiological diagnosis of hepatocellular carcinoma. Am J Gastroenterol. 2010;105(3):610-2. 22. Zhang J, Krinsky GA. Iron-containing nodules of cirrhosis. NMR Biomed. 2004;17(7):459-64. 23. Hussain SM, Reinhold C, Mitchell DG. Cirrhosis and lesion characterization at MR imaging.Radiographics. 2009;29(6):1637-52. 24. Kim SJ, Lee JM, Han JK, Kim KH, Lee JY, Choi BI. Peripheral massforming cholangiocarcinoma in cirrhotic liver. AJR Am J Roentgenol. 2007;189(6):1428-34. 25. Chung YE, Kim MJ, Park YN, et al. Varying appearances of cholangiocarcinoma: radiologic-pathologic correlation. Radiographics. 2009;29(3):683-700 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 RNM en el Paciente Cirrótico con Detección de Nódulo Hepático Dres Juan Perotti, Mariano Volpacchio, Gustavo Romero Objetivos Discutir el concepto, los criterios de definición y la relevancia de la implementación del sistema LIRADS en los informes radiológicos de pacientes con riesgo elevado de HCC. Revisión del tema El carcinoma hepatocelular (HCC) es un problema de salud global. Los pacientes con hepatitis crónica o cirrosis tienen alto riesgo de desarrollar HCC por lo que deben realizarse estudio de screening con ecografía cada 6 meses (recomendado por la Asociación Americana para el Estudio de las Enfermedades Hepáticas (AASLD)). Cuando se detecta alguna anormalidad, se amplía el estudio con resonancia magnética o bien con tomografía computada con contraste en múltiples fases. La detección temprana del HCC se asocia a un mejor pronóstico, dado que permite planificar el trasplante hepático, el cual posee 70 a 80% de sobrevida a 5 años. El hígado cirrótico y particularmente el diagnóstico de HCC es un gran desafío debido a la variabilidad de su presentación. Esta dificultad se pone en evidencia también en los informes radiológicos en los cuales no siempre figura la información necesaria para tomar alguna conducta terapéutica. La ausencia de criterios uniformes en el reporte de los hallazgos evidenciados por los radiólogos constituye una limitación para la toma de decisiones, la comparación entre los estudios y futuro seguimiento. Para esto el Colegio Americano de Radiología desarrolló un sistema dinámico de terminología y criterios estandarizados para interpretar e informar estudios de imágenes hepáticas denominado LIRADS (Liver Imaging Reporting And Data System). Se creó con el objetivo de estandarizar la evaluación y los informes de TC o RM en pacientes con cirrosis y otros factores de riesgo para HCC. LIRADS clasifica los hallazgos en 5 categorías: de LR1 a LR5, que reflejan la probabilidad de benignidad o de HCC en pacientes en riesgo. Una lesión LR1 es una lesión definitivamente benigna y una LR5 es definitivamente un HCC. Las categorías LR2 probablemente benigna, LR3 probabilidad intermedia de HCC y LR4 probable HCC son para lesiones indeterminadas. Las categorías se determinan únicamente en base al comportamiento de las imágenes en los estudios de TC o RM con contraste, sin tener en cuenta datos clínicos del paciente. Para lesiones sin un diagnóstico definitivo, el médico clínico determina la probabilidad de HCC no sólo con las categorías de LIRADS sino también con el resto de los datos clínicos como biomarcadores y la situación previa del paciente para desarrollar un HCC Decisiones como acortar el período de seguimiento, realizar otro estudio de imágenes, biopsia o tratamiento sin biopsia no siguen directamente AAEEH • 71 ASOCIACIÓN ARGENTINA PARA EL a cada categoría de LIRADS o de la probabilidad estimada por un clínico de la existencia de HCC sino de una evaluación clínica que integre toda la información médica, incluyendo comorbilidades y preferencias de cada paciente. Cuando una lesión es indeterminada en RM pero con alta sospecha de HCC se sugiere realizar una TC con contraste ya que a veces con TC se puede identificar mejor el refuerzo arterial o el lavado en fase portal o tardía de una imagen focal que ayude a reclasificarla como definitivamente HCC. Además permite aplicar terminología consistente, reducir la variabilidad y errores en la interpretación de imágenes, mejorar la comunicación con los hepatólogos y cirujanos hepáticos; brinda garantía de calidad en la práctica, y facilita la investigación. Para la correcta utilización de la clasificación de LIRADS también se definieron ciertos requisitos técnicos para TC y para RM Requerimientos técnicos para TC: Fase arterial y fase portal son requisitos. La fase arterial preferentemente tiene que ser tardía que es cuando el hepatocarcinoma refuerza más intensamente. Fase sin contraste, fase tardía y reconstrucciones multiplanares sugeridas. La fase sin contraste y la fase tardía sólo se sugieren porque el beneficio es bajo y aumenta la exposición a radiaciones. Las reconstrucciones multiplanares pueden identificar mejor la cápsula periférica o delimitar mejor los márgenes para hacer una medición más precisa del diámetro de la lesión Fases arterial, venosa y tardía son requisitos del OPTN, no la fase sin contraste Requerimientos técnicos para RM: Características definidas con medio de contraste extracelular Fases sin contraste, arterial, venosa y tardía, son requisitos. La fase arterial tiene que ser preferentemente tardía T2 FSE o T2 SSFSE, T1 en fase y fuera de fase, sin contraste, requeridas Difusión sugerida Adquisiciones multiplanares pueden agregar información al igual que técnicas de post proceso como la sustracción para determinar refuerzo en fase arterial Fases sin contraste, arterial, venosa y tardía, son requeridas por el OPTN para asignar puntos de excepción Con respecto a las especificaciones en cuanto a equipamiento, contrastes, dosis y velocidad de administración están definidas en las políticas del OPTN (Organ Procurement and Transplantation Network) Referencias 1. American College of Radiology. Liver Imaging Reporting and Data System, version 2013.1. http://www. acr.org/Quality-Safety/Resources/ LIRADS 2. LI-RADS (Liver Imaging Reporting and Data System): summary, discussion, and consensus of the LI-RADS Management Working 72 Group and future directions. Mitchell DG1, Bruix J, Sherman M, Sirlin CB. Hepatology 2015 Mar;61(3):1056-65. Epub 2014 Dec 12. 3. Organ Procurement and Transplantation Network. Policies. Policy 9.3.G. Updated 8/10/2015 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Hallazgos Histológicos en el Hepatocarcinoma Temprano Dres Eduardo Mullen, Alejandra Avagnina, Carlos Vigliano En seres humanos, la gran mayoría de los hepatocarcinomas (HC) se originan en contexto de hepatopatías crónicas avanzadas (cirrosis), si bien el hepatocarcinoma se puede originar de novo, es un evento poco frecuente. Existe evidencia que apoya al modelo de desarrollo de hepatocarcinoma a partir de lesiones precursoras (multisteps hepatocarcinogenesis). Desde el punto de vista morfológico, en el proceso de hepatocarcinogenesis, se reconocen 2 tipos de lesiones precursoras: A) Focos de hepatocitos displásicos y Nódulos displásicos y B) Lesiones tumorales pequeñas (≤ 2cm), que incluyen: A) hepatocarcinoma temprano y B) Hepatocarcinoma pequeño en progresión (1). Focos Displásicos Los focos displásicos son lesiones compuestas por hepatocitos displásicos que miden menos de 1 mm en contexto de la cirrosis. El término nódulo displásico se introdujo en 1995 en un consenso internacional (2). La medida arbitraria de 1 mm está relacionada al hecho de que dichos focos displásicos se encuentran en nódulos de hígados en proceso de cirrosis y que su hallazgo es incidental en biopsias y/o estudios de piezas quirúrgicas debido a que no se detectan macroscópicamente. Los focos displásicos se categorizan de acuerdo al tipo celular prevalente en: displasia a células pequeñas; displasia a células grandes y focos de hepatocitos hierro negativos (Perls) en contexto de hemocromatosis. Los focos displásicos a células pequeñas están constituidos por hepatocitos con alteración de la relación núcleo/citoplasma (1:1), hipercromasia y pleomorfismo nuclear con ocasionales nucléolos. Desde el punto de vista molecular los focos displásicos a células pequeñas tienen mayor actividad proliferativa (ki 67) que el parénquima adyacente, y se ha demostrado inactivación de p21, acortamiento de telómeros, inestabilidad cromosomal y ganancias cromosómicas similares a las observadas en HC (3,4,5). Cuando los focos displásicos adoptan un patrón de crecimiento expansivo se los consideró como lesiones precursoras de HC en el consenso internacional de 1995 (2). En contraste, cuando los focos displásicos a células pequeñas tienen un patrón de crecimiento difuso, son considerados cambios regenerativos. Existen dificultades para distinguir lesiones precursoras de HC de lesiones regenerativas por lo que estos criterios tienen un limitado valor predictivo positivo para el desarrollo de HC (3). Algunas publicaciones han demostrado una correlación significativa entre focos de displasia a células pequeñas y HC (3), mientras que otros estudios no han podido corroborar estos hallazgos (6,7). Los cambios a células grandes originalmente llamados displasia a células grandes consisten en hepatocitos con incremento del tamaño citoplasmático y nuclear sin alteración de la relación núcleo/citoplasma. Los cambios a células grandes son un grupo heterogéneo que incluye 2 tipos de lesiones: A) Células displásicas verdaderas y B) Cambios reactivos en relación a senescencia celular, colestasis. Actualmente se considera que la presencia de cambios celulares a células grandes en procesos de hepatitis virus B o C son AAEEH • 73 ASOCIACIÓN ARGENTINA PARA EL morfológica distintiva de los ND es la presencia de neo-angiogénesis evidenciada con vasos arteriales no triadales (arterias no acompañadas de conductos biliares) y capilarización sinusoidal. El fenómeno de neo-angiogénesis en ND es debido a la producción de factores de crecimiento vasculares y es detectado por métodos de diagnóstico angiográficos. Los ND, pueden tener además de displasia a células pequeñas y/o grandes, anomalías estructurales: patrón macrotrabecular (≥ 2 hepatocitos), pseudoacinos, esteatosis y fenómenos de sub-nódulos o nódulo en nódulo con diferentes grados de displasia. El diagnóstico diferencial de mayor relevancia se plantea entre nódulos regenerativos; ND y HC temprano. La infiltración estromal (invasión portal), pérdida de trama reticular (técnica de retículo) (10) y la demostración de neo-angiogénesis con técnicas de inmunohistoquímica para actina músculo liso (arterias no triadales) y CD34 (capilarización sinusoidal), son recursos morfológicos útiles para formular el diagnóstico de ND/HC temprano. lesiones displásicas asociadas a alta incidencia de HC en el seguimiento del paciente (8). En los focos de hierro negativo (Perls) en hemocromatosis genética se ha demostrado mayor actividad proliferativa y son considerados lesiones precursoras de HCC. El patólogo debería reportar focos de displasia a células pequeñas, cambios a células grandes y focos Perls negativos (hemocromatosis) en el informe histopatológico (9). Nódulos Displásicos Los Nódulos Displásicos (ND) son lesiones distintivamente nodulares que se detectan en hígado cirrótico, de ≥ 1cm, únicos o múltiples. Se clasifican en ND de bajo o alto grado en base a los tipos de focos displásicos. Una característica Morfología y Diagnósticos diferenciales de Nódulos Displásicos y HC Temprano Trama Reticular N.D. Alto grado HC Temprano Presente Atenuada/Disminuida CD34 + (Positivo) Focal Multifocal Arteria No Triadal Presente Presente Esteatosis Macrovacuolar Raro Frecuente (40%) Pseudoacinos Focal Multifocal 2/3 Células ≥ 3 células Si Si Celularidad Trabecular Atipia Celular: n/c Hepatocarcinoma Temprano El HC pequeño mide menos de 2 cm, estudios efectuados en Japón han demostrado 2 tipos de HC pequeños: 1) HC temprano y 2) HC pequeño en progresión (distintivo Nodular). El HC temprano es una lesión tumoral de bajo grado, estadio incipiente cuyos criterios diagnósticos surgieron de consensos entre patólogos de Japón y occidentales (11). En el 40% de los casos hay cambios grasos que dificultan evaluar la relación núcleo/citoplasma. El HC no invade vasos, la posibilidad de metástasis 74 es menor y es considerado una entidad intermedia entre un carcinoma in-situ y un carcinoma invasor, invasor,estratificación que se aplica en otros órganos. El HC temprano evidencia infiltración estromal a nivel de los espacios porta o en el margen de nódulos displásicos de alto grado. Este patrón de crecimiento puede ser evaluado con técnicas de Victoria Blue para evidenciar infiltración celular atípica en estroma portal o con Citoqueratinas 7 y 19 que demuestran ausencia de proliferación ductal en los márgenes del espacio porta. Se utiliza CD34 para evaluar el tipo y extensión de la capilarización sinusoidal. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 La trama reticular del HC pequeño en progresión no está totalmente disminuida. Se considera que el HC temprano es la lesión precursora del HC distintivamente nodular Las guías internacionales recomiendan efectuar biopsias en nódulos menores de 2 cm con imágenes angiográficas no concluyentes (11). Las biopsias deberían incluir lesión nodular y parénquima hepático adyacente. Los criterios citológicos solos no son suficientes para establecer diagnóstico dado que debe evaluarse junto con la histoarquitectura. El diagnóstico diferencial más difícil es entre ND de alto grado y HC bien diferenciado y se recomienda no formular un diagnóstico concluyente si no se Técnicas reúnen todos los criterios morfológicos (11). El uso de un panel de inmunohistoquímica que incluya Glipican-3, HSP70 y Glutamina Sintetasa es útil para diagnosticar HC bien diferenciado con una sensibilidad y especificidad del 72% y 100% respectivamente cuando 2 de los 3 marcadores son positivos (12). La determinación de subclases moleculares de HC que se correlacionan con parámetros clínicos e histológicos (13-14), obtenidas por medio de biopsias de HC según guías de manejo clínico(15), podrían ser biomarcadores de mucha utilidad en la aplicación de terapéuticas oncológicas en el tratamiento del HC. Técnicas de histoquímica e inmunohistoquímicas de aplicación en el diagnóstico de Nódulos Hepáticos. Tipo de Reacción Interpretación Retículo de Gomori Perls Atenuado/ Disminuido Negativo en células atípicas HC temprano ( HC T) HC ( hemocromatosis) Glipican-3 Glutamina Sintetasa HSP70 2 de 3 Positivas (cualquier orden) Favorece HC: 72% y 100% Sensibilidad y Especificidad Reacción(-) No descarta HC CD34 Positiva Multifocal Favorece ND alto Grado/ HC temprano Negativa Peri-Portal/ Septal Invasión Estromal: HC T Citoqueratinas 7 y 19 Referencias 1. Roncalli M;Park YN;Di Tomaso L. Histopathological classification of hepatocellular Carcinoma. Digestive and Liver Disease 42S (2010);S228S224 2. International Working Party. Terminology of nodular hepatocellular lesions. Hepatology. 1995;22(3):983–993 3. Hytiroglou P, Park YN, Krinsky G, Theise ND. Hepatic precancerous lesions and small hepatocellular carcinoma. Gastroenterol Clin North Am. 2007;36(4): 867–887, vii. 4. Theise ND, Curado MP, Franceschi S, et al. Hepatocellular carcinoma. In: Bosman FT, Carneiro F, Hruban RH, Heise ND, eds. WHO Classification of Tumours of the Digestive System. 4th ed. Lyon, France: IARC Press; 2010:205– 216. 9. Park YN.Update on Precursors and Early Lesion of Hepatocellular Carcinoma. Arch Pathol Lab Med (135) June 2011;704-715. 10. Singh AD,Torbenson M et all.Reticulin Loss in Benign Fatty Liver:An Important Diagnostic Pitfall when Considering a Diagnostic of Hepatocellular Carcinoma. Am J Surg Pathol 2012;36:710-715 11. International Consensus Group for Hepatocellular Neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia. Hepatology. 2009;49(2):658–664. 12. Di Tomaso L,Franchi G, Oark YN et all. Diagnostic Value of HSP70,Glypican-3 and Glutamine Synthetase in Hepatocellular Nodules in Cirrhosis.Hepatology 2007;45 (3):725-734 5. Plentz RR, Park YN, Lechel A, et al. Telomere shortening and inactivation of cell cycle checkpoints characterize human hepatocarcinogenesis. Hepatology. 2007;45(4):968–976 13. Tan PS,NakagawaS,HoshidaY,et al.Clinicopathological indices to predict hepatocellular carcinoma molecular classification.Liver Int. 2015 Jun 9. doi: 10.1111/liv.12889. [Epub ahead of print] 6. Borzio M, Bruno S, Roncalli M, et al. Liver cell dysplasia is a major risk factor for hepatocellular carcinoma in cirrhosis: a prospective study. Gastroenterology. 1995;108(3):812–817 14. Goossens N, Nakagawa S, Hoshida Y. Molecular classification of hepatocellular carcinoma: potential therapeutic implications. Hepat Oncol 2015 (in press). 7. Koo JS, Kim H, Park BK, et al. Predictive value of liver cell dysplasia for development of hepatocellular carcinoma in patients with chronic hepatitis B. J Clin Gastroenterol. 2008;42(6):738–743. 15. Easl-Eortc. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2012; 56(4): 908-43. 8. Borzio M, Bruno S, Roncalli M, et al. Liver cell dysplasia is a major risk factor for hepatocellular carcinoma in cirrhosis: a prospective study. Gastroenterology. 1995;108(3):812–817. AAEEH • 75 ASOCIACIÓN ARGENTINA PARA EL 1 76 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Algoritmo Diagnóstico en el Paciente Cirrótico con Detección de Lesión Focal Hepática Dres José Luis Fernández, Andrés Ruf, Sebastían Ferretti Introducción La detección de una lesión focal hepática en un paciente cirrótico, especialmente como consecuencia de la vigilancia ecográfica, exige un rápido diagnóstico del hepatocarcinoma hepatocelular (HCC) para detectar estadios tempranos que mejoren las posibilidades terapéuticas. En los países desarrollados este objetivo se logra en el 30% a 60% de los casos, mientras que en los subdesarrollados sigue siendo elevado el porcentaje de diagnóstico en estadios avanzados(1). Hasta el año 2000 el diagnóstico de CHC se basaba en la biopsia, pero esta conducta tenía limitaciones relacionadas con la ubicación de los nódulos y el riesgo de complicaciones como sangrado y siembra tumoral en el trayecto de la aguja(2). A partir de 2001 se establecieron diferentes criterios no invasivos basados en la combinación de la alfa fetoproteína y las imágenes, quedando la biopsia relegada y reservada solo para los casos en los que las características de las imágenes no eran suficientes para hacer el diagnóstico(3). Posteriormente, la alfa fetoproteína fue desplazada del esquema diagnóstico(4). entre 1 y 2 cm y qué técnicas por imágenes pueden usarse, incluyéndose así la tomografía computada (TC), la resonancia magnética (RM) y la ecografía con contraste(1). Estudios por imágenes Se realizaron dos estudios prospectivos evaluando el uso de TC y RM(4,8). El primero mostró una especificidad de 100% pero la sensibidad fue solo del 30%, con lo que dos tercios de los nódulos requirieron confirmación histológica(8). El segundo sugirió que el uso secuencial de dos técnicas podía aumentar la sensibilidad con un ahorro significativo de biopsias(4,9). Sin embargo, un estudio más reciente mostró resultados falsos positivos superiores a 10% en nódulos de 1 a 2 cm que en general eran displasias de alto grado, con el consecuente descenso de la especificidad a 81% con una técnica de imágenes y a 85% con dos(10). A pesar de que el diagnóstico no invasivo del CHC sigue siendo un desafío que requiere una mayor validación prospectiva, los expertos de las asociaciones europea y americana de hepatología decidieron incorporar la regla de una técnica a sus respectivas guías(1,5). Sin embargo, estos expertos proponen ser cautelosos en los escenarios como el nuestro, en los que las habilidades y el equipamiento no son óptimos, recomendando usar en estas circunstancias la estrategia de dos técnicas coincidentes(1). En las guías occidentales el algorimo diagnóstico se basa en el tamaño de la lesión focal(1,5). Las guías orientales, en cambio, prefieren partir de va vascularización de la lesión(6,7). Nosotros seguimos el primer criterio. Para confeccionar un algoritmo diagnóstico basado en los métodos no invasivos se necesita ver cuáles son lo suficientemente precisos para los nódulos cuyo diámetro oscila Con respecto a la técnica por imágenes a utilizar, basándose el diagnóstico radiológico del CHC en su comportamiento vascular, existen ventajas de la TC multidetector con contraste iodado y la RM con gadolinio, dinámicas en cuatro fases (sin contraste, arterial, venosa y tardía), sobre la ecografía con contraste. La TC y la RM tienen un rápido aclaramiento del contraste de AAEEH • 77 ASOCIACIÓN ARGENTINA PARA EL la sangre al espacio extracelular mientras que en la ecografía con contraste las microburbujas están confinadas al espacio intravascular y puede haber un error diagnóstico si se trata de un colangiocarcinoma(1,11,12). Pese a estas limitaciones, las guías asiáticas mantienen la ecografía como un método válido para el diagnóstico(6,7). De todos modos, la ecografía con contraste no está disponible en nuestro medio. Por lo tanto, se recomienda el uso de equipos de TC o RM de última generación para el diagnóstico no invasivo del CHC(13,14). Sin embargo, con estos métodos, los criterios diagnósticos de CHC solo se cumplen en una pequeña proporción de lesiones entre 1 y 2 cm, requiriéndose el uso de marcadores biológicos o biopsia(15). Considerando que el diagnóstico cuando los tumores tienen este tamaño es crucial porque por encima aumenta exponencialmente la invasión vascular microscópica y las lesiones satélites, se requiere desarrollar técnicas diagnósticas confiables para este rango de medida(1). Biopsia hepática Se recomienda realizar una biopsia hepática cuando las imágenes no son concluyentes o son atípicas(1). El diagnóstico histológico es particularmente difícil en nódulos de 1 a 2 cm, con solo 60% de positividad, y el riesgo de siembra tumoral luego de la biopsia es de 2,7%(8,14,16,17). El desarrollo de marcadores tumorales, basados en técnicas de microarrray, PCR, proteómica e inmunotinción, puede ayudar al diagnóstico temprano del CHC pero aún no hay suficientes estudios que los validen(18). Una combinación de los tres genes que respectivamente codifican GPC3, LYVE1 y survivina se propuso como útil para discriminar entre nódulos displásicos y pequeños CHCs(19). Un marcador prometedor, basado en la inmunohistoquímica, es el GPC3, con una sensibilidad de 68% a 72% y una especificidad de 92%(20,21). El International Consensus Group of Hepatocellular Neoplasia recomienda que por lo menos dos marcadores histológicos sean positivos para definir el diagnóstico de CHC(22). Las guías occidentales sugieren estos marcadores para diferenciar un nódulo con displasia de alto 78 grado de un CHC: GPC3, proteina 70 heat shock, glutamina sin¬tetasa, CD 34 del endotelio vascular y citoqueratinas 7 y 19(23). Marcadores biológicos La alfa fetoproteína es el marcador de CHC más conocido(24). Dos metanálisis recientes mostraron una sensibilidad global de 52% y 66% y una especificidad de 94% y 86%, respectivamente(25,26). Los niveles altos de alfa fetoproteína, con un umbral de 200 o 400 ng/dl según las series, se encuentran en aproximadamente el 30% de los casos de CHC y en éstos su determinación puede ser útil para definir el diagnóstico cuando las imágenes no son concluyentes o la biopsia es infructuosa(6,27). Se desarrollaron otros marcadores (alfa fetoproteína ultrasensible, proteína Golgi 73, interleuquina 6, antígeno de carcinoma de células escamosas, osteopontina, expresión de genes, etc.) que podrían ser útiles combinados pero aún no han sido validados ni están accesibles en la práctica diaria(28). Conclusiones. Las imágenes dinámicas, TC con contraste y RM con gadolinio, son la piedra angular del diagnóstico de CHC. Basta con una imagen característica cuando la lesión detectada supera los 2 cm. En las lesiones que oscilan entre 1 y 2 cm puede mantenerse el mismo criterio cuando la calidad de la imagen es adecuada. En los casos en que no lo sea, puede adoptarse el criterio de las dos imágenes compatibles para asegurar el diagnóstico. Dado que las lesiones menores de 1 cm raramente son CHCs, se recomienda su control ecográfico cada tres meses y el progreso en el algoritmo diagnóstico si superan ese tamaño(1,5,23,29). La biopsia hepática queda reservada para los casos en que las imágenes no son concluyentes. Pese a su baja sensibilidad, el dosaje de alfa fetoproteína con niveles superiores a 200-400 ng/dl puede contribuir al diagnóstico cuando los otros métodos son infructuosos(1,28). En la figura 1 se muestra el algoritmo diagnóstico propuesto. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Referencias 1. European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2012;56:908-943. 2. Stigliano R, Marelli L, Yu D, et al. Seeding following percutaneous diagnostic and therapeutic approaches for hepatocellular carcinoma. What is the risk and the outcome? Seeding risk for percutaneous approach of HCC. Cancer Treat Rev 2007;33:437-447. 3. Bruix J, Sherman M, Llovet JM, et al. EASL Panel of Experts on HCC. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL Conference. European Association for the Study of the Liver. J Hepatol 2001;35:421-430. 4. Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005;42:1208-1236. 5. Bruix J, Sherman M. Management of hepatocellular carcinoma: an update. Hepatology 2011;53:1020-1022. 6. Omata M, Lesmana LA, Tateishi R, et al. Asian Pacific Association for the Study of the Liver consensus recommen¬dations on hepatocellular carcinoma. Hepatol Int 2010;4:439–474. 7. Kudo M, Izumi N, Kokudo N, et al. HCC Expert Pan¬el of Japan Society of Hepatology: management of hepatocellular carcinoma in Japan: Consensus-Based Clinical Practice Guidelines proposed by the Japan Society of Hepatology (JSH) 2010 updated version. Dig Dis 2011;29:339–364. 8. Forner A, Vilana R, Ayuso C, et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology 2008;47:97-104. 9. Sangiovanni A, Manini MA, Iavarone M, et al. The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis. Gut 2010;59:638–644. 10. Sersté T, Barrau V, Ozenne V, et al. Accuracy and disagreement of CT and MRI for the diagnosis of small hepatocellular carcinoma and dysplastic nodules: role of biopsy. Hepatology 2012;55:800-806. 11. Rimola J, Forner A, Reig M, et al. Cholangiocarcinoma in cirrhosis: absence of contrast washout in delayed phases by magnetic resonance imaging avoids misdiagnosis of hepatocellular carcinoma. Hepatology 2009;50:791–798. 12. Chou R, Cuevas C, Fu R, et al. Imaging techniques for the diagnosis of hepatocellular carcinoma. A systematic review and meta-analysis. Ann Intern Med 2015;162:697-711. 13. Lencioni R, Cioni D, Della Pina C, et al. Imaging diagnosis. Semin Liver Dis 2005;25:162–170. 14. Bruix J, Gores GJ, Mazzaferro V. Hepatocellular carcinoma: clinical frontiers and perspectives. Gut 2014;63:844-855. 15. Bolondi L, Gaiani S, Celli N, et al. Characterization of small nodules in cirrhosis by assessment of vascularity: the problem of hypovascular hepatocellular carcinoma. Hepatology 2005;42:27–34. 16. Roskams T, Kojiro M. Pathology of early hepatocellular carcinoma: conventional and molecular diagnosis. Semin Liver Dis 2010;30:17–25. 17. Silva MA, Hegab B, Hyde C, et al. Needle track seeding following biopsy of liver lesions in the diagnosis of hepatocellular cancer: a systematic review and meta-analysis. Gut 2008;57:1592–1596. 18. Villanueva A, Minguez B, Forner A, et al. Hepatocellular carcinoma: novel molecular approaches for diagnosis, prognosis, and therapy. Annu Rev Med 2010;61:317–328. 19. Llovet JM, Chen Y, Wurmbach E, et al. A molecular signature to discriminate dysplastic nodules from early hepatocellular carcinoma in HCV cirrhosis. Gastroenterology 2006;131:1758–1767. 20. Di Tommaso L, Franchi G, Park YN, et al. Diagnostic value of HSP70, glypican 3, and glutamine synthetase in hepatocellular nodules in cirrhosis. Hepatology 2007;45:725–734. 21. Capurro M, Wanless IR, Sherman M, et al. Glypican-3: a novel serum and histochemical marker for hepatocellular carcinoma. Gastroenterology 2003;125:89–97. 22. International Consensus Group for Hepatocellular Neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the International Consensus Group for Hepatocellular Neoplasia. Hepatology 2009;49:658–664. 23. Bota S, Piscaglia F, Marinelli S, et al. Comparison of international guidelines for noninvasive diagnosis of hepatocellular carcinoma. Liver Cancer 2012;1:190-200. 24. Attwa MH, El-Etreby SA. Guide for diagnosis and treatment of hepatocellular carcinoma. World J Hepatol 2015;7:1632-1651. 25. Xu C, Yan Z, Zhou L, Wang Y. A comparison of glypican-3 with alphafetoprotein as a serum marker for hepatocellular carcinoma: a metaanalysis. J Cancer Res Clin Oncol 2013;139:1417-1424. 26. Wan H, Xu H, Gu Y, et al. Comparison osteopontin vs AFP for the diagnosis of HCC: a meta-analysis. Clin Res Hepatol Gastroenterol 2014;38:706-714. 27. Nguyen MH, Garcia RT, Simpson PW, et al. Racial differences in effectiveness of alpha-fetoprotein for diagnosis of hepatocellular carcinoma in hepatitis C virus cirrhosis. Hepatology 2002;36:410-417. 28. Schütte K, Schulz C, Link A, et al. Current biomarkers for hepatocellular carcinoma: surveillance, diagnosis and prediction of prognosis. World J Hepatol 2015;7:139-149. 29. Bremner KE, Bayoumi AM, Sherman M, et al. Management of solitary 1 cm to 2 cm liver nodules in patients with compensated cirrhosis: a decision analysis. Can J Gastroenterol 2007;21:491-500. 1 AAEEH • 79 ASOCIACIÓN ARGENTINA PARA EL 2 80 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Módulo Estadificación y Tratamiento AAEEH • 81 ASOCIACIÓN ARGENTINA PARA EL 82 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Clasificación de BCLC Dres Nora Fernández, Federico Piñero, Guillermo Tsariktsian El HCC asienta habitualmente sobre un hígado cirrótico, por lo que la definición del pronóstico y la estadificación son complejas y deben considerar no solo la carga tumoral y los síntomas asociados al tumor, sino el grado de afección de la función hepática. El sistema de estadificación Barcelona Clinic Liver Cancer (BCLC) cumple con estos objetivos y además, relaciona cada estadío con la estrategia de tratamiento más adecuada según la mejor evidencia científica (1). El sistema BCLC estratifica a los pacientes según variables pronósticas relacionadas con el estadío tumoral, la función hepática (indicada por el status de Child-Pugh), el status físico y los síntomas asociados con el cancer (Eastern Cooperative Group Performance Status -ECOG PS-), y variables relacionadas con el tratamiento que influyen en sus resultados. Todas estas variables fueron obtenidas de estudios de cohorte y de estudios randomizados. El sistema BCLC distingue cinco estadíos de enfermedad: muy temprano, temprano, intermedio, avanzado y terminal y relaciona cada estadío con una estrategia de tratamiento. (Figura 1) (1,2). En la evaluación inicial del paciente cirrótico con HCC debe considerarse si es candidato a trasplante hepático según carga y extensión tumoral, edad y comorbilidades. Esta primera consideración permite seleccionar en los estadíos tempranos seleccionar la mejor terapéutica curativa y rescatar pacientes con mala función hepática (Child C, ver BCLC D) pero que reúnen criterios de trasplantabilidad según la carga tumoral (4,5). El estadío muy temprano (BCLC 0) se define por la presencia de un tumor único < 2 cm de diámetro sin invasión vascular, con función hepática conservada (Child-Pugh A) y buen estado de salud (ECOG-PS0). El estadío temprano (BCLC A) incluye a pacientes con un tumor único o hasta 3 nódulos ≤ 3 cm de diámetro, clase Child-Pugh A o B, con ECOG-PS0. En los estadíos BCLC 0 y A, el sistema recomienda tratamientos potencialmente curativos como la resección quirúrgica, la ablación o el trasplante hepático, con los que la mediana de sobrevida a 5 años es de 70 – 90% y de 50 – 70% para sendos estadíos. El tamaño mayor a 5 cm para los tumores únicos es un criterio de selección para trasplante y resulta condicionante de los resultados de la resección y la ablación. La consideración de otros factores predictivos de sobrevida postresección hepática, como el nivel de bilirrubina sérica (> o < 1 mg/dl) y la presencia o ausencia hipertensión portal clínicamente significativa, permiten seleccionar a los mejores candidatos para la resección quirúrgica. El estadío intermedio de HCC (BCLC B) comprende un grupo muy heterogéneo de pacientes con clase Child Pugh A o B, con HCC único de gran tamaño (> 5 cm) no pasible de tratamiento curativo, o con tumor multifocal, definido como más de 3 tumores de cualquier tamaño, o 2 o 3 tumores > 3 cm de diámetro, en ausencia de síntomas relacionados con el cancer, invasión vascular o diseminación extrahepática. La sobrevida mediana en este estadío es de 49% a 2 años. En estos pacientes el tratamiento recomendado es la quimioembolización transarterial (QETA). La población con estadío HCC avanzado (BCLC C) comprende a pacientes con función hepática Child-Pugh A y B, con síntomas relacionados con el cancer (ECOG-PS 1 o 2), invasión macrovascular segmentaria o portal, y/o diseminación extrahepática (compromiso ganglionar o metástasis). La sobrevida mediana esperada de los pacientes en este grupo es de 25% a 1 año. En los pacientes con HCC avanzado y función hepática preservada (Child A), está recomendado el tratamiento sistémico con sorafenib. AAEEH • 83 ASOCIACIÓN ARGENTINA PARA EL Los pacientes con HCC en estadío terminal (BCLC D) presentan tumores sintomáticos, con estado funcional malo (ECOG-PS 3-4), o status Child-Pugh clase C con tumores que superan los criterios de trasplantabilidad. Este grupo tiene una mediana de sobrevida de 11% al año, y no tiene tratamiento específico, excepto los mejores cuidados paliativos. Concepto de migración de estadío: a aquellos pacientes que no reúnan todos los criterios para la asignación del tratamiento recomendado correspondiente a su estadío (p ej localización del tumor, condición clínica, preferencias del paciente), se sugiere ofrecerles la siguiente opción terapéutica dentro del mismo estadío o en el siguiente estadío pronóstico. El sistema BCLC es el más frecuentemente utilizado en Occidente para definir pronóstico, ha sido validado externamente en diferentes escenarios clínicos y es respaldado por la American Association for the Study of Liver Diseases (AASLD), American Gastroenterology Association (AGA), la European Association for the Study of the Liver (EASL), y la European Organization for Research and Treatment of Cancer (EORTC) (4,5). Sin embargo, su aplicabilidad en la práctica diaria se ve afectada principalmente por la dificultad para clasificar algunos pacientes según las recomendaciones internacionales o por la imposibilidad de aplicar el tratamiento recomendado, debido a las características o localización del tumor o a la presencia de comorbilidades. Varios estudios evaluaron la aplicabilidad del BCLC en la práctica asistencial, revelando que hasta el 40% de los pacientes eran tratados fuera de las recomendaciones del sistema BCLC. La aplicabilidad en Argentina está siendo evaluada por un estudio multicéntrico actualmente en marcha. El estadío intermedio es uno de los escenarios que presenta mayor dificultad para la aplicación del BCLC. Propuesta de subestadificación del estadío BCLC B La población incluída en el estadío intermedio 84 es muy heterogénea en lo que respecta a carga tumoral, función hepática y comorbilidades. Esta heterogeneidad se hace evidente en las diferencias en el pronóstico (rango de supervivencia de 11 a 45 meses) y en la aplicabilidad y resultados de distintos tratamientos en los pacientes incluídos en este estadío (6-8). En este sentido, varias observaciones dan sustento a la subestadificación del BCLC B: a) La carga tumoral determina la posibilidad de obtener la necrosis tumoral con QETA, y junto con el status de Child-Pugh (especialmente la presencia de ictericia y de ascitis) definen tanto la probabilidad de sobrevida post QETA como el riesgo de desarrollar complicaciones por este tratamiento. Por lo tanto la eficacia, seguridad y aplicabilidad de la QETA es variable dentro del mismo estadío. De hecho, los pacientes Child-Pugh B representan un área gris, como lo demuestra la discrepancia entre las guías de AASLD (en contra de recomendar QETA en estos pacientes) y las de EASL-EORTC (recomiendan QETA en pacientes Child-Pugh B sin descompensación). b) Pacientes bien seleccionados, con status Child-Pugh A y masa tumoral limitada, pueden beneficiarse con resección hepática o trasplante, c) Pacientes con gran carga tumoral pero status Child-Pugh A, toleran muy bien el sorafenib, d) El ECOG-PS, otro factor determinante de la estrategia terapéutica, es subjetivo y su relación con la enfermedad neoplásica o con la cirrosis es difícil de discriminar, por lo que no debería ser determinante para excluir el trasplante como alternativa, e) Los pacientes con trombosis portal periférica (segmentaria o subsegmentaria) y status Child-Pugh A tienen buena respuesta y tolerancia a la QETA y a la radioembolización (4,9,10). Por lo tanto, la QETA, el tratamiento recomendado para pacientes en estadío BCLC B, no parece beneficiar a todos los pacientes en este estadío, y no resulta ser el tratamiento óptimo en algunos pacientes. Diferentes estudios y experiencias en la práctica clínica han puesto en evidencia la necesidad de explorar una estratificación más fina del BCLC. Varias guías para el manejo del HCC (NCCN, JSH, APASL) reconocen la heterogeneidad de los pacientes incluídos en el BCLC B y la falta de evidencia para recomendar un único tratamiento y recomiendan distintas opciones de tratamiento L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 para diferentes subgrupos de pacientes dentro de esta categoría (11,12). El grupo de Bologna ha propuesto una subclasificación del estadío BCLC B basada en la función hepática (Child-Pugh A5-B9), la carga tumoral (dentro o más allá del criterio ¨hasta 7¨), el status ECOG-PS (0-1) y el estado de la vena porta. Se definieron los subgrupos B1 a B4 y se recomendaron estrategias terapéuticas de primera y segunda línea para cada subestadío. Un quinto subgrupo, con trombosis segmentaria, es considerado una superposición con el estadío BCLC C (13-15). (Tablas 1 y 2) El valor pronóstico de esta subclasificación fue validada en cohortes externas de pacientes en Asia y en Occidente, en las que se confirmó que los mejores candidatos para QETA son aquellos en subestadío B1, mientras que entre los pacientes en subestadío B3 y B4 no se observaron diferencias significativas en el pronóstico (16). Otra propuesta de subclasificación que abarca todo el sistema BCLC fue propuesta y comparada en forma retrospectiva con el sistema BCLC en Hong Kong en una numerosa cohorte de pacientes con HCC predominantemente relacionado con VHB (17). Esta estadificación se estableció en base al status ECOG-PS, el status de Child-Pugh, el estado tumoral según el tamaño del mayor tumor, el número de nódulos, y presencia o ausencia de compromiso vascular intra y extrahepática. Esta estadificación demostró la aplicabilidad de terapias curativas en un mayor número de pacientes que el sistema BCLC. Esta estratificación requiere de validación externa en cohortes de pacientes occidentales. Conclusión • El sistema de estadificación Barcelona Clinic Liver Cancer (BCLC) es el actualmente recomendado para definir pronóstico y determinar la elección de la estrategia de tratamiento del hepatocarcinoma (HCC). • Su aplicabilidad en la práctica clínica presenta algunas restricciones, por lo que se ha propuesto un mayor refinamiento en la estadificación. • Se recomienda que tanto la estadificación como la asignación del tratamiento se realice por equipo multidisciplinario especializado. • En los casos en los que el tratamiento recomendado no sea aplicable, la estrategia terapéutica debe seleccionarse teniendo como objetivo primario la curación y secundario la mejoría en la sobrevida, considerando los posibles efectos adversos y basándose en la mejor evidencia científica. • Se recomienda evaluar la aplicabilidad del BCLC en nuestro medio para determinar si el sistema debería adecuarse a nuestra población y a la disponibilidad de recursos. Referencias 1. Forner A, Reig ME, de Lope CR, Bruix J. Current strategy for staging and treatment: the BCLC update and future prospects. Semin Liver Dis 2010;30:61-74 7. Leoni S, Piscaglia F, Serio I, et al. Adherence to AASLD guidelines for the treatment of hepatocellular carcinoma in clinical practice: experience of the Bologna Liver Oncology Group. Dig Liver Dis 2014; 46:549-555 2. Forner A, Díaz-González A, Liccioni A, Vilana R. Prognosis prediction and staging. Best Prac Res Clin Gastroenterol, 2014;28:855-865 8. Colombo M, Sangiovanni A. Treatment of hepatocellular carcinoma: beyond international guidelines. Liver Int 2015; 35 (S1) 129-138 3. Oken M, Creech R, Tormey D, Horton J, Davis T, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982;5:649-655 9. Bolondi L, Burroughs A, Dufour JF, Galle P, Mazzaferro V, et al. Heterogeinity of patients with intermediate (BCLC B) hepatocellular carcinoma: Proposal for a subclassification to facilitate treatment decisions. Semin Liver Dis 2012;32:348-359 4. European Association for the Study of the Liver, European Organisation for Research and Treatment of Cancer. EASL-EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2012; 56:908-943 5. Bruix J, Sherman M. American Association for the Study of Liver Disease. Management of hepatocellular carcinoma: an update. Hepatology 2011;53:1020-1022 6. Borzio M, Fornari F, De Sio I, et al, EpaHCC Group. Adherence to American Association for the Study of Liver Diseases guidelines for the management of hepatocellular carcinoma: results of an Italian field practice multicenter study. Future Oncol 2013;9:283-294 10. Piscaglia F, Terzi E, Cuchetti A, Trimarchi Ch, Granito A, et al. Treatment of hepatocellular carcinoma in Child-Pugh B patients. Dig Liver Dis 2013;45:852-858 11. Kudo M, Matsui O, Izumi N, Ilijima H, Kadoya M, et al. JSH Consensusbased practice guidelines for the management of hepatocellular carcinoma: 2014 update by the Liver Cancer Study Group of Japan. Liver Cancer 2014;3:458-468 12. Omata M, Lesmana L, Tateishi R, Chen PJ, Lin SM, et al. Asian Pacific Association for the Study of the Liver consensus recommendations on hepatocellular carcinoma. Hepatol Int 2010;4:439-474 AAEEH • 85 ASOCIACIÓN ARGENTINA PARA EL 13. Ha Y, Shim JH, Kim SO, Kim KM, LimYS, et al. Clinical appraisal of the recently proposed Barcelona Clinic Liver Cancer stage B subclassification by survival analysis. J Gastroenterol Hepatol 2014;29:787-793 16. Sieghart W, Hucke F, Peck-Radosavljevic M. Transarterial chemoembolization: Modalities, indication, and patient selection. J Hepatol 2015;62:1187-1195 14. Hucke F, Pinter M, Graziadei I, Vogel W, Trauner M, et al. Validation of the BCLC-B subclassification in an Austrian TACE cohort. J Hepatol 2014; 60:53 17. Yau T, Tang V, Yao TJ, Fan ST, Lo CM, Development of Hong Kong Liver Cancer Staging System with treatment stratification for patients with hepatocellular carcinoma. Gastroenterology 2014;146:1691-1700 15. Weinmann A, Koch S, Sprinzi M, Kloeckner R, Schulze-Bergkamen H, et al. Survival analysis of proposed BCLC-B subgroups in hepatocellular carcinoma patients. Liver Int 2015; 35:591-600 1 2 86 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Otros Sistemas de Estadificación Dras Valeria Descalzi, Melisa Dirchwolf, Diana Levi El pronóstico en el paciente con diagnóstico de hepatocarcinoma (HCC) se encuentra determinado no sólo por características inherentes al tumor (tamaño, localización, histopatología) sino también por el deterioro de la función hepática subyacente debido a la presencia de cirrosis(1). Se ha sugerido que un algoritmo ideal de estadificación en HCC debe considerar cuatro aspectos: estadio tumoral, grado de deterioro de función hepática, condición general del paciente y respuesta al tratamiento(2). Si bien la clasificación BCLC es la guía más utilizada a nivel mundial, otros algoritmos o clasificaciones han sido desarrollados y validados en poblaciones específicas (con diferencias geográficas, raciales, y en etiología de la enfermedad) y se caracterizan por una heterogénea selección de variables para determinar el pronóstico de pacientes con HCC.No existe consenso universal sobre la superioridad de los diferentes algoritmos(3). En la tabla 1 se resumen las principales clasificaciones validadas. Algoritmos desarrollados en Oriente La clasificación de Okuda representó la primer estrategia para la evaluación pronóstica del HCC; compuesta por una valoración indirecta del tamaño tumoral (% de compromiso del hígado afectado) y variables de función hepática (ascitis, albúmina y bilirrubina)(4). Si bien fue utilizada por décadas, sólo demostró utilidad en estadios avanzados de la enfermedad, por lo que actualmente está en desuso(5). Otro algoritmo desarrollado en esta región fue la escala CUPI, la cual incluyó la valoración de extensión tumoral, función hepática y estado general; de difícil extrapolación a población occidental debido a la inclusión de cirrosis secundaria a HBV predominantemente(6). Si bien las escalas de Tokio y JIS incluyeron un porcentaje dominante de cirrosis por HCV (similar a la observada en Occidente), ninguna de ellas evaluó la capacidad funcional de los pacientes(7,8). La clasificación más reciente, desarrollada por el Hong Kong Liver Center, presenta la característica de incluir parámetros de extensión tumoral, función hepática, estado general y recomendación de tratamiento; respecto al BCLC, demostró una mejor capacidad para identificar pacientes en estadios intermedios que se beneficiarían de un tratamiento más agresivo(9). Algoritmos desarrollados en Occidente La primera clasificación occidental pronóstica para HCC fue la denominada francesa o GRETCH (acrónimo que identifica al grupo responsable del estudio). Ésta considera la capacidad de realizar actividades diarias mediante la escala de Karnofsky, incluye cuatro variables relacionadas a la función hepática y extensión tumoral, si bien no considera el número ni tamaño tumoral(10). Posteriormente el Programa Italiano de Cáncer del Hígado desarrolló el algoritmo CLIP, que abarca la escala de Child-Pugh como valoración de la función hepática, características tumorales (número de lesiones y compromiso de tejido hepático afectado) y extensión tumoral (trombosis portal). No tiene en consideración el estado de salud general del paciente(11). La clasificación TNM, ya sea en su versión original desarrollada por la American Joint Committee on Cancer o modificada por el Liver Cancer Study Group of Japan, se ha propuesto para evaluar el pronóstico de pacientes sometidos a resección o trasplante hepático (estadios tempranos)(12,13). Algoritmos basados en marcadores biológicos Distintos marcadores biológicos han sido propuestos como subrogantes de la biología tumoral, sugiriendo su influencia en el pronóstico AAEEH • 87 ASOCIACIÓN ARGENTINA PARA EL de pacientes con HCC. La clasificación del receptor de estrógenos se basó en la influencia negativa en la sobrevida cuando el mismo se encontraba presente; sin embargo, su determinación no cuenta con un rol definido en la práctica clínica y requiere una biopsia hepática (14). La clasificación basada en α-FPha sido sugerida para optimizar la evaluación pronóstica especialmente en pacientes no cirróticos con HCC, mientras que en cirróticos no presentó una clara diferenciación entre estadios intermediosdel BCLC(15). Sin embargo ha demostrado utilidad en la selección de pacientes cirróticos para trasplante hepático fuera de los Criterios de Milán, tanto en cohortes europeas como latinoamericanas (16,17). La clasificación 5-genes y el algoritmo bm-JIS incluyen diversos biomarcadores tales como la expresión de los genes TAF9, RAMP3, HN1, KRT19 yRAN, y el dosaje de α-FP, lensculinaris fracción aglutinina reactiva de α-FP y des-gamma-carboxiprotrombina; estas guías son prometedoras, ya que se ha descrito su marcadoimpactopronóstico y validado en distintas poblaciones, pero no se encuentran aún disponibles para su uso en la práctica diaria(18-20). Modificaciones sugeridas para algoritmos disponibles En un intento de subsanar los déficit identificados en los algoritmos ya mencionados, se han desarrollado numerosas clasificaciones alternativas, tales como el reemplazo del ChildPugh por el score de MELD en los algoritmos de CLIP, BCLC y JIS (no mostró beneficios sobre la escala original de BCLC)(21) o la sub-clasificación del estadio intermedio de BCLC (BCLC-B) para optimizar la selección de tratamiento en este grupo heterogéneo de pacientes(22). Finalmente, se ha propuesto la adición de marcadores biológicos a scores establecidos; en particular, la adición de proteína C-reactiva a los algoritmos CLIP, BCLC, Tokio y TNM ha demostrado ser un marcador independiente de pobre pronóstico útil en todos ellos (pendiente su validación externa)(23). Comparación y selección de algoritmos disponibles Existen numerosos análisis que comparan la eficacia de los algoritmos descriptos, con resultados disímiles; esto se explica por las amplias diferencias existentes en cuanto a el estadio tumoral, población, áreas geográficas, enfermedad de base y objetivos primarios en el desarrollo de los mismos(1). Sin embargo, las únicas clasificaciones que actualmente contemplan las recomendaciones de tratamiento son el BCLC y HKLC; cuando se evaluó la utilidad de este último en una cohorte europea, no se observó una optimización en la predicción de resultado respecto al BCLC(24). Tabla 1. Algoritmos propuestos para la estadificación de pacientes con diagnóstico de HCC. Algoritmos Okuda (1985) Población Extensión tumoral Función hepática Estado general Recomendación de tratamiento Oriental % compromiso hepático Ascitis-Alb-BT No No GRETCH(1999) Occidental Trombosis portal BT-FAL-αFP Karnofsky No CLIP (2000) Occidental N° y % compromiso tumoral hepático Trombosis portal Child-Pugh No No CUPI (2002) Oriental TNM Ascitis BT-FAL-αFP Presencia síntomas No JIS (2003) Oriental TNM modificado Child-Pugh modificado No No Tokio (2005) Oriental N° y tamaño tumoral Alb-BT No No Occidental N°, tamaño, trombosis portal,afectación ganglionar, metástasis No No No Oriental TNM, trombosis portal intra-extrahepática Child-Pugh ECOG Si TNM7th ed. (2009) HKLC (2014) Notas: Alb: albúmina; BT: bilirrubina total; αFP: alfa-fetoproteína; N°: número; %: porcentaje. 88 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Referencias 1. Duseja A. Staging of hepatocellular carcinoma. J Clin Exp Hepatol 2014;4:S74-9. 2. Pons F, Varela M, Llovet JM. Staging systems in hepatocellular carcinoma. HPB (Oxford) 2005;7:35-41. 3. Tejeda-Maldonado J, Garcia-Juarez I, Aguirre-Valadez J, et al. Diagnosis and treatment of hepatocellular carcinoma: An update. World J Hepatol 2015;7:362-76. 4. Okuda K, Ohtsuki T, Obata H, et al. Natural history of hepatocellular carcinoma and prognosis in relation to treatment. Study of 850 patients. Cancer 1985;56:918-28. 5. Au JS, Frenette CT. Management of Hepatocellular Carcinoma: Current Status and Future Directions. Gut Liver 2015;9:437-48. 6. Leung TW, Tang AM, Zee B, et al. Construction of the Chinese University Prognostic Index for hepatocellular carcinoma and comparison with the TNM staging system, the Okuda staging system, and the Cancer of the Liver Italian Program staging system: a study based on 926 patients. Cancer 2002;94:1760-9. 7. Tateishi R, Yoshida H, Shiina S, et al. Proposal of a new prognostic model for hepatocellular carcinoma: an analysis of 403 patients. Gut 2005;54:419-25. 8. Kudo M, Chung H, Osaki Y. Prognostic staging system for hepatocellular carcinoma (CLIP score): its value and limitations, and a proposal for a new staging system, the Japan Integrated Staging Score (JIS score). J Gastroenterol 2003;38:207-15. 9. Yau T, Tang VY, Yao TJ, et al. Development of Hong Kong Liver Cancer staging system with treatment stratification for patients with hepatocellular carcinoma. Gastroenterology 2014;146:1691-700 e3. 10. Chevret S, Trinchet JC, Mathieu D, et al. A new prognostic classification for predicting survival in patients with hepatocellular carcinoma. Groupe d’Etude et de Traitement du Carcinome Hepatocellulaire. J Hepatol 1999;31:133-41. 11. A new prognostic system for hepatocellular carcinoma: a retrospective study of 435 patients: the Cancer of the Liver Italian Program (CLIP) investigators. Hepatology 1998;28:751-5. 12. Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol 2010;17:1471-4. 14. Villa E, Colantoni A, Camma C, et al. Estrogen receptor classification for hepatocellular carcinoma: comparison with clinical staging systems. J Clin Oncol 2003;21:441-6. 15. Burnett NP, Dunki-Jacobs EM, Callender GG, et al. Evaluation of alphafetoprotein staging system for hepatocellular carcinoma in noncirrhotic patients. Am Surg 2013;79:716-22. 16. Duvoux C, Roudot-Thoraval F, Decaens T, et al. Liver transplantation for hepatocellular carcinoma: a model including alpha-fetoprotein improves the performance of Milan criteria. Gastroenterology 2012;143:986-94 e3; quiz e14-5. 17. Federico Piñero, Elaine Cristina de Ataide, Sebastían Marciano, Margarita Anders, Alina Zerega et al. Trasplante Hepático y Hepatocarcinoma: Evaluación del Modelo de Selección Francés en una cohorte multicéntrica Latino-Americana. Acta Gastroenterol Latinoam, 2015 Jun; 45 (S1) S10. 18. Kitai S, Kudo M, Minami Y, et al. A new prognostic staging system for hepatocellular carcinoma: value of the biomarker combined Japan integrated staging score. Intervirology 2008;51 Suppl 1:86-94. 19. Kinoshita A, Onoda H, Fushiya N, et al. Staging systems for hepatocellular carcinoma: Current status and future perspectives. World J Hepatol 2015;7:406-24. 20. Nault JC, De Reynies A, Villanueva A, et al. A hepatocellular carcinoma 5-gene score associated with survival of patients after liver resection. Gastroenterology 2013;145:176-87. 21. Huo TI, Lin HC, Hsia CY, et al. The model for end-stage liver disease based cancer staging systems are better prognostic models for hepatocellular carcinoma: a prospective sequential survey. Am J Gastroenterol 2007;102:1920-30. 22. Bolondi L, Burroughs A, Dufour JF, et al. Heterogeneity of patients with intermediate (BCLC B) Hepatocellular Carcinoma: proposal for a subclassification to facilitate treatment decisions. Semin Liver Dis 2012;32:348-59. 23. Kinoshita A, Onoda H, Imai N, et al. The addition of C-reactive protein to validated staging systems improves their prognostic ability in patients with hepatocellular carcinoma. Oncology 2014;86:308-17. 24. Adhoute X, Penaranda G, Bronowicki JP, et al. Usefulness of the HKLC vs. the BCLC staging system in a European HCC cohort. J Hepatol 2015;62:492-3. 13. Chan AC, Fan ST, Poon RT, et al. Evaluation of the seventh edition of the American Joint Committee on Cancer tumour-node-metastasis (TNM) staging system for patients undergoing curative resection of hepatocellular carcinoma: implications for the development of a refined staging system. HPB (Oxford) 2013;15:439-48. 1 AAEEH • 89 ASOCIACIÓN ARGENTINA PARA EL 2 90 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Ablación Percutánea del Hepatocarcinoma Dres. Juan C Bandi, Shigeru Kozima, Fernando Barreyro Décadas atrás, el diagnóstico de HCC se realizaba tardíamente, en estadios sintomáticos y con descompensación hepática. En la actualidad al realizar el diagnóstico precoz mediante ecografía bianual, podemos hacerlo en estadios iniciales y con mejor función hepática. De esta manera brindarle al paciente tratamientos curativos entre ellos, la resección hepática, el trasplante y la ablación percutánea. De allí deriva la importancia de la adecuada selección y estadificación de los pacientes para brindarle posibilidades terapéuticas con los mejores resultados esperables de acuerdo con datos basados en la evidencia. La aplicación de ablación percutánea y resección hepática encuentra sus mejores resultados en los estadios muy temprano y temprano del HCC (BCLC 0-A) (1,2). La sobrevida en la historia natural del HCC estadio temprano varía entre el 10 y 65% a los 3 años. Si bien no existen trials que comparen la resección hepática y los tratamientos percutáneos con el mejor tratamiento de soporte, estos tratamientos deben brindar una sobrevida de 50-70% a los 5 años (1-3). La ablación se basa en la inducción de la necrosis celular mediante la inyección de agentes o por el aumento de la temperatura. Las dos más utilizadas y con las que contamos en nuestro medio son la alcoholización percutánea (AP) como ablación química y la radiofrecuencia (ARF) como método físico. La AP se realiza mediante la inyección de alcohol dentro del tumor por punción bajo control ecográfico hasta lograr la cobertura total del tumor. Fue la técnica estándar hasta recientemente en que fue reemplazada por la ARF (1) y podría utilizarse en algunos casos determinados como complementario al otro método ablativo. La principal limitación de la AP es la tasa de recurrencia local elevada, que puede alcanzar un 43% en las lesiones de más de 3 cm (4,5). La ARF consiste en un método que utiliza el calor que provoca un daño celular generado por una aguja electrodo que se inserta por punción percutánea. La ARF tiene la ventaja de tener un efecto antitumoral más predecible y potencialmente requerir una sola sesión. Esto se refleja en un mejor control de la enfermedad y una mayor sobrevida comparada con la AP. Esta diferencia es más evidente en tumores mayores de 2 cm observándose resultados similares en tumores menores de 2 cm (4). Ambos procedimientos ablativos son considerados como una terapia curativa para el HCC en estadio temprano. La mayor limitación que poseen es el tamaño tumoral. En nódulos menores a 2 cm se obtiene más del 95% de necrosis, 80% en tumores entre 2-3 cm y 50% en tumores mayores. La AP tiene un papel en aquellos pacientes en que no puede accederse a la ARF debido a la proximidad de la vesícula, colon, estómago y lesiones subcapsulares con mayor riesgo de siembra tumoral (5). En estos casos la ARF mediante laparoscopia también puede ser una opción. Las técnicas ablativas tienen también la ventaja de poder realizarse en pacientes cuya reserva funcional para una cirugía es insuficiente y por otro lado la posibilidad de poder repetirse el tratamiento ante una recidiva o recaída de la enfermedad (4,6). El procedimiento debe realizarse bajo anestesia general. Considerando como primera opción la quirúrgica, las indicaciones del método son en aquellos pacientes con lesión hepática localizada, que no sean candidatos a una cirugía en lo inmediato ya sea para el trasplante o en aquellos pacientes que por la insuficiencia hepática no lo sean a una cirugía resectiva. En pacientes Child Pugh A, en que se alcanza necrosis tumoral satisfactoria se obtiene una sobrevida de AAEEH • 91 ASOCIACIÓN ARGENTINA PARA EL 50% a los 5 años, similar a la de los pacientes que no tienen perfil quirúrgico óptimo. complicaciones mayores. Otra técnica de ablación química, la inyección percutánea de ácido acético (IPA), no ha aportado ventajas sustanciales respecto a la AP (8). En este momento no se dispone de datos que respalden el uso de la ARF para sustituir a la resección como tratamiento de primera línea en pacientes con un HCC en estadio inicial (BCLC A) (19,23,24) . Cinco ensayos controlados y aleatorizados (ECR) han comparado la ARF con la AP en el tratamiento del HCC en estadio inicial mostrando que la ARF tiene un efecto antitumoral superior a la de la AP, dando lugar a un mejor control local de la enfermedad (tasa de recurrencia local a 2 años: 2%–18% frente a 11%–45%) (10-14). Ablación local: Resumen La evaluación de los efectos de la ARF en la supervivencia es controvertida. Un estudio japonés demostró ventajas de supervivencia favorables a la ARF frente a la AP (15), pero no se observaron en los ECRs europeos (16-18). Tres metaanálisis independientes, con la inclusión de todos los ECRs, han confirmado que el tratamiento de ARF proporciona una ventaja de supervivencia en comparación con la AP en los tumores de más de 2 cm (18-20). Los pacientes Child–Pugh A con tumores pequeños no quirúrgicos (que se espera que alcancen respuestas completas) son los candidatos ideales para la ARF. Alrededor del 10%–15% de los tumores de localizaciones difíciles de tratar pueden abordarse mediante AP (21) . El tratamiento de los pacientes con tumores de mayor tamaño (3–5 cm), tumores múltiples (3 nódulos de tamaño < 3 cm) o insuficiencia hepática avanzada (Child–Pugh B) podría ser intentado en forma razonable con una combinación de ambas técnicas. Aunque estos tratamientos producen buenos resultados, no permiten alcanzar tasas de respuesta y resultados comparables a los de los tratamientos quirúrgicos aun cuando se empleen como primera opción. No se sabe aún si la ARF puede competir con la resección quirúrgica como tratamiento de primera línea en el HCC pequeño y solitario. Se han publicado dos ECRs con resultados opuestos (21,22); mientras que el primero no identificó diferencias en los resultados, el segundo ensayo sugirió una ventaja de supervivencia con la resección quirúrgica. Los tumores de HCC de localización subcapsular o adyacente a la vesícula biliar tienen un riesgo superior de ablación incompleta o de 92 • La ablación local con radiofrecuencia o inyección percutánea de etanol se considera el tratamiento estándar en los pacientes con tumores BCLC 0-A no aptos para la cirugía. (evidencia 2A; recomendación 1B) Otros tratamientos ablativos, como las microondas o la crioablación, se encuentran todavía en fase de investigación. La ablación por radiofrecuencia se recomienda en la mayor parte de los casos como principal terapia ablativa en los tumores de menos de 5 cm debido al control significativamente mejor de la enfermedad (evidencia 1iD; recomendación 1A) La inyección de etanol se recomienda en casos en los que la ablación por radiofrecuencia no es viable técnicamente (alrededor del 10%-15%) • En los tumores < 2 cm, BCLC 0, ambas técnicas alcanzan respuestas completas en más del 90% de los casos, con buenos resultados a largo plazo. No está claro si pueden considerarse o no alternativas competitivas a la resección (evidencia 1iA; recomendación 1C) Recomendaciones La ablación tumoral es un tratamiento eficaz en aquellos pacientes con HCC iniciales que no son candidatos a resección quirúrgica o como tratamiento eficaz durante el tiempo de espera del trasplante hepático (nivel II). La AP y la RFA poseen una eficacia similar en tumores menores de 2 cm. Sin embargo, la RFA tiene más capacidad L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 ablativa y su eficacia es claramente mayor a la AP en tumores mayores de 2 cm (nivel I). En tumores menores de 2cm, la ablación percutánea presenta una eficacia terapéutica similar a la resección quirúrgica (nivel II). (23,24) Referencias 1. Forner A, Reig ME, de Lope CR, et al. Current strategy for staging and treatment: the BCLC update and future prospects. Semin Liver Dis. 2010, 30:61-74. 2. Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet. 2012,379:1245-1255. 3. Reig M, Darnell A, Forner A, et al. Systemic therapy for hepatocellular carcinoma: the issue of treatment stage migration and registration of progression using the BCLC-refined RECIST. Semin Liver Dis. 2014, 34:444-55. 4. Khan KN, Yatsuhashi H, Yamasaki K, Yamasaki M, Inoue O, Koga M, et al. Prospective analysis of risk factors for early intrahepatic recurrence of hepatocelular carcinoma following ethanol injection. J Hepatol 2000;32:269–278. 5. Llovet JM, Vilana R, Bru C, Bianchi L, Salmeron JM, Boix L, et al. Increased risk of tumor seeding after percutaneous radiofrequency ablation for single hepatocelular carcinoma. Hepatology 2001;33:1124– 1129. 6. Komorizono Y, Oketani M, Sako K, Yamasaki N, Shibatou T, Maeda M, et al. Risk factors for local recurrence of small hepatocellular carcinoma tumors after a single session, single application of percutaneous radiofrequency ablation. Cancer 2003;97:1253–1262. 7. Germani G, Pleguezuelo M, Gurusamy K, Meyer T, Isgro G, Burroughs AK. Clinical outcomes of radiofrequency ablation, percutaneous alcohol and acetic acid injection for hepatocellular carcinoma: a meta-analysis. J Hepatol 2010;52:380–388. 8. Huo TI, Huang YH, Wu JC, Lee PC, Chang FY, Lee SD, et al. Comparison of percutaneous acetic acid injection and percutaneous ethanol injection for hepatocellular carcinoma in cirrhotic patients: a prospective study. Scand J Gastroenterol 2003;38:770–778. 9. Livraghi T, Giorgio A, Marin G, Salmi A, De Sio I, Bolondi L, et al. Hepatocellular carcinoma and cirrhosis in 746 patients: long-term results of percutaneous ethanol injection. Radiology 1995;197:101–108. 10. Lin SM, Lin CJ, Lin CC, Hsu CW, Chen YC. Randomised controlled trial comparing percutaneous radiofrequency thermal ablation, percutaneous ethanol injection, and percutaneous acetic acid injection to treat hepatocelular carcinoma of 3 cm or less. Gut 2005;54:1151–1156. 11. Shiina S, Teratani T, Obi S, Sato S, Tateishi R, Fujishima T, et al. A randomized controlled trial of radiofrequency ablation versus ethanol injection for small hepatocellular carcinoma. Gastroenterology 2005;129:122–130. 13. Lencioni R, Allgaier HP, Cioni D, Olschewski M, Deibert P, Crocetti L, et al. Small hepatocellular carcinoma in cirrhosis: randomized comparison of radiofrequency thermal ablation versus percutaneous ethanol injection. Radiology 2003;228:235–240. 14. Brunello F, Veltri A, Carucci P, Pagano E, Ciccone G, Moretto P, et al. Radiofrequency ablation versus ethanol injection for early hepatocellular carcinoma: a randomized controlled trial. Scand J Gastroenterol 2008;43:727–735. 15. Lin SM, Lin CJ, Lin CC, Hsu CW, Chen YC. Radiofrequency ablation improves prognosis compared with ethanol injection for hepatocellular carcinoma < or =4 cm. Gastroenterology 2004;127:1714–723. 16. Cho YK, Kim JK, Kim MY, Rhim H, Han JK. Systematic review of randomized trials for hepatocellular carcinoma treated with percutaneous ablation therapies. Hepatology 2009;49:453–459. 17. Germani G, Pleguezuelo M, Gurusamy K, Meyer T, Isgro G, Burroughs AK. Clinical outcomes of radiofrequency ablation, percutaneous alcohol and acetic acid injection for hepatocellular carcinoma: a meta-analysis. J Hepatol 2010;52:380–388. 18. Bouza C, Lopez-Cuadrado T, Alcazar R, Saz-Parkinson Z, Amate JM. Metaanalysis of percutaneous radiofrequency ablation versus ethanol injection in hepatocellular carcinoma. BMC Gastroenterol 2009;9:31. 19. Lencioni R, Llovet JM. Percutaneous ethanol injection in hepatocellular carcinoma: alive or dead. J Hepatol 2005;43:377–380. 20. Chen MS, Li JQ, Zheng Y, Guo RP, Liang HH, Zhang YQ, et al. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Ann Surg 2006;243:321–328. 21. Huang J, Yan L, Cheng Z, Wu H, Du L, Wang J, et al. A randomized trial comparing radiofrequency ablation and surgical resection for HCC conforming to the Milan criteria. Ann Surg 2010;252:903–912. 22. Lu DS, Yu NC, Raman SS, Limanond P, Lassman C, Murray K, et al. Radiofrequency ablation of hepatocellular carcinoma: treatment success as defined by histologic examination of the explanted liver. Radiology 2005;234:954–960. 23. EASL–EORTC Clinical Practice Guidelines: Management Hepatocellular Carcinoma. J Hepatol 2012;56:908–943. of 24. Bruix J, Sherman M. AASLD Practice Guideline. Management of Hepatocellular Carcinoma: An Update. Hepatology 2011;53:1020-1022. 12. Lin SM, Lin CJ, Lin CC, Hsu CW, Chen YC. Radiofrequency ablation improves prognosis compared with ethanol injection for hepatocellular carcinoma < or =4 cm. Gastroenterology 2004;127:1714–723. AAEEH • 93 ASOCIACIÓN ARGENTINA PARA EL 1 2 94 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Resección Quirúrgica del Hepatocarcinoma Dres Victoria Ardiles, Oscar Andriani, Pablo Sánchez Introducción Dado que el 90% de los HCC se presentan sobre pacientes cirróticos, se deben considerar algunos factores que se destacan: a. El parénquima fibroso, la coagulopatía y la hipertensión portal favorecen el sangrado durante la movilización hepática y la transección parenquimatosa. b. La síntesis proteica disminuida y la potencial disfunción de las células de Kupffer aumentan el riesgo de infecciones postoperatorias. c. La inapropiada capacidad de regeneración de los hígados cirróticos potencia la posibilidad de insuficiencia hepática postoperatoria. Operabilidad • Evaluación funcional c. Hipertensión portal: Un gradiente de hipertensión portal por encima de 10 mmHg es considerado como un factor mayor para la contraindicación a una resección hepática (3). Sin embargo, en análisis más actuales, la hipertensión portal no sería una contraindicación absoluta en pacientes Child-Pugh A que requieran de resecciones muy limitadas, especialmente si son abordadas por vía laparoscópica (4-5). La medición del gradiente de hipertensión portal no es utilizado de manera habitual y sistemática en la práctica diaria. Para la evaluación de la hipertensión portal se combinan signos indirectos tales como la presencia de várices esofágicas (> G.II), esplenomegalia, plaquetopenia (<100.000) y presencia de circulación colateral en las imágenes (6-7) . d. Actividad inflamatoria: La elevación de las transaminasas (duplicadas o más) y la presencia de infiltrados inflamatorios en la biopsia del parénquima no tumoral serían otros factores a tener en cuanto en la toma de decisiones para la indicación de la resección (8). a. Escala de Child-Pugh: Es la más utilizada para el primer paso de la evaluación funcional, ya que permite predecir la mortalidad estimada en el postoperatorio. Los pacientes Child-Pugh A son los más aptos para recibir una resección hepática. Sólo algunos pacientes Child-Pugh B cuidadosamente seleccionados podrían ser candidatos a una resección limitada. Los pacientes Child-Pugh C tienen una contraindicación absoluta a la cirugía (1). e. Otras pruebas funcionales: La retención de verde de indocianina a los 15 minutos (ICG-15) es utilizado, principalmente en países asiáticos y Europa (9). Valores por debajo de 14% permiten una resección hepática, entre 14 y 20% se deberían emplear métodos para mejorar el potencial FRH y por encima de 20% son una contraindicación a la resección. El IGC-15 no es aplicado en nuestro país. b. Escala de MELD: También puede ser utilizada para seleccionar a los pacientes cirróticos candidatos a una resección hepática. En pacientes por encima de un puntaje de 8, se debería considerar alguna otra alternativa terapéutica no quirúrgica (2). Otros métodos funcionales contemplan el test de clearence de metabolitos de la lidocaína (MEG-X; LiMax) o centellografía con Galactosil-Albúmina, pero tampoco son aplicados de manera rutinaria en la práctica. AAEEH • 95 ASOCIACIÓN ARGENTINA PARA EL • Evaluación volumétrica Resecabilidad La estimación de la volumetría hepática se hace sobre tomografía computada (TC) o imágenes por resonancia magnética (IRM), calculando el volumen hepático total (VHT), el volumen del hígado a resecar (descontando el volumen tumoral) y el volumen del hígado remanente (HR) .Se considera que el volumen mínimo del futuro HR no debe ser inferior al 40% en pacientes ChildPugh A y del 90% en pacientes Child-Pugh B (10). Si bien la clasificación para estadificación propuesta por BCLC (Barcelona Clinic Liver Cancer) es la más utilizada, debería ser considerada como una guía para estratificar grupos de pacientes y no como para tomar decisiones sobre un paciente individual. Cada paciente debe ser evaluado de manera personalizada y en un grupo interdisciplinario compuesto como mínimo por hepatólogos, cirujanos HPB e imagenólogos. La embolización portal preoperatoria (EPP) puede realizarse de forma segura en pacientes con HCC potenciales candidatos a una resección hepática mayor pero con volumen del HR insuficiente. Mediante la estimulación de la hipertrofia del HR (entre 35 y 69%), la EPP disminuye la insuficiencia hepática postoperatoria y mortalidad en estos pacientes. Las contraindicaciones para realizarla son la presencia de tumor o trombosis portal en el HR. La asociación de quimioembolización puede contrarrestar los efectos de la modulación hemodinámica que produciría la EPP (aumento del flujo arterial en el tumor con el consiguiente aumento de tamaño del mismo) mejorando los resultados oncológicos (11-12). Sin embargo, aún con la EPP hasta un 40% de los pacientes no llegan a la resección ya sea por progresión tumoral o falta de hipertrofia del HR. Recientemente el procedimiento ALPPS (Associating Liver Partition and Portal vein ligation for Staged hepatectomy) ha sido introducido como una técnica que podría contrarrestar estas dos debilidades de la EPP mediante la estimulación de una gran y rápida hipertrofia hepática (>70% en 6-9 días). Sin embargo preocupa la mayor morbimortalidad del ALPPS especialmente en pacientes con tumores primarios del hígado. Si bien existen reportes aislados sobre la utilización del ALPPS en HCC incluso en pacientes con cirrosis, actualmente no hay evidencia suficiente que avale la realización de este procedimiento en HCC. En pacientes con buena función hepática y que no son candidatos a EPP, el ALPPS podría ser una alternativa válida. La presencia de enfermedad extrahepática no resecable (metástasis pulmonares múltiples, óseas, ganglionares en retroperitoneo y/o mediastino) es una contraindicación absoluta a la resección. La presencia de ganglios en el hilio hepático o implantes peritoneales aislados deben considerarse como una contraindicación relativa, debiendo ser muy selectivos con los pacientes candidatos a una potencial resección (13). 96 El balance entre el tipo de resección (no anatómica, segmentectomía o hepatectomía mayor) el volumen del FHR y los riesgos de acuerdo a la reserva funcional hepática son determinantes para la indicación de la resección. En los pacientes con HCC, el equilibrio entre la resección hepática con margen y el parénquima remanente suficiente se vuelve dificultoso. La resección anatómica presenta mejores resultados de sobrevida libre de enfermedad (SLE) comparada con la resección no anatómica en tumores de 2-5 cm. Sin embargo la resección no anatómica es una alternativa de tratamiento cuando la resección anatómica no puede ser realizada (14). En tumores menores de 2 cm o mayores de 5 cm no ha demostrado una clara ventaja. Factores que ensombrecen el pronóstico, aunque no son contraindicación formal a la cirugía (15): • Tamaño tumoral: no es una contraindicación a la resección, pudiendo, en casos seleccionados, realizar incluso hasta hepatectomías mayores con resultados similares a resecciones más limitadas (16-18) . L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 • Invasión macrovascular: La presencia de brotes tumorales en ramos segmentarios o sectoriales de la vena porta tampoco son contraindicaciones a la resección, ya que pueden ser pasibles de resecciones mayores y, en el caso de invasión macrovascular, de trombectomías asociadas en bloque con una resección anatómica (19). • Número de nódulos: En general, los candidatos ideales a la resección son aquellos que presentan enfermedad uninodular. Sin embargo en la forma oligonodular (< 3 nódulos) algunos pacientes cuidadosamente seleccionados se pueden beneficiar con una resección, muchas veces asociada a otros procedimientos locales (ablación por radiofrecuencia). Manejo perioperatorio a. Preoperatorio La optimización de la condición clínica (prohabilitación) es fundamental. Las bases de estas medidas son: nutrición, estimulación del tono muscular y el uso de complementos. • Nutrición: Una dieta pobre en sodio, rica en hidratos de carbono y proteínas (dentro de lo posible, limitadas por poder desencadenar encefalopatía) ayuda a evitar el desarrollo de ascitis y a mejorar las reservas energéticas del hígado. • Ejercicios físicos: Dentro de la capacidad de cada paciente, las caminatas o ejercicios que estimulen el tono muscular son de utilidad para la deambulación postoperatoria temprana. • Complementos: Si bien no hay evidencias contundentes, el uso de antioxidantes tales como la vitamina E y Omega-3, así como probióticos, reducirían los efectos adversos de la isquemiareperfusión durante los eventuales clampeos vasculares y estimularían a la microbiota intestinal como inmunomoduladores y favorecerían la regeneración hepática (20-21). b. Intraoperatorio Debido a la labilidad de los pacientes cirróticos, se debe poner la mayor atención en reducir las pérdidas sanguíneas durante la movilización hepática, utilizar clampeos vasculares durante la transección parenquimatosa y evitar dejar áreas devascularizadas o con mal drenaje venoso y/o biliar realizando resecciones anatómicas (15). El clampeo del pedículo hepático (Maniobra de Pringle) intermitente ha demostrado mejor tolerancia al síndrome de isquemia-reperfusión no sólo en el parénquima hepático sino también en órganos distantes y en pacientes con anormalidad en la función hepática. El clampeo segmentario es utilizado para resecciones limitadas, periféricas de pequeños HCC con parénquima hepático restante anormal para minimizar los cambios hemodinámicos y bioquímicos. La principal desventaja es que es necesario realizar una disección hiliar y el riesgo de sangrado en la línea de transección hepática es mayor que con la maniobra de Pringle (22-23). La técnica de abordaje anterior fue descripta por Lai, y consiste en la transección del hígado sin la movilización previa de sus elementos de fijación (Ligamento triangular). La no-movilización del hígado reduciría el sangrado y tendría una potencial ventaja oncológica. Esta técnica ha sido perfeccionada por Belghiti quien propone pasar una lazada entre la superficie posterior del hígado y la cara anterior de la vena cava inferior (espacio avascular) y realizar el colgado (Hanging) del hígado que sirve de guía y facilita la transección del parénquima hepático (14; 24). El abordaje laparoscópico es ideal en los pacientes cirróticos ya que disminuye los riesgos de sangrado y necesidad de transfusión, desarrollo de ascitis en el postoperatorio y las potenciales complicaciones parietales de las laparotomías y se asocia a menor tiempo de internación sin diferencias en los resultados oncológicos (25-26). En cuanto al manejo anestésico, la corrección de la coagulopatía con plasma fresco congelado y concentrado de plaquetas o el uso de ácido AAEEH • 97 ASOCIACIÓN ARGENTINA PARA EL E-aminocaproico es fundamental para evitar las pérdidas sanguíneas. La reposición de fluidos se debe hacer a base de coloides y albúmina en conjunto con una limitación del aporte de cristaloides para reducir la producción de ascitis en el postoperatorio. Drogas vasoactivas tales como la fenilefrina y la noradrenalina ayudan a mejorar el estado vasopléjico de los cirróticos. b. Postoperatorio Se deben limitar los analgésicos opioides para reducir el íleo y la potencial encefalopatía. La estimulación a la deambulación y la realimentación temprana son otros factores que influyen en los resultados postoperatorios. Referencias 1. Nicoll A. Surgical risk in patients with cirrhosis. J Gastroenterol Hepatol. 2012;27:1569-1575 14. Edward C.S. et al. Anterior approach for difficult major right hepatectomy. World J Surg 1996; 20: 314–318. 2. Teh S. et al. Hepatic resection of hepatocellular carcinoma in patients with cirrhosis: model for end-stage disease (MELD) score predicts perioperative mortality. J Gastrointest Surg. 2005;9:1207–1211 15. Ramesh H. Resection for Hepatocellular Carcinoma. J Clin Exp Hepatol. 2014; 4 (Suppl 3): S90–S96 3. Bruix J et al. Surgical resection of hepatocellular carcinoma in cirrhotic patients: prognostic value of preoperative portal pressure. Gastroenterology 1996;111:1018–1022 4. Santambrogio R. et al. Hepatic resection for hepatocellular carcinoma in patients with Child–Pugh’s A cirrhosis: is clinical evidence of portal hypertension a contraindication? HPB (Oxford). 2013;15:78–84 5. He W, Zeng Q, Zheng Y, et al. The role of clinically significant portal hypertension in hepatic resection for hepatocellular carcinoma patients: a propensity score matching analysis. BMC Cancer 2015; 15:263 6. Hassanain M et al. Liver resection for hepatocellular carcinoma. http:// dx.doi.org/10.5772/54175 7. Kishi Y, Hasegawa K, Sugawara Y, et al. Hepatocellular carcinoma: current management and future development—improved outcomes with surgical resection. Int J Hepatol 2011;2011:728103, doi:10.4061/2011/728103 8. Poon RT et al. Assessment of hepatic reserve for the indication of hepatic resection. How I do it. J Hepatobiliary Pancreat Surg 2005; 12: 31-37 9. Clavien PA, Petrowsky H, De OLiveira ML, et al. Strategies for safer liver surgery and partial liver transplantation. N Engl J Med. 2007;356:15451559 10. Guglielmi A. et al. How much remnant is enough in liver resection? Dig Surg. 2012; 29: 6-17 11. Aoki T et al. Sequential preoperative arterial and portal venous embolizations in patients with hepatocellular carcinoma. Arch Surg. 2004;139:766-774. 12. Ogata S et al. Sequential arterial and portal vein embolization before right hepatectomy in patients with cirrhosis and hepatocellular carcinoma. Br J Surg 2006;93:1091-1098. 13. Ercolani G, Grazi GL, Ravaioli M, et al. The role of lymphadenectomy for liver tumors: further considerations on the appropriateness of treatment strategy. Ann Surg 2004; 239:202-209. 98 16. Lee N et al. Surgical treatment and outcome in patients with a hepatocellular carcinoma greater than 10 cm in diameter. Br J Surg 1998; 85:1654 17. Shrager B et al. Resection of large hepatocellular carcinoma (≥10 cm): a unique western perspective. J Surg Oncol 2013; 107:111 18. Andreou A et al. Improved long-term survival after major resection for hepatocellular carcinoma: a multicenter analysis based on a new definition of major hepatectomy. J Gastrointest Surg 2013; 17:66 19. Ikai I. et al. Results of hepatic resection for hepatocellular carcinoma invading major portal and/or hepatic veins. Surg Oncol Clin N Am. 2003; 12: 65–75 20. Mijagi K et al. Effect of preoperative immunonutrition in patients undergoing hepatectomy: a randomized controlled trial. Kurume Med J. 2011; 58: 1-8 21. Rayes N et al. Effect of pre- and probiotics on liver regeneration after resection: a randomised, double-blind pilot study. Benef Microbes. 2012; 3: 237-244 22. Shimamura Y, et al. Selective portal branch occlusion by balloon catheter during liver resection. Surgery 1986;100:938–941. 23. Castaing D, et al. Segmental liver resection using ultrasound-guided selective portal venous occlusion. Ann Surg1989;210:20–23. 24. Belghiti J, et al. Liver hanging maneuver: a safe approach to right hepatectomy without liver mobilization. J Am Coll Surg 2001;193:109– 111. 25. Cherqui D. Laparoscopic liver resection: A new paradigm in the management of hepatocellular carcinoma? J Hepatol. 2015 Jul 2. pii: S0168-8278(15)00456-0. doi: 10.1016/j.jhep.2015.06.028. 26. Zhou et al. Meta-analysis of laparoscopic versus open resection for hepatocellular carcinoma. Dig Dis Sci 2011; 56:1937-43. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Trasplante Hepático en Hepatocarcinoma Dres. Gustavo Podestá, Lucas Mc Cormack, Nora Cejas La incidencia de hepatocarcinoma (HCC) ha ido incrementándose en el mundo, siendo en la actualidad el 5to cáncer más frecuente y la 3era causa de muerte por cáncer a nivel mundial (1). Este incremento se ha debido en gran parte a situaciones epidemiológicas, debido al incremento de la cirrosis por HCV en países de Occidente, y a la elevada prevalencia de la infección crónica por virus de la hepatitis B en Oriente. En segundo lugar, el tamizaje rutinario de nódulos sugestivos de HCC en pacientes con cirrosis ha permitido que un 30-40% de éstos pacientes accedan a terapéuticas curativas como la resección quirúrgica, la ablación por radiofrecuencia y el trasplante hepático (2,3). El trasplante hepático es la opción radical con mayor tasa de éxito en cuanto a curación y posibilidad de recurrencia de HCC en hígado cirrótico (4). En sus inicios, desde la década de los ’70 a principios de los ’90, los resultados obtenidos en cuanto a sobrevida y recurrencia luego del trasplante hepático en pacientes con HCC eran pobres, con una expectativa de vida no superior al 35% y una incidencia acumulativa de recurrencia cercana al 65% a 5 años. Esto era debido a la no identificación de criterios de selección adecuados para el trasplante, y por otro lado, a la ausencia de screening rutinario en los pacientes con cirrosis. Consecuentemente, la mayoría de los pacientes HCC eran diagnosticados en estadios avanzados (Figura 1). Durante la década de los ’90, Bismuth H y col. identificaron los primeros criterios de selección a punto de partida de estudios de hallazgo incidental en explantes. Posteriormente, en 1996, el grupo de Mazzaferro y col. identifican mediante un estudio de regresión logística un modelo de selección con excelentes resultados a 5 años post trasplante. Este grupo demostró que en aquellos pacientes con un nódulo único ≤5 cm de diámetro mayor o hasta 3 nódulos cada uno ≤3 cm de diámetro, presentaban una sobrevida del 70% y una recurrencia acumulativa de 10-15% a 5 años post trasplante (5). Estos criterios, llamados de Milán, fueron luego validados en cohortes externas y en estudios por imágenes pre trasplante, siendo en la actualidad los criterios de referencia de selección de candidatos a trasplante hepático por hepatocarcinoma (6). Sin embargo, otros autores propusieron la extensión de dichos criterios (“criterios extendidos”), en distintas cohortes y con resultados comparables aunque con mayor riesgo de recurrencia. Los criterios de la Universidad de San Francisco (un nódulo único ≤6.5 cm de diámetro mayor o hasta 3 nódulos siendo el mayor nódulo ≤4.5 cm de diámetro y un diámetro tumoral total ≤8 cm) (7), han sido los criterios extendidos por excelencia. Si bien han sido propuestos a punto de partida de estudios en explantes y luego validados en cohortes externas por imágenes, aún no se han podido repetir los resultados obtenidos por Yao y col. en cohortes externas (8). Adicionalmente, otros autores han propuesto la extensión de criterios de Milán sin tanta aceptación como los criterios de Yao y col. (9-12). Lo cierto es que, si bien se ha mejorado significativamente en los criterios de selección para pacientes con HCC y trasplante hepático, el riesgo de recurrencia continua siendo un problema no resuelto definitivamente. Luego del diagnóstico de recurrencia post trasplante hepático, la mediana de sobrevida es de 12 meses, siendo la primera causa de muerte en pacientes trasplantados por HCC en la actualidad (13,14). Se han propuesto distintos criterios para seleccionar pacientes portadores de HCC en hígado cirrótico y que son sometidos a trasplante AAEEH • 99 ASOCIACIÓN ARGENTINA PARA EL hepático: A.- Selección pre trasplante: • Criterios de Milán y Milán extendidos basados en imágenes preoperatorias. • Criterios basados en la biología tumoral (Alfa feto proteína). • Criterios basados en biopsia tumoral (grado de diferenciación tumoral). B.- Re evaluación del riesgo pos trasplante: • Examen anatomo-patológico del explante. La figura 2 representa un esquema de las variables a considerar en el riesgo de recurrencia. Tres pilares son fundamentales, incluyen: diámetro y nódulos por imágenes, α feto proteína pre trasplante (AFP) y la evaluación del explante. La AFP es un claro marcador biológico de riesgo de recurrencia. Distintos cortes dicotómicos de valor de AFP pre trasplante se han propuesto como criterios de selección de pacientes para trasplante (15,16). Asimismo, valores en ascenso de AFP y modificaciones dinámicas se han asociado a mayor riesgo de recurrencia en otros estudios (1720) . Lo cierto es que valores superiores a 1000 ng/ ml se asocian a un riesgo de recurrencia superior al 40% en distintas series (21). En Argentina, existe un estudio de cohorte retrospectiva que incluye pacientes trasplantados por HCC entre los años 2005-2011, en la cual el corte de AFP >200 ng/ ml identificó pacientes con mayor riesgo de recurrencia, incluso dentro de los criterios de Milán (22). Existen otros factores pre trasplante que se encuentran asociados a mayor riesgo de recurrencia como por ejemplo, la progresión post tratamiento loco regional en lista de espera (23) y el tiempo en lista (24). Las características del donante, incluyendo donante vivo y los tiempos de isquemia, aún son controvertidos en su asociación a la recurrencia post trasplante(25,26). 100 Por otro lado, si bien la estrategia de reducción de estadio o downstaging ha sido sugerida en el consenso mundial de HCC y trasplante hepático realizado en Zurich en el 2010, la selección de candidatos a esta estrategia debe ser criteriosa (27) . En primer lugar, el objetivo de reducción de estadio debe ser siempre hacia criterios de Milán y contemplar una estabilidad tumoral y de AFP en lista de espera de al menos 3 meses luego del último tratamiento. Sin embargo, no hay consenso aún en la selección de candidatos a downstaging, debido a la gran heterogeneidad en la selección de pacientes en distintas series publicadas (28). Finalmente, el estudio de variables pronósticas y asociadas a riesgo de recurrencia en el explante deben ser prioritarios en la categorización individual del riesgo (29). La invasión microvascular, el grado de des diferenciación celular, la satelitosis y la invasión perineural son variables de riesgo. En conjunto, la valoración del número y diámetro junto con la presencia o ausencia de invasión microvascular en el explante, se integran en el score de “hasta 7” o Up to 7 (30). La sobrevida dentro de estos criterios y en ausencia de invasión microvascular estima una expectativa de vida superior a 70% a 5 años y una recurrencia de 14%. Mientras que en aquellos pacientes fuera de Up to 7, la sobrevida a 5 años es inferior al 50% y menor a 25% en caso de presencia de invasión microvascular (30). Recientemente, se han intentado generar criterios de hiperselección de candidatos con mayor riesgo de recurrencia, incluyendo pacientes dentro o fuera de criterios de Milan y evaluando criterios de imágenes en combinación con la AFP pre trasplante (15,31). En Francia, luego del estudio propuesto por Duvoux y col., donde se asigna un score o puntaje de 0 a 9 puntos (con un corte de selección >2 puntos), se ha reemplazado a los criterios de Milán por el de AFP francés en los criterios de selección para trasplante hepático (31) (Figura 3). Recientemente, el modelo de selección Francés ha demostrado ser superior a los criterios de Milán en cohortes francesas, italiana (32) y latinoamericana (33). L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 1 2 3 AAEEH • 101 ASOCIACIÓN ARGENTINA PARA EL Referencias 1. Sherman M. Hepatocellular Carcinoma: Epidemiology, Surveillance, and Diagnosis. Semin Liver Dis. 2010;30:003–016. 2. Bruix J, Sherman M, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma: an update. Hepatology. 2011;53:1020–1022. 3. Sherman M. Screening for liver cancer: Another piece of the puzzle? Hepatology. 2014;59:1673–1675. 4. Liver EAFTSOT, Cancer EOFRATO. EASL–EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. Journal of Hepatology. 2012;56:908–943. 5. Mazzaferro VV, Regalia EE, Doci RR, Andreola SS, Pulvirenti AA, Bozzetti FF, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med. 1996;334:693– 699. 6. Mazzaferro V, Bhoori S, Sposito C, Bongini M, Langer M, Miceli R, et al. Milan criteria in liver transplantation for hepatocellular carcinoma: An evidence-based analysis of 15 years of experience. Liver Transpl. 2011;17:S44–S57. 7. Yao FY, Ferrell L, Bass NM, Watson JJ, Bacchetti P, Venook A, et al. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology. 2001;33:1394–1403. 8. Yao FY. Liver Transplantation for Hepatocellular Carcinoma: Beyond the Milan Criteria. American Journal of Transplantation. 2008;8:1982–1989. 9. Ito T, Takada Y, Ueda M, Haga H, Maetani Y, Oike F, et al. Expansion of selection criteria for patients with hepatocellular carcinoma in living donor liver transplantation. Liver Transpl. 2007;13:1637–1644. 10. Lee S-G, Hwang S, Moon D-B, Ahn C-S, Kim K-H, Sung K-B, et al. Expanded indication criteria of living donor liver transplantation for hepatocellular carcinoma at one large-volume center. Liver Transpl. 2008;14:935–945. 11. Xu X, Lu D, Ling Q, Wei X, Wu J, Zhou L, et al. Liver transplantation for hepatocellular carcinoma beyond the Milan criteria. Gut. 2015; 12. Herrero JI, Sangro B, Pardo F, Quiroga J, Iñarrairaegui M, Rotellar F, et al. Liver transplantation in patients with hepatocellular carcinoma across Milan criteria. Liver Transpl. 2008;14:272–278. 13. Davis E, Wiesner R, Valdecasas J, Kita Y, Rossi M, Schwartz M. Treatment of recurrent hepatocellular carcinoma after liver transplantation. Liver Transpl. 2011;17:S162–S166. 19. Lai Q, Avolio AW, Graziadei I, Otto G, Rossi M, Tisone G, et al. Alphafetoprotein and modified response evaluation criteria in solid tumors progression after locoregional therapy as predictors of hepatocellular cancer recurrence and death after transplantation. Liver Transpl. 2013;:n/a–n/a. 20. Dumitra TC, Dumitra S, Metrakos PP, Barkun JS, Chaudhury P, Deschênes M, et al. Pretransplantation α-Fetoprotein Slope and Milan Criteria. Transplantation. 2013;95:228–233. 21. Hameed B, Mehta N, Sapisochin G, Roberts JP, Yao FY. Alpha-fetoprotein level > 1000 ng/mL as an exclusion criterion for liver transplantation in patients with hepatocellular carcinoma meeting the Milan criteria. Liver Transpl. 2014;20:945–951. 22. Piñero F, Marciano S, Anders M, Orozco F, Zerega A, Cabrera CR, et al. Screening for liver cancer during transplant waiting list. Eur J Gastroenterol Hepatol. 2015;27:355–360. 23. Decaens T, Roudot-Thoraval F, Bresson-Hadni S, Meyer C, Gugenheim J, Durand F, et al. Impact of pretransplantation transarterial chemoembolization on survival and recurrence after liver transplantation for hepatocellular carcinoma. Liver Transpl. 2005;11:767–775. 24. Samoylova ML, Dodge JL, Yao FY, Roberts JP. Time to transplantation as a predictor of hepatocellular carcinoma recurrence after liver transplantation. Liver Transpl. 2014;20:937–944. 25. Vagefi PA, Dodge JL, Yao FY, Roberts JP. Potential role of the donor in hepatocellular carcinoma recurrence after liver transplantation. Liver Transpl. 2015;21:187–194. 26. Park M-S, Lee K-W, Suh S-W, You T, Choi Y, Kim H, et al. Living-Donor Liver Transplantation Associated With Higher Incidence of Hepatocellular Carcinoma Recurrence Than Deceased-Donor Liver Transplantation. Transplantation. 2014;97:71–77. 27. Yao FY, Breitenstein S, Broelsch CE, Dufour J-F, Sherman M. Does a patient qualify for liver transplantation after the down-staging of hepatocellular carcinoma? Liver Transpl. 2011;17:S109–S116. 28. Yao FY, Hirose R, LaBerge JM, Davern TJ, Bass NM, Kerlan RK, et al. A prospective study on downstaging of hepatocellular carcinoma prior to liver transplantation. Liver Transpl. 2005;11:1505–1514. 29. Parfitt JR, Marotta P, AlGhamdi M, Wall W, Khakhar A, Suskin NG, et al. Recurrent hepatocellular carcinoma after transplantation: Use of a pathological score on explanted livers to predict recurrence. Liver Transpl. 2007; 13:543–551. 14. Toso C, Cader S, Mentha-Dugerdil A, Meeberg G, Majno P, Morard I, et al. Factors predicting survival after post-transplant hepatocellular carcinoma recurrence. J Hepatobiliary Pancreat Sci. 2012;20:342–347. 30. Mazzaferro V, Llovet JM, Miceli R, Bhoori S, Schiavo M, Mariani L, et al. Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria: a retrospective, exploratory analysis. Lancet Oncology. 2009;10:35–43. 15. Toso C, Asthana S, Bigam DL, Shapiro AMJ, Kneteman NM. Reassessing selection criteria prior to liver transplantation for hepatocellular carcinoma utilizing the scientific registry of transplant recipients database. Hepatology. 2008;49:832–838. 31. Duvoux C, Thoraval FR, Decaens T, Pessione F, Badran H, Piardi T, et al. Liver Transplantation for Hepatocellular Carcinoma: A Model Including α-Fetoprotein Improves the Performance of Milan Criteria. Gastroenterology 2012; 143:986–994. 16. Berry K, Ioannou GN. Serum alpha-fetoprotein level independently predicts posttransplant survival in patients with hepatocellular carcinoma. Liver Transpl. 2013;19:634–645. 32. Notarpaolo A, Bizouard G, Gambato M, Montalti R, RoudotThoraval F, Duvoux C, et al. Prediction of recurrence after liver transplantation for HCC: validation of the AFP model in an Italian cohort. Liver Transplantation 2014; 20 (6): S133. 17. Vibert E, Azoulay D, Hoti E, Iacopinelli S, Samuel D, Salloum C, et al. Progression of Alphafetoprotein Before Liver Transplantation for Hepatocellular Carcinoma in Cirrhotic Patients: A Critical Factor. American Journal of Transplantation. 2009;10:129–137. 18. Wong LL, Naugler WE, Schwartz J, Scott DL, Bhattacharya R, Reyes J, et al. Impact of locoregional therapy and alpha-fetoprotein on outcomes in transplantation for liver cancer: a UNOS Region 6 pooled analysis. Clin Transplant. 2012;27:E72–E79. 102 33. F Piñero, E C de Ataide, S Marciano, M Anders, A Zerega, JC Diaz, C Rondon, JM Menéndez, R Zapata, L Muñoz, M Maraschio, M Tisi Baña, Y L Boeton, R Mastai, N Jarufe, MP Machaca, E de Santibañes, A Soza, L McCormack, J Poniachik, A Gadano, IF Boin, C Duvoux, M Silva. “Trasplante hepático y hepatocarcinoma: evaluación del modelo de selección francés en una cohorte multicéntrica latino americana”. XVIII Congreso Argentino de Hepatología, 2015. Oral #16. Acta Gastroenterológica latinoamericana 2015; vol 45 (1): S10. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Tratamientos Adyuvantes, Downstaging Dres Omar Galdame, Margarita Anders, Fernando Cairo Introducción El trasplante hepático es el tratamiento de elección para pacientes con hepatocarcinoma (HCC) irresecable sobre hígado cirrótico ya que permite curar el tumor y la enfermedad subyacente. La indicación estándar de trasplante es para aquellos pacientes que cumplen con los llamados criterios de Milán (CM), esto significa un sólo nódulo ≤ 5 cm o hasta tres nódulos ≤ 3cm. Sin embargo, una vez en lista de espera los pacientes pueden presentar crecimiento tumoral y por lo tanto salir de lista por progresión intra o extrahepática. Está demostrado que en los pacientes en lista de espera con HCC dentro de CM existe un riesgo aumentado de progresión de la enfermedad cuando el tiempo en lista de espera es mayor a 6-12 meses (1,2). Por lo tanto, los tratamientos puente (adyuvantes) están recomendados en los pacientes con HCC estadío T2 en quienes la expectativa de tiempo en lista es mayor a 6 meses (3-5). Los pacientes con HCC dentro de los CM ingresan en lista de espera con una prioridad dada por vía de excepción (MELD 22 puntos, incrementándose un punto cada tres meses). A pesar de ello los tiempos en lista de espera pueden ser prolongados. En nuestro país, analizando 60 pacientes trasplantados entre el 27/04/14 y el 27/04/15 la mediana de tiempo en lista de espera al trasplante global fue de 190 días, para el grupo sanguíneo “0” de 453 días, para el grupo “B” de 163 días, para grupo “A” de 119,5 días y para el grupo “AB”, de 75 días (6). Existen varios tratamientos propuestos como puente al trasplante en pacientes con HCC, siendo los principales quimioembolización, radiofrecuencia y resección quirúrgica. El objetivo de estas terapias es evitar la salida de lista de espera, evitar la recurrencia tumoral y mejorar la sobrevida global post trasplante. La tasa de salida de lista al año sin tratamiento puente es del 30%, lográndose un significativo descenso de la misma (3-9.3%) en los pacientes tratados (7-12). Asimismo, la respuesta a dichos tratamientos es un marcador subrogante del comportamiento biológico del tumor. En aquellos pacientes con niveles altos de alfafetoproteína (AFP), el descenso del marcador con los tratamientos locoregionales se asoció a mejores resultados post trasplante (13-17). Los tratamientos locoregionales no solo son útiles como puente al trasplante en paciente dentro de los CM, sino que se utilizan también para el downstaging de pacientes con tumores más avanzados, para disminuir el tamaño tumoral, intentando lograr que los pacientes cumplan con los CM. El objetivo sería poder ofrecer al paciente un tratamiento curativo (trasplante o cirugía) con un bajo índice de recurrencia. Existen distintos criterios mediante los que se evalúa la respuesta a estos tratamientos. Entre ellos: el ingreso dentro de los CM o de UCSF, el descenso de los niveles de AFP, la disminución del tamaño tumoral entre un 30-50%, la no progresión y la respuesta según mRECIST (18-27). Los estudios por imágenes (tomografíaresonancia) suelen sobreestimar la respuesta al tratamiento, con una concordancia entre 5083%. La recomendación actual es la evaluación mediante los criterios mRECIST (28-32). Estudios recientes han demostrado que la sobrevida a cinco años post trasplante de estos pacientes es similar a la de aquellos que se trasplantan dentro de los CM. Por otro lado la respuesta al tratamiento es un predictor de la evolución post trasplante por lo que algunos autores sugieren esperar 3 meses antes de darles puntos adicionales para trasplante; AAEEH • 103 ASOCIACIÓN ARGENTINA PARA EL con el objetivo de identificar pacientes con mayor riesgo de recurrencia. En un reciente estudio multicéntrico latinoamericano, se realizó downstaging, con diferentes tratamientos locoregionales en 40 pacientes, siendo efectivo en el 35% de los mismos (n=14) (18, 20, 24, 33-40). enfermedad hepática. La tasa de necrosis completa del tumor en pacientes dentro de CM varía entre el 27-57% (50,51). A pesar de la instrumentación de la arteria hepática, no se ha demostrado mayor incidencia de trombosis de la arteria en pacientes sometidos a QETA pre trasplante (9,52,53). No se ha podido demostrar diferencias en términos de respuesta con la QETA convencional versus el uso de micro-esferas cargadas con doxorrubicina. Ambos procedimientos han demostrado ser efectivos, siendo el último mejor tolerado (54,55). Tipos de Tratamiento Adyuvantes/Downstaging Resección quirúrgica (RQ) Ablación por radiofrecuencia (AR) En los pacientes sin contraindicaciones para la cirugía, la RQ es superior a la quimioembolización transarterial (QETA) y a las técnicas de ablación percutánea. Dicha superioridad radica por un lado en un mayor control del crecimiento tumoral ya que las otras técnicas no siempre logran una necrosis completa. La otra ventaja de la cirugía es la posibilidad del análisis histopatológico que permite identificar factores de mal pronóstico como la estirpe indiferenciada, la satelitosis, la invasión microvascular y la efracción capsular. Los pacientes con marcadores histológicos de mal pronóstico serían candidatos a evaluarse para trasplante en forma rápida (41). Las desventajas de la resección quirúrgica son un mayor costo, mayor riesgo peri procedimiento, la baja aplicabilidad (solo pacientes compensados y sin hipertensión portal) y la posibilidad de generar dificultades técnicas para el trasplante (42). Es un procedimiento relativamente seguro en pacientes en lista de espera para trasplante. Ocasionalmente se han reportado casos de siembra tumoral en el trayecto de la aguja con la consiguiente recaída post trasplante (56). El tratamiento quirúrgico se prefiere en pacientes con buena reserva funcional, con tumores únicos subcapsulares o exofíticos, ubicados prefentemente en el lóbulo izquierdo (43,44). La resección quirúrgica permite diferir el trasplante hasta el momento de la eventual recurrencia. Los resultados del trasplante de rescate son comparables a los de los pacientes trasplantados dentro de los CM (45-48). Al momento de la recurrencia, el 80% de los pacientes operados son candidatos a trasplante (49). Quimioembolización transarterial (QETA) Se prefieren los procedimientos superselectivos para minimizar el riesgo de descompensación de la 104 En cuanto a los resultados, la necrosis completa varía de acuerdo al tamaño del tumor, siendo entre 50-78% en aquellos < 3 cm, y entre 13-43 % en los de mayor tamaño (10,11,29,30,57). Otros procedimientos - Ablación percutánea con laser: Es otra forma de ablación térmica con resultados comparables a la AR y es una buena alternativa en pacientes con coagulopatía. Al igual que la AR está recomendada en tumores < 3 cm, alejados de estructuras vasculares, vía biliar, vesícula e intestino, que no sean superficiales (60,61). - Ablación por microondas: Es otra forma de ablación térmica que demostró ser superior a la AR en tumores > 3 cm y que tiene la ventaja de poder utilizarse en tumores adyacentes a grandes vasos (62-64). - Radioembolización con microesferas: Es una alternativa a la QETA que ha demostrado muy buenos resultados. Ha demostrado ser superior en términos de tasa de downstaging y sobrevida a 3 años (65-67). La tasa de necrosis completa depende del tamaño tumoral: 89%, 65% y 33% en tumores L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 menores a 3cm, entre 3-5cm y mayores a 5cm, respectivamente (68). Tratamientos combinados Es una estrategia para aumentar la tasa de necrosis, especialmente en tumores mayores a 3cm. Los procedimientos que con más frecuencia se combinan son la QETA y la AR. Existe controversia acerca de la secuencia en la aplicación del tratamiento. La QETA podría disminuir el efecto de pérdida de calor y de esta manera aumentar la eficacia de la AR. Por otro lado, la AR genera un halo hiperémico alrededor de la lesión pudiendo de esta manera aumentar la eficacia de la QETA (12,69-72) . Aspectos controvertidos de los tratamientos adyuvantes/downstaging • La utilización de la respuesta al tratamiento para priorizar los pacientes en lista de espera. • Secuencia de los tratamientos combinados. • Tiempo de espera entre el tratamiento puente y el trasplante. • La elección del mejor tratamiento puente o de downstaging • Superioridad de la QETA con microesferas versus la QETA convencional. • Cirugía versus downstaging trasplante después del • La indicación de las nuevas técnicas como ablación con laser, ablación con microondas y radioembolización. Conclusiones • Los tratamientos puente para pacientes con HCC dentro de CM en lista de espera para trasplante hepático, son una herramienta útil para disminuir la tasa de salida de lista, disminuir la tasa de recurrencia y aumentar la sobrevida del paciente. • Se recomiendan en aquellos pacientes con HCC estadío T2 candidatos a trasplante con una expectativa de tiempo en lista mayor a 6 meses. • La respuesta a los tratamientos puente es un marcador subrogante de la agresividad biológica del tumor. • Los tratamientos indicados a pacientes con HCC avanzado pueden lograr un downstaging hacia los criterios de Milán. • Los pacientes que logran el downstaging tienen una sobrevida a cinco años comparable a aquellos que se trasplantan dentro de los criterios de Milán. • Se recomienda un compás de espera de 3 meses luego del tratamiento neo-adyuvante para incluirlos en lista de espera con puntaje adicional. • La RQ es el tratamiento de elección en pacientes con buena reserva funcional, con tumores únicos sub-capsulares o exofíticos, ubicados preferentemente en el lóbulo izquierdo. El pronóstico del trasplante de rescate es comparable con el del trasplante primario. • El trasplante de salvataje debe ser considerado una buena alternativa en los pacientes que recurren luego de la resección quirúrgica. • Entre los tratamientos no quirúrgicos no existe evidencia para recomendar uno sobre otro. Sin embargo, se podría considerar a la AR como el tratamiento de elección en tumores menores a 3 cm, no superficiales, alejados de la vía biliar principal o de estructuras vasculares. La ablación con alcohol es menos efectiva pero podría reservarse para pacientes con tumores menores a 3 cm con contraindicación de AR. La QETA sería el tratamiento de elección para tumores mayores a 3 cm bien vascularizados. • Los tratamientos combinados son una opción terapéutica prometedora en tumores mayores a 3 cm. • La respuesta a los tratamientos neo-adyuvantes debería ser evaluada según los criterios mRECIST. AAEEH • 105 ASOCIACIÓN ARGENTINA PARA EL Referencias 1. Llovet JM, Fuster J, Bruix J. Intention-to-treat analysis of surgical treatment for early hepatocellular carcinoma: resection versus transplantation. Hepatology 1999;30:1434-1440. 2. Yao FY, Bass NM, Nikolai B, et al. Liver transplantation for hepatocellular carcinoma: analysis of survival according to the intention-to-treat principle and dropout from the waiting list. Liver Transpl 2002;8:873883. 3. Bruix J, Sherman SL: Management of hepatocellular carcinoma: an update. Hepatology 2011;53:1020-1022. 4. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2012;56:908-943. 5. Clavien PA, Lesurtel M, Bossuyt PM, et al. Recomendations for liver transplantation for hepatocellular carcinoma: an international consensus conference report. Lancet Oncol 2012;13: e11-e22. 6. http://sintra.incucai.gov.ar/. [Online] [Cited: abril 29, 2015.] 7. Millonig G, Graziadei IW, Freund MC, et al. Response to preoperative chemoembolization correlates with outcome after liver transplantation in patients with hepatocellular carcinoma. Liver Transpl 2007;13:272279. 8. Alba E, Valls C, Dominguez J, et al.Transcatheter arterial chemoembolization in patients with hepatocellular carcinoma on the waiting list for orthotopic liver transplantation. Am J Roentgenol 2008;190:1341-1348. 9. Majno P, Giostra E, Mentha G. Management of hepatocellular carcinoma on the waiting list before liver transplantation: time for controlled trials? Liver Transpl 2007;13: S27-S35. 10. Mazzaferro V, Battiston C, Perrone S, et al. Radiofrequency ablation of small hepatocellular carcinoma in cirrhotic patients awaiting liver transplantation: a prospective study. Ann Surg 2004;240:900-909. 11. Lu DS, Yu NC, Raman SS, et al Percutaneous radiofrequency ablation of hepatocellular carcinoma as a bridge to liver transplantation. Hepatology 2005;41:1130-1137. 12. Ashoori N, Bamberg F, Paprottka P, et al. Multimodalitiy treatment for early-stage hepatocellular carcinoma: a bridging therapy for liver transplantation. Digestion 2012;86:338-348. 13. Vitale A, D´Amico F, Frigo AC, et al. Response to therapy as a criterion for awarding priority to patients with hepatocellular carcinoma awaiting liver transplantation. Ann Surg Oncol, 2010;17: 2290-2302. 14. Cucchetti A, Cescon M, Bigonzi E, et al. Priority of candidates with hepatocellular carcinoma awaiting liver transplantation can be reduced after successful bridge therapy. Liver Transpl 2011;17: 1344-1351. 15. De Giorgio M, Vezzoli S, Cohen E, et al. Prediction of progression-free survival in patients presenting with hepatocellular carcinoma within the Milan criteria. Liver Transpl 2010;16: 503-512. 16. Lai Q, Avolio AW, Graziadei I, et al. Alfa fetoprotein and modified response evaluation criteria in solid tumors progression after locoregional therapy as predictors of hepatocellular cancer recurrence and death after transplantation. Liver Transpl 2013;19: 1108-1118. 17. Merani S, Majno P, Kneteman NM, et al. The impact of waiting list alfa fetoprotein changes on the outcome of liver transplant for hepatocellular carcinoma. J Hepatol 2011;55: 814-819. 18. Mazzaferro V, Llovet JM, Miceli R, et al. Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria: a retrospective exploratory analysis. Lancet Oncol 2009;10: 35-43. 19. Graziadei IW, Sandmueller H, Waldenberger P, et al. Chemoembolization followed by liver transplantation for hepatocellular carcinoma impedes tumor progression while on the waiting list and leads to excellent outcome. Liver Transpl 2003;9: 557-563. 20. Yao FY, Ker Ian RK, Hirose R, et al. Excellent outcome following downstaging of hepatocellular carcinoma prior to liver transplantation: an intention-to-treat analysis. Hepatology 2008; 48: 819-827. 21. De Luna W, Sze DY, Ahmed A, et al. Transarterial chemoinfusion for hepatocellular carcinoma as downstaging therapy and a bridge toward liver transplantation. Am J Transpl 2009;9: 1158-1168. 22. Bova V, Miraglia R, Maruzzelli L, et al. Predictive factors of downstaging of hepatocellular carcinoma beyond the Milan criteria treated with intraarterial therapies. Cardiovasc Intervent Radiol 2013;36: 433-436. 23. Lei J, Wang W, Yan L. Downstaging advanced hepatocellular carcinoma to the milan criteria may provide a comparable outcome to conventional Milan criteria. J Gastrointest Surg 2013;17: 1440-1446. 24. Ravaioli M, Grazi GL, Piscaglia F. Liver transplantation for hepatocellular carcinoma: results of down-staging in patients initially outside the Milan selection criteria. Am J Transplant 2008;8: 2547-2557 106 25. Otto G, Herber S, Heise M, et al. Response to transarterial chemoembolization as a biological selection criterion for liver transplantation in hepatocellular carcinoma. Liver Transpl 2006;12: 12601267. 26. Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis 2010;30:52-60. 27. Gordon-Weeks AN, Sanith A, Petrinic T, et al. Systematic review of outcome of downstaging hepatocellular cancer before liver transplantation in patients outside the Milan criteria Br J Surg 2011;98:1201-8. 28. Llovet JM, Di Bisceglie AM, Bruix J, et al. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Inst 2008;100: 698-711. 29. Pompili M, Mirante VG, Rondinara G, et al. Percutaneous ablation procedures in cirrhotic patients with hepatocellular carcinoma submitted to liver transplantation: Assessment of efficacy at explant analysis and of safety for tumor recurrence. Liver Transpl 2005;11: 1117-1126. 30. Rodríguez-Sanjuán JC, González F, Juanco C, et al. Radiological and pathological assessment of hepatocellular carcinoma response to radiofrequency. A study on removed liver after transplantation. World J Surg 2008;32: 1489-1494. 31. Kim YS, Rhim H, Lim HK, et al. Completeness of treatment in hepatocellular carcinomas treated with image-guided tumor therapies: Evaluation of positive predictive value of contrast-enhanced CT with histopathologic correlation in the explanted liver specimen. J Comput Assist Tomogr 2006;30: 578-582. 32. Bargellini I, Bozzi E, Campanli D, et al. Modified RECIST to assess tumor response after transarterial chemoembolization of hepatocellular carcinoma: CT-pathologic correlation in 178 liver explants. Eur J Radiol 2013;82: e212-e218. 33. Silva MF, Sherman M. Criteria for liver transplantation for HCC: what should the limits be? J Hepatol 2011;55: 1137-1147. 34. Yao FY, Ferrell L, Bass NM, et al. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limit does not adversely impact survival. Hepatology 2001;33: 1394-1403. 35. Toso C, Mentha G, Kneteman NM, et al. The place of downstaging for hepatocellular carcinoma. J Hepatol 2010;52: 930-936. 36. Cillo U, Vitale A, Grigoletto F, et al. Intention-to-treat analysis of liver transplantation in selected, aggressively treated HCC patients exceeding the Milan criteria. Am J Transplant, 2007;7: 972-981. 37. Chapman WC, Majella Doyle MB, Stuart JE, et al. Outcomes of neoadjuvant transarterial chemoembolization to downstage hepatocellular carcinoma before liver transplantation. Ann Surg 2008;248: 617-625. 38. Bova V, Miraglia R, Maruzzelli L, et al. Predictive factors of downstaging of hepatocellular carcinoma beyon the Milan Criteria treated with intraarterial therapies. Cardiovasc Intervent Radiol 2013;36: 433-439. 39. Yao FY, Mehta N, Flemming J, et al. Downstaging of hepatocellular cancer before liver transplant: long-term outcome compared to tumors within Milan criteria. Hepatology 2015;61: 1968-1977. 40. Piñero F, Andriani O, de Ataide EC, et al. Liver Transplantation for Hepatocellular carcinoma: results of a first multicenter latin-american cohort. Oral Abstract presentation : July 8- 11, 2015, Chicago, ILTS 21st International Congress. 41. Sala M, Fuster J, Llovet JM, et al. Liver cancer staging and transplant survival benefit for patients with hepatocellular carcinoma: a multicentre cohort study. Lancet Oncol 2011;12: 654-662. 42. Earl TM, Chapman WC. Hepatocellular carcinoma: resection versus transplantation. Semin Liver Dis 2013;33: 282-292. 43. Lei JY, Yan LN, Wang WT. Transplantation vs resection for hepatocellular carcinoma with compensated liver function after downstaging therapy. World J Gastroenterol 2013;19: 4400-4408. 44. Lee KK, Kim DG, Moon IS, et al. Liver transplantation versus liver resection for the treatment of hepatocellular carcinoma. J Surg Oncol, 2010;101: 47-53. 45. Del Gaudio M, Ercolani G, Ravaioli M, et al. Liver transplantation for recurrent hepatocellular carcinoma on cirrhosis after liver resection: University of Bologna experience. Am J Transplant, 2008;8: 1177-1185. 46. Belghiti J, Cortes A, Abdalla EK, et al. Resection prior to liver transplantation for hepatocellular carcinoma..Ann Surg 2003; 238: 885892. 47. Facciuto ME, Koneru B, Rocca JP, et al. Surgical treatment of heatocellular carcinoma beyond Milan criteria. Results of liver resection, salvage transplantation, and primary liver transplantation. Ann Surg Oncol 2008;15: 1383-1391. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 48. Liu F, Wei Y, Wang W, et al. Salvage liver transplantation for recurrent hepatocellular carcinoma within UCSF criteria after liver resection. PloS One, 2012;7: e48932. 49. Poon RT, Fan ST, Lo CM, et al Long-term survival and pattern of recurrence after resection of small hepatocellular carcinoma in patients with preserved liver function: implications for a strategy of salvage transplantation. Ann Surg 2002; 235: 373-382. 50. Majno PE, Adam R, Bismuth H, et al. Influence of preoperative transarterial lipiodol chemoembolization on resection and transplantation for hepatocellular carcinoma in patients with cirrhosis. Ann Surg, 1997;226: 688-701. 51. Tsochatzis E, Garcovich M, Marelli L, et al. Transarterial embolization as neo-adjuvant therapy pretransplantation in patients with hepatocellular carcinoma.. Liver Int 2013;33: 944-949. 52. Richard HM, Silberzweig JE, Mitty HA, et al. Hepatic arterial complications in liver transplant recipients treated with pretransplantation chemoembolization for hepatocellular carcinoma..Radiology, 2000;214: 775-779. 53. Pérez Saborido B, Meneu JC, Moreno E, et al. Is transarterial chemoembolization necessary before liver transplantation for hepatocellular carcinoma? Am J Surg, 2005;190: 383-387. 54. Orlacchio A, Chegai F, Merolla S, et al. Downstaging disease in patients with hepatocellular carcinoma ouside up-to-seven criteria: Strategies using degradable starch mirospheres transcatheter arterial chemoembolization. World J Hepatol, 2015;7: 1694-1700. 55. Green TJ, Rochon PJ, Chang S,et al. Downstaging disease in patients with hepatocellular carcinoma outside Milan criteria: strategies using drug eluting bead chemoembolization. J Vas IntervRadiol, 2013;24:16131622. 56. Lopez KT, Kuwada SK, Wong LL. Consequences of needle tract seeding of hepatocellular cancer after liver transplant. Clin Transplant 2013;27:E400-E406. 57. Brillet PY, Paradis V, Brancatelli G, et al. Percutaneous radiofrequency ablation for hepatocellular carcinoma before liver transplantation: a prospective study with histopathologic comparison. Am j Roetgenol, 2006;186: S296- S305. 58. Castroagudín JF, Delgado M, Villanueva A, et al. Safety of percutaneous ethanol injection as neoadjuvant therapy for hepatocellular carcinoma in waiting list liver candidates. Trasplant Proc, 2005;37: 3871-3873. 59. Branco F, Brú C, Vilana R, et al Percutaneous ethanol injection before liver transplantation in the hepatocellular carcinoma. Ann Hepatol, 2009; 8: 220-227. 60. Pompili M, Pacella CM, Francica G, et al. Percutaneous laser ablation of hepatocellular carcinoma in patients with liver cirrhosis awaiting liver transplantation. Eur J Radiol, 2010;74: e6-e11. 61. Francica G, Petro1lati A, Di Stasio E, et al Effectiveness, safety, and local progression after percutaneous laser ablation for hepatocellular carcinoma nodules up to 4 cm are not affected by tumor location.. Am J Roentgenol, 2012;199: 1393-1401. 62. Lu MD, Xu HX, Xie XY, et al. Percutaneous microwave and radiofrequency ablation for hepatocellular carcinoma: a retrospective comparative study. J Gastroenterol, 2005;40:1054-1060. 63. Boutros C, Somasundar P, Garrean S, et al.. Microwave coagulation therapy for hepatic tumors: review of the literature and critical analysis. Surg Oncol, 2010;19: e22-e32. 64. Zanus G, Boetto R, Gringer IE, et al Microwave thermal ablation for hepatocarcinoma: six liver transplantation cases..Transpl Proc 2011;43: 1091-1094. 65. Lewandowski RJ, Kulik LM, Riaz A, et al. A comparative analysis of transarterial downstaging for hepatocellular carcinoma: chemoembolization versus radioembolization. Am J Transplant, 2009;9: 1920-1928. 66. Mosconi C, Cappelli A, Pettinato C, et al. Radioembolization with Yttrium90 microspheres in hepatocellular carcinoma: role and perspectives. World J Hepatol, 2015;7: 738-752. 67. Iñarrairaegui M, Pardo F, Bilbao JI, et al Response to radioembolization with Ytrium-90 resin microspheres may allow surgical treatment with curative intent and prolonged survival in previouly unresectable hepatocellular carcinoma. Eur J Surg Oncol, 2012;38: e594-e601. 68. Riaz A, Kulik L, Lewandowski RJ, et al. Radiologic-pathologic correlation of hepatocellular carcinoma treated with internal radiation using yttrium90 microspheres. Hepatology 2009;49:1185-1193. 69. Rossi S, Garbagnati F, Lencioni R, et al. Percutaneous radio-frequency thermal ablation of nonresectable hepatocellular carcinoma after occlusion of tumor blood supply. Radiology, 2000;217: 119-126. 70. Veltri A, Moretto P, Doriguzzi A, et al. Radiofrequency thermal ablation (RFA) after transarterial chemoembolization (TACE) as a combined therapy for unresectable non- early hepatocellular carcinoma (HCC). Eur Radiol 2006;16: 661-669. 71. Ashoori N, Paprottka P, Trumm C, et al Multimodality treatment with conventional transcatheter arterial chemoembolization and radiofrequency ablation for unresectable hepatocellular carcinoma. Digestion 2012; 85:18-26. 72. Iezzi R, Cesario V, Siciliani L, et al. Single-step multimodal locoregional treatment for unresectable hepatocellular carcinoma: ballonoccluded percutaneous radiofrequency thermal ablation (BO-RFA) plus transcatheter arterial chemoembolization (TACE) . Radiol Med, 2013;118: 555-569. 73. Mailey B, Artinyan A, Khalili J, et al. Evaluation of absolute serum alfa fetoprotein levels in liver transplant for hepatocellular cancer. Arch Surg, 2011;146:26-33. 1 AAEEH • 107 ASOCIACIÓN ARGENTINA PARA EL 2 108 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Resección Versus Trasplante Dres Adrián Gadano, Gabriel Aballay, Federico Orozco Ganem La historia natural del HCC libre de tratamiento ofrece una supervivencia a 5 años del 1-3%. La supervivencia global del HCC resecado quirúrgicamente es del 31-66%, con resultados por encima del 60% de sobrevida en tumores en estadios iniciales (1-4). Numerosas terapias, tanto quirúrgicas como no quirúrgicas han sido descriptas para tratar el HCC. Dentro de ellas, la resección quirúrgica, el trasplante hepático y diversas técnicas ablativas han demostrado tener un potencial curativo sobre esta enfermedad, siempre y cuando la enfermedad se encuentre limitada al hígado y cumpla con determinadas condiciones. La resección quirúrgica y el trasplante hepático han sido las únicas técnicas que han demostrado mejores resultados en términos de sobrevida en pacientes bien seleccionados (5-7). La elección del tratamiento no solo va a estar determinada por las características del tumor (número, tamaño y localización de las lesiones) sino que también, dependerá de la enfermedad hepática subyacente y del grado de compromiso de la funcionalidad hepática y del estado general del paciente. En aquellos pacientes con estadios iniciales y mala reserva funcional hepática, el tratamiento ideal es el trasplante hepático, ya que con el mismo se logra una resección tumoral completa, se elimina la hipertensión portal, se restaura la funcionalidad hepática y se evita la formación de “novo” de HCC (carcinogénesis multicéntrica). Esto es así debido a que al reemplazar el hígado en su totalidad se está eliminando el factor predisponente, que es la cirrosis (8). Resección hepática segmentaria: La resección hepática para el tratamiento del HCC sigue siendo el tratamiento de elección en pacientes no cirróticos y en aquellos pacientes cirróticos que todavía poseen una adecuada reserva funcional (Child-Pugh A). Aquellos pacientes portadores de una cirrosis avanzada (Child-Pugh B y C) tienen una elevada mortalidad postoperatoria cuando son sometidos a tratamientos resectivos y por lo tanto, la resección quirúrgica de dichas lesiones, lleva inherente una elevada morbilidad y mortalidad (9-12). De todas maneras, es fundamental remarcar que la estrategia terapéutica sobre estos pacientes debe surgir de discusiones multidisciplinarias donde participen cirujanos, anestesistas, hepatólogos, oncólogos, imagenólogos e intervencionistas. Esta discusión deberá considerar que los pacientes con HCC no solo tienen una enfermedad oncológica sino que también, padecen una enfermedad hepática subyacente que de cierta manera limita las opciones terapéuticas(13,16). La selección del candidato ideal para la resección depende de la evaluación cuidadosa del tamaño del tumor, presencia de lesiones satélites y compromiso vascular mediante TC o RM. La función hepática preoperatoria puede ser evaluada a través de los scores de Child-Pugh y MELD o la medición de la tasa de retención de verde de indocianina. El grado de hipertensión portal puede evaluarse en forma directa con la medición del gradiente de presión venosa hepática (GPVH, deseable <10 mmHg), o indirectamente a través del recuento de plaquetas (deseable >100.000/μL). Los pacientes que evidencian várices esofágicas por endoscopia, tratamiento con diuréticos para control de la ascitis y altos niveles de bilirrubina no deben ser considerados para resección. El verde de indocianina no es realizado como práctica habitual en nuestro país, mientras que el GPVH solo es evaluado en centros especializados y no es de práctica clínica habitual (17-24). Estudios recientes demuestran que el FibroScan ® podría aportar datos de valor en la evaluación preoperatoria y en el pronóstico de estos pacientes (25-32). Debido a las mejorías en los métodos diagnósticos, el desarrollo de nuevas técnicas quirúrgicas, el mejor manejo anestésico y de las complicaciones AAEEH • 109 ASOCIACIÓN ARGENTINA PARA EL postoperatorias, se ha reducido sustancialmente la morbididad y la mortalidad postoperatoria asociada a la resección hepática para el tratamiento del HCC. A pesar que los pacientes cirróticos sometidos a resecciones hepáticas por HCC presentan mayor índice de complicaciones postoperatorias, cuando se los compara con pacientes no cirróticos, la mortalidad y la sobrevida a largo plazo son similares en ambos grupos (9-18, 20-24, 41) . La presencia de enfermedad metástasis extrahepática, una insuficiente reserva funcional hepática (pacientes Child-Pugh B y C), y el compromiso de la vena porta principal por parte del tumor, son contraindicaciones que limitan las posibilidades de ofrecer un tratamiento con intención curativa. La resección quirúrgica de pacientes con tumores multicéntricos y/o tumores centrales son un verdadero desafío quirúrgico que suele comprometer el éxito de una cirugía realizada con criterio oncológico (19,22,33-36). Recomendaciones de resección 1. Tumor solitario, función hepática conservada, (considerar tamaño del tumor, lesiones satélites y compromiso vascular (Clase 2a, Nivel B). 2. Pacientes con hipertensión portal clínica (varices esofágicas, uso de diuréticos por ascitis y altos niveles de bilirrubinemia) no deben someterse a resección (Clase 2a, Nivel B). Trasplante Hepático: Los pacientes con HCC tempranos portadores de una cirrosis descompensada (Child-Pugh B/C) son los candidatos ideales para el trasplante hepático, representando para ellos la única opción curativa. En aquellos pacientes no cirróticos o que presentan una cirrosis compensada (Child-Pugh A), el trasplante hepático debe ser indicado solo cuando la hepatectomía parcial no es factible debido al compromiso difuso de la glándula hepática (1-5). El beneficio adicional del trasplante hepático por sobre la hepatectomía segmentaria se basa en 110 que a través de la hepatectomía total se remplaza el hígado cirrótico por otro sano, eliminando el principal factor que predispuso a su enfermedad neoplásica y disminuyendo así también la posibilidad de recurrencia. Sin embargo, el trasplante hepático presenta ciertas desventajas. Debido a la escasez de órganos, muchos pacientes con diagnóstico de HCC pueden presentar progresión tumoral y muerte durante prolongados tiempos de espera en la lista nacional, a la espera de un donante cadavérico adecuado (5-8). Esta situación, conlleva a que en aquellos pacientes con indicación multidisciplinaria de trasplante hepático, en los que se estima que permanecerán en lista de espera por más de 6 meses, estaría indicado realizar un tratamiento puente. Dicho tratamiento de puente se podrá realizar por medio de una quimioembolización asociada o no a una ablación por radiofrecuencia, o incluso realizando una hepatectomía segmentaria en candidatos sin hipertensión portal severa (19,20,34-38). Esta estrategia permitiría evitar la progresión tumoral que contraindicaría el trasplante y obligaría al grupo tratante a retirar el paciente de la lista de espera de órganos. En relación a cual es la mejor estrategia de puente para aquellos pacientes incluidos en lista de espera, todavía no hay consenso sobre cual es la mejor opción y estamos a la espera de estudios prospectivos randomizados para estandarizar la mejor terapéutica. Es importante remarcar que los pacientes con diagnostico de HCC que más se ven beneficiados con el trasplante hepático en términos de sobrevida (60-80% a 5 años) son aquellos que cumplen con los ya conocidos criterios de Milán (un nódulo solitario < 5 cm; o hasta tres tumores, todos < 3 cm) y que no presenten invasión vascular o enfermedad extra-hepática, ambas contraindicaciones absolutas para el trasplante. Incluso, se sabe que estos pacientes con tumores pequeños, que se encuentran dentro de los criterios de Milán, tienen una sobrevida similar a aquellos pacientes que se trasplantan por presentar una enfermedad hepática terminal en ausencia de HCC. Aquellos pacientes que exceden los criterios de Milán por lo contrario, presentan una menor sobrevida posterior al trasplante, que se asocia al número y tamaño de las lesiones que se halla en el estudio de la pieza operatoria y a la presencia L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 de invasión micro-vascular por parte del HCC (1575% a 5 años). Al sobrepasar los criterios de Milán, la tasa de supervivencia a cinco años puede bajar a 46-60% (8,39,40). Una versión expandida de los criterios de Milán fue probada por la Universidad de California, San Francisco, en pacientes con un tumor solitario ≤ 6.5 cm, o tres o más nódulos con lesión ≤ 4.5 cm y un diámetro total del tumor ≤ 8 cm. Las tasas de supervivencia que se presentaron fueron de 90 y 75.2% al primer año y a los cinco años, respectivamente, en comparación con 50% de supervivencia a un año en los pacientes con tumores que superaron estos límites (37). Aquellos pacientes que presentan tumores grandes pueden ser sometidos a quimioembolización arterial con el fin de reducir el tamaño tumoral y de esta manera cumplir con los criterios morfológicos y así ser candidatos nuevamente para el trasplante hepático (estrategia de down-staging) (37,38). De acuerdo con un metaanálisis, el retroceso tumoral del HCC previo al trasplante hepático fuera de los criterios de Milán mejoraría las tasas de supervivencia a 1, 3 y 5 años, que pasan a ser de 80 a 100%, de 79 a 100% y de 55 a 94%, comparables a las de los pacientes con criterios de Milán (42). Aunque el retroceso tumoral es prometedor, su aplicación clínica debe considerarse con cuidado debido a las importantes limitaciones metodológicas de los estudios tomados como referencia. Sería necesario esperar nuevos estudios prospectivos y eventualmente considerar para trasplante aquellos pacientes que luego de una o más sesiones de quimioembolización hepática permanecieran estables de enfermedad (durante al menos 3 meses) o con respuesta al tratamiento por criterios imaginológicos de m-RECIST (43). Las eventuales ventajas del trasplante hepático en pacientes con nódulos que son considerados candidatos a resección no ha sido evaluada en estudios prospectivos randomizados. Es de destacar que si este beneficio no está establecido, el trasplante no debiera ser llevado a cabo en buenos candidatos a resección ya que debido a la escasez de donantes podría perjudicar a otros pacientes en quienes el trasplante es la única alternativa terapéutica. Recomendaciones de trasplante hepático 1. Pacientes que no son candidatos a resección y cumplen con los criterios de Milán (tumor único de ≤ 5 cm o tres o más nódulos de ≤ 3 cm) (Clase 1, Nivel A). 2. No es recomendable el trasplante en aquellos pacientes que exceden los criterios de Milán a la espera de una mayor evidencia prospectiva sobre sus beneficios; no se recomienda el trasplante hepático en pacientes que cumplen con criterios expandidos sin haber sido sometidos a un régimen de down-staging de manera que sean situados dentro de los criterios de Milán (Evidencia: Clase 2a, Nivel B). Referencias 1. Bruix J, Sherman M. Management of hepatocellular carcinoma: an update. Hepatology. 2011 Mar;53(3):1020-2. 2. Bruix J, Reig M, Rimola J, Forner A, Burrel M, Vilana R, et al. Clinical decision making and research in hepatocellular carcinoma: pivotal role of imaging techniques. Hepatology. 2011 Dec;54(6):2238-44. 3. Clavien PA, Lesurtel M, Bossuyt PM, Gores GJ, Langer B, Perrier A. Recommendations for liver transplantation for hepatocellular carcinoma: an international consensus conference report. Lancet Oncol. 2012 Jan;13(1):e11-22. 4. De Lope CR, Tremosini S, Forner A, Reig M, Bruix J. Management of HCC. J Hepatol. 2012;56 Suppl 1:S75-87. 5. Gish RG, Lencioni R, Di Bisceglie AM, Raoul JL, Mazzaferro V. Role of the multidisciplinary team in the diagnosis and treatment of hepatocellular carcinoma. Expert Rev Gastroenterol Hepatol. 2012 Apr;6(2):173-85. 6. Majno P, Lencioni R, Mornex F, Girard N, Poon RT, Cherqui D. Is the treatment of hepatocellular carcinoma on the waiting list necessary? Liver Transpl. 2011 Oct;17 Suppl 2:S98-108. 7. McCormack L, Gadano A, Lendoire J, Quinonez E, Imventarza O, Andriani O, et al. Model for end-stage liver disease exceptions committee activity in Argentina: does it provide justice and equity among adult patients waiting for a liver transplant? HPB (Oxford). 2010 Oct;12(8):531-7. 8. Mazzaferro V, Chun YS, Poon RT, Schwartz ME, Yao FY, Marsh JW, et al. Liver transplantation for hepatocellular carcinoma. Ann Surg Oncol. 2008 Apr;15(4):1001-7. 9. McCormack L, Petrowsky H, Clavien PA. Surgical therapy of hepatocellular carcinoma. Eur J Gastroenterol Hepatol. 2005 May;17(5):497-503. 10. Lang H, Sotiropoulos GC, Domland M, et al. Liver resection for hepatocellular carcinoma in non-cirrhotic liver without underlying viral hepatitis. Br J Surg 2005; 92: 198-202. 11. Llovet JM, Bru C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis 1999; 19: 329-38. 12. Torzilli G, Makuuchi M, Inoue K, et al. No-mortality liver resection for hepatocellular carcinoma in cirrhotic and non cirrhotic patients: is there a way? A prospective analysis of our approach. Arch Surg 1999; 134: 984-92. AAEEH • 111 ASOCIACIÓN ARGENTINA PARA EL 13. Tan CH, Low SC, Thng CH. APASL and AASLD Consensus Guidelines on Imaging Diagnosis of Hepatocellular Carcinoma: A Review. Int J Hepatol. 2011;2011:519783. 14. Wildi S, Pestalozzi BC, McCormack L, Clavien PA. Critical evaluation of the different staging systems for hepatocellular carcinoma. Br J Surg. 2004 Apr;91(4):400-8. 15. Belghiti J, Panis Y, Farges O, et al. Intrahepatic recurrence after resection of hepatocellular carcinoma complicating cirrhosis. Ann Surg 1991; 214: 114-17. 16. Rees M, Plant G, Wells J, Bygrave S. One hundred and fifty hepatic resections: evolution of technique towards bloodless surgery. Br J Surg 1996; 83: 1526-9. 17. Poon RT, Fan ST, Lo CM, et al. Extended hepatic resection for hepatocellular carcinoma in patients with cirrhosis: is it justified? Ann Surg 2002; 236: 602-11. 18. Mazzaferro V, Romito R, Schiavo M, et al. Prevention of hepatocellular carcinoma recurrence with alpha-interferon after liver resection in HCV cirrhosis. Hepatology 2006; 44: 1543-54. 19. Ishizawa T, Hasegawa K, Aoki T, et al. Neither multiple tumors nor portal hypertension are surgical contraindications for hepatocellular carcinoma. Gastroenterology 2008; 134: 1908-16. 20. Arii S, Yamaoka Y, Futagawa S, et al. Results of surgical and nonsurgical treatment for small-sized hepatocellular carcinomas: a retrospective and nationwide survey in Japan. The Liver Cancer Study Group of Japan. Hepatology 2000; 32: 1224-9. 21. Takayama T, Sekine T, Makuuchi M, et al. Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma: a randomised trial. Lancet 2000; 356: 802-7. 161. 22. Fong Y, Sun RL, Jarnagin W, Blumgart LH. An analysis of 412 cases of hepatocellular carcinoma at a western center. Ann Surg 1999; 229: 790-9; discussion 799-800. 23. Grazi GL, Ercolani G, Pierangeli F, et al. Improved results of liver resection for hepatocellular carcinoma on cirrhosis give the procedure added value. Ann Surg 2001; 234:71-8. 163. 24. Yamamoto M, Takasaki K, Ohtsubo T, et al. Effectiveness of systematized hepatectomy with Glisson’s pedicle transection at the hepatic hilus for small nodular hepatocellular carcinoma: retrospective analysis. Surgery 2001;130: 443-8. 25. Li C, Zhang JY, Zhang XY, Wen TF, Yan LN. FibroScan predicts ascites after liver resection for hepatitis B virus-related hepatocellular carcinoma: A prospective cohort study. Int J Surg. 2015 Aug;20:21-5. 26. Cescon M, Cucchetti A, Colecchia A, Ercolani G, Festi D, Pinna AD. Reply to letter: “value of transient elastography measured with fibroscan in predicting the outcome of hepatic resection for hepatocellular carcinoma”. Ann Surg. 2015 Apr;261(49)1. 27. Berzigotti A, Reig M, Abraldes JG, Bruix J, Bosch J, García-Pagán JC. Value of transient elastography measured with fibroscan in predicting the outcome of hepatic resection for hepatocellular carcinoma. Ann Surg. 2015 Apr;261(4). 28. Cescon M, Colecchia A, Cucchetti A, Peri E, Montrone L, Ercolani G, Festi D, Pinna AD. Value of transient elastography measured with FibroScan in predicting the outcome of hepaticresection for hepatocellular carcinoma. Ann Surg. 2012 Nov;256(5). 29. Jung KS, Kim SU, Choi GH, Park JY, Park YN, Kim do Y, Ahn SH, Chon CY, Kim KS, Choi EH, Choi JS, Han KH. Prediction of recurrence after curative resection of hepatocellular carcinoma using liver stiffness measurement (FibroScan®). Ann Surg Oncol. 2012 Dec;19(13). 30. Pesce A, Scilletta R, Branca A, Nigro L, Montineri A, Larocca L, Fatuzzo F, Castaing M, Puleo S. Does transient elastography (FibroScan®) have a role in decision making in hepatocellular carcinoma?. HPB (Oxford). 2012 Jun;14(6). 31. Kim SU, Ahn SH, Park JY, Kim do Y, Chon CY, Choi JS, Kim KS, Han KH. Prediction of postoperative hepatic insufficiency by liver stiffness measurement (FibroScan((R))) before curative resection of hepatocellular carcinoma: a pilot study. Hepatol Int. 2008 Dec;2(4). 32. Kawamoto M, Mizuguchi T, Katsuramaki T, Nagayama M, Oshima H, Kawasaki H, Nobuoka T, Kimura Y, Hirata K. Assessment of liver fibrosis by a noninvasive method of transient elastography and biochemical markers. World J Gastroenterol. 2006 Jul 21;12(27). 33. Nakashima Y, Nakashima O, Tanaka M, et al. Portal vein invasion and intrahepatic micrometastasis in small hepatocellular carcinoma by gross type. Hepatol Res 2003;26: 142-7. 34. Poon RT, Fan ST, Ng IO, Wong J. Significance of resection margin in hepatectomy for hepatocellular carcinoma: a critical reappraisal. Ann Surg 2000; 231: 544-51. 35. Hasegawa K, Kokudo N, Imamura H, et al. Prognostic impact of anatomic resection for hepatocellular carcinoma. Ann Surg 2005; 242: 252-9. 36. Vauthey JN, Lauwers GY, Esnaola NF, et al. Simplified staging for hepatocellular carcinoma. J Clin Oncol 2002; 20: 1527-36. 37. Yao FY, Ferrell L, Bass NM, et al. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology2001; 33: 1394-403. 38. Otto G, Herber S, Heise M, et al. Response to transarterial chemoembolization as a biological selection criterion for liver transplantation in hepatocellular carcinoma. LiverTranspl 2006; 12: 1260-7. 39. Mazzaferro V, Regalia E, Doci R, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996; 334: 693-9. 40. Mazzaferro V, Bhoori S, Sposito C, et al. Milan criteria in liver transplantation for hepatocellular carcinoma: an evidence-based analysis of 15 years of experience. Liver Transpl 2011; 17(Suppl. 2): S44-57. 41. Rahman A, Mura assifi M, Pedrosos F, et al. Is resection equivalent to transplantation for early cirrhotic patients with hepatocellular carcinoma ? A meta-analysis. J Gastrointestinal Surg 2012;16:1897-1909. 42. Gordon-Weeks AN, Snaith A, Petrinic T, et al. Systematic review of outcome of downstaging hepatocellular cancer before liver transplantation in patients outside the Milan criteria. Br J Surg 2011; 98: 1201-8. 43. Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma.Semin Liver Dis. 2010 Feb;30(1):52-60. 112 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Tratamiento de la Recurrencia Dres. Fernando Gruz, Claudio Estepo, Carlos Guma La ablación por radiofrecuencia (RFA), la resección y el trasplante hepático constituyen tratamientos potencialmente curativos para los estadios tempranos del hepatocarcinoma (1-2) (HCC). La recurrencia tumoral luego de la implementación de cualquiera de estos tratamientos está asociada a una disminución en la sobrevida. La recurrencia puede ser intrahepática, extrahepática (particularmente en pulmones, huesos y glándulas suprarrenales) o en ambos sitios en forma simultánea. No existen en la actualidad estudios comparativos que establezcan la estrategia óptima para el tratamiento de la recurrencia. Los elementos a tener en cuenta al momento de definir una terapéutica son principalmente el sitio de la recurrencia, si se trata de un nódulo único o múltiples nódulos, el grado de insuficiencia hepática, la presencia de hipertensión portal, las posibilidades técnicas y las enfermedades comórbidas. La mayor parte de la experiencia con RFA proviene de países asiáticos, donde se reporta una tasa de recurrencia vinculada al procedimiento que oscila entre el 3,2 y el 26% (3-6), y predominan las formas intrahepáticas por sobre las extrahepáticas. El re-tratamiento con RFA y la resección tienen una eficacia comparable. La re-ablación es un tratamiento seguro y efectivo para el manejo de recurrencias intrahepáticas pequeñas con localización favorable (ubicadas al menos a 5mm de la vesícula, vía biliar y cápsula de Glisson), pero se requieren sesiones repetidas para lograr una respuesta completa (7). La cirugía constituye un tratamiento más radical, que se asocia a mayor riesgo (7-8), por lo que debería reservarse para los casos de falla a la re-ablación o para cuando esta es inaplicable. La quimioembolización (TACE) como tratamiento para la recurrencia local post-RFA está asociada una menor tasa de respuesta, por lo que no puede ser recomendada (7). El trasplante hepático de salvataje ha sido propuesto como una opción válida para la recurrencia post-RFA en pacientes seleccionados, con tasas de sobrevida a 5 años comparables a aquellos pacientes que recibieron un trasplante como primera línea de tratamiento (9). La recurrencia post-quirúrgica es de (10) aproximadamente 70% a 5 años . Más del 80% se limita al hígado (uni o multifocales) y en aproximadamente un 15% de los casos existe también extensión extrahepática asociada (11). Pueden diferenciarse dos tipos de recurrencias: tempranas y tardías (después de los 2 años) (12). Diferentes modalidades terapéuticas de rescate para las recurrencias post-quirúrgicas han sido propuestas: 1) La RFA se asocia a buenos resultados, con una sobrevida reportada a 1; 3 y 5 años de 84; 51 y 40% respectivamente(13) con bajas tasas de complicaciones (1-3%)(13-14) 2) La rehepatectomía tiene una sobrevida reportada del 47% a 5 años(10), pero es solamente aplicable en un 20% de los pacientes con HCC recurrente(13), como resultado de progresión de la disfunción hepática, adherencias de la cirugía previa o presencia de tumores multifocales 3) La TACE como tratamiento (no curativo) de la recurrencia post quirúrgica del HCC, si bien consigue buenos resultados a corto plazo, estos no se sostienen 5 años (15) 4) El trasplante hepático de salvataje fue descripto por Majno y colaboradores con resultados comparables al trasplante hepático primario(16) en pacientes seleccionados. Posteriormente otros autores encontraron resultados similares, pero han remarcado que aquellos pacientes que recurren en forma temprana se benefician menos del trasplante de salvataje (17-18). Belghiti ha identificado factores de mal pronóstico (invasión microvascular, satelitosis, tumor mayor a 3cm, mala diferenciación tumoral y cirrosis), que se asociarían a recurrencia tumoral por fuera de los AAEEH • 113 ASOCIACIÓN ARGENTINA PARA EL criterios sugeridos para el trasplante de salvataje, proponiendo la realización de trasplantes “preventivos” en aquellos pacientes que presenten 3 ó más de estos factores(19) La recurrencia de HCC post-trasplante ocurre aproximadamente en el 10-30% de los pacientes. La recurrencia aislada en hígado es de un 15-20% en la mayoría de las series (20) y puede ser pasible de tratamiento loco-regional. La RFA puede ser aplicada en el escenario post-trasplante, pero generalmente se opta por la resección, ya que es un método seguro, efectivo y ha sido descripto como un factor independiente en la sobrevida (21-22) . Otros estudios, con pocos pacientes y retrospectivos, muestran buenos resultados con TACE en el tratamiento en la recurrencia intrahepática e irresecable (23-24). Para aquellas recurrencias que exceden las posibilidades de realizar resección, RFA o TACE, la administración de Sorafenib ha mostrado beneficios en cuanto al tiempo a la progresión y a la sobrevida, comparado con el tratamiento de sostén (25). En cuanto a la inmunosupresión, si bien hace unos años se postulaba el beneficio de los mTOR por sobre los Inhibidores de la Calcineurina, esto aún no ha sido demostrado en ensayos clínicos. Dado que se trata de una entidad considerada metastásica, y no puede descartarse la existencia de diseminación a distancia, el re trasplante no está recomendado. Las recurrencias extrahepáticas se asocian a mal pronóstico, con una sobrevida media de 4-5 meses (26). Si bien el tratamiento óptimo no ha sido establecido, varios estudios han descripto diferencias entre las recurrencias extrahepáticas únicas o múltiples. Para el caso de las metástasis únicas, se postula que la resección quirúrgica tiene beneficio en pacientes seleccionados (buen performance status, reserva funcional hepática adecuada y HCC intrahepático controlado) (22,26-27) . La presencia de metástasis óseas, independientemente de la existencia de focos de HCC en otras localizaciones, se asocia a una franca disminución en la sobrevida (22). Las opciones terapéuticas para los pacientes con recurrencias extrahepáticas múltiples se limitan al uso de Sorafenib (28-29) o al tratamiento de sostén. No existen hasta el momento modelos pronósticos, ni algoritmos de decisión en la recurrencia del HCC de acuerdo a la modalidad de tratamiento inicial aplicada. Las opciones terapéuticas más aceptadas para recurrencias intrahepáticas, son: 1) Re-ablación para la recurrencias post-RFA y ante su falla o imposibilidad, resección hepática, o trasplante, 2) Re-resección, RFA o trasplante hepático de salvataje (en casos seleccionados) para recurrencias luego de la resección quirúrgica y 3) En recurrencias post-trasplante, cirugía, RFA ó TACE. En casos seleccionados como la presencia de uno o dos nódulos de localización extrahepática, la resección parecería ser una opción útil y ante recurrencias extrahepáticas múltiples, la terapia sistémica con Sorafenib ha mostrado cierto beneficio. Al momento de definir una terapéutica, debe re-estadificarse al paciente, teniendo en cuenta no sólo cual fue el tratamiento inicial, sino también las características del tumor (número de nódulos, invasión vascular, diferenciación celular), el grado de insuficiencia hepática, la presencia de hipertensión portal, comorbilidades y la experiencia del equipo tratante. Referencias 1. Bruix J, Sherman M. Management of hepatocellular carcinoma: an update. Hepatology 2011;53:1020-1022 2. European Association for the Study of the Liver. European Organization for Research and Treatment EASL–EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2012;56:908–943 3. Omata M, Lesmana L, Tateishi R, Chen PJ, Lin SM, Yoshida H, Kudo M, Lee J, Choi B, Poon R, Shiina S, Cheng AL, JiaJD, Obi S, Han KH, Jafri W, Chow P, Lim SG, Chawla YK, Budihusodo U, Gani R, Lesmana CR, Putranto T, Liaw YF, Sarin S. Asian Pacific Association for the Study of the Liver consensus recommendations on hepatocellular carcinoma. Hepatol Int 2010;4:439–474 4. Abu-Hilal M, Primrose JN, Casaril A, McPhail MJ, Pearce NW, Nicoli N. Surgical resection versus radiofrequency ablation in the treatment of small unifocal hepatocellular carcinoma. J Gastrointest Surg 2008;12:1521-1526 114 5. Lam VW, Ng KK, Chok KS et al. Risk factors and prognostic factors of local recurrence after radiofrequency ablation of hepatocellular carcinoma. J Am Coll Surg 2008;207:20-29 6. Shiina S, Tateishi R, Arano T et al. Radiofrequency ablation for hepatocellular carcinoma: 10-year outcome and prognostic factors. Am J Gastroenterol 2012;107:569-577 7. Xioyan Xie, Chunlin J, Zhengwei P, Baoxian L, Wenjie H, Ye W, Manxia L, Mingde L, Ming K. Local recurrence after radiofrequency ablation of hepatocellular carcinoma: treatment choice and outcome. J Gastrointest Surg 2015 DOI 10.1007/s11605-015-2850-z 8. Sugo H, Ishizaki Y, Yoshimoto J, Imamura H, Kawasaki S. Salvage hepatectomy for local recurrent hepatocellular carcinoma after ablation therapy. Ann Surg Oncol 2012;19:2238-2245 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 9. Kontchou G, Auto M, Laurent A, Nahon P, Ganne-Carrié N, Grando V, Baghad, Roulot D, Trinchet JC, Sellier N, Cherqui D, Vicaut E, Beaugrand M, Seror O. Survival after radiofrecuency ablation and salvage transplantation in patients with hapatocellular carcinoma and Child Pugh A cirrhosis. J Hepatol 2012;56:160-166 10. Tabrizian P, Jibara H, Shrager B, Schwartz M, Roayaie S. Recurrence of hepatocellular cancer after resection. Ann Surg. 2015;261:947-955 11. Lacaze L, Scotté M. Surgical treatment of intra hepatic recurrence of hepatocellular carcinoma. World J Hepatol 2015;7:1755-1760 12. Imamura H, Matsuyama Y, Tanaka E, Ohkubo T, Hasegawa K, Miyagawa S, Sugawara Y, Minagawa M, Takayama T, Kawasaki S, Makuuchi M. Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy. J Hepatol. 2003;38:200207 13. Thomasset S, Dennisin R, Garcea G. Ablation for recurrent hepatocellular carcinoma: a systematic review of clinical efficacy and prognostic factors. World J Surg. 2015;39:1150-1160 14. Choi D, Lim HK, Rhim H, et al. Percutaneous radiofrequency ablation for recurrent hepatocellular carcinoma after hepatectomy: long-term results and prognostic factors. Ann Surg Oncol 2007;14:2319-2329 15. Poon RT, Fan ST, Lo CM et al. Postresection recurrence of hepatocellular carcinoma treated by arterial embolization: analysis of prognostic factors. Hepatology 1992;16:906-911 16. Majno P, Sarasin F, Mentha G, Hadengue A. Primary liver resection and salvage transplantation or primary liver transplantation in patients with single, small hepatocellular carcinoma and preserved liver function: An outcome-oriented decision analysis. Hepatology 2000;31:899-906 17. Sapisochin G, Bilbao I, Balsells J, Dopazo C, Caralt M, Lazaro JL, Castells L, Allende H, Charco R. Optimization of liver transplantation as a treatment of intrahepatic hepatocellular carcinoma recurrence after partial liver resection: experience of a single European series. World J Surgery. 2010;34:2146-2154 18. Lee HS, Choi GH, Joo DJ, Kim MS, Choai JS, Kim SI. The clinical behaviour of transplantable recurrent hepatocellular carcinoma after curative resection: implications for salvage liver transplantation. Ann Surg Oncol 2014:21:2717-2724 19. Belghiti J, Fuks D. Liver resection and transplantation in hepatocellular carcinoma. Liver Cancer 2012;1:71-82 20. Davis E, Wiesner R, Valdecasas J, Kita Y, Rossi M, Schwartz M. Treatment of recurrent hepatocellular carcinoma after liver transplantation. Liver Transplant 2011;17:S162-S166 21. Taketomi A, Fukuhara T, Morita K, Kayashima H, Ninomiya M, Yamashita Y. Improved results of a surgical resection for the recurrence of hepatocellular carcinoma after living donor liver transplantation. Ann Surg Oncol 2010;17:2283-2289 22. Roayaie S, Schwartz J, Sung M, Emre S, Miller C, Gondolesi G, Krieger N Schwartz M. Recurrence of hepatocellular carcinoma after liver transplant: patterns and prognosis. Liver Transplant 2004;10:534-540 23. Ko HK, Ko GY, Yoon HK, Sung KB. Tumor response to transcatheter arterial chemoembolization in recurrent hepatocellular carcinoma after living donor liver transplantation. Korean J Radiol. 2009;8:320-327 24. Zhou B, Shan H, Zhu KS, Jiang ZB, Guan SH, Meng XC, Zeng XC. Chemoembolization with loboplatin mixed with ionized oil for unresecable recurrent hepatocellular carcinoma after orthotopic liver transplantation. J Vasc Interv Radiol. 2010;21:333-338 25. Sposito C, Mariani L, Germini A, Flores Reyes M, Bongini M, Grossi G, Bhoori S, Mazzaferro V. Comparative efficacy of sorafenib versus best supportive care in recurrent hepatocellular carcinoma after liver transplantation: a case-control study. J Hepatol 2013;59:59-66 26. Hirokawa F, Hayashi M, Miyamoto Y, Asakuma M, Shimizu T, Komeda K, Inoue Y, Uchiyama K. Surgical treatment of extrahepatic recurrence of hepatocellular carcinoma. Langenbecks Arch Surg. 2014; 399:10511064 27. Hwang S, Kim YH, Kim DK, Ahn CS, Moon DB, Kim KH, Ha TY, Song GW, Jung DH. Resection of pulmonary metastases from hepatocellular carcinoma following liver transplantation. World J Surg. 2012;36:15921602 28. Zhang W, Zhao G, Wei K, Zhang Q, Ma W, Song T, Wu Q, Zhang T, Kong D, Li Q. Adjuvant sorafenib reduced mortality and prolonged overall survival and post-recurrence survival in hepatocellular carcinoma patients after curative resection: A single-center experience. BioScience Trends. 2014; 8:333-338 29. Pfeiffenberger J, Koschny R, Hoffman K, Mahrabi A, Schmitz A, Radeleff B, Stremmel W, Schemmer P, Ganten T. Sorafenib treatment is safe and may affect survival of recurrent hepatocellular carcinoma after liver transplantation. Langenbecks Arch Surg. 2013; 398:1123-1128. 1 AAEEH • 115 ASOCIACIÓN ARGENTINA PARA EL 2 116 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Qumioembolización del Hepatocarcinoma Dres Ricardo García Mónaco, Gustavo Braslavsky Introducción GR1B La quimioembolización arterial hepática es un tratamiento que mejora la sobrevida en pacientes seleccionados si es realizado por operadores expertos. Existe una amplia heterogeneidad respecto a los agentes antiblásticos y de embolizacion utilizados, la selectividad terapéutica y los intervalos de tratamiento. Ello explica el diferente rango de efectividad clínica descripto en la literatura(1). Los mejores resultados reportados en términos de sobrevida global son actualmente de 48 meses(2). • Paciente con enfermedad avanzada (clasificación de BCLC, estadío C avanzado) aún con trombosis portal segmentaria, siempre y cuando tenga buena reserva hepática (tratamiento restringido solo a centros de alta experiencia) (6,7). En los siguientes párrafos se comentarán las indicaciones, contraindicaciones y resultados siguiendo la tabla de Grados y Recomendaciones (GR) de la EASL. Absolutas(1) GR 2C Contraindicaciones • Tumores masivos con reemplazo de ambos lóbulos • Cirrosis descompensada (Child-Pugh ≥8)* Indicaciones • Ausencia completa de flujo portal* • Paciente asintomático con tumor único grande (>3cm) o multinodular sin invasión vascular o enfermedad extrahepática (clasificación de BCLC, estadío B intermedio)(3,4). GR 1B Relativas GR 1A • Insuficiencia renal severa • Paciente con tumor < 3cm (clasificación de BCLC, A temprano) cuando la ablación por radiofrecuencia o la cirugía no son posibles o están contraindicadas(3). GR1A • Paciente en lista de espera de trasplante hepático, particularmente en aquellos que se asume deberán esperar al menos 6 meses para trasplante(5). • Enfermedad cardiopulmonar severa. • Tumor igual o mayor a 10 cm de diámetro • Obstrucción de la vía biliar y/o esfínter de Oddi incompetente. • Várices esofágicas sin tratar y con elevado riesgo de sangrado. AAEEH • 117 ASOCIACIÓN ARGENTINA PARA EL • *Las 2 últimas contraindicaciones listadas como “absolutas” y marcadas con asterisco pasarían a ser relativas en el caso de pacientes que estén en lista de espera de trasplante hepático. En ambas situaciones, la quimioembolización debe ser estrictamente intratumoral para evitar la descompensación hepática. • La Respuesta Objetiva y el control de enfermedad en pacientes con enfermedad más avanzada demostró ser mejor en pacientes tratados con DEB comparativamente con la técnica convencional (p=0.038 y p=0.026). La Respuesta Objetiva en la población global tendió a ser mejor (52% versus 44%), aunque la diferencia no fue estadísticamente significativa (p=0.11) (9). GR 2C • Se requieren más estudios prospectivos para determinar fehacientemente si una técnica ofrece mayor sobrevida que la otra. Resultados • La sobrevida a 2 años en pacientes con HCC irresecable fue reportada ser significativamente mayor comparada con el tratamiento de sostén(4). • En pacientes asintomáticos de cáncer, con buena función hepática y tumor grande o multinodular, sin invasión vascular ni metástasis extrahepática la técnica convencional ofrece una sobrevida a 2 años del 63% de los pacientes comparada con el 27% del grupo control (p= 0.009)(8). • La expectativa de sobrevida aplicando las técnicas actuales en manos expertas parece ser mejor a la que se había reportado en la década anterior(4,8). La sobrevida de casi 50% a 4 años(2), debe tenerse en cuenta al sugerir el tratamiento a pacientes que encajan en escenarios controvertidos como los criterios expandidos de trasplante y resección en HCC multifocal. Microesferas cargadas con drogas (DEB) versus técnica convencional • El uso de DEB cargadas con doxorrubicina demostró en estudios randomizados una marcada reducción de la toxicidad hepática y de los efectos adversos de los antiblasticos comparada con la quimioembolizacion convencional (9,10). 118 • Los mejores resultados reportados en la literatura sobre quimioembolización (sobrevida del 48% a 4 años) se obtuvieron con técnica de DEB(2). • La utilización de DEB permite un tratamiento reproducible y consistente que no es posible con la técnica convencional ofreciendo la oportunidad de estandarizar el tratamiento. Conclusión • La quimioembolización arterial es un tratamiento seguro y eficaz para el HCC, siempre y cuando se respeten sus indicaciones y sea realizado con la tecnología adecuada y por operadores con experiencia. • La sobrevida esperada es de casi 50% a los 4 años con las técnicas actuales • Existe una manifiesta tendencia al uso de microesferas cargadas con doxorubicina (DEB) ya que ofrece menor toxicidad hepática, menores efectos adversos de los citostaticos y permite un tratamiento reproducible y estandarizado. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Referencias 1. Raoul JL, Sangro B, Forneret al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma: available evidence and expert opinion on the use of transarterial chemoembolization. Cancer Treat Rev 2011; 37: 212-220 7. Xue TC, Xie XY, Zhang L, et al. Transarterial chemoembolization for hepatocellular carcinoma with portal vein tumor thrombus: a metaanalysis. BMC Gastroenterol 2013; 13: 60 doi: 10.1186/1471-230X-1360. 2. Burrel M, Reig M, Forner A, et al. Survival of patients with hepatocellular carcinoma treated by transarterial chemoembolisation (TACE) using Drug Eluting Beads. Implications for clinical practice and trial design. J Hepatol 2012; 56: 1330-1335 8. Llovet JM, Real MI, Montaña X, et al. Barcelona Liver Cancer Group. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet 2002; 359: 1734–1739 3. European Association for the Study of the Liver; European Organization for Research and Treatment of Cancer. EASL-EORTC clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2012; 56:908–943 9. Lammer J, Malagari K, Vogl T et al; PRECISION V Investigators. Prospective randomized study of doxorubicin-eluting-bead embolization in the treatment of hepatocellular carcinoma: results of the PRECISION V study. Cardiovasc Intervent Radiol 2010; 33: 41–52 4. Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology 2003; 37: 429-442 10. Vogl TJ, Lammer J, Lencioni R, et al. Liver, gastrointestinal and cardiac toxicity in intermediate hepatocellular carcinoma treated with PRECISION TACE with drug-eluting beads: results from the PRECISION V randomized trial. AJR Am J Roentgenol 2011;197: W562–W570 5. Clavien PA, Lesurtel M, Bossuyt PM, et al. Recommendations for liver transplantation for hepatocellular carcinoma: an international consensus conference report. Lancet Oncol 2012; 13:11-22 6. Luo J, Guo RP, Lai EC, et al. Transarterial chemoembolization for unresectable hepatocellular carcinoma with portal vein tumor thrombosis: a prospective comparative study. Ann Surg Oncol 2011; 18: 413-420 1 2 AAEEH • 119 ASOCIACIÓN ARGENTINA PARA EL 120 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Radioembolización Dres Francisco Suarez Anzorena, Sebastian Raffa, Sebastian Figueroa Introducción La terapia con Ytrio 90 por vía endovascular es un procedimiento combinado, utilizando la angiografía como vehículo de implante y la medicina nuclear como regulador y administrador del radioisótopo intrahepático (1). Es aplicado por un equipo multidisciplinario que incluye radiólogos, hepatólogos, médicos de medicina nuclear, cirujanos, oncólogos e intervencionistas. Son susceptibles de racibir radioembolizacion hepática pacientes con HCC que no sean pasibles de tratamiento quirúrgico o trasplante: y en pacientes que hayan recibido otras terapias locales y hayan fracasado como quimioembolización, o radiofrecuencia (2). Tambien se podria aplicar radioembolizacion hepatica para downstaging, y en paciente con trombosis segmentarias o de la vena porta (2,3). Evaluación del Paciente Evaluación clínica y de laboratorio. Los pacientes deberían presentar bilirrubina total menor a 2 mg/ dl, y AST-ALT en valores que no superen más de cinco veces lo normal, y tener una funcion hepatica preservada, Child-Pugh A. Antes de iniciar se debe efectuar una volumetría hepática, diferenciando el porcentaje de parénquima sano del área que ocupa la masa tumoral o las distintas masas tumorales, a través de una tomografía helicoidal de abdomen de dieciséis filas. Angiografía para conocer el patrón de perfusión arterial hepática, buscando las ramas del tronco celíaco, de la arteria mesentérica superior y ramas de la coronaria estomáquica, dada la gran frecuencia de variaciones que en ellas existe. En caso de hallarse arterias que de las ramas hepáticas irriguen parte del tubo digestivo, se deberán embolizar con coils y microcoils (4). La infusión de una esfera en territorio no deseado ocasionará algunas de las complicaciones más temidas, como úlceras duodenales o gástricas y pancreatitis. Las ramas que con mayor frecuencia se ocluyen, son la gastroduodenal, la pilórica y la gástrica derecha. Para ello se coloca un introductor vascular en la arteria femoral, y con un catéter Cobra y alambre hidrofílico se llega a la arteria hepática; se coloca un micro catéter para colocar macro albúmina marcada con tecnecio 99 y se evalúa el comportamiento hemodinámico de la liberación de esferas. Una vez finalizado el examen, se efectúa un centellograma hepato-pulmonar determinando la localización de la albúmina marcada con tecnecio 99, tanto en parénquima sano como en el área del tumor. El shunt hepato-pulmonar debe ser menor al 20% para evitar la neumonitis actínica. Realizado el centellograma corporal total, se ajustará la dosis de Ytrio90 a colocar, de acuerdo al porcentaje de captación por el tumor. Para la radioembolización hepática se dispone de dos productos, TheraSphere®, con microesferas de vidrio fabricadas en Canadá, y SIR-Spheres®, producido por SIRTEX Medical, Australia, son microesferas biocompatibles de resina, cuyo diámetro oscila entre 20 y 40 micras, y contienen Ytrio-90, un isótopo de alta energía emisor beta. En los tejidos el alcance máximo de la emisión, es de 11 mm, con una media de 2,5 mm y la vida media es de 64,1 horas. En su uso terapéutico, que requiere una desintegración del isótopo al infinito, el 94% de la radiación se liberará en los primeros 11 días. El producto se comercializa en viales que contienen de 40 a 80 millones de AAEEH • 121 ASOCIACIÓN ARGENTINA PARA EL microesferas que cargan 3 GBq de Ytrio-90 en el momento de calibración. Tener en cuenta que por cada esfera, un GBq de actividad equivale a 2.03.3 X107 microesferas. Finalmente, se solicitará el radiofármaco a la compañía que lo elabora y se programará a la semana de evaluación, el tratamiento. Método Las microesferas se inyectan a través de un micro catéter, mediante una angiografía y se colocará la dosis estipulada de acuerdo a la extensión y localización tumoral así como la presencia o no de shunts pulmonares y/o portales, previamente estudiados. El cálculo debe ajustarse a cada paciente en particular. El mismo puede obtenerse a partir de la superficie corporal, o bien por el volumen corporal. Todo el material a utilizar será manipulado por personal de Medicina Nuclear; el encargado de ello, separará la dosis a utilizar en un frasco ampolla, el cual es colocado dentro de un cubo de acrílico asegurando una distancia constante y segura al contacto del material con los que allí se encuentren. La infusión se prepara con dextrosa en agua al 5%. Una vez listo el material, se infunde el radioisótopo en las arterias hepáticas, consiguiendo aplicar selectivamente altas dosis de radiación intratumoral, respetando el parénquima hepático sano adyacente o al menos no recibiendo éste dosis lesivas de radiación. Complicaciones Unos pocos pacientes experimentan el llamado síndrome de post embolización que incluye efectos secundarios (náuseas, vómitos y fiebre) que no debieran sobrepasar los diez días. De ellos, lo más frecuentemente informado ha sido el dolor a causa del cese de suministro de sangre al área tratada. Otras complicaciones son neumonitis actínica, gastritis, duodenitis, pancreatitits, colecistitis, necrosis de piel periumbilical, pero cada vez menos frecuentes por la experiencia y cuidados al infundir las esferas. Evolución A las 24 hs cumplidas de la intervención, el paciente es dado de alta y citado a control en 3 meses. El seguimiento se efectuará en forma clínica, con visitas a repetición además de un complemento de estudios de laboratorio que controle la función hepática y los marcadores tumorales que estuvieran previamente alterados y de imágenes con resonancia magnética y tomografías. Resultados Los resultados dependen de las características de los pacientes, estadio de la enfermedad BCLC, del ECOG, obstrucción de la vena porta, metástasis a distancia. En pacientes con estadio BCLC-B la sobrevida global en comparacion con la TACE es similar alcanzando los 17 meses, si bien estos resultados no provienen de estudios comparativos randomizados (5,6). Estan en fase de reclutamiento activos estudios clinicos comparativos entre TACE y radioembolizacion, incluyendo un estudio en fase 3 para HCC unilobar (7,8). Referencias 1. Bilbao, J.I., Reiser, M.F. Liver Radioembolization with 90 Y-Microspheres. Universidad de Navarra, Pamplona, España,Springer Berlin Heidelberg, Medical Radiology, 2008. 2. W.Y. Lau, M.D., S. Ho, F.R.S.C. Selective internal radiation therapy for nonresectable hepatocellular carcinoma with intraarterial infusion of 90 ytrium microspheres. The official Journal of the American Society for Therapeutic Radiology and Oncology, Volume 40, Number 3, February 1, 1998. 3. Bruno Sangro, M.D., Ph.D., Jose I. Bilbao, M.D., Ph. D. Radioembolization using 90Y-Resin Microspheres for patients with advanced hepatocellular carcinoma. Int. J. Radiation Oncology Biol. Phys., Vol. 66, No 3, May 30, 2006. 4-. Ali A. Haydar, Harpreet Wasan, Charles Wilson, Paul Tait. Radioembolization: Embolization of the Gastroduodenal Artery is not always Appropiate. Cardiovascular Intervent. Radiology, 2010. 122 5. Survival after yttrium-90 resin microsphere radioembolization of hepatocellular carcinoma across Barcelona Clinic Liver Cancer stages: a European evaluation. Sangro B, Carpanese L, Cianni R et al; European Network on Radioembolization with Yttrium-90 Resin Microspheres (ENRY). Hepatology. 2011Sep 2;54(3):868-78. 6. Radioembolization results in longer time-to-progression and reduced toxicity compared with chemoembolization in patients with hepatocellular carcinoma. Salem R, Lewandowski RJ, Kulik L et al, Gastroenterology. 2011 Feb;140:497-507. 7. https://clinicaltrials.gov/ct2/show/NCT01381211?term=radioembolizati on+hcc&rank=3. 8. https://clinicaltrials.gov/ct2/show/NCT02004210?term=radioembolizati on+hcc&rank=5. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Sorafenib Dres Ezequiel Ridruejo, José Allevato, Marcela Carballido Sorafenib es un inhibidor multiquinasa que ha demostrado poseer propiedades tanto antiproliferativas como antiangiogénicas in vitro e in vivo. Sorafenib es formulado en comprimidos de 200 mg para ser administrados por vía oral en dosis recomendadas de 800 mg divididos en 2 tomas diarias. No hay una recomendación clara en cuanto a su uso en pacientes con CPS B, aunque algunos estudios sugieren que la tolerancia seria similar a la de los pacientes con CPS A (6-8). Contraindicaciones Indicaciones El sorafenib está indicado en pacientes con hepatocarcinoma hepatocelular (HCC) avanzado (estadío C de la clasificación de Barcelona, BCLC) que conserven una buena función hepática (Score de Child Pugh A, CPS A) y un buen estado funcional (Eastern Cooperative Oncology Group, ECOG 0-2) (1-3) . Esta recomendación proviene de los resultados de un estudio aleatorizado, doble ciego y controlado con placebo denominado SHARP (Sorafenib HCC Assessment Randomized Protocol) que incluyó a 602 pacientes tratados (3). El sorafenib prolongó significativamente la sobrevida global en comparación con placebo: 10,7 meses versus 7,9 meses, respectivamente. Las tasas de supervivencia a un año fueron de 44% en el grupo sorafenib y 33% en el grupo placebo. Este beneficio significativo en cuanto a supervivencia representó una reducción relativa del riesgo de muerte de 31%. La mediana de tiempo hasta la progresión radiológica, de acuerdo con una revisión independiente de los datos radiológicos, fue de 5,5 meses en el grupo sorafenib versus 2,8 meses en el grupo placebo (IR en el grupo sorafenib, 0.58; IC 95% 0.45-0.74; P<0.0001) (4). Resultados similares se obtuvieron en un estudio realizado en pacientes asiáticos(5). La única contraindicación para su uso es pacientes con antecedentes de hipersensibilidad a la droga (3) . Eficacia y seguridad en pacientes de la vida real Se han reportado algunas experiencias de tratamiento con sorafenib en la vida real. El estudio GIDEON incluyó más de 3000 pacientes en forma prospectiva (9). La tasa de eventos adversos fue similar en los pacientes CPS A y B (84% versus 88% respectivamente), aunque los eventos adversos serios fueron más frecuentes en CPS B (36% versus 60% respectivamente). La dosis media fue mayor en pacientes CPS B (667 mg versus 741 mg, respectivamente) y la duración de la terapia más larga en pacientes CPS A (17.6 meses versus 9.9 meses, respectivamente). La mediana de la sobrevida global fue mayor en pacientes CPS A (13.6 meses [IC 95% 12.8-14.7]) que en CPS B (5.2 meses [4.6-6.3]); el tiempo a la progresión fue similar: CPS A (4.7 meses [4.3-5.2]) y CPS B (4.4 meses [3.5-5.5]). La sobrevida global fue menor en pacientes con CPS B con mayor puntaje: score 7 (6.2 meses [4.9-8.7]); score 8 (4.8 meses [4.1-6.9]); score 9 (3.7 meses [3.0-5.1]) (9). AAEEH • 123 ASOCIACIÓN ARGENTINA PARA EL En Taiwán, 149 pacientes BCLC-C Child-Pugh A fueron tratados con sorafenib (10). La sobrevida libre de enfermedad, la sobrevida global y la sobrevida luego de la progresión fueron de 2.5, 8.0, y 4.6 meses, respectivamente. De los pacientes tratados, 70.5% de los pacientes redujeron la dosis y 50.3% recibieron <75% de la dosis planeada. El 42.3% redujo la dosis por progresión de la enfermedad, 34.2% por deterioro de la función hepática, y 7.4% por eventos adversos serios. La reacción cutánea mano-pie fue el evento que más frecuentemente llevo a la suspensión (10). En el estudio SOFIA, 296 pacientes fueron tratados (88% Child-Pugh A, 75% BCLC-C, y 25% BCLC-B) (11) . De estos 91% tuvo algún evento adverso y 54% redujeron la dosis. El 44% redujo la dosis por progresión de la enfermedad, 16% por deterioro de la función hepática, y 40% por eventos adversos serios. La sobrevida media global fue de 10.5 meses, 8.4 en BCLC-C versus 20.6 en BCLC-B (P < 0.0001); y fue de 21.6 meses en 77 pacientes tratados >70% del tiempo con media dosis versus 9.6 meses en 219 pacientes tratados >70% del tiempo con la dosis plena (11). Estos y otros estudios similares muestran que el tratamiento con sorafenib en la vida real tiene un perfil de eficacia y seguridad similar a los reportados en los estudios de registro (12-15). Manejo de los eventos adversos asociados Los eventos adversos más frecuentes son fatiga, diarrea y reacción cutánea mano-pie (15). La fatiga puede manejarse con soporte psicoterapéutico, nutricional, psicofarmacológico luego de haber descartado causas secundarias. En caso de fatiga severa puede reducirse o discontinuarse la dosis del sorafenib. Este puede reintroducirse gradualmente según la evolución (15) . La diarrea puede manejarse con ajustes en la dieta (baja en fibras), hidratación y loperamida en dosis de 2 a 4 mg ajustadas al ritmo evacuatorio. En caso de diarrea severa puede reducirse o discontinuarse la dosis del sorafenib. Este puede reintroducirse gradualmente según la evolución (15). La reacción cutánea mano-pie puede manejarse con cremas queratolíticas (que contengan urea, alfa-hidroxiácidos o ácido salicílico); cremas humectantes; corticoides y analgésicos tópicos. El rash puede manejarse con cremas que contengan alfa-hidroxiácidos, óxido de zinc o lanolina y antihistamínicos. En caso de cuadros dermatológicos severos puede reducirse o discontinuarse la dosis del sorafenib. Este puede reintroducirse gradualmente según la evolución (15). Referencias 1. European Association for the Study of the Liver; European Organisation for Research and Treatment of Cancer. EASL---EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2012;56:908-943. 2. Bruix J, Sherman M. Management of hepatocellular carcinoma: An update. Hepatology. 2011;53:1020-1022. 3. Bayer. Nexavar (sorafenib tosylate) tablets prescribing information. West Haven, CT: 2007 Feb. 4. Llovet JM, Ricci S, Mazzaferro V, et al., SHARP Investigators Study Group. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359:378-390. 5. Cheng A, Kang Y, Chen Z, et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomized, double-blind, placebo controlled trial. Lancet Oncol. 2009;10:25-34. 6. Kim JE, Ryoo BY, Ryu MH, et al. Sorafenib for hepatocellular carcinoma according to Child–Pugh class of liver function. Cancer Chemother Pharmacol 2011;68:1285–1290. 7. Hollebecque A, Cattan S, Romano O, et al. Safety and efficacy of sorafenib in hepatocellular carcinoma: the impact of the Child–Pugh score. Aliment Pharmacol Ther 2011;34:1193–1201. 8. Chiu J, Tang YF, Yao TJ, et al. The use of single-agent sorafenib in the treatment of advanced hepatocellular carcinoma patients with underlying Child-Pugh B liver cirrhosis: a retrospective analysis of efficacy, safety, and survival benefits. Cancer. 2012;118:5293-5301. 124 9. Marrero JA, Lencioni R, Ye S-L et al. Final analysis of GIDEON (Global Investigation of Therapeutic Decisions in Hepatocellular Carcinoma [HCC] and of Its Treatment with Sorafenib [Sor]) in >3000 Sor-treated patients (pts): clinical findings in pts with liver dysfunction. J Clin Oncol 2013;31(Suppl.); abstract 4126. 10. Lee IC, Chen YT, Chao Y, et al. Determinants of survival after sorafenib failure in patients with BCLC-C hepatocellular carcinoma in real-world practice. Medicine (Baltimore). 2015;94:e688. 11. Iavarone M, Cabibbo G, Piscaglia F, et al. Field-practice study of sorafenib therapy for hepatocellular carcinoma: a prospective multicenter study in Italy. Hepatology. 2011;54:2055-2063. 12. Lencioni R, Marrero J, Venook A et al. Design and rationale for the non-interventional Global Investigation of Therapeutic DEcisions in Hepatocellular Carcinoma and Of its Treatment with Sorafenib (GIDEON) study. Int J Clin Pract. 2010;64:1034-1041. 13. Turnes J, Díaz R, Hernandez-Guerra M, et al. Decisiones terapéuticas en el tratamiento del carcinoma hepatocelular y patrones de uso de sorafenib. Resultados del estudio internacional observacional GIDEON en España. Gastroenterol Hepatol. 2015;38:263-273. 14. Lencioni R, Kudo M, Ye SL et al. GIDEON (Global Investigation of therapeutic DEcisions in hepatocellular carcinoma and Of its treatment with sorafeNib): second interim analysis. Int J Clin Pract 2014;68:609617. 15. Bolondi L, Craxi A, Trevisani F, et al. Refining sorafenib therapy: lessons from clinical practice. Future Oncol. 2015;11:449-465. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 1 2 AAEEH • 125 ASOCIACIÓN ARGENTINA PARA EL 126 L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Nuevos Agentes Moleculares en el Tratamiento del Hepatocarcinoma Hepatocelular Avanzado Dres Ricardo Mastai, Florencia Perazzo, Oscar Mando Estudios llevados a cabo en la última década han permitido identificar en el carcinoma hepatocelular (CHC) un promedio de 30 a 40 mutaciones por tumor, considerando solo 5 a 8 de ellas como mutaciones “driver”. Análisis basados en la expresión genómica de pacientes con CHC han identificado subclases de acuerdo al perfil molecular permitiendo una clasificación primaria de los tumores basada fundamentalmente en el genotipo proliferativo o no proliferativo. El primero de ellos está asociado con un peor pronóstico y con la activación oncogénica de las vías de señalización de RAS, MTOR, MET, IGF y Notch. Por el contrario, el no proliferativo se caracteriza por tener una mejor evolución. A continuación se resumen algunas características de cada uno de estos grupos: A) El grupo proliferativo ha sido divididoen dos grupos fenotípicos. El Wnt-TGF-beta, caracterizado por la activación de estas vías de señalización y el de las células progenitoras dentro del cual se incluyen estas células, las células epiteliales de adhesión molecular (EpCam) y los marcadores de keratinacitoesqueleticos 19 tipo I (CK19).Este subgrupo se caracteriza por ser tumores pobremente diferenciados y que sobreexpresanalfafetoproteína (AFP), con niveles elevados desde su presentación, asociándose dentro de este grupo los relacionados con el virus B de la hepatitis. B) El grupo no proliferativose asocia con un mejor pronóstico, con bajos niveles de AFP y con tumores bien o moderadamente diferenciados. Este es un grupo heterogéneo por naturaleza y solo aquellos pacientes con mutaciones dela catenina beta 1 (CTNNB1) en el 27% de las mutaciones presentes, comparten un perfil molecular común.Este grupo se encuentra más relacionado con una función hepática normal o leve inflamación, y desde un punto de vista epidemiológico se asocia al CHC por virus C y por alcoholismo. Targets moleculares “drivers” y vías de señalización La adicción oncogénica se define como el estado de dependencia de las células tumorales a los oncogenes activados o a la pérdida de los genes supresores de tumores. En general, aquellos tumores que se desarrollan bajo la adicción oncogénica dependen de un solo oncogén activado y cuando este oncogén, es activado en forma adecuada y eficiente, se logra una importante respuesta tumoral. Las mutaciones drivers más comunes están descriptas en los genes del promotor TERT (56%), TP53 (27%), CTNNB1 (26%), ARID2 (7%), ARIDIA(6%), y AXINI (5%). A su vez, otros genes mutados como el KEAP1, la vía del RAS-MAPK (RPS6KA3) se encuentran relacionados con la remodelación de la cromatina, otros con el stress oxidativo como NFE2L2 y la vía de señalización del JAK-STAT, el JAK1. Es importante destacar, que todos estos genes mutados participan en procesos críticos de la homeostasis celular y, las desregulaciones aberrantes están involucradas en la transformación y/o mantenimiento del fenotipo maligno. Otros genes como el ARID2 y ARIDIA regulan la organización del DNA en cromatina y la disrupción de su expresión puede interferir con el control de la expresión del gen, estando mutadas en un 5 a 7% de los CHC. AAEEH • 127 ASOCIACIÓN ARGENTINA PARA EL Los miembros de la vía de señalización del WNT como el CTNB! Y AXINI1, están comprometidos en la diferenciación celular, que resulta frecuentemente alterada en las células neoplásicas. Sumado a estas mutaciones el gen promotor TERT se encuentra también afectado por amplificaciones focales cromosómicas en el 7% de los pacientes con CHC. Hallazgos en estudios publicados en el últimoaño mostraron que la amplificación del VEGFA puede inducir proliferación tumoral como resultado de una proliferación independiente de las células pero si dependiente de las vías del VEGF inducidas por la secreción del factor de crecimiento del hepatocito mediada por macrófagos. La pérdida del control del stress oxidativo favorece en forma directa mutaciones adicionales y a su vez expande el daño celular. Vías de señalización La hepatocarcinogénesis es un proceso muy complejo en el cual los pasos de las cascadas en las vías de señalización se encuentran alteradas llevando al desarrollo de tumores biológicamente heterogéneos.La clasificación funcional de los genes mutados sugiere que las vías de señalizacióncarcinogéneticas claves para el carcinoma hepatocelular son: la vía de las Wntbeta cateninas , la de la remodelación cromatina, el stress oxidativo y las vías involucradas EGF,PDFG;FGF,VEGF y IGF, sumado a sus mediadores intracelulares como el RAS-RAFMAPK y el PI3K-AKT. La vía de señalización del RAS-MAPK se encuentra activada en el 50% de los pacientes con estadios tempranos de HCC y prácticamente en el 100% de los CHC avanzados, por el contrario, la mutación del gen RAS es infrecuente en pacientes con CHC (2%). Tanto el sorafenib como el regorafenib han sido evaluados en ensayos clínicos fase III, mostrando una actividad parcial en el bloqueo de esta vía. La vía de señalización del PI3K-AKT controla la 128 sobrevida celular, tanto la proliferación como la regulación del ciclo celular, siendo activada por varios receptores de la tirosin-kinasa como el EGFR o el factor de receptor 1 de crecimiento tipoinsulina (IGFR) y por inactivación del gen supresor de tumores PTEN, observándose la activación del m-TOR en el 40-50% de los pacientes con CHC. La vía de las Wnt- beta cateninases crucial en la hepatocarcinogenesis, observándose su activación, en la mitad de los pacientes con CHC, así como también el resultado de la mutación del CTNNB1 o la inactivación de las cateninas 1. La vía de señalización Notch es vital en el desarrollo normal del hígado, encontrándose activación de esta vía en el 30% de los CHC. Por último, la vía de señalización HIPPO, que regula la proliferación y la apoptosis se encuentra también involucrada en la hepatocarcinogenesis. La señalización del VEGF es un componente clave del proceso de la angiogénesis de los pacientes con CHC habiendo identificado en diferentes ensayos clínicos que los altos niveles de amplificación del locus de VEGFA estaban asociados con el CHC. Tanto el bevacizumab como el ramucirumab, que bloquean el VEGFR2, han demostrado actividad en este tumor pero aún debe ser confirmada en las investigaciones fase III. Terapias “target” Su utilidad ha sido puesta de manifiesto desde 2008, en que el sorafenib, dentro del estudio SHARP, demostró mejorar la sobrevida en los pacientes con CHC avanzado de 7.9 a 10.7 meses, con un perfil de efectosadversos aceptables. Resultados similares a los observados en el estudio ASIANPACIFIC, en portadores de CHC por virus B, con igual beneficio en la sobrevida en un grupo con diferentes etiologías y etnias. De acuerdo a las guías de AASLD-JNCI,las nuevas moléculas introducidas como primera línea de tratamiento deberán ser comparadas con el “standard of care” que representa el sorafenib.Es de destacar, que para demostrar superioridad una nueva droga deberá alcanzar un hazard ratio de 0.7-0.8 dentro de un estudio randomizado. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 1° Línea de Tratamiento de segunda línea seleccionaron los pacientes de acuerdo a un biomarcador que pudiera predecir respuesta a la terapéutica seleccionada. A) Inhibidores VEGF-TKI 1)Sunitinib: En un estudio reciente, en pacientes con CHC avanzado la administración de sunitinib no demostró superioridad con respecto al sorafenib en términos de sobrevida (7.9 vs 10.2 meses en el grupo sorafenib),siendo , asimismo, suspendido prematuramente dada la alta toxicidad y futilidad reportada, con una tasa de muertes relacionadas por toxicidad al tratamiento de 3.2% en el brazo del sunitinib comparado con 0.3% en el brazo del sorafenib A) Inhibidores de VEGF_TKI 2) Linifanib:Ha demostrado ser un inhibidor más potente que el sorafenib del VEGFR y del PDGFR. Con respecto a su eficacia clínica, en un estudio fase III presento una sobrevida global similar al sorafenib (9.1 vs 9.8 meses en el grupo sorafenib), pero se asoció a un número significativamente superior de efectos adversos (54 vs 38 % en el grupo sorafenib). 2) Ramucirumab:En un ensayo fase II, que incluyo una serie muy importante de pacientes, se observó una tendencia a favor del ramucirumab con respecto a la sobrevida en aquellos que tenían una alfafetoproteína elevada (mayores a 400ng/ ml). Actualmente, se está realizando un estudio en pacientes con CHC con niveles elevados de alfafetoproteína, esperando sus resultados a la brevedad. 3)Brivanib: Es un inhibidor multikinasa con actividad contra las FGF. En un estudio fase III reciente la administración de brivanibdemostró una sobrevida media global similar al sorafenib(9.5 vs 9.9 meses, respectivamente). Se objetivo una muy pequeña ventana de oportunidad para demostrar el criterio de no inferioridad en el manejo del CHC que resulto en un HR de la sobrevida global con un CI 95% entre 1 y 1.08. B) Inhibidor Intracelular) de la Tirosin-Kinasa (domino Erlotinib: Recientemente, se evaluó la eficacia de la asociación de erlotinib más sorafenib vs sorafenib solo (estudio SEARCH), objetivándose que la sobrevida media global fue de 9.5 meses para la combinación y de 8.5 meses para el sorafenib más placebo, concluyendo que el agregado del erlotinib no aporta beneficio adicional sobre la sobrevida, aumentando el perfil de toxicidad con la combinación de ambas drogas 2° línea de Tratamiento Ninguno de los ensayos clínicos de tratamiento 1) Brivanib: Es la primera droga que fue evaluada como segunda línea luego de que los pacientes con CHC progresaron a pesar de recibir sorafenibo que presentaron intolerancia al antiangiogénico. Los resultados en estudios de fase II no arrojaron beneficios con respecto a la sobrevida global cuando se compararon con respecto a placebo o sorafenib. A) Inhibidores del m-TOR 1) Everolimus: En un estudio fase III la administración de este inhibidor del mTOR no pudo demostrar una mejoría en la sobrevida cuando se comparó 7.6 vs 7.3 meses, respectivamente). B) Inhibidores c-MET: Cabozantinib: Ha demostrado suprimir el crecimiento tumoral y metastásico, por cuyo motivo esta un curso un estudio fase III en pacientes con alta expresión de MET, siendo respaldado por un ensayo Fase II que mostró una mejor evolución en aquellos pacientes que expresaban altos niveles de MET. Hasta el momento actual ninguno de los ensayos clínicos reportados como negativos ha realizado un análisis de biomarcadores que permitiera seleccionar el subgrupo de pacientes que se beneficiara con la droga en estudio basándose en parámetros moleculares.En el ensayo SHARP se estudiaron en plasma biomarcadores como la Angiopoietina 2 (ANGPT2), EGF, bFGF, VEGF, AAEEH • 129 ASOCIACIÓN ARGENTINA PARA EL VEGFR, VEGFR-2, VEGFR-3, HGF,IGF-2, c-KIT, y todas las formas de RAS circulante, permitiendo individualizar un subgrupo de pacientes con altos niveles de c-KIT y bajos niveles de HGF, siendo estos biomarcadores predictivos de una favorable respuesta al sorafenib , requiriendo aún una mayor evidencia para ser aplicada en la práctica diaria. En la actualidad existen dos ensayos clínicos en curso que consideran unbiomarcador predictivo de respuesta, en 1° caso los altos niveles de expresión de c-MET para el Tivantinib y la mutación del RAS para el Refametinib. Nuevas drogas en Estudio Fase I y II En general todas las drogas probadas en fase III se basan en mecanismos antiangiogénicos. Tanto el tivantinib como el cabozantinib son ejemplos de nuevas kinasas inhibidoras con actividad contra el MET, teniendo un beneficio que es su administración por vía oral, siendo evaluadas en segunda línea luego de la progresión al tratamiento con sorafenib. 130 Perspectivas futuras Es probable que la selección de pacientes en un futuro cercano se deba definir en función de la diana terapéutica que se quiera atacar. El problema radicará en cómo asegurar que dicha diana existe al mismo tiempo que es relevante en un paciente concreto.Es bien conocido que el carcinoma hepatocelular es heterogéneo y es difícil que el tejido obtenido en una biopsia vaya a ser informativo de lo que suceda en todo el tumor de la proporción de tumor que vaya a ser afectado por la intervención terapéutica. Es por ello, podemos pensar que la resolución puede hallar en la combinación que puedan actuar sobre diferentes mecanismos. Esta aproximación, que suena como muy atractiva, puede fracasar dado que el posible beneficio se puede ver compensado con un incremento de la toxicidad. Esto es lo que ocurrió cuando se combinó el sorafenib con el erlotinib o con everolimus. En resumen, el entusiasmo y esperanza de que un mejor conocimiento de la biología molecular del cáncer y su genética se acompañase de un gran avance en el diagnóstico y tratamiento del cáncer no se ha confirmado en los pacientes con carcinoma hepatocelular. Debemos considerar que los avances científicos no son súbitos y que se necesita un camino más largo para lograr un mejor objetivo. L ESTUDIO DE LAS ENFERMEDADES DEL HÍGADO CONSENSO ARGENTINO DE HEPATOCARCINOMA • AAEEH 2015 Referencias 1. Hoshida,Y.etal.Molecularclassificationand novel targets in hepatocellular carcinoma: recent advancements. Semin. Liver Dis. 30, 35–51 (2010). 16. Villanueva, A. & Llovet, J. M. Mutational landscape of HCC—the end of the beginning. Nat. Rev. Clin. Oncol. 11, 73–74 (2014). 2. Chiang, D. Y. et al. Focal gains of VEGFA and molecular classification of hepatocellular carcinoma. Cancer Res. 68, 6779–6788 (2008). 17. Totoki, Y. et al. Trans‐ancestry mutational landscape of hepatocellular carcinoma genomes. Nat. Genet. 46, 1267–1273 (2014). 3. Boyault, S. et al. Transcriptome classification of HCC is related to gene alterations and to new therapeutic targets. Hepatology 45, 42–52 (2007). 18. Farazi, P. A. & Depinho, R. A. Hepatocellular carcinoma pathogenesis: from genes to environment. Nat. Rev. Cancer 6, 674–687 (2006). 4. Lee, J.‐S. et al. Classification and prediction of survival in hepatocellular carcinoma by gene expression profiling. Hepatology 40, 667–676 (2004). 5. Lee, J.‐S. et al. A novel prognostic subtype of human hepatocellular carcinoma derived from hepatic progenitor cells. Nat. Med. 12, 410–416 (2006). 6. Hoshida,Y.etal.Integrativetranscriptome analysis reveals common molecular subclasses of human hepatocellular carcinoma. Cancer Res. 69, 7385–7392 (2009). 7. Yamashita, T. et al. EpCAM and alpha‐fetoprotein expression defines novel prognostic subtypesof hepatocellular carcinoma. Cancer Res. 68, 1451–1461 (2008). 8. Lachenmayer, A. et al. Wnt‐pathway activation in two molecular classes of hepatocellular carcinoma and experimental modulation by sorafenib. Clin. Cancer Res. 18, 4997–5007 (2012). 9. Villanueva, A. et al. Combining clinical, pathology, and gene expression data to predict recurrence of hepatocellular carcinoma. Gastroenterology 140, 1501–1512.e2 (2011). 10. Hoshida, Y., Moeini, A., Alsinet, C., Kojima, K. & Villanueva, A. Gene signatures in the management of hepatocellular carcinoma. Semin. Oncol. 39, 473–485 (2012). 11. Nault, J. C. et al. A hepatocellular carcinoma 5‐gene score associated with survival of patients after liver resection. Gastroenterology 145, 176–187 (2013). 12. Sawyers, C. L. Shifting paradigms: the seeds of oncogene addiction. Nat. Med. 15, 1158–1161 (2009) 13. Villanueva, A. & Llovet, J. M. Targeted therapies for hepatocellular carcinoma. Gastroenterology 140, 1410–1426 (2011) 14. Kan, Z. et al. Whole‐genome sequencing identifies recurrent mutations in hepatocellular carcinoma. Genome Res. 23, 1422–1433 (2013). 15. Sawey, E. T. et al. Identification of a therapeutic strategy targeting amplified FGF19 in liver cancer by oncogenomic screening. Cancer Cell 19, 347–358 (2011). 19. Villanueva,A.,Newell,P.,Chiang,D.,Friedman, S. L. & Llovet, J. M. Genomics and signaling pathways in hepatocellular carcinoma. Semin. Liver Dis. 27, 55–76 (2007). 20. Finn, R. S. et al. Phase II, open‐label study of brivanib as first‐line therapy in patients with advanced hepatocellular carcinoma. Clin. Cancer Res. 17, 1973–1983 (2011). 21. Finn, R. S., Kang, Y.‐K. Mulcahy, M. & Lim, H. Y. Phase II, open‐label study of brivanib as second‐line therapy in patients with advanced hepatocellular carcinoma. Clin. Cancer Res. 18, 2090–2098 (2012). 22-. Villanueva, A. & Llovet, J. M. Second‐line therapies in hepatocellular carcinoma: emergence of resistance to sorafenib. Clin. Cancer Res. 18, 1824–1826 (2012). 23-Villanueva, A. et al. Pivotal role of mTOR signaling in hepatocellular carcinoma. Gastroenterology 135, 1972–1983 (2008). 24-. Tovar, V. et al. IGF activation in a molecular subclass of hepatocellular carcinoma and pre‐clinical efficacy of IGF‐1R blockage. J. Hepatol. 52, 550–559 (2010). 25- Abou‐Alfa, G. K. et al. A phase II study of cixutumumab (IMC‐A12, NSC742460) in advanced hepatocellular carcinoma. J. Hepatol. 60, 319–324 (2014). 26. Kaposi‐Novak,P.Met‐regulatedexpression signature defines a subset of human hepatocellular carcinomas with poor prognosis and aggressive phenotype. J. Clin. Invest. 116, 1582–1595 (2006). 27- Goyal, L., Muzumdar, M. D. & Zhu, A. X. Targeting the HGF/c‐MET pathway in hepatocellular carcinoma. Clin. Cancer Res. 19, 2310–2318 (2013). 28-. Zhu, A. X., Duda, D. G., Sahani, D. V. & Jain, R. K. HCC and angiogenesis: possible targets and future directions. Nat. Rev. Clin. Oncol. 8, 292–301 (2011). 29-. Sia,D.,Alsinet,C.,Newell,P.&Villanueva,A. VEGF signaling in cancer treatment. Curr. Pharm. Des. 20, 2834–2842 (2014). 30- Llovet J, Villanueva A, Lachenmayer A & Finn R. Advances in targeted therapies for the hepatocellular carcinoma in the genomic era. Nat.Rev. Clin.Oncol 12,408-424 (2015). AAEEH • 131