Estudio teórico de la descomposición de peróxidos ciclicos
Anuncio

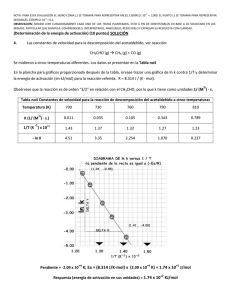
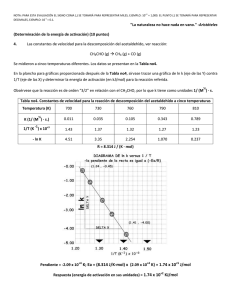
Resumen: E-040 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2004 Estudio teórico de la descomposición de peróxidos ciclicos 1 2 1 Romero Jorge M.1 - Jorge, Nelly L. - Hernández Laguna, Alfonso - Gómez Vara, Manuel, E. 1.Cátedra de Química Física 1c, FACENA - UNNE. Av. Libertad 5460 (3400) Corrientes Teléfono/Fax: (3783) 457996 - e-mail: [email protected] 2.CSIC. 18001. Profesor Alvareda 1. Granada, España. Antecedentes Estudios recientes han demostrado la factibilidad de formación de compuestos cíclicos peroxídicos a nivel troposférico o estratosférico [1]. Teórica y experimentalmente, se ha demostrado que el 1,2,4,5-tetroxano (DPF)[2,3], es térmica y termodinámicamente estable en las condiciones presentes en la atmósfera. Para la descomposición de esta clase de compuestos, mediante el método semiempiempírico AM1 se ha demostrado que el mecanismo en etapas a través de la estructura de birradical en el estado singulete fundamental, es el más probable entre todos los posibles mecanismos calculados y aparece una estructura abierta como producto intermediario. El birradical abierto que se produce tiene una estabilidad similar al reactante, por lo cual, la reacción en este punto es termoneutra [4] El objetivo del presente es estudiar la descomposición del DPF a través del camino presentado anteriormente, mediante la aplicación del método funcional de la densidad UB3LYP en base 3-21+g*. Materiales y Métodos Los estados fundamentales y de transición de la etapa determinante de la reacción de descomposición fueron evaluados mediante la aplicación del método funcional de la densidad UB3LYP. Todos los cálculos se realizaron con el GAUSSIAN94 [5]. Todos los resultados se compararon con los obtenidos en forma experimental. Discusión De Resultados En el esquema 1 se puede observar las diferentes reacciones que sufre el 1,2,4,5-tetroxano (DPF) en el estado fundamental singulete (S0), durante la reacción de termólisis: un cambio conformacional (I); y tres caminos hipotéticos en etapas (II, III, and IV). Dos de estos caminos (I, IV) dan como producto final dos moléculas de formaldehído y una molécula de oxigeno. El camino de reacción III da como producto un hidrocetoperóxido. Se ha encontrado por el método semiempírico AM1 que la etapa determinante es la formación del intermediario birradical, primer ruptura del enlace OO en la etapa IV propuesta. En este trabajo se estudia esta primera etapa mediante calculo con funcional de la densidad B3LYP con la base 3-21+G*. Se toma como estructura más estable la 2H2CO + O2 conformación de silla (c), Distancias de enlace y ángulos de p enlace de c están en concordancia con los resultados experimentales de difracción por rayos-X y espectroscopia de NMR, con excepción de la distancia de enlace O - O (1.53 Å, O O C O C Tabla 1), que es mucho más larga que la obtenida O TSo experimentalmente (1.48 Å). O O O O o O O O O TSco IV I O O C O C O O III H O O II TSca O O O O TSc H O O H C O a O C H H 2H2CO + O2 O O O C TSct c H O C O O O t Esquema 1 El camino IV sigue a través del TSco. La energía de activación es 24.6 kcal/mol (Tabla 2), la cual esta en concordancia con el obtenido en el trabajo experimental (24.3 kcal/mol). La distancia de enlace O - O de este TS (Figura 1, y Tabla 2) es 1.68 Å, claramente más grande que la distancia de enlace O – O, calculada para la configuración c (1.53 Å). El vector de Transición sólo tiene un coeficiente importante en la coordenada interna O - O (Tabla 3). Este TS lleva a una estructura abierta (o), como un producto intermediario, 0.8 kcal/mol, menos estable que c. Este intermediario abierto, o (Figura 1), presenta una distancia de enlace O - O de 2.9 Å, y la estructura es similar a la configuración de la silla. Después de este último paso, la reacción de termólisis podría continuar según tres caminos hipotéticos que serán estudiados como paso siguiente a la obtención de la etapa determinante de la reacción. Resumen: E-040 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2004 Tabla 1 . Parámetros geométricos optimizados de las estructuras moleculares sobre la superficie de energia potencial de la descomposición térmica del tetroxano. H 8 O H 9 C 2 O O C 6 4 3 H 10 1 O 5 H 7 O1O2 O4O5 C3O2 C3O4 C6O1 C6O5 COOC OOCO c 1.543 1.543 1.469 1.469 1.469 1.469 -65.39 69.30 TSco 2.434 1.534 1.412 1.475 1.412 1.475 -79.24 82.24 o 3.760 1.539 1.398 1.466 1.398 1.466 -142.74 78.33 Tabla 2. Energías totales, en unidades atómicas, y sus diferencias, en kcal/mol, de los confórmeros, estructuras de transición y productos del estado fundamental singulete (S0) de la reacción de termólisis del tetroxano. E (ua) ∆E (kcal/mol) c -377.319960435 0.000 TSco -377.280734000 24.61 o -377.300517100 12.20 Tabla 3. Curvaturas canónicas del vector de transición y las coordenadas internas de la matriz z. Eigenvector TSco -0.40730 Contribution 0.98(O1O2) Resumen: E-040 UNIVERSIDAD NACIONAL DEL NORDEST E Comunicaciones Científicas y Tecnológicas 2004 c TSco Figura 1. o CONCLUSIONES Podemos concluir en este trabajo que la etapa determinante de la reacción que es la ruptura homolítica del enlace peroxídico OO, calculado por el método funcional de la densidad B3LYP con la base 3-21+G* describe perfectamente la energía de activación experimental. A partir de este resultado se seguirá con el cálculo de las siguientes etapas de la reacción de descomposición térmica. Bibliografía [1] Romero Jorge M.; Jorge, Nelly L., Gómez Vara, Manuel, E. Reunión de Comunicaciones Científicas y Técnicas 2004. [2] N. L. Jorge, L. C. A. Leiva, J. M. Romero y M. E. Gómez Vara, Revista Internacional Información Tecnológica. Vol. 13, N°2, 2002, ISSN 0716-8756. [3] “EXPERIMENTAL AND THEORETICAL STUDY OF THE HEAT OF FORMATION OF FORMALDEHYDE DIPEROXIDE” J. M. Romero, L. C. Leiva, N. L. Jorge, M. E. Gómez Vara and E. A. Castro. Acta Chimica Slovenica, 2003, Vol. 50 Nº 3, 579-585. [4] Jorge Nelly L., Leiva Laura C., Castellanos María G., Cafferata Lázaro F., Gómez Vara Manuel E., HernándezLaguna Alfonso .http://www1.unne.edu.ar/cyt/2002/cyt.htm. E036. [5] M. J. Frisch, G. W. Trucks, H. B. Schlegel, P. M. W. Gill,B. G. Johnson, M. A. Robb, J. R. Cheeseman, . A. Keith, G. A. Petersson, J. A. Montgomery, K. Raghavachari, M. A. Al-Laham, V. G. Zakrzewski, J. V. Ortiz, J. B. Foresman, J. Cioslowski, B. B. Stefanov, A. Nanayakkara, M. Challacombe, C. Y. Peng, P. Y. Ayala, W. Chen, M. W. Wong, J. L. Andrés, E. S. Replogle, R. Gomperts, R. L. Martín, D. J. Fox, J. S. Binkley, D. J. Defrees, J. Baker, J. P. Stewart, M. Head-Gordon, C. González and J. A. Pople, Gaussian 94, Revision A.1, Gaussian Inc., Pittsburgh, PA, 1995.