Microsoft Word - Introducci\\363n.doc - ramos on
Anuncio

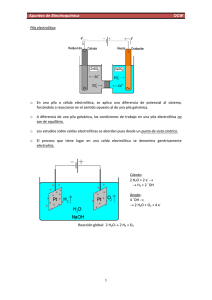
ELECTROQUÍMICA La electroquímica se ocupa del estudio de las transformaciones químicas originadas por el paso de la electricidad y de la producción de electricidad mediante transformaciones químicas. Es una de las ramas más antiguas de la química y el desarrollo de múltiples aplicaciones prácticas ha hecho que su utilidad aumente día a día. La electroquímica permite además comprender fenómenos tan diversos como la corrosión y refinación de metales, la transmisión de los impulsos nerviosos en animales y las interacciones de iones en solución, entre sí y con el solvente. PILAS GALVÁNICAS La pila electroquímica es un dispositivo que permite la ínter-conversión de energía química y eléctrica. Hay dos clases de pilas electroquímicas: las galvánicas, en las que la energía química se convierte en energía eléctrica, y las electrolíticas, en las que la energía eléctrica se convierte en energía química. En primer lugar se verá la operación de las pilas galvánicas. Reacción espontánea y pila galvánica. Se considera la reacción simple redox: Zn(s) + Cu2+ → Zn2+ + Cu(s) Es una reacción espontánea, como se puede demostrar colocando una barra de zinc metálico en una solución de sulfato cúprico. Inmediatamente comienza a formarse una capa de cobre metálico sobre la barra de zinc. En esta reacción el zinc se oxida y el cobre se reduce: Zn(s) + 2eZn(s) + Cu2+ Cu2+ → → → Zn2+ + 2eCu(s) Zn2+ + Cu(s) (oxidación) (reducción) (reacción neta) Para esta reacción ∆G0 es igual a – 212 kJ; este gran valor negativo indica una fuerte tendencia a transferir electrones del Zn metálico a los iones Cu2+, por lo menos cuando los reactivos y productos se encuentran en sus estados estándar (metales puros y concentraciones iónicas 1M). Si ahora se considera un sistema como el mostrado en la Figura 1, en el cual la barra de zinc está separada físicamente de la solución de sulfato de cobre. En este caso la barra de zinc está sumergida en una solución de sulfato de zinc y hay una barra de cobre sumergida en una solución de sulfato cúprico. Las dos barras están conectadas eléctricamente por medio de un Introducción Temas de Electroquímica Aplicada 1 alambre externo. Esta es una forma de pila galvánica o pila voltaica. Las dos mitades de la pila o compartimientos están separadas por una pared porosa. Las barras de zinc y cobre se llaman electrodos y constituyen las superficies en que se realizan las semi-reacciones de oxidación y reducción. Si los electrodos de zinc y cobre de la Figura 1 se conectan directamente a través de un circuito externo, los electrones abandonan el zinc metálico y se trasladan por el circuito externo al electrodo de cobre donde son recibidos en la superficie por los iones Cu2+. Estos iones se reducen a átomos de cobre y se depositan sobre la superficie del electrodo de cobre en un proceso llamado plaqueado. En esta pila el electrodo en que se realiza la oxidación se llama ánodo (electrodo de zinc). El electrodo en el cual se realiza la reducción se denomina cátodo (electrodo de cobre). En la práctica el cátodo puede hacerse de cualquier material inerte, pero que sea conductor eléctrico, como el platino o grafito. Figura 1. Pila galvánica con tabique poroso. La pared porosa de la pila sirve para mantener alejados los iones cúpricos del ánodo de zinc y, por lo tanto, evitar que los electrones se transfieran directamente del zinc a los iones cúpricos, sin pasar por el circuito externo. A medida que la reacción de la pila avanza, los iones de zinc se alejan del ánodo de zinc hacia el cátodo de cobre, lo mismo que los iones cúpricos. Los iones positivos se llaman cationes porque se dirigen hacia el cátodo. Los iones sulfato en cambio, se dirigen al ánodo de zinc y por consiguiente se llaman aniones. Si se coloca un voltímetro, marcado con una V en la Figura 1, en el circuito externo y éste tiene una resistencia eléctrica suficientemente alta, el paso de electrones por el circuito externo queda prácticamente detenido lo mismo que la reacción. El Introducción Temas de Electroquímica Aplicada 2 voltímetro mide la diferencia de potencial eléctrica, o voltaje, entre los dos electrodos, diferencia que se expresa ordinariamente en volts. La Figura 2 muestra otro método para construir una pila galvánica. En este método la pared porosa de la Figura 1 se ha reemplazado por un puente salino, o tubo en U relleno de una solución de cloruro de potasio. En este puente los iones Cl- se orientan hacia el ánodo y los iones K+ hacia el cátodo, a medida que la pila se descarga. Un puente salino realiza tres funciones; separa físicamente los compartimientos de los electrodos, provee continuidad eléctrica (camino para la migración de aniones y cationes) dentro de la pila y reduce el llamado potencial de unión líquido-líquido que es el voltaje producido cuando dos soluciones se ponen en contacto. Este voltaje se genera por las velocidades desiguales de migración de los aniones y cationes a través de la región de contacto, o unión. Un puente salino generalmente contiene iones que migran a velocidades casi iguales, minimizando así el potencial. La interpretación de los voltajes medidos en una pila se acerca más a la realidad, si no hay contacto líquido-líquido. En ambas versiones de la pila galvánica (Figuras 1 y 2) las reacciones de los electrodos y la total son las mismas. Estas pilas son versiones de la pila de Daniell, nombre dado a cualquier pila galvánica que utilice las reacciones anteriores. Figura 2. Pila galvánica con puente salino. Introducción Temas de Electroquímica Aplicada 3 Diagrama de pilas Las pilas galvánicas se representan comúnmente por medio de una notación abreviada llamada diagrama de pilas. El diagrama para la pila de Daniell es Zn(s)│ZnSO4(aq)│CuSO4(aq)│Cu(s) aquí las líneas verticales representan los límites o superficies de contacto de las fases. Por convención se acostumbra a escribir el ánodo a la izquierda del diagrama de la pila. Cuando existe un puente salino se indica por una doble línea. Zn(s)│ZnSO4(aq)││CuSO4(aq)│Cu(s) Algunas veces sólo se muestran los iones reactantes en las fases que corresponden a las soluciones Zn(s)│Zn2+││Cu2+│Cu(s) Electrodos en las pilas galvánicas Los cincos tipos más importantes de electrodos son: 1. 2. 3. 4. 5. Metal-ion metálico. Gas-ion. Metal-sal insoluble-anión. Elemento inerte-oxidación-reducción. De membrana. El electrodo metal-ion metálico consiste de un metal en contacto con sus iones en solución. Como ejemplo se considera una barra de plata inmersa en una solución de nitrato de plata. El diagrama de este electrodo si sirve como cátodo es Ag+│Ag(s) y la semi-reacción de electrodo es: Ag+ + e- → Ag(s) Cuando este electrodo hace las veces de ánodo, se diagrama del modo siguiente Ag(s) │ Ag+ y su semi-reacción es Ag(s) → Ag+ + e- Introducción Temas de Electroquímica Aplicada 4 El electrodo gas-ion usa un gas en contacto con su anión o catión en solución y el contacto eléctrico se realiza por medio de un metal inerte, generalmente platino. La Figura 3 muestra una manera de construir el electrodo hidrógeno-ion hidrógeno (llamado simplemente el electrodo de hidrógeno). El diagrama de este electrodo que funciona como cátodo es H+│H2(g)│Pt(s) y la semi-reacción es H+ + 2e- → H2(g) Figura 3. Electrodo de hidrógeno. En el electrodo metal-sal insoluble-anión, hay un metal que se halla en contacto con una de sus sales insoluble y también con una solución que contiene el anión de la sal; por ejemplo el electrodo de plata-cloruro de plata. Cl-│AgCl(s)│Ag(s) para el cual la semi-reacción es AgCl(s) + e- → Ag(s) + ClEn este electrodo, se cubre un alambre de plata con una pasta de cloruro de plata y se sumerge en una solución que contenga iones cloruro, como se muestra en la Figura 4. Introducción Temas de Electroquímica Aplicada 5 Figura 4. Electrodo de plata-cloruro de plata. El electrodo elemento inerte, oxidación-reducción consiste en una tira o un alambre de metal inerte como el platino, en contacto con una solución que contenga iones de una sustancia en dos estados de oxidación diferentes. Así el ion férrico, Fe3+ se reduce a ferroso, Fe2+ en este electrodo (actuando como cátodo). En este caso el diagrama es el siguiente: Fe3+, Fe2+│Pt(s) donde la coma indica que ambos iones se encuentran en la fase solución. Voltaje y espontaneidad Cuando se conecta un voltímetro a una pila galvánica, ésta muestra una diferencia de potencial eléctrico. A esta diferencia se le llama el voltaje producido por la pila y se le asigna un signo algebraico positivo. Este signo positivo indica que la reacción de la pila se cumple espontáneamente, La reacción de la pila de Daniell Zn(s) + Cu2+ → Zn2+ + Cu(s) ocurre espontáneamente, y en concentraciones iónicas de 1M a 25°C el voltaje medido es de + 1.10 volts. Este voltaje es una medida directa de la tendencia a realizarse que caracteriza a la reacción, o sea de su espontaneidad, ya se trate de una pila galvánica o no. Además se asocia un voltaje negativo con una reacción no espontánea. Así el voltaje para Cu(s) + Zn2+ → Cu2+ + Zn(s) es – 1.10 volts (en concentraciones iónicas 1M y a 25°C). Esto está de acuerdo con los hechos, ya que el cobre metálico no es oxidado por los iones de zinc. Introducción Temas de Electroquímica Aplicada 6 CELDAS ELECTROLÍTICAS La segunda clase de celda electroquímica es la electrolítica. En esta celda se utiliza la energía eléctrica de una fuente externa para producir una reacción química. Reacciones no espontáneas y celdas electrolíticas Considerando de nuevo la pila de Daniell Zn(s)│Zn2+││Cu2+│Cu(s) Si es una pila estándar (concentración iónica = 1M) produce un voltaje de 1.10 V, el electrodo de zinc es el ánodo, lo cual significa que los electrones tienden a abandonar la pila a través de este electrodo. Si ahora se supone que se conecta un voltaje externo a la pila de Daniell, de tal manera que se oponga al voltaje producido por la pila. Para lograr esto el voltaje externo se conecta negativo a negativo y positivo a positivo, a fin de que tienda a bombear los electrones dentro del ánodo de zinc y fuera del cátodo de cobre. Si el voltaje aplicado es menor que el voltaje de la pila, ésta aún se descarga espontáneamente. Ánodo Cátodo Pila Zn(s) 2+ Cu + 2eZn(s) + Cu2+ → → → Zn2+ + 2eCu(s) Cu(s) + Zn2+ Si el voltaje externo se hace igual al de la pila no habrá flujo de electrones y existirá un estado de equilibrio en cada electrodo. Finalmente, si el voltaje externo se hace mayor que el de la pila, los electrones entrarán al electrodo de zinc que se transformará en cátodo y abandonarán el electrodo de cobre, que se transformará en ánodo. Cátodo Ánodo Pila Zn(s) + 2eZn(s) + Cu2+ Cu2+ ← ← ← Zn2+ + 2eCu(s) Cu(s) + Zn2+ La pila es ahora una celda electrolítica. En ella se usa energía eléctrica para invertir una reacción termodinámicamente espontánea, es decir, para forzar la realización de una reacción no espontánea. Introducción Temas de Electroquímica Aplicada 7 Electrolisis En principio cualquier pila galvánica puede convertirse en una celda electrolítica, conectándola a un voltaje externo opuesto que sea mayor que el producido por ella. En la práctica, la reacción inversa a la pila puede no ocurrir debido a efectos de velocidad. Considerando la pila galvánica Pt(s)│H2(g)│H+, Cl-│Cl2(g)│Pt(s) Si la concentración del HCl es 1M y la presión de los gases 1 atm, la celda opera como una pila galvánica y produce un voltaje de 1.36 V. Los procesos que ocurren dentro de la pila son: Ánodo Cátodo Pila H2(g) Cl2(g) + 2eH2(g) + Cl2(g) → → → 2H+ + 2e2Cl2H+ + 2Cl- Esta reacción es espontánea en la dirección descrita, pero puede invertirse aplicando un voltaje mayor de 1.36 V. Esto causa las reacciones opuestas. Cátodo Ánodo Pila 2H+ + 2e2Cl2H+ + 2Cl- → → → H2(g) Cl2(g) + 2eH2(g) + Cl2(g) El efecto total es convertir el HCl disuelto en H2 y Cl2 gaseosos. Este es un ejemplo de electrolisis, proceso en el que una reacción no espontánea (∆G > 0), es forzada a realizarse debido a la aplicación de energía de un circuito externo. La electrolisis comienza sólo cuando el voltaje aplicado excede al de la pila. Este voltaje se conoce como voltaje de descomposición de la solución. Algunas veces este voltaje debe ser mayor que el producido por la pila galvánica opuesta, lo cual se explica por efectos de velocidad en los electrodos o en la solución, en los que la baja difusión de los iones hacia los electrodos puede necesitar la aplicación de un voltaje más alto que el termodinámico para producir la electrolisis. Electrolisis de cloruro de sodio acuoso Si se considera ahora la celda electrolítica que muestra la Figura 5 que contiene una solución acuosa de NaCl y dos electrodos inertes. Introducción Temas de Electroquímica Aplicada 8 Figura 5. Electrolisis de NaCl acuoso. En esta celda existen varias posibilidades en las reacciones del ánodo y del cátodo. Posibles reacciones anódicas (oxidación) → Cl2(g) + 2e2ClH2O → O2(g) + 4H+ + 4e→ O2(g) + H2O + 4e4OHPosibles reacciones catódicas (reducción) → Na(s) Na+ + e2H2O + 2e → H2(g) + 2OH2H+ + 2e→ H2(g) En la práctica, se observa producción de cloro gaseoso en el ánodo; por lo tanto la reacción del ánodo es: 2Cl- → Cl2(g) + 2eEn el cátodo se forma hidrógeno gaseoso; por lo que se reduce el H+ o el H2O. Ya que la concentración de moléculas de H2O en el NaCl acuoso es mucho mayor que la de los iones H+, la reacción del cátodo usualmente se escribe como: 2H2O + 2e- → H2(g) + 2OHEn resumen se tiene: Ánodo Cátodo Pila 2Cl2H2O + 2e2H2O + 2Cl- Introducción → → → Cl2(g) + 2eH2(g) + 2OHH2(g) + Cl2(g) + 2OHTemas de Electroquímica Aplicada 9 Leyes de Faraday A principios del siglo diecinueve Michael Faraday desarrolló los principios cuantitativos ahora conocidos como leyes de la electrolisis de Faraday. Estas son: 1) La cantidad de sustancia producida por la electrolisis es proporcional a la cantidad de electricidad empleada. 2) Las masas de diferentes sustancias producidas por la misma cantidad de electricidad son proporcionales al peso equivalente de las varias sustancias. Estas leyes son simple consecuencia de la naturaleza eléctrica de la materia. Por el principio de continuidad de la corriente eléctrica los electrones deben descargarse en el cátodo a exactamente la misma velocidad con que son suministrados por el ánodo. El equivalente redox se define como la cantidad de sustancia que acepta o suministra un mol de electrones. Por lo tanto en una celda electrolítica el número de equivalentes producidos por la reacción de cada electrodo debe ser igual al número de electrones transportados en el circuito. La carga de un mol de electrones se denomina un faraday (F) y es equivalente a 96500 coulombs. Si por un conductor eléctrico pasa un coulomb de electricidad en un segundo, se dice que el conductor transporta una corriente eléctrica de un ampere. Es decir un ampere es igual a un coulomb por segundo. Problema Se electroliza una solución de sulfato de cobre CuSO4, usando electrodos inertes. Calcule los gramos de cobre metálico y de oxígeno gaseoso producidos si una corriente de 5.0 A fluye a través de la celda durante 1.5 h. Solución Ya que las semi-reacciones de los electrodos se pueden interpretar en términos de faraday de electricidad se debe calcular primero cuantos faraday fluyen a través de la celda. Cantidad de carga = = 5.0 C/s × 3600 s/h × 1.5 h 2.7×104 C y como hay 96500 coulomb en un faraday Cantidad de carga Introducción = 2.7×104 C÷96500 C/F = 0.28 F Temas de Electroquímica Aplicada 10 Las semi-reacciones de los electrodos son: Cátodo: Cu2+ + 2e-→ Cu(s) Para producir 1 mol de Cu(s) se requieren 2F Cantidad de cobre producido Ánodo: = = 0.28 F × 63.5 g ÷ 2F 8.9 g 2H2O →O2(g) + 4H+ + 4e- Según esta semi-reacción un mol de O2 requiere el paso de 4F, luego: Cantidad de O2 producido = = 0.28 F × 32.0 g ÷ 4F 2.2 g Potenciales estándar de electrodo Como el voltaje asociado con una reacción dada es una medida de la tendencia de esa reacción a realizarse, sería útil tener un conjunto de voltajes para diferentes semi-reacciones, las cuales se podrían entonces combinar para dar los voltajes de un gran número de reacciones redox. Desgraciadamente, no es posible medir directamente el voltaje producido en la celda por un solo electrodo. La solución del problema es escoger un electrodo de referencia y asignarle arbitrariamente algún voltaje. Entonces se puede asignar voltaje a cualquier otro electrodo, midiendo simplemente el producido por una celda que utilice el electrodo en cuestión más el de referencia. El electrodo de referencia escogido por convenio internacional es el electrodo estándar de hidrógeno. El electrodo estándar de hidrógeno Un electrodo estándar es aquel en que todos los reactantes y productos de la semireacción del mismo se encuentran en sus estados estándar. El estado estándar de un ion en solución es aquel en que la actividad del ion se define como la unidad. Es el ion a una concentración 1M, en una solución ideal. Como de costumbre, se aproximarán las actividades a las concentraciones, a fin de que el estado estándar del ion llegue a ser, efectivamente, el ion a una concentración 1M. De esta manera, el electrodo estándar de hidrógeno, a menudo abreviado e.s.h., es: Pt(s)│H2(g, 1 atm.)│H+ (1M) El potencial o voltaje, arbitrariamente asignado al e.s.h. es 0.000 V. De este modo, si se usa E para representar el voltaje EºH2 = 0, donde el superíndice indica Introducción Temas de Electroquímica Aplicada 11 “estándar”. Esto quiere decir que cuando se construye una celda con el e.s.h., más algún otro electrodo estándar (todos los reactantes y productos en sus estados estándar), el potencial medido se asigna solamente al otro electrodo. Problema Un electrodo estándar cobre-ion cobre, se combina con un e.s.h. para hacer una celda. El voltaje de ésta se mide como 0.34 V a 25ºC, y se encuentra que los electrones entran al circuito externo por el electrodo de hidrógeno. ¿Cuál es el potencial del electrodo estándar cobre-ion cobre? Solución Ya que los electrones abandonan la celda por el electrodo de hidrógeno, éste debe ser el ánodo. El diagrama de la celda y las reacciones son, por consiguiente, Pt(s)│H2(g)│H+││Cu2+│Cu(s) Ánodo Cátodo Celda H2(g) 2+ Cu + 2eH2(g) + Cu2+ → → → 2H+ + 2eCu(s) 2H+ + Cu(s) Eº = 0 (definido) Eº = ? Eº = 0.34 (medido) Puesto que Eºcelda = Eºánodo + Eºcátodo, claramente EºCu = Eºcelda - EºH2 = 0.34 – 0 = 0.34 V Ya que una reacción anódica es una oxidación, el potencial producido en tal electrodo se llama potencial de oxidación. Del mismo modo, el potencial producido en el cátodo se conoce como potencial de reducción. Cualquiera de los dos podría tabularse, pero por convenio internacional se ha escogido el último (ver Tabla 1) Introducción Temas de Electroquímica Aplicada 12 Tabla 1. Potenciales estándar de reducción. Nótese que en esta Tabla 1 cada semi-reacción se escribe como una reducción. Para hallar el potencial de la semi-reacción inversa, la oxidación basta cambiar el signo del voltaje dado. Una tabla de potenciales estándar de reducción se puede usar para (1) predecir el voltaje que una determinada pila galvánica puede producir, (2) predecir la espontaneidad de una reacción redox dada; (3) comparar las fuerzas relativas de los agentes oxidantes y (4) comparar las fuerzas relativas de los agentes reductores. La predicción de los voltajes de una pila se lleva a cabo sumando los potenciales estándar de las semi-reacciones tal como suceden en la pila. De esta manera, es necesario sumar el potencial de una semi-reacción de oxidación con la de reducción que forma par con ella. Introducción Temas de Electroquímica Aplicada 13 Problema Calcule el voltaje producido por una pila galvánica en la reacción, Ag+ + Cr2+ → Ag(s) + Cr3+ suponiendo que todas las concentraciones iónicas son 1M. Solución Primero se separa la reacción de la pila en semi-reacciones Ánodo Cátodo Cr2+ Ag+ + e- → → Cr3+ + eAg(s) Luego se le asigna un voltaje a cada uno, usando los valores de la Tabla 1, y se suma Ánodo Cátodo Pila Cr2+ Ag+ + eAg+ + Cr2+ → → → Cr3+ + eAg(s) Ag(s) + Cr3+ Eº = + 0.41 V Eº = + 0.80 V Eº = + 1.21 V Note que se ha cambiado el signo de la semi-reacción del cromo porque se trata de una oxidación. Problema Halle el voltaje estándar producido por la pila Pt(s)│Fe2+, Fe3+││Cl-│Cl2(g)│Pt(s) Solución Las semi-reacciones y sus voltajes (de la Tabla 1) son Ánodo Cátodo Pila 2×[Fe2+ Cl2(g) + 2e2Fe2+ + Cl2(g) → → → Fe3+ + e-] 2Cl2Fe3+ + 2Cl- Eº = - 0.77 V Eº = + 1.36 V Eº = + 0.59 V La pila producirá por lo tanto 0.59 V. Observe que aunque fue necesario multiplicar por 2 la semi-reacción del ánodo en la anterior pila, análogamente no se multiplica su potencial de oxidación. El voltaje Introducción Temas de Electroquímica Aplicada 14 producido en una pila es independiente de las cantidades de reactantes y de productos. Esto es así, porque la ocurrencia de la reacción en la pila depende de la naturaleza y el estado de sus reactantes y productos, no de cuanto reactante o producto están presentes. Como se explicó anteriormente, un voltímetro apropiadamente conectado al circuito externo de una pila galvánica marca un voltaje positivo. En otras palabras, un voltaje positivo se asocia con una reacción espontánea. Predecir la espontaneidad de una reacción redox es cuestión de añadir los potenciales apropiados de oxidación y de reducción. Un total positivo indica que la reacción es espontánea, uno negativo, que no es espontáneo. Problema Predecir si puede o no ocurrir la siguiente reacción (todos los reactantes están en su estado estándar). Sn2+ + 2I- → Sn(s) + I2 Solución Sumando el potencial de oxidación con el de reducción (Tabla 1), se tiene: Oxidación Reducción Redox 2ISn2+ + 2eSn2+ + 2I- → → → I2 + 2eSn(s) Sn(s) + I2 Eº = - 0.54 V Eº = - 0.14 V Eº = - 0.68 V Ya que el total es negativo, la reacción no es espontánea; no puede ocurrir. La reacción inversa Sn(s) + I2 → Sn2+ + 2Ise predice como espontánea, porque para ella Eº es + 0.68 V. Pero, realmente no es necesario obtener el valor de Eº a fin de predecir la espontaneidad de una reacción. A fin de que la suma de los potenciales de oxidación y reducción sea positiva, la semi-reacción de oxidación (signo cambiado) debe estar por encima de la semi-reacción de reducción de la tabla. La fuerza relativa de los agentes oxidantes y reductores puede hallarse rápidamente a partir de una tabla de potenciales estándar de reducción. Como los voltajes se vuelven más positivos a medida que se desciende en la tabla, la tendencia para que ocurra la reducción es más fuerte abajo que arriba. Así los Introducción Temas de Electroquímica Aplicada 15 agentes oxidantes (a la izquierda) se vuelven más fuertes a medida que se desciende. Como la tendencia a la reducción aumenta descendiendo en la tabla, la tendencia a la reacción inversa, la oxidación, disminuye. De este modo, los agentes reductores se hacen más débiles descendiendo en la tabla, y más fuertes subiendo en ella. Ejemplos: El Cr3+ es un agente oxidante más fuerte que el Zn2+; el Zn(s) es un agente reductor más fuerte que el Cr(s). Energía libre, voltaje de la pila y equilibrio Se puede demostrar que la disminución de la energía libre, en un proceso que se desarrolla a temperatura y presión constantes, es igual a la máxima cantidad de trabajo teórico, diferente al de expansión, que puede realizar el proceso. En el caso de una reacción que se lleve a cabo en una pila galvánica, el máximo trabajo eléctrico wmax,elect que puede desarrollarse, es igual al voltaje E producido por la pila, multiplicado por la cantidad de carga eléctrica Q que pasa por medio del circuito externo hacia el aparato que va a producir el trabajo (un motor, por ejemplo). En otras palabras, wmax,elect = E×Q Si n es igual al número de moles de electrones (faradays) transferidos cuando la reacción se interpreta en términos de moles. wmax,elect = E×nF Como se postuló antes, esto es igual a la disminución de energía libre a medida que la reacción se realiza. - ∆G = wmax,elect = E×nF o ∆G = - nFE Aquí F, llamada constante de Faraday, es el número de coulombs por faradays, 9.65×104 CF-1. Esta ecuación es el importantísimo puente entre el cambio de energía libre de la termodinámica y el voltaje de una pila de la electroquímica. Pone de manifiesto el hecho de que cualquiera de las dos cantidades puede usarse para predecir la espontaneidad de una reacción redox. En el caso particular en que reactantes y productos se encuentran en sus estados estándar, la relación se transforma en ∆Gº = - nFEº Introducción Temas de Electroquímica Aplicada 16 Problema Calcule ∆Gº para la reacción 8H+ + MnO4- + 5Ag(s) → Mn2+ + 5Ag+ + 4H2O Solución De la Tabla 1 se obtienen los valores de Eº para las semi-reacciones 5e- + MnO4- + 8H+ 5×[Ag(s) 8H+ + MnO4- + 5Ag(s) → → → Mn2+ + 4H2O Ag+ + e-] Mn2+ + 5Ag+ + 4H2O Eº = + 1.51 V Eº = - 0.80 V Eº = + 0.71 V En este caso n, el número de moles de electrones transferidos (faradays) en la reacción, tal como aparece escrita, en 5, como se puede comprobar a partir de las ecuaciones de las semi-reacciones. ∆Gº = - nFEº - (5F)( 9.65×104 CF-1)(0.71 V) = - 3.4×105 J Efectos de la concentración sobre el voltaje de la pila (ecuación de Nernst). El voltaje producido por una pila galvánica depende de las concentraciones (o en forma más rigurosa de las actividades) de los reactantes y productos. Esta dependencia se puede predecir cuantitativamente como sigue. El cambio de energía libre, ∆G, de una reacción y el cambio estándar de la misma, ∆Gº están relacionados por ∆G = ∆Gº + RT lnQ donde Q es la expresión de la acción de las masas de la reacción. Se ha visto que ∆G = - nFE y ∆Gº = - nFEº Así para una reacción redox se tiene: - nFE = - nFEº + RT lnQ o E = E º− RT ln Q nF Esta ecuación se denominó de Nernst, en honor del científico Walter Nernst, quien la desarrolló en 1889. Se puede simplificar para aplicarla a 25ºC sustituyendo Introducción Temas de Electroquímica Aplicada 17 R = 8.413 JK-1mol-1 T = 298.2K F = 96485 Cmol-1 y ln = 2.303 log de modo que a 25ºC 0.0592 log Q n E = E º− Con la ecuación de Nernst se puede calcular el voltaje producido por cualquier pila, conociendo los valores de Eº de sus electrodos y las concentraciones apropiadas (presiones parciales, en el caso de gases). Problema Calcule el voltaje producido por la pila Sn(s)│Sn2+││Ag+│Ag(s) Si [Sn2+] = 0.15M y [Ag+] = 1.7M. Solución Las reacciones de la pila y los valores de Eº (Tabla 1) son Ánodo Cátodo Pila Sn(s) [e + Ag+ Sn(s) + 2 Ag+ → → → Sn2+ + 2eAg(s)]×2 Sn2+ + 2 Ag(s) Eº = - 0.15 V Eº = + 0.80 V Eº = + 0.65 V La expresión de acción de masas Q en esta reacción es Q= aSn 2+ 2 a Ag + Aquí se ha omitido la actividad de los sólidos puros Sn y Ag porque son la unidad. Considerando que la actividad de los iones se puede aproximar a sus concentraciones, se tiene: [Sn ] [Ag ] 2+ Q= + 2 Introducción Temas de Electroquímica Aplicada 18 De esta manera, la ecuación de Nernst en esta reacción es E = E º− [ ] [ ] 0.0592 Sn 2 + log 2 2 Ag + Nota: en esta ecuación n = 2, porque en ella, tal como está escrita, el número de faradays de electricidad que pasan cuando los reactantes forman los productos es 2. E = +0.65 V − 0.0592 V 0.15 log 2 (1.7 )2 = +0.65V + 0.038V = +0.69V La variación de las concentraciones iónicas de 1M no afectó mucho el E de la pila, como ocurre a menudo. El hecho de que E sea más positivo que Eº indica que con estas concentraciones la reacción de la pila tiene una mayor tendencia a realizarse que con concentraciones 1M. Potenciales estándar y constantes de equilibrio Cuando un sistema reactante se halla en equilibrio, ∆G = 0. Además, cuando tal sistema es parte de una pila galvánica, E para la pila es cero, puesto que no existe tendencia a que la reacción prosiga en un sentido o en el otro. En el equilibrio la ecuación de Nernst es 0 = E º− RT ln K nF Como en el equilibrio Q = K, la constante de equilibrio. Así Eº = RT ln K nF que a 25ºC se simplifica como E º = 0.0592 log K n Esto permite calcular Eº a partir de K, o viceversa. Introducción Temas de Electroquímica Aplicada 19 Problema Calcule el valor de la constante de equilibrio para la reacción dada en el ejemplo anterior Solución Para la reacción se encontró que Eº = + 0.65V y n = 2; así 0.0592 log K n nE º 2(0.65) log K = = = 22 0.0592 0.0592 K = 9.1×1022. Eº = Introducción Temas de Electroquímica Aplicada 20