Se escribe la ecuación en forma iónica y se identifican las especies
Anuncio

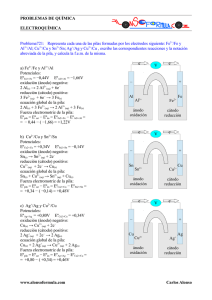
Ejercicio 2 - (1999-00). Dados los potenciales normales de reducción εº (Pb2+/Pb) = – 0’13 V y εº (Cu2+/Cu) = 0’34 V a) Escriba las semirreacciones y la reacción ajustada de la pila formada. b) Calcule su fuerza electromotriz e indique qué electrodo actúa como ánodo y cuál como cátodo. a) Para saber en qué electrodo se produce la oxidación y en cuál la reducción, hay que tener en cuenta que se producirá la reducción en el que tenga un potencial normal de reducción mayor; en este caso, es el electrodo de cobre que, de esta manera, actúa como oxidante. Por tanto, en el electrodo de plomo se producirá la oxidación. Las semirreacciones que tienen lugar en la pila formada serán: Pb2+ Semirreacción de oxidación: Pb – 2 e- Semirreacción de reducción: Cu2+ + 2 e- Cu La reacción ajustada se obtiene sumando las dos semirreacciones; como el número de electrones es el mismo, simplemente hay que sumarlas: Pb + Cu2+ Reacción global de la pila: Esta pila se puede representar simbólicamente como: Pb2+ + Cu Pb | Pb+2 (ac) || Cu+2 (ac) | Cu 0’47 V b) Sabiendo que el electrodo que actúa como cátodo e- es, siempre, en el que se produce la reducción; el electrodo de cobre es, en este caso, el cátodo de la Puente salino K+ Cl- ÁNODO pila. eCÁTODO Y el ánodo, por tanto, es el electrodo de plomo que es donde se produce la oxidación. Pb Cu En la figura de la derecha se muestra la pila de forma esquemática. Pb2+ Cu2+ La fuerza electromotriz se calcula a partir de la siguiente expresión: εºpila = εºred-cátodo – εºoxi-ánodo εºpila = εºCu2+/Cu – εºPb2+/Pb = 0’34 V – (– 0’13 V) = + 0’47 V Que el signo de la fem salga positivo es una prueba de que la reacción global propuesta es la correcta, ya que la reacción de la pila debe ser espontánea (ΔG < 0) y como ΔG α -εºpila, significa que la reacción de la pila propuesta es espontánea.