Tipos de reacciones químicas.
Anuncio

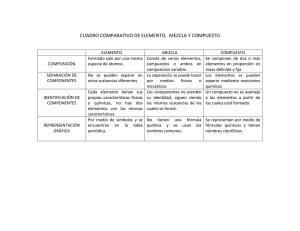
Tipos de reacciones químicas. Imagen esquemática de un átomo. El núcleo denso, cargado positivamente, contiene la mayor parte de la masa del átomo. Los electrones son mucho más ligeros y cargados negativamente, se desplazan alrededor del núcleo de acuerdo a las leyes de la mecánica cuántica. Como no se puede predecir exactamente la ubicación del electrón en un instante determinado, los electrones se representan como una nube continua. La densidad del sombreado de la nube indica la probabilidad de que los electrones se encuentren en la zona. El diámetro de la nube electrónica puede ir de 0.1nm (para el hidrógeno) hasta 0.4nm (para átomos de elevado número atómico). Por ejemplo, el núcleo del átomo de carbono es mucho más pequeño, de alrededor de 2x10–5 nm. El núcleo del hidrógeno está compuesto por un solo protón. Generalmente la masa de un átomo o de una molécula se expresa en daltons, que es la unidad de masa atómica (uma), aproximadamente igual a la masa de un átomo de hidrógeno. El átomo tiene en su centro un núcleo formado por protones cargados positivamente el número de protones determina el número atómico) y neutrones que son eléctricamente neutros. El núcleo está cargado positivamente y rodeado por una nube de electrones cargados negativamente. El átomo es eléctricamente neutro, el número de protones es igual al número de electrones que rodean al núcleo. El número atómico determina el comportamiento químico de un elemento químico. Los neutrones son partículas subatómicas sin carga que tienen esencialmente la misma masa que los protones. Contribuyen a la estabilidad estructural del núcleo (si hay demasiados o muy pocos puede sufrir desintegración radiactiva) pero no alteran las propiedades químicas del átomo. Así, un elemento químico puede existir en formas físicamente diferenciables pero químicamente iguales, llamadas isótopos. Dos isótopos tienen un número diferente de neutrones pero el mismo número de protones. En la naturaleza se encuentran muchos isótopos de casi todos los elementos químicos, algunos de los cuales son inestables (radiactivos). Por ejemplo, en la Tierra el isótopo más estable del carbono es el carbono 12 (12C), con 6 protones y 6 neutrones, también se encuentra la forma radiactiva carbono 14 (14C), con 6 protones y 8 neutrones. En arqueología se usa la desintegración radiactiva del carbono 14 como técnica de datación de material orgánico. http://images.slideplayer.es/8/1872966/slides/slide_2.jpg Los electrones más externos determinan la manera en que interactúan los átomos. Los protones y los neutrones están enlazados firmemente unos a los otros en el núcleo y sólo se separan en condiciones extremas como en el interior del sol, en un reactor nuclear y por desintegración radiactiva. Los electrones están en continuo movimiento alrededor del núcleo del átomo y cumplen diferentes leyes que determinan que los electrones de un átomo sólo pueden existir en estados de movimiento determinados y restringidos llamados órbitas o niveles discretos u orbitales electrónicos. Existe un límite estricto del número de electrones que puede ocupar cada tipo de orbital. Los electrones, en promedio, más cercanos al núcleo positivo son atraídos con mayor fuerza hacia él y ocupan el orbital más interno y más intensamente atraído. Este orbital puede estar ocupado por un máximo de 2 electrones. El segundo orbital está más alejado del núcleo y sus electrones están unidos con menos intensidad, contiene 8 electrones. Así sucesivamente. Puede usarse 2n2 y más correctamente la distribución electrónica con base en los llamados números cuánticos. La disposición de los electrones de un átomo es estable cuando todos los electrones se encuentran en las posiciones permitidas, es decir, los orbitales más internos. Un átomo cuyo orbital más externo esté ocupado por el número máximo de electrones permitido es especialmente estable y por lo tanto químicamente poco reactivo. Ejemplo, los llamados gases inertes. El número de electrones que un átomo puede ceder o ganar (compartiéndolos o transfiriéndolos) para completar el orbital más externo se le llama valencia. Las propiedades químicas de un átomo están determinadas por el número y la disposición de sus electrones. La estabilidad de un átomo es máxima cuando todos sus electrones se encuentran en el mínimo nivel de energía posible y cuando cada uno de sus orbitales electrónicos está completo. Entre dos átomos se forma un enlace químico cuando los electrones se desplazan logrando una disposición más estable. Los grupos de dos o más átomos unidos entre sí por enlaces químicos se llaman moléculas. Reacción química: Interacción entre la materia y la energía provocando ruptura de enlaces, reacomodo de átomos y formación de nuevos enlaces químicos. Hay dos tipos de sustancias químicas puras y son los elementos químicos y los compuestos químicos. Los elementos químicos están formados por un solo tipo de átomos, que son las formas fundamentales de la materia y constituyen toda la materia existente. Los elementos químicos son las unidades estructurales fundamentales de la materia, por lo que es importante comprender sus propiedades físicas y químicas. Cada elemento químico tiene un nombre y un símbolo. El símbolo se deriva del nombre y algunos derivan del nombre en latín. Debido a que los elementos químicos se aislaron e identificaron a lo largo de varios siglos, los nombres y símbolos tienen un origen histórico. Por ejemplo, Sb de stibium, antimonio; Fe de ferrum, fierro; Hg de hydrargyrum, mercurio; Na de natrium, sodio; etc. Los elementos químicos se combinan y forman compuestos químicos. Los elementos químicos tienen propiedades características que los identifican y al formar el compuesto pierden sus propiedades iniciales para producir otras totalmente diferentes. La formación o la descomposición de los compuestos son cambios que se efectúan mediante procesos químicos. Los compuestos químicos son sustancias puras que están formados por la combinación de átomos diferentes o de la misma especie química. Tienen composición definida o específica y propiedades características que los identifica. En determinadas condiciones pueden separarse en los elementos químicos que lo constituyen. Los compuestos siempre contienen los mismos elementos químicos y las mismas cantidades relativas. Fórmula química de un compuesto. La fórmula de un compuesto químico representa la forma simbólica de un compuesto químico en donde se indica: - los diferentes átomos presentes en un compuesto determinado. - los números relativos de los diferentes átomos presentes en el compuesto. Una fórmula química unitaria de un compuesto es la representación de la menor combinación de átomos que forman un compuesto químico, por ejemplo, la fórmula del éter etílico o éter de petróleo es C4H10O indica que está constituido por 4 átomos de carbono, 10 átomos de hidrógeno y 1 átomo de oxígeno o también se puede interpretar como que 1 mol de C4H10O tiene 4 moles de C más 10 moles de H más 1 mol de O. También se utiliza la fórmula semidesarrollada que indica los enlaces químicos entre los átomos como por ejemplo para el éter etílico: CH3–CH2–O–CH2–CH3. Para determinar la fórmula química de un compuesto químico específico se hace a partir del análisis químico de los elementos químicos que lo forman y para ello es importante determinar tanto los átomos que constituyen al compuesto en estudio como sus cantidades y luego se calcula la composición porcentual de cada uno de los constituyentes. Es importante recordar que al escribir una fórmula química se está representando las proporciones equivalentes en que se combinan los elementos o los radicales químicos en un compuesto. Por ejemplo, los elementos químicos o los radicales monovalentes se combinan con otros elementos o con radicales (a) monovalentes en la relación 1:1, como en el cloruro de sodio, NaCl, o el acetato de amonio, CH3-COO-NH4; (b) divalentes en la relación 2:1, como en el sulfato sódico, Na2SO4, o el oxalato de amonio, C2O4NH4; (c) trivalentes en la relación 3:1, como en el tricloruro férrico, FeCL3, o el ácido fosfórico, H3PO4; tetravalentes en la relación 4:1, cloruro estánico, SnCl4, o el acetato plúmbico, (CH3-COO)4Pb. Los elementos o radicales químicos divalentes se combinan con otros elementos o radicales (a) divalentes en la relación 1:1, como en el sulfato de magnesio, MgSO4, o el oxalato de calcio, Ca(COO)2, (b) trivalentes en la relación 3:2, como en el fosfato de calcio, Ca3(PO4)2, o en el sulfato de aluminio, Al2(SO4)3, etc. Para las sales neutras la regla que se usa es, dividir el mínimo común múltiplo de las valencias de los dos iones por la valencia de cada ión y el valor resultante se escribe como subíndice para indicar la relación en que se combinan los dos iones en la sal, cuando el mínimo común denominador es 1 no se escribe. Por ejemplo, en el sulfato férrico, el ión férrico tiene valencia +3 y el ión sulfato tiene valencia – 2, el mínimo común múltiplo es 6, por lo que su fórmula es Fe2(SO4)3. Para aplicar esta regla se requiere saber las valencias de los iones positivos y negativos. Para compuestos complejos como sales ácidas, sales básicas y sales dobles se debe interpretar la regla. El acetato básico de plomo, el plomo tiene valencia +4 y el ión acetato y oxhidrilo – 4, Pb(C2H3O2)2. Pb(OH)2 o Pb2(C2H3O2)2(OH)2; en el alumbre férrico, (NH4)2SO4.Fe2(SO4)3 o (NH4)Fe(SO4)2, las valencias positivas son +4 y las negativas son – 4, por lo que resulta una molécula neutra. La fórmula química es la representación de los compuestos químicos e indican los elementos químicos en la proporción en que se combinan para formar al compuesto. Ejemplos, hidróxido de sodio en fase sólida NaOH(S); óxido de hidrógeno (agua) en fase líquida H2O(l); óxido de magnesio MgO(S); y carbonato de potasio K2CO3. También se usan fórmulas en las que se representan los electrones que forman los enlaces químicos o en las que se representa por líneas los enlaces químicos mediante los cuales se forma el compuesto. La fórmula empírica (simple) expresa la relación más simple con números enteros del número de átomos de los distintos elementos químicos (su símbolo) que conforman a un compuesto químico. La fórmula molecular indica el símbolo y el número de átomos diferentes que integran a la molécula, es decir, indica la composición química de un compuesto. La fórmula empírica y la molecular pueden ser iguales. La fórmula química indica el número de átomos de cada tipo que forman la molécula, pero no expresa el tipo de enlace químico ni el orden en que se enlazan los átomos en la molécula. La fórmula estructural indica cómo están enlazados químicamente los átomos en la molécula. http://www.heurema.com/DFQ20.htm http://www.heurema.com/DFQ20.htm Como la fórmula química representa de un elemento o de un compuesto el número y la clase de los átomos que lo constituyen, entonces se puede usar para determinar los porcentajes en masa de los elementos químicos del compuesto. http://www.genomasur.com/BCH/BCH_libro/imagenescap_1/h.JPG Peso atómico. Es la masa atómica promedio de un elemento químico. Número de masa = Número de protones + número de neutrones. Número atómico = Número de protones que contiene un átomo = número de electrones. El peso fórmula de un compuesto es la suma de las masas atómicas de los elementos químicos de la fórmula, multiplicada por el número de veces en que está presente el elemento químico. Es la masa en unidades de masa atómica (uma) de una fórmula unitaria. La masa molecular (MM) o peso molecular (PM) se emplea cuando se refiere a compuestos moleculares (no iónicos), es decir, cuando las sustancias pueden existir como moléculas discretas. Formas alotrópicas de los elementos químicos. Son las diferentes formas del mismo elemento químico que presentan en el mismo estado físico. Ejemplo, el carbono, el grafito y el diamante. Ecuaciones químicas. Toda ecuación química correctamente escrita y balanceada establece relaciones cuantitativas entre los reactivos y los productos. Expresa las cantidades o proporciones medibles de todos y cada uno de los constituyentes. El fundamento de las relaciones cuantitativas expresadas en una ecuación química fue establecido en la segunda mitad del siglo XVIII por el químico francés Antoine Laurent Lavoisier (26-VIII-1743-8-V-1794). Con el uso de la balanza en el estudio de innumerables reacciones químicas descubrió que la suma de las masas de los reactivos es igual a la suma de las masas de los productos. Es decir, en toda reacción química la masa no se crea ni se destruye, solamente se transforman unas sustancias en otras. Escribir una ecuación química, requiere de un proceso de análisis y de síntesis, además de saber qué es lo ocurre en la reacción química. Se deben identificar a los reactivos y a los productos, conocer sus símbolos, fórmulas y su estado físico. Además se escribe una flecha con dirección hacia la derecha, , después de los reactivos, para indicar que los reactivos se transforman en productos, y una flecharon dirección hacia la izquierda, , después de los reactivos, para indicar que los productos también se transforman en reactivos. Estas reacciones químicas se llaman reacciones reversibles. Para establecer una ecuación química se requiere conocer la fórmula de las sustancias que reaccionan y de los productos que se forman en la reacción química. También se aplican las leyes de las proporciones definidas, la de las proporciones múltiples y la de la conservación de la masa. La ecuación química es la expresión algebraica que representa a un proceso químico como la reacción química, en ella los coeficientes indican el número de moléculas o de moles que participan en la reacción química y los subíndices indican el número de átomos que constituyen al compuesto y las letras de los subíndices indican la fase en la que se encuentra el compuesto respectivo. Pasos para escribir una ecuación química. 1. Escribir las fórmulas correctas o los símbolos de los reactivos y de los productos, separados por una flecha dirigida hacia los productos (usando subíndices). Para que se cumpla con la ley de Proust. 2. Balancear la ecuación química (usando coeficientes). Para que esté de acuerdo con la ley de la conservación de la masa (Lavoisier). 3. Indicar el estado físico (usando letras como subíndices, s = sólido, l = líquido, v = vapor, g = gas y aq o ac = solución acuosa). Por ejemplo, para la reacción química entre el monóxido de nitrógeno (gas) y el oxígeno (gas) que se transforman en dióxido de nitrógeno (gas marrón rojizo). 1a. Se recomienda empezar por escribir con el nombre químico los reactivos, luego una flecha hacia la derecha y enseguida los productos. 1b. Sustituir con el símbolo o la fórmula química que corresponda, indicando con subíndices entre paréntesis la fase de cada componente. Monóxido de nitrógeno + oxígeno dióxido de nitrógeno. NO(g) + O2(g) NO2(g). 2. Para terminar de escribir la ecuación química es necesario que esté balanceada. Para hacerlo sólo se permite usar coeficientes, no es válido usar subíndices ni sumar elementos faltantes. Al analizar la ecuación química anterior se observa que hay más átomos de oxígeno en los reactivos que en los productos, lo que indica que no está balanceada la ecuación. También se observa que una molécula de NO reacciona con un átomo de oxígeno, por lo que es necesario escribir un 2 como coeficiente del NO y otro 2 como coeficiente del NO2. Por lo que resulta: 2 NO + O2 2 NO2. A los coeficientes necesarios para ajustar una ecuación química se llaman coeficientes estequiométricos. Las leyes de las proporciones definidas, la de las proporciones múltiples y la de la conservación de la masa son leyes fundamentales para expresar la composición en las fórmulas y en las ecuaciones químicas. Por eso es importante familiarizarse con la escritura de las fórmulas, las ecuaciones químicas, de los métodos de balanceo de ecuaciones químicas y el rendimiento de las reacciones químicas. Si se conocen las masas atómicas, se pueden calcular la masa molecular y la composición centesimal de un compuesto a partir de su fórmula química, así como, la relación de las masas de los reactivos y de los productos, a partir de la ecuación química que representa a la reacción química. A esta rama de la química se le conoce como estequiometría. Estequiometría, del latín stoicheion, elemento y de metrón, medida. Se llama estequiometría a la parte de la química que cuantifica las relaciones de la materia y la energía en las reacciones químicas con base en las ecuaciones químicas que indican las relaciones entre los reactivos y los productos de una reacción química. La estequiometría es la parte de la química que estudia las leyes de la combinación química y el cálculo de las variables relacionadas con la composición química y las reacciones entre los reactivos y los productos. Es básica para comprender los procesos de los cambios químicos de la materia. Reacción química y ecuación química. http://www.genomasur.com/BCH/BCH_libro/imagenescap_1/union.JPG Un proceso químico es la reacción química mediante la cual dos o más elementos químicos o uno o más compuestos químicos interaccionan rompiendo enlaces químicos y se reacomodan los átomos mediante nuevos enlaces químicos produciendo absorción o liberación de energía. En una reacción química, a las sustancias con las cuales se inicia la reacción química se les llama reactivos o reactantes los cuales reaccionan químicamente (se rompen enlaces químicos entre los átomos) para formar nuevas sustancias (se reacomodan los átomos y se forman nuevos enlaces químicos) a las que se les llama productos. Los productos tienen propiedades químicas diferentes a las de los reactivos. Ejemplos: Na(s) + 2 H2O(l) Na+(s) + 2 OH–(ac) + H2(g) H = – 367.6 kJ/mol. Ba(s) + 2 H2O(l) Ba+2(ac)) + 2 OH– (ac) + H2(g) H = – 426.6 kJ/mol. Mg(s) + H2O(v) MgO(s) + H2(g) H = – 360.0 kJ/mol. El estado de agregación de los reactivos y de los productos se indica mediante un subíndice de la letra inicial correspondiente a sólido, líquido, gas, vapor, acuoso, etc. El hidróxido de sodio es muy soluble en agua, a 25oC puede alcanzar concentraciones 20 M y es un proceso exotérmico y se representa con la ecuación química: NaOH(s) Na+(ac) + OH– (ac) H = – 42.9 kJ/mol. Las reacciones químicas incluyen la ruptura y formación de enlaces químicos entre los átomos y moléculas, por lo que hay intercambio de materia y energía. Como resultado de la ruptura y la formación de los enlaces puede haber una absorción de energía y se les llama reacción endergónica o endotérmica o que ocurra la liberación de energía en forma de calor, flama y luz, y se le llama reacción exergónica o exotérmica. Las reacciones químicas ocurren de tal manera que los átomos se unen para disminuir el cambio de entropía del sistema, adquiriendo una estructura más estable la materia. Ocurren intercambios continuos de materia y/o energía con el alrededor del sistema. Los procesos de transformación de la materia son las reacciones químicas que se representan mediante ecuaciones químicas que se utilizan para establecer las relaciones numéricas cuantitativas entre los reactivos y los productos de la reacción química. A la parte de la química que se ocupa de esto se conoce como estequiometría. Una reacción química es el proceso mediante el cual interaccionan un conjunto de sustancias, llamadas reactivos, que se transforman en un nuevo conjunto de sustancias, llamados productos. Hay ruptura de enlaces químicos y reacomodo de átomos y formación de nuevos enlaces químicos. Reacción química: es el proceso de interacciones entre la materia y la energía que causan la ruptura de unos enlaces químicos y el reacomodo y la formación de nuevos enlaces químicos para producir nuevas sustancias. En muchos casos, cuando se mezclan los reactivos no sucede nada, no ocurre la reacción química, mantienen su composición y sus propiedades. Para que ocurra la transformación de los reactivos es necesario aplicar una cierta cantidad de energía llamada energía de activación. Cuando se realiza la reacción química hay cambio en la composición y en las propiedades, por lo que se presentan evidencias experimentales en las propiedades físicas como: - Un cambio de color. La formación de un sólido (precipitado) en una mezcla líquida. El desprendimiento de un gas. El desprendimiento o absorción de calor, entre otras más. A veces, para darse cuenta que ocurrió una reacción química es necesario hacer un análisis químico de la mezcla de reacción para poder determinar que hay formación de nuevas sustancias. Mecanismo de reacción. Secuencia de los cambios moleculares que ocurren y se pueden identificar cuando un conjunto de reaccionantes se transforman en productos bajo condiciones específicas. http://www.profesorenlinea.cl/Quimica/AguaCaracterisFM.htm Una vez planteadas, a partir de datos experimentales, las ecuaciones matemáticas del comportamiento cinético de una reacción química, e identificado las especies químicas intermedias formadas durante la reacción, se formula el mecanismo probable mediante el cual ocurre la reacción química. Se busca expresar en mecanismo de reacción como una combinación de varias reacciones químicas elementales simples (que ocurren en un solo paso). Ejemplo, Cl2(g) + H2O(l) Cl– + H3O+. La secuencia de reacciones químicas que ocurren para producir un cambio cuantificable, se determina mediante la cinética química (Vr = kCn) y la identificación de las especies químicas. Balanceo de ecuaciones químicas. 1. Escribir la fórmula correcta de cada reactivo y de cada producto. Se utiliza el símbolo del elemento químico con un subíndice que representa el número de átomos iguales que constituyen al compuesto que se está representando con la fórmula. 2. Los reactivos y productos se separan por una flecha () que indica hacia los productos. 3. Se cuentan los átomos, y el número de átomos de cada elemento químico en los reactivos debe ser igual al número de átomos de cada elemento químico en los productos. (Ley de Lavoisier). 4. Cuando el número de átomos de un elemento químico entre los reactivos y los productos es diferente, entonces se utilizan coeficientes para ajustarlos (balancearlos). 5. Cuando esté balanceada la ecuación, si los coeficientes son divisibles y quedan enteros, se dividen hasta su mínima expresión (la razón más baja). Por ejemplo, balancear la ecuación química de la reacción entre el aluminio (Al) y el ácido clorhídrico (HCl), que produce tricloruro de aluminio (AlCl3) más hidrógeno (H2). Al(s) + HCl(ac) AlCl3(ac) + H2(g). Se observa que en los productos, los átomos de H y de Cl están en una relación de 3 de Cl por 2 de H, por lo que y como el mínimo común múltiplo es 6 entonces se coloca el 3 como coeficiente del H2 y el 2 como coeficiente del AlCl3. Al(s) + HCl(ac) 2AlCl3(ac) + 3H2(g). Ahora se tiene que en los productos hay 6 átomos de cloro, por lo que se escribe el 6 como coeficiente del HCl en los reactivos, y como hay 2 átomos de aluminio, se le escribe el 2 como coeficiente del aluminio en los reactivos. 2Al(s) + 6HCl(ac) 2AlCl3(ac) + 3H2(g). Con lo que queda balanceada la ecuación química de la reacción entre el aluminio y el ácido clorhídrico. Una vez balanceada la ecuación química, se pueden hacer los cálculos estequiométricos que se requieran porque los cálculos estequiométricos sólo son válidos cuando la ecuación química está balanceada (cumple con la ley de conservación de la materia de Lavoisier). a) Leyes básicas de las reacciones químicas. Ley de la conservación de la materia (Antoine Laurent Lavoisier, 1743-1794). Ley de la conservación de la energía (1799, Antoine Laurent Lavoisier, 1743-1794). Ley de las proporciones definidas (Joseph Louis Proust, 1754-1826). Ley de las proporciones múltiples (1803, Dalton, T. Thomson y Wollaston). b) Conceptos: símbolo, elemento químico, fórmula química, molécula, compuesto, masa atómica, masa molecular, equilibrio químico, (especie química, reactivo limitante, rendimiento, colisiones efectivas, energía de activación, complejo activado o estado de transición). John Dalton (químico inglés, 6-9-1766–27-7-1844), T. Thomson y William Hyde Wollaston (químico, físico y médico inglés, 6-8-1766–22-12-1828) desarrollaron la ley de las proporciones múltiples, que dice: un conjunto específico de elementos químicos puede combinarse para formar dos o más compuestos diferentes de manera que las razones de las masas respectivas de los elementos químicos sean números enteros. Relaciones de masa en las reacciones químicas. Los coeficientes de una ecuación química balanceada (ajustada) representan el número de moléculas, el número de moles (al multiplicar por el número de Avogadro), el número de volúmenes y de masa en gramos (usando la masa molecular) de los reactivos y de los productos. Reactivo limitante o límite. La cantidad de producto formado está limitada (determinada) por el reactivo limitante, al otro se le llama reactivo en exceso. Rendimiento teórico es la máxima cantidad de productos que se formarían si reaccionara el 100 % de los reactivos (estequiométricos). Rendimiento real es la cantidad que realmente se obtiene en la reacción química. El rendimiento real es menor que el teórico. Se expresan en porcentajes. Ley de la conservación de la materia y la energía. Con el descubrimiento de la energía nuclear, se comprendió que la materia se puede transformar en energía. En las reacciones nucleares la materia se transforma en energía de acuerdo a la ecuación de Einstein: E = mc2. Reacción química ordinaria 1. No pueden producir elementos químicos nuevos. 2. Por lo general, sólo participan los electrones externos. 3. Se liberan o absorben cantidades relativamente pequeñas de energía. 4. La velocidad de reacción depende de factores como la concentración, la temperatura, la presión y los catalizadores. Reacción química nuclear 1. Los elementos químicos pueden transformarse en otro. 2. Participan partículas del interior del núcleo del átomo. 3. Se liberan o absorben cantidades grandes de energía. 4. La velocidad de reacción (decaimiento o desintegración) no depende de factores externos. ¿Qué es el mol? El mol es la unidad básica del Sistema Internacional de Unidades (SI) para medir la cantidad de masa de un compuesto. Como es un número muy grande, del orden de trillones, se usa para contar partículas muy pequeñas (átomos, moléculas, iones, electrones). En química se utiliza como unidad para contar las partículas pequeñas, en grandes cantidades, el número de Avogadro, equivale a 6.023x1023 partículas y se le conoce como mol. La unidad de masa es el mol = 6.022045x1023 partículas (átomos, moléculas, iones, etc.) = Número de Avogadro (Lorenzo Romano Amadeo Carlo, físico italiano, 9-VIII-1776-9-VII1856). Número de Avogadro. 6.023x1023 partículas = 1 mol. Significado del número de Avogadro. Representa el número de átomos en hay en la masa atómica de un elemento químico o el número de moléculas que hay en la masa molecular de un determinado compuesto. Por ejemplo: Masa atómica del carbono = 12.01 g/mol, lo que significa que hay 6.023x1023 átomos de carbono en 12.01 gramos de carbono. Masa atómica del oxígeno = 16 g/mol, lo que significa que hay 6.023x1023 átomos de oxígeno en 16 gramos de oxígeno. Masa molecular del oxígeno (O2) = 32 g/mol, lo que significa que hay 6.023x1023 moléculas de oxígeno en 32 gramos de oxígeno. Masa molecular del óxido de hidrógeno (agua) H2O = 18 g/mol, lo que significa que hay 6.023x1023 moléculas de óxido de hidrógeno en 18 gramos de óxido de hidrógeno. Intercambio de energía y materia en las reacciones químicas. La química estudia las características (propiedades) y la composición de todos los materiales, y los cambios (de materia y energía) que éstos sufren. Cada sustancia química tiene características específicas que cambian al ocurrir una reacción química (ruptura de enlaces químicos e intercambio de materia y energía). Las reacciones químicas se detienen cuando uno de los reactivos se consume, por ejemplo, una vela encendida encerrada en un frasco se apaga cuando se consume el oxígeno aunque la vela no se haya quemado totalmente. Por eso es necesario conocer las cantidades de reactivos disponibles para poder determinar la cantidad de productos que se pueden obtener en una reacción química. Se puede hacer que la gasolina (mezcla de hidrocarburos, C5H12 a C12H26, punto de ebullición de 40oC a 200oC) se combine con el oxígeno del aire al acercarle un cerillo encendido para producir fuego o que se combine de manera explosiva en el interior de un motor para realizar un trabajo, sin embargo, en los dos casos se produce dióxido de carbono (CO2) y óxido de hidrógeno (H2O) o “agua” en forma de vapor y una cantidad específica de energía. Si la cantidad de oxígeno presente no es suficiente para que ocurra completamente la combustión, entonces, se produce monóxido de carbono (CO) en lugar del dióxido de carbono. En los procesos anteriores ocurren complejas reacciones químicas, que generalmente en química se representan únicamente los estados iniciales y finales de los procesos, para lo que se utilizan expresiones matemáticas con fórmulas químicas llamadas ecuaciones químicas. Primer acercamiento para representar la combustión de la gasolina: Gasolina + aire + energía, produce flama + gases. En química, la combustión de la gasolina se representa con la ecuación química siguiente (considerando que la gasolina está formada sólo por octano): 2 C8H18(g) + 25 O2(g) + Energía1 16 CO2(g) + 18 H2O(v) + Energía2. Interpretación de la ecuación química de la combustión de la gasolina (octano): Dos moléculas de octano gaseoso reaccionan con veinticinco moléculas de oxígeno gaseoso y producen dieciséis moléculas de dióxido de carbono gaseoso más dieciocho moléculas de vapor de agua. Al revisar la ecuación química se puede observar que cumple con la ley de la conservación de la masa de Lavoisier. Además, cuando la combustión se realiza en presencia de aire también se producen óxidos de nitrógeno, que son contaminantes y forman lluvia ácida. Otra forma de realizar la combustión, es en el interior de las células de los organismos ocurren una serie de reacciones químicas complejas para obtener la energía de la glucosa (C6H12O6) y de otros carbohidratos que constituyen a los alimentos. Estos carbohidratos se oxida (metabolizan) durante el proceso de respiración al reaccionar con el oxígeno y se produce dióxido de carbono gaseoso y óxido de hidrógeno en forma de vapor, que son exhalados al respirar. Estos dos ejemplos muestran que ciertas sustancias se transforman en otras mediante procesos que se realizan a través de complejas reacciones químicas y absorben o liberan energía como resultado de dichos procesos. Calor de combustión. Cambio de entalpía que ocurre cuando un mol de una sustancia reacciona totalmente con oxígeno gaseoso a una temperatura de 298 K. Calor de combustión de la glucosa: C6H12O6 (s) + 6 O2 (g) 6 CO2 (g) + 6 H2O(l) H = – 673 kcal/mol. Para cualquier proceso: H = G + (TS). Para un proceso que ocurre a temperatura constante: G = H – TS. C6H12O6 (s) + 6 O2(g) 25oC 6 CO2(g) + 6 H2O(l) G = – 791 kcal/mol. Ecuación química de la formación del óxido de hidrógeno: H2 (g,1 at) + ½ O(g, 1 at) H2O(v, 1 at) Hfo = – 57.79 kcal/mol. H2 (g,1 at) + ½ O(g, 1 at) H2O(l) Hfo = – 68.32 kcal/mol. H2O(l) H2O(v, 1 at) Hv = 10.53 kcal/mol. Muchas de las reacciones las realiza el hombre para producir energía. Ejemplo, la combustión de la gasolina, el carbón, y la generación de electricidad por medio de una batería. Otras de las reacciones químicas sólo pueden ocurrir si se dispone de suficiente energía, por ejemplo, la industria química (la metalurgia). ¿Por qué ocurren las reacciones químicas? ¿Está relacionada la energía de una reacción química y la composición y la estructura de las sustancias involucradas? ¿Se puede predecir si una reacción química puede ocurrir espontáneamente? La energía se conserva pero los diferentes tipos de energía (calor, luz, mecánica, eléctrica, química) pueden ser transformados de una forma a otra, en cada caso la cantidad de energía se conserva. Los cambios químicos siempre conllevan consigo cambios de energía, pero algunas transformaciones de energía no implican cambios químicos. Por ejemplo, la energía calorífica se puede transformar en energía eléctrica o en energía mecánica sin cambios químicos simultáneos. El calor (es una propiedad extensiva, depende de la cantidad de masa del sistema) fluye y la diferencia de temperatura define la dirección en la cual fluye el calor espontáneamente. Ley cero de la termodinámica o del equilibrio térmico. La temperatura es una propiedad intensiva porque es independiente de la cantidad de masa del sistema. Calor específico o capacidad calorífica específica. Es la cantidad de calor requerida para elevar la temperatura de un gramo de cualquier sustancia en un grado Celsius. C = Q/mT. La capacidad calorífica molar es la cantidad de calor necesaria para elevar la temperatura de un mol de sustancia en un grado Celsius. La entalpía comprende todas las formas de energía que posee el sistema más el trabajo por expansión: H = E + PV. H = Hproductos – Hreactivos. Generalmente, en las ecuaciones químicas se consideran los estados inicial y final, por ejemplo: C(s, grafito) + O2(g, 1 atm) 25oC CO2(g, 1 atm) + 94.045 kcal/mol. http://reocities.com/CollegePark/Center/7242/termod.html En una reacción química exotérmica se libera energía y la suma de las entalpías de los productos es menor que la suma de las entalpías de los reactivos, por lo tanto, el signo de H es negativo, lo que indica una disminución de la entalpía. 2 HgO(s) calor 2 Hg(L) + O2(g) H = 43.4 kcal/mol. En una reacción química endotérmica la energía se proporciona desde fuera del sistema y hay un incremento en la entalpía al cambiar de un estado inicial a uno final. El signo de H es positivo. C(s) + O2(g) CO2(g) H298 C = – 94.045 kcal/mol. Un proceso que sea exergónico (exotérmico) en una dirección, siempre es endergónico (endotérmico) en la dirección opuesta. La reacción química entre el metano gaseoso y el oxígeno gaseoso es una reacción exergónica y produce dióxido de carbono gaseoso y óxido de hidrógeno (agua) en fase vapor, y se representa de diferente forma mediante las ecuaciones químicas: CH4(g) + 2 O2(g) CO2(g) + 2 H2O(v) + energía. CH4(g) + 2 O2(g) CO2(g) + 2 H2O(l) + 212.80 cal/mol. CH4(g) + 2 O2(g) CO2(g) + 2 H2O(l) H = – 212.80 cal/mol. http://www.gobiernodecanarias.org/educacion/3/usrn/lentiscal/1-cdquimica-tic/FlashQ/1Reacciones%20Q/ReaccionesCombustion/imagenes/Combustion.jpg En la mayoría de las reacciones exotérmicas la energía química se transforma en energía calorífica. En algunos casos se libera energía luminosa sin calor, y otras, se produce energía eléctrica sin desprendimiento de luz o calor. La reacción química entre el nitrógeno gaseoso y el oxígeno gaseoso es una reacción química endergónica o endotérmica que produce monóxido de nitrógeno u óxido nítrico gaseosos y se representa de diferente forma mediante las ecuaciones químicas: N2(g) + O2(g) + Energía 2 NO(g). N2(g) + O2(g) N2(g) + O2(g) 2 NO(g) – 21.600 cal/mol. 2 NO(g) H = 21.600 cal/mol. También para indicar que la reacción química es endotérmica se usa escribir la palabra energía o un triángulo sobre la flecha. En las reacciones endotérmicas, la energía calorífica, luminosa o eléctrica se transforma en energía química. Clasificación de las reacciones químicas. Reacciones de combinación o síntesis. Cuando dos o más elementos químicos se combinan para formar un compuesto químico. Incluyen 1) la combinación de dos elementos químicos para formar un compuesto, 2) la combinación de un elemento químico con un compuesto para formar otro nuevo, y 3) la combinación de dos compuestos químicos para formar otro nuevo. 1. Combinación de dos elementos químicos para formar un compuesto químico. Metal + no metal Compuesto iónico binario. Los metales del grupo IA (M) se combinan con los no metales del grupo VIIA (X) formando compuestos iónicos binarios de fórmula general MX. 2 M(s) + X2 2 (M+X–)(s). M = Li, Na, K, Rb, Cs. X = F, Cl, Br, I. 2 Na(s) + Cl2(g) 2 NaCl(s). Cloruro de sodio, pf. = 801oC. Los metales del grupo IIA también pueden reaccionar con los no metales del grupo VIIA formando compuestos iónicos binarios (excepto BeCl2, BeBr2, BeI2). Se puede representar mediante la ecuación química: M(s) + X2 MX2(s). M = Be, Mg, Ca, Sr, Ba. X = F, Cl, Br, I. El radio y el astatino no se consideran por ser radiactivos. Mg (s) + F2 (g) MgF2 (s). Fluoruro de magnesio, pf = 1266oC. Metal + no metal compuesto binario (óxido, sulfuro o haluro). Para los grupos I A, II A y para el aluminio, zinc y plata se puede predecir el producto que se formará. Para los metales que tienen un estado de oxidación variable, el producto que se formará depende de las condiciones de reacción, pero generalmente se necesita más información para predecir el producto. 4 Al(s) + 3 O2 (g) 2 Al2O3(s). Mg(s) + S (s) Mg S(s) . 2 Na(s) + Cl2(g) 2 NaCl(s). No metal + no metal Compuesto binario covalente. El fósforo del grupo VA se combina con el cloro formando el tricloruro de fósforo, que se representa mediante la ecuación: Con cloro limitado: P4(s) + 6 Cl2(g) 4 PCl3(l). pf = –112oC. Con exceso de cloro: P4(s) + 10 Cl2(g) 4 PCl5(l). Se descompone a 167oC. No metal + oxígeno óxido de no metal (anhídrido). Por este tipo de reacción química se pueden forman una gran variedad de compuestos. Por ejemplo, cuando el carbono reacciona con el oxígeno, si la cantidad es limitada se produce el monóxido de carbono, CO, y si hay exceso de oxígeno se produce el dióxido de carbono, CO2, de acuerdo a las ecuaciones químicas siguientes: 2 C(s) + O2(g) 2 CO(g) . C(s) + O2(g) CO2(g) . 2. Combinación de un elemento químico con un compuesto para formar un nuevo compuesto. PCl3 (l) + Cl2 (g) PCl5 (s). SF4(g) + F2(g) SF6(g). Hexafluoruro de azufre, pf = – 50.5oC. 3. Combinación de dos compuestos químicos para formar uno nuevo. CaO(s) + CO2 (g) CaCO3 (s). SO3(g) + H2SO4(l) H2S2O7(l). Ácido pirosulfúrico. H2S2O7(l) + H2O(l) 2 H2SO4(l). Reacciones de síntesis o de combinación. Dos o más reactivos reaccionan para formar un compuesto. A + B C. 2 H2(g) + O2(g) + Energía 2 H2O(l). 2 H2(g) + O2(g) 2 H2O(l) G = + 118 kcal/mol. (Endergónica). N2(g) + 3 H2(g) 2 NH3O(g) + 22 kcal/mol. N2(g) + 3 H2(g) Fe, 450 a 500oC 2 NH3O(g) Go = – 194.7 kcal/mol. www.laquimicayalgomas.com CH4(g) + 2 O2(g) CO2(g) + 2 H2O(v) + energía. CH4(g) + 2 O2(g) CO2(g) + 2 H2O(v) H = – 890 kJ/mol. (Exergónica). Reacciones de descomposición. 1. Un compuesto produce dos elementos químicos. Electrólisis: 2 H2O(l) corriente directa y electrolito 2 H2(g) + O2(g). 2 HgO(s) 2 Hg(l) + O2(g). 2. Un compuesto produce un elemento químico y un compuesto. 2 KClO3(s) MnO2(s), 2 KCl(s) + 3 O2(g). 3. Un compuesto químico forma dos compuestos. Un solo reactivo se descompone para formar dos o más sustancias. A B + C. CaCO3(s) CaO(s) + CO2(g). NH4NO3(s) N2O(g) + H2O(v). Reacciones de desplazamiento. 1. Metal activo + sal de metal menos reactivo Metal activo + sal de metal menos activo. Fe(s) + CuSO4(ac) FeSO4(ac) + Cu(s). Cu(s) + 2 AgNO3(ac) 2 Ag(s) + Cu(NO3)2 (ac). 2. Metal activo + ácido no oxidante Hidrógeno + sal de ácido. Zn(s) + H2SO4 (ac) ZnSO4 (ac) + H2 (g). 2 K(s) + H2O(l) 2 KOH(ac) + H2 (g). 3. No metal activo + sal de no metal menos activo No metal menos activo + sal de metal no activo. Cl2 (g) + 2 NaBr(ac) 2 NaCl(s) + Br2 (l). Reacciones de desplazamiento sencillo. Un elemento químico reacciona para sustituir a otro elemento químico en un compuesto. A + BX AX + B. Zn(S) + 2 HCl (ac) ZnCl2 (s) + H2(g). Zn(S) + CuSO4(ac) ZnSO4 (ac) + Cu(s). Reacciones químicas de metátesis. Son aquellas reacciones químicas en las cuales dos compuestos reaccionan para formar otros dos compuestos sin que se produzca cambio en el número de oxidación. Se intercambian iones entre los compuestos. Entre las reacciones de metátesis más comunes se encuentran las reacciones de precipitación. Los reactivos están en solución y al reaccionar el producto forma un precipitado (puede ser colorido) o permanece en solución. Cuando el producto forma un precipitado insoluble, la reacción se representa con la ecuación química: A+ + B– AB . NaCl(ac) + AgNO3(ac) AgCl(s) + NaNO3(ac). 2 AgNO3(ac) + Na2CrO4(ac) Ag2CrO4(s, rojo) + 2 NaNO3(ac). Pb(NO3)2(ac) + K2CrO4(ac) PbCrO4(s) + 2 KNO3(ac). 3 CaCl2(ac) + 2 K3PO4(ac) Ca3(PO4)2(s) + 6 KCl(ac). Reacciones de desplazamiento doble (metátesis). Los átomos o los iones intercambian parejas. AX + BY AY + BX. NaOH(ac) + HCl(ac) NaCl(ac) + H2O(l). 2 NaI(ac) + Pb(NO3)2(ac) PbI2(s, amarillo) + 2 NaNO3(ac). Reacción de doble desplazamiento (metátesis). Son reacciones químicas donde dos compuestos reaccionan produciendo dos compuestos nuevos. En general, ocurren entre compuestos iónicos en solución y se intercambian los iones para formar a los nuevos compuestos. En muchas reacciones de este tipo se forman compuestos insolubles. AgNO3(ac) + HCl(ac) AgCl(s) + HNO3(ac). Nitrato de plata + ácido clorhídrico cloruro de plata + ácido nítrico. Con frecuencia, es útil escribir las ecuaciones químicas de las reacciones iónicas, por ejemplo: Ag+(ac) + NO3–1(ac) + Na+(ac) Cl–(ac) AgCl(s) + Na+(ac) + NO3–1(ac). Na2SO4(ac) + Pb(NO3)2(ac) PbSO4(s) + 2 NaNO3(ac). Sulfato de sodio + nitrato de plomo (II) sulfato de plomo (II) + nitrato de sodio. Ba(NO3)2(ac) + 2 NaOH(ac) Ba(OH)2(s) + 2 NaNO3(ac). Nitrato de barrio + hidróxido de sodio hidróxido de bario + nitrato de sodio. Reacciones químicas de óxido-reducción. Reacciones de óxido-reducción. Uno de los elementos químicos que participa en la reacción se oxida (pierde electrones) y otro se reduce (gana electrones). Zn(S) + CuSO4(ac) ZnSO4 (ac) + Cu(s) + Energía. Oxidación: Zn0 – 2 e– Zn2+ o Zn0 Zn2+ + 2 e–. Reducción: Cu2+ + 2 e–- Cu0. Si se introduce un alambre de cobre incandescente en una botella que contenga cloro gaseoso produce cloruro de cobre (II) o cloruro cúprico, un sólido verdoso. El cloro actúa como agente oxidante. Reacción química que se representa mediante la ecuación química: Cu(s) + Cl2 (g) CuCl2 (s). Los metales del grupo I A o metales alcalinos se guardan en aceite o petróleo porque reaccionan con rapidez con el oxígeno del aire, produciendo óxidos metálicos, de fórmula general M2O, donde M representa al metal alcalino. 4 Na(s) + O2 (g) 2 Na2O (s) Reacción rápida. 2 Mg(s) + O2 (g) 2 MgO(s) El magnesio arde con flama. 4 Fe(s) + 3 O2 (g) 2 Fe2O3(s) Reacción lenta, se acelera calentando. En estas reacciones químicas el oxígeno actúa como agente oxidante. Cualquier sustancia que haga que el metal pierda electrones, es un agente oxidante. La sustancia que pierde electrones es el agente reductor, y se oxida. Ejemplos de oxidación espontánea (donde la reacción ocurre sin agregar energía): 2 Sb(s) + 3 Cl2 (g) 2 SbCl3(s). Agente reductor + Agente oxidante compuesto. Al(s) + 3 I2 (s) 2 AlI3(s) (Triyoduro de aluminio). Pierde electrones + Gana electrones compuesto. Los no metales, cloro y yodo, ganan electrones por lo que se transforman en iones, es decir, se reducen y se representa mediante la ecuación siguiente: 3 Cl2 + 6 e– 6 Cl–. Cuando el no metal se reduce por ganar electrones, actúa como un agente oxidante. http://infoquimica.com/agente-reductor/ Las reacciones de desplazamiento, son ejemplo de reacciones químicas redox. Oxidación. Proceso en el que un elemento químico pierde electrones; incremento algebraico del número de oxidación. Reducción. Proceso en el que un átomo de un elemento químico gana electrones; disminución algebraica del número de oxidación. Oxidación. Proceso en el que un átomo de un elemento químico pierde electrones; incremento algebraico del número de oxidación. Reducción. Proceso en el que un átomo de un elemento químico gana electrones; disminución algebraica del número de oxidación. Agente oxidante. Átomo o elemento químico que produce la oxidación de otro. El agente oxidante se reduce. Los elementos químicos no metálicos actúan como agentes oxidantes porque tienen la capacidad de aceptar electrones. Todo elemento químico es oxidante de todos los que tiene encima en la serie electromotriz. Sustancia que disminuye su número de oxidación (gana electrones) y oxida a otra sustancia. Los agentes oxidantes siempre se reducen. Agente reductor. Átomo o elemento químico que produce la reducción de otro. El agente reductor que se oxida. Los elementos químicos metálicos actúan como agentes reductores porque tienen la capacidad de ceder electrones. Cada elemento químico de la serie electromotriz reduce a todos los elementos químicos que se encuentran debajo de él en la serie. Sustancia que aumenta el número de oxidación (pierden electrones) y reducen a otra sustancia. Los agentes reductores siempre se oxidan. http://3.bp.blogspot.com/icmO6OYY8WM/TyTQzVJea2I/AAAAAAAAAAU/K1Zjq5TpYvI/s1600/compuestos_inorganicos_img.gif Óxido de no metal + óxido de hidrógeno oxiácido u oxácido. A los óxidos de los no metales también se les conoce como óxidos ácidos, anhídridos o ácidos anhídridos. Cuando un óxido de un no metal reacciona con el óxido de hidrógeno se produce un oxácido. SO2(g) + H2O(l) H2SO3(ac). Óxido de azufre (IV) o anhídrido sulfuroso ácido sulfuroso. SO3(g) + H2O(l) H2SO4(ac). Óxido de azufre (VI) o anhídrido sulfúrico ácido sulfúrico. Óxido de metal + óxido de hidrógeno hidróxido de metal (álcali o base). El óxido de calcio reacciona con el óxido de hidrógeno formando hidróxido de calcio, de acuerdo a la ecuación química: CaO(s) + H2O(l) Ca(OH)2(ac). Si el metal presenta más de un estado de oxidación, el estado de oxidación en el hidróxido es siempre igual al que tenía el óxido. Por ejemplo, el óxido de hierro (III) produce el hidróxido de hierro (III). Fe2O3(s) + 3 H2O(l) 2 Fe(OH)3(coloide). Óxido de metal + óxido de no metal sal. Como el óxido de un metal es un anhídrido básico y el óxido de un no metal, la reacción química entre estos óxidos produce una sal y corresponde a una reacción del tipo ácidobase. CaO(s) + SO2(g) CaSO3(s). Óxido de calcio + anhídrido sulfuroso sulfito de calcio. Equivale a que reaccionada el hidróxido de calcio y el ácido sulfuroso y se les resta el agua. Reacciones de neutralización: Ácido + Hidróxido Sal + Agua. HCl(ac) + NaOH(ac) fenolftaleína NaCl(ac) + H2O(l). También se representan como ecuaciones químicas iónicas, porque los ácidos y las bases son electrolitos. CH3-COOH(ac) + NaHCO3(s) CH3-COONa(ac) + H2CO3(ac). 2 HCl(ac) + Mg(OH)2(ac) MgCl2(ac) + 2 H2O(l). H2SO4(ac) + Ca(OH)2(ac) CaSO4(s) + 2 H2O(l). H2SO4(ac) + 2 NaOH(ac) Na2SO4(s) + 2 H2O(l). Reacciones de neutralización (ácido-base) con la formación de un no electrolito. Fertilizantes: 2 NH3 + H2SO4 (NH4) 2SO4. Se forma la sal pero no agua. Las reacciones de neutralización pueden incluirse en las de combinación y de doble sustitución, pero por su importancia se consideran como otro tipo. Reacciones químicas iónicas acuosas. ¿Qué hace que ocurra una reacción química iónica acuosa? La mayor parte de las reacciones químicas que ocurren en el medio ambiente y en los organismos vivos tienen lugar en fase líquida, como soluciones acuosas. Esto haría pensar que siempre que se mezclen compuestos iónicos en solución acuosa (reactivos) ocurre una reacción química, pero no siempre es así. Para reacciones químicas de precipitación y de neutralización ácido-base, la reacción química ocurre porque hay iones que se atraen entre sí tan intensamente que son removidos de la solución para formar el producto. Ecuación química iónica (se representan todas las especies químicas): 2 Ag+(ac) + NO31– (ac) + Cu (s) 2 Ag(s) + Cu2+(ac) + 2 NO31– (ac). Reacciones de intercambio iónico. Los electrolitos fuertes tienen la propiedad de disociarse y formar iones. CaCl2 (ac) + 2 AgNO3 (ac) 2 AgCl(s) + Ca(NO3)2 (ac). Como el CaCl2 y el AgNO3 son electrolitos fuertes se disocian en iones: Ca2+, 2 Cl1–, 2 Ag1+ y NO31–. La ecuación química de la reacción química entre estos dos reactivos en solución acuosa, se puede escribir mediante la ecuación química iónica total (no se indica la fase de la reacción): Ca2+(ac) + 2 Cl1–(ac) + 2 Ag1+(ac) + 2 NO31–(ac) 2 AgCl(s) + Ca(NO3)2(ac). La mayor parte de las reacciones químicas que ocurren en el medio ambiente y en los organismos vivos tienen lugar en fase líquida, como soluciones acuosas. Reacción entre el sodio y el agua: Na(s) + 2 H2O(l) Na + (s) + 2 OH (ac) + H2 (g) H = - 367.6 kJ/mol. Reacción de dismutación o desproporción. (El mismo elemento químico se oxida y se reduce). Ejemplo: Cl2(g) + H2O(l) HCl(ac) + HClO(ac). Cl0 Cl– + Cl+. 2 H2O2(ac) 2 H2O(l) + O2(g). O–1 O–2 + O0. Ecuación química molecular. 2 AgNO3(ac) + Cu(s) 2 Ag(s) + Cu(NO3)2 (ac). El nitrato de plata y el nitrato de cobre (II) son compuestos iónicos solubles en agua. Reacciones: moleculares, bimoleculares, trimoleculares. Unos de los combustibles que se usan para impulsar a los cohetes es una mezcla de hidracina líquida (N2H4(l) con tetróxido de nitrógeno líquido (N2O4(l) ) y los productos de la reacción de combustión son nitrógeno gaseoso y el óxido de hidrógeno (agua) líquida. Ecuación química: 2 N2H4(l) + N2O4(l) 3 N2(g) + 4 H2O(l). Si se introduce un alambre de cobre incandescente en una botella que contenga cloro gaseoso produce cloruro de cobre (II) o cloruro cúprico, un sólido verdoso. El cloro actúa como agente oxidante. Reacción química que se representa mediante la ecuación química: Cu(s) + Cl2(g) CuCl2(s). Los metales del grupo I A o metales alcalinos se guardan en aceite o petróleo porque reaccionan con rapidez con el oxígeno del aire, produciendo óxidos metálicos, de fórmula general M2O, donde M representa al metal alcalino. 4 Na(s) + O2(g) 2 Na2O(s) Reacción rápida. 2 Mg(s) + O2(g) 2 MgO(s) El magnesio arde con flama. 4 Fe(s) + 3 O2(g) 2 Fe2O3(s) Reacción lenta, se acelera calentando. En estas reacciones químicas el oxígeno actúa como agente oxidante. Energía de enlace. Cuando dos átomos de hidrógeno gaseoso, a 25oC y una presión de una atmósfera, cada uno con su electrón 1s, reaccionan formando una molécula de hidrógeno, H2(g), se libera una cantidad de energía igual a 1.730x10–19 calorías. Esto se representa con la ecuación química: 2 H(g) (1s) H2(g) + 1.730x10–19 calorías. 2 H(g) (1s) H2(g) H = – 1.730x10–19 calorías. Para romper el enlace de la molécula de hidrógeno (disociarla) y formar dos átomos de hidrógeno con su electrón en el estado basal, se requiere de 1.730x10–19 calorías/mol. Esto se representa con la ecuación química: H2(g) + 1.730x10–19 calorías. 2 H(g) (1s). Dado que no se puede manejar una molécula, se usa como unidad el mol que es equivalente al número de Avogadro, 6.022x1023 moléculas, que es igual a la masa molecular en g/mol. La reacción química de un mol hidrógeno gaseoso se representa con la ecuación química: H2(g) + 10.41979x104 cal/mol. 2 H(g). Otro uso importante de las entalpías de reacción es la estimación de las fuerzas de los enlaces covalentes. La ruptura y la formación de enlaces durante una reacción química del tipo: A2 + B2 2 A–B o A–A + B–B 2 A–B. Si los enlaces A-B son más fuertes que el promedio de los enlaces A-A y B-B, es decir, si los enlaces A-B son de menor energía, la reacción debe ser exotérmica y el exceso de energía ha de corresponder al calor (entalpía) de reacción. Para las moléculas diatómicas, la energía de enlace es la energía requerida para romper en enlace. Es igual en magnitud a la energía de formación de la molécula a partir de sus átomos en estado gaseoso. H2 (g) 2 H(g) Ho298 = 104.2 kcal/mol de H2. Cl2 (g) 2 Cl(g) Ho298 = 58.0 kcal/mol de Cl2. Como cada una de las reacciones anteriores consiste en la ruptura de un mol de enlaces químicos en las respectivas moléculas diatómicas, se considera que la energía del enlace H-H es de 104.2 kcal/mol y que la energía del enlace Cl-Cl es 58.0 kcal/mol. Bibliografía. Brown-LeMay-Bursten-Murphy. (2009). Química. La Ciencia Central. Decimoprimera Edición. Pearson Educación. México. Chang Raymond. 2000. Química. Sexta Edición. McGraw-Hill. México. Chang Raymond. (2008). Química Hill/Interamericana Editores. México. general para bachillerato. McGraw- Dingrando-Gregg-Hainen-Wistrom. (2003). Química. Materia y cambio. McGraw-Hill Interamericana Editores. Colombia. Ebbing Darrell D. y Gammon Steven D. (2010). Química general. Novena edición. Cengage Learning Editores. México. McMurray E. John y Fay C. Robert. (2009). Química General. Quinta edición. Pearson Educación. México. Petrucci-Harwood-Herring. (2002). Química General. Octava Edición. Prentice-Hall. España. Silberberg Martin, S. (2002). Química. La naturaleza molecular del cambio y la materia. McGraw-Hill Interamericana Editores. México. Whitten-Davis-Peck-Stanley. (2011). Química. Octava Edición. Cengage Learning Editores. México. Elaborado por Ramón Tamayo Ortega. Junio 2015.