TER uso terapeu 09
Anuncio
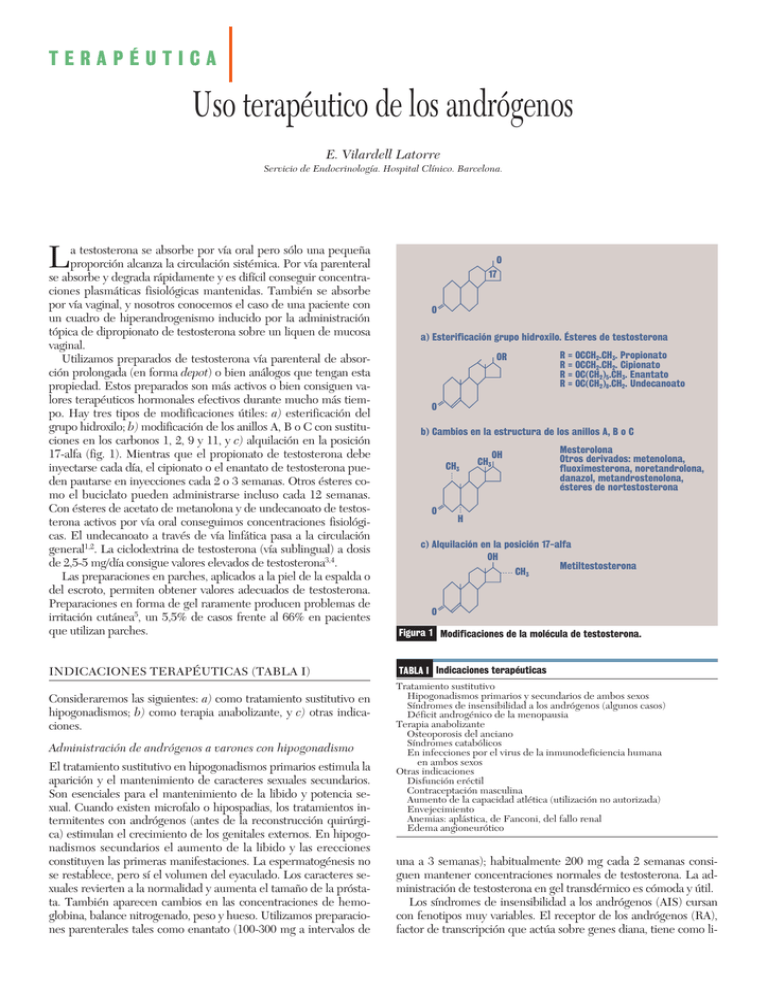
TERAPÉUTICA Uso terapéutico de los andrógenos E. Vilardell Latorre Servicio de Endocrinología. Hospital Clínico. Barcelona. L a testosterona se absorbe por vía oral pero sólo una pequeña proporción alcanza la circulación sistémica. Por vía parenteral se absorbe y degrada rápidamente y es difícil conseguir concentraciones plasmáticas fisiológicas mantenidas. También se absorbe por vía vaginal, y nosotros conocemos el caso de una paciente con un cuadro de hiperandrogenismo inducido por la administración tópica de dipropionato de testosterona sobre un liquen de mucosa vaginal. Utilizamos preparados de testosterona vía parenteral de absorción prolongada (en forma depot) o bien análogos que tengan esta propiedad. Estos preparados son más activos o bien consiguen valores terapéuticos hormonales efectivos durante mucho más tiempo. Hay tres tipos de modificaciones útiles: a) esterificación del grupo hidroxilo; b) modificación de los anillos A, B o C con sustituciones en los carbonos 1, 2, 9 y 11, y c) alquilación en la posición 17-alfa (fig. 1). Mientras que el propionato de testosterona debe inyectarse cada día, el cipionato o el enantato de testosterona pueden pautarse en inyecciones cada 2 o 3 semanas. Otros ésteres como el buciclato pueden administrarse incluso cada 12 semanas. Con ésteres de acetato de metanolona y de undecanoato de testosterona activos por vía oral conseguimos concentraciones fisiológicas. El undecanoato a través de vía linfática pasa a la circulación general1,2. La ciclodextrina de testosterona (vía sublingual) a dosis de 2,5-5 mg/día consigue valores elevados de testosterona3,4. Las preparaciones en parches, aplicados a la piel de la espalda o del escroto, permiten obtener valores adecuados de testosterona. Preparaciones en forma de gel raramente producen problemas de irritación cutánea5, un 5,5% de casos frente al 66% en pacientes que utilizan parches. Figura 1 Modificaciones de la molécula de testosterona. INDICACIONES TERAPÉUTICAS (TABLA I) TABLA I Indicaciones terapéuticas Consideraremos las siguientes: a) como tratamiento sustitutivo en hipogonadismos; b) como terapia anabolizante, y c) otras indicaciones. Administración de andrógenos a varones con hipogonadismo El tratamiento sustitutivo en hipogonadismos primarios estimula la aparición y el mantenimiento de caracteres sexuales secundarios. Son esenciales para el mantenimiento de la libido y potencia sexual. Cuando existen microfalo o hipospadias, los tratamientos intermitentes con andrógenos (antes de la reconstrucción quirúrgica) estimulan el crecimiento de los genitales externos. En hipogonadismos secundarios el aumento de la libido y las erecciones constituyen las primeras manifestaciones. La espermatogénesis no se restablece, pero sí el volumen del eyaculado. Los caracteres sexuales revierten a la normalidad y aumenta el tamaño de la próstata. También aparecen cambios en las concentraciones de hemoglobina, balance nitrogenado, peso y hueso. Utilizamos preparaciones parenterales tales como enantato (100-300 mg a intervalos de O 17 O a) Esterificación grupo hidroxilo. Ésteres de testosterona OR R = OCCH2.CH3. Propionato R = OCCH2.CH2. Cipionato R = OC(CH2)5.CH3. Enantato R = OC(CH2)8.CH2. Undecanoato O b) Cambios en la estructura de los anillos A, B o C CH3 O CH3 OH Mesterolona Otros derivados: metenolona, fluoximesterona, noretandrolona, danazol, metandrostenolona, ésteres de nortestosterona H c) Alquilación en la posición 17-alfa OH Metiltestosterona CH3 O Tratamiento sustitutivo Hipogonadismos primarios y secundarios de ambos sexos Síndromes de insensibilidad a los andrógenos (algunos casos) Déficit androgénico de la menopausia Terapia anabolizante Osteoporosis del anciano Síndromes catabólicos En infecciones por el virus de la inmunodeficiencia humana en ambos sexos Otras indicaciones Disfunción eréctil Contraceptación masculina Aumento de la capacidad atlética (utilización no autorizada) Envejecimiento Anemias: aplástica, de Fanconi, del fallo renal Edema angioneurótico una a 3 semanas); habitualmente 200 mg cada 2 semanas consiguen mantener concentraciones normales de testosterona. La administración de testosterona en gel transdérmico es cómoda y útil. Los síndromes de insensibilidad a los andrógenos (AIS) cursan con fenotipos muy variables. El receptor de los andrógenos (RA), factor de transcripción que actúa sobre genes diana, tiene como li- TERAPÉUTICA Uso terapéutico de los andrógenos E. Vilardell Latorre gandos la testosterona y DHT, y sus concentraciones constituyen uno de los principales determinantes de la función de los RA. Variaciones en sus concentraciones durante la diferenciación sexual masculina explicarían su variabilidad fenotípica. En algunos pacientes la administración de 100 mg i.m. de testosterona cada 4 semanas a edades de 11-12 meses produce una importante masculinización6. Tratamiento sustitutivo en mujeres En las mujeres los valores de testosterona total, testosterona libre y androstenediona (A) y los de deshidroepiandrosterona (DHEA) y deshidroepiandrosterona sulfato (DHEA-S) disminuyen progresivamente con la edad. Después de una ooforectomía las concentraciones de testosterona y de A descienden aproximadamente un 50%. También disminuyen con el uso de contraceptivos orales o si se siguen tratamientos sustitutivos con estrógenos, que aumentan la globulina fijadora de las hormonas sexuales (SHBG). El tratamiento con estrógenos tiene poco efecto sobre la libido, que se relaciona más con las concentraciones de testosterona libre. La testosterona mejora la función sexual y la calidad de vida en mujeres jóvenes con menopausia prematura y en el síndrome de Turner. La asociación de andrógenos al tratamiento estrogénico induce mayor aumento de la densidad mineral ósea y de los marcadores óseos que cuando se administran sólo estrógenos. La testosterona estimula la proliferación de osteoblastos y la DHT aumenta la formación de éstos7. Se utilizan: – Metiltestosterona por vía oral (entre 1,25 y 2,5 mg) combinada con estrógenos esterificados; su administración prolongada puede producir toxicidad hepática y contrarrestar los efectos beneficiosos de los estrógenos sobre los lípidos. – Implantes de testosterona efectivos entre 3 y 6 meses a dosis de 50 mg; ésteres de testosterona en inyección intramuscular, 50100 mg cada 4 a 6 semanas. – Parches transdérmicos de testosterona a dosis de 125 µ de testosterona/día 2 veces por semana y cremas o gel de aplicación transdérmica o liberadas por vía transvaginal. En mujeres posmenopáusicas debe utilizarse la testosterona al mismo tiempo que se sigue un tratamiento estrogénico sustitutivo. En mujeres mayores con osteoporosis se ha propuesto el uso del decanoato de nandrolona (andrógeno débilmente aromatizable). No se conoce si hay alguna relación entre la terapia androgénica y la incidencia de cáncer de mama. Los RA se encuentran en más de un 50% de tumores de mama y se asocian con supervivencia mayor y mejores respuestas al tratamiento hormonal. Administración de andrógenos a varones normales y como terapia anabolizante En varones normales la producción androgénica y la fertilidad pueden estar conservadas aún a edades avanzadas. El eje hipotálamo-hipofisogonadal se afecta con la edad. La función de las células de Sertoli y la actividad espermatogénica valoradas indirectamente a través de la medición de la inhibina B parecen conservarse, si bien existe un aumento progresivo de FSH relacionado con la edad8,9. En adultos jóvenes y en muchachos prepuberales normales los andrógenos aromatizables y no aromatizables aumentan significativamente la síntesis corporal total de proteínas y de proteína muscular. La testosterona, pero no la DHT, aumenta la tasa de producción de somatotropa (GH) y ejercería esta acción a través de su aromatización a estrógenos10. La administración de testosterona a dosis superiores a la secreción diaria disminuye el volumen testicular un 20% y la producción de esperma en un 90% o más, sin cambios en el volumen del eyaculado. Análogos de 17 alfa-alquílicos de testosterona disminuyen las concentraciones de ésta y a dosis altas también la espermatogénesis. Los efectos secundarios desaconsejan su utilización como medida contraceptiva. Como contraceptivo hormonal masculino están indicados los preparados inyectables a dosis altas, solos o en combinación con levonorgestrol (gestágeno oral)11. El mejor método para diagnosticar un déficit androgénico es la determinación de testosterona libre no fijada a la SHBG. En el envejecimiento existe una relación positiva entre testosterona libre y fuerza muscular y densidad mineral ósea, y negativa con la masa grasa12. La síntesis hepática de SHBG está influenciada por hormonas peptídicas, esteroides, tiroxina y dieta. Los lignanos y las isoflavonas aumentan la síntesis y secreción de SHBG, y en mujeres posmenopáusicas se ha observado una correlación positiva entre valores de fitoestrógenos y valores de SHBG, con aumentos como mínimo de un 33%13. Dietas lactovegetarianas14 conducen a una elevación de la DHEA-S plasmática y reducen la producción urinaria de DHEA-S. En varones mayores las dietas bajas en proteínas15 pueden producir elevación de SHBG y disminución de la testosterona total. El tratamiento con testosterona es beneficioso en la osteoporosis del anciano16. Algunos estudios17 no consiguen demostrar mejoría significativa en la densidad mineral ósea (DMO) después de 36 meses de tratamiento. La idea de que los llamados hipogonadismos relativos18 del anciano (testosterona en valores bajos) puedan ser responsables de muchos de los síntomas del envejecimiento (disminución de fuerza muscular, de energía, libido y potencia) ha ganado predicamento. Si se aceptase que la causa está en la declinación de las concentraciones de testosterona, este tratamiento debería ser considerado en todos los ancianos. Se ha utilizado como tratamiento en la talla baja y sobre todo puede ser útil para inducir el desarrollo puberal en los casos de pubertad diferida masculina. La talla final no mejora en ningún caso. Otras indicaciones 1. Disfunción eréctil. En el pene la testosterona ejerce su acción vía interacción específica con el RA de las células de músculo liso y podría ser esencial en el mantenimiento de la actividad eréctil mediada por el óxido nítrico19. No parece que la terapia con testosterona sea siempre efectiva en la disfunción sexual en varones con concentraciones normales bajas de testosterona. 2. Aumento del balance nitrogenado y desarrollo muscular, mejora de estados catabólicos. La administración de testosterona reduce la excreción urinaria de nitrógeno, sodio, potasio y cloro, y produce ganancia de peso. Después de infecciones, traumatismos o cirugía, las proteínas corporales son destruidas más rápidamente que sintetizadas, con lo cual un exceso de nitrógeno se elimina por la orina. Los anabólicos pueden mejorar el balance. El déficit de andrógenos es una complicación habitual en varones con VIH. Las mujeres infectadas por este virus presentan también cifras de testosterona libre y total por debajo de la media normal. Al comparar a estas mujeres con mujeres normales se ha observado que la aplicación de testosterona en parches aumenta menos los valores de testosterona total y libre, presumiblemente por un aclaramiento plasmático aumentado o una absorción disminuida20,21. 3. Andrógenos y capacidad atlética. En realidad representa una forma de utilización abusiva de drogas. Varias líneas de investigación indican que los andrógenos tienen un efecto beneficioso sobre la fuerza. Aumentan la síntesis de proteínas musculares y la TERAPÉUTICA Uso terapéutico de los andrógenos E. Vilardell Latorre masa muscular. Cantidades farmacológicas de ésteres de testosterona aumentan la retención nitrogenada y la masa corporal magra. 4. Estimulación de la eritropoyesis, tratamiento de anemias refractarias. Se ha utilizado en anemias asociadas con fallo de la médula ósea, mielofibrosis o ambas, y en la anemia del fallo renal. 5. Edema angioneurótico hereditario. EFECTOS SECUNDARIOS Los principales son: – Retención de sodio (riesgo en cardiopatías y en fallo renal). – Aumentos de hematócrito con riesgo de aumentar la viscosidad. – Aumentos modestos del volumen prostático en hipogonadales; se excluye de este tratamiento a pacientes con problemas prostáticos. El PSA aumenta, pero dentro de límites normales. – Priapismo. – Efectos virilizantes en mujeres y niños de ambos sexos; también pueden aparecer efectos feminizantes. – Cambios lipídicos según la dosis, vía de administración y tipo de andrógeno; en general cursa con disminución del colesterol total del HDL, y elevación de LDL. Hiperlipemia ocasional. – Alteraciones de la función hepática (elevaciones de fosfatasas alcalinas y de bilirrubina), ictericia por reacción de hipersensibilidad. La peliosis hepática es la complicación más grave. En pacientes con anemia de Fanconi tratados con andrógenos se ha descrito presentación de hepatomas. Bibliografía 1. Gregory JW, Greene SA, Thompson J, Scrimgeour CM, Rennie MJ. Effects of oral testosterone undecanoate on growth, body composition, strength and energy expenditure of adolescents boys. Clin Endocrinol 1992; 37: 207-213. 2. Partsch CJ, Weinbauer GF, Fang R, Nieschlag E. Injectable testosterone undecanoate has more favourable pharmacokinetics and pharmacodynamics than testosterone enanthate. Er J Endocrinol 1995; 132: 514-519. 3. Salehian B, Wang C, Alexander G, Davidson T, McDonald V, Berman N et al. Pharmacokinetics, bioefficacy, and safety of sublingual testosterone cyclodextrin in hypogonadal men: comparison to testoterone enanthate. A clinical research center study. J Clin Endocrinol Metab 1995; 80: 3567-3575. 4. Wang C, Eyre DR, Clark R, Kleinberg D, Newman C, Iranmanesh A et al. Sublingual testosterone replacement improves muscle man and strenght, decreases bone resorption, and increases bone formation markers in hypogonadal men. A clinical research center study. J Clin Endocrinol Metab 1996; 81: 36543662. 5. Wang C, Swedloff RS, Iranmanesh A, Dobs A, Snyder PJ, Cunningham G et al. Transdermal testosterone gel improves sexual function, mood, muscle strenght, and body composition parameters in hypogonadal men. J Clin Endocrinol Meta 2000; 85: 2839-2853. TERAPÉUTICA Uso terapéutico de los andrógenos E. Vilardell Latorre 6. Holterhus P-M, Sinnecker HG, Hiort O. Phenotypic diversity and testosteroneinduced normalization of mutant L712F androgen receptor function in a kindred with androgen insensitivity. J Clin Endocrinol Metab 2000; 85: 3245-3250. 7. Zborowski JV, Cauley JA, Talbott EO, Guzick DS, Winters SJ. Bone mineral density, androgens, and the polycistic ovary: the complex and controversial issue of androgenic influence in female bone. J Clin Endocrinol Metab 2000; 85: 3496-3506. 8. Anderson RA. Sertoli cell function in the ageing male. Clin Endocrinol 2000; 53: 139-140. 9. Mahmoud AM, Goemaere S, De Bacquer D, Comhaire FH, Kaufman JM. Serum inhibin B levels in community-dwelling elderly men. Clin Endocrinol 2000; 53: 141-147. 10. Mauras N, O’Brien JO, Klein KO, Hayes V. Estrogen supression in males: metabolic effects. J Clin Endocrinol Metab 2000; 85: 2370-2377. 11. Kamischke A, Plöger D, Venherm S, Von Eckardstein S, Von Eckardstein A, Nieschlag E. Intramuscular testosterone undecanoate with or without oral levonorgestrel: a randomized placebo-controlled feasability study for male contraception. Clinical Endocrinology 2000; 53: 43-52. 12. Van den Beld AW, De Jong FH, Grobbee DE, Pols HA, Lamberts SWJ. Measures of bioavailable serum testosterone and estradiol and their relationships with muscle strenght, bone density, and body composition in elderly men. J Clin Endocrinol Metab 2000; 85: 3276-3282. 13. Pino AM, Valladares LE, Palma MA, Mancilla AM, Yáñez M, Albala C. Dietary isoflavones affect sex hormone-binding globulin levels in postmenopausal women. J Clin Endocrinol Metab 2000; 85: 2797-2800. 14. Remer T, Pietrzik K, Manz F. Short-tem impact of a lactovegetarian diet on adrenocortical activity and adrenal androgens. J Clin Endocrinol Metab 1998; 83: 2132-2137. 15. Longcope C, Feldman HA, McKinlay JB, Araujo AB. Diet and sex hormonebinding globulin. J Clin Endocrinol Metab 2000; 85: 293-296. 16. Snyder PJ, Peachey H, Berlin JA, Hannoush P, Haddad G, Dlewati A et al. Effects of testosterone replacement in hypogonadal men. J Clin Endocrinol Metab 2000; 85: 2670-2677. 17. Snyder PJ, Peachey H, Hannoush P, Berlin JA, loh L, Holmes JH et al. Effects of testosterone treatment on bone mineral density in men over 65 years of age. J Clin Endocrinol Metab 1999; 84: 1966-1972. 18. Hayes FJ. Testosterone-fountain of youth or drug of abuse? J Clin Endocrinol Metab 85: 3020-3023. 19. Aversa A, Isidori AM, De Martino MU, Caprio M, Fabbrini E, RocchiettiMarch M et al. Androgens and penile erection: evidence for a direct relationship between free testosterone and cavernous vasodilatation in men with erectile dysfunction. Clin Endocrinol 2000; 53: 517-522. 20. Davis S. Androgen replacement in women: a commentary. J Clin Endocrinol Metab 1999; 84: 1886-1891. 21. Javanbakht M, Singh AB, Mazer NA, Beall G, Sinha-Hikim I, Shen R et al. Pharmacokinetics of a novel testosterone matrix transdermal system in healthy, premenopausal women and women infected with the human immunodeficiency virus. J Clin Endocrinol Metab 2000; 85: 2395-2401.









