Comentarios, opiniones y revisiones
Anuncio

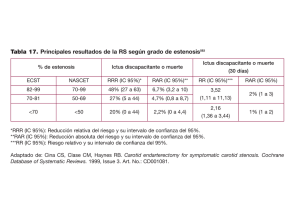
Comentarios, opiniones y revisiones Revisión sistemática de los riesgos perioperatorios de ictus y muerte tras la angioplastia carotídea con implantación de stent Emmanuel Touzé, PhD; Ludovic Trinquart, MSc; Gilles Chatellier, PhD; Jean-Louis Mas, MD Antecedentes y objetivo. No se ha demostrado que la angioplastia carotídea con implantación de stent (ACIS) sea igual de segura que la endarterectomía carotídea (EDAC) por lo que respecta a los riesgos de complicaciones periintervención, aunque después del periodo postoperatorio, los riesgos observados son comparables, lo cual sugiere que la ACIS puede ser una opción aceptable en pacientes seleccionados. Sin embargo, no se han establecido claramente los factores de riesgo para el ictus y la muerte perioperatorios. El objetivo de este estudio fue estimar los riesgos absolutos de ictus o muerte a 30 días tras la ACIS e investigar los orígenes de la heterogeneidad. Métodos. Llevamos a cabo una búsqueda de artículos publicados entre enero de 1990 y junio de 2008, mediante el empleo de las bases de datos de MEDLINE, EMBASE y COCHRANE, una búsqueda manual, libros de resúmenes de congresos y sitios web oficiales. Dos revisores seleccionaron de manera independiente y por duplicado los artículos relativos a los riesgos de la ACIS, con independencia del tipo de tratamiento, el diseño de estudio, el contexto o el idioma de publicación. Los 2 revisores se encargaron de realizar una extracción de los datos y de evaluar la calidad de los estudios. Resultados. Se incluyeron un total de 206 estudios independientes (con 54.713 pacientes). El riesgo global de ictus o muerte a 30 días fue del 4,7% (IC del 95%, 4,1 a 5,2), con una heterogeneidad sustancial entre los diversos estudios. Los pacientes sintomáticos presentaban una probabilidad de sufrir complicaciones aproximadamente doble de la existente en los pacientes con estenosis asintomáticas. El riesgo de ictus o muerte a 30 días fue del 7,6% (3,6 a 9,1) en los pacientes sintomáticos y del 3,3% (2,6 a 4,1) en los pacientes asintomáticos. Los riesgos aumentaban con la edad, la hipertensión y los antecedentes de enfermedad coronaria; no estaban relacionados con el sexo ni con la presencia de una oclusión carotídea contralateral; y eran menores en los pacientes con una reestenosis carotídea tras la EDAC y en los tratados utilizando un dispositivo de protección cerebral. Además, los riesgos han disminuido a lo largo del tiempo. Conclusiones. Los riesgos de ACIS presentan una variación sustancial en los diversos estudios. En general son mayores que los de la EDAC en pacientes sintomáticos. Es probable que algunos factores sean útiles para seleccionar a los candidatos adecuados para la ACIS. (Traducido del inglés: Systematic Review of the Perioperative Risks of Stroke or Death After Carotid Angioplasty and Stenting. Stroke. 2009;40:e683-e693.) Palabras clave: stroke n carotid disease n stenting n angioplasty n atherosclerosis n systematic review L a estenosis de la arteria carótida interna extracraneal explica del 15% al 20% de los ictus isquémicos, según cuál sea la población estudiada1. La eficacia de la endarterectomía carotídea (EDAC) para la prevención del ictus en pacientes con estenosis carotídea está bien establecida, sobre todo en los pacientes con estenosis sintomáticas1-3. La angioplastia carotídea con implantación de stent (ACIS), una posible alternativa terapéutica a la EDAC, se ha evaluado en unos pocos ensayos aleatorizados y en múltiples estudios no aleatorizados, con la participación de muchos especialistas, como neurólogos, radiólogos, cardiólogos, cirujanos vasculares y neurocirujanos, la mayor parte de los cuales han aplicado ya esta técnica en su práctica clínica4. Sin embargo, en recientes ensayos aleatorizados y metaanálisis no se ha podido demostrar que la ACIS sea igual de segura que la EDAC en lo relativo a los riesgos de complicaciones periintervención4–12 y las guías terapéuticas actuales recomiendan que no se utilice la ACIS en los pacientes que son candidatos adecuados para el tratamiento quirúrgico2,3,13. No obstante, los ensayos clínicos han indicado también que, después del periodo perioperatorio, el riesgo de ictus homolateral es muy bajo y comparable en los pacientes tratados con ACIS y con EDAC10,14,15, Recibido el 8 de julio de 2009; revisión final recibida el 25 de agosto de 2009; aceptado el 4 de setiembre de 2009. Université Paris Descartes, INSERM U894 (E.T., J.-L.M.), Hôpital Sainte-Anne, Service de Neurologie, e INSERM CIE4 (L.T., G.C.), Assistance Publique-Hôpitaux de Paris, Unité de recherche clinique, Hôpital Européen Georges Pompidou, París, Francia. Los dos primeros autores contribuyeron por igual a la obtención y análisis de los datos y a la redacción del artículo. Correspondencia: Emmanuel Touzé, MD, PhD, Université Paris Descartes, INSERM U894, Department of Neurology, Hôpital Sainte-Anne, 1 rue Cabanis, 75014 Paris, Francia. E-mail [email protected] © 2009 American Heart Association, Inc. Stroke está disponible en http://www.strokeaha.org DOI: 10.1161/STROKEAHA.109.562041 22 Touzé y cols. Revisión sistemática de los riesgos perioperatorios de ictus y muerte... 23 Tabla 1. Estrategia de búsqueda en MEDLINE y EMBASE Estrategia de búsqueda en PubMed (“Carotid stenosis” Mesh AND (“stents” Mesh OR “angioplasty” Mesh OR “angioplasty, balloon” Mesh ) AND (“treatment outcome” Mesh OR “postoperative complications” Mesh OR “myocardial infarction” Mesh OR “stroke” Mesh OR “brain ischemia” Mesh OR “death” Mesh OR “death, sudden, cardiac” Mesh OR “mortality” Mesh )) OR (“carotid stenosis” AND (“carotid angioplasty” OR “stent”*) AND (“stroke” OR “myocardial infarction” OR “death” OR “mortality”) AND (“1990” PDat :”2008/06” PDat ) AND (“humans” Mesh ) ) Estrategia de búsqueda en EMBASE (“Carotid artery obstruction”/exp AND (“stent”/exp OR “angioplasty”/exp OR “percutaneous transluminal angioplasty”/exp) AND (“treatment outcome”/exp OR “postoperative complication”/exp OR “heart infarction”/exp OR “cerebrovascular accident”/exp OR “stroke”/exp OR “brain ischemia”/exp OR “death”/exp OR “sudden death”/exp) NOT “review” /lim AND “humans” /lim AND 1990 –2008 /py) lo cual sugiere que la ACIS puede ser una opción aceptable en pacientes seleccionados que presentan un riesgo bajo de complicaciones periintervención. Sin embargo, en la actualidad no existe ningún método que permita seleccionar a los pacientes que son candidatos adecuados para una ACIS. Además, aunque la ACIS se utiliza ampliamente en algunos centros, no se sabe si el riesgo absoluto de la ACIS observado en los ensayos clínicos aleatorizados puede generalizarse a la práctica clínica cotidiana. Los riesgos de complicaciones tras la EDAC y su relación con diferentes subgrupos se han estimado en varios estudios y metaanálisis16–20, pero no existen datos similares par la ACIS. Algunos estudios han puesto de manifiesto que es probable que el riesgo de complicaciones tras la ACIS esté relacionado con algunas características de los pacientes y con aspectos técnicos. Sin embargo, el número de complicaciones observadas en estudios específicos fue generalmente bajo, y ello impide extraer una conclusión fiable. Por otra parte, muchos de los estudios se han centrado en pacientes con un riesgo quirúrgico percibido alto, lo que lleva a plantear la hipótesis de que estos pacientes deben ser candidatos adecuados para una ACIS4,21. Sin embargo, es posible que las comorbilidades asociadas a un riesgo perioperatorio superior con la EDAC aumenten también el riesgo periintervención en la ACIS. Así pues, hemos realizado una revisión sistemática de los estudios en los que se ha descrito el riesgo de ictus, muerte e infarto de miocardio (IM) tras la ACIS, con objeto de estimar los riesgos absolutos e investigar la posible relación entre los riesgos observados y el diseño del estudio, la población incluida, los factores clínicos y los aspectos técnicos. Métodos Antes de realizar la revisión, elaboramos un protocolo que incluía los fundamentos y objetivos, junto con una descripción de los métodos de investigación propuestos y los planes para la obtención y el análisis de los datos. El manuscrito se preparó según lo establecido en las guías MOOSE22. Criterios de selección y estrategia de búsqueda Se consideraron elegibles para la revisión los estudios que cumplían las siguientes características: (1) incluían a pacien- tes con estenosis sintomáticas y/o asintomáticas situadas en la región de la bifurcación carotídea; (2) los pacientes eran tratados con angioplastia, fuera cual fuera el tipo de tratamiento concreto utilizado (angioplastia con balón con o sin implantación de stent), la vía de acceso arterial y el uso de protección cerebral; y (3) era posible extraer información relativa al número de episodios (ictus, IM o muerte). Se excluyeron los estudios para los que se había reclutado tan solo a un grupo de población específico (reestenosis tras una EDAC, estenosis post-radioterapia, displasia fibromuscular, disección carotídea, y pacientes tratados en un contexto de urgencia). Realizamos una búsqueda de los artículos publicados entre enero de 1990 y junio de 2008 sobre los riesgos de ictus, muerte o IM tras una ACIS, con independencia del diseño de estudio, el contexto o el idioma de publicación. Se llevaron a cabo búsquedas electrónicas con el empleo de MEDLINE y EMBASE , utilizando tanto los términos de clasificación de temas médicos (medical subject heading terms) como las palabras del texto (Tabla 1), y en la base de datos de la COCHRANE Library (CENTRAL y DARE). Realizamos búsquedas manuales en las listas de bibliografía de todos los artículos incluidos, de todos los artículos de revisión relevantes, de nuestros archivos personales y de las páginas de índice de las 3 revistas en las que se había identificado un mayor número de artículos elegibles en las búsquedas electrónicas (Journal of Vascular Surgery, Journal of Endovascular Therapy y Catheter Cardiovascular Interventions). Con objeto de identificar los estudios recientes todavía no publicados en forma de artículos completos, realizamos también una búsqueda en los libros de resúmenes de los congresos recientes (Joint World Congress on Stroke 2006, American Heart Association International Stroke Conferences 2007 y 2008, European Stroke Conferences 2007 y 2008, congresos de la Cardiovascular and Interventional Radiological Society of Europe 2006 y 2007, congresos de Transcatheter Cardiovascular Thera­peutics 2006 y 2007, sesiones del American College of Cardiol­ogy Scientific 2007 y 2008, y congresos de la Society of Interven­tional Radiology 2007 y 2008), así como de los sitios web del registro de ensayos clínicos (www.clinicaltrials.gov), la Food and Drug Administration de EEUU (www.fda.gov) y la Agencia Europea del Medicamento (www. emea.europa.eu). Selección de los estudios y obtención de los datos Dos revisores se encargaron de evaluar, de manera independiente y por duplicado, la elegibilidad de las referencias bibliográficas identificadas mediante la estrategia de búsqueda, mediante el examen de los títulos y luego de los resúmenes de los artículos. En cada paso, las discrepancias aparecidas se resolvieron mediante el debate. La selección final se realizó tras haber revisado los artículos completos correspondientes a todos los artículos que o bien cumplían los criterios de selección o bien no estaba del todo clara la selección según lo indicado en el resumen. En los casos de publicaciones múltiples relativas a la misma población, se eligió la que presentaba un número más elevado de pacientes para el análisis del riesgo absoluto. Se obtuvieron datos adicionales de subgrupos del ensayo SPACE solicitándolos a los autores8. Los 2 24 Stroke Marzo 2010 Medline y Embase 53 referencias de otras fuentes Cochrane Library, FDA, EMEA, libros de resúmenes, archivos personales, listas de bibliografía 1.796 títulos examinados 605 resúmenes examinados 457 referencias elegibles para una revisión completa Figura 1. Diagrama de flujo de la selección de los estudios. 510 referencias analizadas con el texto completo Población no independiente (149) Resultados no disponibles (69) Muy seleccionados (56) 206 poblaciones independientes 234 referencias incluidas revisores se encargaron de extraer los datos mediante un formulario estandarizado (que puede solicitarse a los autores). La calidad de cada estudio fue evaluada con un esquema ya existente23 que adaptamos a nuestro contexto y que incluía la siguiente lista de criterios: (1) diseño (ensayo aleatorizado frente a estudios de cohortes/registros), (2) contexto (estudio de un solo centro frente a estudio multicéntrico), (3) forma de inclusión de los pacientes (prospectiva frente a retrospectiva, y consecutiva frente a no consecutiva), (4) descripción de la población (adecuada frente a insuficiente) y (5) evaluación del resultado (evaluación sistemática por un neurólogo tras la intervención, sí frente a no). La descripción de la población se consideró adecuada cuando se describían suficientemente el marco de referencia del muestreo, el reclutamiento, los criterios de inclusión y exclusión y las características basales de la muestra en estudio. La evaluación sistemática por parte de un neurólogo hacía referencia a que todos los pacientes fueran examinados por un neurólogo a los 30 días (resultados a los 30 días) o antes del alta (episodios periintervención o intrahospitalarios), tanto si el paciente presentaba un episodio de la variable de valoración como si no. Síntesis y análisis de los datos Las variables de valoración principales fueron los riesgos a 30 días de ictus; ictus o muerte; o ictus, IM o muerte. Las variables de valoración secundarias fueron los riesgos intrahospitalarios y periintervención (en las primeras 24 horas). Cuando no estaba claro el momento exacto de la evaluación de las complicaciones, sin un seguimiento sistemático a los 30 días, consideramos que se trataba de episodios de complicaciones periintervención. Las estimaciones combinadas del riesgo se calcularon por separado para las diferentes variables de valoración. Cada proporción individual obtenida se transformó primero en una cantidad con la transformación estabilizadora de varianzas de Freeman-Tukey24. Se calculó una media ponderada de las proporciones transformadas, utilizando un modelo de efectos aleatorios de DerSimonianLaird25. La proporción combinada se calculó mediante la retrotransformación de esta media ponderada26. Con objeto de explorar los posibles orígenes de la heterogeneidad, realizamos en primer lugar comparaciones de subgrupos según los siguientes factores: forma de presentación clínica (sintomática frente a asintomática; ictus frente a ataque isquémico transitorio; episodio cerebral frente a episodio ocular), edad (>75 a 80 frente a <75 a 80 años), sexo, diabetes mellitus, enfermedad coronaria (EC), enfermedad arterial periférica (EAC), oclusión carotídea contralateral, reestenosis tras la EDAC frente a lesión aparecida de novo, estructura de la placa (ulcerada frente a lisa, presencia de calcificación), momento de realización de la ACIS (<14 días frente a >14 días tras el episodio de isquemia cerebral), lado de la lesión tratada y uso de un dispositivo de protección cerebral. Estas comparaciones se llevaron a cabo dentro de cada estudio. Calculamos los riesgos relativos (RR) combinados para el conjunto de todos los estudios utilizando un metaanálisis de efectos fijos, según el método de MantelHaenszel, o bien con el empleo de un metaanálisis de efectos aleatorios de DerSimonian-Laird, según fuera apropiado. A continuación realizamos comparaciones indirectas de los riesgos absolutos combinados, según la forma de presentación clínica y las características de calidad del estudio que se han definido antes y evaluamos los posibles cambios del riesgo a lo largo del tiempo, mediante un análisis de metarregresión. Utilizamos un modelo normal logístico que especificaba la distribución binomial de la variable dependiente (riesgo de ictus o muerte a 30 días) y un efecto aleatorio para tener en cuenta la varianza compartida dentro del estudio27. Se calculó el año de mitad de cohorte, definido como el punto medio del periodo de inclusión, para cada estudio si se disponía de información sobre el periodo de inclusión, y se consideró una covariable. Evaluamos los sesgos de publicación mediante un análisis visual simple de los gráficos de embudo en el metaanálisis de los riesgos absolutos, puesto que no hay pruebas estadísticas validadas para la detección de la asimetría, y utilizamos gráficos de embudo y la prueba de Egger en las comparaciones de subgrupos28. En todos los análisis, se evaluó la inconsistencia de los resultados en los diversos estudios utilizando el parámetro estadístico Q de Cochran y Touzé y cols. Revisión sistemática de los riesgos perioperatorios de ictus y muerte... 25 Tabla 2. Calidad, características de la población y aspectos técnicos de los estudios incluidos Número Número de de estudios (%), pacientes (Número de intervenciones) Total 206* Calidad del estudio Tabla 3. Estimaciones combinadas de los riesgos absolutos de ictus, muerte o IM, según el momento de valoración de los resultados tras la ACIS Ictus Ictus, muerte Ictus, IM, muerte Episodios a 30 días Contexto Multicéntrico 36 (17) 34 898 (35 502) 113 63 170 (83) 19 815 (20 684) Número de estudios incluidos 118 Un solo centro 10 (5) 1613 (1613) Número de pacientes 27 186 25 237 17 291 Número de intervenciones 28 149 26 145 17 858 Diseño ECA (EDAC frente a ACIS) ECA (otros)† 3 ( 1) 144 (144) 193 (94) 52 956 (54 430) Prospectiva 83 (40) 24 878 (25260) Retrospectiva 42 (20) 8580 (8881) No se indica claramente 81 (40) 21 255 (22045) Riesgo combinado (IC del 95%) P(het) 119 (58) 29 485 (30250) I² (IC del 95%) 87 (42) 25 228 (25936) Episodios intrahospitalarios Se describe el marco de referencia del muestreo Se describen los criterios de inclusión 154 (75) 140 (68) 38 056 (39 354) 36 487 (37 429) Se describen las características basales 132 (64) Evaluación realizada por un neurólogo Registro Inclusión de pacientes Consecutiva No se indica claramente Descripción de la población 3,9% (3,4 a 4,4) 0,0001 67% (60 a 73) 4,7% (4,1 a 5,2) 0,0001 69% (62 a 74) 5,3% (4,6 a 6,0) 0,0001 64% (52 a 72) Número de estudios incluidos 53 48 19 34832 (3552) Número de pacientes 11 694 7912 1723 79 (39) 26 286 (26 835) 12 073 8243 1806 Se indica la definición de la variable de valoración de ictus 87 (43) 37 499 (38 292) Número de intervenciones Presencia de al menos 1 neurólogo en la relación de autores 66 (32) 9075 (9410) Evaluación de las variables de valoración Número de estudios con datos disponibles Mediana (RIC) Características de la población Número de pacientes 206 90 (41 to 204) Número de intervenciones 20 6 94 (43 to 215) Porcentaje de varones 179 71 (65 to 80) Media de edad, años 180 70 (67 to 71) Porcentaje de pacientes sintomáticos 180 50 (33 to 78) Porcentaje de pacientes diabéticos 128 31 (24 to 38) Porcentaje de pacientes con reestenosis carotídea 95 14 (7 to 24) Porcentaje de pacientes con estenosis carotídea post-irradiación 47 5 (2 to 9) Porcentaje de pacientes con EC 104 60 (40 to 71) Porcentaje de pacientes con EAC 44 28 (20 to 37) Porcentaje de pacientes con oclusión carotídea contralateral 79 10 (6 to 14) Riesgo combinado (IC del 95%) P(het) 3,9% (3,2 a 4,6) 0,0001 0,0001 0,11 I² (IC del 95%) 56% (41 a 68) 54% (36 a 67) 30% (0 a 60) Ningún paciente tratado con protección cerebral, n estudios (%) 201 54 (27) Todos los pacientes tratados con protección cerebral, n estudios (%) 201 71 (35) Porcentaje de intervenciones satisfactorias, mediana (RIC) 109 98 (97–100) RIC indica rango intercuartiles. *Incluye también resúmenes. †ECA en los que se comparan diferentes estrategias en pacientes tratados con ACIS. 4,6% (3,5 a 5,9) 53 40 13 Número de pacientes 9003 3893 979 Número de intervenciones 9413 4199 1006 3,7% (2,6 a 5,0) 4,0% (2,6 a 5,7) Episodios periintervención* Número de estudios incluidos Riesgo combinado (IC del 95%) P(het) Aspectos técnicos 4,1% (3,3 a 5,0) I² (IC del 95%) 3,5% (2,7 a 4,4) 0,0001 71% (61 a 78) 0,0001 66% (53 a 76) 0,23 21% (0 a 59) P (het) indica el valor de P asociado a la prueba de χ² para la heterogeneidad; I², porcentaje de la variabilidad en las estimaciones del efecto que se debe a la heterogeneidad y no al error de muestreo (aleatorio). Se calcularon estimaciones combinadas del riesgo por separado para las distintas variables de valoración. Cada proporción individual se transformó primero en una cantidad con la transformación estabilizadora de la varianza de Freeman-Tukey24. Se calculó una media ponderada de las proporciones transformadas mediante un modelo de efectos aleatorios de DerSimonian-Laird24. Se calculó la proporción combinada mediante la retrotransformación de esta media ponderada. *Incluye también los episodios en los que no estaba claro el momento de la determinación. el parámetro estadístico I2 con el IC del 95% asociado; este último correspondía al porcentaje de variabilidad debida a la heterogeneidad entre los estudios y no al error de muestreo 26 Stroke Marzo 2010 Figura 2. Valores combinados de los RR de ictus y de ictus o muerte en diferentes subgrupos. p(het) indica el valor de probabilidad asociado a la prueba estadística de χ2 de Cochran para la heterogeneidad; I2, porcentaje de la variabilidad en las estimaciones del efecto que se debe a la heterogeneidad y no al error de muestreo (aleatorio); NA, no evaluable; AIT, ataque isquémico transitorio; y p(sig), valor de p para la significación. Utilizamos un modelo de efectos fijos para calcular las estimaciones combinadas, excepto cuando sucedía que p(het) < 0,10 o I2 > 30%, en cuyo caso se utilizó un modelo de efectos aleatorios. Véanse las Figuras II y III del suplemento para los valores de cada metaanálisis individual. Se combinaron los resultados evaluados a los 30 días, en el momento del alta, durante la intervención o cuando no se conocía el momento de valoración. La comparación corresponde a sí frente a no, salvo que se indique lo contrario. A, RR combinado (IC del 95%) para ictus o muerte (véase también la Figura II del suplemento). B, RR combinado (IC del 95%) para ictus (véase también la Figura III disponible solamente online). (aleatorio)29,30. Según el manual Cochrane, la heterogeneidad se clasificó como moderada (I2 ≥30%), substancial (I2 ≥50%) o considerable (I2 ≥75%)31. Consideramos significativo un valor de probabilidad bilateral <0,05. El análisis estadístico se realizó con los programas SAS versión 9.1 y MIX (http:// mix-for-metaanálisis.info). Resultados De los 1.796 artículos identificados en nuestra búsqueda electrónica en MEDLINE y EMBASE, se examinaron 605 resúmenes y se obtuvieron 457 artículos para la evaluación del texto completo (Figura 1). Identificamos otros 53 artículos o resúmenes a partir de otras fuentes. De las 510 re- Touzé y cols. Revisión sistemática de los riesgos perioperatorios de ictus y muerte... 27 Figura 3. Riesgo absoluto de ictus o muerte a 30 días (%) tras la ACIS en 91 estudios (18.538 pacientes) según el año de mitad de cohorte, junto con una metarregresión de efectos aleatorios de resumen. El área de cada círculo es inversamente proporcional a la varianza del riesgo absoluto. ferencias bibliográficas analizadas de manera detallada, 206 correspondían a estudios independientes que fueron considerados elegibles (133 solamente en cuanto al riesgo absoluto, 62 en cuanto al riesgo absoluto y los subgrupos, y 11 en cuanto a los subgrupos solamente). Dada la existencia de múltiples publicaciones de algunos registros, con diferentes análisis de subgrupos, los 206 estudios independientes dieron origen a 234 presentaciones de datos (212 artículos completos, 19 resúmenes, 2 documentos de la Food and Drug Administration de EEUU y 1 documento presentado en un sitio web) relevantes para nuestro análisis. En la Tabla 2 se presentan las características resumidas de los estudios incluidos, y la lista de referencias bibliográficas y características de los trabajos individuales pueden consultarse en la Tabla I del suplemento disponible online en http://ictus.ahajournals. org. En el conjunto de 206 estudios independientes (54.713 pacientes), había 10 ensayos clínicos aleatorizados (ECA) en los que se comparaba la ACIS con la EDAC (1.613 pa­ cientes)5,7,8,21,32–37, 3 ECA en los que se comparaban estrategias diferentes en pacientes tratados con ACIS (144 pacientes)38–40 y 193 registros (52.956 pacientes). Había 32 estudios (2.922 pacientes) en los que un 95% o más de los pacientes tenían una estenosis sintomática, 2 estudios (136 pacientes) en los que el 95% o más de los pacientes tenían una estenosis carotídea asintomática, y 172 estudios (51.655 pacientes) que incluían a pacientes tanto sintomáticos como asintomáticos. Aproximadamente la mitad (51%) de los estudios iniciaron el reclutamiento de pacientes antes de 2000. Como se muestra en la Tabla 2, un 83% de los estudios se habían realizado en un solo centro y en el 40% se indicaba que eran prospectivos. La descripción de la población era adecuada en el 46%, y la evaluación de los resultados fue realizada por un neurólogo independiente en el 40% de los estudios publicados en forma de artículos completos. Se identificó una población plenamente descrita y una evaluación neurológica de los resultados en 49 (26%) de los estudios publicados en forma de artículo completo. De los 172 estudios que incluyeron a pacientes sintomáticos y asintomáticos, 36 (21%) presentaron los riesgos de ACIS estratificados según la forma de presentación clínica. De los 173 estudios que indicaban claramente el tipo de tratamiento realizado, 161 (93%) eran estudios en los que más del 90% de los pacientes fueron tratados con implantación de stents. Las características principales de los ECA y los registros fueron muy similares en lo relativo a la edad (mediana, 69 frente a 70 años), la proporción de varones (mediana, 71% frente a 71%), la proporción de pacientes con oclusión carotídea contralateral (mediana, 10% frente a 10%) y la proporción de pacientes con EC (mediana, 57% frente a 61%). La proporción de pacientes sintomáticos fue mayor en los ECA que en los registros (mediana, 81% frente a 49%). En cambio, en los registros era más probable que en los ECA haber incluido a pacientes con reestenosis tras una EDAC (mediana, 15% frente a 8%), la presencia de pacientes con diabetes (mediana, 32% frente a 24%) y el haber tratado a pacientes utilizando dispositivos de protección cerebral (mediana, 83% frente a 42%). 28 Stroke Marzo 2010 Figura 4. Riesgo combinado de ictus o muerte a 30 días tras la ACIS, estratificado según la indicación clínica y con una estratificación adicional respecto al diseño de estudio y a si los resultados fueron evaluados o no por un neurólogo. La línea a trazos corresponde al riesgo a 30 días combinado para los diversos ECA y en todos los datos de registros. Se realizó una evaluación neurológica independiente en todos los ECA. Algunos ECA no pudieron ser incluidos en este análisis porque no se dispuso de una evaluación de los resultados de ictus o muerte a los 30 días. En la Tabla 3 se indican las estimaciones combinadas de los riesgos absolutos según el momento en el que se realizaba la evaluación del resultado. El riesgo a 30 días de ictus fue del 3,9% (IC del 95%, 3,4 a 4,4; 118 estudios; 27.186 pacientes); el de ictus o muerte fue del 4,7% (IC del 95%, 4,1 a 5,2; 113 estudios; 25.237 pacientes); y el de ictus, muerte o IM fue del 5,3% (IC del 95%, 4,6 a 6,0; 63 estudios; 17.291 pacientes). Los correspondientes riesgos intrahospitalarios y periintervención fueron ligeramente inferiores. Sin embargo, había una heterogeneidad sustancial entre los distintos estudios. La exclusión de los resúmenes o de los estudios postcomercialización que podrían haber incluido a pacientes considerados también en los estudios individuales publicados, no modificó las estimaciones (datos no mostrados). Por lo que respecta a la calidad de los estudios, los análisis de metarregresión indicaron que el riesgo de ictus o muerte a 30 días no estaba relacionado con el contexto de realización del estudio (multicéntrico 4,8% frente a unicéntrico, 4,6%, p = 0,77), ni con el reclutamiento de pacientes consecutivos (sí 4,6% frente a no 4,8%, p = 0,89). Sin embargo, el riesgo era más alto cuando había una descripción adecuada de la población (sí 5,2% frente a no 4,0%, p =0,04), en el caso de una inclusión prospectiva (sí 5,2% frente a no 4,2%, p = 0,07), y cuando la evaluación era realizada por un neurólogo (sí 5,4% frente a no 4,1%, p = 0,02). No observamos indicio alguno de sesgo de publicación en el análisis visual de los gráficos de embudo del tamaño muestral de los estudios en relación con el riesgo absoluto de ictus o muerte, puesto que había igual número de estudios de menor tamaño con riesgos de complicaciones altos y bajos (Figura I del suplemento, accesible online en http://ictus.ahajournals.org). Los resultados fueron similares para el ictus y para el conjunto de ictus, IM o muerte (datos no mostrados). En la Figura 2 se presenta un resumen de los RR combinados de ictus y de ictus o muerte con la ACIS para los diferentes análisis de subgrupos preespecificados, por separado en función de los síntomas clínicos, las características de los Touzé y cols. Revisión sistemática de los riesgos perioperatorios de ictus y muerte... 29 pacientes (incluidos los factores de riesgo vascular y los antecedentes patológicos previos), las características de la estenosis y los factores técnicos. (Pueden consultarse los gráficos de Forest de los correspondientes análisis en las Figuras II y III del suplemento). Las estenosis sintomáticas (RR = 1,86; IC del 95%, 1,61 a 2,14), los episodios cerebrales frente a los oculares (RR = 2,28; IC del 95%, 1,08 a 4,77), la edad >75 a 80 años (RR = 1,93; IC del 95%, 1,66 a 2,24), la EC (RR = 1,41; IC del 95%, 0,97 a 2,06), los antecedentes de bypass arterial coronario (RR = 2,21; IC del 95%, 1,03 a 4,72), y la EAC (RR = 2,04; IC del 95%, 0,92 a 4,52) se asociaron a un riesgo superior de ictus o muerte tras la ACIS. Hubo también una tendencia a un riesgo superior de complicaciones en los pacientes que presentaban placas calcificadas. En cambio, el riesgo de ictus o muerte tras la ACIS fue inferior en los pacientes tratados por una enfermedad carotídea causada por una reestenosis tras una EDAC, en comparación con los tratados por una estenosis carotídea aterosclerótica (RR = 0,45; IC del 95%, 0,28 a 0,71). El empleo de sistemas de protección cerebral se asoció a un menor riesgo de ictus o muerte (RR = 0,57; IC del 95%, 0,43 a 0,76). El riesgo de ictus o muerte no estaba relacionado con el sexo, la oclusión carotídea contralateral, la diabetes mellitus, la ulceración de la placa, el momento de realización de la ACIS o el lado de la lesión tratada. Se observaron resultados similares en cuanto al resultado de ictus, excepto porque la hipertensión se asociaba de manera significativa a un riesgo superior de complicaciones (RR = 1,86; IC del 95%, 1,30 a 2,68). A diferencia de la heterogeneidad sustancial observada en las estimaciones combinadas de los riesgos absolutos, la heterogeneidad en estas estimaciones combinadas de los RR fue nula o tan solo moderada. No observamos indicio alguno de sesgos de publicación en estos análisis en los gráficos de embudo ni en la prueba de Egger (datos no mostrados). El riesgo combinado de ictus a 30 días fue del 6,3% (IC del 95%, 4,8 a 8,0) en los estudios con un año de mitad de cohorte anterior a 1998, del 5,0% (IC del 95%, 4,1 a 5,9) en los estudios con un año de mitad de cohorte situado entre 1998 y 2002, y del 3,9% (IC del 95%, 3,0 a 4,9) en los estudios con un año de mitad de cohorte posterior a 2002. Un análisis de metarregresión tomando el año de mitad de cohorte como covariable puso de manifiesto una reducción significativa del riesgo de ictus o muerte a los 30 días a lo largo del tiempo, que correspondía a una reducción del RR de ≈6% anual (91 estudios, p <0,0001; Figura 3). Se obtuvo un resultado similar al utilizar el año de publicación en vez del año de mitad de cohorte (p <0,0001) o al considerar el ictus solamente en vez del ictus o la muerte (datos no presentados). En la Figura 4 se muestran los riesgos absolutos combinados a 30 días para el ictus o la muerte, estratificados según la indicación clínica y con una estratificación adicional según el diseño del estudio y según que los resultados fueran evaluados o no por un neurólogo. En los pacientes con estenosis sintomáticas, el riesgo absoluto global de ictus o muerte a los 30 días fue del 7,6% (IC del 95%, 6,3 a 9,1; 42 estudios; 4.910 pacientes). Ese riesgo era superior en la ECA (10,8%; IC del 95%, 6,8 a 15,5) en comparación con los registros que incluían solamente a pacientes sintomáticos (7,3%; IC del 95%, 5,3 a 9,6; p = 0,16) y en comparación con los subgru- pos de pacientes sintomáticos incluidos en otros registros (7,0%; IC del 95%, 5,2 a 9,0; p = 0,04). El riesgo absoluto de ictus o muerte a 30 días no fue significativamente mayor en los estudios en los que hubo una evaluación neurológica independiente en comparación con los estudios en los que no estaba claro que el método de evaluación de los resultados estuviera a cargo de un neurólogo independiente. En los pacientes con estenosis asintomáticas, sólo hubo un ECA en el que no se hubiera evaluado claramente el riesgo de ictus o muerte a 30 días34, y 1 de los estudios de registro incluyó únicamente a pacientes asintomáticos41. El riesgo absoluto global de ictus o muerte fue del 3,3% (IC del 95%, 2,6 a 4,1; 23 estudios; 8.504 pacientes). Al igual que para la estenosis sintomática, los riesgos no fueron significativamente mayores en los estudios en los que se utilizó una evaluación neurológica independiente. Todos estos resultados fueron similares al utilizar la presencia de al menos 1 neurólogo en la relación de autores como indicador de calidad, en vez de la evaluación neurológica independiente (datos no presentados). Discusión En primer lugar, hemos evidenciado que el riesgo global de ictus o muerte a 30 días después de una ACIS es de ≈5%, pero presenta variaciones sustanciales en los distintos estudios. Estas variaciones pueden ser consecuencia de diferencias en la combinación de tipos de casos, el diseño, la calidad del estudio o la pericia de los médicos que realizan las intervenciones. En segundo lugar, los riesgos de la ACIS dependen de la indicación clínica, de tal manera que los pacientes sintomáticos tienen una probabilidad de presentar complicaciones aproximadamente doble de la de los pacientes con estenosis asintomáticas; y dependen también de características de los pacientes que son asimismo factores de riesgo quirúrgico elevado, como la edad, la hipertensión y los antecedentes de EC (incluido el bypass arterial coronario). En cambio, otros factores de riesgo quirúrgico elevado establecidos o bien no parecieron influir en el riesgo de complicaciones de la ACIS (sexo femenino y oclusión carotídea contralateral) o bien se asociaron incluso a un riesgo inferior (reestenosis carotídea tras una EDAC). En consecuencia, nuestros resultados sugieren claramente que hay factores clínicos simples que es probable que faciliten la selección de los candidatos adecuados para la ACIS en futuros ensayos clínicos de comparación de esta técnica con la EDAC, y finalmente en la práctica clínica. Por último, nuestros resultados sugieren que los riesgos del tratamiento han disminuido a lo largo del tiempo, y que el uso de un dispositivo de protección cerebral se asocia a un riesgo de complicaciones inferior. Identificamos un total de 206 estudios que presentaban datos sobre los riesgos de la ACIS, en 54.713 pacientes. Debe señalarse que los pacientes de ECA suponían solamente un 3% de la población total, lo cual subraya el grado en el que esta técnica se ha venido aplicando en la práctica clínica a pesar del bajo nivel de la evidencia existente. Dada la heterogeneidad sustancial existente entre los estudios, nuestras estimaciones combinadas de los riesgos operatorios absolutos no pueden interpretarse de manera directa. Sin embargo, el IC del 95% obtenido en un metaanálisis de efectos aleatorios describe bien la incertidumbre relativa al riesgo medio. 30 Stroke Marzo 2010 Por ejemplo, para el conjunto de todos los estudios, el riesgo de ictus o muerte a 30 días fue, con el intervalo de confianza del 95%, al menos igual al 4,1% y de hasta un 5,2%. Es interesante señalar que se ha observado una heterogeneidad similar en revisiones sistemáticas previas de los riesgos de la EDAC16–18. La heterogeneidad existente entre los estudios tienen varios orígenes que pudimos identificar. Está claramente establecido que el efecto beneficioso de la EDAC depende en gran medida de la indicación clínica, de tal manera que se observa un efecto beneficioso superior en los pacientes sintomáticos en comparación con los asintomáticos, así como que el riesgo de complicaciones perioperatorias es superior en los pacientes sintomáticos17,18,42,43. En una revisión sistemática anterior se observó que solamente ≈25% de los estudios realizados en la EDAC habían estratificado sus resultados en función de que los pacientes fueran asintomáticos o sintomáticos16. De forma análoga, nosotros observamos que solamente un 21% de los estudios de la ACIS presentaban los riesgos estratificados según la indicación clínica. Hemos evidenciado que, al igual que en la EDAC, los pacientes sintomáticos tienen una probabilidad aproximadamente doble de la de los pacientes asintomáticos de sufrir complicaciones después de la ACIS. Este resultado se basa en análisis de subgrupos, es decir, en la comparación de los pacientes sintomáticos y asintomáticos dentro de los mismos estudios, y no observamos una heterogeneidad entre los distintos estudios a este respecto. Para los pacientes sintomáticos, observamos que el riesgo de ictus o muerte a 30 días de la ACIS era del 7,6%, con un límite inferior del IC del 95% del 6,3%, valor éste que es superior al riesgo a 30 días asociado a la EDAC según lo observado en una revisión sistemática anterior (5,1%; IC del 95% 4,6 a 5,6)16. Este nivel de riesgo es también superior al umbral de riesgo establecido por los comités ad hoc de las guías del American Heart Association Stroke Council, que indican que el riesgo combinando de ictus y muerte como consecuencia de la EDAC no debe ser superior al 5% para los pacientes con ataques isquémicos transitorios y al 7% en los pacientes con ictus2,3. Aun siendo cuestionable, esta comparación de los riesgos absolutos combinados concuerda plenamente con el metaanálisis de ECA de comparación de la ACIS con la EDAC en pacientes sintomáticos y pone de manifiesto que la ACIS se asocia a un aumento del 40% en el riesgo de ictus o muerte a 30 días12. Hemos observado también que el riesgo fue mayor en los ECA en comparación con los registros. Es probable que la definición de la estenosis sintomática fuera diferente en los distintos estudios, aunque esta información no puede extraerse con facilidad de las publicaciones (por ejemplo, algunos registros consideraban los ictus correspondientes a cualquier territorio o en cualquier periodo de tiempo). Además, al igual que en el caso de la EDAC18, nuestros resultados sugieren que la calidad de la evaluación neurológica explica en parte las diferencias observadas. Aunque la mayoría de los pacientes incluidos en los registros presentaban estenosis asintomáticas, obtuvimos datos específicos muy limitados sobre los riesgos de la ACIS en esos pacientes. El riesgo global de ictus o muerte a 30 días con la ACIS fue del 3,3%, con un límite inferior del IC del 95% de 2,6%. Ese nivel de riesgo está próximo al que se da con la EDAC (2,8%; IC del 95%, 2,4 a 3,2)16 y al umbral de riesgo del 3% establecido en las directrices para la estenosis asintomática2,3. Muchos registros se han centrado en los pacientes que tienen un riesgo quirúrgico elevado según un conjunto de criterios, que varían en número y tipo, y han planteado la hipótesis de que esos pacientes debieran ser candidatos adecuados para la ACIS4. Los factores que se citan con frecuencia como asociados a un riesgo quirúrgico superior son factores anatómicos como las lesiones no accesibles quirúrgicamente, la EDAC o la irradiación cervical previas, la edad avanzada, la oclusión carotídea contralateral y las comorbilidades médicas. Sin embargo, no hay una evidencia que indique que en los pacientes de riesgo quirúrgico elevado se obtenga un efecto beneficioso con alguna otra estrategia de revascularización en comparación con el tratamiento médico solo44. Además, es posible que las comorbilidades asociadas a un mayor riesgo perioperatorio en la EDAC aumenten también el riesgo periintervención de la ACIS. Los estudios en los que se ha investigado si los factores que identifican a los pacientes de riesgo quirúrgico elevado tienen alguna influencia en los riesgos de la ACIS han tenido generalmente una potencia estadística baja para poder extraer conclusiones fiables. Aunque los análisis previos de ECA y de registros han indicado de manera uniforme que la edad tiene tan solo una influencia pequeña en el riesgo de complicaciones tras la EDAC45, los pacientes ancianos se consideran un grupo de riesgo quirúrgico elevado y posibles candidatos adecuados para la ACIS. De hecho, nosotros observamos que la edad se asociaba a un aumento de ≈2 veces en el riesgo de complicaciones tras la ACIS, lo cual sugiere que la edad tienen más influencia en los riesgos de la ACIS que en los riesgos de la EDAC. Es interesante señalar que varios estudios han indicado que los pacientes de mayor edad tienen una mayor probabilidad de presentar vasos tortuosos con una calcificación intensa que probablemente aumentan el riesgo de embolización durante la manipulación de la guía y los cambios de catéter en algunas de las fases de la ACIS46,47. Otra observación importante de nuestro análisis es que, a diferencia de la EDAC, en la que las mujeres tienen un riesgo de complicaciones superior al de los varones, los riesgos de la ACIS no muestran una relación con el sexo. Sin embargo, aunque en ambos casos están próximos a 1 y no son significativos, los RR combinados de las mujeres respecto a los varones en cuanto al ictus y en cuanto al ictus o la muerte, se encuentran a cada lado del valor 1. De hecho, los resultados obtenidos para el ictus eran consecuencia en gran parte de los del registro CAPTURE, en el que las mujeres presentaron un riesgo de ictus ligeramente superior en el análisis univariado, pero no en los análisis multivariados 48. La ausencia de efecto del sexo sobre el riesgo de ACIS se ha demostrado también en 2 estudios recientes, publicados fuera del periodo de inclusión definido para nuestra revisión sistemática49,50. La inclusión de esos estudios no hubiera modificado nuestras estimaciones [RR combinado para el ictus = 1,02; IC del 95%, 0,87 a 1,27; p(het) = 0,87; RR combinado para el ictus o la muerte = 0,90; IC del 95%, 0,74 a 1,10; p(het) =0,84]. Touzé y cols. Revisión sistemática de los riesgos perioperatorios de ictus y muerte... 31 Nuestra observación de que los riesgos de la ACIS no dependen de la oclusión carotídea contralateral y de que son inferiores en los pacientes con una reestenosis tras la EDAC es también importante, puesto que permite identificar a una posible población diana en la que la ACIS podría compararse con la EDAC. Por último, aunque se obtuvieron a partir de datos más limitados, y coincidiendo con lo indicado por datos previos sobre la EDAC, nuestros resultados sugieren que los riesgos de la ACIS son mayores en los pacientes que sufrieron un episodio cerebral en comparación con los que presentaron un episodio ocular, y que los antecedentes previos de EC pueden no ser útiles para la selección de los candidatos adecuados para la ACIS. Hay algunas razones que podrían explicar que los factores de riesgo para las complicaciones puedan diferir en la EDAC y la ACIS. El mayor riesgo de complicaciones tras la EDAC en las mujeres suele atribuirse al hecho de que la arteria carótida interna es más pequeña en ellas que en los varones, lo cual predispone a los errores técnicos o a la trombosis postoperatoria inmediata, si bien esta hipótesis ha sido puesta en duda51,52. La cirugía de la reestenosis carotídea se asocia a un riesgo elevado de complicaciones, debido probablemente a las importantes modificaciones fibrosas postoperatorias que se producen en el tejido cervical y al hecho de que la reestenosis se deba con frecuencia a una hiperplasia de la mioíntima más que a la aterosclerosis53. Aunque en los pacientes sintomáticos con reestenosis, el efecto beneficioso a largo plazo de la EDAC continúa justificando el riesgo quirúrgico inmediato y hace que sea inferior al riesgo del tratamiento médico solo, la única evidencia derivada de estudios aleatorizados sugiere que los pacientes asintomáticos con reestenosis evolucionan ligeramente mejor con el tratamiento médico1. Dado que la ACIS no requiere una incisión cervical ni arterial, es probable que los factores anatómicos relacionados con el sexo o con la EDAC previa sean superados por la ACIS. La oclusión carotídea contralateral puede comprometer los mecanismos de compensación y, por consiguiente, la perfusión cerebral durante el pinzamiento de la arteria carotídea que es necesario para practicar la EDAC. La menor duración de la oclusión carotídea durante la ACIS, en comparación con la EDAC, podría explicar la ausencia de aumento del riesgo operatorio durante la ACIS. En cambio, otros factores como la edad, la hipertensión y los antecedentes de EC o EAC, tienen una intensa asociación con la gravedad y la extensión de la aterosclerosis y es probable que estén relacionados con el riesgo de complicaciones tromboembólicas durante el avance arterial por la aorta y la arteria carótida. Con el empleo de un análisis de metarregresión, observamos que los riesgos de la ACIS han disminuido a lo largo del tiempo, entre 1993 y 2006. Esto puede ser consecuencia de mejoras en la técnica de la ACIS, los dispositivos utilizados o la formación de los especialistas, así como de una mejor selección de los pacientes candidatos para la ACIS a lo largo del tiempo. El desarrollo de dispositivos de protección frente a la embolia durante la intervención de ACIS puede haber sido un avance importante. Las revisiones sistemáticas anteriores de series de casos sin asignación aleatoria indicaron que el uso de los dispositivos de protección cerebral parece reducir las complicaciones tromboembólicas durante la ACIS54 y también la incidencia de nuevas lesiones isquémicas, mayoritariamente asintomáticas en la resonancia magnética con ponderación de difusión obtenida en las primeras 48 horas siguientes a la ACIS55,56. Nuestros resultados, obtenidos a partir de un mayor número de estudios, concuerdan con estos datos previos. Sin embargo, hubo una heterogeneidad significativa entre los distintos estudios en este análisis. De hecho, la aparente ventaja de los dispositivos de protección cerebral podría ser ilusoria. Ciertamente, el uso de estos dispositivos de protección ha aumentado con el paso del tiempo, y el aparente efecto protector puede haberse visto afectado por los efectos de confusión derivados de los avances en las técnicas de implantación de stents y en la selección de los pacientes a lo largo del tiempo. Podría reflejar también la selección de los pacientes. Además, continúa sin haber datos de estudios aleatorizados en los que se compare la ACIS con o sin protección cerebral, y puesto que los dispositivos de protección deben superar la estenosis arterial, es posible que los propios dispositivos pudieran causar complicaciones. Nuestro estudio tiene varias posibles limitaciones. En primer lugar, la existencia de factores de confusión constituye una amenaza importante en un metaanálisis de estudios observacionales, puesto que los análisis de subgrupos se basan en comparaciones univariadas. Solamente un metaanálisis de los datos individuales permitiría abordar esta cuestión. Sin embargo, nuestros análisis de subgrupos fueron muy uniformes en los diversos estudios y disponen de explicaciones fisiopatológicas plausibles. Además, con el empleo de un enfoque similar para la EDAC, todos los factores de riesgo para las complicaciones observadas en las revisiones sistemáticas de los estudios de registros se reprodujeron en un análisis combinado de los datos individuales de ECA16– 20,43. Así pues, es improbable que nuestros resultados sean falsamente positivos. En segundo lugar, aunque incluimos los estudios publicados en cualquier idioma y utilizamos múltiples fuentes de datos, los sesgos de publicación podrían haber distorsionado nuestros resultados, puesto que los registros con un riesgo de complicaciones bajo podrán tener una mayor probabilidad de haber sido publicados. Sin embargo, con el empleo de gráficos de dispersión de puntos sencillos, puesto que no hay ninguna prueba estadística validada para valorar el sesgo de publicación en un metaanálisis de riesgos absolutos, no observamos indicio alguno de sesgos de publicación. Además, los sesgos de publicación son improbables en los análisis de subgrupos, dado que es improbable que las posibilidades de publicación estén relacionadas con los resultados de los análisis de subgrupo, y no observamos indicio alguno de sesgos de este tipo en los gráficos de embudo. Por otra parte, los RR no suelen depender del riesgo absoluto. En tercer lugar, la posible inclusión de datos duplicados podrían haber distorsionado nuestros resultados57. Sin embargo, examinamos detalladamente la relación de autores y el contexto de cada artículo con objeto de excluir en la mayor medida posible las poblaciones duplicadas. Además, realizamos análisis de sensibilidad excluyendo algunos registros amplios que podrían haber incluido a pacientes cuyos datos se hubieran publicado también en estudios unicéntricos más pequeños, y los resultados obtenidos fueron similares. En cuarto lugar, la heterogeneidad 32 Stroke Marzo 2010 existente en la calidad de los datos constituye otro problema en los metaanálisis de estudios observacionales. Aunque la calidad de la evaluación de las variables de valoración fue diferente en los distintos estudios, nuestros resultados no se vieron influidos por este parámetro. En quinto lugar, algunos análisis de subgrupos (por ejemplo, tipo de episodio cerebrovascular, aspecto superficial de la placa o antecedentes de bypass arterial coronario) se basaron en un número relativamente bajo de estudios y requerirían datos de confirmación adicionales. Por último, hay otros posibles factores de riesgo para las complicaciones que no pudieron ser evaluados. Por ejemplo, el papel de la experiencia del operador y la curva de aprendizaje no pudieron evaluarse en nuestra revisión sistemática, puesto que no había una definición estandarizada de esos factores en los distintos estudios. Es probable que los factores anatómicos arteriales influyan también en la viabilidad y los riesgos de la ACIS58. En resumen, los riesgos de la ACIS son globalmente superiores a los de la EDAC en los pacientes sintomáticos. Nuestros resultados respaldan la recomendación de las actuales guías en cuanto a que la ACIS no debe utilizarse en los pacientes que son candidatos adecuados para el tratamiento quirúrgico. Sin embargo, también sugieren que existen factores que es probable que faciliten la selección de los candidatos adecuados para la ACIS en futuros ensayos y finalmente en la práctica clínica. Agradecimientos Quisiéramos agradecer especialmente a Peter A. Ringleb y a los investigadores del SPACE que nos proporcionaran datos de subgrupos no publicados de este ensayo. Damos las gracias a Marta Pasquini, Enrico Floβmann, Kaori Floβmann, Hu Chau, Maria Koziak, Daniel Freddy, Didier Leys, Ghislain Nokam, Barish Turak y Suzanne Vobecky por su ayuda en la extracción de los datos de artículos publicados en lenguas diferentes del francés y el inglés. Agradecemos también a Bernard Beyssen y Olivier Naggara sus recomendaciones sobre aspectos técnicos y a Isabelle Laurent su apoyo técnico. Ninguna. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. Declaraciones de intereses Bibliografía References 1. Chaturvedi S, Bruno A, Feasby T, Holloway R, Benavente O, Cohen SN, Cote R, Hess D, Saver J, Spence JD, Stern B, Wilterdink J. Carotid endarterectomy–an evidence-based review: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology. 2005;65:794 – 801. 2. Goldstein LB, Adams R, Alberts MJ, Appel LJ, Brass LM, Bushnell CD, Culebras A, Degraba TJ, Gorelick PB, Guyton JR, Hart RG, Howard G, Kelly-Hayes M, Nixon JV, Sacco RL. Primary prevention of ischemic stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council: cosponsored by the Atherosclerotic Peripheral Vascular Disease Interdisciplinary Working Group; Cardiovascular Nursing Council; Clinical Cardiology Council; Nutrition, Physical Activity, and Metabolism Council; and the Quality of Care and Outcomes Research Interdisciplinary Working Group: the American Academy of Neurology affirms the value of this guideline. Stroke. 2006; 37:1583–1633. 3. Sacco RL, Adams R, Albers G, Alberts MJ, Benavente O, Furie K, Goldstein LB, Gorelick P, Halperin J, Harbaugh R, Johnston SC, Katzan I, Kelly-Hayes M, Kenton EJ, Marks M, Schwamm LH, Tomsick T. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/American Stroke Association Council on Stroke: Co-Sponsored by the Council on Cardiovascular Radiology and 16. 17. 18. 19. 20. 21. 22. Intervention: The American Academy of Neurology affirms the value of this guideline. Stroke. 2006;37:577– 617. Touzé E, Calvet D, Chatellier G, Mas JL. Carotid stenting. Curr Opin Neurol. 2008;21:56 – 63. Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial. Lancet. 2001;357:1729 –1737. Coward LJ, Featherstone RL, Brown MM. Safety and efficacy of endovascular treatment of carotid artery stenosis compared with carotid endarterectomy: a Cochrane systematic review of the randomized evidence. Stroke. 2005;36:905–911. Mas JL, Chatellier G, Beyssen B, Branchereau A, Moulin T, Becquemin JP, Larrue V, Lievre M, Leys D, Bonneville JF, Watelet J, Pruvo JP, Albucher JF, Viguier A, Piquet P, Garnier P, Viader F, Touze E, Giroud M, Hosseini H, Pillet JC, Favrole P, Neau JP, Ducrocq X. Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis. N Engl J Med. 2006;355:1660 –1671. Ringleb PA, Allenberg J, Bruckmann H, Eckstein HH, Fraedrich G, Hartmann M, Hennerici M, Jansen O, Klein G, Kunze A, Marx P, Niederkorn K, Schmiedt W, Solymosi L, Stingele R, Zeumer H, Hacke W. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet. 2006;368:1239 –1247. Ringleb PA, Chatellier G, Hacke W, Favre JP, Bartoli JM, Eckstein HH, Mas JL. Safety of endovascular treatment of carotid artery stenosis compared with surgical treatment: a meta-analysis. J Vasc Surg. 2008; 47:350 –355. Gurm HS, Yadav JS, Fayad P, Katzen BT, Mishkel GJ, Bajwa TK, Ansel G, Strickman NE, Wang H, Cohen SA, Massaro JM, Cutlip DE. Long-term results of carotid stenting versus endarterectomy in high-risk patients. N Engl J Med. 2008;358:1572–1579. Jeng JS, Liu HM, Tu YK. Carotid angioplasty with or without stenting versus carotid endarterectomy for carotid artery stenosis: a meta-analysis. J Neurol Sci. 2008;270:40 – 47. Ederle J, Featherstone RL, Brown MM. Randomized controlled trials comparing endarterectomy and endovascular treatment for carotid artery stenosis: a Cochrane systematic review. Stroke. 2009;40:1373–1380. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis. 2008;25:457–507. Eckstein HH, Ringleb P, Allenberg JR, Berger J, Fraedrich G, Hacke W, Hennerici M, Stingele R, Fiehler J, Zeumer H, Jansen O. Results of the Stent-Protected Angioplasty versus Carotid Endarterectomy (SPACE) study to treat symptomatic stenoses at 2 years: a multinational, prospective, randomised trial. Lancet Neurol. 2008;7:893–902. Mas JL, Trinquart L, Leys D, Albucher JF, Rousseau H, Viguier A, Bossavy JP, Denis B, Piquet P, Garnier P, Viader F, Touze E, Julia P, Giroud M, Krause D, Hosseini H, Becquemin JP, Hinzelin G, Houdart E, Henon H, Neau JP, Bracard S, Onnient Y, Padovani R, Chatellier G. Endarterectomy Versus Angioplasty in Patients with Symptomatic Severe Carotid Stenosis (EVA-3S) trial: results up to 4 years from a randomised, multicentre trial. Lancet Neurol. 2008;7:885– 892. Bond R, Rerkasem K, Rothwell PM. Systematic review of the risks of carotid endarterectomy in relation to the clinical indication for and timing of surgery. Stroke. 2003;34:2290 –2301. Rothwell PM, Slattery J, Warlow CP. A systematic comparison of the risks of stroke and death due to carotid endarterectomy for symptomatic and asymptomatic stenosis. Stroke. 1996;27:266 –269. Rothwell PM, Slattery J, Warlow CP. A systematic review of the risks of stroke and death due to endarterectomy for symptomatic carotid stenosis. Stroke. 1996;27:260 –265. Rothwell PM, Slattery J, Warlow CP. Clinical and angiographic predictors of stroke and death from carotid endarterectomy: systematic review. BMJ. 1997;315:1571–1577. Rothwell PM, Eliasziw M, Gutnikov SA, Warlow CP, Barnett HJ. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet. 2004;363:915–924. Yadav JS, Wholey MH, Kuntz RE, Fayad P, Katzen BT, Mishkel GJ, Bajwa TK, Whitlow P, Strickman NE, Jaff MR, Popma JJ, Snead DB, Cutlip DE, Firth BG, Ouriel K. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med. 2004;351: 1493–1501. Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D, Moher D, Becker BJ, Sipe TA, Thacker SB. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis Of 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. Observational 283:2008 –2012 Hayden JA, Co studies in syste Freeman M, T square root. An DerSimonian R Trials. 1986;7: Trinquart L, To lessons from a atherosclerosis. Gao S. Combin Comput. 2004; Egger M, Dav detected by a s Higgins JP, Th Stat Med. 2002 Higgins JP, Th tency in meta-a Higgins JPT, G of Intervention Collaboration, Alberts MJ. Re carotid artery s Abstract. Brooks WH, M angioplasty and in a community Brooks WH, M angioplasty and asymptomatic hospital. Neuro Hoffman A, En EW, Lyrer P. prospective ra follow-up (BA 84 – 89. Ling F, Jiao L stenting for th (TESCAS-C). Naylor AR, Bo London NJ, B stenting versus 1998;28:326 –3 Dalainas I, Nan antiplatelet reg Cardiovasc Int Kaposzta Z, S-nitrosoglutath angioplasty. Ci Jordan WD Jr, cost compariso my for the tre 16 –22. Marine LA, Ru Treatment of as after carotid s standard-risk p Redgrave JN, R Curr Opin Neu Rothwell PM, MR, Warlow domised contr stenosis. Lance Ederle J, Feath vascular treatm patients not su Vertebral Arte brovasc Dis. 2 Bond R, Rerka associations be endarterectomy Bazan HA, Pra aortic arch cal affirms the value of tenting. Curr Opin h carotid stenosis in Angioplasty Study 1729 –1737. d efficacy of endod with carotid endndomized evidence. oulin T, Becquemin Watelet J, Pruvo JP, F, Touze E, Giroud X. Endarterectomy e carotid stenosis. HH, Fraedrich G, Kunze A, Marx P, Zeumer H, Hacke otected angioplasty ents: a randomised i JM, Eckstein HH, otid artery stenosis J Vasc Surg. 2008; J, Bajwa TK, Ansel o JM, Cutlip DE. ectomy in high-risk or without stenting sis: a meta-analysis. ed controlled trials nt for carotid artery ;40:1373–1380. transient ischaemic edrich G, Hacke W, n O. Results of the erectomy (SPACE) multinational, pro3–902. eau H, Viguier A, , Touze E, Julia P, zelin G, Houdart E, ni R, Chatellier G. ymptomatic Severe from a randomised, iew of the risks of ation for and timing comparison of the my for symptomatic . view of the risks of tic carotid stenosis. angiographic preectomy: systematic P, Barnett HJ. Endion to clinical sub–924. n BT, Mishkel GJ, pma JJ, Snead DB, ery stenting versus Med. 2004;351: son GD, Rennie D, nalysis of observag. Meta-analysis Of S-nitrosoglutathione reduces asymptomatic embolization after carotid Endarterectomy Versus Angioplasty in Patients with Symptomatic Severe angioplasty. Circulation. 2002;106:3057–3062. Carotid Stenosis (EVA-3S) trial: results up to 4 years from a randomised, 40. Jordan WD Jr, Roye GD, Fisher WS III, Redden D, McDowell HA. A multicentre trial. Lancet Neurol. 2008;7:885– 892. cost comparison of balloon angioplasty and stenting versus endarterecto16. Bond R, Rerkasem K, Rothwell PM. Systematic review of the risks of my for the treatment of carotid artery stenosis. J Vasc Surg. 1998;27: carotid endarterectomy in relation to the clinical indication for and timing 16 –22. of surgery. Stroke. 2003;34:2290 –2301. 41. Marine LA, Rubin BG, Reddy R, Sanchez LA, Parodi JC, Sicard GA. 17. Rothwell PM, Slattery J, Warlow CP. A systematic comparison of the Touzé y cols. Revisión sistemáticaTreatment de los riesgos perioperatorios de ictus y muerte... 33 of asymptomatic carotid artery disease: similar early outcomes risks of stroke and death due to carotid endarterectomy for symptomatic after carotid stenting for high-risk patients and endarterectomy for and asymptomatic stenosis. Stroke. 1996;27:266 –269. standard-risk patients. J Vasc Surg. 2006;43:953–958. 18. Rothwell PM, Slattery J, Warlow CP. A systematic review of the risks of Observational in Epidemiology group. JAMA. 2000; 42. Redgrave JN, Rothwell PM. Asymptomatic carotid stenosis: what to do. stroke and deathStudies due to endarterectomy for(MOOSE) symptomatic carotid stenosis. 283:2008 –2012. –265. Curr Opin Neurol. 2007;20:58 – 64. Stroke. 1996;27:260 23.Rothwell Hayden JA, P, Bombardier C. CP. Evaluation the quality of prognosis 43. Rothwell PM, Eliasziw M, Gutnikov SA, Fox AJ, Taylor DW, Mayberg 19. PM,Cote Slattery J, Warlow Clinicalofand angiographic prestudiesofin stroke systematic Ann carotid Intern Med. 2006;144:427– 437. MR, Warlow CP, Barnett HJ. Analysis of pooled data from the randictors and reviews. death from endarterectomy: systematic 24.review. Freeman M, 1997;315:1571–1577. Tukey J. Transformations related to the angular and the domised controlled trials of endarterectomy for symptomatic carotid BMJ. square root. Math M, Stat. 1950;21:607– 611. CP, Barnett HJ. Endstenosis. Lancet. 2003;361:107–116. 20. Rothwell PM,Ann Eliasziw Gutnikov SA, Warlow 25.arterectomy DerSimonian Laird N. Meta-analysis in clinical trials. ControlsubClin 44. Ederle J, Featherstone RL, Brown MM. Long-term outcome of endoforR, symptomatic carotid stenosis in relation to clinical Trials.and 1986;7:177–188. vascular treatment versus medical care for carotid artery stenosis in groups timing of surgery. Lancet. 2004;363:915–924. 26.Yadav Trinquart L, TouzéMH, E. Pitfalls meta-analysis of observational studies: patients not suitable for surgery and randomised in the Carotid and 21. JS, Wholey Kuntz in RE, Fayad P, Katzen BT, Mishkel GJ, lessonsTK, from a systematic review of theJaff risks of stenting forSnead intracranial Vertebral Artery Transluminal Angioplasty study (CAVATAS). CereBajwa Whitlow P, Strickman NE, MR, Popma JJ, DB, atherosclerosis. 2009;40:e586 – e587. brovasc Dis. 2009;28:1–7. Cutlip DE, Firth Stroke. BG, Ouriel K. Protected carotid-artery stenting versus 27.endarterectomy Gao S. Combining using theN logistic J Stat 45. Bond R, Rerkasem K, Cuffe R, Rothwell PM. A systematic review of the in binomial high-riskdata patients. Engl Jnormal Med. model. 2004;351: Comput. 2004;74:293. associations between age and sex and the operative risks of carotid 1493–1501. 28.Stroup Egger DF, M, Berlin Davey JA, SG,Morton Schneider Minder C. Bias in endarterectomy. Cerebrovasc Dis. 2005;20:69 –77. 22. SC, M, Olkin I, Williamson GD,meta-analysis Rennie D, detected a simple, graphical test. BMJ. – 634. 46. Bazan HA, Pradhan S, Mojibian H, Kyriakides T, Dardik A. Increased Moher D, by Becker BJ, Sipe TA, Thacker SB.1997;315:629 Meta-analysis of observa29.tional Higgins JP, Thompson SG. Quantifying a meta-analysis. aortic arch calcification in patients older than 75 years: implications studies in epidemiology: a proposal heterogeneity for reporting. in Meta-analysis Of for carotid artery stenting in elderly patients. J Vasc Surg. 2007;46: Stat Med. 2002;21:1539 –1558. 841– 845. 30. Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsis47. Lam RC, Lin SC, DeRubertis B, Hynecek R, Kent KC, Faries PL. The tency in meta-analyses. BMJ. 2003;327:557–560. impact of increasing age on anatomic factors affecting carotid angioplasty 31. Higgins JPT, Green S, eds. Cochrane Handbook for Systematic Reviews of Interventions Version 5.0.1. Updated September 2008. The Cochrane and stenting. J Vasc Surg. 2007;45:875– 880. Collaboration, 2008. Available from www.cochrane-handbook.org. 48. Gray WA, Yadav JS, Verta P, Scicli A, Fairman R, Wholey M, Hopkins 32. Alberts MJ. Results of the multicenter prospective randomized trial of LN, Atkinson R, Raabe R, Barnwell S, Green R. The CAPTURE registry: carotid artery stenting vs. carotid endarterectomy. Stroke. 2001;32:325. results of carotid stenting with embolic protection in the post approval Abstract. setting. Cathet Cardiovasc Interv. 2007;69:341–348. 33. Brooks WH, McClure RR, Jones MR, Coleman TC, Breathitt L. Carotid 49. Howard VJ, Voeks JH, Lutsep HL, Mackey A, Milot G, Sam AD, Tom angioplasty and stenting versus carotid endarterectomy: randomized trial M, Hughes SE, Sheffet AJ, Longbottom M, Avery JB, Hobson RW, Brott in a community hospital. J Am Coll Cardiol. 2001;38:1589 –1595. TG. Does sex matter? thirty-day stroke and death rates after carotid artery 34. Brooks WH, McClure RR, Jones MR, Coleman TL, Breathitt L. Carotid stenting in women versus men: results from the Carotid Revascularization angioplasty and stenting versus carotid endarterectomy for treatment of Endarterectomy Versus Stenting Trial (CREST) Lead-in Phase. Stroke. asymptomatic carotid stenosis: a randomized trial in a community 2009;40:1140 –1147. hospital. Neurosurgery. 2004;54:318 –324. 50. Goldstein LJ, Khan HU, Sambol EB, Kent KC, Faries PL, Vouyouka AG. 35. Hoffman A, Engelter T, Taschner C, Mendellowitsch A, Merlo A, Radue Carotid artery stenting is safe and associated with comparable outcomes EW, Lyrer P. Carotid artery stenting versus carotid endarterectomy–a in men and women. J Vasc Surg. 2009;49:315–323. prospective randomised controlled single-centre trial with long-term 51. Lee JW, Pomposelli F, Park KW. Association of sex with perioperative follow-up (BACASS). Schweizer Archiv Neurol Psychiatr. 2008;159: mortality and morbidity after carotid endarterectomy for asymptomatic 84 – 89. carotid stenosis. J Cardiothorac Vasc Anesth. 2003;17:10 –16. 36. for Ling F, Jiao LQ. stenting Preliminary report patients. of trial ofJ endarterectomy versus 52. Rockman CB, Castillo J, Adelman MA, Jacobowitz GR, Gagne PJ, carotid artery in elderly Vasc Surg. 2007;46: stenting Lamparello PJ, Landis R, Riles TS. Carotid endarterectomy in female 841– 845. for the treatment of carotid atherosclerotic stenosis in China (TESCAS-C). Chin J Cerebrovasc Dis. 2006;3:4 patients: are the concerns of the Asymptomatic Carotid Atherosclerosis 47. Lam RC, Lin SC, DeRubertis B, Hynecek R, Kent– 8. KC, Faries PL. The 37. impact NaylorofAR, Bolia A, RJ, Pyefactors IF, Smith J, Lennard Lloyd AJ, Study valid? J Vasc Surg. 2001;33:236 –240. increasing ageAbbott on anatomic affecting carotidN, angioplasty London NJ, J Bell study 53. Lal BK. Recurrent carotid stenosis after CEA and CAS: diagnosis and and stenting. VascPR. Surg.Randomized 2007;45:875– 880. of carotid angioplasty and stenting endarterectomy: a stopped trial. JM,Vasc Surg. management. Semin Vasc Surg. 2007;20:259 –266. 48. Gray WA,versus Yadav carotid JS, Verta P, Scicli A, Fairman R, Wholey Hopkins 1998;28:326 54. Kastrup A, Groschel K, Krapf H, Brehm BR, Dichgans J, Schulz JB. LN, Atkinson –334. R, Raabe R, Barnwell S, Green R. The CAPTURE registry: Early outcome of carotid angioplasty and stenting with and without 38. results Dalainas I, Nano stenting G, Bianchi P, embolic Stegher S, Malacrida DG. Dual of carotid with protection inG, theTealdi post approval cerebral protection devices: a systematic review of the literature. Stroke. antiplatelet regime versus Interv. acetyl-acetic acid for carotid artery stenting. setting. Cathet Cardiovasc 2007;69:341–348. 2003;34:813– 819. Cardiovasc Intervent 49. Howard VJ, Voeks JH,Radiol. Lutsep 2006;29:519 HL, Mackey–521. A, Milot G, Sam AD, Tom 55. Kastrup A, Nagele T, Groschel K, Schmidt F, Vogler E, Schulz J, 39.M,Kaposzta Z,Sheffet Clifton A, Molloy M, J, Avery Martin JF, Markus HS. Hughes SE, AJ, Longbottom JB, Hobson RW, Brott Ernemann U. Incidence of new brain lesions after carotid stenting with S-nitrosoglutathione reduces asymptomatic embolization after carotid TG. Does sex matter? thirty-day stroke and death rates after carotid artery and without cerebral protection. Stroke. 2006;37:2312–2316. angioplasty. Circulation. 2002;106:3057–3062. stenting in women versus men: results from the Carotid Revascularization 56. Schnaudigel S, Groschel K, Pilgram SM, Kastrup A. New brain lesions 40. Endarterectomy Jordan WD Jr, Versus Roye GD, FisherTrial WS (CREST) III, Redden D, McDowell HA. A Stenting Lead-in Phase. Stroke. after carotid stenting versus carotid endarterectomy: a systematic review cost comparison of balloon angioplasty and stenting versus endarterecto2009;40:1140 –1147. of the literature. Stroke. 2008;39:1911–1919. my for the treatment of carotid artery stenosis. J Vasc Surg. 1998;27: 50. Goldstein LJ, Khan HU, Sambol EB, Kent KC, Faries PL, Vouyouka AG. 57. Senn SJ. Overstating the evidence– double counting in meta-analysis and 16 –22. Carotid artery stenting is safe and associated with comparable outcomes related problems. BMC Med Res Methodol. 2009;9:10. 41. Marine LA, Rubin BG, Reddy R, Sanchez LA, Parodi JC, Sicard GA. in men and women. J Vasc Surg. 2009;49:315–323. 58. Silvestro A, Civelli P, Laffranchini G, Troianiello B, Graziani L. Treatment of asymptomatic carotid artery disease: similar early outcomes 51. Lee JW, Pomposelli F, Park KW. Association of sex with perioperative Influence of anatomical factors on the feasibility and safety of carotid after carotid stenting for high-risk patients and endarterectomy for mortality and morbidity after carotid endarterectomy for asymptomatic stenting in a series of 154 consecutive procedures. J Cardiovasc Med standard-risk patients. J Vasc Surg. 2006;43:953–958. (Hagerstown, Md). 2008;9:137–141. carotid stenosis. J Cardiothorac Vasc Anesth. 2003;17:10 –16. 42. Redgrave JN, Rothwell PM. Asymptomatic carotid stenosis: what to do. Curr Opin Neurol. 2007;20:58 – 64. 43. Rothwell PM, Eliasziw M, Gutnikov SA, Fox AJ, Taylor DW, Mayberg MR, Warlow CP, Barnett HJ. Analysis of pooled data from the randomised controlled trials of endarterectomy for symptomatic carotid stenosis. Lancet. 2003;361:107–116. 44. Ederle J, Featherstone RL, Brown MM. Long-term outcome of endovascular treatment versus medical care for carotid artery stenosis in patients not suitable for surgery and randomised in the Carotid and Vertebral Artery Transluminal Angioplasty study (CAVATAS). Cerebrovasc Dis. 2009;28:1–7. 45. Bond R, Rerkasem K, Cuffe R, Rothwell PM. A systematic review of the associations between age and sex and the operative risks of carotid endarterectomy. Cerebrovasc Dis. 2005;20:69 –77. 46. Bazan HA, Pradhan S, Mojibian H, Kyriakides T, Dardik A. Increased aortic arch calcification in patients older than 75 years: implications 52. Rockman CB, Lamparello PJ, patients: are the Study valid? J V 53. Lal BK. Recurr management. Se 54. Kastrup A, Gro Early outcome cerebral protect 2003;34:813– 81 55. Kastrup A, Na Ernemann U. In and without cer 56. Schnaudigel S, after carotid ste of the literature 57. Senn SJ. Overst related problem 58. Silvestro A, C Influence of an stenting in a se (Hagerstown, M