2 Cl
Anuncio

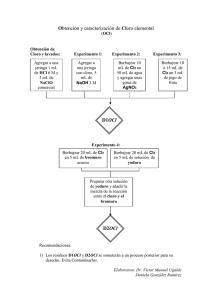
Grupo 17. Halógenos Autor: Areli Flores Gaspar Propiedades de los halógenos • No metálicos, excepto el At que es un metaloide (radiactivo). • Son llamados halógenos = “formadores de sales” • Diferentes estados de agregación • Reactivos • Tóxicos • Altas energías de ionización • Oxidantes Abundancia fluorita CaF2, Fluorapatito Ca5(PO4)3F criolita Na3AlF6. Es el halógeno más abundante en la corteza terrestre. No se encuentran en estado libre en la naturaleza. Se encuentran en forma de haluros (X-). Depósitos de NaCl Silvina KCl, Es el halógeno más abundante en el agua marina con una concentración de 18000 ppm Configuración electrónica Cuando los elementos del grupo 17 ganan electrones forman aniones Ganan electrones p e r í o d o s Configuración electrónica ns2np5 Grupo Electronegatividad La electronegatividad decrece a medida que aumenta el Z Energía de ionización La energía de ionización de los halógenos es alta. Disminuye al aumentar el número atómico de los elementos. Poder oxidante El flúor es el agente oxidante más fuerte F2 + 2 Cl- 2 F - + Cl2 F2 + 2 Br + 2,87 V 2 F - + Br2 Cl2 + 2 Br- F 2 Cl - + Br2 F2 + 2 I Cl2 + 2I- + 1,36 V Cl + 1,09 V Br 2 F - + I2 2 Cl - + I2 Br2 + 2I+ 0,54 V I 2 Br - + I2 Características Físicas Distancias y energías de enlace ∆H (KJ/mol) 158 242 193 151 •• • •F •• •• F• • •• Mayor repulsión que en el resto de los halógenos Flúor Flúor del latín fluere, que significa "fluir". Descubierto en suecia en 1971. Denominado el “tiranosaurio rex” (reacciona con todos los elementos excepto He, Ne y Ar). Obtención de fluor El flúor se obtiene mediante electrolisis de una mezcla de HF y KF, en donde se produce la oxidación de los fluoruros: 2F- (g)→ F2 (g) + 2 e2H+ (g) + 2e- → H2 (g) Producción anual: 104 toneladas 55% se emplea para preparar UF6 Flúor. Aplicaciones CFC’s politetrafluoroetileno (PTFE) TEFLÓN UF6 •Alta estabilidad físico-química y nula toxicidad. •Destructores de la capa de ozono prevención de caries Flúor. Aplicaciones Cloro Cloro del griego choloros que significa “de color verde amarillento” Descubierto en Suecia en 1774. Fue utilizado durante la guerra como arma química. Reacciona con muchos elementos para dar el edo. de oxidación más alto del elemento. 2 Fe(s) + 3 Cl2 (g) 2 FeCl3 (s) 2 P(s) + 5 Cl2 (g) 2 PCl5 (s) Obtención de cloro En el laboratorio: 2 HCl(ac) 2 H+ (ac) + 2 Cl2 (g) + 2 e- 2 MnO4-(ac) + 8 H+ (ac) + 5 e- Mn2+ (ac) + 4 H2O (l) Preparación industrial: Electrólisis de solución acuosa de NaCl (salmuera) Síntesis de compuestos organoclorados Cloro. Aplicaciones C2Cl4 Percloroetileno (Desengrasante) Policloruro de vinilo (PVC) Cloración de agua potable Hipoclorito de sodio (blanqueador) Bromo Bromo del griego bromos que significa “fetidez”. Fue descubierto en Francia en 1826. Pesticidas Retardador de combustión. Evita la descomposición del plástico por bacterias. Bromacil (C9H13BrN2O2) Bromo. Aplicaciones Síntesis de productos químicos: Medicinas Antidetonantes de gasolina Colorantes Sedantes C2H4Br2 Fotografía: KBr NaBr Yodo Yodo del griego iodes que significa “de color violeta”. Descubierto en Francia en 1811. Se emplea para esterilizar material quirúrgico El yodo es usado en la glándula tiroides para producir una hormona esencial (tiroxina) Astato Astato del griego astatos que significa "inestable". De hecho, es un elemento radioactivo. El astato se origina en la serie radioactiva del 235U, pero de una manera colateral: Se preparó por primera vez mediante la reacción en un ciclotrón, entre el 209Bi y partículas a: No se conocen bien propiedades físicas del elemento debido a que los isótopos del At poseen vidas medias de sólo horas. Compuestos iónicos Compuestos covalentes Propiedades físicas de los halogenuros de hidrógeno Compuesto Masa H F 92 pm PF (°C) H Cl PE (°C) 127 pm H pKa ∆H (kJ/mol) 141 pm L (pm) H 163 pm Br I Hidrácidos o ácidos halogenhídricos •• H • • •• • O • + H • F • • • •• •• H HF (ac) + H2O (l) H • • •• + O • H • •• H •• +• F • • • •• H3O+ (ac) + F – (ac) Ka= 7,2 10 -4 - El HF es un ácido débil O H H H F Puentes de hidrógeno en solución acuosa de FH El HCl, HBr y el HI son ácidos fuertes H Cl Enlace covalente fuerte H Cl Enlace intermolecular débil Fuerza relativa de los hidrácidos HF (ac) << HCl (ac) < HBr (ac) < HI (ac) Oxoácidos de los halógenos Los oxoácidos son oxidantes Número de oxidación Fórmula Nombre ácido perhálico ácido hálico ácido haloso ácido hipohaloso Ejemplo pKa Oxoácidos del cloro Oxoácido Estructura Número de oxidación del cloro pKa perclórico fuerte clórico fuerte cloroso hipocloroso El grado de acidez aumenta con: la electronegatividad, el número de oxidación y el número de oxígenos unidos al halógeno Comparación de la acidez de los oxoácidos del cloro, bromo , yodo Ácido hipoahaloso HClO HBrO HIO Estructura Electronegatividad pKa Notas adicionales Notas …cont.