Tema 11 – Halógenos
Anuncio

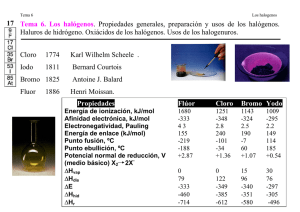
Tema 11- Halógenos Maturita Química Tema 11 – Halógenos Los halógenos forman el grupo principal 17 del sistema periódico (o el grupo VII.A) A este grupo pertenecen cinco elementos: flúor (F), cloro (Cl), bromo (Br), yodo (I) y astato (At) Su nombre “halógenos” significa en griego “formador de sales” -> muestra su propiedad de combinarse con los metales formando sales directamente Su configuración electrónica es ns2p5, pertenecen al bloque p En su capa de valencia se encuentran 7 electrones, así que resultan muy reactivos, queriendo alcanzar la configuración de los gases nobles (para lo que les falta solamente un electrón). El astato se diferencia de los demás y a veces se elimina de este grupo -> es un elemento de corta vida que se encuentra como producto intermedio de las series de desintegración radiactiva. Propiedades Todos los elementos pertenecientes a este grupo son no-metales, aunque al aumentar su número protónico Z, puede aparecer cierto carácter metálico -> por ejemplo, el yodo tiene brillo metálico y conduce la electricidad Forman moléculas diatómicas -> por ejemplo F2, Cl2, Br2, cuyos átomos se mantienen unidos por enlace covalente simple y cuya energía de enlace disminuye al descender en el grupo (excepto el flúor1) Aunque existan en forma diatómica, debido a su gran reactividad no se encuentran libres en la naturaleza sino formando haluros de metales alcalinos y alcalinotérreos. Debido a su configuración electrónica (les falta 1e- para la conf. de gas noble) tienden a formar especies negativas, X¯ (en sales), o a formar enlaces covalentes simples. Por ello, suelen tener estados de oxidación -I en compuestos iónicos (sales -haluros-…) o covalentes polares (hidrácidos…). Pero también pueden tener +I, +III, +V y +VII en compuestos covalentes con elementos más electronegativos, sobre todo con el oxígeno (excepto el flúor que solamente puede tener –I por ser el elemento más electronegativo que existe). Presentan alta afinidad electrónica (muy negativa) y muy altos valores de energía de ionización (sólo les superan los gases nobles). Los valores de electronegatividad también son muy altos, el flúor es el elemento más electronegativo del a tabla periódica. Son oxidantes muy enérgicos, el flúor es el agente oxidante más poderoso conocido. El carácter oxidante disminuye según se desciende el grupo Todos son tóxicos (venenosos), presentan actividad corrosiva en contacto con la piel y con los órganos respiratorios2. Se encuentran con abundancia normal en la corteza terrestre (ocupan posiciones intermedias), excepto el astato, que es extraordinariamente raro. 1 El F2 tiene menor energía de enlace que el Cl2 y el Br2, debido a las repulsiones de los pares de electrones en los orbitales ocupados y al pequeño tamaño del átomo (que hace que estas repulsiones sean importantes) 2 Irritan las mucosas de la nariz y garganta, el bromo además produce quemaduras al contacto con la piel. 1 Tema 11- Halógenos Maturita Química Ptos de fusión F2 gas amarillo verdoso Cl2 gas (más fácilmente licuable) amarillo verdoso Br2 líquido marrón rojizo I2 sólido (a la temperatura ambiente) gris oscuro púrpura At sólido (a la temperatura ambiente) Electronegatividad Reacciones Son elementos muy muy reactivos Reaccionan con el agua y se disuelven en ella (con excepción del flúor que la oxida): X2(g) + H2O(l) HX(aq) + HXO(aq). Reaccionan con oxígeno, formando óxidos covalentes Reaccionan con hidrógeno, formando haluros de hidrógeno (HF, HCl, HBr..) y éstos al disolverse en agua forman ácidos hidrácidos. Reaccionan con casi todos los metales formando haluros metálicos (sales binarias), casi todos son iónicos: Mg(s) + Br2(l) MgBr2(s) Reaccionan también con casi todos los no-metales: S(s) + F2(g) SF6(s) Reaccionan con compuestos covalentes inorgánicos y orgánicos (reacción de halogenación): PCl3 + Cl2 PCl5; CH2=CH2 + F2 CH2F– CH2F Obtención Como el flúor y el cloro son agentes oxidantes fuertes, deben prepararse por oxidación (electroquímica) de los iones fluoruro y cloruro. Flúor Como el flúor es el elemento más reactivo, es muy difícil prepararlo por una reacción habitual. La electrólisis de disoluciones acuosas de fluoruros es inadecuada porque el flúor es un agente oxidante más enérgico que el oxígeno. El ion F– no puede oxidarse en condiciones normales -> la reacción se tiene que preparar en ausencia de agua. El flúor se prepara por electrólisis del fluoruro de hidrógeno (HF) líquido que contiene fluoruro de potasio (KF) para aumentar su conductividad (a 70°C aprox. se tiene que evitar que el hidrógeno desprendido reaccione violentamente con el flúor obtenido). Cloro El cloro se obtiene por: 1. La electrólisis de NaCl fundido (alta temperatura) (esta es la más fácil de recordar os la recomiendo) 2 Tema 11- Halógenos Maturita Química 2. La electrólisis de disoluciones muy concentradas de NaCl (salmuera). Cuando se produce esta reacción, también se obtiene NaOH como producto secundario: 2NaOH(ac) + H2(g) +Cl2(g) 2NaCl(ac) + 2H20(l) Reducción (cátodo): 2 H2O + 2e– H2 + 2 OH– (aq) Oxidación (ánodo): 2 Cl–(aq) Cl2(g) + 2e– NOTA: Hay que separar los productos para evitar estas reacciones: NaOCl(aq) + NaCl(aq) +H2O(l) 2NaOH(ac) + C(g) HCl(g) H2(g) +Cl2(g) Bromo Se obtiene por la oxidación de los bromuros con cloro: 2 – – Br + Cl2 2 Cl + Br2 Yodo Se obtiene a partir del yodato de sodio, que se encuentra en las aguas residuales de los nitratos de Chile. Se usa el SO2 para reducir el yodato a yoduro, luego el propio yoduro reacciona con más yodato produciéndo yodo: 5 I– + IO3– + 6 H+ 3 I2 + 3 H2O También se puede obtener mediante un procedimiento análogo al de bromo (a partir de KI del agua de mar) NOTA: En el laboratorio el Cl, el Br y el yodo se pueden preparar por reacción de haluros alcalinos (sales de haluros con Na o K, NaCl, KBr o KI) con óxido de manganeso (IV) en medio ácido (que reduce a los iones X-): MnSO4(ac) + NaSO4(ac) + 2H20(l) +Cl2(g) MnO2(s) + 2NaCl(ac) + 2H2SO4(ac) Astato es tan raro que hasta ahora solamente se ha producido artificialmente a través del bombardeo de bismuto con partículas Flúor Fue descubierto por Henri Moissan en 1886, su nombre significa flujo en latín. Es un gas incoloro, corrosivo, venenoso, inflamable, con olor penetrante, (sólo tiene un isótopo) Es el elemento más electronegativo, por lo tanto el más reactivo y oxidante, el único número de oxidación que puede tener es –I. Se encuentra en minerales CaF (fluorita, ver figura), Na3AlF6 Usos e importancia: Se emplea en la síntesis del UF6 (hexafluoruro de uranio) que se emplea en el enriquecimiento en 235U Se usa para la fabricación de los plásticos -> politetrafluoroetileno (PTFE o más comúnmente teflón, antiadherente y resistente a la corrosión) Algunos fluoruros (iones F-) se añaden a la pasta de dientes para la prevención de caries, incluso en algunos países se añade fluoruro al agua potable para favorecer la salud dental Antes se utilizaban como freones = fluoroclorocarbonos (CCl2F2) que se usaban como refrigeradores y gases en espray (aerosoles), pero ya están prohibidos porque en la atmósfera reaccionan con el ozono descomponiéndolo y causando el agujero. Junto con Cl e I es un oligoelemento importante para los seres vivos Forma parte de los huesos y diente dándoles mayor resistencia 3 Tema 11- Halógenos Maturita Química Cloro Fue obtenido por primera vez en el 1810 por H. Davy, su nombre procede de griego “cloros” = amarillo verdoso. El Cloro tiene dos isótopos (76% de cloro35 y 24% de cloro 37); Es una materia prima tan importante que el valor de su producción es indicador del nivel del desarrollo de un país Forma parte de los minerales NaCl, KCl Cl2 es soluble en agua y reacciona con la mayoría de los elementos excepto de O2, N2 y C Usos e importancia: Se encuentra en la sangre (en forma de anión, sales) y en forma de HCl está presente en el estómago (para ayudar en la digestión). Es un oxidante muy fuerte por lo que se usa para obtener compuestos blanqueadores de uso doméstico (lejía=savo=hipoclorito de sodio, NaClO) o para blanquear la pulpa del papel, Se utiliza en el tratamiento de aguas (potabilización, como germicida para esterilizar el agua), En la elaboración de polímeros plásticos (PVC), Los derivados orgánicos clorados, tetracloruro de carbono (CCl4) y el cloroformo (CHCl3), son útiles como disolventes orgánicos. Se usa para la producción de agroquímicos y fármacos, desinfecantes, insecticidas, colorantes y tintes, solventes para lavado en seco y degrasado de metales También se puede utilizar como arma -> por ejemplo el Umbreon, que es una gas cloro y se utilizaba en la 1ª guerra mundial. una de sus formas más comunes, el ácido clorhídrico HCl -> un ácido muy fuerte se utiliza en química y además se emplea en la industria alimentaria, metalúrgia, desincrustante, productos de limpieza, abrillantador de pisos, destapador de tuberías Bromo (35Br) fue obtenido antes, pero fue reconocido como el elemento nuevo en el 1825 por J. Balard, su nombre proviene del griego “bromos” = hedor (=zápach, smrad) Tiene dos isótopos (51% de bromo 79; 79% de bromo 81). A temperatura ambiente es un ambiente es un líquido rojo, volátil y denso (junto con el mercurio es el único elemento que es líquido a la temperatura ambiente). El Br2 se disuelve poco en el agua, pero se disuelve bien en otros disolventes orgánicos, reduce el amoníaco al nitrógeno, aunque ya no es tan buen oxidante como cloro Se encuentra en el agua del mar y en lagos salados. Se utiliza como colorante, en la producción de medicamentos y como el material fotográfico (el bromuro de plata (AgBr) que se oscurece al ser expuesto a la luz), también para producir aditivos a las gasolinas… Yodo Lo descubrió B. Courtois en el 1811 cuando estudiaba algas marinas (=řasy) y su nombre proviene del griego “ioeides” = violeta Es menos activos que los demás halógenos, es un o xidante moderado y se combina con todos los elementos excepto los gases noble, S y Se y con Mg sólo a partir de los 600C se encuentra en el agua marina (la sal de mesa yodada que se vende por lo general contiene 0.01% de KI o NaI. 4 Tema 11- Halógenos Maturita Química Usos e importancia: Forma parte de la hormona tiroxina (participa en la regulación del metabolismo) que se produce en la glándula tiroides. La sal de mesa yodada -en forma KI- ayuda a evitar una afección de dicha glándula conocida como bocio (debida al hipotiroidismo3) Se usa como antiséptico, en forma de tintura de yodo, en la producción de medicamentos, como catalizador en la fabricación de gomas y en colorantes, fármacos, desinfectantes y en fotografía.. Un compuesto de yodo que merece mención es el yoduro de plata, AgI. Un sólido amarillo pálido que se oscurece cuando se expone a la luz (comportamiento similar al del bromuro de plata). El yoduro de plata se puede usar en la siembra de nubes. La ventaja de usar el yoduro de plata es que se puede formar un enorme número de núcleos (esto es, pequeñas partículas sobre las que se pueden formar cristales de hielo). Astato su nombre proviene de griego -> “astato” = inestable, fue sintetizado en el 1940 por primera vez en la universidad de Berkeley su comportamiento es muy similar al yodo, también en muy reactivo, pero es más metálico que él es el elemento más raro en la naturaleza -> no hay más que una cuchara en la tierra (30 g) Compuestos derivados de los halógenos Halogenuros (o haluros) Las combinaciones binarias de halógenos con los metales se denominan haluros metálicos, son compuestos iónicos y se incluyen dentro de los compuestos salinos (sales binarias). Ejemplos característicos son las sales de metales alcalinos: NaCl, KCl, etc Halogenuros de hidrógeno: HX (X =halógeno) Se pueden formar por la combinación directa de los elementos: 2HX(g) H2(g) + X2(g) Las disoluciones acuosas de los halogenuros de hidrógeno son ácidas (hidrácidos). La fuerza de los hidrácidos aumenta como sigue: HF < HCl < HBr < Hl (ver explicación detallada en anexo) El HF es el más reactivo de todos, su alta reactividad se demuestra por el hecho de que ataca la sílice y los silicatos (vidrios): H2[SiF6](ac) + 2H2O(l) 6HF(ac) + SiO2(s) Esta propiedad confiere al HF utilidad para marcar el vidrio y por esta razón el HF debe guardarse en recipientes de plástico o de metales inertes (por ejemplo, Pt). El fluoruro de hidrógeno también se usa en la manufactura de los freones4, por ejemplo: CFCl3(g) + HCl(g) CCl4(l) + HF(g) CF2Cl2(g) + HCl(g) CFCl3(g) + HF(g) El cloruro de hidrógeno se prepara en forma industrial como subproducto en la manufactura de C2H5Cl(g) + HCl(g) hidrocarburos clorados: C2H6(g) + Cl2(g) 3 El hipotiroidismo es una enfermedad hormonal debida a la deficiente producción de tiroxina (hipo=”poco”). Se recomiende tomar 150 microgramos de yodo cada día para que la producción de hormonas funcionen bien). 4 Cada vez más en desuso por el problema que causaban a la capa de ozono 5 Tema 11- Halógenos Maturita Química El cloruro de hidrógeno se usa en la preparación de ácido clorhídrico, cloruros inorgánicos y en varios procesos metalúrgicos. Óxidos Todos los óxidos de los halógenos son muy reactivos, muy oxidantes y muy peligrosos porque son inestables y muchos de ellos explosivos (por eso es muy difícil o hasta imposible aislarlos). Oxoácidos de los halógenos: Los halógenos forman una serie de oxoácidos con las siguientes fórmula general: HXOn (En nomenclatura tradicional: hipohaloso HXO , haloso HXO2 , hálico HXO3 , perhálico HXO4) Las estructuras de Lewis de los oxoácidos son: No existen todos, en la tabla se muestran los existentes: Flúor HOF Cloro Bromo a HOCl HOBr a a HOClO HOBrO a HOClO2 a HOBrO2 a HOClO3 HOBrO3 a a Estables solo en disolución. Yodo HOI a HOIO2 (HOIO3)n, (HO)5IO, H4I2O9 El ácido cloroso, (HClO2), es el único ácido “haloso” conocido. Todos los halógenos excepto el flúor, forman ácidos hálico y perhálico. Aumento fuerza La fuerza de los oxoácidos de halógenos depende de básicamente de dos factores (ver explicación detallada en anexo al final): ◦ De la electronegatividad (En) del halógeno (X): Cuanto mayor sea la En de X más polarizado estará el enlace H-O y más fácilmente se liberará el protón (H+) en disolución acuosa. (ver figuras en anexo) Compuesto HClO (H-O-Cl) Electronegatividad de X 3 pKa 7.5 HBrO (H-O-Br) 2,8 8.7 HIO (H-O-I) 2,5 10.7 ◦ Del nº de átomos de oxígeno en torno al átomo X (o del nº de oxidación de X): Debido a que el oxígeno es muy electronegativo cuanto mayor sea el nº de átomos de este elemento en torno a X, más “ayudará” éste a polarizar el enlace H-O y con más facilidad se cederá este H+. (ver figuras en anexo) 6 Aumento fuerza Tema 11- Halógenos Maturita Química Compuesto Nº oxidación del cloro pKa Fortaleza ácida Nombre tradicional HClO (H-O-Cl) +1 7.5 Muy débil Ac. hipocloroso HClO2 (H-O-ClO) +3 2.0 Débil Ac. cloroso HClO3 (H-O-ClO2) +5 -1.2 Fuerte Ac. clórico HclO4 (H-O-ClO3) +7 -10 Muy fuerte Ac. perclórico (Es decir para un halógeno dado, la fuerza del ácido disminuye del ácido perhálico al ácido hipohaloso) 7 Tema 11- Halógenos Maturita Química ANEXO Relación entre la fuerza de los ácidos y su estructura: Un ácido se puede considerar (según B-L) un compuesto de la forma: HA Donde A es un átomo o grupo atómico más electronegativo. El enlace estará polarizado y se podrá romper según: H A H : A En general, cuanto más polarizado este el enlace más facilidad tendrá para romperse y más ácido será el compuesto. Por eso los principales ácidos son compuestos de los elementos no metálicos más electronegativos. Uno de los factores principales que determinan la fuerza del ácido es la electronegatividad de A pero también hay que tener en cuenta otros: radio atómico, carga de la molécula… Fuerza de los ácidos hidrácidos: H X En este caso la fuerza del ácido hay que relacionarla con la energía de enlace. Cuanto mayor es la energía más estable es el enlace y más débil el ácido. Ácido HF HCl HBr HI HF , HCl , HBr , HI Aumento fuerza E enlace (KJ/mol) 568,2 431,9 366,1 pKa 3,19 -6,2 -9 –10,0 Esto se debe al radio atómico de X, cuanto mayor es el átomo su carga negativa está repartida en una superficie más grande y la fuerza sobre el H+ no es tan intensa). Fuerza de los oxoácidos: Oxoácidos: H únido a oxigeno y este a al menos un átomo de un elemento muy electronegativo. normalmente un no metal (halógeno –F, Cl..-, anfígeno o calcógeno –S…-, carbono, nitrogeno…)) H O XOn Ácido Electronegatividad pKa En este caso la fuerza del ácido hay que relacionarla con la HClO 3,0 7.53 electronegatividad de este átomo. Cuanto más electroHBrO 2,8 8,70 negativo es el halógeno más atrae hacia sí al par de electrones HIO 2,5 10,64 que comparte con el oxígeno unido al H y más ayuda a éste a atraer el par electrónico de su enlace con el H. El enlace OH estará más polarizada y se cederá más fácilmente ese H+ HClO, HBrO , HIO Aumento fuerza En oxoácidos del mismo halógeno la fuerza esta relacionada con el número de átomos de O junto al X unido al grupo OH. Cuanto mayor sea el nº de átomos de oxígeno en torno a X más “ayudará” eéte a polarizar el enlace H-O y con más facilidad se cedera este H+. HClO, HClO2 , HClO3, HClO4 Aumento fuerza Ácido Nº oxidación pKa HClO +1 7.49 HClO2 +3 1.96 HClO3 +5 -1 HClO4 +7 ≈ -8 8 Tema 11- Halógenos Maturita Química FIGURAS Y “GILIPOLLECES” (con perdón) NO LO IMPRIMÁIS Halógeno Molécula Estructura Modelo d(X−X) / pm d(X−X) / pm (fase gaseosa) (fase sólida) Flúor F2 143 149 Cloro Cl2 199 198 Bromo Br2 228 227 Yodo I2 266 272 9