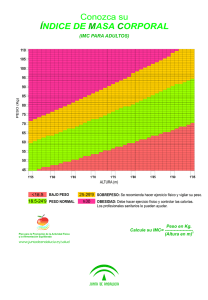
(IR) y Acantosis Nigricans
Anuncio

PONTIFICIA UNIVERSIDAD CATOLICA DEL ECUADOR FACULTAD DE MEDICINA ESPECIALIZACIÓN EN PEDIATRÍA Estudio de prevalencia de Insulinorresistencia (IR) y Acantosis Nigricans (AN) en niños con índice de masa corporal (IMC) mayor al percentil 85 comprendidos entre los 2 a 17 años, que acuden a la Consulta Externa del Servicio de Pediatría del Hospital Dr. Enrique Garcés, en el período comprendido entre febrero del 2010 a julio de 2011. DISERTACIÓN PREVIA A LA OBTENCIÓN DEL TÍTULO DE ESPECIALISTA EN PEDIATRÍA DRA. ELIANA MARGARITA VELASTEGUI AYALA DR. FABRICIO FERNANDO POLO PASTRANO Director: Dr. PATRICIO PROCEL E. Quito AGRADECIMIENTOS A Dios por ser la luz que ilumina nuestras vidas y que permite que continuemos por el sendero de la verdad y la justicia, haciendo que nuestra dedicación y entrega al servicio de los niños sea nuestro más preciado acierto. A nuestras familias quienes nos enseñaron que con humildad y perseverancia se alcanza cualquier sueño y que el camino que nos hace llegar a él mientras estamos acompañados es más llevadero, alcanzando aquella luz que a veces parece inalcanzable, en especial a nuestros padres. A nuestros hijos por toda la compresión por los días de abandono, circunstancias que hicieron separarnos de su compañía, pero sin querer se convirtieron en nuestros más grandes profesores y por quienes daríamos nuestro más sublime esfuerzo. A nuestras parejas por ser nuestros compañeros de vida y sobre todo nuestro puntal de apoyo. A cada uno de nuestros maestros quienes de una forma desinteresada nos guiaron por la larga caminata para poder crecer, aprender y sentirnos libres de tomar nuestro propio rumbo, en especial a la Dra. Rosario Moya +. A nuestros inolvidables amigos, a quienes nos acompañaron en las buenas y malas para alcanzar esta gran victoria, que hoy parece fácil, pero fue el resultado de retos y pequeñas victorias que pasaron desapercibidas. ii A la PUCE y Hospital Dr. Enrique Garcés por ser las instituciones que nos acogieron y acompañaron en este proceso tan importante en nuestra vidas. Al Dr. Patricio Prócel E. Director de la tesis. Al Dr. Roberto Yajamín. Tutor metodológico de la tesis. Al Dr. Alfredo Naranjo. Director y mentor del posgrado de pediatría de la PUCE. iii ºTABLA DE CONTENIDOS PORTADA........................................................................................................ i AGRADECIMIENTOS ..................................................................................... ii LISTA DE CUADROS .................................................................................... vi LISTA DE GRÁFICOS .................................................................................. vii LISTA DE ABREVIATURAS ......................................................................... vii RESUMEN ..................................................................................................... 9 ABSTRACT .................................................................................................. 11 CAPITULO I: INTRODUCCIÓN ................................................................... 13 CAPITULO II: REVISIÓN BIBLIOGRÁFICA ................................................ 17 2.1. 2.1.1. 2.1.2. 2.1.3. 2.1.4. 2.1.4.1. 2.1.5. 2.1.6. 2.1.7. 2.1.8. 2.1.8.1. 2.1.8.2. 2.1.8.3. 2.1.8.4. 2.1.9. 2.1.9.1. 2.1.9.2. 2.1.9.3. 2.1.9.4. 2.1.10. 2.1.10.1. 2.1.11. 2.1.12. 2.1.13. 2.1.13.1. 2.1.13.2. 2.1.13.3. Sobrepeso y Obesidad ................................................................ 17 Antecedentes ............................................................................... 17 Definición ..................................................................................... 18 Etimología .................................................................................... 19 Índice de Masa Corporal (IMC) .................................................... 20 Percentiles al Valorar el IMC ....................................................... 22 Prevalencia .................................................................................. 23 Etiología ....................................................................................... 24 Epidemiología .............................................................................. 26 Clasificación o tipos ..................................................................... 28 Desde el punto de vista etiológico (origen) .................................. 28 Desde el punto de vista cuantitativo ............................................ 29 Desde el punto de vista de distribución regional ......................... 29 Clasificación la Obesidad en la Niñez.......................................... 29 CAUSAS ...................................................................................... 30 Las causas de una Obesidad Endógena ..................................... 30 Causas Iatrogénicas .................................................................... 32 Causas por Herencia y genética .................................................. 40 Aspectos Microbiológicos ............................................................ 41 PRUEBAS A CONSIDERAR ....................................................... 42 Puntos a determinar con la Pruebas............................................ 43 Efecto sobre la salud ................................................................... 52 Consecuencias de la obesidad pediátrica: .................................. 55 Tratamiento ................................................................................. 56 Tratamiento Infantil ...................................................................... 57 Medicamentos ............................................................................. 63 Cirugía bariátrica ......................................................................... 65 2.2. 2.2.1. 2.2.1.1. INSULINORESISTENCIA (IR) .................................................... 66 Definición ..................................................................................... 66 Insulina ........................................................................................ 66 iv 2.2.1.2. 2.2.2. 2.2.3. 2.2.8. 2.2.9. Insulinoresistencia (IR) ................................................................ 66 Causas ........................................................................................ 68 Consecuencias de la resistencia a la insulina en pacientes con sobrepeso y obesidad ........................................................... 69 IR y Obesidad .............................................................................. 70 Sensibilidad a la Insulina e IR en Niños y Adolescentes ............. 73 Diferentes Métodos para Cuantificar la Sensibilidad a la Insulina e IR ................................................................................. 75 Métodos Directos ......................................................................... 75 Métodos Indirectos ...................................................................... 75 Anormalidades asociadas a IR / Hiperinsulinemia compensatoria. ............................................................................ 77 Clasificaciones del SIR ................................................................ 81 Prevención y Tratamientos para la IR.......................................... 82 2.3. 2.3.1. 2.3.2. 2.3.3. 2.3.4. Acantosis Nigricans (AN) ............................................................. 85 Definición ..................................................................................... 85 Tipos: ........................................................................................... 86 Enfermedades Asociadas al AN .................................................. 88 Diagnóstico diferencial................................................................. 90 2.4. 2.4.1. 2.4.2. 2.4.3. 2.4.3.1. 2.4.4. Niños y Adolecentes .................................................................... 90 Definición ..................................................................................... 90 Niñez ........................................................................................... 91 Adolescencia ............................................................................... 92 Etimología .................................................................................... 93 Niños y Adolescentes de 2 a 17 años.......................................... 93 2.2.4. 2.2.5. 2.2.6. 2.2.6.1. 2.2.6.2. 2.2.7. CAPITULO III: MÉTODOS ........................................................................... 95 CAPITULO IV: RESULTADOS .................................................................. 103 CAPITULO V: DISCUSIÓN ....................................................................... 124 CAPITULO VI: CONCLUSIONES……………………………………………..128 CAPITULO VII: RECOMENDACIONES………………………………………129 BIBLIOGRAFIA:………………………………………………………………….132 ANEXOS ................................................................................................... 148 v LISTA DE CUADROS Cuadro Nº 1: Clasificación de SIR según la NCEP-ATPIII para niños y adolescentes……………………………………………………..47 Cuadro Nº 2: Tabla de Algunos Métodos para Mesurar la IR……………….76 Cuadro Nº 3: Tabla de Operacionalización de las Variables del Estudio...98101 Cuadro Nº 4: Distribución de casos asociados a antecedentes familiares de DM II, HTA, hipotiroidismo e hiperlipidemia……………..119 Cuadro Nº 5: Distribución de dislipidemia……………………………………116 Cuadro Nº 6: Distribución de casos asociados a antecedentes familiares de DM II, HTA, hipotiroidismo e hiperlipidemia.………...…..120 vi LISTA DE GRÁFICOS Gráfico Nº 1: IMC (Kg/m2)……………………………………………………….21 Gráfico Nº 2: Acantosis Nigricans en Axila y en Cuello………………...……86 Gráfico Nº 3: Total de Pacientes Atendidos en Consulta Externa de Pediatría vs. Pacientes con sobrepeso, obesidad…....…....104 Gráfico Nº 4: Pacientes Pediátricos por Edad con IMC mayor al p85 en el HEG ……………………………………………..………………105 Gráfico Nº 5: Pacientes Pediátricos con IMC mayor al p85 por Sexo en el HEG del año 2010…...…………………………………………106 Gráfico Nº 6: Porcentaje de pacientes niños (2-9 años) y pacientes adolescentes (10-17 años)………………..………………….107 Gráfico Nº 7: Distribución de pacientes por sexo…………………..…….....108 Gráfico Nº 8: Distribución de pacientes por rangos de percentil……..…...109 Gráfico Nº 9: Distribución de ptes por rango de percentil en talla…….......110 Gráfico Nº 10: Distribución de pacientes por percentil de IMC……..…..…111 Gráfico Nº 11: Distribución de pacientes con presencia de AN…..…….…112 Gráfico Nº 12: Distribución de pacientes con AN en genero y edad...……112 Gráfico Nº 13: Distribución de pacientes con respecto a la glucemia.……113 Gráfico Nº 14: Distribución de casos con valores de HOMA normal y anormal…………………………………………………....……114 Gráfico Nº 15: Distribución de pacientes con valores de HOMA normal y anormal……………………..……..…………………………115 Gráfico Nº 16: Distribución de casos con valores de insulina normal y anormal….….………………………………..………………116 Gráfico Nº 17: Distribución de casos con valores anormal y normal de HDL……………………………………………………………..117 Gráfico Nº 18: Distribución de casos con valores normal y anormal de TGC……………………………………………………….…….118 Gráfico Nº 19: Distribución de casos con valores normal y anormal de colesterol……………………………………………………….118 Gráfico Nº 20: Total de Pacientes Atendidos en Consulta Externa en el HEG en el Año 2010 vs. Pacientes Diagnosticados con Diabetes en el 2010………………..………………………….121 Gráfico Nº 21: Pacientes con Diabetes de Consulta Externa por Edad en el HEG del año 2010……………………………………….122 Gráfico Nº 22: Pacientes con Diabetes de Consulta Externa por Sexo en el HEG del año 2010……………..…………………………….123 vii LISTA DE ABREVIATURAS IR: Insulinoresistencia. ACV: Accidente cerebro vascular. MEPRADE: Mejoramiento de las Prácticas Alimentarias y Nutricionales de Adolescentes Ecuatorianos. AIEPI: Estrategia de atención integrada a las enfermedades prevalentes de la infancia. NHANES III: National Health and Nutrition Examination Surveys AN: Acantosis nigricans. CC: Cintura cadera. NCEP-ATP III: Programa Nacional de Educación y Control del Colesterol. CDC: Center for Diseases Control. CT: cholesterol sérico total. LDL: lipoproteínas de baja densidad. FRCV: Factores de riesgo cardiovasculares. GAA: glucemia en ayunas alterado. OMS: Organización Mundial de la Salud. DM 2: Diabetes mellitus tipo 2. PTG-O: prueba de tolerancia a la glucosa oral. H.Cl.: Historias clínicas QUICKI: quantitative insulin sensitivity check index. HDL: lipoproteínas de alta densidad. HEG: Hospital Dr. Enrique Garcés. SAOS: Sindrome de apnea obstructiva del sueño. HGNA: Hígado graso no alcohólico. SIR: Sindrome de insulina resistencia. HTA: hipertensión arterial. SM: sindrome metabólico. HOMA: Homeostatic Model Assessment for Insulin Resistance. SPSS: Sofware para análisis predictivos estadísticos. IHC: Intolerancia a los hidratos de carbono. TA: tensión arterial. TGC: Triglicéridos. IGF-1: Factor parecido a la hormona de crecimiento. TSI: Test de supresión de insulina IMC: índice de masa corporal viii RESUMEN Objetivo: Realizar un estudio de la prevalencia de IR y AN en pacientes que acuden a la Consulta Externa de Pediatría del Hospital “Dr. Enrique Garcés” en niños desde los dos años y adolescentes hasta los 17 años de edad con el IMC de Percentil 85 ó mayor. Métodos: Estudio descriptivo transversal tomado del registro de historias clínicas de la consulta externa del Hospital Doctor Enrique Garcés en un período de 1 año 5 meses, entre febrero del 2010 a julio del 2011, con una prevalencia de niños con IMC sobre p85 del 2.17%. Se tomó en cuenta las variables: Edad, sexo, IMC, presencia de AN, Índice HOMA-IR, insulinemia, glucemia en ayunas, colesterol, triglicéridos y HDL. Resultados: Se hizo el estudio en 42 pacientes, calculados a través de la prevalencia demostrada en la consulta externa de Pediatría del HEG, con un intervalo de confianza del 95% y error de precisión del 5%. El grupo de niños (2 a 9 años) y adolescentes (mayor a 10 años de edad) fue de 21 casos (50% para cada uno), la media de edad fue de 9.4 años, mediana 10 años con una desviación estándar de 2.45. El sexo masculino se presentó en número de 27 (64.3%) y femenino en número de 15 (35.7%); Con respecto al peso entre p5 y 95 fue de 45.2%; y mayor al p95: 54.8%, talla por debajo del p5: 14.3%; entre p5 al 95: 81%; y mayor al p95: 4.8%. El IMC entre p85 al 95 fue del 28.6%; y mayor al p95: 71.4%. 9 La prevalencia de AN encontrada en este estudio fue del 74% (n=31), de forma general en adolescentes con el 52% y niños 48%, sexo masculino 64% y grupo femenino 36%, siendo predominante el grupo de adolescentes masculinos con el 26%, y niños con 21%, adolescentes femeninas 14%, niñas 11%. Se encontró igual prevalencia de IR (definido por HOMA) e hiperinsulinismo del 45,2% (n=19), adolescentes masculinos 38%, adolescentes mujeres 23.8%, niños 23.8%, niñas 14.2%, en niños se obtuvo una media de HOMA de 3.44, mediana 1.79; desvió estándar de 3.36, mientras que en el grupo de adolescentes se obtuvo una media 3.17 y mediana de 2.9 y un desvió estándar de 1.83. La dislipidemia (refiriéndose a valores alterados de colesterol, triglicéridos y HDL) encontrada en la muestra estuvo entre el 58%. Conclusiones: Los niños con obesidad y sobrepeso tienen alta prevalencia de insulinoresistencia similar a los estudios citados en bibliografía y mayor presencia de AN que los indicados en los mismos, predominantemente en el sexo masculino. La prevalencia de alteración en los lípidos en este estudio llegó hasta el 46.4%. 10 ABSTRACT Objective: To study the prevalence of IR and AN in patients attending the Outpatient Pediatric Hospital "Dr. Enrique Garces "in children two years and adolescents up to 17 years of age with BMI of 85 or higher percentile. Methods: A cross made of log records of the outpatient clinic of the Hospital Doctor Enrique Garces in a period of 1 year 5 months, from February 2010 to July 2011, with a prevalence of children with BMI on p85 of 2.17% . It took into account the variables: age, sex, BMI, presence of AN, HOMA-IR index, insulin, fasting blood glucose, cholesterol, triglycerides and HDL. Results: We did the study in 42 patients, calculated by the prevalence demonstrated in the outpatient Pediatric HEG, with a confidence interval of 95% and precision error of 5%. The group of children (2 to 9 years) and adolescents (more than 10 years of age) was 21 cases (50% each), the mean age was 9.4 years, median 10 years with a standard deviation of 2.45 . The male appeared in number 27 (64.3%) and female in number of 15 (35.7%); With respect to the weight between p5 and 95 was 45.2% and greater than p95: 54.8%, height below the p5 : 14.3%, from p5 to 95: 81% and greater than p95: 4.8%. The BMI of p85 to 95 was 28.6%, and greater than p95: 71.4%. The prevalence of AN found in this study was 74% (n = 31), generally in adolescents with children 52% and 48%, 64% male and female group 36%, predominantly male group of adolescents with 26% and 21% children, adolescent females 14%, 11% girls. We found the same prevalence of IR (HOMA-defined) and hyperinsulinism of 45.2% (n = 19), 38% male adolescents, female adolescents 23.8%, children 11 23.8%, girls 14.2% in children obtained a mean HOMA of 3.44, median 1.79, standard deviation of 3.36, while in the group of adolescents had a mean 3.17 and median of 2.9 and a standard deviation of 1.83. Dyslipidemia (referring to altered levels of cholesterol, triglycerides and HDL) found in the sample ranged from 58%. Conclusions: Children with obesity and overweight have a high prevalence of insulin resistance similar to the studies cited in literature and presence of AN than those given in the same, predominantly in males. The prevalence of abnormal lipids in this study was higher and reached 58%. 12 CAPITULO I INTRODUCCIÓN Según la Organización Mundial de la Salud (OMS), el sobrepeso y la obesidad son el quinto factor principal de riesgo de defunción en el mundo. Cada año fallecen por lo menos 2,8 millones de personas adultas como consecuencia del sobrepeso o la obesidad. Además, el 44% de la carga de diabetes, el 23% de la carga de cardiopatías isquémicas y entre el 7% y el 41% de la carga de algunos cánceres son atribuibles al sobrepeso y la obesidad. A continuación se presentan algunas estimaciones mundiales de la OMS correspondientes al año 2008: 1500 millones de adultos de 20 y más años tenían sobrepeso. De esta cifra, más de 200 millones de hombres y cerca de 300 millones de mujeres eran obesos. En general, más de una de cada 10 personas de la población adulta mundial eran obesas. En 2010, alrededor de 43 millones de niños menores de cinco años de edad tenían sobrepeso. Si bien el sobrepeso y la obesidad tiempo atrás eran considerados un problema propio de los países de ingresos altos, actualmente ambos trastornos están aumentando en los países de ingresos 13 bajos y medianos, en particular en los entornos urbanos. En los países en desarrollo están viviendo cerca de 35 millones de niños con sobrepeso, mientras que en los países desarrollados esa cifra es de 8 millones. En el plano mundial, el sobrepeso y la obesidad están relacionados con un mayor número de defunciones que la insuficiencia ponderal. Por ejemplo, el 65% de la población mundial vive en países donde el sobrepeso y la obesidad se cobran más vidas que la insuficiencia ponderal (estos países incluyen a todos los de ingresos altos y la mayoría de los de ingresos medianos). Por los que, la obesidad constituye un problema de salud pública que ha alcanzado proporciones de epidemia en distintos países y regiones del mundo. Esta tendencia se observa tanto en la población adulta como en la infanto-juvenil. De acuerdo a los resultados del NHANES III (National Health and Nutrition Examination Surveys), el 14% del grupo de edad entre 6 y 17 años está en riesgo de tener sobrepeso (índice de masa corporal, IMC, entre el 85 y 95 percentil correspondiente a la edad y sexo) y casi el 11% presenta sobrepeso (≥ 95 percentil). La prevalencia de sobrepeso entre la población estadounidense comprendida entre los 6 y 17 años casi se ha duplicado entre los periodos 1976 a 1980 y 1988 a 1994. Ahora bien, fue notable la observación de que en países en vías de desarrollo o de “economías emergentes” se ha presentado también esta epidemia de obesidad, alcanzando en muchos casos una frecuencia superior a la desnutrición y constituyéndose entonces, según el enfoque, en la 14 principal enfermedad nutricional en esos lugares. En estos países o regiones la obesidad es una enfermedad de la pobreza; paralelamente aparece la figura del gordo pobre en contraposición al gordo rico, dos tipos de enfermos muy diferentes. Estas características se aplican muy estrechamente a América Latina, donde la pobreza efectivamente coincide con índices crecientes de obesidad y donde es dominante la presencia del obeso pobre. Otro hecho que se agrega es el del retardo de crecimiento en estatura que generalmente se asocia en poblaciones mestizas con exceso de peso. Esta obesidad en personas de baja estatura se asocia posteriormente con diabetes tipo 2 y otros trastornos metabólicos. En Ecuador la información disponible sobre epidemiología de la obesidad en puede ser obtenida de un trabajo presentado por Pacheco y Pasquel1. Estos autores citan 14 trabajos, pero en la mayoría no está definido el punto de corte para el diagnóstico de obesidad ni tampoco las características y representatividad de las muestras estudiadas. Los estudios son muestreos de poblaciones seleccionadas (grupos escolares, grupos de padres de estudiantes universitarios, concurrentes a un servicio de Endocrinología, etc.). 1 Pacheco V, Pasquel M. Obesidad en Ecuador: una aproximación epidemiológica. En: Obesidad; un desafío para América Latina. Ed. J. Braguinsky, R. Álvarez Cordero y A. Valenzuela, ANALES, Navarra 2002, vol. 25. 15 Pacheco y Pasquel sugieren que la prevalencia de obesidad en la población mayor de 20 años es alrededor del 10% con un incremento de su prevalencia en relación a la edad y el sexo femenino, y del 40% de preobesidad, con aparente predominio masculino. Sugieren también que los estratos urbanos de bajos ingresos económicos tendrían una prevalencia mayor, todo lo cual hablaría a favor de procesos de transición epidemiológica y nutricional en el país. En el estudio nacional ecuatoriano conocido por Mejoramiento de las Prácticas Alimentarias y Nutricionales de Adolescentes Ecuatorianos (MEPRADE), que se efectuó en 1994, se encontró que el sobrepeso, basado en el IMC, fluctuaba entre 12 y 15% en las mujeres y entre 8 y 10% en los varones de zonas urbanas, mientras que en el área rural se mantenía en alrededor de 2% en ambos sexos. El sobrepeso predominó en los estratos socioeconómicos altos, pero también se manifestó con bastante frecuencia en los estratos de bajos ingresos, especialmente en las mujeres 2. En adolescentes mujeres de Quito3 encontraron prevalencias de 8,6% de sobrepeso y de 3,2% de obesidad, en tanto que en adolescentes varones esas prevalencias fueron de 8,5% y 2%, respectivamente. 2 3 De Grijalva Y. Adolescencia y nutrición: Proyecto MEPRADE. Quito: Centro de Investigaciones en Salud y Nutrición; 1994. De la Vega A, Mogrovejo P, Jiménez P, Rivera J, Collahuazo M, Acosta M. Prevalencia de obesidad en la población infanto-juvenil de Quito, Ecuador. Congreso Latinoamericano de Obesidad, Santa Fe de Bogotá, Colombia, agosto de 1996. 16 CAPITULO II REVISIÓN BIBLIOGRÁFICA 2.1. Sobrepeso y Obesidad 2.1.1. Antecedentes En varias culturas humanas, la obesidad estuvo asociada con atractivo físico, fuerza y fertilidad, como las figuritas de Venus. La obesidad fue considerada un símbolo de riqueza y estrato social en culturas pronas a la escasez de comida o hambrunas. En las artes visuales las figuras obesas fueron usadas, como en las pinturas de Rubens (1577-1640 descripción de Rubenesca) o Botero en Colombia. Con la siempre creciente diversidad de elementos, la comida se ha convertido no solamente en un asunto de estatus social, sino también una marca de la personalidad y el gusto individual"4. Especialmente en décadas recientes, la obesidad ha comenzado a ser vista más como una condición médica, una epidemia5. Se argumentan que el estigma social alrededor de la obesidad está fundado en la ansiedad cultural y que la preocupación pública sobre los riesgos de salud asociados con la obesidad6. 4 Powdermaker H. "An anthropological approach to the problem of obesity." In: Food and Culture: A Reader. Ed. Carole Counihan and Penny van Esterik. New York: Routledge, 1997;206. ISBN 0-41591710-7 5 Phillips, Stone (18 de agosto de 2006). Quién tiene la culpa de la epidemia de la obesidad EE.UU? MSNBC. http://www.msnbc.msn.com/id/14415766/. Consultado el 3 de junio de 2007 6 Paul Campos, The Diet Myth. Gotham Books, NY, 2004. 17 En 2004, el CDC reportó que el 66,3% de los adultos en los Estados Unidos tenía sobrepeso u obesidad. La causa en la mayoría de los casos es el estilo de vida sedentaria; aproximadamente el 40% de los adultos en Estados Unidos no participan en ninguna actividad física durante su tiempo de ocio y menos de un tercio de los adultos se ocupan de la cantidad de actividad física recomendada. El sobrepeso y la obesidad son fácilmente determinados usando el índice de masa corporal (IMC), este índice utiliza el peso y altura para determinar la grasa corporal7. 2.1.2. Definición El sobrepeso y la obesidad se definen como una acumulación anormal o excesiva de grasa que puede ser perjudicial para la salud. La obesidad se suma como una enfermedad crónica, compleja y multifactorial que se establece por un desequilibrio entre la ingesta y el gasto energético, dando un balance positivo, trastorno que es prevenible. Es un proceso que suele iniciarse en la infancia y la adolescencia. En su origen se involucran factores genéticos y ambientales, que determinan un trastorno metabólico que conduce a una excesiva acumulación de grasa corporal para el valor esperado según el sexo, talla, y edad (IMC). 7 The Surgeon General's call to action to prevent and decrease overweight and obesity; U.S. Dept. of Health and Human Services, Public Health Service, Office of The Surgeon General; Washington, D.C. Disponible en: http://www.surgeongeneral.gov/topics/obesity /calltoaction/CalltoAction.pdf 18 2.1.3. Etimología Obesidad es la forma nominal de un viso la cual proviene del latín obēsus, lo que significa "corpulento, gordo o regordete". “Ēsus” el participio pasado de edere (comer), con ob agregado a éste. En el latín clásico, este verbo se encuentra solamente en la forma de participio pasado8. La obesidad es una disfunción metabólica que permite a los pacientes almacenar la grasa con eficacia patológica, provocando que el hipotálamo controle mal el apetito y el metabolismo. "La obesidad genética", el gen ob, a través de las células grasas y la insulina induce a producir leptina, la misma que afecta el hipotálamo para suprimir el apetito, aumentar el gasto energético. Las personas portadoras de una variante concreta del gen FTO tienen un riesgo mayor de padecer diabetes por tener un IMC más elevado. Las portadoras de dos copias del alelo A en rs9939609 del gen FTO pesaban de media tres kilos más y tenían un riesgo 70% más elevado de ser obesas que los heterocigotos9. En los últimos estudios se ha demostrado que la célula adiposa no sólo es un lugar de depósito de triglicéridos, sino que representa un órgano endocrino metabólico de extraordinaria complejidad, por lo que la obesidad es una enfermedad multidisciplinaria. 8 9 The Oxford English Dictionary (sitio web) Cecil JE, Tavendale R, Watt P, An obesity-associated FTO gene variant and increased energy intake in children. N Engl J Med. 2008 Dec 11; 359(24):2558-66. 19 Las células grasas de los seres humanos muy obesos contienen más del ARNm y leptina que implica el fracaso del hipotálamo para responder a la leptina o producen una molécula de leptina funcionalmente defectuosa, 33 los niveles séricos de leptina en 139 sujetos obesos eran 4 veces más altos que en 136 sujetos normales, los niveles de leptina cayeron con la pérdida de peso (gen receptor de la leptina - gen db - o también llamado gen de la diabetes)10. 2.1.4. Índice de Masa Corporal (IMC) El Índice de Masa Corporal (IMC), índice de Quetelet o conocido como BMI por sus siglas en inglés (Body Mass Index). El IMC da un estimativo de lo que uno debe pesar, con base en la estatura. Ideado por el estadístico belga Adolphe Quetelet en 1830, por lo que también se conoce como índice de Quetelet. Pero no fue sino hasta 1980 que las agencias de salud pública lo adoptaron como una manera de identificar el riesgo de los individuos por ataques cardíacos, hipertensión, diabetes, ACV y algunos tipos de cáncer. El IMC se calcula dividiendo el peso en kilogramos entre el cuadrado de la estatura en metros, a continuación se presentan la fórmula para calcularlo según la expresión matemática: 10 Reilly JJ, Armstrong J, Early life risk factors for obesity in childhood: cohort study. BMJ. 2005 Jun 11; 330(7504):1357. Epub 2005 May 20. 20 La teoría que hay detrás de este índice es que las proporciones peso/estatura en la población general tienen una relación positiva con el porcentaje de grasa corporal. Gráfico Nº 1: IMC (Kg/m2) El IMC tiene la ventaja de contabilizar tanto la altura como el peso del individuo. En la práctica, señala si un niño está ganando demasiado peso para su altura. En contraste con los adultos, la cantidad de grasa en un niño varía fisiológicamente con su crecimiento. El sobrepeso infantil se establece a partir del percentil 85 en las curvas de IMC y la obesidad infantil a partir del percentil 95. La OMS y CDC ofrece en su página web, además de las tablas con los patrones de crecimiento, tablas con el IMC (en inglés BMI) para niños de 2 hasta 20 años. Una vez tenemos el valor (el IMC) del niño, debemos seleccionar la tabla que corresponda según el sexo: Ver (anexo 2-3) coorespondiente para Tabla de IMC para Niños de 2 a 20 años y Tabla de IMC para Niñas de 2 a 20 años. 21 2.1.4.1. Percentiles al Valorar el IMC El percentil es una medida de posición no central que nos dice cómo está posicionado un valor respecto al total de una muestra, pero no son más que casos particulares. Una medida de posición muy útil para describir una población, es la denominada 'percentil'. En forma intuitiva podemos decir que es un valor tal que supera un determinado porcentaje de los miembros de la población. Una vez que sabemos cuál es el percentil del niño miramos qué significa dicho percentil: Menor de 5: niño o niña en situación de bajo peso. Entre 5 y 85: niño o niña con peso normal. Entre 85 y 95: niño o niña con sobrepeso. Mayor de 95: niño o niña con obesidad. Mayor de 97: niño o niña con obesidad grave. De esto se desprende que todo lo que no esté entre el percentil 5 y el percentil 85 debería ser valorado por un pediatra, para actuar en consecuencia si es necesario, aportando pautas de alimentación y consejos educativos que ayuden a conseguir unos hábitos saludables que repercutan en el peso (en la mayoría de personas, unos hábitos saludables provocan un peso normal). 22 En varones el IMC aumenta progresivamente con la edad, mientras que en las mujeres la mediana del IMC se estabiliza a partir de los 16 años, y de los 7 a los 10 años, con una fase de intenso crecimiento de los 10 a los 16 años. Hasta los 8 años, los valores de IMC son parecidos en ambos sexos, si bien los varones presentan valores superiores para el percentil 95 a partir de los 5 años. En un marco clínico, los médicos toman en cuenta la raza, la etnia, la masa magra (muscularidad), edad, sexo y otros factores los cuales pueden interferir en la interpretación del IMC. 2.1.5. Prevalencia La prevalencia de una enfermedad es el número total personas que presentan síntomas o padecen una enfermedad durante un periodo de tiempo, dividido por la población con posibilidad de llegar a padecer dicha enfermedad. La prevalencia es un concepto estadístico usado en epidemiología, sobre todo para planificar la política sanitaria de un país. Su Fórmula es: Además, la prevalencia mide en medicina la proporción de personas que en un área geográfica y periodo o periodos de tiempo establecido sufren una determinada enfermedad, la prevalencia puede referirse a espacios de tiempo por ejemplo un mes, un año o toda la vida. 23 La incidencia mide el número el número de casos nuevos que surgen en un área geográfica y periodo de tiempo determinado. Tanto la prevalencia como la incidencia son datos de una gran importancia a la hora de planificar los recursos necesarios en un sistema sanitario ya que nos acercan a una estimación del número potencial de usuarios que pueden acceder a los servicios sanitarios. La obesidad es un problema de salud pública y política de vida su prevalencia, costos y carga. La prevalencia decida ha ido aumentando continuamente por dos décadas. Este repentino aumento en la prevalencia de obesidad es atribuido a factores del medio ambiente y de la población más que a un comportamiento individual y biológico debido al aumento rápido y continuo en el número de individuos con sobrepeso y obesidad11. 2.1.6. Etiología La obesidad es un trastorno multifactorial en cuya etiopatogenia están implicados factores genéticos, metabólicos, psicosociales y ambientales, la rapidez con que se está produciendo el incremento de su prevalencia parece estar más bien en relación con factores ambientales. Es así que para desarrollar la obesidad es necesario el efecto combinado de la predisposición genética a este trastorno y la exposición a condiciones ambientales adversas. 11 Morrill A, Chinn C. The obesity epidemic in the United States. J Public Health Policy 2004; 25:353366. PMID 15683071 24 Los factores genéticos rigen la capacidad o facilidad de acumular energía en forma de grasa tisular y menor facilidad para liberarla en forma de calor, lo que se denomina como elevada eficiencia energética del obeso. Se produce porque a largo plazo el gasto energético que presenta el individuo es inferior que la energía que ingiere, es decir existe un balance energético positivo. La influencia genética se va a asociar a condiciones externas como los hábitos dietéticos y estilos de vida sedentarios, relacionado esto con la disponibilidad de alimentos, la estructura sociológica y cultural que intervienen en el mecanismo de regulación del gasto y almacenamiento de la energía que es lo que define la estructura física. Clásicamente está establecido que si ambos padres son obesos el riesgo para la descendencia será de 69% al 80 %; cuando solo uno es obeso será 41% al 50 % y si ninguno de los 2 es obeso el riesgo para la descendencia será solo del 9%. La actividad física permite que los niños dediquen mucho tiempo a la televisión, a los juegos de video y se alejen de la práctica de deportes, las caminatas y los juegos al aire libre, esto condiciona la ganancia excesiva de peso12. Varios investigadores señalan la existencia de otros factores ambientales predisponentes a la obesidad como el destete temprano del lactante, 12 Durá Travé T, Sánchez-Valverde Visus F. Obesidad Infantil: ¿un problema de educación individual, familiar o social? Acta Pediátrica Española [en línea] 2005 [12 de febrero del 2007]; 63:(204-207). URL disponible en: http://www.gastroinf.com/OBESIDAD.pdf 25 insuficiente uso de la lactancia materna, la aglactación precoz antes del tercer mes de vida, el consumo de más de un litro de leche en el día. También se mencionan la formación de malos hábitos en la alimentación como la ausencia de desayuno, ingestión de grandes cantidades de alimentos en las últimas horas del día, comer muy rápido, ingestión de alimentos con exceso de grasa o azúcares simples. Es por ello que en los últimos 20 años el incremento de la prevalencia de la obesidad solo puede ser explicado por los factores ambientales al existir una epidemia de inactividad. 2.1.7. Epidemiología Aunque la obesidad es una condición clínica individual se ha convertido en un serio problema de salud pública que va en aumento y la OMS considera que "La obesidad ha alcanzado proporciones epidémicas a nivel mundial, y cada año mueren, como mínimo, 2,6 millones de personas a causa de la obesidad o sobrepeso. Aunque anteriormente se consideraba un problema confinado a los países de altos ingresos, en la actualidad la obesidad también es prevalente en los países de ingresos bajos y medianos"13. La prevalencia de obesidad infantil está aumentando de manera alarmante tanto en países desarrollados como en vías de desarrollo. La Organización Mundial de la Salud (OMS) llevó a cabo un estudio para cuantificar la prevalencia en todo el mundo y las tendencias de sobrepeso y 13 La obesidad. Organización mundial de la Salud. Consultado el 6 de junio de 2011 26 obesidad entre los niños en edad preescolar en el 2010, en 144 países. Encontraron 43 millones de niños en edad preescolar con sobrepeso y obesos y 92 millones en riesgo de sobrepeso; 35 millones de niños obesos y con sobrepeso se encontraron en países en vías de desarrollo. La prevalencia global del sobrepeso y la obesidad infantil ha aumentado a 8.9% en el 2010, frente al 4,2% en 1990. La OMS calcula que la cifra global alcanzará el 9,1% en el año 2020. Los investigadores estiman que la prevalencia de sobrepeso y la obesidad es de 8,5% en África y un 4,9% en Asia, que tiene el mayor número de niños con sobrepeso en el mundo14. La OMS reconoce que la prevalencia creciente de la obesidad infantil se debe a cambios sociales. La obesidad infantil se asocia fundamentalmente a la dieta malsana y a la escasa actividad física, pero no está relacionada únicamente con el comportamiento del niño, sino también, cada vez más con el desarrollo social y económico y las políticas en materia de agricultura, transportes, planificación urbana, medio ambiente, educación y procesamiento, distribución y comercialización de los alimentos. El problema es social y por consiguiente requiere un enfoque poblacional, multisectorial, multidisciplinar y adaptado a las circunstancias culturales15. 14 15 Arian Tarbal, OMS, La Obesidad Infantil: una epidemia mundial, en el link: www.faroshsjd.net/adjuntos/389.1-Pindola_obesitat_castella.pdf. Francesco Branca, Haik Nikogosian, and Tim LobsteinThe challenge of obesity in the WHO European Region and the strategies for response, World Health Organization 2007, ISBN 978 92 890 1408 3. 27 En Estados Unidos de Norteamérica se triplicó la prevalencia de sobrepeso (de acuerdo con la definición del CDC) en el rango de 2 a 19 años en este periodo; desde el 5,1% en la década de los setenta hasta el 17,1% en el registro del año 2003 al 200416. Se calculo el 16,3% de prevalencia de sobrepeso en niños de 2 a 19 años en el 2006. La obesidad se caracterizada por un cúmulo de grasa neutra en el tejido adiposo superior al 20% del peso corporal debido a un balance energético positivo mantenido durante un tiempo prolongado, se asocio con una mayor mortalidad en la edad madura, adolescentes con obesidad severa (IMC ≥ P 30), se manifestó con obesidad en la edad adulta en un 70.5%, y en adolescentes con sobrepeso al inicio del estudio fueron severamente obesos en la edad adulta en un 7,9%17. 2.1.8. Clasificación o tipos La obesidad puede ser clasificada de diferentes formas, dependiendo del criterio que se tenga en cuenta: 2.1.8.1. - Desde el punto de vista etiológico (origen) Obesidad exógena (Idiopática, esencial o exógena el 95%): La obesidad debida a una alimentación excesiva. 16 17 Martos. Moreno GA, Argente J. Obesidades pediátricas: de la lactancia a la adolescencia. An Pediatr (Barc). 2011. doi: 10.1016/j.anpedi.2011.03.018. Francesco Branca, Haik Nikogosian, and Tim LobsteinThe challenge of obesity in the WHO European Region and the strategies for response, World Health Organization 2007, ISBN 978 92 890 1408 3. 28 - Obesidad endógena (Secundaria, sindrómica o endógena del 1 al 3 % de los casos): La que tiene por causa alteraciones metabólicas. Dentro de las causas endógenas, se habla de obesidad endocrina cuando está provocada por disfunción de alguna glándula endocrina, como la tiroides (obesidad hipotiroidea) o por deficiencia de hormonas sexuales como es el caso de la obesidad gonadal. 2.1.8.2. Desde el punto de vista cuantitativo - Leve grado/clase I (120- 140%), obesidad es el IMC 30-34.9 kg/m2 - Moderada grado/clase II (141-160%), la obesidad es el IMC 35-39.9 kg/m2 - Intensa grado/clase III (160-200%), la obesidad es el IMC 40 kg/m2 - Mórbida (>200%), la obesidad es el IMC> 40 kg/m2 2.1.8.3. Desde el punto de vista de distribución regional - Androide - Ginecoide - Generalizada 2.1.8.4. Clasificación la Obesidad en la Niñez Existen 4 posibles clasificaciones para el exceso de peso en el niño: 29 Obeso de Alto Riesgo Sobrepeso de Alto Riesgo u Obeso Sobrepeso o en Riesgo No tiene Sobrepeso Se toma en consideración el cuadro tomado de: Dr. Alberto. Barceló, Programa de Enfermedades No Transmisibles, Dr. Juan Carlos Bossio, Módulo Obesidad Infantil, Salud del Niño y del Adolescente, Salud Familiar y Comunitaria, AIEPI 2001. (anexo 5) Se anexa un cuadro de flujo de proceso para realizar una Evaluación Clínica Terapéutica, tomado de: Laura Islas Ortega. HN-DIF. Mónica Peguero García, HN-DIF Hgo, Obesidad infantil, Boletín de practica medica efectiva, México, noviembre 2006. (anexo 4) 2.1.9. CAUSAS Las causas de la obesidad son múltiples, e incluyen factores tales como la herencia genética; el comportamiento del sistema nervioso, endocrino y metabólico; y el tipo o estilo de vida que se lleve. Los mecanismos para que estos factores causen exceso de grasa corporal son: 2.1.9.1. Las causas de una Obesidad Endógena 2.1.9.1.1. Las afecciones endocrinas asociadas - Hipotiroidismo - Enfermedad y síndrome de Cushing 30 - Hiperinsulinismo - Hipogonadismo. - Síndromes polimalformativos asociados: - Síndrome de Lawrence-Moon Bield - Síndrome de Prader Willi - Síndrome de Carpenter - Síndrome de Cohen - Síndrome de Alstrom - Síndrome de Albright - Síndrome del Cromosoma X frágil - Síndrome de Morgani-Stuart-Moreli 2.1.9.1.2. Alteraciones cromosómicas asociadas - Síndrome de Turner - Síndrome de Down - Síndrome de Klinefelter 2.1.9.1.3. Alteraciones Neurológicas asociadas - Tumores (cráneofaringioma) - Lesiones cerebrales - Distrofias musculares - Espina bífida - Parálisis cerebral 31 - Retraso mental intenso - Trastornos psicológicos asociados: - Bulimia reactiva 2.1.9.2. Causas Iatrogénicas18 2.1.9.2.1. Determinantes Clínicos a. Factores conductuales - Disminución del tiempo para actividad física y reemplazo por tiempo dedicado a la televisión, videojuegos y computadora19. - Niños que evitan el desayuno, pero que consumen una colación en la escuela. - Horarios de comida no establecidos; con largos periodos de ayuno y/o unión de comidas. - Hábitos alimentarios inadecuados (dietas altas en lípidos, hidratos de carbono refinadas), aumento en el consumo de alimentos industrializados, comidas rápidas20. - Familias en las cuales ambos padres trabajan. - Disminución de la actividad física21. 18 19 20 Hiltje Oude Luttikhuis, Louise Baur, Intervenciones para Tratar la Obesidad Infantil (Revisión Cochrane traducida). En: Biblioteca Cochrane Plus 2009 Número2. Oxford: Update Software Ltd. Disponible en: http://www.update-software.com. Laurson KR, Eisenmann JC, Combined influence of physical activity and screen time recommendations on childhood overweight. J Pediatr. 2008 Aug; 153(2):209-14. Epub 2008 Apr 16. Dennison BA, Erb TA, Jenkins PL. Television viewing and television in bedroom associated with overweight risk among low-income preschool children. Pediatrics. 2002 Jun; 109(6):1028-35. 32 - Bajo consumo de verduras, vegetales y fibra22. - El aumento del consumo de alimentos fritos fuera de casa asociadas con el aumento de índice de masa corporal23. - Madres que dormían durante el embarazo más de 8 horas al día tenían un menor riesgo de obesidad24. - Aumento del tiempo de la pantalla de visión, ver la televisión más de 8 horas a la semana y/o ≤ 2 horas día. - Duración media del sueño <12 horas / día a los 6 meses a 2 años, <10,5 horas a los 3 años 39-65 < a 9 horas de los 7 años en adelante, 66 existe menor duración del sueño en el 3ro a 6to grado lo cual se asoció con una mayor probabilidad de tener sobrepeso en sexto grado25. - Falta de comidas familiares. Comer la cena en familia> 5 noches por semana26. - Televisión en la habitación donde duerme el niño a la edad de 4 años.27,28 - Consumo de bebidas endulzadas con azúcar a la edad de dos años.29,30 21 Salbe AD, Weyer C, Assessing risk factors for obesity between childhood and adolescence: I. Birth weight, childhood adiposity, parental obesity, insulin, and leptin. Pediatrics. 2002 Aug; 110(2 Pt 1):299-306 22 Lluís Serra Majema,b, Lourdes Ribas Barbab, Obesidad infantil y juvenil en España, Resultados del Estudio enKid (1998-2000) Med Clin (Barc) 2003;121(19):725-32. 23 Farooqi IS, Wangensteen T, Clinical and molecular genetics spectrum of congenital deficiency of the leptin receptor. N Engl J Med. 2007 Jan 18; 356(3):237-47. 24 Lumeng JC. Overweight and psychiatric illness in children. South Med J. 2008 Apr; 101(4):347-8. 25 Cynthia L. Ogden, Margaret D. Carroll, Lester R. Curtin, Prevalence of Overweight and Obesity in the United States, 1999-2004 JAMA. 2006; 295(13):1549-1555. doi:10.1001/ jama 295.13.1549. 26 Riddoch CJ, Leary SD, Prospective associations between objective measures of physical activity and fat mass in 12-14 year old children: the Avon Longitudinal Study of Parents and Children (ALSPAC). BMJ. 2009 Nov 26; 339:b4544. doi: 10.1136/bmj.b4544 27 Lumeng JC, Rahnama S, Television exposure and overweight risk in preschoolers. Arch Pediatr Adolesc Med. 2006 Apr; 160(4):417-22. 28 Li L, Law C, Lo Conte R, Intergenerational influences on childhood body mass index: the effect of parental body mass index trajectories. Am J Clin Nutr. 2009 Feb; 89(2):551-7. Epub 2008 Dec 23. 33 - Rápido consumo de alimentos a la edad de 3 años. - Nivel social, económico y cultural bajos.31,32 - Los niños con antecedentes de atracones de comida, son jóvenes que se asocian a depresión, ansiedad que llevan a síntomas de trastornos alimentarios, así como alcoholismo33. - Programas de dietas para el control del sobrepeso se asocian con el aumento de peso, estudio prospectivo de 8.203 niñas y 6.769 niños de 9 a14 años seguidos por 2 años34. - El uso del biberón prolongado (> 19 meses de edad) se asocio con un mayor riesgo de obesidad a la edad de 3-5 años en el estudio de 3.027 niños35. - El estilo de crianza asociado con el riesgo de sobrepeso (autocontrol, alta sensibilidad y la implicación emocional). - Padres autoritarios - altas expectativas de autocontrol y baja sensibilidad y con implicación emocional se asocio con 17,1%. 29 Field AE, Austin SB, Taylor CB, Relation between dieting and weight change among preadolescents and adolescents. Pediatrics. 2003 Oct; 112(4):900-6. 30 Bonuck K, Kahn R, Is late bottle-weaning associated with overweight in young children? Analysis of NHANES III data. Clin Pediatr (Phila). 2004 Jul-Aug; 43(6):535-40. 31 Kimm SY, Glynn NW, Relation between the changes in physical activity and body-mass index during adolescence: a multicentre longitudinal study. Lancet. 2005 Jul 23-29; 366(9482):301-7. 32 Welsh JA, Cogswell ME, Rogers S, Overweight among low-income preschool children associated with the consumption of sweet drinks: Missouri, 1999-2002. Pediatrics. 2005 Feb; 115(2):e223-9. 33 Ludwig DS, Peterson KE, Relation between consumption of sugar-sweetened drinks and childhood obesity: a prospective, observational analysis. Lancet. 2001 Feb 17; 357(9255):505-8 34 Taveras EM, Berkey CS, Association of consumption of fried food away from home with body mass index and diet quality in older children and adolescents. Pediatrics. 2005 Oct; 116(4):e518-24. 35 Rhee KE, Lumeng JC, Parenting styles and overweight status in first grade. Pediatrics. 2006 Jun; 117(6):2047-54 34 - Padres permisivos - bajas expectativas para el auto-control y alta sensibilidad y con implicación emocional se asocio con 9,8%. - Padres negligentes - bajas expectativas para el auto-control y la baja sensibilidad y con implicación emocional se asocio con 9,9%36. - Depresión en la adolescencia se asocio con un mayor riesgo para la obesidad, en un año de seguimiento de 9.374 adolescentes37. - Estrés psicológico en las familias se asocio 4.2% más de riesgo para presenta obesidad en situaciones como: acontecimientos serios de la vida, estrés de los Padres, falta de apoyo social38. - La obesidad está asociada con baja auto-estima en el estudio de 2.812 niños australianos (edad media 11.3 años)39. b. Factores biológicos - Antecedentes de obesidad en familiares de primer grado40. - Si uno de los padres es obeso, el riesgo de ser obeso en la edad adulta se triplica (17 al 45%). 36 Rosenfield RL, Lipton RB, Thelarche, pubarche, and menarche attainment in children with normal and elevated body mass index. Pediatrics. 2009 Jan; 123(1):84-8. 37 Hillier TA, Pedula KL, Childhood obesity and metabolic imprinting: the ongoing effects of maternal hyperglycemia. Diabetes Care. 2007 Sep; 30(9):2287-92. Epub 2007 May 22. 38 Franklin J, Denyer G, Obesity and risk of low self-esteem: a statewide survey of Australian children. Pediatrics. 2006 Dec; 118(6):2481-7. 39 Stuart CA, Pate CJ, Peters EJ, Prevalence of acanthosis nigricans in an unselected population. Am J Med. 1989 Sep; 87(3):269-72. 40 Semmler C, Ashcroft J, Development of overweight in children in relation to parental weight and socioeconomic status. Obesity (Silver Spring). 2009 Apr; 17(4):814-20. Epub 2009 Jan 22. 35 - Ablactación temprana (antes de los 6 meses de edad), la falta de lactancia materna exclusiva hasta los 6 meses, e introducción de alimentos sólidos a <4 meses de edad. - Adenoamigdalectomía a la edad de ≤ 7 años están asociadas con el sobrepeso y la obesidad a los 8 años41. - Tabaquismo materno en el embarazo temprano.42,43 y 44 - Hijo de madre con diabetes gestacional o madre diabética45. - Retraso de crecimiento intrauterino. - Grandes para la edad gestacional. - Aumento rápido de peso (porcentaje más alto de cambio) desde el nacimiento hasta los 6 meses, la obesidad en la niñez temprana es factor de riesgo más importante para la obesidad infantil más tarde46. - Medicamentos psiquiátricos y esteroides pueden estar asociados con un grave aumento de peso47. - Hiperfagia48. 41 Pinhas-Hamiel O, Doron-Panush N, Obese children and adolescents: a risk group for low vitamin B12 concentration. Arch Pediatr Adolesc Med. 2006 Sep; 160(9):933-6. 42 Gillian M. Nixon, MBChB, FRACP, Short Sleep Duration in Middle Childhood: Risk Factors and Consequences, Volume 31, ISSUE 01, 2008 enero, 31 (1): 71. 43 Koch FS, Sepa A, Psychological stress and obesity. J Pediatr. 2008 Dec; 153(6):839-44. Epub 2008 Jul 26. 44 Wijga AH, Scholtens S, Adenotonsillectomy and the development of overweight. Pediatrics. 2009 Apr; 123(4):1095-101. 45 Chen X, Beydoun MA, Is sleep duration associated with childhood obesity? A systematic review and meta-analysis. Obesity (Silver Spring). 2008 Feb;16 (2):265-74. 46 Goodman E, Whitaker RC. A prospective study of the role of depression in the development and persistence of adolescent obesity. Pediatrics. 2002 Sep; 110(3):497504. 47 Pinhas-Hamiel O, Doron-Panush N, Obese children and adolescents: a risk group for low vitamin B12 concentration. Arch Pediatr Adolesc Med. 2006 Sep; 160(9):933-6. 48 The NS, Suchindran C, Association of adolescent obesity with risk of severe obesity in adulthood. JAMA. 2010 Nov 10; 304(18):2042-7. 36 - Pubertad adelantada en niñas con exceso de IMC49. - Síndrome de ovarios poliquísticos en adolescentes. c. Factores de riesgo para desarrollar complicaciones metabólicas - Diabetes mellitus tipo 2, independientemente de la edad de presentación. - Hipertensión arterial sistémica, independientemente de la edad de presentación. - Enfermedad hipertensiva durante el embarazo. - Enfermedad isquémica del miocardio en familiares varones menores de 55 años o mujeres menores de 60 años. - Enfermedad vascular cerebral en familiares varones menores de 55 o mujeres menores de 60 años. - La presencia de obesidad se asoció a riesgo de valores anormales de colesterol, triglicéridos, LDL, HDL y dislipidemia. - Hiperuricemia. - Presencia de acantosis nigricans en la parte posterior e inferior del cuello, independientemente de que ésta se presente también en axilas, inglés y otras localizaciones anatómicas. 49 Viner RM, Cole TJ. Adult socioeconomic, educational, social, and psychological outcomes of childhood obesity: a national birth cohort study. BMJ. 2005 Jun 11; 330(7504):1354. Epub 2005 May 17. 37 - Presión arterial en decúbito por arriba de la percentil 90 para la edad. - Circunferencia de cintura mayor a 90 cm, determinándola a nivel de la cicatriz umbilical. - Mayor (IMC ≥ percentil 80) está asociado con el aumento de factores de riesgo cardiovascular en la infancia, basado en un análisis transversal (NHANES) desde 2001 hasta 2006 que se realizo en 8.216 niños de 6 a 17 años, los cuales fueron evaluados y se encontró asociación con dislipidemia, disglucemia, hipertensión arterial50. - La obesidad y el sobrepeso en la infancia están asociados con la presión arterial elevada, basado un estudio transversal de 675 niños canadienses rurales 4 a 17 años, el 18,1 % tenía sobrepeso y el 11,4% eran obesos51. - El exceso de peso está asociado con una mayor tasa de fracturas óseas documentadas en un 13%, mayor tasa de dolor musculo-esquelético en un 14%, la queja más común fue el dolor de rodilla 6,6%. - La obesidad infantil está asociada con niveles más bajos de vitamina B12, e hipotiroidismo52. 50 Salvadori M, Sontrop JM, Elevated blood pressure in relation to overweight and obesity among children in a rural Canadian community. Pediatrics. 2008 Oct;122(4):e821-7. 51 Rigel DS, Jacobs MI. Malignant acanthosis nigricans review, J Dermatol Surg Oncol. 1980 Nov; 6(11):923-7. 52 Eduardo J. Sanchez, MD, Charles E. Bell, Acanthosis Nigricans and Insulin Resistance, Cuidado de la Diabetes 2002 Jun; 25 (6): 1009 38 - Se ha descrito que los niños y adolescentes con obesidad, sobre todo aquellos con incremento en la grasa abdominal, pueden tener un perfil sérico de lípidos aterogénico, caracterizado por un incremento de la concentración de colesterol sérico total (CT), triglicéridos (TGL) y lipoproteínas de baja densidad (LDL), y por la disminución de las lipoproteínas de alta densidad (HDL); se ha llegado a notificar la presencia de estas alteraciones hasta en 30% de niños y adolescentes con obesidad. 53 d. Las dermatosis asociadas con la obesidad - Asociadas con la resistencia a la insulina: acantosis nigricans y los fibromas péndulos o blandos. - Asociadas con hiperandrogenismo en mujeres: acné, hirsutismo y alopecia de patrón androgenético54. - La acantosis nigricans es una dermatosis, trastorno cutáneo benigno, marcador de resistencia a la insulina y, a veces un marcador de malignidad visceral, que se caracteriza por placas hiperpigmentadas, de aspecto papilomatoso, con textura semejante al terciopelo, que se localizan principalmente en el cuello, las axilas, el dorso de las manos, los pliegues inguinales y submamarios; son generalmente simétricas, 53 Omar García Solís, Diana E Medina Castillo, José de la Cruz López, Obesidad y dermatosis: estudio prospectivo y descriptivo en la Clínica de Consulta Externa Alfredo del Mazo Vélez del ISSEMyM, Toluca, Dermatología Rev Mex Volumen 54, Núm. 1, enero-febrero, 2010. 54 Laura Islas Ortega, HN-DIF, Mónica Peguero García, HN-DIF Hgo, Obesidad infantil, Boletín de practica medica efectiva, México, noviembre 2006. 39 cuyo color oscuro está relacionado con el grosor de queratina contenido en el epitelio superficial. Es una de las manifestaciones dermatológicas más comunes de la obesidad y mientras mayor sea el grado de ésta, mayor la incidencia. La acantosis nigricans se considera un marcador cutáneo de resistencia a la insulina e hiperinsulinismo, porque la insulina interacciona con el factor de crecimiento parecido a la insulina tipo 1, lo que aumenta la producción de fibroblastos y queratinocitos55. 2.1.9.3. Causas por Herencia y genética Como con muchas condiciones médicas, el desbalance calórico que resulta en obesidad frecuentemente se desarrolla a partir de la combinación de factores genéticos y ambientales. El polimorfismo en varios genes que controlan el apetito, el metabolismo y la integración de adipoquina, predisponen a la obesidad, pero la condición requiere la disponibilidad de suficientes calorías y posiblemente otros factores para desarrollarse completamente. Varias condiciones genéticas que tienen como rasgo la obesidad, han sido identificadas (tales como el síndrome de Prader-Willi, el síndrome de Bardet-Biedl, mutaciones en los receptores de leptina y melanocortina), pero mutaciones sencillas en locus sólo han sido encontradas en el 5% de los individuos obesos. 55 Ludwig DS, Peterson KE, Relation between consumption of sugar-sweetened drinks and childhood obesity: a prospective, observational analysis. Lancet. 2001 Feb 17. 40 Un estudio de 2007 identificó bastantes mutaciones comunes en el gen FTO; los heterocigotos tuvieron un riesgo de obesidad 30% mayor, mientras que los homocigotos tuvieron un incremento en el riesgo de un 70%56. A nivel poblacional, la hipótesis del gen ahorrador, que postula que ciertos grupos étnicos pueden ser más propensos a la obesidad que otros y la habilidad de tomar ventaja de raros períodos de abundancia y usar esta abundancia para almacenar energía eficientemente, pueden haber sido una ventaja evolutiva, en tiempos cuando la comida era escasa. Individuos con reservas adiposas mayores, tenían más posibilidades de sobrevivir la hambruna. Esta tendencia a almacenar grasas es probablemente una inadaptación en una sociedad con un abastecimiento estable de alimentos57. 2.1.9.4. Aspectos Microbiológicos El rol de las bacterias que colonizan el tracto digestivo en el desarrollo de la obesidad ha comenzado a ser recientemente objeto de investigación. En el tracto digestivo humano, las bacterias generalmente son miembros del filo de los bacteroides o de los firmicutes. En la gente obesa, existe una abundancia relativa de firmicutes (los cuales causan una absorción de energía relativamente alta), lo cual es restaurado por la pérdida de peso. A 56 Frayling TM, Timpson NJ, Weedon MN, et al (2007). A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity. Science 316 (5826): pp. 889-94. Doi:10.1126/science.1141634.. 57 Chakravarthy MV, Booth FW (2004). Eating, exercise, and "thrifty" genotypes: connecting the dots toward an evolutionary understanding of modern chronic diseases». J. Appl. Physiol. 96 (1): pp. 310. doi:10.1152/japplphysiol.00757.2003. 41 partir de estos resultados no se puede concluir aún si este desbalance es la causa de la obesidad o es un efecto58. 2.1.10. PRUEBAS A CONSIDERAR Biopsia indicada si la condición es maligna (melanoma, la micosis fungoide, tcp.) Descartar condiciones comunes asociadas como la diabetes, tiroides y otros trastornos endocrinos con: o Glucosa en ayunas o la prueba tolerancia a la glucosa e insulina. o Estudios de función tiroidea o Detección de colesterol o Electrolitos Tamizaje de la presión arterial. Índice de masa corporal59. 58 Ley RE, Turnbaugh PJ, Klein S, Gordon JI (2006). «Microbial ecology: human gut microbes associated with obesity». Nature 444 (7122): pp. 1022-3. doi:10.1038/4441022a 59 Syme C, Abrahamowicz M, Intra-abdominal adiposity and individual components of the metabolic syndrome in adolescence: sex differences and underlying mechanisms. Arch Pediatr Adolesc Med. 2008 May; 162(5):453. 42 2.1.10.1. Puntos a determinar con la Pruebas 2.1.10.1.1. Determinar el peso Para pesar adecuadamente, se deben tomar una serie de precauciones como utilizar siempre la misma balanza y preferiblemente por el mismo profesional o en su defecto, por personal previamente entrenado. Pesar con ropa ligera y dentro de un mismo horario. Recordar siempre calibrar previamente la balanza y evitar que el niño tenga contacto con la superficie o pared mientras se está registrando su peso. 2.1.10.1.2. Determinar la talla. El niño debe estar sin zapatos, con el pelo suelto y de pie, columna y cuello bien extendidos. Debe pararse de forma que el occipucio y que los glúteos y los talones hagan contacto contra la superficie donde se encuentra la cinta métrica para tallar. 2.1.10.1.3. Determinar el IMC Se utilizan las curvas de IMC (anexo 2-3), que se utilizan para clasificar la obesidad en la infancia. En este estudio tomamos en cuenta a pacientes con alto riesgo de sobrepeso y obesidad en donde las instrucciones alimentarias saludables y los cambios en hábitos pueden modificar el pronóstico. 43 2.1.10.1.4. Determinar el Índice HOMA-IR60 El Índice HOMA-IR: insulinemia en ayunas (μU/l) x glucemia en ayunas (mmol/l)/22,5. El índice HOMA (descripto por Turner61 y perfeccionado por Matthews62) se emplea como medida de IR y simplifica el procedimiento matemático asumiendo (aunque no es exactamente así) una relación simple en el feedback glucosa-insulina. Este índice, por haber sido validado frente al clamp, sigue siendo el más utilizado como patrón secundario en la mayoría de las publicaciones. Sin embargo, debe recordarse que es apenas una forma simplificada del programa HOMA, provisto en 1985 para fines de investigación por la Universidad de Oxford. Junto al HOMA, originalmente denominado HOMA-IR (por Homeostatic Model Assessment for Insulin Resistance)63. Anexo Cuartilos HOMA-IR (anexo 6). 60 Dr. Alberto Barceló, Programa de Enfermedades No Transmisibles, Dr. Juan Carlos Bossio, Módulo Obesidad Infantil, Salud del Niño y del Adolescente, Salud Familiar y Comunitaria, AIEPI 2001. 61 Buccini Graciela S. (1), Wolfthal D.L, Valores de corte para índices de IM, insulinosensibilidad e insulinosecreción derivados de la fórmula HOMA y del programa HOMA2. Interpretación de los datos. Revista Argentina de Endocrinología y Metabolismo Copyright © 2008 por la Sociedad Argentina de Endocrinología y Metabolismo: Vol 45 No. 1 62 Majkowska, L. Tests for evaluating Insulin Sensitivity in vivo. Przegl Lek. 1999;56(5): 3516 63 Kong, RL Williams, R Rhyne, J Am Fam Med Junta, Acantosis nigricans: alta prevalencia y asociación con la diabetes en un consorcio de investigación de la red basada en la práctica - de atención primaria de la red multiétnica (neto PRIME) estudio, 2010 Jul-Aug; 23 (4):476-85. 44 2.1.10.1.5. Determinar la Circunferencia de Cintura - Cadera (CC) Este es un predictor del la IR, indica también riesgos de salud asociados con una distribución excesiva de grasa abdominal en niños y podría incluirse en la práctica clínica como una herramienta simple para identificar niños con riesgo de presentar en el futuro enfermedad cardiovascular (ECV), HTA y diabetes tipo 264. La CC tiene un bajo error intraobservador e intemedidor y cuando se ajusta por la vestimenta la precisión se mantiene. La CC es fácil de medir y más reproducible que la medida del pliegue cutáneo. Una distribución de la masa grasa más troncal (patrón androide) se asociaba con la elevación de triglicéridos, disminución de HDL, incremento de la TA sistólica y de la masa ventricular izquierda. Las medidas de la CC se toman a nivel umbilical. Se miden con una cinta métrica flexible y no elástica con el sujeto parado. Los datos son percentilados en forma separada para varones y mujeres. Se define obesidad central como CC ≥ a percentil 90°. Ver (anexo 9) tabla percentiles Cintura cadera en mujeres y varones. 64 Dres. Valeria Hirschler, Claudio Aranda, ¿Es la acantosis nigricans un signo de insulinorresistencia en adolescentes obesos?, 1668-3501, Arch. argent. pediatr. v.102 n.2 Buenos Aires mar./abr. 2004. 45 2.1.10.1.6. Determinar la TA Se mide con un esfingomanómetro de mercurio y con el manguito adecuado para la edad, peso y talla del sujeto, luego de haber permanecido tranquilamente sentado durante 5 minutos. Las mediciones se realizaran a la mañana y en dos oportunidades distintas. La hipertensión arterial se definirá como el promedio de la tensión arterial sistólica y diastólica mayor o igual al percentil 95 para la edad, sexo y talla. 2.1.10.1.7. Determinar el estadio de Tanner La IR se incrementa significativamente entre los estadios de Tanner I y II y se mantuvo estable a través de los estadios de Tanner II, III y IV. La resistencia a la insulina es el sello de la fisiopatología de la diabetes mellitus tipo 2 y los pacientes con AN son dos veces más propensos a desarrollar Diabetes tipo 265. Los sujetos con hiperinsulinemia e intolerancia a la glucosa son bien aceptados como de alto riesgo para la diabetes. La acantosis nigricans (AN) se ha propuesto como un marcador fiable de la hiperinsulinemia. 65 JF-fu , Liang L , Dong GP, Los niños Obesos con acantosis nigricans benigna y resistencia a la insulina: análisis de 19 casos, diciembre 2004; 42 (12):917-9, Departamento de Endocrinología, Hospital de Niños de la Universidad de Zhejiang, la Facultad de Medicina, Hangzhou 310003, China. 46 La IR tiene una prevalencia que oscila entre 3,0 y 8,4 % de los niños y adolescentes delgados y obesos, según las clasificaciones del Programa Nacional de Educación y Control del Colesterol (NCEP-ATP III).66 Cuadro Nº 1: Clasificación de SIR según la NCEP-ATPIII para niños y adolescentes Para decir que un niño o adolescente tiene un SIR deberán cumplirse 3 de estos criterios: 1. Circunferencia cintura p 90 percentil 2. Triglicéridos >110 mg/dL o HDL-c < 40 mg/dL - Colesterol HDL <1,03 mmol / L (40 mg / dl) en hombres o <1,29 mmol / L (50 mg / dl) en las mujeres67. 3. HTA p 90 percentil 4. Elevación de la glucemia - En ayunas 6,1 mmol/L - A las 2h 11,1 mmol/L 66 Dr. Raul Calderín Bouza RO, Orlandi González N. Síndrome metabólico vs síndrome de insulinorresistencia. Diferentes términos, clasificaciones y enfoques: ¿existe o no? Rev. Cubana Endocrinol. 2006; 17(3):1-16. 67 Boney CM, Verma A, Metabolic syndrome in childhood: association with birth weight, maternal obesity, and gestational diabetes mellitus. Pediatrics. 2005 Mar; 115(3):e290-6. 47 El SIR tiene una etiopatogenia compleja y aún no totalmente dilucidada, en la que no solo existe una IR, expresada por resistencia a la acción fisiológica de la hormona insulina en los tejidos y órganos dianas como son: hígado, músculo, tejido adiposo y endotelio vascular, sino que además, existe un estado inflamatorio crónico asociado, en el que ambos inclusive, están involucrados en las situaciones clínicas y síndromes afines a la IR, algunas dentro de los criterios de las diferentes clasificaciones como son: sobrepeso y obesidad, sobre todo visceral (que no son causas de IR, pero sí se asocian y la empeoran), HTA esencial, perfil lipídico aterogénico (expresado por disminución de las lipoproteínas de alta densidad HDL-c, un aumento de la concentración plasmática de los triglicéridos, con un aumento de las partículas pequeñas densas de LDL-c)68, alteraciones en el metabolismo de los carbohidratos expresado por una glucemia en ayunas alterada (GAA), intolerancia a los hidratos de carbono (IHC), DM 2 y otras, descritas como asociaciones clínicas, tales como: hiperuricemia, hiperfibrinogenemia y aumento del activador del plasminógeno, hígado graso no alcohólico (HGNA), síndrome de ovarios poliquísticos en mujeres premenárquicas (SOP), síndrome de apnea obstructiva del sueño (SAOS), algunos tipo de cáncer (como el de mama, de colon, de próstata y de páncreas), alteraciones en el metabolismo del hierro y la ferritina, hiperhomocistinemia, disminución en la concentración de un aminoácido producido exclusivamente en el tejido adiposo llamado adiponectina, aumento de la proteína C 68 Turner, R. C., Holman, R.R; Matthews, D. R. y col. Insulin deficiency and insulin resistance interaction in diabetes: estimation of their relative contribution by feedback analysis from basal plasma insulin and glucose concentrations. Metabolism28:1086-96. 1979. 48 reactiva, incremento en la expresión del factor de necrosis tumoral-alfa (TNF-α) en el tejido adiposo, así como otras citocinas involucradas directamente en la inflamación y que se asocian estrechamente con la IR y el SIR69,70,71: enfermedades reumáticas (como la artritis reumatoidea [AR] y el lupus eritematoso sistémico [LES], la osteoporosis y el asma bronquial) 72. Pocos estudios han separado el papel de la AN y la obesidad como marcadores independientes de IR. Por esta razón, se determina la relación entre AN y distintos índices de IR como HOMA-IR, e insulinemia basal, determinar la asociación con el IMC, HDLC, triglicéridos y otros predictores de IR. El HOMA-IR se eligió como marcador, porque es el método más fidedigno para los distintos valores de glucemia y con los métodos inmuno-reactivos actuales para la medición de la insulinemia (ICMA), el coeficiente de variación del HOMA-IR está comprendido solamente entre 7,8% y 11,7%. Además, es un método validado en pediatría, hablaremos con mayor detalle más adelante. Es importante comentar sobre el sindrome metabólico por la relación ajustada con IR y AN, temas de este estudio. La prevalencia del síndrome 69 Dr. Raúl Orlando Calderín Bouza, Síndrome de IR en niños y adolescentes, Hospital Docente Clínico quirúrgico "Hermanos Ameijeiras", Rev. Cubana Endocrinol 2007; 18(2). 70 Bloomgarden ZT. Third Annual World Congress on the Insulin Resistance Syndrome. Mediators, antecedents, and measurement. Diabetes Care. 2006; 29(7):1700-06. 71 Soubrier M, Dougados M. Atherosclerosis and rheumatoid arthritis. Rev. Med. Internet. 2006 Feb; 27(2):125-36. 72 Castro - Rodríguez JA, Holberg CJ, Morgan WJ, Wright AL, Martinez FD. Increased incidence of asthma like symptoms in girls who become overweight or obese during the school years. Respir Crit Care Med. 2001; 163:1344-9. 49 metabólico en niños y adolescentes con sobrepeso varían ampliamente con la definición utilizada, en un estudio en 1.205 niños caucásicos con sobrepeso y adolescentes de 4-16 años (edad media 11.8 años, índice de masa corporal media de 27,3 kg / m 2), sólo el 2% cumplieron los criterios de síndrome metabólico en todas las definiciones73. Hay un 4,2% de prevalencia de síndrome metabólico en adolescentes, y es más alta en niños que en niñas (6,1% vs 2,1%). La prevalencia aumentó con el aumento de índice de masa corporal de 0,1% en el IMC74. Baja prevalencia en las niñas a la edad de 9-10 años; hasta el 3% a la edad de 18 a 19 años; 3,5% en niñas de raza negra y el 2,4% en niñas blancas75. Se encontró una prevalencia del 39% en obesos y el 50% en los niños gravemente obesos76. También alto contenido de grasa intra-abdominal asociado con el síndrome metabólico en adolescentes y presión arterial elevada asociada con alto contenido de grasa intra-abdominal en los niños pero no en las niñas77. 73 74 75 76 77 Lutsey PL, Steffen LM, Dietary intake and the development of the metabolic syndrome: the Atherosclerosis Risk in Communities study. Circulation. 2008 Feb 12; 117 (6):754-61. Epub 2008 Jan 22. Weitzman M, Cook S, Auinger P, Tobacco smoke exposure is associated with the metabolic syndrome in adolescents. Circulation. 2005 Aug 9; 112(6):862-9. Epub 2005 Aug 1. Houston TK, Person SD, Pletcher MJ, Active and passive smoking and development of glucose intolerance among young adults in a prospective cohort: CARDIA study. BMJ. 2006 May 6; 332 (7549):1064-9. J. Clin Endocrinol Metab. Fan AZ, Russell M, Naimi T, Li Y, Patterns of alcohol consumption and the metabolic syndrome. 2008 Oct; 93(10):3833-8. Epub 2008 Jul 15. Am J Kidney Dis. Lucove J, Vupputuri S, Heiss G, Metabolic syndrome and the development of CKD in American Indians: the Strong Heart Study. 2008 Jan; 51(1):21-8. 50 El IMC, presión arterial sistólica, y los triglicéridos elevados en la infancia o adolescencia está asociado con la incidencia de síndrome metabólico78. La combinación de peso elevado para la edad gestacional al nacer y la madre con diabetes gestacional están asociado con un mayor riesgo de síndrome metabólico79. El consumo de un patrón de dieta occidental (carne, fritos, carbohidratos refinados, bebidas azucaradas, alcohólicas) a si como la exposición al humo de tabaco80, pueden estar asociada con el síndrome metabólico (mayor riesgo de intolerancia a la glucosa), mientras que el consumo de lácteos puede proporcionar cierta protección81. El síndrome metabólico se asoció con un mayor riesgo de enfermedad renal crónica, enfermedad cardiovascular, síndrome de ovario poliquístico en mujeres y apnea obstructiva del sueño (OSA). 2.1.10.1.8. Determinar la Grasa Corporal Una vía alternativa para determinar la obesidad es medir el porcentaje de grasa corporal. Médicos y científicos generalmente están de acuerdo en que 78 Morrison JA, Friedman LA, Metabolic syndrome in childhood predicts adult cardiovascular disease 25 years later: the Princeton Lipid Research Clinics Follow-up Study. Pediatrics. 2007 Aug; 120 (2):340-5. 79 Dokras A, Bochner M, Hollinrake E, Screening women with polycystic ovary syndrome for metabolic syndrome, Department of Obstetrics and Gynecology, The University of Iowa Roy J. and Lucille A. Carver College of Medicine, Iowa City, 52242, USA, 2005 Jul; 106 (1): 131. 80 Steinberg J., Daniels SR. Obesity, insulin resistance, diabetes, and cardiovascular risk in children. Circulation 2003; 107: 1448-53. 81 Hermanns-Lé T, Hermanns JF, Piérard GE. Juvenile, Acanthosis Nigricans and Insulin Resistance. Pediatric Dermatology 2002; 19:12-4. 51 un hombre con más del 25% de grasa corporal y una mujer con más de 30% de grasa corporal son obesos. Sin embargo, es difícil medir la grasa corporal de forma precisa. El método más aceptado ha sido el de pesar a las personas bajo el agua, pero la pesada bajo el agua es un procedimiento limitado a laboratorios con equipo especial. Los métodos más simples para medir la grasa corporal son el método de los pliegues cutáneos, en el cual un pellizco de piel es medido exactamente para determinar el grosor de la capa de grasa subcutánea; o el análisis de impedancia bioeléctrica, usualmente llevado a cabo por especialistas clínicos. Su uso rutinario es desaconsejado. Otras medidas de grasa corporal incluyen la tomografía computarizada, la resonancia magnética y la absorciometría de rayos X de energía dual82. 2.1.11. Efecto sobre la salud La OMS señala que "El sobrepeso y la obesidad son el quinto factor principal de riesgo de defunción en el mundo. Cada año fallecen por lo menos 2,8 millones de personas adultas como consecuencia del sobrepeso o la obesidad. Además, el 44% de la carga de diabetes, el 23% de la carga de cardiopatías isquémicas y entre el 7% y el 41% de la carga de algunos cánceres son atribuibles al sobrepeso y la obesidad"83. 82 National Institute for Health and Clinical Excellence. Clinical guideline 43: Obesity: the prevention, identification, assessment and management of overweight and obesity in adults and children. London, 2006 83 Obesidad y sobrepeso. Nota descriptiva N°311. Organización Mundial de la Salud. Marzo de 2011 52 Un gran número de condiciones médicas han sido asociadas con la obesidad. Las consecuencias sobre la salud están categorizadas como el resultado de un incremento de la masa grasa (artrosis, apnea del sueño, estigma social) o un incremento en el número de células grasas (diabetes, cáncer, enfermedades cardiovasculares, hígado graso no alcohólico). Existen alteraciones en la respuesta del organismo la insulina (IR), un estado pro inflamatorio y una tendencia incrementada a la trombosis (estado pro trombótico)84. La asociación de otras enfermedades puede ser dependiente o independiente de la distribución del tejido adiposo. La obesidad central (u obesidad caracterizada por un radio cintura cadera alto), es un factor de riesgo importante para el síndrome metabólico, el cúmulo de un número de enfermedades y factores de riesgo que predisponen fuertemente para la enfermedad cardiovascular. Éstos son diabetes mellitus tipo dos, hipertensión arterial, niveles altos de colesterol y de triglicéridos en la sangre (hiperlipidemia combinada)85. Cardiovascular: Insuficiencia cardíaca congestiva, corazón aumentado de tamaño y las arritmias y mareos asociados, cor pulmonar, várices y embolismo pulmonar. 84 85 Bray GA (2004). Medical consequences of obesity. J. Clin. Endocrinol. Metab. 89 (6): pp. 2583-9. Grundy SM (2004). Obesity, metabolic syndrome, and cardiovascular disease. J. Clin. Endocrinol. Metab. 89 (6): pp. 2595-600. 53 Endocrino: síndrome de ovario poliquístico, desórdenes menstruales e infertilidad86. Gastrointestinal: enfermedad de reflujo gastro-esofágico, hígado graso, colelitiasis, hernia y cáncer colorectal. Renal y génito-urinario: disfunción eréctil87,incontinencia urinaria, insuficiencia renal crónica88, hipogonadismo (hombres), cáncer mamario (mujeres), cáncer uterino (mujeres), Obstétrico: Sufrimiento fetal agudo con muerte fetal intrauterina. Tegumentos (piel y apéndices): estrías, acantosis nigricans, linfedema, celulitis, intertrigo. Músculo esquelético: hiperuricemia (que predispone a la gota), pérdida de la movilidad, osteoartritis, dolor de espalda. Neurológico: accidente cerebrovascular, meralgia parestésica, dolores de cabeza, síndrome del túnel del carpo, demencia89, hipertensión intracraneal idiopática. 86 Van der Steeg JW, Steures P, Eijkemans MJ, et al (2008). Obesity affects spontaneous pregnancy chances in subfertile, ovulatory women. Hum. Reprod. 23 (2): p. 324–8. 87 Esposito K, Giugliano F, Di Palo C, Giugliano G, Marfella R, D'Andrea F, D'Armiento M, Giugliano D (2004). Effect of lifestyle changes on erectile dysfunction in obese men: a randomized controlled trial. JAMA 291 (24): pp. 2978-84. 88 Ejerblad E, Fored CM, Lindblad P, Fryzek J, McLaughlin JK, Nyrén O (2006). Obesity and risk for chronic renal failure. J. Am. Soc. Nephrol. 17 (6): pp. 1695-702. 89 Whitmer RA, Gunderson EP, Barrett-Connor E, Quesenberry CP Jr, Yaffe K (2005). Obesity in middle age and future risk of dementia: a 27 year longitudinal population based study. BMJ 330 (7504): pp. 1360 54 Respiratorio: disnea, apnea obstructiva del sueño o síndrome de Pickwick, y asma. Psicológico: depresión, baja autoestima, desorden de cuerpo dismórfico, estigmatización social. Mientras que ser severamente obeso tiene muchas complicaciones de salud, aquellos quienes tienen sobrepeso enfrentan un pequeño incremento en la mortalidad o morbilidad (anexo 7). Por otra parte algunos estudios han encontrado que la osteoporosis ocurre menos en personas ligeramente obesas sugiriendo que la acumulación de grasa sobre todo visceral, que se mide con la circunferencia abdominal, es un factor protector para la mineralización ósea90. 2.1.12. Consecuencias de la obesidad pediátrica: A corto plazo (para el niño o el adolescente) 90 - Problemas psicológicos - Aumento de los factores de riesgo de enfermedad cardiovascular - Asma - Diabetes (tipo 1 y 2) - Anormalidades ortopédicas Hinojosa Andia, Lucy J y Berrocal Kasay, Alfredo. Relación entre obesidad y osteoporosis, en mujeres posmenopáusicas del Hospital Nacional Arzobispo Loayza. Acta méd. peruana. [online]. sep./dic. 2007, vol.24, no.3 [citado 10 Agosto 2011], p.172-176. Disponible en la World Wide Web: <http://www.scielo.org.pe/ scielo.php?script=sci_arttext&pid=S172859172007000300008&lng=es&nrm=iso 55 - Hepatopatías. A largo plazo (para el adulto que era obeso de niño o adolescente) - Persistencia de la obesidad - Aumento de los factores de riesgo cardiovascular, diabetes, cáncer, depresión, artritis, etc. - Mortalidad prematura. 2.1.13. Tratamiento Es necesario tratar adecuadamente las enfermedades subyacentes, si existen. A partir de aquí depende de buscar el equilibrio, mediante ajustes en la dieta. La obesidad, como todas las enfermedades, es tratable; aunque no siempre se encuentre su cura. El tratamiento varía de acuerdo al nivel de grasa de la persona. El principal tratamiento para la obesidad, es reducir la grasa corporal comiendo menos calorías y ejercitándose más. En efecto colateral beneficioso del ejercicio es que incrementa la fuerza de los músculos, los tendones y los ligamentos, lo cual ayuda a prevenir injurias provenientes de accidentes y actividad vigorosa. Los programas de dieta y ejercicios producen una pérdida de peso promedio de aproximadamente 8% del total de la masa corporal (excluyendo los 56 sujetos que abandonaron el programa). No todos los que hacen dieta están satisfechos con estos resultados, pero una pérdida de masa corporal tan pequeña como 5% puede representar grandes beneficios en la salud. Mucho más difícil que reducir la grasa corporal es tratar de mantenerla fuera acontecida 80 a 90% de aquellos que tienen 10% o más que su masa corporal a través de la dieta vuelven a ganar todo el peso entre dos y cinco años. 2.1.13.1. Tratamiento Infantil 2.1.13.1.1. Obeso de Alto Riesgo IMC > P 95: El niño clasificado como Obeso de Alto Riesgo debe ser referido de urgencia a un nivel de mayor complejidad para hospitalización. Es importante captar a este niño e informar a la madre que debe volver al servicio de salud al salir de la hospitalización. Allí, debe iniciarse un seguimiento estricto del peso y acompañar los tratamientos iniciados en el nivel de referencia (anexo 8). 2.1.13.1.2. Sobrepeso de Alto Riesgo u Obeso con IMC > P 85: El niño debe ser referido a consulta especializada por pediatría y nutrición. En algunos casos deberá ser directamente referido a un servicio subespecializado como endocrinología. En general, el plan de tratamiento tiene varios tópicos que se separan para una mejor comprensión pero en realidad todos se relacionan entre sí: 57 Dieta con reducción energética Incremento de la actividad física Apoyo psicológico Apoyo familiar Prevención Debemos controlar al niño cada 30 días para hacer un seguimiento cercano del peso. El niño obeso o con sobrepeso no se puede dejar solo durante el tratamiento porque cuando no existe un seguimiento cercano, los tratamientos fallan. 2.1.13.1.3. Sobrepeso o en Riesgo Tratamiento del niño clasificado como Sobre Peso o en Riesgo son fundamentales las medidas preventivas, pero hay que hacer algunas modificaciones: a. Educación alimentaria o alimentación saludable La restricción alimentaria es el instrumento más eficaz y por lo tanto, imprescindible en el manejo del niño obeso, pero se debe tener algunos detalles en cuenta para evitar iatrogenia. En cuanto al régimen alimentario, es muy importante recordar que estamos en presencia de niños que están en pleno crecimiento y desarrollo. Por lo tanto, la meta es lograr en primer lugar que dejen de aumentar de peso ya 58 que si el niño crece normalmente, la relación peso para la talla se acercará gradualmente hacia la normalidad. En los más pequeños se indicaría dieta normocalórica para su edad pero en los adolescentes podemos recomendar dietas restrictivas. La labor más importante es educativa: si se enseña a las familias hábitos alimentarios sanos y adecuados, se logrará una prevención de la obesidad que es en realidad la forma más eficiente de combatirla. Existen algunas pautas que se pueden recomendar a todos los pacientes, adaptándolas según la necesidad: Las cantidades deben ser variables y no fijas. No deben medirse cantidades ni limitar porque existirán momentos en que se querrá comer más y en algunos menos. Lo importante es que no se debe comer nunca hasta quedar completamente lleno. Eso significa que se comió en exceso. Realizar 4 comidas diarias (desayuno, almuerzo, merienda y cena). Estas son fundamentales y no se debe eliminar ninguna. No comer nada entre las 4 comidas excepto si hay sed, agua. No tener en casa alimentos hipercalóricos de fácil acceso. La alimentación debe ser parecida para toda la familia. Siempre comer formalmente en la mesa, sin discusiones durante la comida. 59 No comer mientras se realizan otras actividades como leer, estudiar, ver televisión, etc. Servir la comida en platos pequeños. La vista influye notablemente, no solo en lo apetitoso sino también en la valoración subjetiva de la cantidad. Masticar despacio. Si algún día es indispensable algo de comer entre comidas, elegir frutas o verduras. Utilizar siempre preparaciones culinarias sencillas, evitando frituras y salsas. Evitar alimentos ricos en grasas y azúcares. Evitar siempre la repetición de platos. Alimentos aconsejables: Verduras: pueden ingerirse libremente, crudas o cocidas, sin grasas vegetal o animal. Frutas: prácticamente todas. Mejor entera que jugos con azúcar donde se pierde todo el poder vitamínico. Carne/pescado/aves: Todos para crear una dieta variada, menos el cerdo. Evitar las porciones con exceso de grasa. Huevo: uno diario evitando los fritos y eliminando el exceso de grasa de los mismos. Leche/yogurt: preferir semidescremados o descremados, hasta 2 porciones por día. 60 Bebidas: idealmente agua cada que exista sed. Las bebidas dietéticas son dulces y acostumbran al niño a este sabor. Pastas/legumbres: 1 ó 2 por semana, sin grasa, ni queso, ni mantequilla ni aceite en su preparación. Papa: en escasa cantidad, nunca fritas. Arroz: en cantidad escasa. Pan: escaso si es una costumbre, sin mantequilla. Cereal, galletas: escaso pero nunca con crema o chocolate, deben ser galletas sencillas b. Actividad Física: Es fundamental que se combine una alimentación saludable con el ejercicio. Algunas pautas para conseguir éxito en la actividad física son: Aumentar gradualmente la actividad física, comenzando por ejercicio muy suave. Lograr evitar que el niño se sienta ridículo haciendo ejercicio. El ejercicio debe ser diario, nunca esporádico. Buscar el más idóneo. No se debe depender de nadie para hacer ejercicio, porque si ese alguien falla, se pierde toda la rutina de ejercicio. Buscar pares con fines parecidos. Buscar un aspecto lúdico en el ejercicio o juego. Evitar el carro para salidas cerca. 61 Evitar en los apartamentos el uso de ascensor y volver a las escaleras. Si el niño utiliza bus para desplazarse al colegio, lograr si es posible que el bus lo deje unas 5 cuadras antes de llegar. Quizá, uno de los aspectos más importantes para fomentar la actividad física es limitar las actividades sedentarias. Se recomienda la limitación de la televisión, el computador y los videojuegos, etc. a una o dos horas máximo por día. c. Aspectos familiares y psicológicos importantes: En primer lugar, una historia clínica amplia y detallada que recoja: características de la alimentación, hábitos de ejercicio, nivel socioeconómico, antecedente de obesidad, hipertensión, diabetes, hiperlipidemia, o síndromes con obesidad y la actitud ante la obesidad del niño y la familia. Esta información ayudará a personalizar más el tratamiento. Además, recogerá las características de la familia en relación con el peso corporal, ¿se trata de una familia de obesos?, ¿cómo son los padres?, ¿cómo son los hermanos? En este contexto, también existen algunas pautas para tener en cuenta: La sobreprotección o rigidez de los padres influye en la manera de ser y comer. Algunos padres sobrealimentan por factores culturales y educacionales. 62 El primer cambio es la auto monitorización. El niño debe evaluar su ingesta y gasto calórico y todo lo que lo afecte sin tener que tener un conocimiento profundo del tema. Debe conocer qué come, cómo y el ejercicio que hace. Los padres llevan todo el peso del tratamiento en el menor de 5 años. Entre 5 y 9 años se da responsabilidad a los niños, pero la familia vigila y es responsable. Al mayor de 9 años se da más responsabilidad y en el adolescente disminuye notablemente la participación de la familia. Deben prevenirse situaciones que hacen que fallen los esfuerzos: -Falta de interés: especialmente cuando uno de los padres es obeso. -Resistencia al cambio: desean seguir patrones alimentarios diferentes a los recomendados. -Un familiar sabotea los esfuerzos: usualmente un abuelo. 2.1.13.1.4. No Tiene Sobrepeso El tratamiento del niño clasificado como NO TIENE SOBREPRESO es preventivo. Usted debe estimular hábitos de vida saludable. 2.1.13.2. Medicamentos La medicación más comúnmente prescrita para la obesidad de resistente al ejercicio/dieta es el orlistat (Xenical, el cual reduce la sesión intestinal de grasas inhibiendo la lipasa pancreática) y sibutramina (reductil, Meridia, un anorexígeno (supresor del apetito). La pérdida de peso con estas drogas es modesta y a largo plazo la pérdida promedio de peso con el orlistat es de 2,9 63 kg, con la sibutramina 4,2 kg y con el rimonabant 4,7 kg. El orlistat y el rimonabant llevan a una reducción en la incidencia de diabetes, y todas las drogas tienen algún efecto sobre las lipoproteínas (diferentes formas de colesterol). Sin embargo, existe poca información sobre las complicaciones a largo plazo de la obesidad, tales como los infartos. Todas las drogas tienen efectos secundarios y contraindicaciones potenciales. Comúnmente las drogas para pérdida de peso se usan por un período (por ejemplo tres meses) y se descontinúan o se cambian por otra gente si el beneficio no ha sido obtenido, tal como una pérdida de peso menor de 5% del total del peso corporal. Un meta análisis de estudios controlados al azar realizado por International Cochrane Collaboration, concluyó que en pacientes diabéticos la fluoxetina, el orlistat y la sibutramina, podrían conseguir una significativa aunque modesta pérdida de peso entre 12 a 57 semanas, con beneficios a largo plazo sobre la salud no muy claros. La obesidad también puede influir sobre la elección de las drogas para el tratamiento de la diabetes. La metformina puede conducir a una leve reducción de peso (en oposición a las sulfonilureas e insulina) y ha sido demostrado que reduce el riesgo de enfermedad cardiovascular en los diabéticos tipo dos obesos. Las tiazolidinedionas, pueden causar una ligera ganancia de peso, pero disminuyen la "patológica" grasa abdominal y pueden por lo tanto ser usadas en diabéticos con obesidad central. 64 2.1.13.3. Cirugía bariátrica La cirugía bariátrica (o "cirugía para pérdida de peso") es la intervención quirúrgica usada en el tratamiento de la obesidad. Como toda intervención quirúrgica puede conducir a complicaciones, por lo que debe ser considerada como el último recurso cuando la modificación dietética y el tratamiento farmacológico no han sido exitosos. La cirugía bariátrica depende de varios principios, la propuesta más común es la reducción de volumen del estómago, produciendo una sensación de saciedad temprana (con una cinta gástrica ajustable) mientras otros también reducen la longitud del intestino con la que la comida en contacto, reduciendo directamente la absorción (bypass gástrico). La cirugía en la que se emplea la cinta o banda es reversible mientras que las operaciones en las que se acorta el intestino no lo son. Algunos procedimientos pueden ser realizados laparoscópicamente. Las complicaciones de la cirugía bariátrica son frecuentes91. Dos grandes estudios han demostrado una relación mortalidad/beneficio a partir de la cirugía bariátrica. Una marcada disminución en el riesgo de sufrir diabetes mellitus, enfermedades cardiovasculares y cáncer92. 91 Encinosa WE, Bernard DM, Chen CC, Steiner CA (2006). Healthcare utilization and outcomes after bariatric surgery. Medical care 44 (8): pp. 706-12. 92 Sjöström L, Narbro K, Sjöström CD, et al (2007). Effects of bariatric surgery on mortality in Swedish obese subjects. N. Engl. J. Med. 357 (8): pp. 741-52. 65 La pérdida de peso fue más marcada en los primeros meses después de la cirugía, pero el beneficio se mantuvo a largo plazo. En uno de los estudios hubo un incremento inexplicable en las muertes por accidentes y suicidios que no pesó más que el beneficio en términos de prevención de enfermedad. La cirugía bypass gástrico fue aproximadamente dos veces más efectiva del procedimiento de la banda gástrica ajustable. 2.2. INSULINORESISTENCIA (IR) 2.2.1. Definición 2.2.1.1. Insulina Es una hormona producida por el páncreas, que cumple en el organismo múltiples funciones, por diferentes mecanismos. Dentro de ellas mantiene los niveles de glucemia (glucosa en sangre) dentro de límites normales. Esta acción la ejerce a través del aumento del transporte de glucosa a los tejidos y su utilización como combustible por los mismos, disminuyendo de esta manera la glucemia. Además por otros mecanismos o vías aumenta el crecimiento y multiplicación celular en algunos tejidos. 2.2.1.2. Insulinoresistencia (IR) Es un trastorno en la acción de la insulina, en el cual existe una menor respuesta a la misma o, dicho de esta manera, se requiere de un mayor nivel de insulina para lograr un efecto dado. 66 La insulina es una hormona sintetizada en el páncreas. La liberación de insulina es estimulada fundamentalmente por la glucosa, ya que es la hormona hipoglucemiante por excelencia: Se secreta luego de las comidas, para reducir la glucosa en sangre, que ha aumentado al ser absorbida desde los alimentos. El mecanismo por el cual la insulina reduce la glucosa en sangre es facilitar su entrada a ciertos tejidos que requieren insulina para ello y promover su utilización. Además, la insulina presenta otras acciones: lipogénica (favorece la síntesis de grasas) y antilipolítica (inhibe la degradación del tejido graso) y es anabólica proteica (favorece la producción de proteínas). Además, regula el funcionamiento de varios órganos, entre ellos los ovarios, y estimula la proliferación de algunas células, como las células moleculares de las arterias. La IR se relaciona con: Obesidad central Hipertensión arterial (HTA) Dislipidemia: aumenta los triglicéridos en sangre TGL (forma parte de lípidos o grasas), disminuye el HDL (colesterol bueno), alteración de la LDL (colesterol malo) que se vuelve pequeño y denso (favoreciendo la arterioesclerosis) 67 Estado procoagulante (aumenta el riesgo de trombosis o coagulación, predisponiendo al infarto agudo de miocardio) Anomalías o trastornos en los vasos sanguíneos (arterias) Hiperuricemia (aumento del ácido úrico) 2.2.2. Causas En la génesis de la IR existen factores genéticos y ambientales o exógenos: Anomalías genéticas que alteran la acción de la insulina. Entre los primeros, la IR es mucho más frecuente en quienes presentan antecedentes familiares de diabetes del adulto, IR o incluso enfermedad coronaria o hipertensión arterial. Los aspectos ambientales relacionados con el desarrollo del IR incluyen la mala alimentación materna durante el embarazo y la propia en la infancia temprana, así como la inadecuada dieta (exceso de grasas, azúcares simples y escasa cantidad de fibras) y el sedentarismo a lo largo de la vida. La obesidad altera la respuesta de las células a la insulina, siendo por lo tanto causa y consecuencia de IR. - OBESIDAD (presente en la mayoría), estamos asistiendo a una verdadera "epidemia de obesidad" a nivel mundial. La reducción de un 5% a un 10% del peso corporal mejora notablemente la sensibilidad a la insulina. 68 - Uso de fármacos que aumenten la resistencia a la insulina (ej. corticoides) - Aumento de hormonas contrarreguladoras (opuestas) a la acción de la insulina - Desnutrición fetal (el bajo peso al nacer predispone a IR en un futuro) - La macrosomía (peso al nacer mayor a 4 kg) también predispone a la obesidad y a la Insulinoresistencia. 2.2.3. Consecuencias de la resistencia a la insulina en pacientes con sobrepeso y obesidad En los pacientes que tienen Insulinoresistencia, que particularmente se produce por la acción hipoglucemiante, puede ocurrir que se logre conservar la glucosa en sangre dentro de niveles normales o que resulte elevada en sangre, pero en ambos casos con un mayor nivel de insulina circulante. En el primer caso se tiene IR sin diabetes y en el segundo, cuando ya hay aumento de la glucosa en sangre, diabetes tipo 2 o del adulto. Como la resistencia es más acentuada para los efectos hipoglucemiantes de la insulina las acciones antilipolítica y lipogénica están más preservadas, y es por ello que los pacientes son IR presentan un aumento de la grasa corporal; es decir que la obesidad puede relacionarse, entre otros factores causales, con la IR. 69 Como se mencionó, la insulina interviene en la regulación de la función ovárica, modulando la ovulación y estimulando la síntesis de hormonas ováricas, especialmente la de andrógenos (o sea las hormonas masculinas). Cuando existe IR e algunos tejidos, el consecuente exceso de insulina actúa por demás en el ovario, que no presenta menor respuesta a la insulina, e inhibe la ovulación y produce exceso de andrógenos, desarrollándose un cuadro bastante común, conocido como poliquitosis ovárica. Este cuadro se caracteriza por pérdida de la ovulación e irregularidades menstruales (en general espaciamiento o ausencia de menstruaciones), sobrepeso e incremento del vello corporal (debido al aumento de los andrógenos), aunque no siempre están presentes todos los síntomas. Estas mujeres además tienen un riesgo aumentado de tener diabetes o enfermedades cardíacas. La IR frecuentemente se asocia con hipertensión arterial y además el exceso de insulina estimula el aumento de las fibras musculares de la pared de las arterias, y por eso los pacientes con IR presentan riesgo aumentado de padecer enfermedad coronaria. La acantosis nigricans en pacientes con sobrepeso y obesidad. 2.2.4. IR y Obesidad El aumento de peso comienza a partir de los 7 años como promedio, luego este se retarda con relación al crecimiento de la talla de los niños, sobre 70 todo, en la adolescencia, por lo que la ganancia de peso se convierte en esta etapa en uno de los mayores predictores de IR. El IMC transita desde la niñez a la adultez, con un coeficiente de correlación de 0,64 entre el IMC del niño y del adulto, entonces niños delgados se convierten en adultos delgados, mientras que niños obesos se convierten en adultos obesos; pero con similar trayectoria le sigue la HTA y los niveles de lípidos, con el consiguiente incremento del riesgo de presentar IR (alrededor de un 3,0 al 4,2 % de los niños y adolescentes delgados, según la clasificación de la NCEP, y de un 8,4% si se usa la de la OMS, que tiene mayor sensibilidad y especificidad que la anterior, aunque esta última fue diseñada para el uso en los adultos. Esta prevalencia de SIR aumenta en los niños y adolescentes obesos, y es de 6,1 a 8,4% en adolescentes sobrepesos, pero en los adolescentes obesos se incrementa la prevalencia hasta un 28,7%). Es útil resaltar que diferentes investigaciones realizadas en adolescentes obesos reflejan que el 89 % de ellos presentaba, al menos, uno de los criterios de SIR, y más de la mitad, el 56 %, presentaba 2 de los criterios de SIR según NCEP-ATP III. Se ha demostrado que el mejor indicador de grasa abdominal perivisceral es la medida de la C-C. Su incremento en niños y adolescentes se ha asociado con elevación de la presión arterial, del colesterol total, de las lipoproteínas de baja densidad (LDL-c), de la concentración de triglicéridos, de la insulina en sangre en ayunas y del índice HOMA (Homeostasis Model 71 Assessment-Evaluación con el Modelo Homeostático), así como con una concentración baja de lipoproteínas de alta densidad (HDL-c). Estas evidencias de resultados de investigaciones en niños y adolescentes han convertido la presencia del sobrepeso, la HTA y la dislipidemia como verdaderos predictores de IR. Estudios longitudinales en niños y adolescentes con obesidad han revelado que su presencia después de los 3 años de edad está asociada con un mayor riesgo de presentar obesidad en la vida adulta, relacionado con la presencia de IR, SIR y con otros factores de riesgo cardiovasculares (FRCV), como son, la HTA, la dislipidemia, los trastornos metabólicos (GAA, intolerancia a los HC y a la diabetes DM 2 en el niño y el adolescente), el aumento de la proteína C reactiva, de la interleucina 6 (IL-6), el aumento del TNF-α, conjuntamente con otros marcadores de inflamación, la hiperhomocistinemia, la hiperfibrinogenemia, al aumento del activador del plasminógeno, además de reducciones en la concentración de adiponectina, que traen consigo la aparición de las señales de aterosclerosis temprana, como el aumento de las estrías de grasas en las arterias carótidas, coronarias y otros vasos sanguíneos, que aceleran el proceso de aterosclerosis (aterosclerosis temprana) y la aparición de DM 2. Sin dudas, no solo la genética, sino los factores ambientales, explican estos alarmantes resultados: la adquisición cada vez más fácil de comidas ricas en grasas y carbohidratos, el consumo de jugos y refrescos azucarados, y el 72 sedentarismo de los niños por el aumento de las horas destinadas a la televisión, a los juegos de video caseteras y a las computadoras. 2.2.5. Sensibilidad a la Insulina e IR en Niños y Adolescentes La insulina, hormona anabólica, constituye la principal hormona reguladora de los mecanismos de homeostasis en el metabolismo de los glúcidos y de los lípidos. Dentro de sus múltiples funciones, una de las principales es la disminución de la glucemia, por lo que reduce la gluconeogénesis y la glucogenolisis hepática, además de facilitar el transporte y entrada de la glucosa a la célula del tejido muscular estriado y del tejido adiposo. Por estas razones decimos que la IR no es más que la incapacidad de la hormona insulina para mantener la homeostasis glucídica por resistencia a la acción de la hormona en los tejidos periféricos (hígado, músculo estriado, tejido adiposo y el endotelio vascular), lo que conlleva a una hiperinsulinemia compensatoria, asociada a un estado inflamatorio crónico, principal etiopatogenia del SIR. Esta disminución de la capacidad de acción de la hormona insulina, para generar la respuesta fisiológica en el mantenimiento de la homeostasis glucídica, trae como consecuencia una hiperinsulinemia compensatoria que puede ser compatible con una glucemia plasmática normal. La sensibilidad a la insulina es muy variable en los sujetos sanos, y esta variabilidad se expresa con la edad, la raza, grupos étnicos, el peso y la 73 distribución de la grasa corporal; también en los diferentes estados fisiológicos como la pubertad, la gestación, el puerperio y la senectud; pero además, podemos apreciar su variabilidad, con diferentes tipo de dieta, con la actividad física, con la presencia de enfermedades (por ejemplo, la cirrosis hepática) y con el uso de medicamentos. Existe una mayor sensibilidad a la insulina en los niños que en las niñas alrededor de los 11 años, pero a los 19 la sensibilidad a la insulina es menor, a pesar de la disminución de la grasa corporal en los muchachos en la adolescencia. Esto trae como consecuencia cambios en los niveles de insulina en ayunas: es pequeña la disminución de estos niveles de insulina en los niños, mientras que en las niñas decrece a través de la adolescencia. Las medidas de sensibilidad a la insulina y la insulinemia en ayunas en edades pediátricas tienen una correlación ligeramente negativa, y sugieren que la medida de insulinemia en ayunas no tiene el mismo valor que en la población adulta, por lo que el índice HOMA aquí no es muy útil. A pesar de estos resultados, se han encontrado niveles más bajos de insulinemia en los sujetos delgados IR que en los sujetos obesos IR. Un factor modificable, la ganancia de peso, es el determinante para que disminuya la sensibilidad y empeore la IR, sobre todo, en niños y adolescentes que tienen un sustrato genético que los predispone a padecer de IR. 74 Se ha mostrado en estudios anteriores que quienes estuvieron en el 3ro. o 4to. percentil en el IMC a la edad de 13 años, triplican, e incluso pueden llegar a tener hasta 5 veces más probabilidades de padecer SIR, con respecto a los sujetos delgados que también padecían de IR. 2.2.6. Diferentes Métodos para Cuantificar la Sensibilidad a la Insulina e IR Existen diferentes métodos para evaluar la resistencia a la acción de la insulina que pueden ser agrupados en métodos directos e indirectos. 2.2.6.1. Métodos Directos Dada su complejidad, duración y coste, las técnicas de estimación directa quedan relegadas, en la práctica, a la investigación de casos y controles en muestras reducidas y en pacientes aislados. (clamp euglicémico, modelo mínimo de Bergman y el test de supresión de insulina [TSI]). 2.2.6.2. Métodos Indirectos Son los más utilizados, pero debido a su menor precisión con respecto a los anteriores, su empleo queda relegado a los estudios epidemiológicos y a investigaciones con muestras amplias. Aquí se citan los métodos basados en respuesta glucémica e insulinémica a la sobrecarga de glucosa (índice HOMA, CIGMA, McAuley, FIRI, Raynaud, QUICKI); como también el método de Matsuda, el de Stumvoll, el de OGIS, el de Gutt, el de Avignon, el de Belfiore y el de Soonthornpun. 75 Cuadro Nº 2: Tabla de Algunos Métodos para Mesurar la IR Métodos directos: Métodos indirectos: Clamp euglicémico de DeFronzo Modelo mínimo de Berman Test de supresión de insulina (TSI) PTG oral y PTG endovenoso Índice HOMA Índice de Bennet Dextrosa deuterada y otros Es importante señalar que de los métodos basados en la cuantificación basal de la glucosa y de la insulina, el HOMA es el que mejor ha pasado los controles de fiabilidad. La insulinemia en ayunas ha sido también utilizada como criterio de IR, a mayor insulinemia mayor IR, que se usa más en adultos y para determinar el índice HOMA; pero dada su variabilidad tan grande en niños y adolescentes, sobre todo, en algunos estados fisiológicos como la pubertad en que se encuentra muy elevada, no se recomienda su uso. No obstante, Goran y Gower establecieron después de estudios de mesuración de la insulinemia en el estadio puberal algunos puntos de cortes para la misma; así determinaron para el estadio prepuberal valores de inulinemia ≥ a 15 μU/ml, para la pubertad media (estadio de Tanner de 2 a 76 4) valores ≥ a 30 μU/ml, y en el pospuberal valores de 20 μU/ml, que sus autores plantean que son valores similares a los de los adultos. Sin embargo, Bloomgarden ZT, al relatar el III Congreso de Síndrome de SIR realizado en 2006, refleja en el acápite Cuantificación de la Insulina valores más bajos para decir si hay insulinemia en el adulto que los planteados por Goran y Coger, como son: valores normales de insulinemia en ayunas hasta 15 μU/ml, o sea, un adulto con insulinemia ≥ 16 μU/ml tiene una hiperinsulinemia en adultos.1 Otros investigadores, como Lamber y otros64 o Csabi y otros65 determinaron sus propios niveles de cortes para sus respectivos universos de estudio, estimando tablas con percentiles. 2.2.7. Anormalidades asociadas a IR / Hiperinsulinemia compensatoria. Inflamación a. Aumento de la Proteína C Reactiva. b. Aumento de la interleucina 6 (IL-6), c. Aumento del Factor de Necrosis Tumoral alfa (TNF-α). d. Aumento del Factor de Von Willebrand Dislipidemia aterogénica. a. Aumento de los triglicéridos plasmáticos. b. Disminución de la HDL-c 77 c. Disminución del diámetro de la partícula pequeña densa de las LDL. d. Aumento de la acumulación de triglicéridos en el estado post-prandial. e. LDL pequeña y densa elevada. f. Apo B elevada. g. LDL-c normal o alta. Algunos grados de trastornos de la glucemia: a. Glucosa alterada en ayunas. b. Intolerancia a los hidratos de carbono (IHC). c. Diabetes mellitus tipo 2 (DM 2) en el adulto. d. Diabetes mellitus tipo 2 en el niño y adolescentes. Disfunción Endotelial. a. Aumento de la adhesión de las células mononucleares. b. Aumento de la concentración en el plasma de las moléculas de adhesión. c. Aumento de la concentración plasmática de la Dimethylarginina asimétrica. d. Disminución de la vasodilatación dependiente del endotelio. 78 Factores Procoagulantes a. Aumento del inhibidor 1 del activador del plasminógeno. b. Aumento del fibrinógeno. Cambios hemodinámicas a. Aumento de la actividad del sistema nervioso simpático. b. Aumento de la retención de Sodio Renal. c. Aumenta la Actividad de la Bomba Na-K- ATP asa. d. Aumenta el contra transporte de Na e H. e. Aumenta la actividad Ca- ATPasa. f. Estimula factores de crecimiento (Hiperplasia las células musculares lisas de las arterias y arteriolas) por estimulación de la hiperinsulinemia resultante de la IR a un factor parecido a la hormona del crecimiento, el IGF-I. Metabolismo Anormal del ácido Úrico. Aumento de la Secreción de testosterona Ovárica. a. Poliquistosis Ovárica asociado compensatoria. 79 con IR e hiperinsulinemia b. Aumento de la mortalidad cardiovascular en las pacientes que presentan Poliquistosis Ovárica con IR/Hiperinsulinemia compensatoria. Síndrome de Apnea Obstructiva del Sueño. (SAOS). Trastornos en el metabolismo del hierro. Síndrome Clínicos Asociados a la IR: 1. Diabetes Mellitus tipo 2 (DM 2). 2. Enfermedad Cardiovascular: Cardiopatía Isquémica y Enfermedad Vascular Cerebral. 3. Hipertensión Arterial Esencial (HTA). 4. Síndrome de Ovarios Poliquísticos. 5. Hígado Graso no Alcohólica. (HGNA). - Hígado Graso no Alcohólico Simple. - Esteatohepatistis no alcohólica. - Cirrosis Hepática. 6. Ciertas formas de Cáncer (Mama, páncreas, colon y próstata) 7. Síndrome de Apnea Obstructiva del sueño. 8. Síndrome derivado del trastorno en el metabolismo del Hierro. 80 9. Osteoporosis. 10. Asma Bronquial. 11. Enfermedades reumáticas (Artritis reumatoidea). 12. Bajo peso al nacer. 13. Enfermedad renal Crónica. 2.2.8. Clasificaciones del SIR Clasificación de la OMS, modificada en 1999: Presencia de una de estas situaciones: Glucemia en ayunas alterada (GAA), intolerancia a los hidratos de carbono (IHC) y/o diabetes mellitus tipo 2 (DM2)] o IIR + dos criterios de los 3 que se reflejan a continuación en mujeres (M) y en hombres (H) respectivamente: a. IMC > = 30 kg/m² o IC-Cad. > = 0,85 M y > = 0,9 H. b. TG > = 1,7 mmol o HDL-c < 0,9 mmol M y < 1,0 mmol H. c. TA > = 140/ 90 mmHg. La de la OMS, modificada en el año 1999, va hacia la fisiopatología; presenta mayor sensibilidad que la de la NCEP- ATP III, pero tiene cuatro defectos: 1. Tiene como primer criterio la obesidad. El sujeto obeso de hecho ya está enfermo. La obesidad no es causa de Insulinoresistencia, sino que la 81 empeora y predispone al fallo de la célula Beta, pero debe haber un sustrato de base ¿genético? para que se produzca la Insulinoresistencia y el fallo de la célula Beta. No todos los sujetos obesos son Insulinoresistencia y viceversa. Incluir la obesidad hipertrofiaría cualquier clasificación y desviaría la meta principal en el diagnóstico del IR, que debe ser precoz y preventivo, de las complicaciones en sujetos aparentemente sanos. 2. No toma los valores de glucemia de la PTG-O, ni en ayunas ni a las 2 h como criterios para el diagnóstico de IR, aunque lo utiliza indirectamente para saber si el paciente tiene una GAA, IHC o DM2, condiciones que no requieren la presencia de IR para su diagnóstico, ya que la presencia de dos criterios con las condiciones antes mencionadas hace, automáticamente el diagnóstico; por eso se dice que solo utiliza la PTGO indirectamente y no como criterio. 3. Pasan a un segundo plano los triglicéridos y el metabolismo de los lípidos en general, cuando esto es lo primero que se afecta y es una condición sin ecuanón de la IR. 2.2.9. Prevención y Tratamientos para la IR La comunidad médica y en particular los pediatras deben prevenir el desarrollo del síndrome metabólico en niños y adolescentes, mediante su identificación y posterior manejo y tratamiento adecuado 20. Para ello se debe entrenar y concientizar a los mismos mediante: 82 - La realización de despistajes en grupos de alto riesgo, utilizando adecuadamente las medidas antropométricas y tablas desarrolladas en cada comunidad (peso, talla, índice de masa corporal y otros parámetros como lo son: circunferencia abdominal y pélvica y su relación). - Seguimiento apropiado en grupos de alto riesgo como lo son: hijos de padres obesos, hijos de familias con alta incidencia de enfermedad cardiovascular y/o diabetes, niños con retardo de crecimiento intrauterino, familias con alta incidencia de hiperandrogenismo y ovario poliquístico y en grupos étnicos específicos. - Determinar niveles de glicemia y lípidos en los grupos anteriores. - Determinar niveles de insulina basales y utilizar los índices desarrollados con niveles de insulina y glicemias en ayunas como lo son: HOMA, QUICKI, relación glicemia /insulina basales y otros. - Realizar curvas de tolerancia glucosadas y otras pruebas de metabolismo como determinación de primera fase de secreción insulínica mediante CTGIV y métodos de clamp-glucosa, sólo en casos muy específicos para diagnosticar un síndrome de resistencia a la insulina y/o diabetes. - Cambios en hábitos alimenticios: dietas adecuadas para niños y adolescentes de diferentes edades. Promover comidas sanas en comedores escolares, concientizar al público en general del peligro del 83 abuso de las llamadas "comidas rápidas", por su alto contenido en grasas y carbohidratos así como del tamaño de las porciones tanto de comidas como de bebidas de alto contenido calórico. - Cambios en el estilo de vida: incorporación de actividad física, ejercicios y deportes estructurados en la actividad diaria del niño y adolescente. - Tratamientos farmacológicos sólo en caso de fracaso terapéutico con dieta y ejercicio, como: la metformina, troglitazone y acarbose, pueden reducir el riesgo de desarrollar diabetes tipo 2 en pacientes con síndrome metabólico. Algunos estudios reportan que la metformina limita la ganancia en peso, aunque existe controversia en la literatura, este medicamento reduce los niveles de glucosa e insulina en ayunas, así como los niveles de lípidos, sobre todo a corto plazo. La experiencia que se tiene utilizando intervención farmacológica es mucho menor en edades pediátricas que en el adulto. El tratamiento con metformina en niños y adolescentes con diabetes mellitus tipo 2, síndrome de resistencia a la insulina y/o ovario poliquístico, es que es bien tolerado en la mayoría de los niños, aunque un porcentaje pequeño manifiestan trastornos gastrointestinales u otros síntomas. 84 2.3. Acantosis Nigricans (AN) 2.3.1. Definición La acantosis nigricans es un trastorno pigmentario, debido a una hiperinsulinemia secundaria a la resistencia de las células del cuerpo en contra de la insulina, tal como se presenta en la diabetes tipo II el cual se acompaña en esta situación en general de signos de hiperandrogenismo (hirsutismo, acné y oligomenorrea en las mujeres) siendo en estos casos una resistencia grave a la insulina93, el Síndrome Metabólico y en la obesidad94. Al parecer, la incrementada concentración de insulina activa o estimula a ciertos receptores celulares promotores de la proliferación de células de la piel. Algunas drogas como los anticonceptivos orales, linfomas y algunos canceres pueden causar casos de acantosis pigmentaria. Acantosis Nigricans es un marcador clínico de Insulinoresistencia. Es una hiperpigmentación (amarronamiento de la piel), que se presenta en forma de sobre-elevaciones y depresiones. Típicamente se puede encontrar en dorso de cuello, axilas, pliegues inguinales, nudillos, codos. 93 94 Harrison Tratado de Medicina interna 17ª Ed. VOLII pág. 2282 Aaron S. Katz, et al. Acantosis nigricans en pacientes obesos: formas de presentación e implicaciones para la prevención de la enfermedad vascular aterosclerótica. Dermatology Online Journal. Volume 6, Number 1 85 Gráfico Nº 2: Acantosis Nigricans en Axila y en Cuello 2.3.2. Tipos: I: Hereditaria - benigna II: Benigna - asociada a la enfermedad endocrina o La insulina-resistencia asociada a trastornos genéticos como la enfermedad de ovario poliquístico, lipodistrofias, diabetes mellitus tipo 2, aproximadamente el 15% tienen una anormalidad endocrina III: Pseudo - complicación de la obesidad (aumento rápido de peso) 86 IV: Inducida por medicamentos - anticonceptivos orales, ácido nicotínico, los corticosteroides, la insulina subcutánea, la testosterona, dietilestilbestrol, triazinate (un antagonista del ácido fólico con actividad antitumoral) y el ácido fusídico tópico (Fucidin, utilizado para las infecciones cutáneas bacterianas gram-positivas) V: malignos - generalmente un adenocarcinoma gástrico, también se observa con neoplasias endocrinas y de pulmón, linfoma, melanoma, sarcomas y cáncer del tracto genitourinario, visto con mayor frecuencia en pacientes no obesos con aparición súbita, la participación progresiva severa o rápidamente en membranas mucosas o de la palma95. Se estudio en Texas en 102.733 niños de 8 a 15 años la prevalencia fue de 14,4%,96,97 se encontró el 21,7% de prevalencia entre los niños nativos americanos de entre 5 a 18 años98, encontrándose en: 2 (0,5%) de 440 niños blancos no hispanos 19 (5,5%) de 343 niños hispanos 95 Kobaissi HA, Weigensberg MJ, Relation between acanthosis nigricans and insulin sensitivity in overweight Hispanic children at risk for type 2 diabetes. Diabetes Care. 2004 Jun; 27(6):1412-6. 96 Williams RL, Rhyne R Acanthosis Nigricans: high prevalence and association with diabetes in a practice-based research network consortiuma PRImary care Multi-Ethnic network (PRIME Net) study. J Am Board Fam Med. 2010 Jul-Aug; 23(4):476-85. 97 Ice CL, Murphy E, Minor VE, Metabolic syndrome in fifth grade children with acanthosis nigricans: results from the CARDIAC project. World J. Pediatr. 2009 Feb; 5(1):23-30. Epub 2009 Jan 27. 98 Mork NJ, Rajka G, Halse J. Treatment of acanthosis nigricans with etretinate (Tigason) in a patient with Lawrence-Seip syndrome (generalized lipodystrophy). Acta Derm Venereol. 1986; 66(2):173-4. 87 80 (13,3%) de 601 niños Negro El 47% de los participantes tenían AN e hiperinsulinemia, la prevalencia de esta afección aumenta con la edad, el aumento de grado de herencia indígena, el sexo femenino, el sobrepeso con obesidad, la diabetes tipo 2, e historia familiar de diabetes tipo 2, en pacientes recién diagnosticados con diabetes tipo 2 se encontró el 36% de prevalencia y esta aumenta con la obesidad hasta 54% en pacientes con índice de masa corporal de 30 kg/m2 o superior (53% en afro-americanos y el 36% en pacientes de América Latina)99,100,101. El Metabolismo anormal de la glucosa, síndrome metabólico y la hipertensión arterial están asociados con acantosis nigricans en niños hasta en un 49%102. 2.3.3. Enfermedades Asociadas al AN La AN se encuentra asociada con: El síndrome de ovario poliquístico (síndrome de Stein-Leventhal) Acromegalia 99 Eberting CL, Javor E, Insulin resistance, acanthosis nigricans and hypertriglyceridemia. J. Am Acad Dermatol. 2005 Feb; 52(2):341-4. 100 Elizabeth A. Leonard, LT, Anthony J. Viera, LCDR, MC, USN Naval Hospital Jacksonville, Velvety Axillary Lesions, Physician 2004 15 de enero, 69 (2): 373. 101 Gibson LE. Acanthosis nigricans. Mayo Clin Proc. 2004 Dec; 79(12):1571. 102 Stoddart ML, Blevins KS, Lee ET, Association of acanthosis nigricans with hyperinsulinemia compared with other selected risk factors for type 2 diabetes in Cherokee Indians: the Cherokee Diabetes Study. Diabetes Care. 2002 Jun;25(6):100914 88 Insuficiencia adrenocortical Enfermedad de Cushing Pinealoma o hiperplasia pineal (síndrome de Rabson-Mendenhall) Adenocarcinoma gástrico en un 55,5%, 17,7% de otros tipos de cáncer intra-abdominal y 26.8% eran cánceres de otros sitios como pulmón, mama, útero, etc103. Trastorno genéticos como el síndrome de Alstrom, ataxia telangiectasia , síndrome de Bloom , el síndrome de Capozucca, la enfermedad de Crouzon, síndrome de Lawrence-Seip, leprechaunismo, el síndrome de Prader-Willi , el síndrome de RabsonMendenhall, el síndrome de Rud, el síndrome de hipertrofia acral, lipodistrofia generalizada congénita104 y calambres musculares Seip-síndrome de Lawrence es la lipodistrofia generalizada con hipertrofia muscular, pérdida de grasa subcutánea, hiperlipidemia, diabetes mellitus y la acantosis nigricans105. Fármacos como corticosteroides, Anticonceptivos la insulina 103 orales, ácido subcutánea, la nicotínico, los testosterona, Zimmet P, Alberti G, Kaufman F, The metabolic syndrome in children and adolescents. Lancet. 2007 Jun 23; 369(9579):2059-61. 104 Jonsson A, Franks PW, Obesity, FTO gene variant, and energy intake in children, N Engl J Med. 2009 Apr 9;360(15):1571-2; author reply 1572. 105 Reinehr T, de Sousa G, Comparison of metabolic syndrome prevalence using eight different definitions: a critical approach. Arch Dis Child. 2007 Dec; 92(12):1067-72. Epub 2007 Feb 14. 89 dietilestilbestrol, triazinate (un antagonista del ácido fólico con actividad antitumoral), ácido fusídico tópico. 2.3.4. Diagnóstico diferencial Hiperpigmentación de la inflamación de extensión superficial del melanoma. Manchas en la piel Falta de higiene Tiña versicolor Paraqueratosis granular Micosis fungoide 2.4. Niños y Adolecentes 2.4.1. Definición Niño o niña es la persona que no ha cumplido doce años de edad. Adolescente es la persona de ambos sexos entre doce y dieciocho años de edad. La OMS toma los adolescentes entre 10 a 19 años. Es menester estudiar los inicios de la alimentación de nuestros pacientes para entender la fisiopatología y problemática de nuestro estudio, a si como las razones por las que escogimos a este grupo etario. 90 2.4.2. Niñez El recién nacido y del lactante presenta unas características peculiares sobre la alimentación que tendrá en la adultez, ya que debe en sus inicios debe cubrir las necesidades metabólicas para un correcto crecimiento y debe servir para la maduración de órganos vitales, como son el cerebro, riñones, hígado, etc. Cuando sea imposible la lactancia materna habrá que recurrir a la alimentación con leches artificiales, fórmula de inicio hasta el 4º a 6º mes y fórmula de continuación a partir del 4º a 6º mes hasta los 2 a 3 años, lo cual le da cierta protección al menor al no consumir una dieta con exceso de carbohidratos y lípidos. (Anexo complicaciones obesidad infantil) En este sentido, las estrategias de cribado y detección de niños de riesgo por sus antecedentes familiares, así como el establecimiento de recomendaciones nutricionales se están estableciendo a partir de los 2 ó 3 años de edad. Incluso el acto de la comida debe ser utilizado durante esta etapa de la vida como un medio educativo para la adquisición de hábitos alimentarios que repercutirán en el comportamiento nutricional del futuro adulto. El desarrollo es la conjunción del crecimiento y de la maduración. Transcurridos los 2 primeros años de la vida del niño correspondientes al período de crecimiento acelerado, se pasa a la etapa de crecimiento estable 91 correspondiente a las edades preescolar (3 a 5 años) y escolar (desde los 6 años al comienzo de la pubertad) que son el objetivo de nuestro estudio debido a la exposición de factores como el nutricional para el desarrollo del exceso de peso. El crecimiento longitudinal en el preescolar es de 6 a 8 cm/año y el incremento ponderal de 2 a 3 kg anuales. En el escolar se retarda más el crecimiento longitudinal (5 a 6 cm/año) y la ganancia de peso es de 3 a 3,5 kg/año, por lo que se denota una mayor ganancia de peso que de talla a esta edad. Paralelamente continúa la maduración de órganos y sistemas. El desarrollo psicológico en los preescolares incluye la incorporación paulatina de habilidades motoras y del lenguaje; más tarde, durante la época escolar, maduran habilidades como la lectura, escritura, operaciones matemáticas y adquisición progresiva de conocimientos, que en generaciones actuales los lleva a sedentarismo. 2.4.3. Adolescencia La adolescencia es la edad que sucede a la niñez y que transcurre desde la pubertad hasta el desarrollo completo del organismo. La pubertad es el proceso de maduración del eje hipotálamo, hipofisario y gonadal que da lugar al crecimiento y desarrollo de los órganos genitales y, concomitantemente a cambios físicos y psicológicos hacia la vida adulta que conducen a la capacidad de reproducción, que según nuestra constitución, 92 adolescente es la persona de ambos sexos entre doce y dieciocho años de edad. 2.4.3.1. Etimología El término adolescencia procede del vocablo latino adolescere, que significa cambio. Los acontecimientos que caracterizan a la pubertad son: adrenarquía o aparición de vello sexual y axilar; telarquía o desarrollo mamario y menarquía o aparición de la menstruación (eyaculación en los niños). Los cambios que se producen durante la pubertad o adolescencia afectan básicamente al fenotipo, al sistema neuroendocrinológico y a la esfera psicosocial. Desde el punto de vista de la nutrición y alimentación, conviene recordar los primeros y tener en cuenta los últimos como componentes del comportamiento alimentario. La obesidad nutricional, ligada a un balance energético positivo, por consumo de dietas hipercalóricas y una disminución progresiva de la actividad física, se presenta en una proporción importante en los adolescentes. La obesidad constituye a cualquier edad un problema sanitario de primer orden. Su desarrollo durante la adolescencia incluye, además de los aspectos comunes a esta situación, un impacto negativo en el desarrollo psicosocial. 2.4.4. Niños y Adolescentes de 2 a 17 años En resumen, el desarrollo es la conjunción del crecimiento y de la maduración. Transcurridos los 2 primeros años de la vida del niño 93 correspondiente al período de crecimiento acelerado, se pasa a la etapa de crecimiento estable correspondiente a las edades preescolares (3 a 5 años) y escolar (desde los 6 años al comienzo de la pubertad). El crecimiento longitudinal en el preescolar es de 6 a 8 cm/año y el incremento ponderal de 2 a 3 kg anuales. En el escolar se retarda más el crecimiento longitudinal (5 a 6 cm/año) y la ganancia de peso es de 3 a 3,5 kg/año. Paralelamente continúa la maduración de órganos y sistemas. Biológicamente la deceleración del crecimiento condiciona un cambio sustancial desde el punto de vista nutricional al disminuir las necesidades energéticas y de nutrientes específicos en relación al tamaño corporal al no ser así aparece el sobrepeso y obesidad por el incremento de tejido adiposo el mismo es considerado como un órgano fundamental en la regulación energética, dotado de acciones locales (autocrinas y paracrinas) y a distancia en el cerebro, músculo, páncreas e hígado (endocrinas como al mantener glucemias altas se auto regula con hiperinsulinismo)106. Anexo (algoritmo diagnóstico de la obesidad) gráfico 7 106 Federico Argüelles M., Gustavo Silva G., Tratamiento en Gastroenterología, Hepatología y Nutrición Pediátrica, 2008 Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica, ISBN: 978-84-8473-680-6 Pg: 603-668. 94 CAPITULO III MÉTODOS 3.1. Diseño del Estudio La presente investigación es un estudio transversal, descriptivo en un período de 17 meses considerando una prevalencia del 2.17% de pacientes pediátricos con IMC superior al p85, indicando un posible subregistro ya que la prevalencia en estudios nacionales llegan hasta el 8%. 3.2. Definición de la Población sujeto de estudio La población objetivo de la investigación va a ser todos los pacientes atendidos de la Consulta Externa de Pediatría del HEG desde los 2 a los 17 años de edad durante el período: Febrero del 2010 a julio del 2011 considerando de ambos géneros. El universo de pacientes pediátricos atendidos en este período fue de 3870, de los cuales con IMC mayor al p85 correspondieron a 84 casos. De estos, aquellos que cumplieron criterios para ingresar al estudio fueron de 42. En el estudio emplearemos múltiples variables, dentro de las cuales por su revisión científica, técnica y epidemiológica son de interés para realizar la presente investigación como son: La IR (indicado por el método indirecto HOMA) y AN asociadas al exceso de peso: Obesidad (IMC mayor al p95) y sobrepeso (IMC mayor al p85), definiendo IMC a la relación de peso en Kg con la talla al cuadrado. Que se sustenta en la distribución corporal del 95 exceso de grasa en los pacientes de 2 a 17 años. Se escogió este grupo de edad por las tablas de IMC del CDC (Center for Diseases Control) que utilizamos para definir a los pacientes en sobrepeso u obesidad. La valoración de la IR se calculó usando la fórmula HOMA (insulina ayuno (mUI/dl)/18 * glicemia ayuno (mmol /l)/22.5) y de la AN con una exploración física durante la consulta médica y reportada en la historia clínica. Los pacientes se ubicaron previa autorización del estudio por parte de las autoridades del hospital, así como, de los líderes de docencia y estadística para la recolección de datos, los mismos que se obtuvieron mediante una hoja de registro en las historias clínicas (HCl). A estas variables se sumaron otras como: sexo y edad (escolares y adolescentes), datos de laboratorio como glucosa, colesterol, triglicéridos, HDL, cuyos datos fueron procesados en el programa informático SPSS 19; y además analizamos otros datos como antecedentes familiares y trastornos asociados. 3.3. Selección Marco y Diseño Muestral El tamaño de la muestra se calculó con 32 pacientes, sin embargo, ampliamos la muestra porque se cumplía con criterios de inclusión. Se hizo mediante un muestreo probabilístico causal ya que se juzgó de antemano estratos definidos por algunas variables de distribución con un conocimiento profundo del tema bajo estudio, excluyendo a los pacientes con sindrome 96 metabólico, usando la prevalencia demostrada en el HEG del 2.17% en el grupo de edad de 2 a 17 años. pqz2 n 2 e Reemplazando: n= 0,0217*0,9783* (1,96)2/0,052 n= 32 pacientes. z= 1,96 para el 95% de confianza, 2,56 para el 99% p= Frecuencia esperada del factor a estudiar q= 1- p e= Precisión o error admitido Los pacientes tomados en cuenta serán los que presenten un IMC superior al percentil 85 de las curvas del CDC. a. Criterios de inclusión: Pacientes entre 2 a 17 años. Pacientes que hayan acudido a la Consulta Externa de Pediatría del HEG y que cumplan con los rangos y variables determinados. Pacientes que presenten un IMC con percentil mayor a 85 según la curva del CDC Pacientes que cumplan los criterios para estar dentro de la clasificación de AN tipo II y III. b. Criterios de exclusión: 97 Pacientes que no cumplan con los rangos de edad establecidos. Que presenten alguna patología o discapacidad que limite la aplicación de las técnicas de peso y talla estandarizadas. Pacientes que se incluyan dentro de los tipos de AN (I, IV y V). Que no se encuentre en la historia clínica los exámenes necesarios para el estudio. Pacientes con diabetes y Sindrome Metabólico. El análisis de estas variables se hace y se presenta con base en los siguientes parámetros: Cuadro Nº 3: Tabla de Operacionalización de las Variables del Estudio Variables Definición Categoría Indicador Indicador estadístico Hiperpigmentación Acantosis nigricans de pliegues Si cutáneos. Dermatosis No Número de pacientes Número y con y sin AN Porcentaje benigna 2 a 9 años Número de años y meses cumplidos Edad 10 a 17 años Niños Mediana, a la fecha de aplicación del Media, Adolescentes estudio. Cálculo a partir de fecha de nacimiento. Instrumento: encuesta 98 moda Porcentaje, Es una masa Peso Número de casos sometida a la Normal aceleración Mayor percentil 90 valores mayores al percentil 90. gravitacional normales y con Estatura de una persona Porcentaje Número de casos Normal Talla Número y Mayor percentil 90 Talla Baja < p3 normales y con Número y valores mayores al Porcentaje percentil 90. Normal: (de P 6 a IMC Es una medida de Índice de asociación entre Masa peso y talla de un Corporal individuo. 84) Sobrepeso: (IMC) = Peso (en (> P 85-95) Obesidad:(> P 95) Kg) dividido por la Número y porcentaje Altura (en metros) al cuadrado. Masculino Genero Género al que pertenece Medición sérica en Glucosa Ayunas Número y Número de casos Normal ayunas por el método glucosa oxidasa porcentaje Femenino normales y con Anormal, > 100 mg/dl Número, porcentaje, valores mayores a Media y 100 mg/dl Mediana Número de casos Número , Medición sérica de insulina luego de Normal: Insulina 12 h de ayuno por 5 – 15 mU/ml normales y con Ayunas el método de Mayor a: valores mayores a 15 radio inmuno 15 mU/ml ensayo. 99 mU/ml Frecuencia Media, Mediana Homeostasis Model Assessment, Cociente de HOMA IR Normal niños: < 3.1 Anormal niños: Igual o mayor 3.1. Número de casos Normal normales y número de glucosa en ayunas(mg/dl)/18 por cociente de adolescentes: < 2.5 casos anormales. insulina en Anormal: igual o ayunas(mU/L)/ mayor 2.5 Frecuencia, Porcentaje, Media y Mediana 22.5 HDL Colesterol unido a proteínas de alta densidad Deseable 45 mg/dl Número de casos No deseable menor a 40mg/dl. Triglicéri- Compuesto Normal: < al dos formado por un percentil 95 ácido graso y normales y con Frecuencia, porcentaje, valores mayores a 40 Media y mg/dl Mediana 2-4 años: mg/dl. glicerol, son principales lípidos de la sangre. Hombres: > 99 Mujeres: >112 5-9 años: Número de casos Frecuencia, Hombres: > 85 normales y con Porcentaje, mg/dl. valores mayores a media y Mujeres: >126 > 110 mg/dl. Mediana 10-14 años: Hombres: > 111 Mujeres: > 120 15-17 años: Hombres: > 143 100 Mujeres: > 126 Anormal mayor al percentil 95 de las cifras anteriores. Colesterol Alcohol asteroideo Deseable <170 cristalino liposoluble presente en mg/dl Límite entre 171 a 199 mg/dl Número de casos Número, normales y con porcentaje, valores mayores a Media y 200 mg/dl Mediana aceites y grasas animales. Alto > 200 mg/dl Fuente: Autores Realizado por: Autores Nota: en este estudio no se tomará en cuenta la variable C-C (cintura cadera) ya que los parámetros de edades infantojuveniles no están estandarizados por el MSP y también no hay registros de este detalle en la historia clínica única del Hospital Dr. Enrique Garcés. Los criterios se tomaron fueron el rango de edad por los percentiles que nos muestra la curva del CDC y a la disponibilidad de datos en el registro de la historia clínica. Y obviamente que presenten las características cutáneas de la AN. 3.4. Recolección de Datos Los datos se recogieron mediante la historia clínica de cada paciente de la muestra utilizando el formulario de registro hecho por los autores y que consta en el anexo 1. 101 3.5. Protocolo de estudio: Si se aplicó el formulario (hoja de recolección de datos) indicado en el anexo 1. Los datos de filiación y examen físico fueron aquellas registradas por el médico tratante en la historia clínica; y los datos de laboratorio en su totalidad fueron aquellos tomados de las hojas de registro del instituto Ecuatoriano de Metabolismo y Reproducción (IEMYR) que cumple con certificación ISO. 3.6 Análisis Estadístico: El análisis estadístico de este estudio es univariado ya que utilizamos elementos estadísticos básicos como frecuencia y distribución. Contamos con dos elementos bivariados por si solos que son el IMC (peso y talla) y el índice HOMA (glucosa e insulina) que nos ayudan en el análisis. El cálculo fue acompañado por un nivel de confianza del 95% en el cálculo muestral con u error de precisión del 0,05%. 102 CAPITULO IV RESULTADOS Se hizo el estudio en 42 pacientes en niños por la prevalencia demostrada en la consulta de Pediatría del 2.17% de pacientes que tenían su IMC mayor al percentil 85 (sea referido como obeso o sobrepeso). Según datos del departamento de Estadística del HEG el total de pacientes fue de 36512, de los cuales los pediátricos atendidos en Consulta Externa durante el año 2010 son de 3.870 niños correspondientes al 10,6%. Se encontró dentro del grupo pediátrico 84 pacientes que fueron catalogados como: Obesidad, sobrepeso. El cálculo muestral realizado estimó que el número de pacientes a estudio eran en número de 32 utilizando la fórmula de prevalencia con población conocida como se detalló anteriormente en métodos, sin embargo de los 84 casos, 42 cumplían criterios de inclusión. 103 Gráfico No. 3. Total de Pacientes Atendidos en Consulta Externa de Pediatría vs. Pacientes con IMC mayor al p85 del HEG en el Año 2010 | Fuente: Estadística del HEG Realizado por: Autores El grupo de edad con mayor porcentaje de sobrepeso y obesidad fue de 10 a 14 años con 42 casos que corresponde al 51%, el que le sigue es el grupo de 5 a 9 años con 36 casos, correspondiéndole el 43% y con 6 casos el grupo de 2 a 4 años con el 6% y no se han registrado casos para el grupo de 15 a 17 años. 104 Gráfico No. 4: Pacientes Pediátricos con IMC mayor al p85 por Edad en el HEG Fuente: Estadística del HEG Realizado por: Autores Podemos indicar que los hombres tienen mayor número con 51 casos al que le corresponde el 61% y luego están las mujeres con 32 casos que le corresponde el 39%. 105 Gráfico No. 5: Pacientes Pediátricos con IMC mayor al p85 por género en el HEG Fuente: Estadística del HEG Realizado por: Autores Los datos mencionados en el grafico son del total de niños (84 pacientes del período de recolección demuestra con índice de masa corporal >p85 pero no todos cumplen con criterios de inclusión) y de estos fueron tomados para el estudio 42 pacientes, correspondientes 21 casos para cada rango de edad (Niños de 2-9 años y adolescentes de 10 a 17 años), siendo el 50%. El mínimo de edad fue de 2 años y el máximo de 14 años según la distribución de la edad, la mediana fue de 9,4 años; moda y mediana de 10 años y una desviación estándar de 2,45, lo cual es visualizado en el siguiente grafico. 106 Gráfico Nº 6: Porcentaje de pacientes niños (2-9 años) y pacientes adolescentes (10-17 años) Fuente: Estadística del HEG Realizado por: Autores El grupo de pacientes con problema de sobrepeso y obesidad para el sexo masculino fue en número de 27 correspondiendo al 64.3%; y para el sexo femenino en número de 15 pacientes correspondiendo al 37.3%, como está ilustrado a continuación: 107 Gráfico Nº 7: Distribución de pacientes por genero. Fuente: Estadística del HEG Realizado por: Autores En lo correspondiente al peso ubicamos a aquellos pacientes entre el percentil 5 al 95 en número de 19 correspondiendo al 45.2% de la muestra y los pacientes con percentil sobre 95 en número de 23 correspondiendo al 54.8%, como se ilustra a continuación: 108 Gráfico Nº 8: Distribución de pacientes por rangos de percentil Fuente: Estadística del HEG Realizado por: Autores En lo referente a la talla los pacientes por debajo del percentil 5 encontramos 6 pacientes correspondiente al 14.3%; entre el percentil 5 al 95 hubo 34 pacientes correspondiente al 81% y sobre el percentil 95 sólo 2 pacientes correspondiente al 4.8%. Se ilustra a continuación: 109 Gráfico Nº 9: Distribución de ptes por rango de percentil en talla Fuente: Estadística del HEG Realizado por: Autores En cuanto al IMC tuvimos 2 grupos: Aquellos entre percentil 85 al 95 con un número de pacientes de 12 correspondiente al 28,6%; y sobre el percentil 95 con 30 pacientes correspondiente al 71.4%. Se ilustra a continuación: 110 Gráfico Nº 10: Distribución de pacientes por percentil de IMC Fuente: Estadística del HEG Realizado por: Autores La prevalencia de AN encontrada en este estudio fue de 31 pacientes lo que corresponde al 74%. El grupo predominante de AN fue adolescentes varones con el 26% (11 casos), le sigue los niños con el 21% (9 casos), adolescentes femenino con 14% (6 casos), y niñas con el 11% (5 casos). En total el grupo de adolescentes presentó AN en un 52%, mientras que en el grupo de niños 48%. Por género: El grupo masculino presento un 64 % (27 casos) y el grupo femenino 36% (15 casos). 111 Gráfico Nº 11: Distribución de pacientes con presencia y ausencia de AN Fuente: Estadística del HEG Realizado por: Autores Gráfico Nº 12: Distribución de pacientes con AN en genero y edad. Fuente: Estadística del HEG Realizado por: Autores 112 La glicemia fue registrada en 42 pacientes con una media de 83,2 mg/dL, mediana de 82,5 mg/dL, moda menor de 71 mg/dL, un valor mínimo de 71 y un máximo de 101 mg/dL y una desviación estándar de 7,9, cabe recordar que todos nuestros pacientes mantuvieron normo glucemias. Gráfico Nº 13: Distribución de pacientes con respecto a la Glucemia. Fuente: Estadística del HEG Realizado por: Autores Se encontró igual número de pacientes con hiperinsulinismo y valores anormales de HOMA: 19 casos, Correspondiendo una prevalencia de IR (definido por HOMA) e hiperinsulinismo del 45,2%. 113 Detallado en porcentajes: En adolescentes varones: 38%, adolescentes mujeres: 23.8%, niños: 23.8% y niñas: 14.2%. Ilustrado a continuación: Gráfico Nº 14: Distribución de casos con valores de HOMA normal y anormal Fuente: Estadística del HEG Realizado por: Autores Se tomó los resultados de HOMA en 2 grupos: En niños (2-9 años) se obtuvo una media de 3,44; mediana 1,79; moda menor 1,3; desvío estándar de 3,36; un valor mínimo de 0,3 y un valor máximo 13,2. En el grupo HOMA adolescentes (10-17 años) se obtuvo una media de 3,17; mediana de 2,9; moda menor de 1,0; desvío estándar de 1,83; un valor mínimo de 1,0; y un valor máximo de 7,5. 114 Gráfico Nº 15: Distribución de casos con valores de HOMA normal, anormal y edad. Fuente: Estadística del HEG Realizado por: Autores En los valores obtenidos de insulina en ayunas, luego de 121 horas de ayuno fueron: media 15,9; mediana 12,6; moda 19,3; desvío estándar de 12,26; un valor mínimo de 1,9; y un valor máximo de 59,4, Tomando como normal valores de 5-15 mU/ml. 115 Gráfico Nº 16: Distribución de casos con valores de insulina normal y anormal Fuente: Estadística del HEG Realizado por: Autores La dislipidemia (refiriéndose a valores alterados de colesterol, triglicéridos y HDL) encontrada en la muestra estuvo en promedio de 46.43%. Detallado de la siguiente manera: HDL anormal con 25 pacientes correspondiente al 59.5%; Triglicéridos anormal con 23 pacientes correspondiente al 54.8%; y Colesterol anormal con 25 pacientes correspondiente al 59.5%. Cuadro Nº 5: Distribución de dislipidemia. LIPIDOS VALORES PACIENTES % HDL 25 59.5 TGC 23 54.8 COLESTEROL 25 59.5 ANORMALES Fuente: Estadística del HEG Realizado por: Autores 116 Gráfico Nº 17: Distribución de casos con valores anormal y normal de HDL Fuente: Estadística del HEG Realizado por: Autores En la recolección de HDL se obtuvo 33 casos válidos y 9 perdidos, tomando como anormalidad < a 45 mg, en el 25% de casos, con una media de 45, mediana 43, moda menor 39, desvío estándar 11,96; valor mínimo 23 y máximo 88. Gráfico Nº 18: Distribución de casos con valores normal y anormal de TGC Fuente: Estadística del HEG Realizado por: Autores 117 En la recolección de datos de TGC se obtuvo 35 casos válidos, 7 perdidos, se presento el 59.5 % de casos con anormalidad siendo este el más alto con relación al colesterol, con una media de 134, mediana 117, moda menor de 142, desvío estándar 72,5; valor mínimo 41 y máximo 385 mg/dL. Gráfico Nº 19: Distribución de casos con valores normal y anormal de colesterol Fuente: Estadística del HEG Realizado por: Autores En los datos de recolección de colesterol se obtuvo 36 casos válidos y 6 perdidos, presentándose el 54.8 % de anormalidad, con una media de 182, mediana 173, moda menor 140, desvío estándar de 37,4; valor mínimo de 123 y máximo de 290 mg/dL. Se encontraron trastornos asociados en los pacientes de la muestra de diverso tipo entre osteomusculares, endocrinológicos y cutáneos con un 118 rango de presencia entre 2 al 12%. En el siguiente cuadro detallamos el número y el porcentaje: Cuadro Nº 4: Distribución de casos por trastornos Físicos asociados TRASTORNOS NÚMERO DE PACIENTES % 3 7% Pie Plano 3 7% Lordosis Lumbar 2 5% Cifosis Cervical 2 5% Ginecomastia 2 5% Pezón Invertido 5 12 % Hirsutismo 1 2% Micropene 1 2% Pene Empotrado 3 7% Adenomas Sebáceos 3 7% Problemas Osteoarticulares Escoliosis Fuente: Estadística del HEG Realizado por: Autores También encontramos antecedentes en los familiares de los pacientes como diabetes mellitus tipo II en número de 5 correspondiente al 12%; HTA en 11 pacientes correspondiente al 26%; Hipotiroidismo en 2 pacientes correspondiente al 5% y; Dislipidemia en 5 pacientes correspondiendo al 12%. Lo detallamos en el siguiente cuadro: 119 Cuadro Nº 6: Distribución de casos asociados a antecedentes familiares de DM II, HTA, hipotiroidismo e hiperlipidemia. Antecedentes Familiares NUMERO DE PACIENTES % Diabetes tipo II 5 12 % HTA 11 26 % Hipotiroidismo 2 5% Dislipidemia 5 12 % TRASTORNOS Fuente: Estadística del HEG Realizado por: Autores Como apoyo a este estudio se incluye datos de una de las patologías como consecuencia del sobrepeso, obesidad y/o sindrome metabólico, presente en el adulto mayor: Se encontró 493 casos de diabetes mellitus tipo II que corresponde al 1,35%; los cuales se detallan a continuación por edad y sexo: 120 Gráfico Nº 20: Total de Pacientes Atendidos en Consulta Externa en el HEG en el Año 2010 vs. Pacientes Diagnosticados con Diabetes en el 2010 Fuente: Estadística del HEG Realizado por: Autores La edad con mayor incidencia de diabetes es de mayores de 60 años con 385 casos que corresponde al 78%, le sigue la etapa de 41 a 60 años con 100 casos que corresponde al 20%, con un mínimo pero muy preocupante 2% en grupos de 19 a 40 años con 5 casos y de 1 a 18 años con 3 casos. 121 Gráfico Nº 21: Pacientes con Diabetes de Consulta Externa por Edad en el HEG del año 2010 Fuente: Estadística del HEG Realizado por: Autores Las mujeres son las que presentan mayor incidencia de diabetes con 374 casos que corresponde al 76%, luego siguen los varones con 119 casos que corresponde al 24%. 122 Gráfico Nº 22: Pacientes con Diabetes de Consulta Externa por Sexo en el HEG del año 2010 Fuente: Estadística del HEG Realizado por: Autores 123 CAPITULO V DISCUSIÓN La prevalencia de niños y adolecentes obtenida en el HEG con IMC mayor al percentil 85 es del 2.17%, algo contradictorio con los datos reportados de estudios nacionales como de Meprade de 1994 indican 12 a 15% en mujeres y 8 a 10% en varones, y la prevalencia global de la OMS en el 2010 fue de 8.9%. En el estudio de prevalencia de obesidad en América latina del 2002 en donde se toma entre algunos países a Ecuador Pasquel reporta una prevalencia del 3 al 22% con predominio masculino en pacientes con riesgo de obesidad y sobrepeso, igual que nuestro estudio. Un posible sub-registro pudo presentarse en la prevalencia de 2.17% ya que en la organización de datos diagnósticos por parte del departamento de estadística del HEG, se considera un solo diagnóstico inicial al paciente obeso o con riesgo que generalmente acude por otra dolencia, sobre todo cuando acude por primera vez. No se encuentran reportes de prevalencia de IR y AN en el hospital y eso es lo que se presentará más adelante según este estudio. El número de pacientes que se distribuyó como niños (entre 2 a 9 años) y el grupo de adolescentes de 10 a 17 años fue del 50% para cada uno, con predominio en nuestra muestra del sexo masculino (64,3%), a diferencia de lo detallado en el estudio MEPRADE, en donde el predominio es femenino. En cuanto al peso como lo detallamos en la variable tenemos el 45,2 % entre 124 percentil 5 al percentil 95 y un 54.8% por encima del percentil 95, siendo predominante el grupo que presenta algún grado de obesidad, igualmente determinado por el bajo registro del diagnóstico de sobrepeso en la historia clínica. En cuanto a talla el 14.3% se ubica por debajo del percentil 5, pacientes en quienes se sospecha de una obesidad endógena ya que su peso está dentro de percentiles adecuados dando un IMC sobre percentil 85. El 81% entre el percentil 5 y el percentil 95 que están dentro de la normalidad y sobre el percentil 95 el 4,8%. El IMC que fue el parámetro que se tomó en cuenta en este estudio revelando a 2 grupos: Entre percentil 85 al percentil 95 un 28,6% y sobre el percentil 95 un 71,4%. Hay que tomar en cuenta que estos datos son sacados de una población cautiva de niños con problema de peso (IMC sobre 85) y no de una población general, por lo que no es comparable. Y se ve claramente los resultados del NHAHES III (National Health an Nutrition Examination surveys) en donde se reporta el 14% en pacientes con IMC entre 85 y 95; y el 11% con IMC mayor al percentil 95. El porcentaje de AN obtenida en este estudio fue del 74% frente a un 26% que no lo presentaba. En comparación con el estudio de Stoddart y cols (Diabetes Care 2002) con la más grande muestra de este tipo, había presencia de AN hasta un 54% en pacientes obesos y asociados a otras anormalidades como HTA, DM2 llegaba a un 49%. El presente estudio similar a la anterior, muestra una mayor prevalencia en adolescentes 125 varones, corroborando en parte la insulinosensibilidad en este grupo etáreo. La AN tuvo mayor presencia en los adolescentes con un 52% similar a la litetarura de Stoddart y Cols. En referencia a la IR el estudio de S Shalitin publicado en 2005 por la International Journal of Obesity concluía que se presentaba en un 81.2% frente al 45.2% de nuestro estudio en pacientes con percentil mayor de 85. Se obtuvo una media de HOMA en niños de 3,44 y en adolescentes 3,17 tomando en cuenta que son niños con obesidad y sobrepeso, este valor se acerca al valor referido en Pediatrics del 2005 (estudio HOMA) universal para los dos grupos. Hay que anotar que la frecuencia de los valores HOMA para considerar IR son directamente proporcionales en nuestra muestra a los pacientes que presentan hiperinsulinismo (referido con valores mayores a 15 mUI/ml). En dislipidemia tomando en cuenta colesterol, triglicéridos (TGC) y HDL las frecuencias encontradas en este estudio se acercan en promedio al 58%, similar a los estudios anteriores mencionados. Hay que tomar en cuenta que los valores obtenidos tienen limitaciones en la obtención de datos al registro de la historia clínica y la falta de una mejor anamnesis. Se podría para completar de mejor manera los datos realizar una anamnesis dirigida en el niño y/o adolescente con sobrepeso u obesidad. Al analizar las historia clínicas encontramos como antecedentes personales a las afecciones respiratorias en un 19 % dentro de estos encontramos 126 (asma en 2 pacientes, neumonías en 3 pacientes y sinusitis en 3 pacientes), trastornos alérgicos (atopia y rinitis en un 19 %). El retraso psicomotor y trastornos de aprendizaje se presentaron en un 12 % de este porcentaje 1 paciente tenia hipoacusia. Dentro de problemas sindrómicos encontramos Síndrome Down y Prader Willi en 2 pacientes, hipotiroidismo en un 14% y en su totalidad se encontraban en tratamiento con levo-tiroxina, este grupo suma un 19 % de casos que serán catalogados dentro de una obesidad endógena. En 5 pacientes fueron peso bajo al nacer, 1 paciente con macrosomia neonatal, La obesidad se asocia con trastornos físicos y en este estudio no fue la excepción, encontramos esta realidad en el 60 % de los casos, mostrando la obesidad como un cofactor, predominando el pezón invertido (12%), pie plano (5%) y las deformaciones de columna vertebral (15%). Dentro de los antecedentes de familiares encontramos que el 38 % de familiares fueron de primer grado, predominando la HTA (26%), diabetes mellitus tipo 2 y dislipidemia (12%), demostrando importante asociación Como futuras patologías de comorbilidad de obesidad e IR. 127 CAPITULO VI CONCLUSIONES La prevalencia de sobrepeso y obesidad de este estudio es del (2.17%), está en el rango más bajo del estudio de Pasquel que va del 3 al 21%. La AN en este estudio es mayor que los demostrados por el Diabetes Care del 2002 (Con la más grande muestra) con un 74% versus al 54% del mencionado. Hay una diferencia significativa al valor dado por el estudio de Stoddar (con la muestra más grande) en cuando a IR del 81.2% frente al 45.2% de este estudio. Puedo haber sido porque se hizo la diferenciación del valor del HOMA en niños y adolescentes con 3.1 y 2.5 respectivamente. Los valores en cuanto a lípidos oscilan alrededor del 54%, siendo similar a los estudios anteriores y al NHANES. El estudio señala relación entre Obesidad, AN e IR. La mayor parte de los pacientes con obesidad y sobrepeso e insulinoresistencia acompañaron de (demostrado alteraciones por en HOMA la alterado) glicemia, no se indicando probablemente un problema submetabólico o prediabético o síndrome metabólico. 128 CAPITULO VII RECOMENDACIONES Actualmente en el país no se tiene datos sobre IR, AN en sobrepeso y obesidad infantil en este rango poblacional debido a la ausencia de registros epidemiológicos nacionales seriados y a las diferencias metodológicas entre los estudios disponibles. Si no comenzamos a poner en la palestra esta problemática de salud, se tendría complicaciones mediatas y futuras de los niños y adolescentes dándonos un alto costo social y de salud al no tratar tempranamente esta problemática transformándose así en una carga social principalmente se vería reflejado por los altos costos en tratamientos, médicos especialistas en el tema, medicación etc. El manejo minucioso bajo un programa nacional de salud es primordial ya que no se cuenta con datos estadísticos, seguimiento y tratamiento de estos niños y adolescentes que al ser el presente y futuro de nuestra patria deben ser atendidos con calidad y calidez de una forma multidisciplinaria. Se realizo de este estudio descriptivo para que sirva de referencia a futuras investigaciones y mejorar las condiciones de salud y vida de esta población. 129 Crear un registro de datos con anamnesis y exploración física dirigidas para el niño con diagnóstico de sobrepeso y obesidad. Concientizar el registro adecuado de las hojas de anamnesis y examen físico de la historia clínica única del ministerio de salud pública. Este fue uno de los obstáculos, ya que muchas veces no había datos completos. Analizar la creación en consulta externa del HEG el Servicio de Clínica de la Obesidad, para mejor el seguimiento y estudio de estos pacientes. Manejo multidisciplinario de los pacientes con obesidad, con los servicios de Endocrinología, Ortopedia y Traumatología, Psicología, Dermatología, Laboratorio, Nutrición, etc., tomando en consideración los múltiples trastornos que presentan estos pacientes. Para futuros estudios y mejoría de la atención en los pacientes con obesidad es pertinente percentilar índice cintura-cadera, y tensión arterial de una mejor manera. El análisis del signo clínico cutáneo AN mediante el examen físico en una primera consulta médica relacionada con el IMC de percentil mayor a 85 y otras alteraciones metabólicas que obligarán a realizar pruebas de escrutinio como: Glucosa e insulina pre y postprandial, colesterol, triglicéridos, lipoproteínas de alta densidad (HDL). A través 130 de estos exámenes se establecerán la IR determinado por el Índice HOMA. La AN es un signo clínico que estaría en relación directa con la hiperinsulinemia y sería un método no invasivo, simple y económico para identificar niños y adolescentes con riesgo de desarrollo de IR. 131 BIBLIOGRAFÍA 1. Pacheco V, Pasquel M. Obesidad en Ecuador: una aproximación epidemiológica. En: Obesidad; un desafío para América Latina. Ed. J. Braguinsky, R. Álvarez Cordero y A. Valenzuela, ANALES, Navarra 2002, vol. 25. 2. De Grijalva Y. Adolescencia y nutrición: Proyecto MEPRADE. Quito: Centro de Investigaciones en Salud y Nutrición; 1994. 3. De la Vega A., Mogrovejo P., Jiménez P., Rivera J., Collahuazo M., Acosta M. Prevalencia de obesidad en la población infanto-juvenil de Quito, Ecuador. Congreso Latinoamericano de Obesidad, Santa Fe de Bogotá, Colombia, agosto de 1996. 4. Pinhas-Hamiel O, Dolan LM y cols. Increased incidence of non insulin dependent diabetes mellitus among adolescents. J Pediatr. 1996; 128: 608-13. 5. Rosenbloom AL, Joe JR, Young RS, Winter WE. Emerging epidemic of type 2 diabetes in youth. Diabetes Care 1999; 22: 345-54. 6. Amiel SA, Sherwin RS, Simonson DC, Lauritano AA, Tamborlane WV. Impaired insulin action in puberty. N Engl. J Med 1986; 315: 215-9. 7. Hoffman RP, Vicini P, Sivitz W, Cobelli C. Pubertal adolescent malefemale differences in insulin sensitivity and glucosa effectiveness determined by the one compartment minimal model. Pediatr. Res 2000; 48: 384-8. 8. Brickman WJ, Binns HJ, Jovanovic BD, Kolesky S, Mancini AJ, Metzger BE; Pediatric Practice Research Group. Acanthosis nigricans: a common finding in owerweight youth. Pediatr Dermatol. 2007; 24: 6016. 9. Williams, B. “Insulin resistance: the shape of things to come”. Lancet 1994; 344:521-524.-53. 132 10. Wajchenberg, B L. “Subcutaneos and Visceral Adipose Tissue: their relationship to the Metabolic Syndrome”. Endocrine Reviews 2000; 21(6):697-738. 11. Derpress, J P. “Abdominal obesity an important component of insulin resistance syndrome”. Nutrition 1999; 9:452-459. 12. Koyama, K: Chen, G; Lee, Y; Unger, R. “Tissue Triglycerides, insulin resistance and insulin production: implications for hiperinsulinemia of obesity”. Am J. Physiol Endrocrinol Metab 1997;273: E708-E713. 13. Kahn B B; Flier, J S. “Obesity and Insulin Resistance”. J Clin Invest 2000;106(4):473-481 14. Stein D, et al. “The Insulinotropic Potency of Fatty Acids Is Influenced Profoundly by Their Chain Length and Degree of Saturation”. J Clin Invest 1997; 100(2):398-403. 15. Nestler, J.E., Usiskin, K.S., Barlascini, C.O., Welty, D.F., Clore, J.N. and Blackard, W.G. Suppression of serum dehydroepiandrosterone sulfate levels by insulin: an evaluation of possible mechanisms. J. Clin. Endocrinol. Metab. 1989; 69: 1040-1046. 16. Mehmet Keskin MD; Selim Kurtoglu, Homeostasis Model Assessment Is More Reliable Than the Fasting Glucose/Insulin Ratio and Quantitative Insulin Sensitivity Check Index for Assessing Insulin Resistance Among Obese Children and Adolescents, Pediatrics Vol. 115 No. 4 April 2005. 17. Portillo Pineda Abraham, Núñez Olivares Ma. Auxilio, Identificación de Acantosis nigricans y su relación con obesidad y resistencia a la insulina en niños y adolescentes en una Unidad de Medicina Familiar en Michoacán, México, Aten Fam 2011; 18(2):31-34. 18. Hermanns-Lé T, Hermanns JF, Piérard GE. Juvenile, Acanthosis Nigricans and Insulin Resistance. Pediatric Dermatology 2002; 19:12-4. 19. Steinberg J, Daniels SR. Obesity, insulin resistance, diabetes, and cardiovascular risk in children. Circulation 2003; 107: 1448-53. 20. Stoddart ML, Blevins KS, Lee ET, Wang W, Blackett PR; Cherokee Diabetes Study. Association of 133 acanthosis nigricans with hyperinsulinemia compared with other selected risk factors for type 2 diabetes in Cherokee Indians: the Cherokee Diabetes Study. Diabetes Care. 2002 Jun; 25(6):1009-14. PubMed PMID: 12032107. 21. Mary Ann Liebert, Inc. Obesidad Infantil, Diciembre de 2010, Volumen 6, DOI:10.1089/chi.2010.0612.gcou 22. Maria Soledad Achor, Néstor Adrián Benítez, OBESIDAD INFANTIL, Revista de Posgrado de la VI Cátedra de Medicina. N° 168 – Abril 2007. 23. Lluís Serra Majema,b, Lourdes Ribas Barbab, Obesidad infantil y juvenil en España, Resultados del Estudio enKid (1998-2000) Med. Clin. (Barc) 2003;121(19):725-32. 24. Nsiah-Kumi PA, Beals J, Lasley S, Whiting M, Brushbreaker C, Erickson J, Qiu F, Yu F, Canaris G, Larsen JL. Body mass index percentile more sensitive than acanthosis nigricans for screening Native American children for diabetes risk. J Natl Med Assoc. 2010 Oct;102(10):944-9. PubMed PMID: 21053710. 25. Litonjua P, Piñero-Piloña A, Aviles-Santa L, Raskin P. Prevalence of acanthosis nigricans in newly-diagnosed type 2 diabetes. Endocr Pract. 2004 Mar-Apr; 10(2):101-6. PubMed PMID: 15256325. 26. Kobaissi HA, Weigensberg MJ, Relation between acanthosis nigricans and insulin sensitivity in overweight Hispanic children at risk for type 2 diabetes. Diabetes Care. 2004 Jun; 27(6):1412-6. 27. Eberting CL, Javor E, Insulin resistance, acanthosis nigricans, and hypertriglyceridemia. J Am Acad Dermatol. 2005 Feb; 52(2):341-4. 28. Williams RL, Rhyne R Acanthosis Nigricans: high prevalence and association with diabetes in a practice-based research network consortium--a PRImary care Multi-Ethnic network (PRIME Net) study. J Am Board Fam. Med. 2010 Jul-Aug; 23(4):476-85. 29. Ice CL, Murphy E, Minor VE, Metabolic syndrome in fifth grade children with acanthosis nigricans: results from the CARDIAC project. World J Pediatr. 2009 Feb; 5(1):23-30. Epub. 2009 Jan 27. 134 30. Böhm M, Luger TA, Metze D. Treatment of mixed-type acanthosis nigricans with topical calcipotriol. Br J Dermatol. 1998 Nov; 139(5):9324. PMID: 9893209 31. Mork NJ, Rajka G, Halse J. Treatment of acanthosis nigricans with etretinate (Tigason) in a patient with Lawrence-Seip syndrome (generalized lipodystrophy). Acta Derm Venereol. 1986; 66(2):173-4. 32. Buccini Graciela S. (1), Wolfthal D.L, Valores de corte para índices de Insulinoresistencia, insulinosensibilidad e insulinosecreción derivados de la fórmula HOMA y del programa HOMA2. Interpretación de los datos. Revista Argentina de Endocrinología y Metabolismo Copyright 2008 por la Sociedad Argentina de Endocrinología y Metabolismo: Vol. 45 No. 1 33. Llanos Tejada, Félix Konrad y Cabello Morales, Emilio. Distribución del índice de masa corporal (IMC) y prevalencia de obesidad primaria en niños pre-púberes de 6 a 10 años de edad en el distrito de San Martín de Porres - Lima. Rev Med Hered., set. 2003, vol.14, no.3, p.107-110. ISSN 1018-130X. 34. Laura Islas Ortega, HN-DIF, Mónica Peguero García. HN-DIF Hgo Obesidad infantil, Boletín de práctica médica efectiva, México, noviembre 2006. 35. Omar García Solís, Diana E Medina Castillo, José de la Cruz López, Obesidad y dermatosis: estudio prospectivo y descriptivo en la Clínica de Consulta Externa Alfredo del Mazo Vélez del ISSEMyM, Toluca, Dermatología Rev. Mex. Volumen 54, Núm. 1, enero-febrero, 2010. 36. Romero-Velarde E, Campollo-Rivas O, Celis de la Rosa A, VásquezGaribay EM, Castro-Hernández JF, Cruz-Osorio RM. Factores de riesgo de dislipidemia en niños y adolescentes con obesidad. Salud Pública Mex 2007;49:103-10 37. Hiltje Oude Luttikhuis, Louise Baur, Intervenciones para Tratar la Obesidad Cochrane Infantil (Revisión Cochrane Plus 2009 Número2. Oxford: traducida). Update Disponible en: http://www.update-software.com. 135 En: Biblioteca Software Ltd. 38. Dr. Alberto Barceló, Programa de Enfermedades No Transmisibles, Dr. Juan Carlos Bossio, Módulo Obesidad Infantil, Salud del Niño y del Adolescente, Salud Familiar y Comunitaria, AIEPI 2001. 39. Dres. Valeria Hirschler, Claudio Aranda, ¿Es la acantosis nigricans un signo de Insulinoresistencia en adolescentes obesos?, 1668-3501, Arch. argent. Pediatr.. v.102 n.2 Buenos Aires mar./abr. 2004. 40. Dres. Valeria Hirschler, Ana María Delfino, ¿Es la circunferencia de cintura un componente del síndrome metabólico en la infancia? Archivos argentinos de pediatría, ISSN1668-3501, v.103 n.1 Buenos Aires ene / feb. 2005. 41. JF-fu , Liang L , Dong GP, Los niños Obesos con acantosis nigricans benigna y resistencia a la insulina: análisis de 19 casos, diciembre 2004; 42 (12):917-9, Departamento de Endocrinología, Hospital de Niños de la Universidad de Zhejiang, la Facultad de Medicina, Hangzhou 310003, China. 42. Kong, RL Williams, R Rhyne, J Am Fam. Med. Junta, Acantosis nigricans: alta prevalencia y asociación con la diabetes en un consorcio de investigación de la red basada en la práctica - de atención primaria de la red multiétnica (neto PRIME) estudio, 2010 Jul-Aug; 23 (4):47685. 43. Buccini Graciela S. (1), Wolfthal D.L, Valores de corte para índices de Insulinoresistencia, insulinosensibilidad e insulinosecreción derivados de la fórmula HOMA y del programa HOMA2. Interpretación de los datos. Revista Argentina de Endocrinología y Metabolismo Copyright. 2008 por la Sociedad Argentina de Endocrinología y Metabolismo: Vol 45 • No. 1 44. Majkowska, L. Tests for evaluating Insulin Sensitivity in vivo. Przegl Lek. 1999;56(5): 351-6 45. Turner, R. C., Holman, R.R; Matthews, D. R. y col. Insulin deficiency and insulin resistance interaction in diabetes: estimation of their relative contribution by feedback analysis from basal plasma insulin and glucose concentrations. Metabolism28:1086-96. 1979. 136 46. Dr. Raúl Orlando Calderín Bouza, Síndrome de insulinorresistencia en niños y adolescentes, Hospital Docente Clinicoquirúrgico "Hermanos Ameijeiras", Rev Cubana Endocrinol 2007; 18(2). 47. Bloomgarden ZT. Third Annual World Congress on the Insulin Resistance Syndrome. Mediators, antecedents, and measurement. Diabetes Care. 2006; 29(7):1700-06. 48. Soubrier M, Dougados M. Atherosclerosis and rheumatoid arthritis. Rev. Med. Interne. 2006 Feb.; 27(2):125-36. 49. Powdermaker H. "An anthropological approach to the problem of obesity." In: Food and Culture: A Reader. Ed. Carole Counihan and Penny van Esterik. New York: Routledge, 1997;206. ISBN 0-41591710-7 50. Phillips, Stone (18 de agosto de 2006) (en inglés). Who's to blame for the U.S. obesity epidemic? MSNBC. Consultado el 3 de junio de 2007 51. Paul Campos, The Diet Myth. Gotham Books, NY, 2004. ISBN 1-59240135-X 52. The Surgeon General's call to action to prevent and decrease overweight and obesity; U.S. Dept. of Health and Human Services, Public Health Service, Office of The Surgeon General; Washington, D.C. Disponible en: http://www.surgeongeneral.gov/topics/obesity /calltoaction/CalltoAction.pdf 53. The Oxford English Dictionary (sitio web) 54. Cecil JE, Tavendale R, Watt P, An obesity-associated FTO gene variant and increased energy intake in children. N Engl J Med. 2008 Dec 11; 359(24):2558-66. 55. Reilly JJ, Armstrong J, Early life risk factors for obesity in childhood: cohort study. BMJ. 2005 Jun 11; 330(7504):1357. Epub 2005 May 20. 56. Morrill A, Chinn C. The obesity epidemic in the United States. J Public Health Policy 2004; 25:353-366. PMID 15683071 57. Durá Travé T, Sánchez-Valverde Visus F. Obesidad Infantil: ¿un problema de educación individual, familiar o social? Acta Pediátrica 137 Española [en línea] 2005 [12 de febrero del 2007]; 63:(204-207). URL disponible en: http://www.gastroinf.com/OBESIDAD.pdf 58. La obesidad. Organización mundial de la Salud. Consultado el 6 de junio de 2011 59. Arian Tarbal, OMS, La Obesidad Infantil: una epidemia mundial, en el link: www.faroshsjd.net/adjuntos/389.1-Pindola_obesitat_castella.pdf. 60. Francesco Branca, Haik Nikogosian, and Tim LobsteinThe challenge of obesity in the WHO European Region and the strategies for response, World Health Organization 2007, ISBN 978 92 890 1408 3. 61. Martos. Moreno GA, Argente J. Obesidades pediátricas: de la lactancia a la adolescencia. An Pediatr (Barc). 2011.doi: 10.1016 / j.anpedi. 2011.03.018. 62. Francesco Branca, Haik Nikogosian, and Tim LobsteinThe challenge of obesity in the WHO European Region and the strategies for response, World Health Organization 2007, ISBN 978 92 890 1408 3. 63. Hiltje Oude Luttikhuis, Louise Baur, Intervenciones para Tratar la Obesidad Infantil (Revisión Cochrane Cochrane Plus 2009 Número2. traducida). Oxford: Update En: Biblioteca Software Ltd. Disponible en: http://www.update-software.com. 64. Laurson KR, Eisenmann JC, Combined influence of physical activity and screen time recommendations on childhood overweight. J Pediatr. 2008 Aug; 153(2):209-14. Epub 2008 Apr 16. 65. Dennison BA, Erb TA, Jenkins PL. Television viewing and television in bedroom associated with overweight risk among low-income preschool children. Pediatrics. 2002 Jun; 109(6):1028-35. 66. Salbe AD, Weyer C, Assessing risk factors for obesity between childhood and adolescence: I. Birth weight, childhood adiposity, parental obesity, insulin, and leptin. Pediatrics. 2002 Aug; 110(2 Pt 1):299-306 67. Lluís Serra Majema,b, Lourdes Ribas Barbab, Obesidad infantil y juvenil en España, Resultados del Estudio enKid (1998-2000) Med Clin (Barc) 2003;121(19):725-32. 138 68. Farooqi IS, Wangensteen T, Clinical and molecular genetics spectrum of congenital deficiency of the leptin receptor. N Engl J Med. 2007 Jan 18; 356(3):237-47. 69. Lumeng JC. Overweight and psychiatric illness in children. South Med J. 2008 Apr; 101(4):347-8. 70. Cynthia L. Ogden, Margaret D. Carroll, Lester R. Curtin, Prevalence of Overweight and Obesity in the United States, 1999-2004 JAMA. 2006; 295(13):1549-1555. doi:10.1001/ jama 295.13.1549. 71. Riddoch CJ, Leary SD, Prospective associations between objective measures of physical activity and fat mass in 12-14 year old children: the Avon Longitudinal Study of Parents and Children (ALSPAC). BMJ. 2009 Nov 26; 339:b4544. doi: 10.1136/bmj.b4544 72. Lumeng JC, Rahnama S, Television exposure and overweight risk in preschoolers. Arch Pediatr Adolesc Med. 2006 Apr; 160(4):417-22. 73. Li L, Law C, Lo Conte R, Intergenerational influences on childhood body mass index: the effect of parental body mass index trajectories. Am J Clin Nutr. 2009 Feb; 89(2):551-7. Epub 2008 Dec 23. 74. Field AE, Austin SB, Taylor CB, Relation between dieting and weight change among preadolescents and adolescents. Pediatrics. 2003 Oct; 112(4):900-6. 75. Bonuck K, Kahn R, Is late bottle-weaning associated with overweight in young children? Analysis of NHANES III data. Clin Pediatr (Phila). 2004 Jul-Aug; 43(6):535-40. 76. Kimm SY, Glynn NW, Relation between the changes in physical activity and body-mass index during adolescence: a multicentre longitudinal study. Lancet. 2005 Jul 23-29; 366(9482):301-7. 77. Welsh JA, Cogswell ME, Rogers S, Overweight among low-income preschool children associated with the consumption of sweet drinks: Missouri, 1999-2002. Pediatrics. 2005 Feb; 115(2):e223-9. 78. Ludwig DS, Peterson KE, Relation between consumption of sugarsweetened drinks and childhood obesity: a prospective, observational analysis. Lancet. 2001 Feb 17; 357(9255):505-8 139 79. Taveras EM, Berkey CS, Association of consumption of fried food away from home with body mass index and diet quality in older children and adolescents. Pediatrics. 2005 Oct; 116(4):e518-24. 80. Rhee KE, Lumeng JC, Parenting styles and overweight status in first grade. Pediatrics. 2006 Jun; 117(6):2047-54 81. Rosenfield RL, Lipton RB, Thelarche, pubarche, and menarche attainment in children with normal and elevated body mass index. Pediatrics. 2009 Jan; 123(1):84-8. 82. Hillier TA, Pedula KL, Childhood obesity and metabolic imprinting: the ongoing effects of maternal hyperglycemia. Diabetes Care. 2007 Sep; 30(9):2287-92. Epub 2007 May 22. 83. Franklin J, Denyer G, Obesity and risk of low self-esteem: a statewide survey of Australian children. Pediatrics. 2006 Dec; 118(6):2481-7. 84. Stuart CA, Pate CJ, Peters EJ, Prevalence of acanthosis nigricans in an unselected population. Am J Med. 1989 Sep; 87(3):269-72. 85. Semmler C, Ashcroft J, Development of overweight in children in relation to parental weight and socioeconomic status. Obesity (Silver Spring). 2009 Apr; 17(4):814-20. Epub 2009 Jan 22. 86. Pinhas-Hamiel O, Doron-Panush N, Obese children and adolescents: a risk group for low vitamin B12 concentration. Arch Pediatr Adolesc Med. 2006 Sep; 160(9):933-6. 87. Gillian M. Nixon, MBChB, FRACP, Short Sleep Duration in Middle Childhood: Risk Factors and Consequences, Volume 31, ISSUE 01, 2008 enero, 31 (1): 71. 88. Koch FS, Sepa A, Psychological stress and obesity. J Pediatr. 2008 Dec; 153(6):839-44. Epub 2008 Jul 26. 89. Wijga AH, Scholtens S, Adenotonsillectomy and the development of overweight. Pediatrics. 2009 Apr; 123(4):1095-101. 90. Chen X, Beydoun MA, Is sleep duration associated with childhood obesity? A systematic review and meta-analysis. Obesity (Silver Spring). 2008 Feb;16 (2):265-74. 140 91. Goodman E, Whitaker RC. A prospective study of the role of depression in the development and persistence of adolescent obesity. Pediatrics. 2002 Sep; 110(3):497-504. 92. Pinhas-Hamiel O, Doron-Panush N, Obese children and adolescents: a risk group for low vitamin B12 concentration. Arch Pediatr Adolesc Med. 2006 Sep; 160(9):933-6. 93. The NS, Suchindran C, Association of adolescent obesity with risk of severe obesity in adulthood. JAMA. 2010 Nov 10; 304(18):2042-7. 94. Viner RM, Cole TJ. Adult socioeconomic, educational, social, and psychological outcomes of childhood obesity: a national birth cohort study. BMJ. 2005 Jun 11; 330(7504):1354. Epub 2005 May 17. 95. Salvadori M, Sontrop JM, Elevated blood pressure in relation to overweight and obesity among children in a rural Canadian community. Pediatrics. 2008 Oct; 122(4):e821-7. 96. Rigel DS, Jacobs MI. Malignant acanthosis nigricans, review, J Dermatol Surg Oncol. 1980 Nov; 6(11):923-7. 97. Eduardo J. Sanchez, MD, Charles E. Bell, Acanthosis Nigricans and Insulin Resistance, Cuidado de la Diabetes 2002 Jun; 25 (6): 1009 98. Omar García Solís, Diana E Medina Castillo, José de la Cruz López, Obesidad y dermatosis: estudio prospectivo y descriptivo en la Clínica de Consulta Externa Alfredo del Mazo Vélez del ISSEMyM, Toluca, Dermatología Rev Mex Volumen 54, Núm. 1, enero-febrero, 2010. 99. Laura Islas Ortega, HN-DIF, Mónica Peguero García, HN-DIF Hgo, Obesidad infantil, Boletín de practica medica efectiva, México, noviembre 2006. 100. Ludwig DS, Peterson KE, Relation between consumption of sugarsweetened drinks and childhood obesity: a prospective, observational analysis. Lancet. 2001 Feb 17; 357(9255):505-8. 101. Frayling TM, Timpson NJ, Weedon MN, et al (2007). «A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity». Science 316 (5826): pp. 889-94. Doi:10.1126/science.1141634. PMID 17434869. 141 102. Frayling TM, Timpson NJ, Weedon MN, et al (2007). «A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity». Science 316 (5826): pp. 889-94. Doi:10.1126/science.1141634. PMID 17434869. 103. Syme C, Abrahamowicz M, Intra-abdominal adiposity and individual components of the metabolic syndrome in adolescence: sex differences and underlying mechanisms. Arch Pediatr Adolesc Med. 2008 May; 162(5):453. 104. Dr. Alberto Barceló, Programa de Enfermedades No Transmisibles, Dr. Juan Carlos Bossio, Módulo Obesidad Infantil, Salud del Niño y del Adolescente, Salud Familiar y Comunitaria, AIEPI 2001. 105. Buccini Graciela S. (1), Wolfthal D.L, Valores de corte para índices de IM, insulinosensibilidad e insulinosecreción derivados de la fórmula HOMA y del programa HOMA2. Interpretación de los datos. Revista Argentina de Endocrinología y Metabolismo Copyright © 2008 por la Sociedad Argentina de Endocrinología y Metabolismo: Vol 45 • No. 1 106. Majkowska, L. Tests for evaluating Insulin Sensitivity in vivo. Przegl Lek. 1999;56(5): 351-6 107. Kong, RL Williams, R Rhyne, J Am Fam Med Junta, Acantosis nigricans: alta prevalencia y asociación con la diabetes en un consorcio de investigación de la red basada en la práctica - de atención primaria de la red multiétnica (neto PRIME) estudio, 2010 Jul-Aug; 23 (4) :47685. 108. Dres. Valeria Hirschler, Claudio Aranda, ¿Es la acantosis nigricans un signo de insulinorresistencia en adolescentes obesos?, 1668-3501, Arch. argent. pediatr. v.102 n.2 Buenos Aires mar./abr. 2004. 109. JF-fu , Liang L , Dong GP, Los niños Obesos con acantosis nigricans benigna y resistencia a la insulina: análisis de 19 casos, diciembre 2004; 42 (12):917-9, Departamento de Endocrinología, Hospital de Niños de la Universidad de Zhejiang, la Facultad de Medicina, Hangzhou 310003, China. 142 110. Dr. Raul Calderín Bouza RO, Orlandi González N. Síndrome metabólico vs síndrome de insulinorresistencia. Diferentes términos, clasificaciones y enfoques: ¿existe o no? Rev. Cubana Endocrinol. 2006; 17(3):1-16. 111. Boney CM, Verma A, Metabolic syndrome in childhood: association with birth weight, maternal obesity, and gestational diabetes mellitus. Pediatrics. 2005 Mar; 115(3):e290-6. 112. Turner, R. C., Holman, R.R; Matthews, D. R. y col. Insulin deficiency and insulin resistance interaction in diabetes: estimation of their relative contribution by feedback analysis from basal plasma insulin and glucose concentrations. Metabolism28:1086-96. 1979. 113. Turner, R. C., Holman, R.R; Matthews, D. R. y col. Insulin deficiency and insulin resistance interaction in diabetes: estimation of their relative contribution by feedback analysis from basal plasma insulin and glucose concentrations. Metabolism28:1086-96. 1979. 114. Dr. Raúl Orlando Calderín Bouza, Síndrome de IR en niños y adolescentes, Hospital Docente Clínico quirúrgico "Hermanos Ameijeiras", Rev. Cubana Endocrinol 2007; 18(2). 115. Bloomgarden ZT. Third Annual World Congress on the Insulin Resistance Syndrome. Mediators, antecedents, and measurement. Diabetes Care. 2006; 29(7):1700-06. 116. Soubrier M, Dougados M. Atherosclerosis and rheumatoid arthritis. Rev. Med. Internet. 2006 Feb; 27(2):125-36. 117. Castro - Rodríguez JA, Holberg CJ, Morgan WJ, Wright AL, Martinez FD. Increased incidence of asthma like symptoms in girls who become overweight or obese during the school years. Respir Crit Care Med. 2001; 163:1344-9. 118. Lutsey PL, Steffen LM, Dietary intake and the development of the metabolic syndrome: the Atherosclerosis Risk in Communities study. Circulation. 2008 Feb 12; 117 (6):754-61. Epub 2008 Jan 22. 143 119. Weitzman M, Cook S, Auinger P, Tobacco smoke exposure is associated with the metabolic syndrome in adolescents. Circulation. 2005 Aug 9; 112(6):862-9. Epub 2005 Aug 1. 120. Houston TK, Person SD, Pletcher MJ, Active and passive smoking and development of glucose intolerance among young adults in a prospective cohort: CARDIA study. BMJ. 2006 May 6; 332 (7549):10649. 121. J. Clin Endocrinol Metab. Fan AZ, Russell M, Naimi T, Li Y, Patterns of alcohol consumption and the metabolic syndrome. 2008 Oct; 93(10):3833-8. Epub 2008 Jul 15. 122. Am J Kidney Dis. Lucove J, Vupputuri S, Heiss G, Metabolic syndrome and the development of CKD in American Indians: the Strong Heart Study. 2008 Jan; 51(1):21-8. 123. Morrison JA, Friedman LA, Metabolic syndrome in childhood predicts adult cardiovascular disease 25 years later: the Princeton Lipid Research Clinics Follow-up Study. Pediatrics. 2007 Aug; 120 (2):340-5. 124. Dokras A, Bochner M, Hollinrake E, Screening women with polycystic ovary syndrome for metabolic syndrome, Department of Obstetrics and Gynecology, The University of Iowa Roy J. and Lucille A. Carver College of Medicine, Iowa City, 52242, USA, 2005 Jul; 106 (1): 131. 125. Steinberg J., Daniels SR. Obesity, insulin resistance, diabetes, and cardiovascular risk in children. Circulation 2003; 107: 1448-53. 126. Hermanns-Lé T, Hermanns JF, Piérard GE. Juvenile, Acanthosis Nigricans and Insulin Resistance. Pediatric Dermatology 2002; 19:12-4. 127. National Institute for Health and Clinical Excellence. Clinical guideline 43: Obesity: the prevention, identification, assessment and management of overweight and obesity in adults and children. London, 2006 128. Obesidad y sobrepeso. Nota descriptiva N°311. Oreganización Mundial de la Salud. Marzo de 2011 129. Bray GA (2004). Medical consequences of obesity. J. Clin. Endocrinol. Metab. 89 (6): pp. 2583-9. 144 130. Grundy SM (2004). Obesity, metabolic syndrome, and cardiovascular disease. J. Clin. Endocrinol. Metab. 89 (6): pp. 2595-600. 131. Van der Steeg JW, Steures P, Eijkemans MJ, et al (2008). Obesity affects spontaneous pregnancy chances in subfertile, ovulatory women. Hum. Reprod. 23 (2): p. 324–8. 132. Esposito K, Giugliano F, Di Palo C, Giugliano G, Marfella R, D'Andrea F, D'Armiento M, Giugliano D (2004). Effect of lifestyle changes on erectile dysfunction in obese men: a randomized controlled trial. JAMA 291 (24): pp. 2978-84. 133. Ejerblad E, Fored CM, Lindblad P, Fryzek J, McLaughlin JK, Nyrén O (2006). Obesity and risk for chronic renal failure. J. Am. Soc. Nephrol. 17 (6): pp. 1695-702. 134. Whitmer RA, Gunderson EP, Barrett-Connor E, Quesenberry CP Jr, Yaffe K (2005). Obesity in middle age and future risk of dementia: a 27 year longitudinal population based study. BMJ 330 (7504): pp. 1360 135. Hinojosa Andia, Lucy J y Berrocal Kasay, Alfredo. Relación entre obesidad y osteoporosis, en mujeres posmenopáusicas del Hospital Nacional Arzobispo Loayza. Acta méd. peruana. [online]. sep./dic. 2007, vol.24, no.3 [citado 10 Agosto 2011], p.172-176. Disponible en la World Wide Web: <http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S17285917 2007000300008&lng=es&nrm=iso 136. Encinosa WE, Bernard DM, Chen CC, Steiner CA (2006). Healthcare utilization and outcomes after bariatric surgery. Medical care 44 (8): pp. 706-12. 137. Sjöström L, Narbro K, Sjöström CD, et al (2007). Effects of bariatric surgery on mortality in Swedish obese subjects. N. Engl. J. Med. 357 (8): pp. 741-52. 138. Harrison Tratado de Medicina interna 17ª Ed. VOLII pág. 2282 139. Aaron S. Katz, et al. Acantosis nigricans en pacientes obesos: formas de presentación e implicaciones para la prevención de la enfermedad 145 vascular aterosclerótica. Dermatology Online Journal. Volume 6, Number 1 140. Kobaissi HA, Weigensberg MJ, Relation between acanthosis nigricans and insulin sensitivity in overweight Hispanic children at risk for type 2 diabetes. Diabetes Care. 2004 Jun; 27(6):1412-6. 141. Williams RL, Rhyne R Acanthosis Nigricans: high prevalence and association with diabetes in a practice-based research network consortium--a PRImary care Multi-Ethnic network (PRIME Net) study. J Am Board Fam Med. 2010 Jul-Aug; 23(4):476-85. 142. Ice CL, Murphy E, Minor VE, Metabolic syndrome in fifth grade children with acanthosis nigricans: results from the CARDIAC project. World J Pediatr. 2009 Feb; 5(1):23-30. Epub 2009 Jan 27. 143. Mork NJ, Rajka G, Halse J. Treatment of acanthosis nigricans with etretinate (Tigason) in a patient with Lawrence-Seip syndrome (generalized lipodystrophy). Acta Derm Venereol. 1986; 66(2):173-4. 144. Eberting CL, Javor E, Insulin resistance, acanthosis nigricans, and hypertriglyceridemia. J Am Acad Dermatol. 2005 Feb; 52(2):341-4. 145. Elizabeth A. Leonard, LT, Anthony J. Viera, LCDR, MC, USN Naval Hospital Jacksonville, Velvety Axillary Lesions, Physician 2004 15 de enero, 69 (2): 373. 146. Gibson LE. Acanthosis nigricans. Mayo Clin Proc. 2004 Dec; 79(12):1571. 147. Stoddart ML, Blevins KS, Lee ET, Association of acanthosis nigricans with hyperinsulinemia compared with other selected risk factors for type 2 diabetes in Cherokee Indians: the Cherokee Diabetes Study. Diabetes Care. 2002 Jun;25(6):1009-14 148. Zimmet P, Alberti G, Kaufman F, The metabolic syndrome in children and adolescents. Lancet. 2007 Jun 23; 369(9579):2059-61. 149. Jonsson A, Franks PW, Obesity, FTO gene variant, and energy intake in children, N Engl J Med. 2009 Apr 9;360(15):1571-2; author reply 1572. 146 150. Reinehr T, de Sousa G, Comparison of metabolic syndrome prevalence using eight different definitions: a critical approach. Arch Dis Child. 2007 Dec; 92(12):1067-72. Epub 2007 Feb 14. 151. Federico Argüelles M., Gustavo Silva G., Tratamiento en Gastroenterología, Hepatología y Nutrición Pediátrica, 2008 Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica, ISBN: 978-84-8473-680-6 Pg.: 603-668. 147 ANEXOS 148 Anexo Nº 1 149 Anexo Nº 2: Cuadro de Percentiles de ICM para Niños 150 Anexo Nº 3: Cuadro de Percentiles de ICM para Niñas 151 Anexo Nº 4: Flujo del proceso para realizar una Evaluación Clínica Terapéutica con IMC para Niños 152 Anexo Nº 5: Programa de Enfermedades No Transmisibles. AIEPI 153 Anexo Nº 6: Tabla de las Características clínicas y metabólicas según los Cuartilos de HOMA-IR 154 Anexo Nº 7: Complicaciones de la Obesidad Infantil 155 Anexo Nº 8: Algoritmo Diagnóstico de la Obesidad 156 Anexo Nº 9: Tabla de Percentilos de la Circunferencia de la Cintura (cm) n Mujeres (A) y Varones (B) 157 Anexo Nº 9 158 159