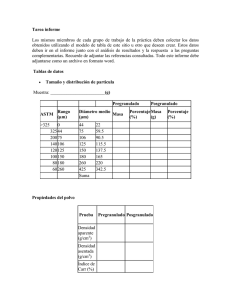
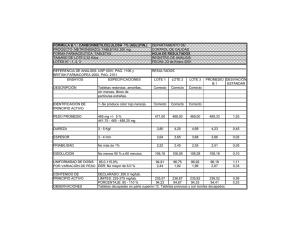
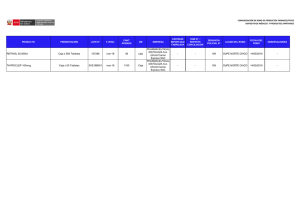
Avances en el PAT - Revista Médica Veterinaria
Anuncio

Más: Volumen 11, Número 2 Dentro de la Guia para CoA del IPEC Avances en el PAT para la manufactura de fármacos parenterales Sección Especial Formas Farmacéuticas Sólidas y Excipientes INVESTIGACIÓN ARBITRADA Mejoras en el análisis de productos inhalados Granulado de espuma: Una nueva técnica para la granulación húmeda continua utilizando un extrusor de doble tornillo NANOPARTÍCULAS: Apuntando a las terapias cáncer Portada Mayo-Junio 2013.indd 1 RESOLUCIÓN DE PROBLEMAS: Tableteado y herramental 30/05/13 10:29 Un socio estratégico en aplicaciones de sistemas globales e innovadores para optimizar los procesos de manufactura, enfocado y con amplia experiencia en las industrias biotecnológicas, farmacéuticas, alimentos y bebidas. Equipos de pruebas de integridad |Bioreactores| Contenedores de b i o p ro c e s o – te c n o l o g í a S i n g l e - U s e | Fermentadores | Sistemas cross-flow | Filtros de membrana 0.2 micras | Prefiltros–filtros desde 50 micras hasta 0.45 micras | Filtros para retención de virus | Sistemas de Mezclado Single-Use | Filtro para aire/gas | housingde acero inoxidable | Sistemas de transferencia Aséptica | Filtros de cromatografía por membrana | Equipos para la determinación de análisis en proceso | sistemas de filtración Upstreamand donwstream. turning science into solutions Sartorius de México S.A. de C.V. Cto. Circunvalación Pte. No. 149 Ciudad Satélite, Naucalpan Estado de México 53100 Tel: +52-55-5562-1102 Fax: +52-55-5562-2942 [email protected] adentro es más seguro modelo 628 Nosotros arriesgamos el cuello para que usted no tenga que hacerlo. En Weiler Engineering, nuestro personal está dedicado al diseño y construcción de nuestras empacadoras ASEP-TECH®. ¿El resultado? Los sistemas de envasado aséptico de líquidos más eficientes de la industria, con tecnología de vanguardia que reduce en gran medida el elemento humano. Qué más esperaria del sistema de envasado aséptico de líquidos más avanzado del mundo? Nuestras máquinas de Soplado/Llenado/Sellado integran moldeado por soplado, llenado estéril y sellado hermético en una operación ininterrumpida—un proceso de producción sin contacto humano que garantiza que los productos parenterales, soluciones oftálmicas, fármacos respiratorios y otros medicamentos líquidos de su compañía puedan llegar al mercado de la manera más rentable posible— en todas las ocasiones. ©2013 Weiler Engineering, Inc. Por más de 40 años, hemos determinado el estándar industrial para el desarrollo del procesamiento estéril con un compromiso continuo por la calidad e innovación por tecnología aséptica. Trabajaremos con su compañía para desarrollar una estrategia a medida para cada uno de sus productos. Para ver los sistemas ASEP-TECH® en acción, visite www.asep-tech.com/ptes Soluciones protectoras mediante envasado innovador Marque en la tarjeta de servicio al lector el No. 9 14004-75 WEIL PharmTech ES_May2013.indd 1 PT MAYO / JUNIO.indd 1 3/28/13 3:50 PM 27/05/13 16:31 MAYO / JUNIO 2013 VOLUMEN 11, NÚMERO 2 En la Portada Pharmaceutical Technology en Español, proporciona información importante, confiable, y oportuna sobre todos los aspectos relacionados con Desarrollo e Investigación Aplicada; y con las Tecnologías de Proceso, Fabricación, Formulación, y Empaque para la Industria Farmacéutica Convencional y la de Biotecnología. Primera plana 11 PAT para la manufactura de fármacos parenterales Aplicar la calidad por diseño y la tecnología analítica de proceso facilita la comprensión del proceso y el control de varias operaciones en la liofilización. Illustración por Dan Ward Imágenes: JurgaR/Getty Images Aspectos Investigación Arbitrada POSTURA OFICIAL DESARROLLO DE FÁRMACOS INHALADOS 5 GMPs del desarrollo inicial para ESTABILI- 54 Mejora del análisis de productos inhalados DAD: Perspectiva de la industria (Parte IV) Bruce Acken, Mark Alasandro, Stephen Colgan, Paul Curry, Frank Diana, Q. Chan Li, Z. Jane Li, Tony Mazzeo, Andy Rignall, Z. Jessica Tan, Robert Timpano Los representantes del Consorcio IQ exploran y definen esquemas y prácticas comunes de la industria para la aplicación de las GMPs en el desarrollo inicial. Los autores aportan métodos para obtener mejores relaciones in vitro-in vivo. 66 Granulado con espuma Los autores revisan los desarrollos en ganulación húmeda utilizando un extrusor de doble tornillo. RESOLUCIÓN DE PROBLEMAS 48 Resolución de los problemas del tableteado y los herramentales NOVEDADES Y ANÁLISIS La adopción de un proceso de siete pasos para el mantenimiento y el almacenamiento mejora la calidad del tableteado. EDITORIAL INVITADA 50 Esterilización con dióxido de nitrógeno La esterilización a temperatura ambiente utilizando gas de dióxido de nitrógeno beneficia a los fármacos parenterales. SÍNTESIS Y MANUFACTURA DE APIs 53 Ofreciendo un punto de vista farmacéutico de los medios sociales Porqué los medios sociales presentan retos y oportunidades únicas para las compañías farmacéuticas. SOLUCIONES ESTADÍSTICAS 51 Logrando la estereoselectividad en la síntesis 63 Cálculo del resultado reportable de los datos Los investigadores utilizan catalizadores inorgánicos como una alternativa a los biocatalizadores en la conversión selectiva de azúcares para producir bloques de construcción quirales. Dos métodos para evaluar los resultados del reanálisis después de los resultados fuera de especificaciones. asimétrica del reanálisis FARMACÉUTICOS 60 Nanopartículas: facilitación de la entrega de fármacos dirigidos en la terapia para el cáncer Ingeniería de nanopartículas con propiedades óptimas para el uso en las terapias del cáncer. 2 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 2 MAYO / JUNIO 2013 27/05/13 16:31 CONTENIDO Especial REGULACIÓN Y CUMPLIMIENTO Formas Farmacéuticas Sólidas y Excipientes DENTRO DE LA USP ESTRATEGIAS DE SOLUBILIZACIÓN 26 Polímeros avanzados para la mejora de la solubilidad 14 Modernización de los estándares USP La Convención de la Farmacopea de EEUU continúa haciendo de la modernización de los estándares la máxima prioridad en el 2013. SOLUCIONES INTERNAS Mesa redonda con Bend Research, Dow Wolff Cellulosics y Evonik 16 El error humano detrás del error humano RECUBRIMIENTO DE TABLETAS Y GRANULACIÓN EN SECO Debe llevarse a cabo una profunda investigación de todas las posibles causas de desviaciones. 31 Mejora continua en el recubrimiento de tabletas y la granulación en seco RESOLUCIÓN DE PROBLEMAS DEL CMC Martin Hack y Dejan Djuric 18 Contaminantes por cozrrosión y sistemas TABLETEADO Problemas asociados con la contaminación por corrosión en sistemas de agua. de agua 39 Lucha contra problemas comunes en el tableteado y el herramental Entrevista con I Holland CALIDAD POR DISEÑO 20 Medición de la distribución del tamaño de partícula de los APIs Se obtiene un mapa visual que puede usarse para estimar el tamaño de partícula del API visualmente. 35 Calidad por diseño en excipientes Entrevista con Colorcon VIGILANCIA REGULATORIA EN EEUU DIVIDIDO DE TABLETAS 17 La innovación en vacunas aporta nuevos productos y procesos 43 Preocupaciones e innovaciones en El desarrollo de vacunas se está beneficiando de los avances en manufactura y del soporte para la salud global. Mesa redonda con Freeman Technology, AccuBreak Pharmaceuticals y Medelpharm DENTRO DEL IPEC el dividido y ranurado de tabletas 22 Alineándose con la guía para CoA del IPEC Pharmaceutical Technology es selectivamente extraida o indexada en: Biological Sciences Database (Cambridge Scientific Abstracts) Biotechnology and Bioengineering Database (Cambridge Scientific Abstracts) Business and Management Practices (RDSI) Chemical Abstracts (CAS) Current Packaging Abstracts DECHEMA Derwent Biotechnology Abstracts (Derwent Information, Ltd.) Excerpta Medica (Elsevier) International Pharmaceutical Abstracts (ASHP) Science Citation Index (Thomson) Pharmaceutical Technology está orgullosa de ser miembro asociado de DCAT, IPEC y PDA. Los presidentes anteriores del comité de calificación de excipientes del IPEC-Américas destacan los cambios a la guía del IPEC sobre los certificados de análisis para excipientes a granel. Secciones 69 ¿Qué hay de nuevo? 69 Calendario de eventos 71 Directorio Clasificado 72 Directorio de anunciantes Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 3 MAYO / JUNIO 2013 3 27/05/13 16:31 James P. Agalloco President, Agalloco & Associates R. Gary Hollenbeck, PhD Chief Scientific Officer, UPM Pharmaceuticals Larry L. Augsburger, PhD Professor, Department of Pharmaceutics, University of Maryland Ruey-ching (Richard) Hwang, PhD Senior Director, Pharmaceutical Sciences, Pfizer Global R&D David H. Bergstrom, PhD COO, NovaDel Pharma Inc. Phil Borman QbD Lead & Data Management & Analysis Manager GlaxoSmithKline Mansoor A. Khan, PhD Director, FDA/CDER/DPQR Russell E. Madsen President, The Williamsburg Group, LLC Rory Budihandojo Director, Quality Systems Audit, Boehringer-Ingelheim Shanghai Pharmaceuticals Co. (China) Heidi M. Mansour, PhD Assistant Professor, College of Pharmacy, University of Kentucky Todd L. Cecil Vice-President Compendial Science United States Pharmacopeia Jim Miller President, PharmSource Information Services Bio/Pharmaceutical Outsourcing Report Metin Çelik, PhD President, Pharmaceutical Technologies International (PTI) Zak T. Chowhan, PhD Consultant, Pharmaceutical Development Suggy S. Chrai, PhD President and CEO, Chrai Associates, Inc. Roger Dabbah, PhD Principal Consultant, Tri-Intersect Solutions Tim Freeman Managing Director, FreemanTechnology Sanjay Garg, PhD Professor, Pharmaceutical Sciences, University of South Australia Moheb M. Nasr, PhD Vice-President, CMC Regulatory Strategy, Global Regulatory Affairs, GlaxoSmithKline Garnet E. Peck, PhD Professor Emeritus of Industrial Pharmacy, Purdue University James Polli, PhD Professor, School of Pharmacy, University of Maryland Wendy Saffell-Clemmer Director, Research, BioPharma Solutions Gurvinder Singh Rekhi, PhD Director, Research and Development, Elan Drug Delivery Inc. Susan J. Schniepp Pharmaceutical Consultant, Schniepp & Associates, LLC Colin Minchom, PhD Vice President Particle Design Hovione David R. Schoneker Director of Global Regulatory Affairs, Colorcon Christine Moore, PhD Deputy Director for Science and Policy, Office of New Drug Quality Assessment, CDER, FDA Eric B. Sheinin, PhD President, Sheinin and Associates R. Christian Moreton, PhD Vice-President, Pharmaceutical Sciences, Finnbrit Consulting Fernando J. Muzzio, PhD Director, NSF Engineering Research Center on Structured Organic Particulate Systems, Dept. of Chemical and Biochemical Engineering, Rutgers University Charles A. Signorino, PhD CEO, Emerson Resources, Inc. Aloka Srinivasan Principal Consultant, PAREXEL International Heinz Sucker, PhD Professor Emeritus, Pharmaceutical Institute, University of Bern Scott Sutton, PhD Microbiology Network Lynn D. Torbeck Statistician, PharmStat Consulting Pharmaceutical Technology en Español, V.11 No. 2 Mayo-Junio de 2013. Publicación bimestral editada por Revistas para la Industria, S.A. de C.V. Editor responsable: Ma. Antonieta Guerrero Paz. No. de Certificado de Reserva de Derechos al Uso Exclusivo otorgado por el Instituto Nacional del Derecho al Autor No. 04-2011-010610533100-102. No. de Certificado de Licitud de Título y Contenido otorgado por la Secretaría de Gobernación No. 15794. Domicilio de la Publicación: Av. Insurgentes Sur 605, Desp. 404-D, Col. Nápoles, C.P. 03810, Deleg. Benito Juárez, México, D.F. Impreso en: Polymasters de México, S.A. de C.V. - Calle Dos No. 123-C, Col. Granjas San Antonio C.P. 09070, México, D. F. Distribuida por: Revistas para la Industria, S.A. de C.V. - Av. Insurgentes Sur 605, Desp. 404-D, Col. Nápoles, C.P. 03810, Deleg. Benito Juárez, México, D.F. Toda la información y conceptos que aquí aparecen son responsabilidad exclusiva de cada uno de los autores y firmas comerciales. Esta prohibida y será castigada la reproducción total o parcial de cualquiera de los materiales que aquí aparecen. 4 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 4 MAYO / JUNIO 2013 27/05/13 16:31 Postura Oficial: GMPs en Fase Inicial GMPs en el Desarrollo Inicial para Estabilidad Perspectiva de la Industria (Parte IV) Bruce Acken, Mark Alasandro, Stephen Colgan, Paul Curry, Frank Diana, Q. Chan Li, Z. Jane Li, Tony Mazzeo, Andy Rignall, Z. Jessica Tan, Robert Timpano Los autores, parte del Consorcio Internacional sobre Innovación y Calidad en Desarrollo Farmacéutico (IQ Consortium), exploran y definen enfoques y prácticas comunes de la industria cuando aplican las GMPs en el desarrollo inicial. Un grupo de trabajo del consorcio tiene como objetivo desarrollar una serie de recomendaciones que puedan ayudar a la industria a identificar oportunidades para mejorar el tiempo de entrega para el primer estudio en humanos y reducir los costos de desarrollo, manteniendo mientras tanto los estándares de calidad requeridos y garantizando la seguridad del paciente. Este artículo es el cuarto de la serie y se enfoca en la estabilidad. Bruce Acken está en Ciencias Analíticas en Merck & Co. Inc. (Summit, NJ); Mark Alasandro está en Análisis Farmacéutico y Microbiología en Allergan (Irvine, CA); Stephen Colgan está en Pfizer Investigación y Desarrollo Global (Groton CT); Paul Curry está en NCE IyD Analítico en Abbott Laboratories (Abbott Park, IL); Frank Diana está en Desarrollo Farmacéutico en Endo Pharmaceuticals (Chadds Ford, PA); Q. Chan Li está en Desarrollo Analítico US y Z. Jane Li está en Desarrollo Farmacéutico, ambas en Boehringer Ingelheim Pharmaceuticals (Ridgefield, CT); Tony Mazzeo* está en Desarrollo Analítico y Bioanalítico en Bristol-Myers Squibb Company (New Brunswick, NJ); Andy Rignall está en Ciencia Analítica en AstraZeneca IyD (Macclesfield, RU); Z. Jessica Tan está en Analítica IyD en Amgen (Thousand Oaks, CA); y Robert Timpano está en Pfizer IyD Global (Groton, CT). *A quien debe dirigirse toda la correspondencia E l Consorcio Internacional sobre Innovación y Calidad en Desarrollo Farmacéutico (IQ) formado en 2010, es una asociación de más de 25 compañías farmacéuticas y de biotecnología con la misión de promover estándares y regulaciones basados en la ciencia y científicamente llevados para productos medicinales en todo el mundo. En una edición pasada del Pharmaceutical Technology, se publicó un artículo que describía las IQs de las Buenas Prácticas de Fabricación (GMPs) en el grupo de trabajo de Desarrollo Inicial (1). Este grupo de trabajo (WG) está concentrado en el desarrollo de enfoques recomendados para la aplicación de las GMPs en varias áreas de actividad del desarrollo CMC en la Fase Inicial (p.ej., Fase 1 a Fase 2a). Una premisa clave de las GMPs en el WG de Desarrollo Inicial es que los documentos guía existentes de GMPs para el desarrollo inicial son vagos y que sería valiosa una mejor claridad con opciones para cumplir las expectativas GMP. Aunque no se aboga por una guía más prescriptiva, en este artículo se comparten las mejores prácticas para promover la innovación en el desarrollo de productos farmacéuticos mejorando los tiempos de ciclo, y manteniendo mientras tanto la calidad apropiada del producto y garantizando la seguridad del paciente. Una consecuencia de la ausencia de claridad que rodea a la guía de las GMP en fase inicial ha sido la variada interpretación y aplicación de la guía de GMP existente dentro de diferentes compañías y cuerpos regulatorios de acuerdo a su propia cultura y tolerancia al riesgo. Los debates internos con frecuencia resultan en interpretaciones conservadoras de “uno se ajusta a todo” que se apoyan en las guías de la Conferencia Internacional de Armonización (ICH) que son relevantes para el desarrollo de productos comerciales y no distingue diferencias en las prácticas entre el desarrollo inicial y el desarrollo en etapa final (es decir, Fase 2b y más allá). Por lo tanto, un conductor clave del WG de IQ ha sido definir colectivamente las prácticas mínimas aceptables dentro de la industria con respecto a las expectativas de GMP en el desarrollo inicial, que permitan una flexibilidad agregada y que sean consistentes con la guía y los estatutos existentes (2, 3). Según se describió en el artículo introductorio de esta serie, los esfuerzos del WG en GMPs en el Desarrollo Inicial han estado concentrados en las siguientes cuatro áreas de actividades de Química, Manufactura y Controles (CMC): Validación de Métodos Analíticos, Especificaciones, Manufactura del Producto Farmacéutico y Estabilidad (1). El alcance inicial de estos esfuerzos ha estado limitado al desarrollo de pequeñas moléculas, el cual soporta los estudios clínicos de Primero en Humanos (FIH) hasta la Fase 2a (prueba de concepto). Dentro de esta revista se han publicado una serie de artículos que describen un enfoque recomendado para la aplicación Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 5 MAYO / JUNIO 2013 5 27/05/13 16:31 Postura Oficial: GMPs en Fase Inicial de las GMPs en cada una de estas áreas. En las ediciones pasadas, se proporcionaron enfoques para la Validación de Métodos Analíticos, Manufactura y Especificaciones para soportar los sometimientos a las autoridades de salud (4, 5). En este artículo, Parte IV, se discuten las necesidades de la estabilidad. Durante el desarrollo inicial de fármacos, pueden generarse datos de estabilidad para respaldar la manufactura y el almacenamiento de productos clínicos que cumplan las expectativas regulatorias para los sometimientos de Nuevos Fármacos en Investigación (IND), Dossier de Productos Medicinales en Investigación (IMPD) o Solicitud de Estudio Clínico (CTA) y ayudar a comprender el producto y el proceso. Los autores ilustran algunas de las mejores prácticas para estabilidad que respalden los estudios clínicos en fase inicial en este artículo; sin embargo, algunas compañías pueden elegir hacer más, o posiblemente menos, a su discreción y con las justificaciones apropiadas basadas en la ciencia y en el riesgo, adecuadas para las fases y propósitos del desarrollo. Los sistemas de calidad GMP (p.ej., calificación de la cámara, procedimientos normalizados de operación) usados para soportar dichos estudios no son el enfoque de este artículo. Estudios de estabilidad para soportar el desarrollo en la fase inicial Al inicio en el desarrollo, las organizaciones de investigación farmacéutica desarrollan productos con un enfoque primario en la seguridad del paciente. Se generan datos en condiciones de almacenamiento apropiadas para demostrar o soportar la estabilidad de la sustancia farmacéutica y producto para asegurar la calidad del producto a través del período del estudio clínico. Se dispone de documentos guía para indicar el tipo de información necesaria para respaldar los estudios clínicos (3, 6-8). Aunque las guías de estabilidad del ICH describen los datos de estabilidad necesarios para respaldar las condiciones de almacenamiento y la vida de anaquel para los sometimientos comerciales, estas guías no son aplicables para las etapas iniciales del desarrollo cuando se conoce menos acerca de las nuevas sustancias y productos (9). Sin embargo, debe haber datos apropiados para soportar el almacenamiento de los productos que se están proponiendo para el uso clínico. Si un producto está destinado para uso humano, aplican los conceptos de las cGMPs. Para estabilidad, esta aplicación con frecuencia resulta en un plan o protocolo escrito para el estudio de estabilidad, métodos de prueba que se ajustan al propósito, documentación rastreable y confiable, y PNOs apropiados. La mayoría de los compuestos en desarrollo inicial terminan siendo suspendidos, por problemas de seguridad y/o eficacia y/o por viabilidad comercial inadecuada. Por lo tanto, asegurar eficientemente la calidad de los productos que se están usando en los primeros estudios clínicos en humanos es un desafío que enfrenta cada organización de investigación farmacéutica involucrada en los primeros estudios. Los desafíos comunes que se enfrentan en el respaldo de la estabilidad de la sustancia farmacéutica (también conocida como API) y del producto farmacéutico se discuten aquí. Los autores ofrecen algunos enfoques basados en el riesgo para recolectar datos para moléculas pequeñas, formas farmacéuticas orales sólidas usadas en estudios clínicos Fase 1 y Fase 2a, en la esperanza de guiar a las compa6 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 6 ñías y a las autoridades de salud hacia estrategias armonizadas y mejores prácticas. En la fase inicial del desarrollo, los requerimientos CMC incluyen la generación de los datos de estabilidad apropiados en condiciones de almacenamiento adecuadas para respaldar el sometimiento del IND (ó IMPD/CTA) y el uso del material clínico hasta el final del estudio clínico. Estos objetivos científicos y regulatorios para la estabilidad deben cumplirse minimizando al mismo tiempo los gastos de operación que no agregan ningún valor. Varios factores desde una perspectiva de negocio, regulatoria y científica necesitan tomarse en cuenta cuando se diseñan estudios de estabilidad en fase inicial: • La tolerancia al riesgo de la organización patrocinadora y su enfoque a la mitigación científica de los riesgos. • La estabilidad inherente de la sustancia farmacéutica o producto y el conocimiento previo del producto, del proceso y de la estabilidad. • El ambiente regulatorio en los países en donde se realizará el estudio clínico. Por ejemplo, algunos países pueden solicitar datos de estabilidad de múltiples lotes o de los lotes clínicos reales o pueden no aceptar la extrapolación para justificar asignaciones de fecha de uso. • El uso futuro proyectado del producto. Los equipos de desarrollo pueden tener alguna idea de la probabilidad de que el proyecto avance a la Fase 2b. Si se espera que un producto sea usado durante muchos meses o múltiples años a través de varias fases de desarrollo, entonces puede ser necesaria una propuesta de extensión de la fecha de uso basada en datos adicionales a largo plazo y el aporte adicional del conocimiento que se ha colectado. (3). Esta información puede influir el alcance del estudio inicial de estabilidad en forma de puntos de tiempo adicionales, condiciones adicionales y/o pruebas adicionales. Considerando estos factores, la industria debe trabajar para equilibrar las expectativas percibidas de los reguladores en los países donde se realizarán estudios clínicos utilizando un enfoque basado en la ciencia y en el riesgo para generar y proveer datos de estabilidad en los sometimientos regulatorios. Alcance En este artículo se discuten recomendaciones con respecto a la generación de datos de estabilidad para la sustancia farmacéutica y formas farmacéuticas orales sólidas usadas para Fase 1 y Fase 2a (fases iniciales del desarrollo). Este artículo presenta un marco de trabajo y principios orientadores para este fin. Los ejemplos presentados no pretenden ser una guía de “como hacer”, sino más bien ilustraciones de los principios que se están discutiendo. Otros diseños y condiciones del estudio también pueden ser posibles con la justificación apropiada. Los esfuerzos de desarrollo del producto para los suministros clínico iniciales con frecuencia son simples formulaciones con limitada historia de desarrollo. Los productos orales iniciales de pequeña molécula pueden colocarse en una de dos categorías: productos basados en la sustancia farmacéutica (DS) y productos formulados. Los productos basados en la DS incluyen el uso de la DS tal cual (p.ej., polvo en un frasco [PIB], polvo en cápsula [PIC], o DS enviado a granel a los sitios clínicos para el mezclado en el sitio. Estos productos casi MAYO / JUNIO 2013 27/05/13 16:31 siempre tienen las mismas características de estabilidad que la DS a granel, y los datos de estabilidad de la DS pueden ser usados para respaldar la fecha de uso del producto. Los productos formulados pueden ser polvos formulados con excipientes, cápsulas llenas con granulado formulado, o es una formulación en tableta. Estas formulaciones llevan más esfuerzo y normalmente son usadas debido a una necesidad clínica específica, un defecto del producto basado en la DS, o un deseo de utilizar la misma formulación en los estudios Fases 1 y 2. En la mayoría de los casos, serán formulaciones bastante simples que se supone tendrán un corto ciclo de vida. Si el producto avanza más en el desarrollo, necesitarán desarrollarse formulaciones más elegantes. No incluidas en este artículo están las formulaciones que son preparadas extemporáneamente en el sitio clínico. Estas formulaciones son consumidas rápidamente y no se justifican estudios de estabilidad a largo plazo. En las siguientes secciones, se discuten las consideraciones de estabilidad de la DS y del producto farmacéutico (DP) para el desarrollo inicial. Estabilidad de la sustancia farmacéutica Lotes representativos de la sustancia farmacéutica. Un lote representativo de la DS o del DP, es aquel que se espera que tenga estabilidad similar a la de los lotes usados en la producción clínica, basada en una evaluación fundamentada en la ciencia y el riesgo, de los atributos que se espera que influyan en la estabilidad, y en el conocimiento obtenido durante el desarrollo. Frecuentemente se fabrican primero lotes de DS no GMP o GLP (buenas prácticas de laboratorio) y se colocan en estabilidad para soportar una variedad de actividades de desarrollo del producto. Estos lotes con frecuencia son representativos de lotes GMP desde una perspectiva de la estabilidad y pueden usarse para establecer un período de reanálisis inicial para la DS y soportar un sometimiento clínico. Los datos de estabilidad incluidos en la sección del CMC son limitados en esta etapa del desarrollo (5). El lote de DS utilizado para la manufactura del suministro clínico Fase 1 puede colocarse en estabilidad concurrente con los estudios clínicos, si se justifica el estudio adicional. En el desarrollo inicial, es común que el proceso de manufactura sea mejorado como parte normal del desarrollo. Conforme evoluciona el proceso de la DS, es necesaria una evaluación para determinar si el lote inicial puesto en estabilidad es todavía representativo del proceso mejorado. Los autores defienden un enfoque basado en la ciencia y el riesgo para decidir si los estudios de estabilidad en los nuevos lotes del proceso están justificados. Los principios básicos se discuten más adelante y pueden encontrarse más detalles de dicho enfoque en la Ref. 10 y sus citas (10). El primer paso es determinar cuáles de los atributos de la DS tienen un efecto en la estabilidad. Este paso puede ser completado a través de evaluaciones de riesgo basadas en papel, conocimiento previo, o a través de un desafío de estabilidad a corto plazo a la par (según se discute en la siguiente sección) que compare el nuevo lote con el lote inicial. Si el proceso modificado impacta uno o más de estos atributos de calidad relacionados con la estabilidad, el nuevo lote debe colocarse en estabilidad. Si el proceso modificado no resulta en un cam- bio de un atributo de calidad relacionado con la estabilidad, el nuevo lote no necesita colocarse en estabilidad. Existen ciertos cambios que casi siempre requieren un nuevo estudio. No puede asumirse que diferentes formas polimórficas, contra-iones, o formas solvatadas de un compuesto tengan los mismos índices de degradación o las mismas vías de degradación. Por lo tanto, estos cambios casi siempre requerirán nuevos datos de estabilidad (11). Los cambios típicos encontrados en el desarrollo inicial incluyen cambios en la vía de la síntesis (incluyendo un cambio en el orden de los pasos formadores de enlaces), escala del lote, equipo o sitio de manufactura, reactivos, origen de los materiales, solventes usados y pasos de cristalización. En la mayoría de los casos, estos cambios no resultarán en cambios de la estabilidad de la DS. Una idea falsa común es que los cambios del perfil de impurezas afectarán adversamente la estabilidad. La mayoría de las impurezas de la DS, particularmente las impurezas orgánicas, son esencialmente inertes y no tienen efecto sobre la estabilidad de la DS. Algunas impurezas, tales como los metales catalíticos, las impurezas inorgánicas ácidas o básicas, o cantidades significativas de aguas residuales o solventes, pueden afectar la estabilidad, y si el nuevo proceso cambia el nivel de estas impurezas, puede justificarse una estabilidad adicional. Los cambios en el empaque del material a granel a un empaque menos protector pueden requerir datos de estabilidad para soportar el cambio. Similarmente, el cambio a un empaque más protector con el fin de extender el período de reanálisis, más allá de lo que el estudio del lote representativo original podría soportar, puede requerir datos adicionales en el nuevo empaque. Los atributos físicos que pueden impactar la estabilidad incluyen tamaño de partícula/área de superficie, el grado de cristalinidad/amorficidad, forma polimórfica, forma hidratada, y contenido de humedad. Si un nuevo proceso cambia cualquiera de estos atributos, se recomienda una evaluación de riesgo para determinar si se justifica la estabilidad adicional. En algunos casos, los datos de estabilidad acelerada o con estrés de corto plazo pueden ayudar a decidir si estos atributos son de hecho atributos de calidad relacionados con la estabilidad. Los conceptos detallados en los dos párrafos anteriores intentan diferenciar cambios mayores y menores y pueden resultar en diferentes estrategias de estabilidad para soportar estos cambios. Una evaluación de riesgo puede ayudar a determinar si el lote actual es suficientemente representativo. Alternativamente, los datos adicionales pueden ser necesarios cuando el lote no es representativo o cuando existe duda sustancial después de la evaluación. Colecta de los datos de estabilidad de la sustancia farmacéutica. Aunque las prácticas de análisis de estabilidad y la cantidad de datos colectados varían de compañía a compañía, se discuten aquí tres enfoques comúnmente usados. Uno es que un lote inicial de DS representativo sea colocado bajo tiempo real y condiciones aceleradas (p.ej., 25°C/60% HR y 40°C/75% HR) y los resultados de estabilidad para unos cuantos puntos de tiempo (p.ej., 1-6 meses) se generen para soportar un período inicial de reanálisis (p.ej., 12 meses o más). Si es necesario, el estudio de estabilidad puede continuar para extender el período de reanálisis o el material GMP simplemente puede ser reanalizado, según sea necesario, como parte de un prograPharmaceutical Technology en Español PT MAYO / JUNIO.indd 7 MAYO / JUNIO 2013 7 27/05/13 16:31 Postura Oficial: GMPs en Fase Inicial ma de reanálisis comúnmente usado para los componentes de la manufactura. Las pruebas analíticas seleccionadas para los estudios de estabilidad deberán cubrir los atributos de calidad relacionados con la estabilidad. Típicamente, estas pruebas incluirían impurezas y descripción y pueden incluir el ensayo. La pureza quiral, la forma polimórfica (p.ej., rayos X) y el contenido de agua deben ser analizados, según convenga. Puede no ser necesario realizar todas las pruebas en cada punto de tiempo dependiendo del propósito de la prueba. Un segundo enfoque es usar condiciones de alto estrés con un tiempo corto, como el modelo de alta temperatura y alta humedad (HT/HH), Por ejemplo, la DS es almacenada a 70°C/75% HR en contenedores abiertos y cerrados, mientras se monitorea la estabilidad química y física hasta tres semanas. Los resultados de la estabilidad química se utilizan para extrapolar el período de reanálisis inicial de la DS hasta 18 meses más o menos, si se justifica. La extrapolación se basa en el principio de la clásica relación de Arrhenius entre la temperatura y la tasa de reacción (degradación), asumiendo una reacción de orden pseudo-cero. Es una predicción simple y rápida de la estabilidad de la DS (12). Este enfoque es más aplicable para la DS que se considera que tiene buena estabilidad física y química demostrada durante el descubrimiento del fármaco. Se ha ganado la aceptación de este enfoque en un número de sometimientos. Un tercer enfoque es el uso de estudios de estrés en diversas condiciones acopladas con el modelo, como el Programa de Evaluación de Estabilidad Acelerada (ASAP) (13). El ASAP combina un protocolo de envejecimiento acelerado con una ecuación de Arrhenius corregida para humedad para proveer una predicción temprana para la DS y un período de uso de la DS. Este programa involucra análisis estadístico para modelos El conocimiento adquirido de estos estudios puede usarse para: soportar condiciones de almacenamiento y asignaciones del período inicial de reanálisis; diseñar futuros estudios de estabilidad; evaluar el impacto de las excursiones de temperatura; y seleccionar el empaque. más complejos de cinética de orden no simple de degradación en la DS y el DP, y produce predicciones más rápidas y confiables de estabilidad química. Para la DS o DP con desafíos de estabilidad química potencial, este enfoque puede ser muy útil para definir la condición de almacenamiento apropiado y utilizar el período dentro de un tiempo relativamente corto que permita el avance de los programas de desarrollo inicial. Lo que es más importante, el ASAP tiene potencial para un alcance más amplio de evaluación de la estabilidad para desarrollar la estrategia de control de estabilidad del DP, como es la predicción de 8 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 8 MAYO / JUNIO 2013 estabilidad a largo plazo y los requerimientos de empaque en la implementación de la QbD para comercialización. El ASAP ha sido utilizado por las compañías como parte de los sometimientos regulatorios en múltiples países y ha proporcionado la base para la justificación de la formulación, del empaque y del contenido de humedad. Existe un diálogo continuo entre la industria y las agencias regulatorias acerca de estas nuevas formas para la industria de cumplir sus obligaciones con respecto al aseguramiento de la aceptabilidad de los productos al final de sus vidas de anaquel. El conocimiento adquirido de estos estudios puede entonces ser utilizado para: soportar las condiciones de almacenamiento y las asignaciones del período de reanálisis inicial; el diseño de futuros estudios de estabilidad; evaluar el impacto de las excursiones de temperatura; y seleccionar el empaque. Los resultados también pueden ser usados para establecer el período de uso inicial para los productos basados en la DS (p.ej., PIB ó PIC). Los esquemas acelerados o de estrés pueden ahorrar tiempo para llegar a un primer estimado de la estabilidad del material. El período de reanálisis derivado de estos tipos de estudios acelerados o con estrés puede ser verificado posteriormente colocando el primer lote clínico en estudios de estabilidad en tiempo real bajo condiciones aceleradas y de largo plazo del ICH. Las extensiones futuras del período de reanálisis/uso pueden basarse en los datos en tiempo real. Asignación de la fecha de reanálisis. Los datos de estabilidad de la sustancia farmacéutica que se adecúan con la etapa de desarrollo, pueden ser generados para soportar el uso de la DS para la manufactura de suministros clínicos a través de un sistema que utilice las fechas de reanálisis. Cuando es necesario un período de reanálisis más prolongado, las extensiones son más comúnmente manejadas ya sea a través de un programa de estabilidad o a través de un programa de reanálisis específico para el lote. En los sometimientos se puede describir cómo se extenderá el período de reanálisis en el futuro. Si se utilizan los datos de estabilidad del segundo (HT/HH) o del tercer enfoque (ASAP), se extrapola un período de reanálisis a partir de la ecuación de Arrhenius o de la ecuación de Arrhenius corregida para la humedad (12). El análisis de estabilidad también se usa para soportar el período de uso de productos simples basados en la DS. Diseño de estudios de estabilidad del producto farmacéutico para el desarrollo inicial Selección del lote para estudios de estabilidad. Según se señaló antes, los suministros clínicos de la etapa inicial con frecuencia son simples formulaciones orales o polvos en frascos o polvos en cápsulas. Los estudios de estabilidad en esta etapa inicial necesitan respaldar el uso del producto en los estudios clínicos y facilitar más desarrollo. A menos que se requiera una formulación específica para los estudios en fase inicial (p.ej., debido a escasa solubilidad, pobre biodisponibilidad, la necesidad de formulaciones de una vez al día, o la necesidad de una formulación estéril inyectable), se emplea típicamente una simple forma farmacéutica sólida oral. Para la DS en cápsula o frasco, la estabilidad de la DS soportará el desarrollo en fase inicial, sin embargo, el suministro clínico puede ser colocado en estabilidad (p.ej., muestras de retención) y analizado, si es 27/05/13 16:31 necesario. El estudio continúa hasta el término del estudio clínico y podría también ser monitoreado en puntos de tiempo posteriores para incrementar el conocimiento del producto, si así conviene. Para productos formulados como dosis sólidas orales, pueden llevarse a cabo los estudios de preformulación y desarrollo del proceso para definir la formulación inicial. Estos estudios también proveerán información inicial de estabilidad sobre la DS y su compatibilidad con los excipientes, humedad, condiciones del proceso, y así sucesivamente. En esta etapa, puede fabricarse un lote de desarrollo (no GMP) y ponerse en estabilidad. Si este lote es representativo del suministro clínico (misma o cercana composición, proceso y empaque) puede soportar el sometimiento como IND/IMPD y la fecha de uso inicial para el producto. Si se requiere más de una potencia, puede usarse un diseño de estabilidad agrupado. Los cambios en el producto farmacéutico clínico necesitan ser evaluados y los lotes adicionales ser puestos en estabilidad, conforme sea necesario. Utilizando las mismas herramientas y procesos de pensamiento que se mencionaron en la porción de la DS de este artículo, el primer paso es determinar qué atributos del DP tienen un efecto sobre la estabilidad. Si el nuevo DP cambia uno o más de los atributos de calidad relacionados con la estabilidad, el nuevo lote deberá ser colocado en estabilidad. La identificación de estos atributos de calidad relacionados con la estabilidad puede facilitarse a través de evaluaciones de riesgo en papel, el conocimiento previo o a través de desafíos de la estabilidad a corto plazo. Los cambios que podrían impactar la estabilidad del producto incluyen cambios mayores en la DS (p.ej., forma sólida), cambios en la formulación (p.ej., relación de fármaco a excipiente, diferentes excipientes), cambios significativos al proceso (p.ej., compresión directa a granulación húmeda), y cambios en el empaque (p.ej., materiales de contacto, blíster contra frasco, cambio en tamaño/espacio vacío). Los cambios que improbablemente afecten la estabilidad para formas farmacéuticas orales simples incluyen cambios en la escala, el equipo y el sitio de manufactura. Vale la pena subrayar el punto de que los datos de estabilidad incluidos primero en los sometimientos regulatorios son con frecuencia justo el inicio de un programa. Requisitos mínimos para que un estudio de estabilidad soporte los sometimientos iniciales Número de lotes. Típicamente, los lotes son limitados en el desarrollo inicial. Como estos estudios clínicos son pequeños, seguido existe la necesidad de producir sólo un lote. Los materiales clínicos que se espera que sean usados sólo en las Fases 1 y 2a, los autores piensan que los datos a largo plazo colectados en el lote clínico o en un lote representativo del lote clínico pueden ser suficientes para asegurar la estabilidad del producto clínico en la primera fase del desarrollo. Para productos esta- bles, los lotes adicionales de la misma formulación no necesitan colocarse en estabilidad. Duración del estudio y puntos de tiempo. Los estudios deben generar datos que den la certeza de que los suministros clínicos conservan su calidad dentro de límites aceptables al menos a través del uso de los suministros en la clínica. Como los estudios clínicos en la primera etapa pueden ser relativamente cortos, los datos de estabilidad sólo necesitan soportar períodos de uso breves. Sin embargo, en muchos casos, se tienen en reserva muestras extra para extender los estudios durante más tiempo como asunto de practicidad; por ejemplo, si los suministros son necesarios para mayor duración que los planes iniciales debido a retrasos en el programa clínico. Como se señaló, la guía Q1A del ICH sobre análisis de estabilidad incluye recomendaciones para estudios de estabilidad para requerimientos de solicitud de comercialización aunque estos no pretenden respaldar los estudios clínicos iniciales. No obstante, muchos de los lineamientos del ICH son útiles, tales como las condiciones de almacenamiento y el espaciado de los puntos de tiempo. El espaciado de los puntos de tiempo debe estar diseñado para capturar la tendencia general de la estabilidad, señalando que puede ser deseable tener unos pocos puntos de tiempo iniciales durante los estudios de selección o estudios de estabilidad más formales para establecer una fecha de uso para el momento del sometimiento. Para el DP, la formulación en la fase inicial habitualmente no será usada en los estudios clínicos posteriores. Como tal, tiene poco valor realizar el estudio de estabilidad más allá del tiempo en la clínica. Las pruebas analíticas seleccionadas para los estudios de estabilidad deben cubrir los atributos de calidad que pueden cambiar con el tiempo. Típicamente, estas pruebas incluirían ensayo, impurezas (es decir, productos de degradación), liberación del fármaco (p.ej., desintegración o disolución) y descripción. Si la conversión quiral ha demostrado ser un problema en la DS, entonces ésta debe ser monitoreada en el DP. Puede no ser necesario realizar todas las pruebas en cada punto de tiempo dependiendo del propósito de la prueba. Los datos de los estudios de estrés HT/HH pueden ser útiles en la evaluación del impacto para las excursiones de temperatura y para diseñar estudios eficientes a largo plazo. Otro enfoque son los estudios de estrés acoplados con el modelo, como el ASAP que se discutió anteriormente. El ASAP en algunos casos puede dar un buen estimado del período de uso en un tiempo más corto que el enfoque tradicional de estabilidad a largo plazo. La fecha de uso derivada de la extrapolación del estrés puede ser verificada posteriormente colocando el primer lote clínico en estudios de estabilidad en tiempo real bajo las condiciones aceleradas y a largo plazo del ICH. Estrategia para asignar la fecha de uso y extensiones de la fecha de uso. La extrapolación de los períodos de uso es una práctica comúnmente aceptada y casi una necesidad en términos de obtener un producto clínico empacado, etiquetado, liberado y embarcado a los sitios clínicos con algo de tiempo se uso sobrante para el almacenamiento en los sitios clínicos. Ha habido mucho debate sobre cómo debe usarse la extrapolación del conocimiento existente de la estabilidad para establecer los períodos de uso de los suministros clínicos. Según se discutió al principio de este artículo, muchos factores determinarán la Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 9 MAYO / JUNIO 2013 9 27/05/13 16:31 Postura Oficial: GMPs en Fase Inicial cantidad de extrapolación que es defendible. Las autoridades de salud pueden estar reluctantes a aceptar extrapolaciones de más de 12 meses después de los datos de estabilidad a largo plazo existentes, pero es posible justificar más o menos la extrapolación con base en fundamentos científicos (ver la sección de colecta de datos de estabilidad de la DS). Un enfoque de ‘un tamaño se adapta a todos’ es difícil de lograr en términos de un número exacto de extrapolaciones permitidas, pero se recomienda un enfoque basado en la ciencia y el manejo del riesgo. Con suficiente conocimiento de la estabilidad de la DS y del producto farmacéutico y una formulación clínica estable, el riesgo para la calidad del material es bajo cuando se permiten extensiones del período de reanálisis/uso 12 meses más allá de los datos de estabilidad en tiempo real disponibles. Esto, no obstante, no sería apropiado para un producto farmacéutico inestable o uno para el cual existe conocimiento insuficiente de la estabilidad. Este enfoque basado en el riesgo se basa en tres principios: 1.) Los atributos de estabilidad que limitan la vida de anaquel están determinados de los estudios de desarrollo iniciales y de las condiciones apropiadas de empaque y almacenamiento seleccionadas. 2.) Las asignaciones de fecha de uso son monitoreadas y confirmadas a través de estudios tradicionales (tiempo real y acelerados) y acciones apropiadas tomadas cuando se requiere. 3.) Las compañías tienen procedimientos internos que describen procesos para establecer y extender las fechas de uso iniciales. Los procedimientos internos para actualizar las asignaciones de la fecha de uso normalmente involucran la coordinación del reetiquetado clínico y en algunos casos de los sometimientos del CMC. Vale la pena subrayar el punto de que los datos de estabilidad incluidos primero en los sometimientos regulatorios son con frecuencia justo el inicio de un programa para monitorear la estabilidad de los suministros clínicos, y el monitoreo continuo para confirmar las demandas de almacenamiento y las tendencias iniciales pueden ser muy útiles para productos que continúan el desarrollo. Los autores respaldan la siguiente recomendación de A. Kane: Las compañías con frecuencia luchan con la estrategia para actualizar las asignaciones del período de reanálisis/uso a lo largo del desarrollo y las consiguientes actualizaciones a los sometimientos del CMC para dossiers del tipo IND e IMPD. “Podría decirse que la preferencia de muchos solicitantes sería actualizar las asignaciones conforme se generaran más datos de estabilidad sin necesidad del sometimiento de una enmienda sustancial. Para evitar la necesidad para enmiendas sustanciales posteriores, el IMPD debe contener la especificación propuesta y proporcionar una explicación clara de cómo se aplica o aplicará la extrapolación para asignar el período de reanálisis/uso” (14). Es opinión del autor que con un programa de monitoreo bien planeado, la extrapolación con datos iniciales limitados está justificada. Conclusiones La demostración de estabilidad para suministros clínicos debe ser conducida por medio del conocimiento científico adquirido en el desarrollo así como en una evaluación basada en el ries10 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 10 MAYO / JUNIO 2013 go para orientar el uso eficiente de recursos disponibles. En el desarrollo inicial, los esfuerzos clínicos están con frecuencia concentrados en productos relativamente simples con ciclos de vida cortos y la DS de la cual están hechos es con frecuencia producida al evolucionar los procesos químicos. Los esfuerzos para determinar la estabilidad de la DS y del producto farmacéutico deben ajustarse para esta fase del desarrollo y están diseñados para dar la información de estabilidad más básica, esto es, asegurar que la DS es de calidad adecuada cuando se usa para la manufactura del producto y que el producto farmacéutico es de calidad adecuada mientras está en la clínica. Para hacer esta evaluación, pueden usarse simples estudios de estabilidad utilizando la guía del ICH y/o datos obtenidos en condiciones aceleradas o de estrés. Pueden colectarse otros datos experimentales para incrementar el conocimiento científico de la DS/DP. Esperamos que la aportación de los enfoques para la estabilidad en fase inicial descritos aquí, junto con los enfoques en esta serie de artículos de las otras áreas del grupo de trabajo de GMPs en Fase Inicial de IQ, le den una plataforma para estimular las discusiones sobre estos enfoques dentro de la industria y con las autoridades de salud de todo el mundo. Para estimular más diálogo, este grupo de trabajo de IQ está planeando un taller en el futuro cercano para promover un debate robusto y discusiones sobre estos esquemas. Tenemos la esperanza de que estas discusiones proveerán una mejor alineación entre desarrollo, la vigilancia de QA y el área regulatorio dentro de la industria farmacéutica y de manera más importante con las autoridades de salud mundiales. El acuerdo entre la industria y las autoridades de salud con respecto a los esquemas aceptables para los estudios de estabilidad en las fases iniciales del desarrollo de fármacos sería claramente benéfico para los científicos de desarrollo y permitiría un esquema más ágil y flexible para abordar mejor el entorno dinámico típicamente encontrado durante las fases iniciales del desarrollo clínico, proporcionando mientras tanto controles apropiados para garantizar la seguridad del paciente. Renuncia Este artículo representa la opinión de los autores y no necesariamente la de sus respectivas compañías. Referencias 1.A. Eylath et al., Pharm. Technol. 36 (6) 54–58 (2012). 2.21 CFR Part 211.166 Stability Testing. 3.CHMP, CHMP/QWP/185401/2004, Requirements to the Chemical and Pharmaceutical Quality Documentation Concerning Investigational Medicinal Products in Clinical Trials (EMA, Mar. 31, 2006). 4.D. Chambers et al., Pharm. Technol. 36 (7) 76–84 (2012). 5.R. Creekmore et al., Pharm. Technol. 36 (8) 56–61 (2012). 6.FDA, Guidance for Industry: cGMP for Phase 1 Investigational Drugs (Rockville, MD July 2008). 7.FDA, Guidance for Industry: Content and Format of Investiga tional New Drug Applications (INDs) for Phase 1 Studies of Drugs, Including Well Characterized, Therapeutic, Biotechnology Derived Products (Rockville, MD, November 1995). 8.FDA, Guidance for Industry: INDs for Phase 2 and Phase 3 Studies Chemistry, Manufacturing, and Controls (Rockville MD, May 2003). “GMPs en el Desarrollo Inicial para Estabilidad Perspectiva de la Industria (Parte IV)” continúa en la pág. 20 27/05/13 16:31 Tecnología Analítica de Proceso Avances en el PAT para la manufactura de fármacos parenterales Patricia Van Arnum La aplicación de la calidad por diseño y la tecnología analítica deproceso facilita la comprensión del proceso y el control de varias operaciones en la liofilización. C uando la FDA anunció en 2 0 0 2 una nueva iniciativa, Buenas Prácticas de Ma nufactura Farmacéutica Actuales (CGMPs) para el Siglo XXI, y posteriormente publicó su reporte, CGMPs Farmacéuticas para el Siglo XXI - Un Enfoque Basado en el Riesgo, en 2004, empezó un esfuerzo para aumentar la calidad del producto y modernizar la manufactura farmacéutica a través de un enfoque basado en la ciencia y en el riesgo bajo los principios de calidad por diseño (QbD) (1). Este esfuerzo fue además estimulado por la emisión de la guía sobre tecnología analítica de proceso (PAT) en 2004 para facilitar para facilitar las nuevas tecnologías que mejorarían el conocimiento del proceso y asistirían en la identificación y control de los puntos críticos en un proceso (2). Estas tecnologías incluyen: dispositivos de medición apropiados, los cuales pueden colocarse en, dentro o en línea; herramientas estadísticas o de tecnología de la información; y un enfoque de sistemas científicos para el análisis de datos para controlar los procesos y asegurar la producción de materiales en proceso y productos finales de la calidad deseada (1-4). La liofilización es una aplicación específica de la QbD y del PAT en la manufactura de fármacos parenterales, y una revisión de la literatura reciente muestra varios desarrollos en este campo. Evaluación de la tecnología En la aplicación de la QbD al proceso de liofilización, la primera tarea en definir los parámetros que tienen el potencial de afectar el desempeño del proceso y los atributos de calidad del producto (5). Los puntos clave incluyen los parámetros de operación del proceso de secado por congelamiento, los parámetros de la formulación, el equipo y la preparación de componentes y los dispositivos (5). El PAT puede aplicarse a través de sensores en varias etapas del liofilizado, lo cual puede incluir el uso de sensores de temperatura , análisis de elevación de presión, mediciones de temperatura manométrica, calorimetría, microscopía y técnicas espectroscópicas, tales como el infrarrojo cercano (NIR), Raman y espectroscopía de infrarrojo (6). Evaluación de las herramientas Un enfoque establecido para el PAT en la liofilización es ofrecido por la tecnología del secado por congelamiento SMART de SP Scientific, la cual es utilizada para optimizar el ciclo de secado por congelamiento. La tecnología SMART fue desarrollada por la Universidad de Connecticut y la Universidad de Purdue a través del Centro para la Investigación de los Procesos Farmacéuticos y autorizada a SP Scientific. La tecnología se apoya en el uso de la medición de la temperatura manométrica, la cual calcula la temperatura del producto en la interfase de sublimación sin tener que colocar termopares u otros sensores de temperatura en los viales del producto (7). La tecnología de secado por congelamiento SMART es usada en el congelador de desarrollo Lyostar 3 de SP Scientific. La tecnología SMART usa información, como es el número de viales, el volumen de llenado, el peso del llenado, el volumen de la cámara del secador por congelamiento y la temperatura de formulación crítica para optimizar un ciclo (8). Ésta contribuye con varios puntos clave en liofilización: selecciona un ciclo óptimo de congelamiento que se basa en si la formulación es cristalina o amorfa; selecciona la presión óptima de la cámara; determina la temperatura objetivo del producto y ajusta el secado del anaquel durante el secado primario para mantener el producto en una temperatura objetivo predeterminada (8). SP Scientific se ha asociado con la compañía de gas industrial Praxair para otra herramienta basada en el PAT para liofilización, ControLyo Nucleation on Demand Technology de Praxair, usada para controlar la nucleación de la solución del producto en el secador por congelamiento. Las compañías se asociaron primero en 2010, lo que le dio Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 11 MAYO / JUNIO 2013 11 27/05/13 16:31 Tecnología Analítica de Proceso a SP los derechos globales, exclusivos para comercializar la tecnología en liofilizadores de desarrollo. En 2012, las compañías expandieron su colaboración para permitir a SP Scientific equipar sus secadores clínicos, piloto y de producción con la Tecnología ControLyo y transferir la tecnología para permitir que SP adecúe las unidades piloto y de producción existentes. IQ Mobil Solutions, ubicada en Holzkirchen, Alemania, ofrece sensores inalámbricos y sin baterías (Sistema de Interrogación de Temperatura Remota, TEMPRIS) como una herramienta PAT para liofilización. En un estudio reciente, el sistema TEMPRIS fue valorado para la medición de la exactitud, la capacidad de detección exacta del punto final, y el efecto del posicionamiento utilizando corridas de producto con sacarosa, manitol y trehalosa (9). Los datos fueron comparados con las mediciones con termopares de calibre 36 y con medición no invasiva de la temperatura a partir de mediciones de temperatura manométrica. Los resultados mostraron que los perfiles de temperatura del TEMPRIS concuerdan con los datos de los termopares cuando los sensores se colocaron en el fondo, en el centro del vial. Adicionalmente, los sensores del TEMPRIS revelaron perfiles de temperatura confiables e indicaciones de punto final relacionadas con los datos del termopar cuando se monitorearon los viales en la posición del borde (9). Los investigadores en la Universidad Ghent en Bélgica utilizaron espectroscopía Raman y NIR como herramientas PAT en un proceso de secado por congelamiento (10). Para el estudio, las sondas del Raman y del La espectroscopía Raman proporcionó datos acerca del estado sólido del manitol, el punto final del congelamiento y varias condiciones físicas y químicas (p.ej., inicio de la nucleación del hielo e inicio de la cristalización del manitol). La espectroscopía NIR monitoreó los puntos clave en el secado, el punto final de sublimación del hielo y la liberación del agua de hidratos durante el almacenamiento (10). Un estudio posterior examinó además el uso de los analizadores de proceso espectroscópicos en línea (Raman, NIR y espectroscopía de emisión de plasma) (11). Otro estudio reciente examinó el uso de espectroscopía de absorción con láser de diodos sintonizable (TDLAS) para el monitoreo del secado secundario en el liofilizado a escala de laboratorio con el propósito de dirigirse a los contenidos de humedad intermedia en el producto (12). Un estudio inicial examinó el TDLAS para determinar la temperatura promedio del producto en el secado primario (13). Otros enfoques Los investigadores recientemente implementaron y evaluaron un sistema de fibra óptica como herramienta de monitoreo del proceso durante la liofilización. El estudio registró los perfiles de temperatura del manitol, sacarosa y trehalosa utilizando varios prototipos de sensores de fibra óptica (OFSs) (14). Los datos se compararon con los datos obtenidos con termopares convencionales o manometría Pirani/capacitancia con respecto al punto final del secado primario. Los investigadores reportaron que los datos obtenidos con el OFS en Un estudio reciente evaluó un sistema de fibra óptica como herramienta de monitoreo del proceso. NIR se construyeron en la cámara del liofilizador para permitir el monitoreo simultáneo del proceso de una solución de manitol al 5% (p/v). Los espectros Raman y NIR fueron colectados continuamente durante el secado por congelamiento y se analizaron utilizando análisis de componentes principales y resolución multivariada de la curva (19). 12 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 12 contacto con el producto estuvieron en buena concordancia con los datos obtenidos mediante los termopares o la manometría Pirani/capacitancia. Los OFSs mostraron mayor sensibilidad, respuesta más rápida y mejor resolución en comparación con los termopares (14). Otro estudio examinó el uso de un sensor suave para el monitoreo en línea del paso de secado primario de un proceso de secado por congelamiento en viales (15). Referencias 1.FDA, Pharmaceutical CGMPs for the 21st Century—Risk-Based Approach: Final Report (Rockville, MD, 2004). 2.FDA, Guidance for Industry: PAT—A Framework for Innovative Pharmaceutical Development, Manufacturing and Quality Assurance (Rockville, MD, 2004). 3.FDA, Progress Report on Process Analytical Technology, www.fda.gov/Drugs/ DevelopmentApprovalProcess/Manufacturing/QuestionsandAnswersonCurrentGoodManufacturingPracticescGMPforDrugs/ucm072006.htm, accessed Feb. 13, 2013. 4.P. Van Arnum, Pharm. Technol. 36 (9), 38-40 (2012). 5.F. Jameel and W.J. Kessler, “Real-time Monitoring and Controlling of Lyophillization Process Parameters Through Process Analytical Technology Tools,” in PAT Applied in Biopharmaceutical Process Development and Manufacturing: An Enabling Tool for Quality by Design, C. Undey et al., Eds. (CRC Press, Taylor & France, Boca Raton, FL, 2012), pp. 241-243. 6.R.B. Shah et al., “Scientific and Regulatory Overview of Process Analytical Technology in BioProcesses,” in PAT Applied in Biopharmaceutical Process Development and Manufacturing: An Enabling Tool for Quality by Design, C. Undey et al., Eds. (CRC Press, Taylor & France, Boca Raton, FL 2012), p. 5. 7.D. Sesholtz and L. Mather, “’Smart Freeze Drying,” Innovation in Pharm. Technol., www.biopharma.co.uk/wpcontent/uploads/2010/07/Smart_Freezedr y ing _ a r ticle _ 20 07, accessed Feb. 13, 2013. 8.Shon, “Optimization of Primary FreezeDrying Cycle Times,” Innovation in Pharm. Technol., www.iptonline.com/ pdf_viewarticle.asp?cat=7&article=887, accessed Feb. 13, 2013. 9.C. Schneid and H. Giessler, AAPS PhamSciTech. 9 (3), 729-739 (2008). 10. R.M. De Beer et al., J. Pharm. Sci. 98 (9),3430-3446 (2009). 11. R.M. De Beer et al., Talanta 83 (5), 16231633 (2011). 12. S.C. Schneid et al., AAPS PharmSciTech. 12 (1), 379-387 (2011). 13. C. Schneid et al., J. Pharm. Sci. 98 (9), 3406-3418 (2009). 14. J.C. Kasper et al., Eur. J. Pharm. Biopharm. online, DOI 10.1016/j.ejpb.2012.10.009, 15 Nov. 2012. 15. S. Bosca, A.A. Barresi and D. Fissore, Pharm. Dev. Technol., online, DOI 10.3109/10837450.2012.757786, Jan. 22, 2013. PT MAYO / JUNIO 2013 27/05/13 16:31 Avances de las pruebas analíticas e instrumentación para biofarmacéuticos También en enero del 2013, Perkin Elmer lanzó la estación de trabajo automatizada JANUS BioTx Pro para un proceso mejorado de desarrollo de proteínas. La estación de trabajo está diseñada para purificación de proteínas en pequeña escala, de alto rendimiento (de µg a mg de proteínas) y acomoda múltiples modos de cromatografía (columna, punta y lote). Ésta también soporta herramientas de selección en placas comercialmente disponibles y basada en columnas, tales como las placas GE PreDictor, las columnas PhyNexus PhyTip, y las columnas Atoll. Las aplicaciones para la estación de trabajo incluyen estudios de unión a resinas y selección de condiciones. En mayo del 2012, Shimazdu lanzó un Analizador de Glicanos Accurate 2 (AGA2) mejorado, el cual provee una base de datos de glicanos y la Resonancia AXIMA de la compañía, un MALDI (desorción/ ionización de láser asistido con matriz)-QIT (trampa de iones quadrupolo)-espectrómetro de masas TOF (tiempo de vuelo). El AXIMA Resonancia está acoplado a una base de datos que contiene información estructural de glicanos generada a partir de espectros de MSn reales para seleccionar picos precursores hasta MS4. Los espectros resultantes son interpretados para regresar la estructura del glicano más probable. El AGA2 fue creado a partir de glicanos biosintetizados y contiene glicanos bien definidos y caracterizados, biológicamente relevantes. También usa esquemas comunes de marcado con fluorescencia, incluyendo la 2-aminopiridina, el ácido 2-aminobenzoico y la 2-aminobenzamida, y otros tipos de marcado con fluorescencia. En febrero de 2013, Thermo Fisher Scientific expandió su portafolio de análisis de alto contenido con tres nuevas soluciones en biología celular: el Lector Thermo Scientific ArrayScan XTI High Content Analysis (HCA, la Plataforma Thermo Scientific CellInsight NXT HIgh Content Screening (HCS), y la actualización del Thermo Scientific X1 para clientes actuales del ArrayScan VTI. Cada uno de estos productos presenta una cámara de gran formato, CCD (dispositivo cargado-acoplado) sensible, la suite para el software Thermo Scientific HCS Studio, y mayores capacidades de proceso. La cámara Thermo Scientific X1 CCD, usada para análisis de alto contenido, ofrece mejor sensibilidad, mayor resolución y un gran campo de visión. Thermo Fisher Scientific también introdujo la columna Thermo Scientific Dionex GlycanPac AXH-1 HPLC, la cual está diseñada para la separación simultánea de glicanos biológicamente importantes con base en la carga, el tamaño y la polaridad. La columna está diseñada para separar glicanos tanto marcados como nativos con base en la disponibilidad de las muestras. La separación de glicanos nativos le permite a los investigadores eliminar el paso de arcado fluorescente e incrementar el rendimiento. En 2012, Agilent Technologies se asoció con el Centro para Ciencias Ómicas de España en metabolómicos basados en RMN (resonancia magnética nuclear) y espectrometría de masas y automatización para usar en biología de sistemas integrados. El Centro para Ciencias Ómicas (COS) fue establecido por la Universidad de Rovira i Virgili en colaboración con el Centro Tecnológico de Nutrición y Salud de España. El COS abrió en septiembre de 2012 y está equipado con instrumentación de Agilent. El COS es un centro de excelencia, donde Agilent demostrará los flujos de trabajo en biología integrados en genómica, proteómica, transcriptómica{ lipidómica y metabolómica. En noviembre de 2012, Bruker lanzó METALJET, una fuente brillante microfocal de rayos X para aplicaciones en biología estructural. METALJET es una opción para los sistemas de cristalografía de proteínas D8 VENTURET y para sistemas de Dispersión de Rayos X en Ángulo Pequeño (SAXS) NANOSTAR. La fuente METALJET para los sistemas de biología estructural de Bruker fue desarrollada en colaboración con Excillum AB e Incoatec GmbH para usar en cristalografía de proteínas y aplicaciones de SAXS. Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 13 MAYO / JUNIO 2013 Chad Baker/Getty Images Conforme las compañías biofarmacéuticas/ farmacéuticas incrementan su desarrollo de fármacos basados en biológicos, las compañías que proveen la instrumentación analítica y los bienes y servicios a laboratorios de análisis están, a su vez, ofreciendo herramientas mejoradas para la caracterización de biológicos, la biomanufactura y el análisis relacionado. En diciembre de 2012, Sartorius Stedim Biotech (SSB) expandieron sus capacidades de software para tecnología analítica de proceso asociándose con Umetrics, un proveedor de tecnología multivariada, incluyendo el software para el diseño de experimentos (DoE) y el análisis de datos multivariados (MVA). Bajo el pacto, SSB asume la comercialización global y la distribución del portafolio de Umetrics para las industrias farmacéutica y biofarmacéutica e integrarán los programas de software de Umetrics como productos de marca propia dentro de su propio portafolio de bioproceso y comercializar éstos como soluciones autónomas bajo un convenio de marca dual. Las principales áreas para estos sistemas de software son los pasos críticos de proceso, tal como los procesos de cultivo celular o pasos de purificación específicos. El MVA permite que los parámetros del proceso sean sumados en trayectorias del lote, y el programa de DoE permite que estos parámetros críticos del proceso sean identificados y cuantificados. En enero de 2013, Waters expandió su plataforma biofarmacéutica con UNIFI, nuevas columnas de cromatografía de líquidos de ultra-resolución (UPLC) ACQUITY CSH130 C18 y XSelect HPLC CSH130 C18 para mapeo de péptidos, y tres kits GlycoWorks para marcado de glicanos y preparación de muestras. Estos productos son un avance en el análisis bioterapéutico de rutina, particularmente para glicoproteínas que requieren análisis de modificaciones de glicanos así como análisis estructural a nivel proteína y a nivel péptido. La plataforma biofarmacéutica reúne la tecnología de caracterización UPLC/espectrometría de masas (MS) con el sistema de información científica UNIFI que fue primero desarrollado para análisis de masa de proteínas intactas, mapeo de péptidos, y soporte de bioseparaciones generales. La expansión soporta una mezcla de MS con tiempo de vuelo quadrupolo (Q-TOF) e instrumentos de detección óptica dentro de un grupo de trabajo de laboratorio en red. La aplicación recientemente liberada Glycan expande las capacidades de la plataforma para respaldar la asignación de rutina y el perfilado de glicanos liberados utilizando detección con fluorescencia. La combinación de separaciones UPLC HILIC (cromatografía de líquidos con interacción hidrofílica) de alta resolución, los estándares de calibración y los reactivos de la compañía y el acceso al Instituto Nacional de Irlanda para Investigación y Capacitación en Bioprocesos (NIBRT)/base de datos de referencia de la unidad de glicano GlycoBase 3+ UPLC de Waters permite las asignaciones, la cuantificación y el perfilado de glicanos. Desarrollado por el grupo de trabajo del Profesor Pauline Rudd en NIBRT, la base de datos GlycoBase 3+ es un depositario de datos de retención cromatográfica de glicanos, expresados en unidades de calibración de glucosa, y el cual abarca series de estructuras de glicanos asociadas con glicoproteínas bioterapéuticas. 13 27/05/13 16:31 DENTRO DE LA USP Anthony J. DeStefano, PhD es vicepresidente senior, capítulos generales y estándares de calidad en la Convención REGULACIÓN Y CUMPLIMIENTO de la Farmacopea de Estados Unidos. Modernización de los Estándares USP La Convención de la Farmacopea de EUA continúa teniendo como prioridad en el 2013 la modernización de los estándares. L a modernización de las monografías y de los capítu- rencia de Procedimientos Analíticos; <1225> Validación de los generales estándar continuará siendo una priori- Procedimientos Compendiales; y <1226> Verificación de dad máxima para la Convención de la Farmacopea Procedimientos Compendiales. Aunque la USP-NF especifica de EUA (USP) en 2013. La USP también continuará que sólo los resultados obtenidos mediante métodos y prodesarrollando y modificando los capítulos generales que tie- cedimientos en el compendio se consideran concluyentes, la nen un amplio impacto en múltiples monografías que aparecen USP-NF provee lineamientos en el Capítulo General <1225> en todas sus publicaciones compendiales -Farmacopea de los sobre la validación de procedimientos no compendiales para Estados Unidos y el Formulario Nacional (USP-NF), Food aquéllos que desean utilizar métodos alternativos para la evaChemical Codex, Compendio de Medicamentos, Compendio luación de conformidad. En el Capítulo General <1226>, la de Suplementos Dietéticos, USP sobre Mezclado (galénica), USP-NF provee guías sobre la verificación -una demostración y Compendio de Medicamentos del usuario de que un artículo es Herbolarios. Las prioridades de adecuado para ser analizado por La USP evaluará todas las la modernización también han métodos y procedimientos desfactorizado en la expansión de buenas prácticas de distribución critos en el compendio. En gelas capacidades del laboratorio neral, la USP también está evadisponibles para productos en los sitios internacionales de luando más estrechamente los la USP en Brasil, China e India enfoques estadísticos aplicados a farmacéuticos. así como en sus oficinas cenla validación y verificación que trales en Rockville, Maryland. Estas capacidades mejoradas les permitiría a los fabricantes pronosticar que sus procedisoportarán los esfuerzos de desarrollo de los estándares de mientos se ajustarán a los objetivos. referencia internos de la USP. Buenas prácticas de distribución Pruebas de identificación En el área de las pruebas de identificación, la USP ha estado recurriendo cada vez más al uso de pruebas instrumentales como alternativas para las pruebas más viejas y menos específicas. El Comité de Expertos de Análisis Químico de la USP le ha dado a la modernización del Capítulo General <191> Pruebas de Identificación - General, una alta prioridad durante el ciclo 2010-2015 de la USP, particularmente debido a la relevancia directa del capítulo general para cientos de monografías en la USP-NF, muchas de las cuales están actualmente modernizándose por sí mismas. Mucho del trabajo del Comité de Expertos se basará en la retroalimentación de una encuesta a fabricantes realizada por la USP en 2011, en la cual el 92% de quienes respondieron reportaron el uso de las pruebas tradicionales de química húmeda para la identificación. Dentro de este grupo, el 64% también reporto el uso de métodos adicionales de análisis instrumental que son más específicos -un indicador para la necesidad de modernizar esta prueba para la identidad de una muestra de material. Validación y verificación en control de calidad Para los fabricantes, la validación y verificación de procedimientos analíticos juega papeles importantes en las actividades de control de calidad del laboratorio. La USP ha establecido un Panel de Expertos que propondrá modificaciones a los tres Capítulos Generales de la USP: <1224> Transfe14 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 14 Otra área principal de actividad en el 2013 para los Capítulos Generales de la USP será el desarrollo de un conjunto de capítulos generales relacionados con asuntos de la cadena de suministro. En 2012, la USP fue anfitriona de un taller público para fabricantes, profesionistas, reguladores y otras partes interesadas para obtener retroalimentación sobre una propuesta inicial para un capítulo general de información de la USP titulado <1083> Integridad de la Cadena de Suministro. El propósito del capítulo general fue proporcionar un recurso para todas las partes, sin importar el tamaño y papel en la cadena de suministro global, para la producción, distribución, y entrega de medicamentos a paciente4s. En un nuevo enfoque planeado, la USP evaluará todas las buenas prácticas de distribución disponibles para productos farmacéuticos, sustancias farmacéuticas, excipientes, suplementos dietéticos, preparaciones galénicas y otras subcategorías de artículos compendiales. Se espera que esto le permita a la USP desarrollar una nueva estructura para las buenas prácticas de distribución que abarcarán a los capítulos generales de información relacionados con los sistemas de gestión de la calidad, gestión del control ambiental, importación y exportación e integridad de la cadena de suministro. Referencias 1. USP, “2011 USP Identification Testing Methods Survey” (USP, 2011). PT MAYO / JUNIO 2013 27/05/13 16:31 Marque en la tarjeta de servicio al lector el No. 4 PT MAYO / JUNIO.indd 15 27/05/13 16:31 SOLUCIONES INTERNAS Susan J. Schniepp es vicepresidente de calidad y asuntos regulatorios en Allergy Laboratories Inc. y es miembro REGULACIÓN Y CUMPLIMIENTO del Consejo Consultor Editorial de PharmTech. El error humano detrás del error humano Debe realizarse una investigación minuciosa de todas las posibles causas de desviación. L a investigación de desviaciones es un elemento importante en el cumplimiento de las cGMP. Las investigaciones bien realizadas y documentadas son cruciales para cualquier operación de manufactura de una compañía. Existen numerosas clases de capacitación y seminarios destinados a demostrar cómo conducir investigaciones apropiadas y minuciosas. Incluso con todo esto disponible, persiste un sobre uso de “error humano” atribuido como causa raíz. Este sobre uso representa pérdida de oportunidades para reducir problemas futuros mediante la identificación de la verdadera causa raíz de una desviación. En este punto es el error humano en el Error Humano. La pregunta que necesita ser respondida durante la investigación inicial en una desviación es ¿qué causó que el empleado cometiera el error humano? El hacerse esta pregunta al principio de la investigación lleva a una mejor identificación de la causa raíz y a oportunidades para la mejora continua. ¿Cómo se reduce el “error humano” como causa raíz de los problemas? Hay tres elementos clave requeridos para minimizar efectivamente el error humano como causa raíz detrás de una desviación: documentación bien escrita y concisa (p.ej., PNOs y registros de lote), capacitación efectiva sobre dichos procedimientos y ejecución apropiada en el desempeño de los pasos. Cuando estos elementos están en su sitio y funcionando entonces el uso de errores humanos, como causa raíz, deben ser pocos y alejados entre sí. Ver cada uno de estos elementos en más detalle para asegurar que cumplen su propósito, puede ayudar a las compañías a llegar a la causa raíz real de un problema en lugar de sólo desestimar un evento como error humano. Documentación La documentación está destinada a detallar de manera concisa y comprensible una serie recurrente de instrucciones que, si se llevan a cabo apropiadamente y en orden, deben producir un resultado predecible. Estas instrucciones deben estar escritas de manera clara y sucinta y con suficiente detalle, de manera que la operación que describe pueda ser ejecutada con éxito por individuos entrenados. Todos los documentos asociados con una actividad necesitan ser sincronizados de manera que la información sea consistente entre los documentos. Por ejemplo, los PNOs pueden contener instrucciones de muestreo pero los registros de lote maestro indican cuándo deben tomarse las muestras. Las instrucciones entre los dos documentos no deben ser ambiguas o contradictorias. Adicionalmente, debe evitarse el texto subjetivo con palabras tales como “inmediatamente”. En lugar de utilizar la palabra “in16 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 16 mediatamente”, las instrucciones deben definir los elementos necesarios para la tarea a ser realizada de manera apropiada. También es importante escribir las instrucciones para la audiencia a la que van dirigidas. En algunos casos, la fuerza de trabajo puede estar educada en el idioma inglés, aunque puede ser que no sea el idioma materno dominante. Evitar los términos coloquiales o la jerga popular ayudará a asegurar que todos los empleados comprendan las instrucciones. Capacitación Una vez que está establecido el contenido del documento, los empleados que realizan la función descrita deben ser apropiadamente capacitados. La capacitación cabal de un empleado debe ser un enfoque multifase. Inicialmente, el empleado debe leer todos los documentos relacionados que definen la tarea y preguntar cualquier duda que pudieran tener de su supervisor. Una vez que el capacitado ha comprendido la documentación escrita, debe asociarse con un empleado experimentado. Muchas compañías tropiezan en este paso en el departamento de capacitación porque con frecuencia solo asocian al nuevo empleado con el empleado experimentado más conveniente sin detenerse a pensar si el empleado experimentado tiene la capacidad para entrenar a otro en su área de experiencia. Las compañías deben invertir tiempo evaluando quiénes de su personal con experiencia tiene la habilidad y paciencia para enseñar una actividad a una persona en capacitación. El supervisor debe también permanecer en el circuito a través de esta fase de la capacitación para ayudar a enfatizar la importancia de la actividad en la manufactura del producto. El supervisor y el entrenador designado deben ambos acordar cuando el capacitado se siente cómodo realizando una función sin supervisión constante. Cuando los empleados están apropiadamente entrenados y comprenden la actividad que están realizando, es menos probable que cometan un error. Realización y ejecución Después de que los documentos de control están establecidos y los empleados están apropiadamente capacitados, éstos necesitan monitorear su propio desempeño conforme al estándar establecido durante el entrenamiento. El proceso para monitorear el desempeño debe incluir el uso de métricas. Las métricas podrían incluir el rastreo de qué tan frecuente se escriben desviaciones para una operación particular o sobre un empleado particular. El análisis de estos datos podría “El error humano detrás del error humano” continúa en la pág. 25 MAYO / JUNIO 2013 27/05/13 16:31 Novedades Regulatorias Cuando los fármacos y biológicos están en desabasto o llevan precios altos, los médicos y otros proveedores parecen desear comprar medicamentos de orígenes desconocidos, ignorando la posibilidad de que esos productos pudieran estar adulterados, falsificados o que sean inefectivos. Una respuesta de los funcionarios de la FDA es idear un método para identificar productos que cumplen los estándares de calidad. Si dicha designación se tradujera en mayores ventas, se estimularía a los fabricantes a invertir más en mejorar sus instalaciones de producción, particularmente las que hacen productos inyectables estériles, de acuerdo a Janet Woodcock, directora del Centro para Evaluación e Investigación de Fármacos (CDER), y Marta Wosinska, director del personal de economía del CDER. Escribiendo en “Farmacología Clínica y Terapéutica”, los reguladores describen cómo los fabricantes de genéricos compiten en precio y no en calidad, debido a que los compradores consideran a todos los genéricos igualmente efectivos y seguros y con frecuencia no pueden vincular los problemas de seguridad con productos o pacientes específicos (1). De esta forma, el mercado fracasa para recompensar la calidad del producto y estimula a los fabricantes a reducir costos minimizando la inversión en la producción de calidad. La propuesta de la FDA es proporcionarle a los compradores y los pagadores “Métricas significativas de calidad en la manufactura”, similares a las medidas de calidad usadas para calificar a los restaurantes, crear tarjetas de calificación HMO, o identificar vitaminas que cumplan los criterios de la Farmacopea de los Estados Unidos. Más falsificaciones A pesar de toda la publicidad y las alertas que advierten contra la compra de medicamentos fraudulentos y no aprobados, la FDA recientemente descubrió más versiones falsificadas del fármaco para cáncer de Roche, Avastin (bevacizumab) circulando en el sistema de salud de EUA. El fármaco está siendo distribuido por Medical Device King (también conocido como Pharmacological), y las pruebas de laboratorio muestrean que algunos lotes no tienen ningún ingrediente activo. La FDA amonestó a los médicos a tener cuidado de medicamentos que llevaran grandes descuentos y que parecieran “demasiado bueno para ser verdad”. Éstos son probablemente falsificados, y el gobierno federal está metiendo a los distribuidores a la cárcel y levantando cargos contra los médicos que compran los fármacos con conocimiento de causa. Ayuda con mejores etiquetas Una regla de la FDA adoptada en 2006 les pedía a los fabricantes de fármacos y biológicos que actualizaran el etiquetado de productos nuevos y recientemente aprobados de manera que la información para prescribir fuera más clara y más útil para los profesionales de la salud. Desafortunadamente, sólo el 15% de todos los fármacos y biológicos han adoptado la Regla del Etiquetado para Médicos (PLR), en gran medida debido a que sólo aplica a terapias aprobadas después de Junio del 2001. Los fármacos genéricos obtienen un pase, por otra parte, a menos que el innovador cambie su etiqueta, lo cual no ha ocurrido para muchos productos más antiguos en donde las marcas ya no están en el mercado. Para alentar la mayor adopción del formato PLR, el CDER está ofreciendo darles a los fabricantes un proyecto de etiquetado PLR y asistencia para la conversión al nuevo formato de etiquetado. El CDER anunció la propuesta en el Federal Re- gister de Feb. 6 2013 y solicita comentarios sobre cómo ayudar mejor a la industria con la conversión del etiquetado (2). Vigilancia de seguridad en tiempo real La FDA está desarrollando su sistema Mini-Sentinel para el monitoreo de la seguridad y desempeño de fármacos después de que éstos entren al mercado cambiando al Sistema Sentinel completo previsto por la legislación 2007 de la FDA. El plan es establecer un “sistema sostenido de vigilancia activa” que pueda servir como un “recurso nacional” para evaluar múltiples problemas de salud, explicó Janet Woodcock, del CDER, en el 5o. Taller Público de la Iniciativa Sentinel en enero de 2013. El Mini-Sentinel ha operado a través de un modelo de base de datos distribuida que obtiene respuestas a preguntas de seguridad de fármacos desde una red de sistemas de datos de salud. Durante los cinco años pasados, el programa ha establecido operaciones centrales, métodos de investigación, y protocolos para analizar las evaluaciones de seguridad de los fármacos, Con la caducidad del programa mini-sentinel a finales del 2014, Woodcock prevé un consorcio más amplio, el cual puede incluir a los fabricantes farmacéuticos que pueden tener acceso a datos del sistema actual y de fuentes adicionales para respaldar la calidad del producto. La investigación metodológica adicional explorará maneras de asegurar que los resultados de las operaciones del Sentinel sean válidas y que el Sentinel respalde “el bien público”. Sunshine al fin El objetivo de la largamente esperada regulación federal “Sunshine” (luz de sol), publicada en Feb. 1o. 2013, por los Centros para Servicios de Medicare y Medicaid (CMS), es evitar la indebida influencia de la industria sobre la prescripción y la investigación biomédica requiriendo a los fabricantes que reporten todos los pagos y “transferencias de valor” a los médicos y hospitales de enseñanza. Promulgada como parte del Acta de Cuidado Costeable (ACA) de 2010, el programa Sunshine tomó casi dos años para finalizar, en gran medida porque los doctores protestaron porque el revelado de los pagos de las compañías farmacéuticas y de dispositivos médicos sería engañoso y estaría fuera de contexto. La regulación final establece marcos de tiempo y especifica que los fabricantes sometan la información con el CMS sobre los pagos para actividades de investigación, honorarios de consulta, obsequios, alimentos, costos de viaje, y honorarios de ponencias, más la propiedad e intereses de inversión de un doctor y su familia en un “fabricante aplicable”. El CMS le dio a los doctores unos pocos días extra para revisar y desafiar los datos de la industria antes de publicar los datos en su sitio web, y se espera que los fabricantes eviten dichas disputas estableciendo sistemas de rastreo electrónico de “gasto agregado” que les permita compartir y confirmar los datos del pago con los receptores antes del sometimiento al CMS. Con todos los retrasos, los fabricantes tienen ahora hasta Marzo de 2014 para reportar los datos de pago para Agosto hasta Diciembre 2013 y los datos no serán publicados hasta Septiembre de 2014. Queda por ver si el “Sunshine” desalienta a los médicos de servir como investigadores en estudios clínicos comerciales o como consultores o asesores de los fabricantes. Referencias 1.“Clinical Pharmacology and Therapeutics,” posted on Nature. com (Jan. 23, 2013), www.nature.com/cpt, accessed Feb. 14, 2013. 2.Federal Register, Vol. 78, No. 25, pp. 8446-8. PT Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 17 REGULACIÓN Y CUMPLIMIENTO Identificación de la Calidad MAYO / JUNIO 2013 17 27/05/13 16:31 REGULACIÓN Y CUMPLIMIENTO RESOLUCIÓN DE PROBLEMAS DEL CMC Larry Gatlin, PhD es consultor de Biotecnología y Farmacéutica en Patheon. Contaminantes por corrosión y sistemas de agua Larry Gatlin discute los problemas asociados con contaminación por corrosión en los sistemas de agua. P. ¿Es la corrosión un contaminante con el que necesito lidiar en mi sistema de agua? Es visiblemente seguro, pero no hay un impacto detectable en la calidad de mi agua. La medición de la tasa de corrosión puede ayudar a determinar cuándo un sistema debe limpiarse, de manera que no se impacte el producto final. R. El sarro es una descripción de los depósitos por corrosión encontrados en los sistemas de acero inoxidable. El sarro puede variar de color desde un rojo claro o naranja a un ladrillo oscuro. Los colores púrpura oscuro o negro se encuentran normalmente en los sistemas de vapor con colores variables debido a las temperaturas más calientes. Con mucha frecuencia el material rojo claro de los depósitos es principalmente óxido de hierro hidratado. Los componentes del sarro también pueden incluir óxido de cromo, níquel y molibdeno. La formación de sarro es un proceso continuo en todos los sistemas de tubería metálica, pero se exacerba por la alta temperatura y la composición del metal. No obstante, la alteración del color de las tuberías de acero inoxidable 316L, los accesorios y los recipientes debido a la deposición de sarro no es un problema por sí mismo, cualquier contaminación del producto que provenga del sarro es un problema. Cantidades muy pequeñas de iones metálicos pueden impactar significativamente la estabilidad de algunos productos. El sarro puede ser colocado en una de tres categorías: • Sarro Clase I es producto de la corrosión depositado, que consiste en óxidos de hierro e hidróxidos que se originan en cualquier sitio en el sistema y se depositan corriente abajo. La superficie subyacente de acero inoxidable por debajo de dichos depósitos generalmente permanece inalterada. 18 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 18 Este depósito de sarro puede generalmente limpiarse con facilidad. • Sarro Clase II es un producto de corrosión adherido que se origina in-situ sobre superficies de acero inoxidable no pasivadas o pasivadas inapropiadamente. Por su formación, la película protectora normalmente pasiva sobre la superficie de acero inoxidable se altera. • Sarro Clase III es un producto de la corrosión azul o negro, principalmente de óxido de fierro, llamado comúnmente magnetita, el cual se forma sobre las superficies en sistemas de vapor a alta temperatura. En superficies electropulidas, el depósito de la corrosión puede ser negro brillante, estable y adherente. En superficies pulidas mecánicamente, pasivadas, el depósito de la corrosión puede ser negro polvoso y puede deshacerse. Los cambios en la tasa de formación de sarro pueden ser resultado de influencias de la operación del flujo, puntos de uso, presión, oscilaciones en la temperatura del agua, y suministro o problemas de la constitución. La medición de la tasa de corrosión puede ayudar a determinar cuándo un sistema debe limpiarse de manera que el producto final no sea impactado. Los sistemas modernos de agua farmacéutica son completamente automatizados y varias compañías ofrecen instrumentos en línea para medir la formación de sarro mientras se mantiene el apego al 21 CFR parte 11. Es responsabilidad de la compañía demostrar que el sistema de “Contaminantes por corrosión y sistemas de agua” continúa en la pág. 25 MAYO / JUNIO 2013 27/05/13 16:31 PT MAYO / JUNIO.indd 19 27/05/13 16:31 Elga.indd 1 ¿Pureza del agua? Sólo elija tecnologías adaptadas a su ciencia y aplicación. ¿Cambios a futuro? Actualice y reconfigure conforme necesite evolucionar. ¿El reto del espacio? Adapte su solución donde usted quiera Marque en la tarjeta de servicio al lector el No. 6 ELGA. Nuestra Innovación. Su Elección. ¿Quiere ver más? Vea el PURELAB Chorus en acción en www.elgalabwater.com/choice • • • 16/05/13 19:04 Es su laboratorio, es su presupuesto, es su ciencia, de manera que… ¿No debería tener el control de su manera de trabajar? ELGA, líder del mercado en purificación de agua de laboratorio, ha innovado un rango de soluciones de purificación modulares que le dan la libertad de hacer justo eso. ¿Está listo para experimentar la libertad de elegir? Presentando al innovador PURELAB® Chorus: innovación es ahora su elección, un enfoque nuevo y fresco a su manera de trabajar. En sintonía con su ciencia REGULACIÓN Y CUMPLIMIENTO RESOLUCIÓN DE PROBLEMAS Medición de la distribución del tamaño de partícula del API Ann Newman, PhD es consultora principal para Patheon El mapeo visual puede proporcionar un estimado de la distribución del tamaño de partícula P. ¿Existe una manera inteligente de medir directamente la distribución del tamaño de partícula del fármaco/ API en una mezcla/granulado de tabletas, suponiendo que el API tiene muy baja solubilidad acuosa y los excipientes están en un estado mezclado (ya sea solubles o insolubles en agua)? Se obtiene un mapa visual que puede ser utilizado para estimar visualmente el tamaño de partícula. R. Un método que he usado para estimar/medir directamente el tamaño de partícula de las partículas de API en tabletas, el cual también funcionaría para mezclas y granulados, es el mapeado. Escogiendo un único pico para el API, puede obtenerse una distribución visual del API. Con el fin de obtener una distribución del tamaño de partícula, necesitarías extender el análisis contando las dimensiones para un número relevante de partículas. Muchas veces, es suficiente una simple evaluación visual para ver fácilmente las diferencias basadas en parámetros tales como el material de inicio o del proceso. El mapeo puede ser realizado utilizando una variedad de técnicas que incluyen infrarrojo (IR), Raman, energía dispersiva por rayos x (EDX) e incluso difracción en polvos con rayos X (XRPD). El análisis EDX, realizado en un microscopio electrónico de barrido (SEM), puede usarse para moléculas de API que contienen elementos dóci- les para el EDX (habitualmente arriba del carbón en la tabla periódica). En mi proyecto, el API contenía un ión cloruro que no estaba presente en ninguno de los excipientes. Mediante el mapeo de la presencia del cloruro, los tamaños de partícula del API presente en dos tabletas fueron comparados directamente y relacionados con los datos de disolución para ayudar a explicar una velocidad de disolución más lenta. Para el mapeo espectral, es necesario un pico del API que no se traslape con los excipientes en la formulación. El pico del API se utiliza entonces para mapear la presencia del API en la muestra. Se obtiene un mapa visual que puede ser usado para estimar el tamaño de partícula del API visualmente o puede realizarse un paso adicional de medición del tamaño de áreas relevantes. La limitación es el aumento del microscopio usado; las partículas más pequeñas requerirán mayores aumentos. La resolución de la técnica también jugará un papel y puede ser controlada por la fuente del instrumento y los parámetros experimentales. La mayor resolución requerirá pasos de análisis más pequeños y tiempos de escaneo más prolongados. Estos factores necesitarán ser considerados cuando preparen su experimento para determinar la cantidad de tiempo y esfuerzo que es necesario para la información que se desea obtener. “GMPs en el Desarrollo Inicial para Estabilidad Perspectiva de la Industria (Parte IV)” continuación de la pág. 10 9. ICH, Q1A(R2) Stability Testing of New Drug Substances and Products, Step 4 version (2003). 10. S. T. Colgan et al., “The Application of Science and Risk Based Concepts to Drug Substance Stability Strategies,” Jrnl. of Pharm. Innov. (in press 2012). 11. S. R. Byrn, R. R. Pfeiffer, and J. G. Stowell, Solid-State Chemistry of Drugs. 2nd Edition (SSCI, Inc., West 20 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 20 Lafayette, Indiana) pp. 259–366. Also see, ICH, Q6A, Specifications: Test Procedures and Acceptance Criteria for New Drug Substances and New Drug Products: Chemical Substances, Step 4 version (1999). 12. K.C. Waterman, “Understanding and Predicting Pharmaceutical Product Shelf-life” in Handbook of Stability Testing in Pharmaceutical Develop- ment, K. Huynh-Ba, ed. (Springer Science Business Media, LLC, New York, NY, 2009) pp. 115–135. 13. K.C. Waterman, AAPS PharmSciTech 12 (3) 932–937 (2011). 14. A. Kane, J. Williams, and L Yeo, Regulatory Rapporteur, pp. 3–8 (July/Aug 2008). PT MAYO / JUNIO 2013 27/05/13 16:31 Marque en la tarjeta de servicio al lector el No. 7 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 21 MAYO / JUNIO 2013 21 27/05/13 16:31 REGULACIÓN Y CUMPLIMIENTO DENTRO DEL IPEC Juanita Garofalo David B. Klug David R. Schoneker Juanita Garofalo es gerente global de etiquetado y acondicionado en Avantor Performance Materials David B. Klug es gerente senior, auditorías GMP en Sanofi y Director de IPEC-Americas David R. Schoneker is director, global regulatory affairs at Colorcon. Alineándose con la Guía CoA del IPEC Los directores anteriores del comité de calificación de excipientes de IPEC-Americas destacan los cambios a la guía del IPEC de los certificados de análisis para los excipientes a granel. H a pasado más de una década desde que la Guía de Certificados de Análisis para Excipientes Farmacéuticos a Granel (Guía CoA 2000) fue publicada (1). Desde entonces, han ocurrido cambios importantes en la industria farmacéutica global y en la arena regulatoria, los cuales han necesitado el desarrollo de la Guía de Certificados de Análisis IPEC para Excipientes Farmacéuticos, 2013 (Guía CoA). Entre estos cambios está la formación de la Federación del IPEC en 2010, la publicación de documentos del IPEC interrelacionados (2-12) que hacen referencia a certificados de análisis de excipientes, el mayor énfasis en la transparencia de la cadena de suministros (13) para proteger la vida de los pacientes, y la disponibilidad de las opciones definidas por el Instituto de Investigación de Calidad de Productos (PQRI) para el análisis de excipientes terminados (14). La guía CoA incorpora las mejores prácticas actuales de la industria y de las fuentes regulatorias (15). La Federación del IPEC se estableció para coordinar mejor el trabajo de IPEC-Americas, IPEC Europa, IPEC Japón e IPEC China dirigido a cumplir los objetivos de sus compañías miembro y de la industria como un todo. La seguridad de los pacientes es un conductor clave de todas las guías del IPEC. Como muchos excipientes farmacéuticos son ahora fabricados, distribuidos y usados globalmente, la Guía del CoA fue desarrollada bilateralmente por IPEC-Americas e IPEC Europa. Adicionalmente, la Guía CoA se les proporcionará a IPEC Japón e IPEC China para la posible adopción y publicación en sus regiones respectivas. Como el comercio de excipientes es internacional, la Guía CoA será un activo invaluable para la industria mundial. La Guía CoA fue desarrollada como un esfuerzo de colaboración por los fabricantes de excipientes, los distribuidores y usuarios. Los miembros de los comités de Calificación de Excipientes de IPEC-Americas y los de Calidad/Asuntos Regulatorios de IPEC Europa, fueron los que integraron el grupo de trabajo que desarrolló la Guía CoA. Se identificaron y se abordaron los asuntos de las compañías miembro del IPEC en el proceso de revisión, como se: la ausencia de referen- 22 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 22 cia a métodos analíticos, las restricciones de los programas de computadora, las circunstancias en las que el fabricante del excipiente no necesita llevar a cabo pruebas de identificación, legibilidad, ausencia de nombre y dirección del fabricante original, transparencia de la cadena de suministro, y uso de términos además de la fecha de caducidad o la fecha de reevaluación recomendada. Además de las aportaciones de las compañías miembro del IPEC, la FDA ha presentado sus ideas sobre los CoAs en diversas conferencias y en reuniones con IPEC-Americas y las observaciones de la FDA también fueron abordadas durante el proceso de revisión. Los estándares internacionales de certificación GMP de excipientes incluyen requerimientos que son consistentes con la Guía CoA. El estándar NSF/IPEC 363 GMP para Excipientes Farmacéuticos (actualmente en desarrollo) define el contenido mínimo requerido para el CoA. También EXCIPACT Certificación de Estándares para Excipientes Farmacéuticos: Buenas Prácticas de Manufactura/Buenas Prácticas de Distribución incluye varios requerimientos relacionados con al CoA. La Guía CoA será proporcionada a la Farmacopea de los Estados Unidos (USP) para su consideración en la modificación del Capítulo General <1080> Excipientes Farmacéuticos a Granel - Certificado de Análisis, el cual actualmente se basa en la Guía CoA 2000. A las agencias regulatorias y las organizaciones de la industria tales como Sindusfarma en Brasil y SaFyBi en Argentina también se les proporcionará la Guía CoA como parte de un esfuerzo continuo para armonizar las expectativas de los excipientes a nivel mundial. Cambios importantes La Guía CoA detalla el contenido requerido y el formato recomendado e incluye un CoA modelo a ser usado como ejemplo. Se reconoce que el programa de computadora existente usado para generar el CoA puede plantear restricciones que limitan la capacidad para lograr el formato recomendado. Por esta razón, el formato del CoA modelo proporcionado en la Guía CoA se ofrece sólo como ejemplo. No debe interpretarse MAYO / JUNIO 2013 27/05/13 16:31 erróneamente que debe seguirse el formato recomendado. Formato de fecha. Como la Guía CoA es de aplicación internacional, se requiere un formato de fecha que no sea ambiguo de manera que las fechas (p.ej., reevaluación o fecha de caducidad) sean claramente comunicadas. Un ejemplo de un formato de fecha no ambigua ofrecido en la Guía CoA es usar caracteres alfa para designar el mes y cuatro dígitos para designar el año: DD MMM AAAA (p.ej., 14 JUL 2013). Esta mejor práctica garantiza que los excipientes usados en la manufactura de productos farmacéuticos cumplan los requerimientos de la especificación en el momento del uso y que la confusión no lleve al uso de excipientes caducos. Fabricante original. El fabricante original y el sitio de manufactura deben estar identificados si son diferentes al proveedor o a la ubicación del proveedor. Específicamente, el nombre y la dirección deben aparecer directamente o por referencia (es decir, utilizando un código) en el CoA. Independientemente de si aparece o no un código en el CoA, el usuario del excipiente es responsable de conocer el nombre del fabricante original y la dirección del sitio de manufactura original para cada lote recibido. Cuando se utiliza un código, el proveedor del excipiente es responsable de definir el código para el usuario del recipiente, a solicitud del mismo. Dicha información puede requerir un acuerdo de divulgación de información confidencial (16). Además de ser un documento legal y la base de la certificación del fabricante del excipiente de que el excipiente continuará cumpliendo la especificación hasta la fecha de reevaluación o de caducidad, el CoA es un elemento crucial de los controles generales de la cadena de suministro que deben tener en sitio los fabricantes de excipientes, los distribuidores y los fabricantes de producto terminado. Para facilitar la rastreabilidad hasta el fabricante del excipiente, la inclusión del nombre del fabricante original y la dirección del sitio de manufactura original o un código apropiado en el CoA fue enfatizada en las discusiones que IPEC-Americas ha tenido con la FDA. Verificación de autenticidad. El usuario del excipiente debe verificar periódicamente la autenticidad y validez del CoA- Esto puede lograrse de manera eficiente durante una auditoría al proveedor o de otra forma, enviando el CoA al emisor para verificar que es auténtico. La frecuencia de dicha verificación puede basarse en la evaluación de riesgo, la cual toma en consideración la confiabilidad del fabricante del excipiente y de la cadena de suministro involucrada. El CoA debe incluir el nombre y el título de la persona que lo autorizó. Un CoA generado por computadora, donde los controles apropiados están en orden con el fabricante del excipiente, proporciona un grado equivalente o mejor de aseguramiento de que el CoA está apropiadamente autorizado que un documento original firmado a mano. No hay un requerimiento legal de tener un CoA firmado a mano en la mayoría de los países a condición de que los controles apropiados estén en el lugar para un proceso alternativo de firma generada por computadora. Si un distribuidor emite un CoA con su membrete, su CoA debe ser rastreable hasta el CoA del fabricante original. También, el CoA del distribuidor debe incluir el nombre y la ubi- cación o el código (si se usa) del fabricante original. Opciones definidas por el PQRI para el análisis de excipientes terminados. La Guía CoA 2000 incluía provisiones para “frecuencia de análisis reducido” por el fabricante del excipiente. Desde la emisión de la Guía CoA 2000, fue publicada la Postura Oficial Conjunta del Instituto de Investigación de Calidad de Productos (PQRI) sobre Análisis Farmacéutico y Estrategias de Control. Según se reportó en este documento de postura oficial: “En una reunión post-taller, los representantes de la FDA establecieron que se considera que la práctica de análisis salteado no cumple con las cGMPs porque para aquellos lotes que no son muestreados y analizados, hay una carencia de aseguramiento de que el excipiente terminado cumpla todas sus especificaciones. La FDA piensa que si un atributo para una materia prima terminada tiene criterios requeridos, debe haber alguna medición o prueba del material en cada lote para asegurar que se cumplen los criterios” (14). La FDA estableció en su respuesta al artículo del PQRI y en discusiones posteriores con la industria que el análisis en proceso puede ser utilizado en lugar del análisis del excipiente terminado para determinar el cumplimiento con un parámetro de prueba especificado y liberar un excipiente que cumple con las especificaciones apropiadas, siempre y cuando el fabricante del excipiente haya identificado/documentado claramente la “medición” en proceso que se relaciona directamente con el parámetro de prueba especificado y la prueba en proceso demuestra claramente que cada lote de excipiente pasaría el requerimiento si se analiza. Este tipo de aseguramiento puede obtenerse durante una auditoría del proveedor. Sin el aseguramiento de la correlación del análisis en proceso con un resultado de la prueba del excipiente terminado (p.ej., auditoría del proveedor), se le requiere al usuario realizar alguna prueba que no es realizada por el fabricante del excipiente en cada lote. Con base en las observaciones de la FDA, un usuario ya no debería más considerar los datos del análisis periódico (lote salteado) por el fabricante del excipiente, como suficientes para liberar el excipiente para usarlo en un producto farmacéutico, sin importa la cantidad de datos históricos que puedan existir. Esta posición es un cambio de paradigma para la industria farmacéutica. Muchas compañías utilizan los programas de análisis reducido y se apoyan en los datos del CoA del proveedor y, en el pasado, han aceptado las declaraciones del proveedor de que las especificaciones para una prueba particular fueron certificadas a través del uso del análisis en proceso o de lote salteado. Adicionalmente, de manera histórica, las farmacopeas tales como la USP han permitido que se utilice este tipo de enfoque por parte de los fabricantes del excipiente en sus noticias generales y el ICH Q6A ha permitido el análisis de lote salteado del producto farmacéutico y de la sustancia farmacéutica. Sin embargo, con base en las observaciones recientes de la FDA, no les permitirán a los usuarios apoyarse en las mediciones en proceso para justificar un parámetro de prueba especificado sin evidencia documentada Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 23 MAYO / JUNIO 2013 23 27/05/13 16:31 REGULACIÓN Y CUMPLIMIENTO (p.ej., auditorias en sitio) para demostrar que están en función los procedimientos apropiados para asegurar el cumplimiento. Aunque históricamente los usuarios de excipientes pueden no haber establecido este nivel de evidencia documentada, sino que más bien, pueden haberse apoyado simplemente en datos “no justificados/no confirmados” en sus programas de análisis reducido, la FDA dejó claro durante las discusiones con el PQRI que esto se considera ahora inapropiado (14). “De acuerdo con los representantes de la FDA, una determinación apropiada que asegure que cada lote se ajusta a las especificaciones apropiadas podría involucrar alguna combinación de los siguientes enfoques: 1. Análisis del producto final 2. Análisis en proceso 3. Monitoreo continuo de un atributo con controles de proceso estadísticos 4. Justificación documentada que, con base en el método de manufactura, el atributo de prueba puede no estar presente y por lo tanto la prueba no es aplicable (p.ej., solventes residuales)” (14). La Guía CoA se refiere a los incisos 2-4 (arriba) como “además del análisis del excipiente terminado” y los resultados derivados de otros que no sean el análisis del excipiente terminado deben estar claramente indicados en el CoA. Por ejemplo, el nombre de la prueba puede ponerse como pie de página para indicar que el resultado se obtiene de otro análisis que no es el del excipiente terminado. La Guía CoA también hace referencia al ICH Q6A en esta sección, el cual permite el análisis de lote salteado del producto farmacéutico y de la sustancia farmacéutica. Como se mencionó antes, la FDA tiene expectativas adicionales relacionadas con el uso de los resultados del análisis de lote salteado del proveedor, listados en un CoA para determinar el cumplimiento de la materia prima por parte de las compañías farmacéuticas. La FDA ha establecido que el análisis de lote salteado por parte del fabricante de un excipiente, por sí mismo no proporciona los datos suficientes para que los usuarios del excipiente justifiquen el análisis reducido en la recepción y esta ausencia de datos fue la base de las discusiones del PQRI. Sin embargo, el análisis apropiado de lote salteado puede proporcionar la base para que el fabricante de un excipiente certifique el cumplimiento con la especificación porque el fabricante del excipiente tiene un conocimiento y comprensión significativos del proceso más allá de lo que está disponible para el usuario. Esto se permite en el capítulo de Noticias Generales de la USP y no existe el requerimiento de que el fabricante del excipiente analice cada lote con todas las pruebas listadas en sus especificaciones, cuando otros controles pueden demostrar el cumplimiento continuo. Verificación de los resultados de las pruebas y mediciones para los parámetros específicos. Antes de liberar un excipiente para usar en la manufactura de un producto farmacéutico terminado, es responsabilidad del usuario del excipiente asegurar que se haya obtenido un resultado de conformidad de la prueba para cada parámetro de la especificación ya sea mediante el muestreo y el análisis del excipien24 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 24 te terminado para cada parámetro, utilizando los resultados calificados de las pruebas del proveedor obtenidos del CoA, o apoyándose en “otras pruebas aparte de las del análisis del excipiente terminado” para respaldar el cumplimiento con un parámetro particular cuando esté calificado como se señaló anteriormente. El CoA del excipiente debe identificar estos resultados “aparte de los del análisis del excipiente terminado” que se están usando para la liberación del producto en su sitio e informar a los usuarios del excipiente en consecuencia. Antes de aceptar cualquier resultado de las pruebas del CoA, el usuario del excipiente debe calificar al fabricante del excipiente para asegurarse que el excipiente es fabricado y analizado de manera consistente con las guías aplicables de GMP para excipientes y con los requisitos del usuario del excipiente. La calificación debe incluir una auditoría en el sitio del fabricante o proveedor del excipiente quien proporcionó el CoA ya sea al usuario del excipiente o a un tercero calificado para verificar que los datos proporcionados en el CoA son generados utilizando los métodos apropiados y son confiables. La reevaluación periódica también es necesaria para verificar que el fabricante del excipiente permanece calificado. Siempre que el usuario de un excipiente se apoye en los datos del CoA, en lugar del análisis de entrada, se sugiere que exista un acuerdo de calidad apropiado entre el fabricante del excipiente y el usuario del excipiente que defina claramente las responsabilidades de cada parte. En tales casos, el fabricante del excipiente sirve, en esencia, como un laboratorio por contrato para el usuario del excipiente. Referencia a métodos analíticos. Es necesario que el usuario del excipiente conozca los métodos analíticos usados por el fabricante del excipiente para analizar cada lote cuando los datos del CoA se usan para la liberación del lote. Las referencias a los métodos analíticos deben aparecer en el CoA o estar vinculadas a un documento de especificaciones, de manera que el método analítico utilizado por cada prueba sea comunicado claramente al usuario. En el caso en que el método analítico esté incluido en la especificación vinculada en lugar del CoA, se le debe proporcionar al usuario del excipiente el documento de la especificación. Análisis de identificación. La identidad 5.40 de las Noticias Generales de la USP establece “Una prueba compendial titulada Identidad o Identificación se proporciona como un auxiliar para verificar la identidad de los artículos que pretenden ser, p.ej., aquéllos tomados de contenedores etiquetados, y establecer si es el artículo nombrado en la USP-NF” (17). Adicionalmente, el 21 CFR § 211.84(d)(1) establece “Al menos debe realizarse una prueba para verificar la identidad de cada componente de un producto farmacéutico. Se llevarán a cabo pruebas de identidad específicas, si existen” (18). De manera similar, para los usuarios de excipientes cuyo producto farmacéutico sea comercializado en Europa, la legislación de EUA establece, “La identidad de un lote completo de material de inicio puede normalmente estar garantizado, sólo si “Alineándose con la Guía CoA del IPEC” continúa en la pág. 25 MAYO / JUNIO 2013 27/05/13 16:31 “Alineándose con la Guía CoA del IPEC” continuación de la pág. 24 se toman muestras individuales de todos los contenedores y se hace una prueba de identidad en cada muestra (19)”. Ha habido confusión dentro de la industria con respecto al reporte de pruebas de identificación en el CoA de los excipiente. La Guía CoA del IPEC aclara que este reporte no se requiere cuando el fabricante de un excipiente tiene otros procedimientos de control en el sitio que proporcionan el aseguramiento adecuado de que su producto cumplirá la prueba de identificación, si se realiza. Adicionalmente, el usuario debe realizar una prueba de identificación en cada lote recibido sin importar si el proveedor ha realizado la prueba de identificación o no. 3. 4. 5. 6. 7. 8. 9. 10. Resumen En resumen, se espera que la Guía CoA sea una herramienta crucial para los fabricantes, distribuidores y usuarios de excipientes proveyendo claridad en los requerimientos regulatorios e industriales adicionales relacionados con la transparencia de la cadena de suministro, la autenticidad del CoA y los requerimientos de análisis por nombrar unos cuantos y proporcionando un formato sugerido que incluya toda la información necesaria. 11. 12. 13. 14. 15. 16. Referencias 1. 2. D. Schoneker, Changing the Supply-Chain Controls for Excipients –Part I: The IPEC-Americas Certificate of Analysis Guide for Bulk Pharmaceutical Excipients, Pharm.Tech. (June 2000). IPEC-Americas, Excipient Master File Guide (2004), ipecamericas.org. 17. 18. 19. IPEC-Americas and IPEC Europe, Excipient Pedigree Position Paper (2009), ipecamericas.org. IPEC-Americas and IPEC Europe, Excipient Stability Program Guide (2010), ipecamericas.org. IPEC-Americas and IPEC Europe, Good Distribution Practices Guide (2006), ipecamericas.org. IPEC-Americas, Good Distribution Practices Audit Guide (2011), ipecamericas.org. IPEC-Americas, IPEC Europe, and the PQG, Good Manufacturing Practices Audit Guide (2007), ipecamericas.org. IPEC-Americas, IPEC Europe, and the PQG, Good Manufacturing Practices Guide (2006), ipecamericas.org. IPEC-Americas and IPEC Europe, Qualification of Excipients for Use in Pharmaceuticals (2008), ipecamericas.org. IPEC-Americas and IPEC Europe, Quality Agreement Guide and Template (2009), ipecamericas.org. IPEC-Americas, Significant Change Guide (2009), ipecamericas.org. IPEC, International Pharmaceutical Excipient Council Glossary (2010), ipecamericas.org. A. Falk, PhD, Pharm.Tech. 34(3) (Mar. 2010). B. Carlin et al., Pharm. Tech. 31 (9) (Sept. 2007). PQG PS 9100:2002 Annex C Certificates of Analysis; WHO Technical Report Series, No. 902 & No. 908; UK Guidance on Certificates of Analysis (from Orange Guide). Note: It is hoped that in the future, all excipient makers and excipient users will realize the benefits of establishing a longterm confidential disclosure agreement during the supplier qualification process. USP, USP 35 General Notices, 5.40 Identity CFR 211.84(d)1 EU Legislation–Eudralex Vol 4: Good Manufacturing Practice Guidelines, Chapter 6 Quality Control, Annex 8 Sampling of Starting and Packaging Materials (2006). PT “Contaminantes por corrosión y sistemas de agua” continuación de la pág. 18 medición trabaja porque un método de medición exacto para la tasa de corrosión o depósito de sarro ayudará a determinar los límites de operación antes de que se requiera la limpieza del sarro y la repasivación. Históricamente, las frecuencias de retiro del sarro y repa- sivación se determinaban subjetivamente (es decir, anualmente, bianualmente, semestralmente o cada paro programado), pero una frecuencia basada en el nivel de comodidad de riesgo para la compañía puede ser demasiado frecuente, costándole así tiempo, recursos y dinero a la compañía. “El error humano detrás del error humano” continuación de la pág. 16 llevar a una documentación pobre o un entrenamiento pobre como causa raíz en lugar de “error humano”. Además de las métricas, el proceso debe también aportar un circuito de retroalimentación donde el empleado (viejo o nuevo) tenga una oportunidad de identificar áreas de mejora tanto en los documentos como en la capacitación. Cuando se modifican los documentos de control, es importante recapacitar a los empleados en el cambio y asegurarse que modifiquen su conducta para estar en línea con las nuevas instrucciones. Asignar ocasionalmente el error humano como la causa de una desviación es válido si un empleado simplemente cometió un error. Sin embargo, deben agotarse otras posibilidades para la desviación antes de que el error humano sea atribuido como la causa raíz. Utilizando la métrica apropiada, teniendo instrucciones claras y concisas, realizando una capacitación detallada,estableciendo mecanismos de retroalimentación en el desempeño y utilizando las herramientas apropiadas para el análisis de la causa raíz, puede asignarse una causa raíz más precisa y puede alcanzarse una mejora continua del proceso. PT Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 25 MAYO / JUNIO 2013 25 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes Estrategias de Solubilización Polímeros avanzados para mejora de la solubilidad Sesión de preguntas y respuestas moderada por Adeline Siew, PhD Colin Anderson/Gettyimages Clases químicas y propiedades fisicoquímicas La pobre solubilidad continúa siendo un reto mayor en el desarrollo de formulaciones. Como el número de nuevas entidades químicas que son escasamente solubles continúa incrementándose, los profesionales de la formulación se enfrentan con la importante tarea de abordar estos problemas de solubilidad de manera que más compuestos puedan ser traducidos en medicamentos clínicamente útiles. Un enfoque popular para este problema es el uso de polímeros como excipientes solubilizantes. Pharmaceutical Technology reunió un panel de expertos de la industria para un foro especial de discusión de los polímeros para solubilización y las estrategias de formulación relacionadas para fármacos escasamente solubles. Los participantes incluyen a Michael Morgan, PhD, director de nueva tecnología en Bend Research; Brian Koblinski, gerente de marketing estratégico en Dow Wolff Cellulosics; y Firouz Asgarzadeh, PhD, director de servicios técnicos, Norteamérica, polímeros farmacéuticos y servicios en Evonik Corporation. 26 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 26 PharmTech: Varios polímeros/copolímeros pueden ser usados en el mejoramiento de la solubilización. ¿Qué identificarían como clases químicas clave para estos excipientes y las propiedades relacionadas que contribuyen a su función como solubilizantes? ¿En qué tipos de formulación se usan? Morgen (Bend Research): Los celulósicos, poli(vinilpirrolidona) (PVP) y sus copolímeros, acrilatos y poli(etilen óxido) (PEO) y sus copolímeros son algunas de las clases clave de polímeros que han sido identificados como excipientes solubilizantes para formulaciones orales. Los polímeros para la solubilización efectiva tienden a ser amfifílicos por naturaleza, significando que tienen sitios tanto hidrofóbicos como hidrofílicos que les permiten interactuar favorablemente con compuestos de baja solubilidad (es decir, hidrofóbicos) y dispersarse y disolverse en ambientes acuosos como el tracto gastrointestinal (GI). Las interacciones específicas del polímero con sí mismo, el API y el medio acuosos puede resultar en un rango de estructuras solubilizantes, que incluye micelas, coloides y complejos iónicos. Los polímeros solubilizantes se utilizan en muchos tipos de formulaciones, dependiendo de la ruta de administración, la dosis, las propiedades del API y los retos de entrega específicos asociados con el programa de desarrollo particular. Para la entrega oral, las dispersiones de sólidos amorfos pueden ser un enfoque de mejoramiento de la formulación para mejorar la biodisponibilidad de compuestos Clase II y IV del Sistema de Clasificación de Biofarmacéuticos (BCS). Dos procesos comunes para hacer dichas dispersiones son el secado por aspersión y la extrusión con fundido caliente (HME). El secado por aspersión puede ser usado para formar una partícula de dispersión monolítica o alternativamente, la dispersión puede ser depositada sobre un soporte sólido para incrementar el área de superficie y la velocidad de disolución. Mezclas físicas de dos fases de polímero y API cristalino en una forma farmacéutica sólida pueden usarse para solubilizar el API. Para los primeros estudios del alcance, las soluciones líquidas de polímero (p.ej., PEO) y el API pueden ser valiosas. En cada caso, la selección del tipo de formulación y el proceso de manufactura dependerán de los requerimientos del programa específico de desarrollo del fármaco. Koblinsky (Dow): Los polímeros con base de celulosa, como la hipromelosa (HPMC) y el acetato de hidroxipropil metil celulosa (HPMCAS, también conocido como acetato succinato de hipromelosa) tienen una elevada utilidad en las dispersiones sólidas. Su seguridad y baja reactividad del fármaco hacen de ellos un candidato ideal para la mayoría de los fármacos. Las dispersiones secadas por aspersión (SDDs) y el HME son las tecnologías más comunes usadas para la MAYO / JUNIO 2013 27/05/13 16:31 Marque en la tarjeta de servicio al lector el No. 18 PT MAYO / JUNIO.indd 27 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes solubilización con polímeros celulósicos. Los polímeros celulósicos mantienen dispersiones estables de sólidos, inhiben la cristalización del API y pueden promover la supersaturación del fármaco. Las opciones en viscosidad y niveles de sustitución tanto con el HPMC como con el HPMCAS ayudan al formulador a optimizar el desempeño en el mejoramiento de la solubilidad así como en la capacidad de procesamiento del material, lo cual incluye SDDs post-procesado y formulaciones de HME en formas farmacéuticas tradicionales como tabletas y cápsulas. Asgarzadeh (Evonik): La estructura química y las propiedades fisicoquímicas de los APIs y polímeros juegan un papel principal en la formación de soluciones de polímero-API sólido. Los poli(met)acrilatos, los polímeros celulósicos y la PVP son extensamente usados en el desarrollo de formulaciones de dispersión sólida. Cada clase de polímeros contiene enlaces químicos específicos que pueden interactuar con grupos específicos en los APIs. Las técnicas de HME, SDD y coprecipitación transforman los fármacos cristalinos escasamente solubles en una estructura amorfa, metaestable, con un estado de energía mayor dispersa en una matriz de polímero que se solubiliza más fácilmente, llevando a una solubilidad acentuada. Las fuertes uniones de hidrógeno y las interacciones iónicas entre el API amorfo y el polímero inhiben o retardan la recristalización del API incluso con polímeros que tienen temperaturas de transición de vidrio bajas (Tg’s), Como existe una miríada de estructuras de API con diferentes características fisicoquímicas, no hay una clase de polímeros que pudieran considerarse mejores solubilizadores que otros. Es esencial seleccionar los polímeros apropiados para estudios de selección basados en una buena comprensión de las estructuras tanto del polímero como del fármaco y las posibles interacciones que pueden tener. Un conductor clave para la buena estabilidad física del estado sólido de formas amorfas es la baja movilidad molecular. Selección de un polímero adecuado PharmTech. ¿Qué factores determinan el tipo de polímero farmacéutico para usar en una formulación dada para mejorar la solubilidad? ¿Puede proporcionar un ejemplo específico para ilustrar los puntos de decisión usados en una formulación que implica un desafío, incluyendo cualquier dato relevante? Morgen (Bend Research): Cuando se seleccionan polímeros solubilizantes, debe considerarse el desempaño, la estabilidad y la capacidad de manufactura de la formulación asociada. Las propiedades químicas y físicas del polímero solubilizante afectan al total de estos tres atributos, por lo tanto, es con frecuencia necesario balancear las propiedades del polímero para lograr la formulación solubilizada óptima. Habitualmente, las propiedades del API y los requerimientos del programa de desarrollo (p.ej., dosis) resultarán en un mayor 28 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 28 énfasis en uno o dos de estos tres atributos de la formulación. Idealmente, el polímero solubilizante interactuará con el API para sostener las elevadas concentraciones del API en el tracto GI en una o más especies de alta actividad (p.ej., fármacos fácilmente disueltos, micelas y coloides). Para los APIs que son particularmente propensos a precipitación en una forma de baja energía, la interacción significativa polímero/API es especialmente importante. Para muchos APIs, se prefieren los polímeros que tienen una interacción hidrofóbica sustancial con el API. La HPMCAS es uno de los polímeros de dispersión más ampliamente útiles para formar y sostener a las especies de alta energía en medios acuosos con compuestos BCS Clase II y IV. Tanto la estabilidad química como la física de las formulaciones solubilizadas son importantes. De las dos, la estabilidad química tiende a ser más específica del API. La estabilidad física del estado sólido es por lo general una consideración importante para las formulaciones solubilizadas, especialmente cuando el fármaco está en el estado amorfo. Un conductor clave para una buena estabilidad física en estado sólido de las formas amorfas, tales como las dispersiones poliméricas, es la movilidad molecular baja, la cual puede alcanzarse seleccionando un polímero de dispersión que tenga una Tg alta. Un número de polímeros de solubilización comunes, como la PVP y sus copolímeros y celulósicos, tienen alta Tg en su estado seco. El agua, sin embargo, puede plastificar los materiales y reducir la Tg. Los polímeros con captación de humedad baja como una función de la humedad, como las HPMCAS, con frecuencia le imparten mejor estabilidad física a las formas farmacéuticas amorfas en el estado sólido, bajo condiciones de almacenamiento ambiental que los polímeros más higroscópicos. Una alta Tg es menos importante para la estabilidad física cuando el API y el polímero son miscibles, lo cual es con frecuencia el objetivo para las formulaciones HME. La capacidad de manufactura es una consideración importante cuando se seleccionan polímeros solubilizantes. Para el secado por aspersión, la alta solubilidad y la baja viscosidad en los disolventes orgánicos volátiles usados durante el proceso son importantes. Los requisitos para el procesado con HME son algo diferentes, requiriendo buena estabilidad térmica, especialmente cuando se formulan fármacos con alta temperatura de fusión (Tm). Adicionalmente, la miscibilidad del API y del polímero es con frecuencia deseable en el proceso por HME para lograr una fase de dispersión simple. Koblinski (Dow): La estructura química del API, así como la tecnología usada para alcanzar mejor solubilidad impacta la elección del polímero. La SDD y la HME son dos tecnologías comunes usadas para crear dispersiones sólidas para mejorar la solubilidad. Cada técnica tiene su propia serie de parámetros del polímero mejor adaptados para usar en la tecnología, sin embargo los objetivos generales para ambos métodos son suministrar el fármaco amorfo, inhibir la cristalización del fármaco y maximizar la carga del fármaco en la formulación. Las características de los polímeros mejor adaptados para el secado por aspersión incluyen la capacidad para formar una solución atomizable de polímero-fármaco. Los polímeros MAYO / JUNIO 2013 27/05/13 16:31 que resultan en una viscosidad de la solución baja facilitarán concentraciones más elevadas de fármaco y polímero en la solución, reduciendo así el uso del solvente e incrementando la versatilidad de la formulación. Pueden usarse modelos de predicción para calcular las interacciones polímero-API que pueden ocurrir. Para ser adecuado para la HME, un polímero farmacéutico debe ser procesable con fusión en condiciones que no degraden los componentes de la formulación. Los polímeros con baja Tg así como una amplia ventana de procesado térmico se adaptan bien para la HME; sin embargo, la Tg debe ser lo suficientemente elevada para evitar la recristalización en condiciones de almacenamiento. El polímero también debe tener buena inhibición de la nucleación del cristal para mantener el API en niveles supersaturados con la disolución. Debido a un contenido de polímero relativamente alto en muchas formulaciones de HME, la seguridad del polímero durante el procesado (es decir, ningún producto de degradación tóxico) y en la formulación final es también crítica. Asgarzadeh (Evonik): Los polímeros usados para la formación de dispersiones sólidas deben tener Tg’s razonablemente altas para permitir la estabilización de la estructura amorfa del API vía la restricción del movimiento molecular (es decir, el estado vítreo) en condiciones de almacenamiento que generalmente están por debajo de la Tg del producto terminado. Los polímeros con menores Tg’s han demostrado formar soluciones sólidas estables cuando se forman fuertes uniones de hidrógeno o interacciones iónicas entre el polímero y el activo. Las fuertes uniones del hidrógeno y las interacciones iónicas contribuyen a la formación y estabilización de soluciones sólidas primeramente, rompiendo el entramado cristalino de fármacos altamente cristalinos, escasamente solubles, y en segundo lugar, retrasando la recristalización ya que el API molecularmente disperso prefiere permanecer unido al polímero. Otra consideración cuando se utiliza extrusión con fundido para la preparación de dispersiones sólidas es que la Tg del polímero debe ser suficientemente baja para permitir temperaturas de procesado aceptables minimizando la degradación del polímero y/o del fármaco. El copolímero catiónico amino metacrilato (Eudragit E, Evonik) forma soluciones con el fármaco aniónico ibuprofeno debido a la fuerte unión del hidrógeno y a las interacciones iónicas en temperaturas de extrusión tan bajas como 60°C. Aunque las Tg’s de los extruidos de la solución sólida de ibuprofeno/Eudragit E son tan bajas como 10°C a 20°C, éstos permanecen amorfos y estables a temperatura ambiente debido a la fuerte unión de hidrógeno y a las interacciones iónicas. La fusión del API durante la extrusión con fundido no es un requerimiento pero ayuda con la formación de la solución sólida. Las soluciones sólidas de fármacos con puntos de fusión tan altos como 250°C a 300°C es posible cuando dichas interacciones fuertes pueden formarse entre polímeros y el fármaco como es el caso del azúcar y el agua (soluto/solvente) donde el azúcar no es necesario que se funda con el fin de disolverse en el agua. Modelos de predicción PharmTech: ¿Puede utilizarse modelos de predicción en la selección de excipientes de un polímero solubilizante? Si es así, ¿Puede explicar el modelo y las variables relacionadas usadas en el modelo? Morgen (Bend Research): Un rango de modelos físicos predictivos es valioso en la selección de polímeros solubilizantes. Dichos modelos son más valiosos cuando se utilizan en conjunto con propiedades físicas medidas del API, el polímero y/o la formulación. En particular, con frecuencia utilizamos modelos para estimar la absorción oral con base en los parámetros clave, tales como la dosis del API, los valores de solubilidad y supersaturación, el coeficiente de partición del API en sales biliares y las velocidades de disolución y precipitación del API. Varios de estos parámetros dependen de la elección del polímero. En particular, el perfil del tiempo del nivel de supersaturación del API está con frecuencia fuertemente influido por la elección del polímero y puede afectar dramáticamente la absorción y la biodisponibilidad. Estos parámetros son típicamente medidos in vitro y después usados en modelos predictivos. Una importante advertencia es que es notoriamente difícil pronosticar exactamente ciertos parámetros in vitro, tales como la velocidad de precipitación del API con base en las mediciones in vitro. Otros tipos de modelos que algunas veces son empleados incluyen esquemas del parámetro de solubilidad para predecir interacciones entre los APIs y los polímeros, incluyendo estimados de la solubilidad del API en una matriz de polímeros. Aunque tales predicciones pueden ser útiles, es algunas veces más rápido y más exacto hacer las mediciones que hacer los cálculos. Koblinski (Dow): Los modelos de predicción pueden ser usados para calcular las interacciones polímero-API que pueden ocurrir. Adicionalmente, pueden usarse herramientas tales como los parámetros de solubilidad, para establecer la solubilidad del API en el polímero seleccionado. Los parámetros de solubilidad de Hansen son usados con frecuencia en este aspecto como una herramienta de selección para la compatibilidad fármaco-polímero; sin embargo, sólo deben ser usados como guía en conjunto con los datos de preformulación. Asgarzadeh (Evonik): En un esquema de desarrollo de una formulación empírica convencional, varias combinaciones cualitativas y cuantitativas de fármaco y polímeros son fundidas, secadas por aspersión o fundidas en película a partir de disolventes orgánicos en numerosos experimentos para identificar formulaciones apropiadas de solución sólida/dispersión. Dichas metodologías de desarrollo empírico consumen tiempo y requieren cantidades significativas de fármacos así como análisis costosos. Las herramientas predictivas para identificar los disolventes para los polímeros basadas en los parámetros de solubilidad y en las interacciones moleculares (p.ej., uniones de hidrógeno e interacciones iónicas) han sido usadas durante varias décadas en las industrias de pintura, polímeros y química orgánica. Estas herramientas de pronóstico Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 29 MAYO / JUNIO 2013 29 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes permiten una selección sistemática más rápida de formulaciones y condiciones de proceso en las primeras etapas de desarrollo de un producto de dispersión sólida, independiente de la tecnología de preparación usada. Una de tales herramientas desarrolladas por Evonik es el MemFis (Modelado de Extrusión con Fundido y Sistema de Información de la Formulación). El modelo MemFis utiliza teorías de contribución bien establecidas del grupo de polímeros y química orgánica para estimar los parámetros de solubilidad de Hansen de moléculas de fármacos y polímeros. En MemFis, se consideran los cálculos de más de 50 contribuciones de grupos químicos y los efectos de las interacciones polares (es decir, momentos dipolo), así como de 40 diferentes interacciones de uniones de hidrógeno sobre los parámetros de solubilidad. El MemFis permite la selección de formulaciones iniciales de solución solida/dispersión y de condiciones del proceso de extrusión con fundido sin consumo del API. Reduce el número de experimentos llevando calidad al desarrollo de la formulación en un enfoque sistemático más que empírico que está dirigido a experimentos apropiados. Otras herramientas analíticas, tales como el mapeo Raman, la calorimetría diferencial de barrido, y la microscopía de fuerza atómica, pueden permitir la detección temprana de la formación de una solución sólida o de cualquier efecto de recristalización. Calidad por diseño PharmTech: La calidad por diseño (QbD) es una consideración general en el desarrollo de fármacos. Con respecto al mejoramiento de la solubilidad ¿Cuáles son los atributos de calidad críticos y/o los parámetros de procesos críticos, importantes en la selección del excipiente? Morgen (Bend Research): Recientemente, las compañías farmacéuticas, los proveedores de excipientes y los CRDMOs (organizaciones de investigación/desarrollo/ manufactura por contrato) han lanzado iniciativas significativas para llevar los principios de la QbD a la selección y diseño del polímero, la formulación, y el espacio del proceso. Con respecto al polímero, los atributos de calidad críticos pueden incluir distribución del peso molecular y atributos químicos, tales como la relación y secuencia de diferentes unidades monoméricas y/o el número y patrón de sustitución de los grupos hidrofóbicos en la columna vertebral del polímero. Existen casos en los cuales las diferencias relativamente pequeñas en la química pueden afectar significativamente el desempeño del polímero y la formulación. En algunos casos, el perfil de impurezas del polímero también puede ser crítico para el desempeño. Típicamente, un número de parámetros críticos por el lado del proceso influirá en la selección de los excipientes. Dependiendo del proceso, los disolventes y las temperaturas de la solución, puede ser seleccionada con base en la solubilidad del API o su compatibilidad con el disolvente, el cual puede a su vez influir en la elección del polímero. De la misma forma, los perfiles de tiempo de proceso-temperatura pueden ser parámetros críticos del proceso, particularmente para la elección de los excipientes de la HME, para asegurar el adecuado mezclado para la completa dispersión y disolución del API dentro de la matriz del polímero calentado si se desea una solución sólida. 30 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 30 Los excipientes en una formulación con solubilidad acentuada no deben considerarse como rellenos o parte de la matriz de aglutinante. Koblinski (Dow): La selección del excipiente correcto con control de los atributos de calidad críticos es crucial para una formulación robusta. Un enfoque de QbD para el desarrollo de fármacos ayuda a que el producto farmacéutico final tenga el efecto terapéutico deseado sobre una base consistente. En el mejoramiento de la solubilidad, los excipientes juegan el papel de estabilizar el fármaco y mantenerlo en el estado deseado para lograr la máxima liberación del fármaco y el sostenimiento de la concentración. Un estudio de QbD con un excipiente, por ejemplo HPMCAS, buscará las características del polímero, tales como la sustitución de acetil y succinil utilizando un estudio de diseño de experimentos para cubrir el espacio experimental y encontrar los niveles de sustitución acentuados para la solubilización del fármaco específico. A través de estudios hechos en Dow, hemos encontrado que algunos fármacos, tales como la fenitoína, son muy sensibles a cambios en los niveles de sustitución del polímero y por lo tanto, requieren un estrecho control alrededor de los valores acentuados para un desempeño consistente. Otros fármacos menos sensibles pueden tolerar un rango más amplio de valores de sustitución manteniendo mientras tanto el desempeño. Un programa de QbD, en colaboración con el fabricante del excipiente, puede ayudar a los formuladores a desarrollar un producto farmacéutico robusto y terapéuticamente eficiente. Asgarzadeh (Evonik): Cuando se seleccionan excipientes para mejoramiento de la solubilidad, las propiedades fisicoquímicas del excipiente, tales como las características morfológicas, la solubilidad acuosa/pH, el peso molecular, la estructura cristalina, la porosidad, la densidad y la viscosidad están entre los atributos de calidad críticos (CQAs) que deben ser evaluados. El impacto de los CQAs seleccionados basado en la evaluación de riesgo sobre las propiedades del producto final debe ser estudiado y bien comprendido. Los excipientes en una formulación con solubilidad mejorada ya no deben considerarse como relleno o parte de la matriz de aglutinante porque contribuyen al desempeño del API que de otra manera no tiene ninguna absorción y biodisponibilidad. Los parámetros críticos del proceso (CPPs) son atributos específicos del proceso. Para aplicaciones de mejoramiento de la solubilidad, la extrusión con fundido y el secado por aspersión son las tecnologías más comúnmente usadas. Los CPPs para la extrusión con fundido son la velocidad del tornillo, la temperatura de extrusión, la velocidad de alimentación, la temperatura de transición vítrea de la mezcla fármaco-polímero y la viscosidad del fundido. Sin embargo, para el secado por aspersión, deben considerarse parámetros tales como velocidad de atomizado, contenido de sólidos en porciento, tamaño y escala del secador por aspersión, tamaño de la boquilla y temperatura en la cámara de expansión. PT MAYO / JUNIO 2013 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes R ecubrimiento de Tabletas y Granulado en Seco Mejora continua en el recubrimiento de tabletas y la granulación Avances en diseño y operación de equipo L.B. Bohle Martin Hack y Dejan Djuric La alta eficiencia en las operaciones unitarias es un prerrequisito para lograr mejoras generales en la manufactura de formas farmacéuticas sólidas. Los autores examinan avances recientes en diseño y operación de equipos en atomizado, secado y mezclado para mejorar el proceso de recubrimiento de tabletas. Martin Hack* es vicepresidente y gerente general y Dejan Djuric, PhD, es gerente de operaciones científicas, ambos en L.B. Bohle, 700 Veterans Circle, Oficina 100, Warminster, PA 18974, tel. 215.957.1240, [email protected] *A quien debe dirigirse la correspondencia. E l costo es un asunto crucial para las compañías farmacéuticas, los fabricantes de genéricos y los CMOs, los cuales deben estar atentos a los costos operacionales generales del equipo así como a los costos iniciales de capital. El proceso de alta eficiencia en la manufactura de formas farmacéuticas sólidas es un objetivo deseado, y los recubridores de tabletas y los granuladores han pasado por mejoras en la tecnología para lograr la mejora continua en estas operaciones. Mejoras en la manufactura de formas farmacéuticas sólidas Para evaluar las mejoras en la manufactura de formas farmacéuticas sólidas, uno debe examinar los avances en el diseño y la operación de equipos para el atomizado, secado y mezclado para mejorar el proceso general de recubrimiento de tabletas. Se describe lo más destacado de tales avances. Recubrimiento de tabletas. Las mejoras a las tecnologías de recubrimiento de tabletas están ayudando a los fabricantes farmacéuticos a alcanzar mayor uniformidad y reducción de desechos. Estas mejoras se deben en su mayor parte a los avances en el sistema de mezclado, así como en el bombo y la configuración del flujo de aire. El recubrimiento de tabletas consiste en tres pasos principales: atomizado, secado y mezclado. Cada paso debe estar calibrado con los otros para optimizar el proceso completo. Atomizado. El equipo de atomizado incluye los tipos de boquilla, el número y tipo de pistolas y el espaciado de pistola a pistola. Los parámetros de proceso incluyen la velocidad del atomizado, la distancia y ángulo de la pistola al lecho de las tabletas, la presión del aire de atomización y el patrón de la presión del aire. Las boquillas de la pistola de atomización son claves para el recubrimiento eficiente y las boquillas que crean un patrón de rocío oval y un ángulo del rocío de 50° a 60° trabajan mejor. La configuración de la barra de atomización dictará la cantidad de traslape rocío-cono. Un ligero traslape de los conos de rocío de cada boquilla puede ser deseable para una cobertura consistente; sin embargo, demasiado traslape llevará a una sobrehumectación localizada del lecho de las tabletas. En la mayoría de los casos, la distancia pistola a lecho irá de 6 pulg. a 10 pulg. aunque la distancia real depende de la fuerza de la presión del aire de atomización y el patrón de la presión del aire sobre el tamaño del bombo de recubrimiento. Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 31 MAYO / JUNIO 2013 31 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes Secado. El secado de la suspensión de recubrimiento tiene lugar durante la atomización y cuando se esparce sobre la superficie de la tableta. La temperatura del aire de entrada, el flujo y humedad del volumen del aire de entrada y el grado de perforación del bombo controlan el secado. Estos parámetros deben estar controlados en una manera que evita la sobrehumectación pero no causa el secado por aspersión. La manera en que el aire se mueve a través del bombo de recubrimiento también influye el secado. La mayoría de los bombos de recubrimiento extraen aire de la parte superior del bombo y lo sacan por un lado. Otros colocan tanto la entrada como la salida en la base del bombo. No importa dónde está la entrada y la salida, el objetivo es manejar el aire de manera que se minimice la turbulencia y el calor excesivo en la zona del atomizado. Debe alcanzarse un equilibrio entre la temperatura y el volumen del aire de entrada y la velocidad del atomizado. Una vez que los elementos básicos del recubrimiento de tabletas son entendidos, el fabricante puede decidir cuales características de recubridor de tabletas se adaptan mejor a su forma farmacéutica sólida. Mezclado. El mezclado es un prerrequisito para un recubrimiento homogéneo y uniforme. Idealmente, la acción del bombo mezclará las tabletas de manera que cada una esté expuesta por igual al rocío. Hacerlo así depende de la geometría del bombo y del uso de deflectores, espirales, barras elevadoras u otros componentes. Muchos bombos comunes tienen un diámetro que excede su longitud. Esta relación puede crear un lecho de tabletas demasiado profundo para un mezclado efectivo. No es poco común encontrar puntos muertos en la mitad de estos lechos de tabletas. Tales puntos muertos pueden causar sobrehumectación y la formación de grumos o gemelos, lo cual puede dañar las tabletas. Para romper o evitar los grumos y las zonas muertas, algunos bombos están adaptados con un dispositivo llamado deflector o pala. La pala está fija dentro del bombo de recubrimiento, de manera que conforme gira el bombo, las tabletas contactan con la pala, dirigiéndolas hacia afuera. Aunque la inserción de la pala puede mejorar el mezclado, puede incrementar el riesgo de rompimiento de tabletas. Un enfoque alternativo es usar un bombo cuya longitud exceda a su diámetro y que incorpore deflectores helicoidales para un mezclado suave de las tabletas. El bombo más largo crea un lecho poco profundo de tabletas que está libre de zonas muertas. Los deflectores helicoidales superior e inferior exponen todas las tabletas al atomizado igualmente. Esta configuración permite velocidades de atomizado más elevadas, lo cual acorta el 32 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 32 tiempo requerido para recubrir las tabletas en cada lote. El papel del diseño del equipo de recubrimiento en la manufactura Una vez que los fabricantes farmacéuticos entienden los elementos básicos del recubrimiento de tabletas, pueden determinar cuáles características del recubridor de tabletas se adaptan mejor a su forma farmacéutica sólida. Por ejemplo, apoyándose en un recubridor cuya longitud del bombo de recubrimiento excede su diámetro crea un lecho de tabletas poco profundo que promueve la exposición de las tabletas al atomizado. También permite la instalación de más boquillas sobre el lecho de lo que es posible en los bombos convencionales. Esta combinación mejora exponencialmente la uniformidad del recubrimiento. Sin embargo, existe un límite para el número de boquillas que deben añadirse. Los fabricantes deben ponderar el beneficio de agregar boquillas contra el riesgo de sobrehumectar el lecho de tabletas. Es mejor utilizar suficientes boquillas para cubrir el lecho evitando o minimizando al mismo tiempo el traslape. También debe evaluarse el flujo de aire. Los recubridores convencionales tienen flujo de aire superior-a-lateral, de manera que el aire caliente a alta velocidad pasa a través de la zona de atomizado. Esta implementación del flujo de aire causa turbulencia y la posibilidad de secar por aspersión las gotas del recubrimiento. Los fabricantes farmacéuticos pueden reducir estos efectos ajustando el flujo de aire, la temperatura y la velocidad de atomizado. Esta corrección, sin embargo, puede hacer más lenta la operación de recubrimiento o incrementar la cantidad de solución de recubrimiento desperdiciada. La mínima turbulencia de aire y las aplicaciones de recubrimiento mejoradas pueden lograrse utilizando un bombo con una entrada y salida que se extiende en la base del bombo. Esta mejora del diseño también permite un mejor control sobre la temperatura del lecho de tabletas. Adicionalmente, este control da velocidades del atomizado más rápidas y reduce los tiempos de recubrimiento en tanto como 45%. Las compañías que utilizan ambos diseños del bombo de recubrimiento han encontrado que los bombos con flujo de aire superior-a-lateral son hasta 85% eficientes. Este resultado significa que aproximadamente el 15% o más del atomizado se deposita dentro del bombo de recubrimiento, en las pistolas y en la barra de atomización o en el desfogue. Los diseños que usan aire de flujo base-a-base, los cuales jalan el atomizado sobre el lecho de tabletas como un vacío, pueden alcanzar aproximadamente el 98% de eficiencia. También acortan el tiempo de recubrimiento general porque facilitan mayores velocidades de atomizado sin sobrehumectar el lecho de tabletas. En aplicaciones que requieren recubrimientos gruesos de las tabletas, el lecho de tabletas puede crecer en un tercio o más. Esta formulación requiere un ajuste de la distancia de pistola a lecho durante el proceso. Cuando el recubrimiento de las tabletas involucra sustancias potentes, los fabricantes pueden considerar la automatización del movimiento de las boquillas, la barra de atomización, o ambos. Esta característica elimina la necesidad de abrir el bombo de recubrimiento, incrementando así la eficiencia y seguridad. MAYO / JUNIO 2013 27/05/13 16:31 Finalmente, los fabricantes deben notar cómo su bombo de recubrimiento mezcla y maneja las tabletas. El mezclado homogéneo promueve la uniformidad de contenido. Los bombos equipados con deflectores de mezclado helicoidales mueven constantemente las tabletas hacia atrás y hacia adelante a través del bombo, eliminando así los puntos muertos. Estudios de recubrimiento de tabletas Los investigadores han realizado varios estudios científicos en recubrimiento de alta eficiencia en la manufactura de formas sólidas. Estos estudios proporcionan guía para las mejoras del proceso de recubrimiento de tabletas (1-6). Efectos del escalamiento sobre la abrasión de las tabletas durante el recubrimiento en bombo. Un estudio del 2006 investigó la influencia del escalamiento de la producción sobre la abrasión de las tabletas en un bombo de recubrimiento (1). Se examinó cómo el tamaño del lote durante el escalamiento puede afectar la abrasión y el mellado de los bordes de las tabletas planas. Los investigadores vieron la pérdida de peso de tabletas rastreadoras blancas mezcladas con un lote de tabletas recubiertas con azul en un bombo a escala de laboratorio y un bombo a escala piloto como función de diferentes velocidades y tiempos de mezclado del bombo. Ellos observaron que incrementando el tamaño del lote se causaba una reducción en la pérdida de peso debido al menor daño en los bordes de las tabletas. Los investigadores determinaron que un mayor número de tabletas impacta en la pared del bombo en la escala de laboratorio en comparación con lo que la escala piloto podría explicar para este resultado. Este efecto es contrario a la creencia común de que el incremento en el tamaño de lote en el escalamiento lleva a una mayor abrasión o daño a las tabletas (1). Espectroscopía Raman como herramienta PAT en el recubrimiento con activo. El recubrimiento con activo es una aplicación de recubrimiento pelicular en la cual el ingrediente activo farmacéutico está incluido en la capa de recubrimiento. Esto le representa a los fabricantes el desafío de lograr la cantidad correcta de recubrimiento y uniformidad en cada dosis. Para asegurar la calidad de cada dosis, los fabricantes pueden beneficiarse desarrollando tecnología analítica de proceso (PAT) que pueda monitorear el proceso de recubrimiento y detectar el final del ciclo de recubrimiento. En un estudio, los investigadores realizaron experimentos de recubrimiento utilizando el fármaco diprofilina (2). Ellos utilizaron un bombo para cubrir tabletas de placebo y tabletas conteniendo diprofilina. Durante el recubrimiento con activo, los investigadores registraron espectros Raman en línea. Estas mediciones espectrales fueron comparadas con el aumento promedio de peso y la cantidad de ingrediente activo recubierto en cada punto de tiempo (2). El modelo quimiométrico que crearon utilizando espectroscopía Raman fue probado monitoreando más tabletas recubiertas. El grupo de investigación también estudió los efectos de la velocidad de rotación del bombo y la distancia de trabajo en la señal Raman y estudiaron el efecto resultante del modelo quimiométrico. Utilizando espectroscopía Raman como herramienta PAT, ellos pudieron determinar la cantidad de ingrediente activo en la película cuando se aplicó sobre los núcleos de las tabletas placebo y en tabletas que contenían el ingrediente activo. Los investigadores también determinaron que este método puede ser usado cuando se cambian los parámetros del proceso y las condiciones de medición dentro de un rango restringido, haciendo de esto una herramienta PAT apropiada (2). Comparación de la pistola de atomizado en laboratorio y en producción para el escalamiento. En un estudio de escalamiento, los investigadores examinaron una pistola de atomizado de laboratorio y una pistola de atomizado de producción (3). Ellos analizaron la influencia de la presión del aire de atomización, la distancia de la pistola de atomizado al lecho de las tabletas, la viscosidad de la solución del polímero y la velocidad de atomizado. Las pistolas de atomización fueron comparadas con base en el ancho y la altura del atomizado, el tamaño y velocidad de la gota, y la densidad del atomizado. Los investigadores midieron la densidad del atomizado, el tamaño de la gota y la velocidad con un analizador de partículas con fase Doppler (3). Este estudio le dio a los investigadores información básica para los ajustes del escalamiento de las pistolas de atomizado del laboratorio y de producción. Ambas fueron comparables con respecto al tamaño y velocidad de la gota, y el escalamiento del tamaño de la gota puede realizarse mediante un ajuste de la presión del aire de atomización. El escalamiento de la velocidad de la gota puede lograrse ajustando la pistola de atomizado a la distancia tableta-lecho. El resultado del estudio fue que el modelo estadístico de los investigadores y las gráficas de superficie fueron herramientas poderosas y convenientes para escalar los ajustes del atomizado si la pistola de atomizado se cambió de una pistola de atomizado de laboratorio a un pistola de atomizado para producción (3). Granulación seca y compactación con rodillos La granulación seca continua es un proceso establecido en la industria farmacéutica. Actualmente, no sólo se aplica para materiales sensibles a la humedad y temperatura sino también para productos de formas farmacéuticas sólidas de gran volumen. En comparación con las técnicas clásicas de granulación húmeda, no se requiere un sofisticado sistema de secado para el proceso. Esta eliminación del sistema de secado evita grandes inversiones para el equipo de producción y el espacio y baja los costos de manufactura. Un beneficio adicional de tener una operación de una unidad es su aptitud para la instalación en una operación de un piso. El granulador seco puede ser alimentado con un solo contenedor del granel intermedio (IBC). Para habilitar el proceso continuo, puede usarse una tolva de alimentación de mayor potencia con un sensor de nivel y una adecuada capacidad de retención para facilitar el cambio de IBCs adicionales sin interrumpir el proceso. En el lado de la descarga, puede usarse un sistema simple de transporte neumático del flujo para transferir el granulado resultante a un IBC receptor para el futuro mezclado y procesado. Esta reducción en el manejo de equipo puede reducir más los costos de capital con un sistema de granulado en seco. Adicionalmente, para rendimientos de gran volumen, el Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 33 MAYO / JUNIO 2013 33 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes rápido proceso de compactación con rodillos es primordial para el procesado eficiente. Esta eficiencia permite la producción de diferentes productos y tamaños de lote de producto con una sola máquina (4). El mercado ya ofrece varios granuladores en seco, los cuales pueden ser descritos por el arreglo de los dos rodillos de compactación. Éstos pueden ser montados horizontalmente, verticalmente o en un plano inclinado. Dependiendo del proveedor, los rodillos difieren en anchura, diámetro y propiedades de la superficie. Además, los compactadores de rodillo se distinguen entre compactadores de hueco fijo y de hueco movible, mientras que los compactadores de rodillos movibles son lo último. Sin embargo, sólo los compactadores de rodillos movibles aseguran una porosidad homogénea del listón a presión de compactación constante. El paso de la granulación, en donde los listones son transferidos a gránulos finales, está por lo general integrado en el equipo de compactación con rodillos y se lleva a cabo en uno o dos pasos (5, 6). Con esto en mente, los fabricantes introdujeron un granulador en seco con un manejador de rodillos electromecánico y ejes del rodillo masivos montados de manera horizontal. Con esta máquina recientemente desarrollada, es necesario un tiempo mínimo para lograr un estado estable durante el arranque del proceso, y el hueco paralelo está asegurado durante todo el tiempo de la producción. El control del circuito proporcional-integral-derivativo (PID) minimiza las desviaciones del hueco durante el procesado y permite porosidades constantes del gránulo. El paso de la granulación se logra utilizando un tamiz cónico, el cual transforma suavemente los listones en gránulos finales incluso en rendimientos de material altos. Debido a los diferentes tamices, puede obtenerse la distribución deseada del tamaño de partícula. Estudio de caso del compactador con rodillos El objetivo del siguiente estudio es mostrar y demostrar la funcionalidad de este tipo de granulador en saco sofisticado. Materiales y métodos. Se utilizó una mezcla de polvos (relación 1:1) que consiste en lactosa y celulosa microcristalina para la compactación con rodillos. Para la lubricación, se añadió 0.5% de estearato de magnesio. Los excipientes fueron premezclados en un mezclador de caja. La mezcla homogénea fue compactada con rodillos en diferentes fuerzas de compactación y diferentes arreglos del tamiz. Se utilizó un rodillo maestro liso y un rodillo ranurado de 100 mm de ancho para los ensayos de compactación. El muestreo se llevó a cabo después del arranque del proceso cuando se había alcanzado el estado estable. Los gránulos finales fueron submuestreados manualmente y analizados por duplicado mediante tamizado mecánico. Fuerza de compactación. Se analizó el impacto de la fuerza de compactación sobre el tamaño de partícula del gránulo final a 2 rpm de velocidad del rodillo, 300 rpm para el tamiz raspador de 1.5 mm, y un ancho de hueco de 2.5 mm. El proceso empezó con un control del circuito activado del PID para el sistema de alimentación. El estado estable se alcanzó en 40 segundos con una fuerza de compactación específica constante y un ancho de hueco constante. De esta manera, pudo 34 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 34 detectarse una pérdida mínima de material debido al control de circuito rápido. Durante el procesado, se incrementó gradualmente la fuerza de compactación, de manera que el siguiente nivel de fuerza fue alcanzado rápidamente en un lapso de segundos. Las desviaciones de la fuerza de compactación específica estuvieron por debajo de ± 0.1 kN/cm y ± 0.1 mm para el hueco, respectivamente. Así, ambos parámetros pudieron considerarse constantes durante el proceso. El tamaño de partícula del gránulo se incrementó con los mayores niveles de fuerza de compactación. Después de la granulación, a través de un tamiz raspador de 1.5 mm, la cantidad de finos (tamaño de partícula < 100 μ m) fue desde el 39% para los gránulos compactados a 5 kN/cm hasta 11% para los gránulos preparados con una fuerza de compactación de 15 kN/cm. La compactación con dicho nivel de fuerza alto llevó a una cantidad más elevada de gránulos gruesos (> 2000 μm). Por lo tanto, se recomienda un tamaño de tamiz más pequeño entre 1 mm y 1.5 mm para minimizar esta fracción de gránulos grandes. Ancho del hueco. El rendimiento del material durante la compactación con rodillos puede incrementarse con un ancho de hueco más grande. Se reporta en la literatura que un ancho de hueco más grande con un nivel de fuerza de compactación constante lleva a gránulos más finos (4). Este efecto no pudo ser observado cuando se compactó la mezcla de polvos a 10 kN/cm. A una velocidad de los rodillos de 2 rpm y una velocidad del tamiz de 300 rpm (1.5 mm de tamiz raspador), se obtuvieron distribuciones comparables del tamaño de partícula de los gránulos aunque el ancho del hueco se incrementó desde 1.5 mm hasta 3.5 mm. Una aplicación homogénea de la fuerza de compactación sobre el ancho del rodillo completo pudo ser una razón para el tamaño de gránulo similar. Por lo tanto, el resultado del material podría ser fácilmente incrementado sin un cambio en las propiedades del gránulo. Disposición del tamiz. La fuerza de compactación aplicada afecta principalmente el tamaño de partícula del gránulo. En segundo lugar, la disposición de una unidad de granulación integrada determina la distribución final del tamaño de partícula. Con el incremento del tamaño del tamiz, se obtienen gránulos más secos. Los tamices de raspado con tamaño de la malla de 1.5 mm y 2 mm llevó a distribuciones similares del tamaño de partícula de los gránulos a una velocidad del tamiz de 300 rpm. En comparación, el tamiz raspador de 1 mm llevó a gránulos más finos con mayor cantidad de finos. Finalmente los tres tipos de malla llevaron a cantidades aceptables de finos debido al comportamiento de corte suave del tamiz raspador durante la granulación. La elección del tamaño correcto de la malla hace posible influir la distribución final del tamaño de partícula del gránulo. Una posibilidad adicional para variar la disposición del tamiz es la alteración de la velocidad del rotor del tamiz. En contraste con los sistemas clásicos de tamiz rotatorio, los ta“Mejora continua en el recubrimiento de tabletas y la granulación” continúa en la pág. 42 MAYO / JUNIO 2013 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes Calidad por Diseño Calidad por diseño en excipientes Manejo de la variabilidad de los excipientes Creative Crop/Getty Images Sesión de preguntas y respuestas moderada por Patricia Van Arnum El manejo de la variabilidad de los excipientes es un elemento esencial en el diseño y la manufactura robusta de productos farmacéuticos sólidos orales y es una tarea integral cuando se aplican los principios de la calidad por diseño (QbD). El artículo examina factores en la evaluación de la variabilidad de los excipientes, los retos asociados que los desarrolladores necesitan abordar para diseñar y fabricar productos farmacéuticos sólidos orales y las soluciones para dichos retos. L os excipientes juegan un papel crucial en una formulación y, como parte de la misma, influyen en la calidad del producto farmacéutico final. El manejo de la variabilidad de los excipientes es un elemento esencial en el diseño y la manufactura de productos farmacéuticos sólidos orales y es una tarea integral en la aplicación de los principios de la calidad por diseño (QbD). Pharmaceutical Technology examinó el desempeño de los excipientes en la QbD en una transmisión por Internet (webcast) (www.pharmtech.com/excipient) en 2012. Participando de dicho webcast estuvieron Catherine Sheehan, directora de excipientes en la Farmacopea de EUA, Ian Robertson, gerente de QbD Global en Colorcon, Chris Moreton, vicepresidente de ciencias farmacéuticas en FinnBrit Consulting y Greg Amidon, profesor de investigación de ciencias farmacéuticas en el Colegio de Farmacia de la Universidad de Michigan y director del Panel de Expertos del Desempeño de Excipientes de la USP. En este artículo, Robertson ofrece información más profunda sobre el manejo de la variabilidad de los excipientes en paradigma de la QbD. Evaluando la variabilidad de los excipientes PharmTech: ¿Cuáles son las consideraciones clave en la evaluación de la variabilidad de los excipientes y cuáles son los desafíos asociados que los desarrolladores necesitan abordar para el diseño y manufactura de productos farmacéuticos sólidos orales? Robertson (Colorcon): Es importante entender los efectos de la variabilidad normal de los excipientes para asegurar que los riesgos potenciales para la calidad del producto farmacéutico sean manejados efectivamente. Con un enfoque cada vez mayor en la QbD, tanto el innovador como los desarrolladores del fármaco genérico deberán demostrar el manejo del riesgo del excipiente en relación con los atributos de calidad críticos de los productos farmacéuticos. De esta forma, mientras que es responsabilidad del desarrollador demostrar el diseño y manufactura robusta de la formulación, es importante que todas las partes interesadas colaboren al principio del ciclo de vida del producto para asegurar el éxito mutuo. Con frecuencia, se dispone del conocimiento y las herramientas para evaluar proactivamente los efectos de la variabilidad de los excipientes sobre la calidad del producto farmacéutico. Desde luego, esto no sólo proporciona el suficiente desarrollo sino que, de manera importante, da soporte a la implementación de una estrategia de control efectivo para la manufactura comercial posterior. De manera que uno podría preguntar ¿Por qué son variables los excipientes y cuáles son las fuentes de esta variabiPharmaceutical Technology en Español PT MAYO / JUNIO.indd 35 MAYO / JUNIO 2013 35 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes lidad? Bueno, los excipientes usados dentro de los productos farmacéuticos son diversos en términos de su química, origen, manufactura y también control. Hablando en general, podríamos considerar dos clases de excipientes. Los descritos como naturales o que se derivan de un origen natural y aquéllos descritos como sintéticos o semi-sintéticos. Los excipientes naturales o derivados naturalmente y los factores, incluyendo el origen de la cosecha junto con las variables ambientales, tales como el cultivo y las condiciones del proceso, pueden todos afectar las propiedades fisicoquímicas del excipiente resultante. Incluso para excipientes sintéticos o semi-sintéticos, las diferencias en la materia prima, tales como los componentes orgánicos e inorgánicos del aceite crudo o el gas, junto con la variabilidad en el proceso químico, contribuirán todos a la variabilidad general del propio excipiente. Es crítico que los fabricantes y vendedores de excipientes colaboren estrechamente con el desarrollador para reducir mejor los riesgos de fallas en la calidad. Para un fabricante individual de un excipiente, puede haber variabilidad de lote a lote en las propiedades fisicoquímicas. Con frecuencia, un fabricante puede hacer productos relacionados, como los diferentes grados físicos o químicos, o incluso abastecer a diferentes industrias. Por lo tanto, puede adoptarse diferentes campañas de manufactura, las cuales pueden llevar a la variabilidad asociada con el cambio, el arranque o el paro de una sola línea de producción. Ciertamente, entre los múltiples fabricantes de un excipiente, es probable que haya diferencias en las materias primas y en el proceso de producción usado, la escala de manufactura y la ubicación, todo lo cual puede contribuir a la variabilidad de las propiedades fisicoquímicas de un excipiente. Yo creo que es también importante reconocer la variabilidad en los controles usados. Aunque se requiere que los excipientes cumplan los estándares farmacopeicos apropiados, puede haber diferencias en las especificaciones del excipiente de vendedor a vendedor. Esto puede incluir los rangos especificados dentro de las pruebas estándar así como la inclusión de pruebas de propiedades fisicoquímicas no compendiales. Junto con los parámetros especificados, es importante también considerar tanto los parámetros no especificados así como los parámetros no rutinarios. La variabilidad de los parámetros no especificados o no reportados podría impactar el desempeño del producto farmacéutico dependiendo de su diseño o uso a que está destinado. Aunque no estén reportadas, estas propiedades pueden ser medidas por el fabricante como parte de su estrategia de control. Adicionalmente, los excipientes puede variar en lo que se denomina parámetros no rutinarios (p.ej., reactantes residuales y catalizadores residuales). La variación de estos parámetros puede no ser medida 36 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 36 comúnmente por el fabricante. Por lo tanto, en la mayoría de los casos los productos farmacéuticos robustos se desarrollan y fabrican con éxito para manejar dicha variabilidad de los excipientes. Sin embargo, la falla para comprender y controlar la variabilidad del excipiente ha llevado a algunos problemas de calidad serios. La FDA, por ejemplo, se ha expresado públicamente sobre la variabilidad de los excipientes y su relación con las recuperaciones de producto farmacéutico del mercado (recalls). Es claro que pueden fallar algunas prácticas existentes de desarrollo y manufactura para asegurar que rutinariamente se produzcan medicamentos con los estándares de calidad apropiados. Además, la demostración de calidad mediante el análisis no evita que estos productos sub-estándar entren al mercado. Obviamente, las fallas de calidad, incluyendo las relacionadas con la variabilidad de los excipientes, pueden tener consecuencias serias para el fabricante en términos de daños financieros y de reputación. Finalmente, el usuario final, es decir, el paciente, se pone en riesgo. Los productos farmacéuticos sub-estándar que llegan al paciente pueden impactar la seguridad y la eficacia. E incluso aquéllos que son capturados y rechazados por control de calidad o aquéllos que son recuperados del mercado pueden llevar a la escasez del fármaco. Esto, nuevamente, tiene un impacto en el paciente. De esta forma, con la atención del público cada vez mayor en la industria farmacéutica y las regulaciones, es claro que el manejo de la variabilidad de los excipientes será un área de importancia industrial cada vez mayor. Es crítico, por lo tanto que los fabricantes de excipientes y los vendedores colaboren estrechamente con el desarrollador para reducir mejor las fallas de calidad. Esto es importante desde el inicio en el desarrollo del producto farmacéutico, donde el conocimiento y la experiencia del excipiente pueden soportar proactivamente un diseño robusto de la formulación y un control eficiente de la manufactura. El no considerar la variabilidad normal de los excipientes puede llevar al diseño y desarrollo de formulaciones no robustas. Desafortunadamente, esto puede necesitar límites más estrechos en las especificaciones de los excipientes, la selección del lote, o incluso la manufactura a la medida para controlar el desempeño del producto farmacéutico terminado. Debe reconocerse que, en algunos casos, la capacidad del fabricante del excipiente para cumplir dichos requerimientos puede no ser fácilmente alcanzable, si no es que inalcanzable en lo absoluto. Esto, por lo tanto, presenta un riesgo y costo adicional para el producto en general. También es importante considerar la interacción de todas las variables, incluyendo las del API (ingrediente activo o fármaco) y las del proceso de manufactura. El uso de evaluación del riesgo es útil para identificar aquéllas variables primarias que puedan afectar los atributos de calidad críticos del producto farmacéutico. El uso de la QbD, por lo tanto, presenta una oportunidad para asegurar que la calidad se construye por diseño. La colaboración temprana de todas las partes interesadas puede asegurar mejor que los riesgos potenciales de la variabilidad normal de los excipientes pueden ser calculados eficiente- MAYO / JUNIO 2013 27/05/13 16:31 Marque en la tarjeta de servicio al lector el No. 18 Marque en la tarjeta de servicio al lector el No. 8 PT MAYO / JUNIO.indd 37 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes mente mediante nuestro conocimiento previo y las herramientas disponibles. Enfoques PharmTech: ¿Puede profundizar sobre ese conocimiento y las herramientas y soluciones relacionadas? Robertson (Colorcon): Como mencioné previamente, el diseño de la formulación es crítico para asegurar un desempeño robusto del producto. Y para ilustrar este punto, me gustaría mucho mostrar un ejemplo de cómo la variabilidad normal del excipiente en un polímero que controla la tasa de liberación del fármaco, la hipromelosa (METHOCELTM K15M CR) fue determinada para la liberación de un fármaco a partir de una matriz hidrofílica de liberación extendida. El estudio examinó la importancia de la concentración de METHOCELTM K15M CR con respecto al manejo de la variación de los atributos del material como tamaño de partícula, viscosidad y porcentaje de sustituyentes hidroxipropoxilo (HP). Y los rangos estudiados fueron en los extremos y el punto central de los límites de especificación. Utilizando clorhidrato de propanolol como el fármaco modelo, pudo verse que la liberación del fármaco fue más lenta cuando se incrementaba la concentración de METHOCELTM K15M CR de 15% a 30% (p/p) y esto, por supuesto, se podía esperar. La liberación del fármaco fue generalmente consistente a través de los extremos de la viscosidad y el porciento de sustituyentes hidroxipropoxilo (HP) independientemente de la concentración del fármaco. Por lo tanto, la formulación fue robusta para la variación normal de estos dos atributos del material. Curiosamente, sin embargo, para el tamaño de partícula se demostró claramente que la concentración más baja de METHOCELTM K15M CR, 15% (p/p) resultó no sólo en una diferencia de la tasa de liberación, como se vio previamente, sino también en variabilidad entre tabletas. Aquí, se demostró una liberación del fármaco más rápida y más variable para la formulación que contenía la fracción de partículas de tamaño en el límite superior de la especificación del polímero METHOCELTM K15M CR. En la concentración de METHOCELTM K15M CR de 30%, sin embargo, esta variación no se observó. Se demostró tal desempeño robusto de la disolución independientemente del tamaño de partícula. Estos ejemplos muestran que es prudente determinar si tales atributos del material son un riesgo potencial para los atributos de calidad del producto farmacéutico durante el desarrollo inicial de la formulación. Claramente, en esta etapa, es generalmente más fácil ajustar la formulación y/o el pro- ceso para manejar dichos efectos más que la implementación de cambios durante las últimas etapas del desarrollo del producto farmacéutico. El impacto de la variabilidad normal de los excipientes, sin embargo puede también ser manejada de otras formas. Ciertamente, la QbD da soporte a estrategias para desarrollar la flexibilidad de la formulación o el espacio de diseño de la formulación. El ajuste de la composición cuantitativa del lote de producto farmacéutico puede justificarse para manejar la variabilidad del atributo del excipiente entrante. Según se discute en las guías del ICH, es necesario el mejor conocimiento de los atributos del material para desarrollar y justificar dicha estrategia. No obstante, esto proporciona una oportunidad tanto para el desarrollador como para el proveedor para colaborar más y asegurar que pueden ser evaluadas las propiedades fisicoquímicas necesarias del excipiente para desarrollar dichas estrategias. Adicionalmente, también es importante no ver las especificaciones del excipiente para ventas como el criterio de valoración para el control de la variación del mismo. Las especificaciones de venta del excipiente y los límites de prueba pueden, desde luego, ser variables. Por lo tanto, esto puede ser no representativo de la capacidad de control del fabricante del excipiente. Y yo creo que esto es un punto importante, particularmente para la evaluación del riesgo. El mejor conocimiento aquí puede reducir el riesgo percibido de la variabilidad de la propiedad del excipiente sobre los atributos de calidad del producto farmacéutico. Y, ciertamente, los fabricantes del excipiente pueden proporcionar el conocimiento previo de su capacidad, por ejemplo, demostración de la capacidad del proceso, datos de tendencia representativos del atributo del material, o incluso estadísticas descriptivas que ilustren el control para la estrategia individual de manufactura. En el estudio de caso de la matriz de propanolol, otra herramienta disponible para el desarrollador es la de la muestra del atributo del excipiente. Esta puede estar disponible para ayudar al desarrollador en el análisis proactivo del efecto de la variabilidad normal del excipiente sobre su formulación particular. Sin embargo, esto puede no ser siempre útil para estudiar todos los atributos del excipiente, particularmente si el control del fabricante es exhaustivo y si la variabilidad lote a lote es insignificante. No obstante, dichos esquemas pueden ser valiosos para respaldar el diseño experimental y el posterior desarrollo del espacio de diseño. PT METHOCEL™ es marca registrada de The Dow Chemical Company Informes y Contrataciones: Tel: 52 (55) 5659-8880, 5536-2100, 5543-1486 E-mail: [email protected] 38 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 38 MAYO / JUNIO 2013 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes Tableteado Lucha contra los problemas comunes en el tableteado y el herramental FotografiaBasica/Getty Images Sesión de preguntas y respuestas moderada por Adeline Siew, PhD Este artículo proporciona un panorama general del proyecto de investigación antiadherente en la ciencia del tableteado (TSAR) de I Holland, el cual está realizando la compañía en colaboración con la Universidad de Nottingham en el Reino Unido. El proyecto TSAR busca comprender porque ciertas formulaciones se adhieren a herramental de la tableta, un problema principal encontrado por los fabricantes de tabletas. L os problemas durante la manufactura de tabletas con frecuencia resultan en tiempos muertos del proceso y costos de operación más elevados. Algunos de estos problemas pueden ser minimizados o eliminados con el mantenimiento y almacenamiento apropiado del herramental de las tabletas. Pharmaceutical Technology habló con los expertos en I Holland acerca de las causas de los problemas comunes tales como la variación del peso de las tabletas, la dureza o los problemas de rotura, el laminado, y el pegosteado, así como de un proceso de siete pasos para el cuidado del herramental. Los representantes de I Holland también discutieron la colaboración en la investigación de la compañía de la Escuela de Farmacia de la Universidad de Nottingham en el Reino Unido, la cual busca comprender por qué ciertas formulación se adhieren al herramental de las tabletas, un problema mayor que con frecuencia se encuentran los fabricantes de tabletas. El objetivo de este proyecto conjunto es desarrollar una herramienta predictiva que permite la identificación de la mejor solución de recubrimiento para los problemas de adhesión de la formulación sin necesidad de llevar a cabo experimentos de ensayo y error a escala completa con varios recubrimientos anti-adherentes. Ciencia del Tableteado PharmTech: ¿Qué es la ciencia del tableteado? I Holland: La ciencia del tableteado es parte de la oferta de servicios básicos de I Holland. Esto abarca muchos aspectos de nuestra capacidad de IyD, incluyendo el trabajo con socios académicos y técnicos sobre proyectos de investigación científica que nos ayudan a mejorar nuestra comprensión de porqué un punzón o una matriz se comportan bien. Por ejemplo, durante años muchos fabricantes de herramental han pulido los punzones hasta un acabado de espejo óptimo porque saben que esto ayuda a que el punzón se comporte más efectivamente, aunque nadie realmente comprende por qué es este el caso. Los fabricantes de punzones y matrices son esencialmente compañías de ingeniería y con frecuencia tienen una reluctancia a involucrarse en problemas de tableteado más amplios. Nuestra inversión en la ciencia del tableteado ayudará a los fabricantes de tabletas a reducir los gastos que pueden estar asociados con un desempeño pobre del herramental más abajo de la línea, eliminando muchos problemas antes que el punzón o la matriz golpeen la producción. Por ejemplo, la ‘adhesión’ es un problema mayor en la producción de tabletas que estamos tratando de enfrentar a través de nuestro trabajo con la Universidad de Nottingham con el proyecto de investigación anti-adhesión de la ciencia del tableteado (TSAR). Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 39 MAYO / JUNIO 2013 39 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes Esperamos entregar una herramienta predictiva que elimine la necesidad de pasar por costosos ensayos de recubrimiento para determinar la mejor solución de recubrimiento. de proporcionar capacitación sobre estos asuntos y cómo resolverlos (1). Problemas comunes en el tableteado PharmTech: ¿Cuáles son las soluciones a estos problemas? I Holland: Dependiendo de las causas exactas de cada uno de los problemas previamente descritos, existen varias soluciones potenciales. Como guía, seguir un simple proceso de siete pasos para el cuidado y mantenimiento del herramental puede ayudar a minimizar la presencia potencial de la mayoría de los problemas del tableteado y del herramental (2). El proceso de siete pasos es un enfoque lógicamente planeado y profesional para el mantenimiento y almacenamiento del herramental según se resume a continuación: • Limpiar. Cuando el herramental se retira de la tableteadora, debe ser limpiado concienzudamente y secado para remover cualquier residuo de aceite o de producto, especialmente de las partes difíciles de alcanzar como el grabado y las chavetas. • Evaluar. Los punzones y las matrices deben ser visualmente inspeccionados con aumento en busca de señales de daño, desgaste o corrosión y para validar el proceso de limpieza. Esta evaluación establecerá si el proceso de producción está corriendo bien o no, dando así pistas de problemas con la tableteadora o con el propio herramental y si se requiere algún mantenimiento del herramental. • Reparar. El desgaste ligero de la superficie, la corrosión y el daño en el herramental puede ser reparado y pulido hasta una condición utilizable. Las puntas desgastadas pueden resultar en tabletas de pobre calidad y definición inferior del grabado que puede llevar a punteado y adhesión. La reparación deben hacerla técnicos bien capacitados y experimentados de mantenimiento para asegurar que el herramental no excede los límites de tolerancia. • Medir. La medición es esencial después de reparar para asegurar que las dimensiones críticas del herramental se han mantenido dentro de una tolerancia de trabajo aceptable. La medición debe realizarse a intervalos regulares incluso si no ha sido necesaria la reparación, para verificar el desgaste natural durante el proceso de compactación. La medición esencial es la longitud de trabajo crítica del punzón ya que esto controla el espesor, el peso y la dosis de la tableta. • Pulir. El pulido ligero, controlada, sobre una base frecuente, asegurará que el herramental se mantiene con un terminado liso, ayudando así a maximizar la vida del herramental y reduce los problemas tales como la adhesión y el laminado. • Lubricar. La lubricación es importante para proteger, preservar y ayudar a una operación suave del herramental. Puede recomendarse un rango de aceites y grasas para diferentes aplicaciones, tales como preservativos, o para propósitos de lubricación. • Guardar. El almacenamiento y transporte del herramental debe ser específicamente diseñado para maximizar la seguridad y el manejo seguro para minimizar el daño y el deterioro. PharmTech: ¿Cuáles son los problemas comunes encontrados en la manufactura de tabletas? I Holland: Hay muchos problemas comunes encontrados en la manufactura de tabletas. Algunos de los más comunes están listados más adelante. Cada una de estas áreas de problemas puede tener varias causas potenciales, pero a continuación se resumen breves panoramas generales de los principales problemas: • Variación del peso de la tableta. La causa más probable de este problema es la extensa variación en las longitudes de trabajo del punzón, que con frecuencia se debe a punzones desgastados o adherencia/punteado que pueden causar acumulación de gránulos en la cara del punzón y resultar en longitudes de punzón no uniformes. • Punteado. El punteado se refiere a cuando un gránulo comprimido se adhiere al detalle (es decir, el grabado) en la cara del punzón. Este problema podría deberse a un diseño inapropiado del grabado, caras de la punta desgastadas, insuficiente fuerza de compactación o problemas de granulación tales como humedad excesiva o lubricante insuficiente. • Adhesión. La adhesión está definida como la adherencia de los gránulos en general a la superficie de la punta del punzón. Adicionalmente, el perfil inapropiado de la tableta puede tener un impacto en la dureza y densidad inadecuadas de la tableta. • Laminado. El laminado es la separación en láminas del cuerpo o copa de la tableta y con frecuencia está causado por el aire atrapado en el cuerpo de la tableta. • Pobre definición de la tableta (grabado en relieve). Este problema podría atribuirse a un pobre diseño del grabado (es decir, demasiado pequeño o demasiado superficial), caras del punzón desgastadas debido a una formulación abrasiva, o excesivo pulido. • Dureza de la tableta/problemas de rotura. Estos problemas son con frecuencia causados por longitudes disparejas del punzón en un juego, agentes aglutinantes incorrectos en la formulación, o laminado debido al aire atrapado. Existen otros problemas relacionados con el herramental, tales como: • Problemas de manejo del herramental • Rotura de la punta del punzón • Desgaste de la cabeza del punzón • Estrechez del punzón • Desgaste del hueco de la matriz • Desgaste de la punta por abrasión • Corrosión • Picoteado/impregnación de las caras de la punta del punzón Los fabricantes de punzones y matrices deben ser capaces 40 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 40 El proceso de siete pasos MAYO / JUNIO 2013 27/05/13 16:31 DuraLac®. Lactosa anhidra ahora disponible. De Meggle. Inmedi t Inmediatamente eficaz, MEGGLE también ofrece lactosa anhidra para una amplia variedad de aplicaciones p farmacéuticas. ¡Optimice ¡ p su formulación! Los beneficios hablan por p sí solos. Y por DuraLac®: – Perfectamente adecuada para la compresión directa y formulaciones de granulación seca – Excipiente p de elección para p formulaciones con p principios p activos sensibles a la humedad – Excelente rendimiento de dureza a baja fuerza de compactación – Humedad estable debido a la relativamente baja higroscopicidad DuraLac® de MEGGLE: Lactosa anhidra de calidad conocida. MEGGLE HEAD OFFICE: www.meggle-pharma.de [email protected] Tel.: +49 [0]807 173 476 MEXALC, S.A. DE C.V. www.mexalc.com [email protected] Tel. (52 55) 5616 0668; 5616 1651 Marque en la tarjeta de servicio al lector el No. 17 PT MAYO / JUNIO.indd 41 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes Investigación anti-adhesión PharmTech: ¿Podría decirnos más acerca del proyecto TSAR, para el cual usted está colaborando con la Universidad de Nottingham? I Holland: Desde el lanzamiento de nuestro PharmaCote en un rango de recubrimientos de punzón y matriz hace más de cinco años, I Holland ha sido llamado cada vez más para resolver problemas de adhesión dentro del sector farmacéutico ya que los fabricantes de tabletas se dan cuenta que estos problemas pueden ser eliminados sin reducir el rendimiento del producto e invertir en costosos sistemas de estearato de magnesio. La manera tradicional de resolver un problema de adhesión sería suministrarle al cliente con una serie de pruebas de herramientas que contienen muchos recubrimientos diferentes de punzones y matrices. Se lleva a cabo un ensayo de compresión completa en el sitio del cliente para averiguar el recubrimiento que más efectivamente resolvería el problema de adhesión. Este enfoque involucra una inversión significativa para el cliente en el herramental así como en tiempo. El objetivo del proyecto TSAR es desarrollar una herramienta predictiva que nos permita identificar cuál recubrimiento de punzón y matriz es más probable que resuelva estos problemas de adhesión, eliminando así la necesidad de llevar a cabo estudios de compresión a escala completa con todos los recubrimientos anti-adherentes. El desarrollo de la herramienta predictiva no comenzará hasta que hayamos colectado suficientes datos de interacción de muchos excipientes diferentes e ingredientes activos. Este trabajo está actualmente en marcha ya que estamos probando varias muestras suministradas por nuestros clientes. Nuestro objetivo es utilizar las técnicas de análisis multivariado recientemente desarrolladas, vinculadas a química de superficie en nanoescala y técnicas de morfología tales como microscopía de fuerza atómica (AFM), tiempo de vuelo secundario a espectroscopía de masas iónica (ToFSIMS), espectroscopía Raman, mediciones de ángulo de contacto, espectroscopía fotoelectrónica de Rayos X (XPS), microscopía electrónica de barrido (SEM) y perfilometría con láser. Una vez que los datos sean colectados, utilizaremos una herramienta de análisis de componentes que nos permita agrupar los diferentes excipientes/ingredientes activos. Sólo después de este proceso, podremos iniciar el desarrollo de la herramienta predictiva. Actualmente estamos a medio camino a través de dos años de proyecto y gastamos el primer año únicamente en colectar datos de varios productos suministrados por diferentes clientes. La pieza de equipo más utilizada a la fecha ha sido la AFM, la cual nos permite mapear cuantitativamente, a nivel de nanoescala, la adhesión en los punzones de tabletas recubiertos con PharmaCote utilizando partículas simples de fármaco/excipiente. Las bajas mediciones de la fuerza de adhesión (nN) colectadas dentro del AFM indican el nivel de fuerzas de Van der Waals que están presentes. También estamos cambiando la humedad y la temperatura dentro del ambiente de análisis para colectar datos sobre fuerzas capilares que estén presentes. Sólo cuando todos los ingredientes de la formulación estén probados se esta forma analítica, moveremos la formulación a un ambiente de producción y comprimiremos las tabletas utilizando el mismo herramental recubierto con PharmaCote. Esta revisión en el ‘mundo real’ permite que los resultados del estudio analítico sean verificados en un ambiente de producción y le da al cliente la seguridad de que están comprando la solución óptima para su problema específico. No se puede enfatizar lo suficiente en cómo es único cada problema de adhesión y puede variar significativamente de sitio a sitio, de tableteadora a tableteadora y de producto a producto, lo cual hace que las pruebas de compresión de laboratorio sean vitales. Referencias 1. Eurostandard Educational Collection 2010 Edition. 2. T. Higgins, Pharm. Tech. 37 (2) 30–31 (2013). PT “Mejora continua en el recubrimiento de tabletas y la granulación” continuación de la pág. 34 mices cónicos ofrecen un alto rendimiento del material y en bajos valores de velocidad del tamiz. Para evaluar el impacto de la velocidad del tamiz sobre el tamaño final del gránulo, la compactación se llevó a cabo en una fuerza de compactación específica de 10 kN/cm, 2 rpm de velocidad del rodillo y valores cada vez mayores de velocidad del tamiz para un tamaño de malla (es decir, tamiz raspador de 1.5 mm). Con velocidades más altas del tamiz, la cantidad de finos se redujo. Esto puede ser explicado por el hecho de que, con mayor velocidad del rotor, los listones necesitan menos tiempo para pasar la malla. Ocurre menos fricción durante la granulación y lleva a una menor cantidad de finos. Por lo tanto, la alteración de la velocidad del tamiz es otra posibilidad para ajustar la distribución deseada del tamaño de partícula de los gránulos finales. Conclusión Este estudio demuestra la funcionalidad de los nuevos com42 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 42 pactadores de rodillo. Fue posible producir precisamente una formulación de gránulos de placebo representativa, con desperdicio de material insignificante durante el arranque del proceso. Adicionalmente, el estudio muestra que una disposición adecuada del tamiz ofrece la posibilidad de lograr un tamaño de gránulo deseado alterando el tamaño de la malla y la velocidad del tamiz. Referencias 1. 2. 3. 4. 5. 6. R. Mueller and P. Kleinebudde, Eur. J. Pharm. Biopharm. 64 (3), 388-92 (2006). R. Mueller et al., Drug. Dev. Ind. Pharm. 36 (2), 234-243 (2010). R. Mueller and P. Kleinebudde, AAPS PharmSciTech. 28 (1), E21-31 (2007). R.W. Miller, Pharm. Technol. 18 (3), 154-162 (1994). P. Kleinebudde, Eur. J. Pharm. Biopharm. 58 (2), 317-326 (2004). Y. Teng, Z. Qiu, and H. Wen, Eur. J. Pharm. Biopharm. 73 (2), 219-229 (2009). PT MAYO / JUNIO 2013 27/05/13 16:31 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes Dividido de Tabletas Preocupaciones e innovaciones en el dividido y ranurado de tabletas Nicholas Eveleigh/Gettyimages Tecnologías analíticas PharmTech habló con Tim Freeman de Freeman Technology; David Beach, asesor y consultor de tecnología para Accu-Break Pharmaceuticals; y Thierry Menard, gerente de laboratorio, y Bruno Villa, presidente, ambos en Medelpharm, acerca de los retos e innovaciones en el dividido y ranurado de tabletas. PharmTech: ¿Cómo ha influido el desarrollo de nuevas tecnologías analíticas los criterios y estándares de calidad para la uniformidad de dosis unitarias? ¿Los sistemas más precisos han llevado a una mayor focalización en el ranurado de tabletas? Freeman (Freeman Technology). El ranurado de tabletas les permite a los pacientes controlar la dosificación de sus fármacos y podría potencialmente producir ahorros en el costo para los proveedores de salud. También hace que las tabletas grandes sean fáciles de tragar. Sin embargo, la producción de una tableta ranurada indudablemente suma complejidad al proceso de manufactura. Este tema salió a relucir por la reciente guía de la FDA sobre el ranurado de tabletas, tanto para el tableteado general y más específicamente para la manufactura de genéricos. Aunque un aspecto clave de la división de tabletas ha estado siempre en cómo se distribuye uniformemente el ingrediente activo dentro del producto terminado, es igualmente importante comprender cómo producir tabletas con la integridad mecánica y propiedades requeridas. Los avances en las técnicas espectroscópicas, tales como el infrarrojo cercano (NIR) y la espectroscopia de rotura inducida por láser (LIBS), significa que es ahora posible analizar la uniformidad de contenido a través de la superficie de una tableta. Adicionalmente, los avances en las técnicas de caracterización de polvos pueden apoyar en el desarrollo de procesos de manufactura verdaderamente robustos. La pobre uniformidad de contenido se atribuye con frecuencia a la dificultad de lograr una mezcla homogénea para empezar, lo cual puede deberse a que el ingrediente activo está presente en muy bajos niveles o es cohesivo y propenso a la aglomeración. Alternativamente, si el API tiene una diferencia significativa en el tamaño de partícula o en la densidad, con los excipientes en la mezcla, puede ser posible la segregación posterior al mezclado. La caracterización dinámica del polvo puede ayudar a optimizar el proceso de mezclado (1) y también pronostica la probabilidad de segregación. Esto, por lo tanto, da un conocimiento real de cómo abordar estos problemas. Adicionalmente, los parámetros dinámicos en combinación con el cizallamiento y las propiedades del granel, soportan una comprensión amplia de la conducta del polvo, ya sea durante el propio proceso de mezclado o cuando se procesa a través de la tableteadora. Estas propiedades juntas ayudan a los fabricantes a racionalizar y controlar el desempeño del polvo durante la descarga desde la tolva, mientras fluye a través del alimentado y durante el llenado de la matriz. Adicionalmente, proporcionan información relacionada con las características de compresión de la mezcla, así como a cuantificar la facilidad con la cual el aire es arrastrado y liberado, Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 43 MAYO / JUNIO 2013 43 27/05/13 16:32 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes los cuales impactan la calidad de la tableta terminada. Esta información puede ser extremadamente valiosa en asegurar compatibilidad entre el equipo de proceso seleccionado y las propiedades de la muestra, una pareja que es crucial para garantizar la uniformidad de contenido en tabletas ranuradas. PharmTech. Cuando los fabricantes están desarrollando una tableta diseñada para ser ranurada o subdividida, ¿Qué pruebas son necesarias para asegurar la estabilidad? ¿Cómo influye el factor de cumplimiento del paciente en estas decisiones? Freeman (Freeman Technology): La estabilidad genera problemas alrededor de las propiedades mecánicas de la tableta, por ejemplo, ¿puede ser partida en dos dosis igualmente útiles sin desmoronarse, y el producto terminado es estable a pesar de la ranura? Una vez más, la caracterización del polvo puede jugar un papel útil aquí en la optimización del producto y del proceso. Por ejemplo, uno de los factores que influyen la dureza y friabilidad de la tableta es la consistencia del llenado de la matriz, lo cual a su vez está impactado por las características de la mezcla de polvo. Incluso si la matriz puede ser llenada uniformemente a una velocidad de tableteado comercialmente viable, es vital que el aire arrastrado sea rápidamente liberado durante la compresión y la compactación, ya que la retención puede ocasionar laminación y la formación de casquillos. La retención es especialmente un problema para las tabletas más grandes que tienen más probabilidad de ser ranuradas. La capacidad de la mezcla para liberar aire puede ser cuantificada utilizando parámetros tales como permeabilidad y a través de caracterización dinámica de polvos aireados. Finalmente, la respuesta del polvo a la compresión puede ser medida directamente vía el análisis de compresibilidad. En resumen, la amplia caracterización multifacética del polvo soporta el desarrollo de formulaciones optimizadas y de procesos más exactos, los cuales ambos se requieren para producir tabletas ranuradas bien construidas, mecánicamente estables que son fáciles de usar por los pacientes. PharmTech: La FDA está actualmente trabajando en un proyecto de guía para el ranurado de tabletas. Si se implemen- La mayor atención por parte de la FDA intensifica la necesidad de un enfoque riguroso para el desarrollo de tabletas. — Tim Freeman ta, ¿Cómo podría afectar dicha guía los enfoques analíticos para las tabletas ranuradas, tanto en términos de nuevos desarrollos como en demandas de la industria? Freeman (Freeman Technology): La mayor atención por parte de la FDA en las tabletas ranuradas intensifica el requerimiento para que los fabricantes adopten un riguroso esquema de calidad por diseño (QbD) a sus procesos de desarrollo. Los esquemas analíticos que pueden llevar a una mejor comprensión de los parámetros críticos para la calidad, tales como la uniformidad de contenido y la estabilidad mecánica, como se señaló antes, son, por lo tanto, probables que se vuelvan 44 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 44 Cómo está abordando la USP las dosis divididas La Convención de la Farmacopea de EUA (USP) está examinando el tema de la uniformidad de dosis unitarias para determinar si el ranurado produce dosis divididas consistentes. Anthony DeStefano, PhD, vicepresidente senior de capítulos generales y estándares de calidad para la salud en la USP, da un panorama general del trabajo de la USP en esta área. PharmTech: Tenemos conocimiento de que la USP está examinando el tema de la uniformidad de dosis unitarias para determinar si el ranurado produce dosis divididas consistentes y como puede ser mejor evaluada la estabilidad y la friabilidad de las tabletas divididas. ¿Cuál es el estatus del trabajo de la USP sobre este tema? ¿Cuáles son los objetivos clave? DeStefano: Existe un proyecto de guía de la FDA que discute los temas del ranurado de tabletas desde una perspectiva de calidad por diseño, con un enfoque en lo que necesitan hacer los fabricantes para demostrar que una tableta ranurada puede ser etiquetada como ‘funcionalmente ranurada’. La USP está interesada en desarrollar un capítulo general que proporcione una prueba que como mínimo definiera las especificaciones post-comercialización, tales como requisitos de variación de peso, para demostrar que una tableta está funcionalmente ranurada. PharmTech: ¿Está la USP considerando armonizar su potencial nuevo capítulo sobre este tema con los requerimientos propuestos por la Farmacopea Europea (Farm.Eur.)? DeStefano: La USP está analizando la posibilidad de desarrollar un capítulo general que trate con el ranurado de las tabletas. El comité de la USP que desarrolla este capítulo utilizó la información disponible de la Farmacopea Europea como punto de inicio para sus deliberaciones. PharmTech: ¿De qué desafíos está consciente la USP con respecto al ranurado de tabletas para el desarrollo de fármacos y la industria de manufactura? DeStefano: La USP ha publicado un artículo de estímulo en el Foro Farmacopeico 35 (6) (2009), el cual recibió comentarios mezclados con preocupaciones de una amplia audiencia que incluía fabricantes, asociaciones de profesionistas y profesionales académicos. La prevalencia de la división de tabletas fue reconocida como un hecho y las observaciones fueron por lo general de apoyo a los esfuerzos de la USP para establecer estándares para las tabletas ranuradas y la conveniencia de dividir las tabletas. Un punto en común era que la capacidad para subdividir una tableta está implicada por la ranura. El estándar de la Farm.Eur. sobre el ranurado de tabletas está visto como un buen comienzo con la posibilidad de mejora. Se expresaron inquietudes de que sin evidencia de que el fármaco esté uniformemente distribuido a través de la tableta, el uso del peso para evaluar la calidad de las porciones de la tableta dividida puede no ser adecuado. cada vez más importantes. Las propiedades que pronostican el desempeño del mezclado y cómo se comportará la mezcla posteriormente en la tableteadora son especialmente valiosas. Por ejemplo, volviendo al tema del arrastrado y liberación del aire, los polvos para proceso con baja permeabilidad a velocidades altas pueden finalmente llevar a la acumulación de aire atrapado en el polvo en todas las etapas del tableteado, debido a las rápidas velocidades de flujo del polvo y el reciclado. El MAYO / JUNIO 2013 27/05/13 16:32 resultado neto es una degradación eventual en la calidad de la tableta. Esta es sólo una de muchas ilustraciones de cómo los datos de las propiedades del polvo pueden ayudar a los procesadores a tomar decisiones bien pensadas acerca de cuál equipo usar y a que índices de producción apuntar para una manufactura eficiente de tabletas ranuradas. Retos comunes PharmTech: ¿Cuáles son los retos comunes involucrados en la formulación, manufactura y análisis de tabletas ranuradas? Medelpharm: Es desafiante para los fabricantes de fármacos identificar una fórmula robusta que cree la dureza correcta y satisfaga los requerimientos de calidad para el dividido. Ser capaz de seleccionar rápidamente es clave con el fin de probar muchas fórmulas, formatos y opciones. El reto aquí es realizar pruebas rápida y eficientemente. Dosis unitarias PharmTech: ¿Qué tan fácil es para los fabricantes de tabletas tradicionales asegurar que las dosis unitarias de tabletas subdivididas caen dentro de los criterios aceptados de la USP, la Farm.Eur. y otros documentos guía? Beach (Accu-Break): Tradicionalmente, las ranuras en las tabletas han sido aplicadas más como una característica estética/de comercio que con la expectativa de algún propósito funcional. Con la llegada de los cambios regulatorios que empezaron primero en Europa y ahora también propuestos en EUA, el ranurado funcional de las tabletas ha tomado un La precisión y la confiabilidad son incluso más críticas que lo habitual cuando se producen tabletas ranuradas. — Medelpharm nuevo significado y ha colocado requerimientos adicionales en los fabricantes de desean comercializar tabletas con una ranura. El logro de los requerimientos actualmente establecidos para tabletas ranuradas funcionalmente no es un asunto sencillo para los fabricantes de tabletas porque el diseño de la tableta, los procesos y los análisis esperados de la forma farmacéutica terminada han todos tomado nuevas complejidades. Los datos deben ahora demostrar que la ranura resulta en una fracción de la forma farmacéutica completa que cumple los mismos requerimientos que la tableta intacta o sin ranura. Este requerimiento ha colocado requerimientos de análisis adicionales en estos fabricantes que desean tener tabletas funcionalmente ranuradas. Asuntos tales como uniformidad de contenido del segmento, friabilidad de los segmentos de la tableta, desempeño de la disolución in vitro y estabilidad de los segmentos de la tableta fracturada deben todos ser investigados y documentados como parte del desarrollo. Medelpharm: La uniformidad de contenido es incluso más crítica con una dosis que se hace más pequeña y una varianza en el peso ya elevada debido a las tabletas divididas. Esta va- rianza añade más presión en el escalamiento y la formulación, requiriendo procesos más robustos. Medelpharm, por ejemplo, hizo algunos experimentos para un cliente con herramental de forma progresiva donde examinamos la forma ideal (ángulo o indentación), así como la ranuración simple o de dos lados y los beneficios de usar una tableta con “cintura estrecha”. Produciendo pequeños lotes a velocidad de producción, fuimos capaces de pronosticar cuáles pares superiores o inferiores de punzones y la selección de la matriz, producían las mejores tabletas para cumplir los requerimientos regulatorios. Al mismo tiempo, probamos la eficiencia de las matrices conformadas y de diferentes puntas de punzón para encontrar el mejor compromiso entre la aceptación de calidad y los costos del herramental. Sin embargo, cumplir los requisitos es difícil, ya que las guías de calidad toman en cuenta la acción humana en la rotura de la tableta. Y, como todos sabemos, el proceso regulatorio definido para romper una tableta es rara vez seguido en la vida cotidiana. PharmTech: Para asegurar que las tabletas pueden ser divididas equitativamente con buena uniformidad de contenido de la dosis, ¿Qué factores necesitan tomar en cuenta los fabricantes? Medelpharm: Como siempre, el monitoreo y el conocimiento de los parámetros críticos clave son cruciales para la calidad. Durante la investigación y desarrollo de la etapa de compresión, es importante utilizar las herramientas de producción finales (punzones), usar parámetros de compresión similares que durante la producción (p.ej., fuerzas, ciclo/velocidad de compresión y pre-compresión) y el uso de sistemas similares de regulación del peso para controlar la homogeneidad del llenado y del peso. Diferentes fuerzas o velocidades de compresión entre investigación y desarrollo y producción crearán diferente dureza y densidad dentro de las tabletas, lo cual impactará la disolución y el rompimiento. El flujo de polvo en los sistemas de alimentación y dentro de la tableta durante la compresión, es otro parámetro que debería ser medido. Los simuladores de tableteadoras de producción de alta velocidad pueden monitorear estos parámetros. División de tabletas no ranuradas PharmTech: ¿Cuáles son los problemas o riesgos asociados con la división de tabletas no ranuradas, especialmente si tienen recubrimiento pelicular o tabletas de liberación modificada? Beach (Accu-Break): La división de tabletas no ranuradas está plagada de incertidumbre, sin importar el método de división involucrado. Las tabletas no ranuradas no están diseñadas para ser subdivididas en dosis parciales confiables y consistentes, y con frecuencia resultan en partes astilladas son pérdida de masa significativa. La división de tabletas con recubrimiento pelicular no ranuradas o de tabletas de liberación modificada, en la mayoría de los casos resultará no sólo en una dosis del medicamento inexacta, sino podría también tener otros efectos indeseables. En el caso de tabletas con recubrimiento pelicular, particularmente si el recubrimiento pelicular es funcional (p.ej., un recubrimiento entérico), el contenido de la tableta podría hidrolizarse en el estómago, Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 45 MAYO / JUNIO 2013 45 27/05/13 16:32 Sección Especial: Formas Farmacéuticas Sólidas y Excipientes resultando en una profunda degradación del fármaco. Similarmente con las tabletas de liberación modificada, la fractura de la tableta intacta podría resultar en un perfil de liberación marcadamente más rápido de los segmentos rotos y la producción de efectos colaterales indeseados debido a la absorción demasiado rápida del contenido de la tableta. En general, las tabletas no ranuradas, con recubrimiento pelicular deben tragarse enteras para evitar efectos no deseados. Medelpharm: Los principales riesgos son: • Control de la dosis del API. El riesgo de pedazos y fragmentos disparejos con dosis variables es muy alto en comparación con las tabletas ranuradas. Los riesgos se miden en procesos de aseguramiento de la calidad de acuerdo a las farmacopeas. • Modificación de las características de liberación temporizada. Estas características pueden, en algunos casos, destruirse totalmente cuando se rompe una tableta. Para reducir los riesgos y asegurar la QbD en tabletas multicapa diseñadas especialmente para ser divididas sin marcas de ranura, tienes que crear tabletas que sean prototipos reales de producción y navegar por el comportamiento en el espacio de diseño completo utilizando tableteadoras robot como el STYL’ONe. PharmTech: ¿Qué tan diferente es el proceso de tableteado para tabletas ranuradas en comparación con tabletas no ranuradas en términos de la tecnología y equipos involucrados, control de calidad y protocolos de aseguramiento de calidad, y requerimientos de análisis de estabilidad? Medelpharm: La precisión y la confiabilidad son incluso más críticas que lo acostumbrado cuando se producen tabletas ranuradas. La sensibilidad a la varianza se incrementa en los procesos de escalamiento hacia arriba, así como en la producción de tabletas. Es importante tomar nota de lo siguiente: • Antes de la compresión, es crucial asegurar que los procesos están en el sitio para evitar mal mezclado, segregación y sobre-lubricación; problemas clásicos durante el procesado. • Durante la compresión, debe haber control más estrecho de la regulación y reglas de rechazo. • La uniformidad de masa y el llenado son parámetros importantes. El diferente peso o el llenado disparejo crea diferente dureza, la cual a su vez impacta la friabilidad y la calidad de la rotura, así como el llenado disparejo. El diseño del herramental es, desde luego, crucialmente importante y la simulación por computadora puede proporcionar información sobre la línea de estrés dentro de las tabletas. Sin embargo, sólo los estudios de tabletas reales, en oposición a los modelos virtuales, en una tableteadora completamente industrial como el STYLCAM o el STYL’One pueden proporcionar datos y resultados rápidamente. Para limitar más el riesgo, un ‘robot de tableteado’ como un STYL’One puede navegar por el espacio de diseño y ayudar a seleccionar rápidamente el diseño ideal del punzón y los parámetros de producción. 46 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 46 Enfoque de la Farm.Eur. de la división de tabletas El capítulo 2.9.40 de la Farmacopea Europea (Farm.Eur.) es el requerimiento vinculante para la uniformidad de dosis. Recientemente, se ha creado un capítulo adicional, el 2.9.47, titulado “Demostración de Uniformidad de Dosis Unitarias utilizando Tamaños de Muestra grandes”. PharmTech habló con Susanne Keitel de la Comisión de la Farmacopea Europea acerca del capítulo alternativo. PharmTech: ¿Cómo se enfocan las tabletas ranuradas en la FarmEur.? Keitel: El capítulo general, ‘Uniformidad de Dosis Unitarias’, tiene que ver con tabletas intactas y no incluye criterios de aceptación para tabletas ranuradas. Sin embargo, la Comisión de la Farm.Eur. decidió incluir requisitos sobre la uniformidad de tabletas ranuradas en la sección de ‘Producción’ de la monografía general de Tabletas hace varios años. La sub-sección ‘Subdivisión de Tabletas’ describe cómo debe probarse la uniformidad de las tabletas ranuradas y define los criterios de aceptación. Estos requisitos fueron establecidos en colaboración cercana con las autoridades de los estados miembros de la Farm.Eur. PharmTech: La Farmacopea Europea ha creado un capítulo alternativo adicional, el 2.9.47, ¿Puede decirnos más? Keitel: El capítulo 2.9.40 (uniformidad de dosis unitarias) de la Farmacopea Europea, está basado en el texto armonizado con la Farmacopea de EUA y la Farmacopea Japonesa en el contexto del Grupo de Discusión Farmacopeico (PDG), y esto permanecerá como el requisito vinculante. Recientemente, sin embargo, la Comisión de la Farm.Eur. creó un capítulo alternativo adicional 2.9.47 titulado ‘Demostración de Uniformidad de Dosis Unitarias utilizando Tamaños de Muestra grandes’, el cual pretende, aunque no está limitado a, la evaluación de productos medicinales que son fabricados utilizando metodología de tecnología analítica de proceso (PAT). El cumplimiento con el capítulo general 2.9.40 Uniformidad de Dosis Unitarias, puede ser demostrado utilizando los procedimientos descritos en el capítulo 2.9.47. Este nuevo capítulo fue publicado en octubre del 2012 en el suplemento 7.7, y entrara en vigor en abril del2013. El capítulo les permite a los solicitantes usar la información obtenida durante la producción de tabletas, como la proveniente del análisis en línea por infrarrojo cercano, para evaluar la uniformidad de contenido del lote. La información de respaldo en este nuevo capítulo y la justificación pueden encontrarse en artículos adicionales (1, 2). PharmTech: ¿Cómo puede reducirse el gran número de unidades desviadas y qué guía sobre el proceso de tableteado como un todo puede usted ofrecer a los fabricantes de tabletas ranuradas? Keitel: La uniformidad de tabletas ranuradas depende de la formulación de la propia tableta, incluyendo su geometría y dureza y la geometría de la línea de rotura. Por lo tanto, necesita ponerse atención específica a la ranuración durante el desarrollo de la formulación y del proceso de manufactura. Este proceso es un ejemplo de la calidad por diseño: la ranuración necesita construirse dentro de la tableta. Esto está también reconocido por la Farm.Eur., y los reguladores de la UE ya que la demostración de la uniformidad de medias tabletas sólo se requiere durante el desarrollo y no como prueba de liberación de rutina. Referencias 1. 1. O. Holte and M.Horvat, Pharmeuropa 23.2., 286–293 (2011) O. Holte and M. Horvat, Pharm Technol. 36 (10) 118–122 (2012). MAYO / JUNIO 2013 27/05/13 16:32 Desafíos regulatorios PharmTech: Con la división de tabletas ganando mayor atención de la FDA y otros reguladores, ¿Cuáles serán los desafíos para los fabricantes de tabletas? Beach (Accu-Break): El desafío para los fabricantes de tabletas farmacéuticas con la llegada de las nuevas regulaciones es demostrar que sus productos cumplen o exceden los requisitos propuestos. Este desafío sólo puede ser cumplido por el cliente que diseña la formulación y el herramental de las tabletas para cumplir el análisis re querido de los segmentos de la tableta dividida después del rompimiento de la misma. Para aquéllos fabricantes deseosos de etiquetar un producto como ‘funcionalmente ranurado’, las nuevas regulaciones requerirán más diligencia durante el desarrollo del producto, la generación de datos apropiados para darle a los reguladores la confianza para aprobar las tabletas ‘funcionalmente ranuradas’, y el análisis continuo mejorado después de la aprobación para demostrar que el producto ‘funcionalmente ranurado’ continúa, en la fabricación comercial, para cumplir las especificaciones requeridas. Casi la mitad de todos los estadounidenses de más de 55 años están tomando al menos un fármaco de prescripción, y el 25% de los mayores de 55 años están tomando cuatro o más fármacos de prescripción. La demografía de ancianos en su conjunto es responsable de aproximadamente el 30% de las prescripciones emitidas en los EUA. La necesidad para la flexibilidad de las dosis, especialmente dentro de esta demografía es indiscutible. Reconocemos una paradoja en la industria farmacéutica: aunque que la flexibilidad de la dosis es claramente importante, la mayoría de los fabricantes no están comercializando formas farmacéuticas que permitan ajustes de dosis fácil y exactamente. La gran mayoría (estimada como mayor del 85%) de formas farmacéuticas orales fueron comercializadas ya sea como tabletas no ranuradas o como cápsulas. Muchas de las tabletas ranuradas restantes con frecuencia por- Las nuevas regulaciones requerirán más diligencia durante el desarrollo del producto. —David Beach tan una ranura cosmética que indica la mitad de la tableta, pero esa ranura ha demostrado ser escasamente funcional. La Unión Europea reconoció la necesidad del ranurado funcional desde hace una década e implementó la Monografía 0478 de la Farmacopea Europea. En EUA, la necesidad de un ranurado eficaz y consistente de las tabletas ha llegado recientemente a un centro de atención con la publicación de la USP de Estándares Farmacopeicos para las Características de Subdivisión de Tabletas Ranuradas, y la guía de la FDA titulada Guía para la Industria, Ranurado de Tabletas: Nomenclatura, Etiquetado y Evaluación de Datos. Nuestras tecnologías Accu-Break fueron diseñadas para crear dosis farmacéuticas que pueden subdividirse fácilmente a mano en dosis exactas más pequeñas. En el desarrollo de varias tecnologías, nos enfocamos en el apego a los siguientes parámetros para nuestras tabletas: • Las tabletas deben dividirse en dosis parciales exactas, incluyendo ¼ de dosis si se desea. • Las dosis parciales deben pasar la uniformidad de contenido. • Las tabletas deben ser fáciles de romper por los pacientes. • Las tabletas y las dosis parciales deben pasar la friabilidad, la disolución y las pruebas de estabilidad. • La tableta intacta debe ser ingerible (es decir, no demasiado grande). • El costo de la producción unitaria por tableta debe ser comparable al de las tabletas convencionales. • Las formulaciones de liberación controlada y el recubrimiento pelicular deben ser una opción. Hemos desarrollado dos distintas tecnologías de tableta multicapa, conocidas como ‘Accu-B’ y ‘Accu-T’, las cuales ambas incorporan una capa sin fármaco estratégica que sirve como capa de rotura dentro de las tabletas: Con la tecnología Accu-B, la forma farmacéutica tiene dos capas, una de las cuales no tiene fármaco. La segunda capa contiene fármaco y está profundamente ranurada. La capa sin fármaco proporciona varias características únicas: la primera y principal, dada la profunda ranura en la capa del fármaco, la capa sin fármaco forma una columna vertebral que le da a la forma farmacéutica terminada la fuerza mecánica para soportar las operaciones de acondicionado y embarque. La segunda, la capa sin fármaco es el plano de fractura para la tableta Accu-B. La tableta puede romperse a través de la ranura, y la fractura ocurre en la capa sin fármaco. En comparación con una tableta ranurada convencionalmente, el diseño de bicapa Accu-B asegura la exactitud de la dosis parcial y elimina las preocupaciones sobre la pérdida de masa. Las tabletas ranuradas pueden también satisfacer los requerimientos de análisis y datos tanto para la Monografía 0478 de la Farm.Eur. como la nueva guía de tabletas ranuradas de la FDA. Nuestra tecnología Accu-T utiliza hasta cinco capas en una tableta ‘más alta que ancha’, y la incorporación de capas sin fármacos sirve a uno de dos propósitos: Se incorpora una capa de rompimiento sin fármaco dentro de la mitad de una tableta Accu-T y se usa para separar las capas que contienen el fármaco. Como las capas que contienen el fármaco están físicamente localizadas en la parte de ‘arriba’ y en el ‘fondo’ de esta tableta más alta que ancha, el rompimiento de la tableta a través de la capa media de placebo separa la dosis en mitades exactas. La capa sin fármaco proporciona una barrera física entre los ingredientes activos. Esta barrera permita la formulación de activos incompatibles sin preocupaciones acerca del comezclado y los problemas resultantes de estabilidad física o química. La tecnología utiliza maquinaria que puede producir tabletas con hasta cinco capas comprimidas de manera que el uso de más de una capa sin fármaco puede facilitar una “poli píldora” con tres diferentes formulaciones conteniendo APIs. Referencias 1. Freeman Technology, Blending white paper, http://www. freemantech.co.uk/en/literature-and-downloads/articles-andwhite-papers.html#white-papers PT Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 47 MAYO / JUNIO 2013 47 27/05/13 16:32 RESOLUCIÓN DE PROBLEMAS glowimages/GETTY IMAGES Equipo y Proceso Resolución de problemas de tableteo y herramental Trevor Higgins La adopción de un proceso de siete pasos para el mantenimiento y el almacenamiento mejora la calidad del tableteado. L os problemas en la manufactura de las tabletas y las fallas del herramental de las mismas son generalmente el resultado de uno o de una combinación de lo siguiente: • Producto/gránulo difícil • Diseño inapropiado de la tableta • Preparación y operación incorrecta de la tableteadora • Mantenimiento inadecuado de la tableteadora • Pobre condición del herramental de las tabletas. La pobre condición del herramental, en particular, puede causar muchos problemas. Sin embargo, estos problemas pueden minimizarse o eliminarse, adoptando un proceso simple, de siete pasos, de cuidado del herramental. El proceso de siete pasos es un esquema lógico, planeado y profesional para el mantenimiento y el almacenamiento del herramental que ha sido adoptado por muchas compañías alrededor del mundo como un procedimiento estándar de operación (PNO). El proceso de siete pasos 1. Limpiar. Cuando el herramental se retira de la tableteadora, debe ser perfectamente limpiado y secado para eliminar cualquier aceite o residuo de producto, especialmente de áreas difíciles de alcanzar (p.ej., ranuras y relieves). El equipo utilizado para este proceso Trevor Higgins es técnico experto en I Holland, tel. 44 0 115 9726153, [email protected] 48 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 48 podría incluir limpieza ultrasónica y procesos de lavado automatizado. Es esencial, sin embargo, que el proceso no cause corrosión del material del herramental y para este fin, debe utilizarse un inhibidor de la corrosión. 2. Evaluar. Los punzones y las matrices deben ser inspeccionados visualmente bajo aumento en busca de señales de daño, desgaste o corrosión y validar el proceso de limpieza. Esta evaluación establecerá si el proceso de producción está corriendo bien o no. La evaluación también dará pistas para problemas con la tableteadora o el propio herramental e indicará si se requiere algún mantenimiento del herramental. El equipo típico incluye lentes de alto aumento y microscopios. 3. Reparar. El desgaste ligero de la superficie, la corrosión y el daño en el herramental pueden ser reparados y pulidos hasta una condición utilizable. Las puntas desgastadas pueden resultar en tabletas de pobre calidad e inferior definición del grabado, lo que puede llevar a laminado y pegoteado. Equipo tal como el mandril motorizado y el motor de pulido de doble extremo se usa junto con accesorios de pulido. La reparación debe llevarse a cabo por técnicos de mantenimiento bien entrenados y experimentados para asegurar que el herramental no se salga de los límites de tolerancia. La reparación no debe realizarse en herramental con recubrimiento ya que esto puede eliminar el recubrimiento del punzón. 4. Medir. La medición es esencial después de la reparación para asegurar que se han mantenido las dimensiones cruciales del herramental dentro de una tolerancia de trabajo aceptable. El equipo para medir puede ir desde simples micrómetros manuales, calibradores vernier, y medidores de altura hasta sistemas de medición semi-automáticos, computarizados, digitales. La medición debe llevarse a cabo a intervalos regulares, incluso si no ha sido necesaria la reparación, para verificar el desgaste natural durante el proceso de compactación. La medición esencial es la longitud de trabajo crítico del punzón, ya que éste controla el espesor, el peso y la dosis de la tableta. 5. Pulido. Un pulido ligero, controlado, de manera frecuente, asegurará que el herramental se mantenga con un terminado liso, ayudando a maximizar la vida del herramental y a reducir problemas tales como el pegoteo y el laminado. El pulido manual, para remediar, puede ser realizado utilizando motores de pulido con doble extremo con ruedas para pulir de nylon y compuestos abrasivos finos. Un proceso más controlado y consistente es el sistema de pulido por arrastre, automatizado, el cual se apoya menos en la habilidad y experiencia del operador. Este también permite que se pulan hasta 70 punzones en un ciclo de 20 minutos, proporcionando así aumento de la eficiencia. No se requiere volver a limpiar después del pulido siempre y cuando se use un medio y pasta para pulido de grado alimenticio durante esta operación. 6. Lubricar. La lubricación es importante para proteger el herramental MAYO / JUNIO 2013 27/05/13 16:32 y ayudar a que la operación sea suave. Puede recomendarse un rango de aceites y grasas para las diferentes aplicaciones. 7. Guardar. El almacenamiento y el transporte del herramental deben estar específicamente diseñados para minimizar el daño y el deterioro. Existen diferentes maneras de guardar el herramental de las tabletas de manera segura y confiable; esto va desde los gabinetes para almacenamiento hasta contenedores de almacenamiento diseñados a la medida. Cualquiera que sea el sistema adoptado, es importante que el herramental esté separado para evitar contacto y que la condición del herramental no se deteriore durante el almacenamiento. La aplicación del proceso en siete pasos tendrá un impacto directo sobre la reducción de muchos problemas comunes de las tabletas y el herramental, resultando así en una tableta de mejor calidad, y puede proveer un ahorro del costo directo para el fabricante de tabletas. Figura 1. Típico daño a un borde delicado de la punta del punzón Figura 3. Típico anillado del hueco de la matriz Figura 2. Típico desgaste del cabezal Figura 4. Pegoteado (es decir, el producto se adhiere a la cara de la punta del punzón) all figures are courtesy of the author. Aplicación del proceso a los problemas del tableteado Pueden identificarse problemas comunes y resolverse utilizando el proceso de siete pasos. Daño en el borde de la punta del punzón. Los bordes de la punta del punzón son muy delicados y el daño en la forma de rasguños y abolladuras pueden causar rebabas y astillas de vez en cuando (ver Figura 1). Estos defectos pueden llevar a fallas más serias, tales como la rotura de la punta del punzón. La experiencia nos dice que aproximadamente el 80% del daño a los punzones y matrices es generalmente causado de manera accidental cuando se manejan los punzones durante los procesos de producción y cuidado del herramental. El daño puede ocurrir, por ejemplo, cuando se carga o se descarga el herramental en la tableteadora, durante el almacenamiento o mientras se limpia o se pule el herramental. Adoptando los Pasos 1 (Limpiar) y 2 (Evaluar) del proceso de siete pasos, puede identificarse este tipo de daño y, repitiendo la evaluación a lo largo del proceso, podemos reconocer las causas principales. Si el daño es sólo ligero, puede ser posible usar el Paso 3 (Reparar) para reparar el daño, removiendo las rebabas y volviendo a pulir los bordes de la punta hasta una condición buena utilizable, asegurando así una apariencia consistente de la tableta. Desgaste del cabezal. Las áreas del punzón que están en contacto con otras partes de la tableteadora y que están sujetas a fuerzas de fricción y compactación a alta velocidad son típicamente propensas al desgaste. Un ejemplo es el cabezal “de permanencia” plano, el cual está en contacto con los rodillos de precompresión y compresión principal (ver Figura 2). Debe investigarse el desgaste prematuro. El desgaste puede atribuirse a varias causas, pero comúnmente se debe a lo ajustado del punzón y/o a una pobre lubricación. Nuevamente, esto puede identificarse durante el Paso 2 (Evaluar). Cualquier desgaste ligero puede eliminarse con un pulido de remedio mediante el Paso 3 (Reparar). El pulido debe ser seguido de la medición de la longitud de trabajo crítica durante el Paso 4 (Medir) asegurando así que los punzones están dentro de un rango de tolerancia aceptable para un buen peso de la tableta y control del espesor. El desgaste del ángulo del cabezal de la leva puede también ser el resultado de punzones apretados o de carencia de lubricación y este desgaste puede también ser monitoreado y reparado como se indicó anteriormente. “Resolución de problemas de tableteo y herramental” continúa en la pág. 59 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 49 MAYO / JUNIO 2013 49 27/05/13 16:32 RESOLUCIÓN DE PROBLEMAS glowimages/GETTY IMAGES Equipo y Proceso Esterilización con Dióxido de Nitrógeno Evan Goulet La esterilización a temperatura ambiente utilizando gas de dióxido de nitrógeno beneficia a los fármacos parenterales. Evan Goulet, PhD, es gerente de aplicaciones técnicas en Noxilizer, Baltimore, MD, [email protected]. 50 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 50 de vapor saturado. Debido a esto, no es probable que ocurra la condensación del esterilizante, incluso en geometrías complicadas. No se requiere el calentamiento de la cámara de esterilización de NO2 para mantener la fase gaseosa del esterilizante, lo cual permite que la esterilización y aireación se lleven a cabo a temperatura ambiente. Sin embargo, tanto el EO como el H2O2 requieren algún grado de calentamiento, lo cual puede resultar en la desestabilización de productos sensibles. Los empaques esterilizados pueden ser manejados inmediatamente después del ciclo (Noxilizer, Esterilizador Industrial de Dióxido de Nitrógeno RTS 360). No se requiere el calentamiento de la cámara de esterilización con dióxido de nitrógeno. La esterilización con NO2 proporciona una rápida y efectiva inactivación de formas tanto vegetativas como de esporas de bacterias. Esta rápida letalidad permite un nivel de aseguramiento de la esterilidad de 10-6 a ser alcanzado en un ciclo con un tiempo típico de puerta a puerta de 60 - 120 minutos, minimizando así el tiempo que está expuesto el producto farmacéutico a temperatura ambiente. No existe una fase de preacondicionado y la aireación del esterilizante residual del producto está incluida en el tiempo de ciclo global. El NO2 es compatible con muchas de las opciones de empaque de barrera estéril en el mercado, como los sobres de Tyvek y charolas de plástico con tapas de Tyvek. Como el NO2 es un esterilizante de superficie, el gas requiere acceso al producto, lo cual es proporcionado por el Tyvek respirable. La esterilización con NO2 típicamente se llevaría a cabo en el empaque primario, y cualquier instrucción para el uso sería incluida en el empaque secundario. El NO2 esterilizante, aunque es un gas tóxico, no es carcinogénico y no es inflamable, lo que lo hace atractivo como una opción para llevar la esterilización al piso de manufactura para los fabricantes de mayores volúmenes. La esterilización doméstica ofrece ahorros potenciales en términos de los costos de transporte e inventario que se arrastran, asociados con la esterilización por contrato. La esterilización puede colocarse en línea entre las operaciones de empacado primaria y final. Para los fabricantes cuyos volúmenes no son suficientemente grandes para justificar una esterilización en el sitio, pero quienes requieren esterilización a temperatura ambiente, la esterilización con NO2 por contrato es una opción. PT IMAGE COURTESY OF THE AUTHOR. E l gas de dióxido de nitrógeno (NO2) puede darles a los fabricantes de productos farmacéuticos parenterales con medios de esterilización verdaderamente a temperatura ambiente de las superficies exteriores de los contenedores de fármacos para una sola dosis que están destinados a usarse en un campo estéril. Otras opciones de esterilización como el óxido de etileno (EO), el peróxido de hidrógeno (H2O2) y la radiación, pueden exponer a los productos farmacéuticos a temperaturas elevadas durante tiempos extendidos o penetrar el contenedor y los sistemas de cierre. Ambos escenarios pueden afectar adversamente los productos farmacéuticos o los biológicos, especialmente aquéllos que tienen estabilidad limitada a temperaturas elevadas. El NO2 es compatible con muchos de los materiales que son comunes a los contenedores de fármacos parenterales y sistemas de cierre, incluyendo vidrio, copolímeros de olefinas cíclicas (COC), polipropileno, hule silicón, elastómeros termoplásticos y hules farmacéuticos. Como esterilizante de superficie, el NO2 no penetra los contenedores o sistemas de cierre durante el proceso de esterilización, dejando el producto farmacéutico no afectado. El NO2 posee algunas propiedades químicas y físicas específicas que lo posicionan bien para usar como esterilizante para productos farmacéuticos parenterales sensibles a la presión y temperatura. Como hierve a 21°C, el esterilizante NO2 puede introducirse dentro de la cámara con mínimo o ningún vacío. La esterilización se lleva a cabo típicamente utilizando concentraciones de NO2 que están en el rango de 1-2% de la presión MAYO / JUNIO 2013 27/05/13 16:32 Síntesis y M anufactura de A pis Logrando la Estereoselectividad en la Síntesis Asimétrica Patricia Van Arnum Los investigadores utilizan catalizadores inorgánicos como una alternativa a los biocatalizadores, en la conversión selectiva de azúcares para producir bloques de construcción quiral. L a química quiral juega un papel significativo en el desarrollo de intermedios farmacéuticos y APIs, y como tal, los avances en la síntesis asimétrica son de valor para las compañías farmacéuticas. Los investigadores de la academia y la industria continúan desarrollando nuevas rutas para lograr la enantioselectividad deseada. Evaluando la oportunidad El mercado global para la tecnología quiral, inclusive de las aplicaciones en farmacéuticos, se espera que muestre un crecimiento moderado durante los próximos cinco años. El mercado global de tecnología quiral tuvo un valor cercano a los $ 5,300 mdd en el 2011, de acuerdo a un análisis reciente de BCC Research. Se espera que este Patricia Van Arnum es editora ejecutiva de Pharmaceutical Technology, 485 Route One South, Edif. F, Primer Piso, Iselin, NJ 08830, tel. 732.346.3072, [email protected], twitter@PharmTechVArnum mercado aumente a una tasa de crecimiento anual compuesto (CAGR) de 6.5% desde el 2011 hasta el 2016 y se aproximará a $7,200 mdd para finales del período previsto. Los productos de la síntesis quiral representaron la mayoría del mercado de tecnología quiral en 2010, con un 80% de participación (es decir, $ 3,900 mdd en ingresos). Este segmento del mercado se estimó en $4,200 mdd en 2011 y se espera que sea de $5,700 mdd para el 2016, una CAGR de cinco años de 6.4% de acuerdo a BCC. El mercado del análisis quiral fue valorado en $785.7 mdd en 2010 y creció a $839.4 mdd en 2011. Se proyecta que este mercado alcance casi $1,100 mdd para el 2016 una CAGR de 5.8% durante el período de cinco años, de acuerdo a BCC. Generando epímeros del azúcar Una revisión de la literatura reciente revela varios esquemas interesantes en la química quiral. Uno de dichos esquemas involucra la síntesis de azúcares raros, los cuales tienen potencial en varias aplicaciones importantes que incluyen bloques de construcción quiral en síntesis de productos naturales. Los métodos de producción actuales, no obstante, utilizan procesos bioquímicos costosos y complejos para transformar abundantes azúcares que se encuentran fácilmente en estos azúcares raros. Para abordar esta limitación, los investigadores del Instituto de Tecnología de Massachusetts (MIT) han encontrado una manera de utilizar catalizadores inorgánicos en lugar de enzimas para generar epímeros de azúcar de manera simple y robusta, de acuerdo a un comunicado de prensa del MIT el 10 de octubre del 2012. Típicamente, los procesos bioquímicos utilizados para generar azúcares raros de azúcares más abundantes involucran tres clases principales de enzimas, dos de las cuales, las isomerasas y las oxidorreductasas, son activas en un amplio rango de sustratos simples, pero las cuales también pueden resultar en la formación de productos colaterales. Por ejemplo, la xilosa isomerasa convierte la glucosa en fructosa y simultáneamente convierte la fructosa en manosa. Estos procesos han generado algunos azúcares raros comercialmente disponibles, pero la compleja naturaleza de este proceso bioquímico lo hace costoso, de acuerdo al comunicado de MIT. La tercera clase de enzimas, las epimerasas, son potencialmente los biocatalizadores más útiles para la extensa producción de azúcares raros ya que éstos ofrecen alta especificidad para productos y son capaces de modificar selectivamente los azúcares en múltiples posiciones del carbono. Al igual que todos los catalizadores biológicos, sin embargo, las epimerasas pueden ser frágiles ya que requieren condiciones de reacción específicas y sólo pueden actuar sobre azúcares previamente funcionalizados. Los investigadores del MIT reportaron el uso de catalizadores inorgánicos en lugar de las enzimas para generar epímeros de azúcar, ofreciendo así una alternativa a los biocatalizadores en la conversión selectiva de azúcares (1). El sistema catalítico involucra el uso de un silicato microporoso sustituido con estaño (Sn-Beta Zeolite) combinado con una sal de borato. Los investigadores del MIT encontraron que el Sn-Beta zeolite en presencia de tetraborato de sodio catalizaba la epimerización selectiva de aldosas en medio acuoso. La reacción procede por medio de un mecanismo de cambio de carbono 1,2, en Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 51 MAYO / JUNIO 2013 51 27/05/13 16:32 Síntesis y M anufactura donde los enlaces C-C se mueven dentro de la columna vertebral de la molécula, de acuerdo al comunicado de MIT. Otros avances en química quiral Los investigadores del Departamento de Química Aplicada de la Facultad de Ciencias de la Universidad de la Ciencia de Tokio y del Centro de la Fundación Japonesa para la Investigación del Cáncer desarrollaron un método para la síntesis total del AMF-26, un agente antitumor que rompe el sistema de Golgi inhibiendo la activación del factor 1 de la ADP-ribosilación (2). Una parte clave de la síntesis fue la construcción del precursor lineal quiral mediante la reacción del aldol asimétrico seguido por una reacción de Diels-Alder intramolecular estereoselectiva predictiva asistida por computadora (2). Los investigadores también reportaron recientemente lo que clasificaron como la primera síntesis asimétrica organocatalítica de oxindoles 3,3-disustituidos que presenta dos heteroátomos en la posición C3 empleando la aminación altamente enantioselectiva de 3-ariltiooxindoles o 3-alcoxioxindoles utilizando DBAD (3). El trabajo demostró que los 3-tiooxindoles y 3-alcoxioxindoles fueron nucleófilos reactivos para el desarrollo de reacciones asimétricas catalíticas (3). En otras novedades, los investigadores describen su trabajo que involucra una reacción de cicloadición doble (1,3)-dipolar asimétrica catalítica. Ellos reportaron que utilizando un catalizador de plata quiral, pueden prepararse pirrolizidinas enantio-enriquecidas en un matraz a partir de materiales de inicio económicos, disponibles comercialmente. Los productos de pirrolizidina contienen una variedad de patrones de sustitución y tantos como seis centros estereogénicos (4). En el área de la biocatálisis, los investigadores de la Escuela de Ingeniería Química y biomolecular, del Instituto Georgia de Tecnología, del Instituto Petit de Bioengienería y Biociencia y Merck % Co., alteraron con éxito una leucina deshidrogenasa a través de varias rondas de ingeniería de proteínas hasta una amina deshidrogenasa enantioselectiva (5). En lugar del α-ceto ácido de tipo silvestre, la nueva amina deshidrogenasa acepta la cetona análoga, metil isobutil cetona, la cual corresponde al intercambio del grupo carboxi por 52 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 52 de A pis un grupo metilo para producir (R)-1,3dimetilbutilamina quiral (5). Otros esquemas catalíticos En la síntesis de intermedios farmacéuticos o APIs, pueden ser útiles los amplios avances en catálisis. El grupo de investigación del Profesor Petri Pih ko en el Departamento de Química y el Centro de NanoCiencias de la Universidad de Jyväskylä en la Academia de Finlandia, resolvió recientemente dos problemas en catálisis química, de acuerdo a un comunicado de prensa de diciembre 20 de 2012. En el primer proyecto, los investigadores diseñaron un catalizador intramolecularmente asistido para la síntesis de beta-aminoácidos. Los catalizadores previamente publicados trabajan sólo con cadenas laterales aromáticas en las iminas, pero el nuevo catalizador diseñado en la Universidad de Jyväskylä no tiene esta limitación, de acuerdo al comunicado. El método puede ser aplicado en la síntesis de beta-aminoácidos, los cuales son bloques de construcción importantes. Para la comprensión del mecanismo catalítico y el diseño del catalizador, los investigadores colaboraron con los grupos de investigación del Profesor Imre Pápai en la Academia Húngara de Ciencias para estudios computacionales y el Profesor de Academia Kari Rissanen en la Universidad de Jyväskylä para la caracterización de los catalizadores por rayos X. En un segundo proyecto, los investigadores identificaron un nuevo mecanismo para la reacción de adición de Michael catalizada por aminas entre aldehídos y nitroalquenos. El nuevo modelo propuesto por los grupos de Pihko y Pápai incluye una nueva especie, un anillo de seis miembros, como el intermedio clave en ciclo que está protonado en el paso determinante de la velocidad. El trabajo es una combinación de estudios computacionales y experimentales que se complementan entre sí en la comprensión del mecanismo de reacción. Específicamente, los investigadores utilizaron óxidos de dihidrooxazina, los cuales son intermedios estables que se protonan directamente, sin la intermediación de los zwitteriones, en adiciones de Michael organocatalíticas de aldehídos y nitroalquenos. La protonación de estas especies explica el papel del co-catalizador ácido en estas reac- ciones y la estereoquímica observada cuando la reacción se lleva a cabo con α-alquilnitroalquenos (6). El BINOL y sus derivados son clases de ligandos ampliamente usados en síntesis asimétrica, como las reacciones de Diels-Alder, la adición de carbonilo, y las reducciones (7). Los investigadores de la Universidad de Texas, en Austin, han desarrollado un catalizador bifuncional derivado del BINOL para producir bromolactonizaciones altamente enantioselectivas de ácidos carboxílicos no saturados (8, 9). Específicamente, el catalizador promovió bromolactonizaciones altamente enantioselectivas de ácidos 4- y 5-aril4-pentenoico, pero también catalizó las bromolactonizaciones altamente enantioselectivas de ácidos 5-alquil4(Z)-pentenoicos. Los investigadores afirman que estas reacciones representan las primeras bromolactonizaciones catalíticas de ácidos olefínicos alquilsustituidos que procedieron por medio de ciclizaciones en modo 5-exo para dar lactonas en las cuales se forman nuevos enlaces carbón-bromo en un centro estereogénico con alta enantioselectividad. Los investigadores también reportaron sobre lo que dicen que es la primera desimetrización catalítica de un ácido dienoico pro-quiral mediante bromolactonización enantioselectiva (8, 9). Referencias 1. 2. 3. 4. 5. 6. 7. 8. 9. Y. Román-Leshkov, “Sn-Beta Zeolites with Borate Salts Catalyze the Epimerization of Carbohydrates via an Intramolecular Carbon Shift,” Nature Comnun., online, DOI:10.1038/ncomms2122, Oct. 9, 2012. I. Shiina, J. Med Chem. 56 (1), 150–159 (2013). J. Zhou, “Organocatalytic Asymmetric Synthesis of 3,3-Disubstituted Oxindoles Featuring Two Heteroatoms at C3 position,” Chem. Commun., online, DOI: 10.1039/C3CC38819K, Jan. 23, 2013. A.D. Lim, J.A. Codelli, and S.E. Reisman, “Catalytic Asymmetric Synthesis of Highly Substituted Pyrrolizidines,” Chem. Sci., online, DOI: 10.1039/ C2SC21617E, Nov. 13, 2012. M.J. Abrahamson, Angew. Chem., Int. Ed. Engl., 51 (16), 3969–3972 (2012). G. Sahoo, Angew. Chem., Int. Ed. Engl. 51 (52), 13144–13148 (2012). W. Sommer and D. Weibel, Aldrich ChemFiles 8.2 (56) (2008). D.H. Paull, J. Am. Chem. Soc., 134 (27), 11128–11131 (2012). C. Drahl, Chem. & Eng. News 90 (28), 29 (2012). PT MAYO / JUNIO 2013 27/05/13 16:32 JORG GREUEL/PHOTODISC/GETTY IMAGES EDITORIAL INVITADA Ofreciendo un punto de vista farmacéutico de los medios socialesfarmacéutico de los medios sociales Aaron Davidson Por qué los medios sociales presentan retos y oportunidades únicas para las compañías farmacéuticas. D esde que Twitter se lanzó en 2006 y Facebook se volvió la corriente principal, la mayoría de las industrias han visto formas de conectarse con sus consumidores a través de los medios sociales. Los fabricantes de dispositivos médicos y farmacéuticos, sin embargo, han estado notablemente ausentes de esta tendencia. ¿Por qué es que, en 2013, tantas compañías de ciencias de la vida evitan los medios sociales mientras que la mayoría de las otras industrias los adoptan? En los Estados Unidos, la respuesta principal es la incertidumbre regulatoria. La FDA todavía no ha publicado una guía final acerca del uso apropiado de los medios sociales, y su limitado proyecto de guía apenas tiene un año de antigüedad (1). La simple naturaleza de los medios sociales -incluyendo sus varias y diferentes formas, su naturaleza pública, intrínsecamente interactiva y sus elementos de anonimato- plantea desafíos únicos para la FDA y las compañías de ciencias de la vida. Regulación promocional La FDA regula estrechamente la manera en que los productos farmacéuticos pueden ser promovidos. Las compañías deben someter todo el material promocional a la FDA y correr el riesgo de recibir cartas de la Oficina de Promoción de Fármacos de Prescripción (OPDP) de la FDA, si se piensa que los materiales promocionales representan engañosamente un perfil de seguridad, eficacia o riesgo de un producto. Además, se prohíbe a los fabricantes dar incluso inAaron Davidson es socio en la práctica de Life Sciences en Baker Botts, que se enfoca principalmente en la defensa de los fabricantes de farmacéuticos y dispositivos médicos. formación veraz acerca de los usos de fármacos o dispositivos médicos si tales usos no han sido aprobados por la FDA. Sin embargo, una reciente apelación del fallo judicial ha generado dudas acerca de la prohibición de la FDA de las comunicaciones veraces no indicadas en la etiqueta (2), lo que revierte una condena penal por la promoción fuera de indicaciones por motivos constitucionales para la libertad de expresión. La simple naturaleza de los medios sociales plantea desafíos únicos. La FDA ha advertido a los fabricantes que “para que los materiales promocionales sean veraces y no engañosos, deben contener información del riesgo en cada parte [de los materiales] según sea necesario para calificar cualquier reclamo hecho acerca del fármaco” (3). El asunto del espacio es una preocupación, por ejemplo, para cualquier compañía que considere el Twitter ya que su límite de 140 caracteres hace imposible proporcionar toda la información de riesgo acerca de un producto. ¿Es suficiente dar un vínculo a esa información cuando se anuncie la aprobación para una nueva indicación? ¿Y qué pasa si un consumidor o un médico ‘twitea’ en respuesta que el fármaco también actúa bien para tratar una condición para la cual el fármaco no ha sido aprobado? ¿La compañía tiene obligación de responder? Los tableros de mensajes en línea y Facebook, incluso YouTube, aunque no están muy limitados de espacio como el Twitter, tienen límites prácticos que los hacen incómodos para proporcionar “toda la información de seguridad importante.” Incluso si toda la información requerida por la FDA pudiera ser proporcionada, esta información está fechada y podría volverse engañosa cuando se disponga de más datos. Guía de la FDA La FDA celebró audiencias acerca del uso de medios sociales por parte de los fabricantes farmacéuticos en Noviembre del 2009. Sin embargo, tomó hasta Diciembre del 2011 para que la agencia publicara su proyecto de guía (1). No obstante, más que proporcionar una dirección amplia acerca de los medios sociales, la FDA se enfocó en un tipo específico de solicitud que podrían recibir los fabricantes. Probablemente llevará más de un año antes que la FDA provea guía adicional. El Acta de Seguridad e Innovación de la FDA (FDA-SIA), promulgada el 9 de Julio de 2012, le solicita a la Secretaría de Salud y Servicios Humanos que emita una guía que describa la política de la FDA sobre promoción y uso del Internet (incluyendo los medios sociales) para Julio de 2014. Mientras tanto, los fabricantes deben tratar de determinar lo que es aceptable revisando el proyecto de guía de la FDA y las cartas emitidas por la OPDP de la FDA. Con los riesgos de cometer una falta de la FDA y los desafíos prácticos creados por los medios sociales, no sería de sorprender que las compañías de ciencias de la vida estén preocupadas para ofrecer páginas de Twitter o Facebook específicas para productos, canales de YouTube o tableros de mensajes en línea. Referencias 1. 2. 3. FDA, Responding to Unsolicited Requests for Off-Label Information About Prescription Drugs and Medical Devices (Rockville, Maryland, December 2011). United States vs. Caronia, No. 90-5006cr (2nd Cir. Dec. 3, 2012). FDA, Letter to Cephalon, Inc., www. fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/ EnforcementActivitiesbyFDA/WarningLettersandNoticeofViolationLetterstoPharmaceuticalCompanies/ UCM166238.pdf. PT Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 53 MAYO / JUNIO 2013 53 27/05/13 16:32 Fármacos I nhalados Mejora del análisis de productos inhalados Métodos para obtener mejores relaciones in vitro-in vivo Mark Copley Incluso en una industria en la que todo el desarrollo de productos es complicado por las complejidades de la biología humana, los productos inhalados oralmente (OIP) destacan como singularmente exigentes. La respuesta clínica es un problema particularmente complejo, aunque también hay otras áreas que representan un desafío. Tanto la técnica del paciente como la capacidad individual pueden tener un mayor impacto sobre la efectividad de la entrega del fármaco y el desarrollo es complicado por la interacción entre el dispositivo y la formulación. El autor discute el equipo de análisis y las técnicas de colecta de información usadas para mejorar la medición de la distribución aerodinámica del tamaño de partícula y la relación entre los datos de prueba in vitro y el comportamiento in vivo. L a técnica de impacto en cascada se utiliza para medir la distribución aerodinámica del tamaño de partícula (APSD) de todos los productos inhalados oralmente (OIPs). Los datos resultantes son ampliamente indicativos de la probable conducta de deposición en el tracto respiratorio y respalda el desarrollo de una eficiencia objetivo para la entrega del fármaco. Es ampliamente reconocido que el impacto en cascada es incapaz de replicar completamente la compleja aerodinámica y conductas de deposición que tienen lugar en la garganta y los pulmones. Los pulmones operan bajo condiciones de humedad elevada y dentro de éstos la velocidad de flujo volumétrico se desacelera con cada bifurcación, estableciendo perfiles de velocidad complejos a través de la estructura del pulmón. Los mecanismos resultantes de la deposición de partículas, los cuales incluyen sedimentación y difusión así como impactación, son difíciles de simular de manera integral. La mejora de la relación entre los datos de la prueba in vitro y la conducta in vivo, sin embargo, se está volviendo cada vez más importante por un número de razones, incluyendo la implementación exitosa de la calidad por diseño (QbD), la necesidad de reducir los costos del desarrollo de OIP y el deseo de lograr bioequivalencia in vitro para los productos genéricos. Los pasos para modificar la impactación en cascada que asegure mejores relaciones in vitro-in vivo (IVIVRs) van desde el uso de nuevo equipo de análisis, como el Alberta Idealized-Throat (AIT) y avanzados simuladores de la respiración, para la adopción de técnicas más eficientes de recolección de información, incluyendo la Medición Abreviada del Impactador (AIM). Impactación en cascada multiplatina Mark Copley es director de ventas en Copley Scientific, Colwick Quays Business Park, Private Road No. 2, Colwick, Nottingham, NG4 2JY, RU, Tel: +44 0 115 961 6229, www.copleyscientific.com *A quien debe dirigirse la correspondencia. Sometido: Junio 28, 2012. Aceptado: Octubre 12, 2012. 54 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 54 Los impactadores multiplatina consisten en una serie de platinas conformadas cada una de una placa de boquillas, con un arreglo específico de las boquillas, y una superficie de colecta. El aire cargado con la muestra es extraído hacia el impactador a una velocidad de flujo volumétrico constante, y pasa secuencialmente a través de las platinas. Como el tamaño de la boquilla y el área total de la boquilla se reducen con el número de platinas, las partículas son aceleradas progresivamente. En cada platina, las partículas con suficiente inercia se liberan del aire prevalente y se impactan sobre la superficie de colecta, produciendo así una serie de fracciones de masa que pueden ser analizadas para determinar cómo se distribuye el activo MAYO / JUNIO 2013 27/05/13 16:32 con respecto al tamaño. Figura 1: Preparación de la prueba con un impactador en cascada típico para el La Figura 1 muestra un impactador estudio de inhaladores de polvo seco (DPI) en cascada farmacopeico típico preparado para el análisis del inhalador de polvo seco Flujómetro y adaptador del flujómetro (DPI) que incluye un número de accesorios esenciales. El dispositivo está interconectado al impactador en cascada utilizando un adapIntercambio tador de boquilla apropiado y un puerto de Dispositivo y inducción. La velocidad de flujo a través del adaptador de boquilla Bomba de impactador en cascada está controlada por Controlador vacío de flujo crítico controlador de flujo crítico/flujómetro, y una Cronómetro bomba de vacío extrae aire a través de todo el sistema. P P Es posible extraer una conexión floja enImpactador tre los diferentes elementos de esta disposiVálvula solenoide Válvula de 2 puertos/2 vías control de flujo ción y el escenario de la vida real que pretende reflejar. El puerto e inducción representa Nota: Este diagrama es una guía general para la preparación de la prueba para DPIs. Por favor, refiérase a las monografíasde prueba individuales (p.ej., Farmacopea de los Estados Unidos y la boca y la garganta y el impactador en casFarmacopea Europea) para instrucciones detalladas.No está dibujado a escala. cada dimensiona a las partículas que con más probabilidad se depositen en los pulmones. El controlador de flujo/flujómetro asegura la aplicación de una manual, lo cual la vuelve incluso más limitante conforme auvelocidad de flujo estable y adecuadamente representativa du- menta la demanda de datos más valiosos y discriminatorios. El alivio de la carga de los análisis es, por lo tanto, importante rante el análisis. para el avance continuo, especialmente en ambientes de IyD Evaluando la práctica establecida en los cuales los presupuestos se están recortando cada vez La evaluación de la disposición establecida contra los re- más. quisitos de información para el desarrollo de productos reconocidos destaca algunas de sus limitaciones. El puerto de Mejor representación de la deposición en garganta inducción estándar de la Farmacopea de los Estados Unidos El objetivo de simular con más precisión la deposición en la (USP)/Farmacopea Europea (Farm.Eur.) descrito en el Capí- boca y garganta concentra la atención en alternativas para el tulo General <601> “Aerosoles, Sprays nasales, Inhaladores puerto de inducción estándar de la USP/Farm.Eur. Una de tade dosis medidas e Inhaladores de Polvos Secos” de la USP les alternativas es un molde de la garganta humana (2-5). Estas y la sección 2.9.18 “Preparaciones para Inhalación”, de la alternativas ofrecen la ventaja de reflejar exactamente la fisioFarm.Eur., por ejemplo, está bien adaptado a la manufactura logía de una garganta. El trabajo experimental ha demostrado, de precisión y da un desempeño confiable, consistente, pero sin embargo, diferencias significativas en la conducta de deactualmente se reconoce ampliamente que tiene una tendencia posición entre los diferentes moldes de garganta (1). Aunque a sub-pronosticar significativamente la cantidad de dosis emi- es de esperarse que estas diferencias se den debido a la variatida capturada por el tracto respiratorio superior para algunos bilidad en la anatomía humana, complican la interpretación de productos, con relación a los datos clínicos (1). Por lo tanto, los resultados dentro del contexto de estandarización y análisis sin importar la conducta de deposición dentro del pulmón, el de rutina. Además, la manufactura reproducible y precisa de puerto de inducción de la USP tiende a sobreestimar el alcance dichos moldes es compleja, lo que los hace difíciles de medir y calificar. Debido a que los moldes tampoco son fáciles de de la deposición en el pulmón completo. De igual importancia es el hecho de que esta disposición manejar o de interconectar con el impactador, éstos son menos requiere de la aplicación de una velocidad de flujo constante a que ideales desde un punto de vista práctico. Estas limitaciones han estimulado el interés en el desarrotravés tanto del dispositivo como del impactador en cascada, mientras que en el uso clínico, los productos inhalados están llo de soluciones que caigan entre un molde de garganta y el sujetos a un rango de perfiles de respiración de los usuarios. puerto de inducción estándar (6). Estas soluciones incluyen el La velocidad de flujo constante requerida por los impactado- Alberta Idealized Throat (AIT). Desarrollado por los invesres en cascada resulta en un forma de onda cuadrada, más que tigadores del Laboratorio de Investigación de Aerosoles de en la forma de los patrones infinitamente variables, con forma Alberta (Universidad de Alberta, Canadá), el AIT tiene una de campana amplia, de los pacientes reales. Adicionalmente, geometría interna estandarizada y altamente reproducible, los impactadores idealmente requieren cambios de volumen pero similar a la humana que se presta a la manufactura de múltiples para garantizar el dimensionamiento confiable y precisión. Su desempeño es independiente de la velocidad completo del aerosol. Este requerimiento invariablemente re- de flujo y con los inhaladores de dosis medida presurizados sulta en un volumen de prueba que es mayor que el volumen (pMDI) y los DPIs, se ha demostrado que colectan más de de inhalación de al menos una parte de la población de pacien- la dosis emitida que el puerto de inducción de la USP (1, 7, 8). Ciertamente, la capacidad del AIT para replicar más certes a los que se destina. Finalmente, existe la preocupación general de la produc- canamente la conducta de deposición in vivo en la garganta, tividad. El impacto en cascado ha sido reconocido desde hace en comparación con el puerto de inducción de la USP, ha sido mucho, como una tarea que consume tiempo, intensivamente confirmada directamente en varios estudios, algunos de los 3 2 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 55 MAYO / JUNIO 2013 55 27/05/13 16:32 Fármacos I nhalados Tabla 1: Datos colectados resumidos para un inhalador de dosis medida presurizado (pMDI) analizado utilizando un puerto de inducción de la Farmacopea de los Estados Unidos (USP) y el Alberta Idealized Throat. (DE es desviación estándar, T/MP es garganta/boquilla, µg a/ac es µg de activo/activación, MOC es colector de micro orificio, FPD es dosis de partículas finas, FPF es fracción de partículas finas, GSD es desviación estándar geométrica, MMAD es diámetro aerodinámico de la mediana de masas). Puerto de Inducción USP Alberta Idealized Throat Platina Media DE Media DE T/MP (μg a/ac) 54.2 1.6 66.8 5.1 1 (μg a/ac) 2.9 0.6 1.1 0.2 2 (μg a/ac) 1.8 0.1 0.7 0.1 3 (μg a/ac) 4 0.3 2.2 0.6 4 (μg a/ac) 16 1.9 12.7 2 5 (μg a/ac) 14.2 1.5 15.5 0.9 6 (μg a/ac) 38 0.6 4.3 0.5 7 (μg a/ac) 0.7 0.2 0.7 0.1 MOC (μg a/ac) 0.5 0.1 0.5 0.1 TOTAL 98 3.6 104.4 8.4 FPD (μg a/ac) 37.3 2.6 34.8 3.3 FPF (%) 38 1.4 33.4 1.3 GSD 1.9 0.2 1.6 0 MMAD (μm) 2.5 0.1 2.2 0.1 Figura 2: Para este inhalador de dosis medida presurizada, el uso del Alberta Idealized Throat cambia la distribución del tamaño de partícula aerodinámico medido, acumulativo, a las distribuciones de partículas más finas en relación con el puerto de inducción estándar de la Farmacopea de los Estados Unidos (USP). Masa acumulativa en %, basada en la masa dimensionada por el impactador 100 80 garganta USP garganta Alberta 60 40 20 0 1 Diámetro aerodinámico (µm) 56 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 56 10 cuales incluyen OIPs comercializados (911). Las geometrías del AIT están también disponibles en formas para niños e infantes, lo cual amplía su atractivo para el análisis in vitro (12). Estudio experimental: Evaluación del desempeño del AIT El APSD de un pMDI (ingrediente activo: salbutamol) fue medido en un proyecto en colaboración con Melbourn Scientific (RU) utilizando un impactador (Next Generation Impactor, Copley Scientific) con el puerto de inducción de la USP y un AIT (7). El análisis se llevó a cabo a una velocidad de flujo de 30 L/min, de acuerdo a la guía de la farmacopea para MDIs, con seis mediciones replicadas realizadas en cada caso. Todas las platinas de colecta del NGI y del AIT estaban recubiertas con aceite de silicón aplicado en solución de n-hexano (1% p/v), lo cual es una práctica estándar que reduce el rebote de las partículas (es decir, el re-arrastre de las partículas que impactan a altas velocidades). El puerto de inducción de la USP se dejó sin recubrir, como se hace para el análisis de rutina. La Tabla 1 muestra los datos de colecta promediados para cada componente del equipo de prueba incluyendo una masa combinada registrada para la garganta y la boquilla del inhalador. Los valores para la dosis de partículas finas (FPD), fracción de partículas finas (FPF), desviación estándar geométrica (GSD), y diámetro aerodinámico de la mediana de la masa (MMAD) fueron determinados a partir de estos datos. Los cálculos se basaron en el total de masa emitida/activación y el supuesto de un límite superior de 5 micras para las FPD y FPF. Los datos de deposición para la garganta/boquilla muestran que el AIT captura más de la dosis, reduciendo así la masa del fármaco que entra al impactador en cascada. Este resultado se atribuye a diferencias en la geometría de las dos interfases, más que a cualquier efecto de recubrimiento (7). La Figura 2 muestra las APSDs acumuladas promediadas basadas en la cantidad de material que sale de la boquilla/garganta. Aquí, el uso del AIT cambia la APSD a tamaños más finos a través del rango de tamaños completo, sugiriendo así que no todos los tamaños de partícula son retenidos igualmente con respecto al puerto de inducción estándar. En un experimento paralelo con un DPI, se observó el mismo efecto (7). Estos son resultados iniciales y se requiere mayor investigación. Sin embargo, los re- MAYO / JUNIO 2013 27/05/13 16:32 sultados subrayan el hecho de que la mejor representación de la deposición en boca/garganta puede influir las evaluaciones de la deposición regional en el pulmón, lo cual es una función del tamaño de partícula, así como estimados de la deposición completa en el pulmón. Desde una perspectiva in vitro, el uso del AIT asegura que sólo la porción del aerosol que realmente se depositaría en el pulmón está dimensionada por el impactador en cascada, proporcionando así datos más relevantes. Figura 3: El análisis de inhaladores estándar de polvo seco involucra la aplicación de un perfil de onda cuadrado, cuyas dimensiones se derivan de la velocidad de flujo establecida. 150 Velocidad de flujo 100 (L/min) 50 Aplicación de perfiles de respiración representativos Como los impactadores en cascada multiplatinas requieren una velocidad de flujo de aire constante para una operación exitosa, el problema de aplicar perfiles de respiración que representen mejor la vida real demanda una solución en dos etapas: desaclopar la velocidad de flujo y el volumen a través del dispositivo, de la velocidad de flujo y el volumen a través del impactador, e identificar el perfil más adecuado para el análisis. La entrada de mezcla es una opción establecida para desaclopar las velocidades de flujo. Diseñada para adaptarse entre la entrada de un rango de impactadores en cascada y un puerto de inducción USP o el AIT, permite que el impactador en cascada sea operado bajo condiciones de estado estacionario, como un muestreador de aerosol de velocidad de flujo constante (de la manera en que fue diseñado), mientras que al mismo tiempo permite la aplicación de una velocidad de flujo reducida o variable a través del inhalador. Una acción de mezclado suave asegura un mezclado efectivo, sin turbulencias, de la composición (es decir, la funda) y de la muestra cargada en las corrientes de aire antes de la introducción al impactador, resultando en mínimas pérdidas internas (4, 13). La evaluación del perfil de respiración más apropiado para el análisis es una cuestión constante y más compleja. Para los inhaladores con un mecanismo de entrega activo, como los pMDIs y algunos DPIs, existe evidencia experimental que sugiere relativamente baja sensibilidad para probar la velocidad de flujo (13, 14). El estudio del nebulizador, por otro lado, en el cual la aerolización de la dosis se basa en la corriente de respiración del paciente, ya se ha sometido a una modificación significativa con la publicación de dos nuevas monografías armonizadas: Farm.Eur. 2.9.44 y USP 1601 (15, 16). Estas entraron en vigor en enero de 2012 y agosto de 2011, respectivamente e incluyen cuatro diferentes perfiles de respiración para evaluar la entrega de dosis para diferentes grupos de pacientes: adultos, niños, infantes y neonatos. Para la mayoría de los DPIs, la fuerza motriz que maneja el dispositivo es suministrada únicamente por el paciente y, por esta razón, se conocen ampliamente como DPIs pasivos. El perfil de respiración seleccionado, por lo tanto, impacta el proceso de dispersión de la dosis así como la inhalación de las partículas resultantes. Aquí, la aplicación de perfiles de respiración más representativos está generalmente reconocida como importante, aunque existe considerable debate acerca de lo que realmente se requiere. Centrándose en los DPIs Las monografías farmacopeicas para el análisis de los DPIs especifican la aplicación de una velocidad de flujo que resulte en una caída de presión de 4 kPa a través del dispositivo, lo cual se considera ampliamente representativo de la fuerza de inhalación de un paciente adulto. Los DPIs varían considera- 4 L en 100 L/min 4 L en 60 L/min 0 0 1 2 4 Figura 4: Disposición de prueba para el análisis del inhalador de polvo seco que incorpora el Alberta Idealized Throat, una entrada de mezcla y un simulador de respiración. blemente en término de resistencia al flujo por lo que, en la práctica, probar velocidades de flujo abarca un amplio rango de valores, desde alrededor de 30 - 40 L/min para un dispositivo de alta resistencia hasta el límite impuesto de 100 L/min para aquéllos con mucha menor resistencia. La velocidad de flujo definida se aplica durante el mismo tiempo tomado para extraer 4 L de aire a través del dispositivo si se siguen las especificaciones farmacopeicas, o 2 L si se sigue la guía de la FDA, en la forma de un perfil de onda cuadrada (ver Figura 3). Aunque este procedimiento es lógico como parte de una prueba de control de calidad rutinaria, estandarizada, se ha presentado evidencia que sugiere que el uso de una caída de presión de 4 kPa da una velocidad de flujo que es irrealmente alta para ciertos grupos de pacientes con función pulmonar deteriorada. De la misma manera, también se ha cuestionado el volumen total inspirado. Sobre esta base, se han hecho sugerencias de que deben realizarse análisis de velocidad de flujo más bajo, posiblemente con volúmenes totales menores, en el desarrollo de productos para uso pediátrico, por ejemplo, o para el tratamiento de la enfermedad pulmonar obstructiva crónica (EPOC) o asma (17). Por el otro lado, conforme la tecnología de DPI se extiende en la entrega de terapias sistémicas, se han propuesto también argumentos contrarios (18). La investigación sugiere que, en un grupo de adultos usuarios sin deterioro pulmonar, podría lograrse una caída de presión de 8 kPa, lo cual sugiere que Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 57 3 Tiempo (s) MAYO / JUNIO 2013 57 27/05/13 16:32 Fármacos I nhalados Figura 5: Esquema que ilustra la Medición Abreviada del Impactador - concepto del tracto respiratorio humano, el cual involucra el uso de dos platinas de impactación (CPM es masa de partículas gruesas, FPM es masa de partículas finas, EPM es masa de partículas extra-finas, IP es producto inhalado). >5micras Espaciador Mejora de la productividad utilizando el AIM <5.0 micras < 1.0 micra 1 micra EPM FPM 5 micras Otras variaciones posibles CPM I.P. Filtro las velocidades de flujo de la prueba deben ser mucho más elevadas si se aplica la misma maniobra de inhalación durante el uso. Este último punto es crucial si, para la entrega sistémica, se instruye a los pacientes para que inhalen de diferente manera para optimizar el perfil de deposición del activo, y entonces el análisis necesita reflejar esto. Igualmente importante, más allá de estas consideraciones de la velocidad de flujo de la prueba, existe un problema más amplio de la forma del perfil de respiración aplicado durante el análisis. Durante el uso del paciente, el aire es extraído a través del DPI para fluidificar y aerosolizar la dosis, formando así una nube de partículas, de las cuales una gran proporción es suficientemente fina para ser extraída dentro del pulmón. Los mecanismos involucrados en este proceso de aerosolización son complejos, pero puede postularse que la aceleración del aire a través del tapón de polvo resulta en la aplicación de fuerzas de corte, dando así lugar a la dispersión y el vaciado del dispositivo. Si el dispositivo no se vacía, o si la fuerza aplicada es insuficiente para dispersar la dosis a un tamaño respirable (típicamente se considera menor de 5 micras), entonces la eficiencia de entrega del fármaco está deteriorada (18). Este mecanismo propuesto ha llevado a sugerir que no es sólo la velocidad de flujo aplicada durante el análisis la que es importante, sino también la velocidad a la cual el flujo parte del cero. En el análisis farmacopeico convencional, el aire es efectivamente “encendido” o “apagado”, con casi una aceleración instantánea. En contraste, los datos para adultos sanos indican que puede tomar hasta 0.5 segundos lograr un pico del flujo inspiratorio, dando así una velocidad de aceleración apreciablemente más lenta (18). Estos debates han resultado en la aplicación de pulmones 58 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 58 electrónicos o artificiales y la introducción de nuevos simuladores de la respiración que permiten la exploración detallada del impacto del perfil de respiración sobre el desempeño del dispositivo durante el análisis de rutina (2, 19). Aplicando perfiles típicos de las poblaciones de pacientes destinados y levantando flujos de aire de una manera variable pero estrechamente definida, estos sistemas permiten a los investigadores determinar cómo pueden ser afectados los atributos de calidad típicos por la variabilidad de paciente a paciente en esta área. Esta investigación es un área que continúa pero es crítica en el desarrollo de la tecnología DPI (ver Figura 4). En años recientes, la búsqueda de productividad mejorada en el análisis de productos inhalados ha impulsado el interés en el AIM (20). Un punto clave es el análisis de control de calidad (QC), aunque el esquema también es promisorio para IyD. El AIM involucra la separación de una muestra en un número mucho menor de fracciones que las de un impactador en cascada multi-platinas, aportando así algunos beneficios importantes: • Resultados analíticos más rápidos • Análisis menos complicados, lo que resulta en una reducción de la probabilidad de error • Facilidad de automatización En IyD, la propuesta es que los requisitos para una mejor productividad pueden cumplirse aplicando la versión humana del tracto respiratorio (HRT) del concepto del AIM, el cual concentra la atención en aquellas partes del APSD que son cruciales para la evaluación del desempeño de la entrega del fármaco (ver Figura 5). Los estudios publicados destacan el interés industrial en este esquema (21-23). El potencial que ofrece el AIM para reducir el error humano y mejorar la integridad de los datos también puede respaldar el desarrollo de mejores IVIVRs que se basan en resultados más seguros. El AIM-HRT consiste en dos platinas de impactación, un filtro y un espaciador para modificar el comportamiento aerodinámico. Éste separa la dosis en una masa de partículas gruesas (>5 micras), una masa de partículas finas (<5 micras) y una masa de partículas extra-finas (<1 micra). Estas fracciones estarían típicamente asociadas con la deposición en boca/garganta, la deposición en pulmones y, potencialmente la pérdida vía la exhalación, respectivamente. La tecnología, no obstante, permite que el diámetro de corte de las platinas se varíe, según sea necesario, para producir resultados que se correlacionen más estrechamente con los datos medidos in vivo, si los hay. Algunos estudios indican que esto puede lograrse utilizando un diámetro de corte más cercano a las 3 micras que a las 5 micras (24). El futuro, el AIM puede, por lo tanto, permitir la aceleración del diseño de experimentos y los estudios de selección aunque hay un debate considerable acerca de su aceptación. Viendo a futuro La prueba convencional con el impactador en cascada usado para medir el APSD de todos los OIPs fue originalmente desarrollada con la idea del análisis de QC. Ésta cumple esta MAYO / JUNIO 2013 27/05/13 16:32 función bien porque permite una medida altamente discriminatoria y reproducible de la calidad del producto. Sin embargo, la disposición convencional tiene inconvenientes para los investigadores que tratan de tener acceso a una comprensión más detallada de la tecnología de inhalación y obtener mejores IVIVRs que el desarrollo adicional. Una cuestión es la mejor representación de la conducta de deposición en la boca y la garganta y otra es la aplicación de perfiles de respiración más representativos durante el análisis, en el cual pueden tener un impacto en la emisión de la dosis y el resultante APSD del aerosol generado. El problema de la productividad analítica continúa presionando en un entorno de recorte de costos más profundo. Los proveedores del instrumento están respondiendo positivamente a estos requerimientos introduciendo nuevos productos tales como la entrada mezclada, simuladores de respiración sofisticados, nuevas interfases tales como el AIT y equipo de AIM que agiliza el análisis. Estos nuevos productos potencialmente permiten avances significativos en el área del análisis de producto inhalado dentro del entorno de IyD. En el futuro, dichas innovaciones ofrecen la oportunidad de conformar el análisis in vitro en una herramienta más efectiva para el rápido avance de la tecnología de inhaladores para el rango más amplio posible de terapias de fármacos. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Referencias 1. 2. 3. 4. 5. Y. Zhang, K. Gilbertson, and W.H. Finlay, J. Aerosol Medicine 20 (3) 227-235 (2007). M. Hamilton and D. Prime, “A Rapid In-vitro Dry Powder Inhaler Device Equivalence Screening Study Using the Hydraulic Lung,” poster presentation at Drug Delivery to the Lungs (DDL) 22 (Edinburgh, Scotland, 2011). B. Olsson, et al., Proceedings of Respiratory Drug Delivery 2008 Conference (Phoenix, AZ, 2008), Vol 1, pp. 197-205. B. Olsson, E. Berg, and M. Svensson, Proceedings of Respiratory Drug Delivery 2010 Conference (Orlando, FL, 2010), pp. 225–234. M. Svensson and E. Berg, Proceedings of Respiratory Drug Delivery 2008 Conference (Phoenix, AZ, 2008), pp. 391-394. 18. 19. 20. 21. 22. 23. 24. Y. Zhang, T. L. Chia, and W. Finlay, Aerosol Sci. and Tech. 40 (5), 361-372 (2006). M. Copley, J. Mitchell, and D. Solomon, Inhalation 5 (4) 12-16 (2011). A. Watkins, T. Gerrish, and N. Childerhouse, Proceedings of Respiratory Drug Delivery 2012 Conference (Phoenix, AZ, 2012), pp. 877-882. B. Grgic, W.H. Finlay, and A.F.Heenan, J. Aerosol Sci. 35 (1) 21-32 (2004). Y. Zhou, J. Sun, and Y.S. Cheng, J. Aerosol Med. and Pulmonary Drug Deliv. 24 (6) 277-284 (2011). M. Rahmatalla, et al., J. Aerosol Med. 15 (4) 379–385 (2002). W. Finlay, Proceedings of Respiratory Drug Delivery 2012 Conference (Phoenix, AZ, 2012), pp. 325-336. N.C. Miller, M.J. Maniaci, S. Dwivedi, and G.W. Ward, Proceedings of Respiratory Drug Delivery Conference (Orlando, FL, 2000), pp. 191-196. W. Finlay and M.G. Gehmlich, Intl. J. of Pharmaceutics 210 (1-2) 83-95 (2000). Eur. Ph., 7.3 (Supplement) Chapter 2.9.44, “Preparations for Nebulisation: Characterisation” (EDQM, Strasbourg, France, 2012), 3803-3805. USP 34-NF 29 First Supplement, General Chapter <1601>, “Products for Nebulization–Characterization Tests” (US Pharmacopeial Convention, Rockville, MD, 2011), pp. 4729-4732. D.K. Nadarassan, K.H.Assi, and H. Chrystyn, Eur. J. Pharm. Sci. 39 (5) 348-354 (2010). D.Harris, Pharm. Tech. Eur. 19 (9) 29-35 (2007). P. Burnell, et al., J. Aerosol Sci. 29 (8), 1011-1025 (1998). M. Copley, J. Mitchell, E. McAulay and D. Russell-Graham, Inhalation 4 (1) 7-11 (2010). J. Mitchell, et al., J. Aerosol Med. and Pulmonary Drug Deliv. 25 (4) 188-197 (2012). G.Keegan and D.A.Lewis, Proceedings of Respiratory Drug Delivery 2012 Conference (Phoenix, AZ, 2012), pp. 465-468. G.Keegan and D.A.Lewis, Proceedings of Respiratory Drug Delivery 2012 Conference (Phoenix, AZ, 2012), pp. 469-472. S. Newman and H-K. Chan, J. Aerosol Medicine 21 (1) 1-8 (2008). PT “Resolución de problemas de tableteo y herramental” continuación de la pág. 49 Desgaste del calibre de la matriz. El desgaste del calibre de la matriz o “anillado” (ver Figura 3) es otro defecto común que puede llevar a problemas tales como “laminado” de las tabletas y problemas para la eyección de las tabletas, lo cual resulta en producto desperdiciado y producción reducida de tabletas. El anillado es causado por el desgaste abrasivo y la deformación por las fuerzas continuas que actúan sobre la cara del calibre de la matriz. Este daño se acelera cuando se comprimen gránulos duros y abrasivos encontrados en algunas formulaciones, particularmente vitaminas y minerales. Este desgaste puede ser identificado utilizando inspección visual durante el Paso 2 (Evaluar), aunque también se dispone de equipo preciso para medir y monitorear este desgaste en el Paso 4 (Medir). El monitoreo de la condición física de la matriz puede resultar en un diagnóstico temprano antes de que el defecto tenga una efecto negativo sobre la producción de las tabletas. Pegoteado y laminado. Cuando son nuevos, las superficies de las caras del punzón de las tabletas están generalmente pulidas hasta un acabado espejo. Sin embargo, estas superficies pueden deteriorarse durante un período de tiempo, debido a la continua compactación de los gránulos, lo que puede llevar a defectos del tableteado tales como el “laminado” y el “pegoteado” (ver Figura 4) provocados por la adhesión del producto al ahora terminado rugoso. Este deterioro puede ser identificado durante la evaluación (Paso 2. Evaluar). El producto puede limpiarse con un sistema de limpieza eficiente (Paso 1. Limpiar) y el terminado puede mejorarse/repararse utilizando el proceso de pulido de remedio como en el Paso 3 (Reparar). Con un frecuente pulido ligero utilizando un sistema de pulido automatizado (Paso 5. Pulir), puede mantenerse una superficie lisa y eficiente. Conclusión El proceso de siete pasos es una secuencia lógica a seguir cuando se ha usado y retirado el herramental de la tableteadora. Cada uno de los pasos puede ser realizado de manera aislada, si es necesario, y va dirigido a prolongar de alguna manera la vida del herramental, permitiendo al mismo tiempo la planeación y el reemplazo programado del herramental. PT Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 59 MAYO / JUNIO 2013 59 27/05/13 16:32 Nanopartículas: facilitando la administración dirigida de fármacos en la terapia para el cáncer A deline Siew, PhD PharmTech habló con Robert Langer, profesor del Instituto de Tecnología de Massachusetts y fundador de BIND Biosciences; Stephen Zale, vicepresidente de desarrollo en BIND Biosciences; y Yanli Zhao, profesor asistente y miembro de la fundación nacional de investigación en la Universidad Tecnológica de Nanyang, Singapur, acerca de la ingeniería de nanopartículas con propiedades óptimas para usar en las terapias para el cáncer. L as nanopartículas han cambiado significativamente el panorama del tratamiento, prevención y diagnóstico de enfermedades, generando una nueva ola de estrategias de entrega de fármacos a nanoescala. Desde mejora en solubilidad/ biodisponibilidad (1, 2) y entrega dirigida de fármacos (3, 4) hasta liberación controlada/sostenida (5, 6) y protección de moléculas lábiles (p.ej., proteínas, péptidos y ADN) de la degradación enzimática (7, 8), estas estructuras pueden ser fabricadas, controladas y manipuladas para sumir nuevas propiedades y funciones que han abierto nuevas puertas en la arena biomédica. Aunque las nanopartículas pueden variar en el rango de tamaño desde 10 nm a 1000 nm, las nanomedicinas son típicamente menores de 200 nm (9). Las nanopartículas hechas de polímeros naturales o sintéticos han ganado popularidad debido a su estabilidad y facilidad de modificación de la superficie. Pueden ser construidas para alcanzar una liberación controlada del fármaco así como la localización específica en sitios de la enfermedad mediante la modificación de las características del polímero y la química de superficie. Por ejemplo, ha sido bien establecido 60 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 60 MAYO / JUNIO 2013 que las nanopartículas se acumulan de preferencia en el tumor y sitios inflamatorios debido al efecto mejorado de permeabilidad y retención (EPR) de la vasculatura (9-11). En el sitio objetivo, las nanopartículas poliméricas biodegradables pueden actuar como un depósito local de fármacos que provee liberación continua del agente terapéutico encapsulado. Estas ventajas ofrecidas por las nanopartículas para la entrega dirigida de fármacos son resultado de su pequeño tamaño y del uso de los materiales biodegradables. El pequeño tamaño le permite a las nanopartículas superar las barreras biológicas (p.ej., epitelio gastrointestinal, vasculaturas del tumor, y endotelio de los sitios inflamatorios) y alcanzar una captación celular mientras que el uso de los materiales biodegradables permite la liberación sostenida del fármaco en el sitio objetivo (9-11). Los avances en el desarrollo de las nanopartículas han visto que estos sistemas se han traducido en medicamentos clínicamente útiles, particularmente en el tratamiento del cáncer. Ejemplos de medicamentos basados en nanopartículas aprobados por la FDA y la EMA como terapias para el cáncer incluyen Doxil y Myocet (formulaciones lipo- somales de doxorubicina), DepoCyt (citarabina liposomal), Abraxane (una formulación unida a albúmina de paclitaxel) y Genexol-PM (una formulación de micelas poliméricas de paclitaxel). Nanomedicinas en evaluación clínica Algunas formulaciones basadas en nanopartículas están en desarrollo clínico como tratamientos potenciales para el cáncer. El nanoplatino de NanoCarrier (NC-6004), el cual consiste de cisplatino incorporado dentro de nanopartículas micelares compuestas de polietilen glicol (PEG) y copolímeros en bloque de ácido poliglutámico, está pasando por la evaluación Fase II en pacientes con cáncer pancreático avanzado o con metastásicos (12). Los resultados preclínicos mostraron que el nanoplatino se acumulaba en las células cancerosas y tenía una nefrotoxicidad y neurotoxicidad significativamente menor (13). En un estudio Fase I realizado en el RU, la formulación fue bien tolerada en pacientes con tumores sólidos, proporcionando liberación sostenida y prolongada con mínima nefrotoxicidad y ninguna mielosupresión, ototoxicidad, emesis o neurotoxicidad significativas (14). El CRLX101 de Cerulean consiste en el inhibidor de topoisomerasa-1, la camptotecina, conjugada covalentemente a un copolímero de PEG-βciclodextrina que se auto-ensambla en nanopartículas de aproximadamente 30 nm de diámetro (15). A diferencia de las camptotecina, estas nanopartículas tienen una larga vida media en circulación, permitiendo que se acumulen en los tumores. Después de la captación del CRLX101 en las células tumorales, la camptotecina activa es liberada gradualmente de las nanopartículas, proporcionando una concentración sostenida del fármaco en los tumores. Se ha observado que esta concentración sostenida de camptotecina en el sitio del tumor resulta en la inhibición del HIF-1 alfa, un factor de transcripción inducido por hipoxia que se sabe que regula la supervivencia de las células cancerosas, la metástasis y la resistencia al fármaco. Los estudios han demostrado que las nanopartículas de CRLX101 aumentan la eficacia de la camptotecina facilitando la localización y retención en el tejido blanco, incrementando la deposición intracelular del fármaco, proveyendo un suministro sostenido de la camptotecina activa y prolongando la actividad del fármaco en el sitio blanco (16). El CRLX101 está en evaluación Fase II para el tratamiento de diversos tipos de SCIEPRO/Science Photo Library/Getty Images SOLUCIONES EN FARMACÉUTICOS 27/05/13 16:32 tumores (15). El NK105 de Nippon Kayaku, una formulación de paclitaxel basada en nanopartículas incorporadas en copolímeros en bloque de PEG-poliaspartato, fue desarrollada para aumentar la actividad antitumoral del paclitaxel reduciendo mientras tanto los efectos adversos tales como neurotoxicidad, mielosupresión y reacciones alérgicas (17). El NK105 está actualmente en desarrollo Fase III y se están llevando a cabo estudios para investigar si el NK105 puede mejorar la sobrevivencia sin avance en pacientes con cáncer de mama metastásico o recurrente. Otros ejemplos de terapéuticos para el cáncer, dirigidos a nivel molecular y basados en nanopartículas que están en desarrollo clínico incluyen el BIND014 de BIND Biosciences (Fase I), el CALAA-01 de Calando (Fase I), el MBP-426 de Mebiopharm (Fase I/II), y el SGT53-01 de SynerGene (Fase I). Pharmaceutical Technology habló con Robert Langer, profesor del Instituto de Tecnología de Massachusetts (MIT) y fundador de BIND Biosciences; Stephen Zale, vicepresidente de desarrollo en BIND Biosciences; y Yanli Zhao, profesor asistente y miembro de la fundación de investigación nacional en la Universidad Tecnológica de Nanyang (NTU), Singapur, acerca de la ingeniería de las nanopartículas con propiedades óptimas para usar como terapias para el cáncer. Construyendo en propiedades óptimas PharmTech: ¿Cuáles son las consideraciones clave cuando se diseñan nanopartículas para la entrega de terapéuticos para el cáncer? ¿Cómo se construyen estas nanopartículas para lograr la entrega dirigida? Zale (BIND Biosciences): Esta es una cuestión complicada debido a que los efectos de muchas características sobre cómo se comportan las nanopartículas en el cuerpo humano son interdependientes entre sí. Hablando ampliamente, para que las nanopartículas sean efectivas, éstas deben poder circular en el torrente sanguíneo, extravasarse dentro de los tejidos enfermos y liberar su carga terapéutica a una velocidad que proporcione altas concentraciones en el sitio blanco. Nosotros utilizamos partículas basadas en copolímeros de ácido poliláctico (PLA) o ácido copoliláctico/glicólico (PLGA) y PEG, y pegamos ligandos focalizados en el extremo de la cadena del PEG. Hemos desarrollado un proceso de manufactura de partículas que PT MAYO / JUNIO.indd 61 encapsulan la carga del fármaco en el núcleo del PLA/PLGA de la partícula y orienta el PEG y el ligando focalizado hacia la superficie de la partícula. El PEG le da a las partículas una corona similar al agua, que oculta a las partículas de los sistemas corporales que de otra manera las retirarían de la corriente sanguínea en unos pocos minutos después de la administración. Como resultado, nuestras nanopartículas muestran vidas medias en la circulación de cerca de 24 horas y son capaces de concentrar los fármacos en tumores a niveles típicamente 10 veces mayores que cuando la misma dosis se da en solución. Langer (MIT y BIND Biosciences): Hemos utilizado un amplio rango de ligandos focalizados, incluyendo anticuerpos, fragmentos de anticuerpos, aptámeros, péptidos y pequeñas moléculas. Hemos estudiado un rango de objetivos que incluyen, por ejemplo, objetivos tumorales bien establecidos y clínicamente validados como el antígeno de membrana específico para próstata (PSMA) y receptor 2 del factor de crecimiento epidérmico humano (HER2), y han descubierto nuestros propios blancos y ligandos en áreas tales como la enfermedad cardiovascular. En BIND, es rápida la traducción a la clínica y por lo tanto, el foco está sobre los blancos validados en áreas de necesidades clínicas no cumplidas como el cáncer, y principalmente utilizando péptidos y ligandos de pequeña molécula para la focalización. Existen muchos antígenos o receptores expresados por células cancerosas o el tejido circundante que pueden ser La focalización pasiva con frecuencia no es suficiente para erradicar los efectos colaterales de fármacos citotóxicos. - Zhao focalizadas por ligandos de péptidos o pequeñas moléculas, las cuales son inherentemente más estables y menos complejas que los ligandos macromoleculares tales como anticuerpos y aptámeros. Por ejemplo, mientras que nuestros estudios iniciales empleaban un aptámero que se dirigía al PSMA, BIND cambió a una molécula pequeña de unión al PSMA en el BIND-014, lo cual les permitió moverse rápidamente al desarrollo clínico con una partícula dirigida simple, farmacéuticamente estable y bien caracterizada. Esta partícu- la dirigida al PSMA puede ser fabricada reproduciblemente a gran escala y ha demostrado ser no tóxica en estudios en animales. Zhao (NTU): Las nanopartículas tienden a agregarse como resultado de su gran relación de superficie a volúmen en el medio biológico. Cuando se aglomeran las nanopartículas, éstas no sólo pierden su funcionalidad pretendida, sino que son rápidamente reconocidas y efectivamente removidas por las células fagocíticas mononucleares en el sistema retículoendotelial (RES) del hígado y el bazo. Este secuestro con frecuencia se incrementa por el recubrimiento superficial de nanopartículas con una corona de proteínas que lleva a la opsonización y fagocitosis mejorada por el RES. Una estrategia para mantener una buena dispersión de nanopartículas cargadas con fármaco en medios biológicos es por modificaciones en la superficie con polímeros de PEG. Se sabe que el PEG evita la adsorción de proteína (opsonización) sobre las superficies de la nanopartícula, mejora el tiempo de circulación, reduce la captación no específica del RES y facilita la acumulación preferencial en sitios del tumor a través del efecto EPR. Sin embargo, la focalización pasiva por sí misma, con frecuencia no es suficiente para erradicar los efectos colaterales de fármacos citotóxicos y desvían la terapia anticáncer alejándola de las células sanas a las células cancerosas selectivamente focalizadas. Para mejorar más la capacidad de focalización de nanopartículas cargadas con fármaco, estos sistemas también deben ser acoplados con agentes focalizadores que pueden unirse activamente con antígenos sobre-expresados o receptores en la superficie de las células cancerosas. Las nanopartículas cargadas con fármaco pueden construirse para reconocer y unirse a células cancerosas a través de interacciones ligando-receptor y las nanopartículas enlazadas se internalizan antes de que el fármaco cargado sea liberado dentro de las células. Finalmente, existe otra preocupación de que estos sistemas de entrega de fármacos deben liberar el fármaco cargado rápidamente acumulándola en los sitios del tumor y después de haber sido captada por las células cancerosas. Diseño de nanopartículas para la focalización selectiva PharmTech: ¿Podría describir su investigación sobre nanopartículas como sistemas de entrega dirigidos en el traPharmaceutical Technology en Español MAYO / JUNIO 2013 61 27/05/13 16:32 SOLUCIONES EN FARMACÉUTICOS tamiento del cáncer? Langer (MIT y BIND Biosciences): La idea de emplear nanopartículas dirigidas para llevar los fármacos para cáncer al sitio de la enfermedad e incrementar su seguridad ha estado dando vueltas durante varias décadas, pero hasta recientemente la solución ha sido esquiva. Un obstáculo mayor ha sido la incapacidad de lograr la interacción óptima de las características de la partícula que confiere la dirección a las células enfermas, la evasión de los mecanismos de depuración de partículas y la liberación controlada de la carga del fármaco encapsulada. A mediados de la década del 2000, Omid Farokhzad de la Escuela de Medicina de Harvard y yo, desarrollamos una nueva estrategia para la focalización de nanopartículas poliméricas cargadas con el fármaco a los sitios de la enfermedad, incluyendo las células cancerosas y la vasculatura enferma. La tecnología se basa en un novedoso proceso de auto-ensamblado que permite la formación de bibliotecas de nanopartículas que consisten en cientos e incluso miles de distintas formulaciones de nanopartículas. Desarrollamos métodos para separar estas partículas para identificar a aquéllas con las propiedades óptimas para la focalización al tejido enfermo y la evasión de los tejidos que no son el blanco. De manera importante, las partículas que desarrollamos están compuestas de polímeros biocompatibles y biodegradables que son usados comúnmente en otros productos farmacéuticos tales como microesferas biodegradables y proteínas PEGiladas. Zale (BND Biosciences): BIND está actualmente usando esta plataforma para desarrollar nanopartículas focalizadas llamadas Accurins para tratar el cáncer y otras enfermedades. La compañía se ha propuesto desarrollar Accurins para evaluación clínica. La más avanzada de estas nanopartículas es el BIND-014, un Accurin dirigido a un receptor de la superficie celular expresado en todos los tipos de tumores sólidos mayores. El BIND-014 contiene el agente quimioterapéutico docetaxel, el cual es un fármaco revolucionario por derecho propio, con aprobaciones en cinco indicaciones de tumores sólidos, incluyendo el de mama, pulmón y próstata. El BIND-014 apenas ha completado un estudio clínico Fase I y está avanzando a la Fase II. Los primeros resultados para el BIND-014 son muy prometedores. Hemos visto que el fármaco se comporta de manera muy diferente 62 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 62 MAYO / JUNIO 2013 del docetaxel convencional, incluyendo señales de actividad mostrada en dosis relativamente bajas y en tumores donde el docetaxel no se utiliza normalmente. Zhao (NTU): Nuestras nanopartículas de sílica meso-porosa multifuncional para la entrega controlada y dirigida al cáncer tienen tres componentes -el núcleo de nanopartícula de sílica mesoporosa, la amino-β-ciclodextrina, los polímeros de PEG funcionalizados con una unidad de adamantano (Ad) en un extremo y una unidad de folato (FA) en el otro extremo (Ad-PEG-FA) (18). La superficie de las nanopartículas de sílica mesoporosa se funcionaliza primero con los anillos de la amino-β-ciclodextrina unidos por enlaces disulfuro hidrolizables, que bloquean los fármacos dentro de los mesoporos de las nanopartículas. Los polímeros de Ad-PEG-FA son inmovilizados sobre la superficie de la nanopartícula a través de una fuerte com- El BIND-014 ha completado apenas un estudio clínico Fase I y está avanzando a la Fase II. -Zale plejación de β-ciclodextrina/adamantano. Las nanopartículas multifuncionales pueden ser atrapadas eficientemente por las células cancerosas, ricas en receptores de folato a través de endocitosis mediada por el receptor, donde después liberan rápidamente el fármaco anticáncer cargado dentro de la célula cuando se dispara por el pH ácido y el glutatión intracelular. Se construyen diversas funciones sobre las nanopartículas multifuncionales para entregar fármacos de manera óptima. Estas funciones incluyen: • Recubrimiento PEGilado en la superficie de la nanopartícula para mejorar la estabilidad a largo plazo de las nanopartículas bajo condiciones fisiológicas • Focalización activa del cáncer mediante los ligandos de folato unidos a la superficie de la nanopartícula • Liberación del fármaco activada por el pH para permitir que el fármaco se libere dentro de los compartimientos intracelulares ácidos tales como el endosoma y el lisosoma (pH 5.0-5.5) • Superficie de la nanopartícula cargada positivamente bajo condiciones ácidas para facilitar la transferencia de las nanopartículas desde el endosoma al citoplasma Hidrólisis inducida por el glutatión de los enlaces disulfuro para mejorar más la liberación del fármaco en el citoplasma de las células cancerosas. La construcción de estas funciones sobre las entidades individuales de nanopartículas mejora la eficacia de la entrega de fármacos anticáncer a las células cancerosas, reduciendo mientras tanto los efectos citotóxicos sobre las células sanas. Los experimentos in vivo demuestran que las nanopartículas de sílica mesoporosa multifuncionales, cargadas con doxorubicina, podrían efectivamente liberar la doxorubicina en los sitios con tumor dando como resultado una inhibición significativa del crecimiento tumoral. • Referencias 1. M. Morgen et al., Pharm. Res. 29 (2) 427440 (2012). 2. A. Siew et al., Mol. Pharm. 9 (1) 14-28 (2012). 3. C. Liu et al., Biomat. 34 (10) 2547-2564 (2013). 4. I. Altintas et al., J. Control. Rel. 165 (2) 110-118 (2013). 5. W.Y. Qian et al., Int. J. Nanomed. 7: 57815792 (2012). 6. J.H. Sung, D. Han, and J.B. Lee, Biotechnol. J. 8 (2) 215-220 (2013). 7. C.Y. Dombu and D. Betbeder, Biomat. 34 (2) 516-525 (2013). 8. S. Hauptstein and A. BernkopSchnurch, Expert. Opin. Drug Deliv. 9 (9) 1069-1081 (2012). 9. R. Singh and J.W. Lillard, Exp. Mol. Pathol. 86 (3) 215-223 (2009). 10. A.Z. Wang, R. Langer, and O.C. Farokhzad, Annu. Rev. Med. 63: 185-198 (2012). 11. A. Swami et al., “Nanoparticles for targeted and temporally controlled drug delivery,” in Multifunctional Nanoparticles for Drug Delivery Applications, S. Svenson and R.K. Prud’homme, Eds. (Springer, US, 2012), pp. 9-29. 12. NanoCarrier, “NC-6004 Nanoplatin,” www.nanocarrier.co.jp/en/research/ pipeline, accessed Feb. 8, 2013. 13. H. Uchino et al., Br. J. Cancer 93 (6) 678687 (2005). 14. R. Plummer et al., Br. J. Cancer 104 (4) 593-598 (2011). 15. Cerulean, “CRLX101,” http://ceruleanrx. com, accessed Feb. 8, 2013. 16. Young et al., Curr. Bioact. Compd. 7 (1) 8-14 (2011). 17. T. Hamaguchi et al., Br. J. Cancer 92 (7) 1240-1246 (2005). 18. Zhang et al., Adv. Funct. Mat. 22 (24) 5144-5156 (2012). PT 27/05/13 16:32 PHOTODISC/GETTY IMAGES SOLUCIONES ESTADÍSTICAS Calculando el resultado reportable de los datos del reanálisis Chris Burgess Dos métodos para evaluar datos de reanálisis después de resultados fuera de especificaciones. L a importancia de Estados Unidos vs. Barr Laboratories (1) en el manejo de resultados fuera de especificaciones (OOS) en el laboratorio farmacéutico no puede ser sobreestimado. Se llevó 13 años después del juicio para que la FDA emitiera su guía final (2) sobre la materia en el 2006. El Grupo de Trabajo de Control de Calidad Analítico (3) de la Aca-demia Europea de Cumplimiento (ECA) lanzó recientemente la versión 2 de su procedi-miento estándar de operación (SOP) sobre investigaciones de OOSA (4), el cual armoniza los enfoques regulatorios de la FDA y Europeos. En una columna anterior, se discutió la cuestión de la selección del tamaño de la mues-tra para el análisis y se hicieron propuestas (5). El artículo, sin embargo, no abordó la polémica cuestión de cómo calcular el resultado reportable. El reanálisis sólo se lleva a cabo si no puede establecerse una causa raíz para el OOS. En tales casos, el requeri-miento de la FDA es específico. Si no se identifica ningún error del laboratorio o de cálculo en la primera prueba, no hay bases científicas para invalidar los resultados OOS iniciales a favor de pasar los resultados del reanálisis. Todos los resultados del análisis, Chris Burgess, PhD, es científico analítico en Burgess Analytical Consultancy Limited, ‘Rose Rae’, The Lendings, Startforth, Barnard Castle, Co Durham,DL12 9AB, RU; Tel: +441833 637 446; chrisburgessconsultancy.com; wwwburgessconsultancy.com tanto los que pasan como los sospechosos, deben ser reportados y considerados en las decisiones de liberación del lote (2). La palabra clave es considerados. ¿Cómo podemos tomar en cuenta todos los resultados del análisis de manera racional y científica según lo requiere el 21 CFR §211.160 (b)? Existen dos maneras bien establecidas de tomar en consideración un resultado OOS para llegar a un resultado reportable. Enfoque del intervalo de confianza estándar Primeramente, buscaremos el aislamiento del resultado OOS utilizando un enfoque de intervalo de confianza estándar. Tomemos como ejemplo que la especificación registrada para un ensayo es 95.0 a 105.0% del etiquetado y que se obtuvo un resultado OOS de 94.7% en el laboratorio. La investigación que se realizó no pudo identificar una causa raíz. La unidad de calidad autorizó un protocolo de reanálisis para seis reanálisis y los resultados en % obtenidos fueron 98.0, 97.0, 96.1, 96.5, 97.4 y 96.2. En este ejemplo, se tomó la decisión de que seis resultados de reanálisis que pasaran de siete llevarían al aislamiento del resultado OOS en lugar del ejemplo del caso de Barr que era de siete resultados de ocho. Sin embargo, la cuestión que permanece es cómo demostrar que el resultado OOS ha sido aislado con éxito y como calcular el resultado reportable. Una cosa que no podemos hacer para llegar a un resultado reportable es tomar el promedio de todos los resultados porque: En el contexto del análisis adicional realizado durante una investigación OOS, promediar el(los) resultado(s) del análisis original que ocasionó la investigación y los resultados del reanálisis adicional o del remuestreo obtenidos durante la investigación del OOS no es apropiado ya que oculta la variabilidad entre los resultados individuales (2). Existe también una buena razón estadística para no calcular este promedio, la cual es porque la media aritmética (el promedio) es sensible a resultados aberrantes y una inclusión del OOS causará que el resultado reportable esté sesgado. Un mejor enfoque sería utilizar un método estadístico para calcular la media robusta y la desviación estándar robusta. La idea detrás del método de aislamiento utilizando un intervalo de confianza, es que si el intervalo de confianza de la media aritmética, calculado con una confianza de 95% de todos los resultados, cae por arriba del límite de especificación más bajo (LSL), excluirlo del cálculo del resultado reportable está justificado, aunque el resultado OOS será registrado en el registro del laboratorio según está requerido por la regulación. El límite de confianza (LC) al 95% más bajo de la media se calcula para todos los resultados (n = 7) utilizando la ecuación convencional: X– t (0.05,n–1) s n donde X es la media del total de los siete valores, t(0.05, n-1) es el valor de la distribución t para 6 grados de libertad con el 95% de confianza y s es la desPharmaceutical Technology en Español PT MAYO / JUNIO.indd 63 (EC .1) MAYO / JUNIO 2013 63 27/05/13 16:32 SOLUCIONES ESTADÍSTICAS Figura 1: Ilustración de un “aislamiento” exitoso de resultado fuera de especificación (OOS) utili-zando el esquema del intervalo de confianza. LSL es el límite inferior de la especificación, USL es el límite superior de la especificación. LSL USL Límite inferior de confianza al 95 % 105 104 103 102 101 99 Reanálisis 100 98 97 96 95 94 93 92 91 90 Reanálisis OOS inicial Figura 2: Ilustración de un “aislamiento” fallido de resultado fuera de especificación (OOS) utili-zando el esquema del intervalo de confianza. LSL es el límite inferior de la especificación, USL es el límite superior de la especificación. LSL USL Limite inferior de confianza al 95% Reanálisis 105 104 103 102 101 Reanálisis 100 99 98 97 96 95 94 93 92 91 90 OOS inicial al 95% de 94.9%. En este caso, el “aislamiento” fallaría (ver Figura 2). Enfoque H15 Un enfoque estadísticamente más atinado es incluir el resultado OOS directamente utilizando un procedimiento robusto basado en la mediana y las desviaciones a partir de él, debido a que las medianas están menos influidas por los valores aberrantes. El método descrito aquí brevemente está basado en el método H15 de Hubert (6). Este método es más difícil de calcular que el intervalo de confianza estándar ya que se apoya en un procedimiento iterativo. Sin embargo, se logra fácilmente utilizando una hoja de cálculo de Excel sin la necesidad de macros. Los detalles matemáticos se dan en Ellison, Barwick y Duguid Farrant (7) y no se cubren aquí. Este procedimiento estadístico robusto tiene una ventaja mayor en que el cálculo incluye al aberrante como parte de la serie de datos y proporciona valores para la media robusta y la desviación estándar robusta. Este procedimiento de cálculo cumple el requerimiento de la FDA descrito al principio porque se le da consideración activa al resultado OOS. Adicionalmente, calcula el intervalo de confianza al 99% más que al 95%, ya que proporciona un mayor aseguramiento del cumplimiento con la especificación. Brevemente, el algoritmo usado es el siguiente: 1. Calcular el estimado inicial de la mediana y la desviación estándar robusta. 0 viación estándar de la muestra calculada. Por lo tanto para nuestro ejemplo: t s IC 95% inferior = X (0.05,n–1) n 2.45 (1.06) = 96.76– 7 = 95.8 (EC .2) Como este valor es mayor que el LSL de 95.0%, el aislamiento del resultado OOS inicial se logra. El valor reportable es el valor medio 64 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 64 de seis resultados del reanálisis. Esta situación se muestra en la Figura 1. Observe en la Figura 1 y, en particular, en la Figura 2, el efecto del sesgo sobre la media causado por la inclusión del resultado OOS original y el ensanchamiento de la distribución normal. Existe una desventaja estadística para este método debido a que la distancia del resultado OOS de los valores de reanálisis causa un punto en el cual falla el “aislamiento”. Por ejemplo, si el resultado OOS fuera 92.7% en lugar de 94.7, entonces al repetir el cálculo se tendría un límite inferior de confianza 1 n 1.483Mediana 2. x *i = Evaluar todos los puntos de datos utilizando x *i–1 –1.5s *i–1 if x *i < x *i–1 –1.5s *i–1 x *i–1 + 1.5s *i–1 if x *i > x *i–1 + 1.5s *i–1 de otra forma x *i–1 Este paso reemplaza los puntos fuera del rango con valores en los límites de con- MAYO / JUNIO 2013 27/05/13 16:32 Figura 3: Ilustración del esquema H15 para calcular la media robusta y la desviación estándar robusta. LSL es el límite inferior de la especificación. LSL X̂ 0 = 96.5 2.96ŝ 0 = 2.20 Datos iniciales – X = 96.56 s = 1.063 94.0 95.0 96.0 97.0 98.0 99.0 Iteración 1 94.0 95.0 96.0 97.0 98.0 99.0 – X = 96.62 s = 0.731 Iteración 5 – X = 96.66 s = 0.798 LSL 94.0 H15 X̂ 28 = 96.64 95.0 96.0 97.0 fianza calculados de 99% pero deja otros valores sin cambio. 3. Actualizar el estimado para la desviación estándar con base en el estimado actual con un factor de corrección, β, para la distribución normal. 4. Repetir los pasos 2 y 3 para los datos actualizados hasta que los valores para la media robusta y la desviación estándar robusta ya no cambien, por ejemplo, en 0.1% (es decir, el cálculo converge). 5. Calcular el intervalo de confianza final s donde i es el al 99% de 2.96 β ciclo en el cual converge. Es más sencillo entender el proceso gráficamente (Figura 3) que matemáticamente y este enfoque se ilustra utilizando la misma serie de datos que el ejemplo original. El resultado OOS inicial se muestra como un círculo rojo y los datos del reanálisis se muestran como círculos verdes (línea de datos inicial). El LSL también está marcado i 2.96 ŝ 28 = 2.54 β 98.0 99.0 Iteración28 (convergencia) – X = 96.64 s = 0.860 en la gráfica. La primera iteración se mueve tanto al resultado OOS inicial como al resultado de un reanálisis para el intervalo de confianza robusto calculado de 99% que se muestra como puntos azules rodeados por un círculo rojo. Observe que cinco de los seis resultados del reanálisis no cambiaron a lo largo de todos los cálculos iterativos. Conforme avanzan las iteraciones, la media robusta y la desviación estándar robusta cambian hasta que los valores convergen. En nuestro ejemplo, tomó 28 iteraciones para obtener la convergencia. El cambio más grande durante las iteraciones es para la desviación estándar robusta. El intervalo de confianza final al 99% está dentro de la especificación y el valor de la media robusta para el resultado reportable (basado en los siete puntos de datos) es 96.44. Conclusión Se han descrito dos enfoques establecidos para la evaluación de los datos de reanálisis SU PRESENCIA EN LA REVISTA MÁS LEIDA POR LA INDUSTRIA FARMACÉUTICA después de un resultado OOS junto con un método para generar un resultado reportable. Estos dos enfoques no son los únicos y las compañías pueden seleccionar y defender sus propios enfoques estadísticos. Cualquiera que sea el esquema que se seleccione, la selección debe ser documentada, justificada y descrita en un PNO. References 1.United States vs. Barr Laboratories, Inc. Civil Action No. 92-1744, US District Court for the District of New Jersey: 812 F. Supp. 458. 1993 US Dist. Lexis 1932; Feb. 4, 1993, as amended Mar. 30, 1993. 2. FDA, Investigating Out-of-Specification (OOS) Test Results for Pharmaceutical Production (Rockville, MD, Oct. 2006). 3. European Compliance Academy (ECA) Analytical Quality Control Working Group website, www.gmp-compliance. org/eca_aqc_aboutus.html, accessed Jan. 7, 2012. 4. C. Burgess and B. Renger, ECA Standard Operating Procedure 01, Laboratory Data Management; Out of Specification (OOS) Results, Version 2, Aug. 2012. 5. L.D. Torbeck, Pharm. Tech. 35 (12), 28, 54 (2011). 6. M. Thompson and P.J. Lowthian, Notes on Statistics and Data Quality for Analytical Chemists, Section 7.6; Huber’s H15 method, Imperial College Press, 2011, ISBN-10 184816-617 & references therein. 7. S.L.R. Ellison, V.J. Barwick, and T.J. Duguid Farrant, Practical Statistics for the Analytical Scientist, Section 5.3; Robust Statistics, Royal Society of Chemistry, 2009, ISBN 978-0-85404-131-2. PT CONTRATE SU PAUTA PUBLICITARIA AHORA Mayores Informes y Contrataciones: Tel: 52 (55) 5659-8880, 5536-2100, 5543-1486 E-mail: [email protected] Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 65 MAYO / JUNIO 2013 65 27/05/13 16:32 Granulado con espuma Granulación espumosa Una nueva técnica para la granulación húmeda continua, utilizando un extrusor de doble tornillo Michael R. Thompson y Paul J. Sheskey Como resultado del cambio de filosofía hacia la manufactura continua, se está introduciendo nuevo equipo en las plantas de producción farmacéutica. El extrusor de doble tornillo es un ejemplo de dicho equipo para usar en la granulación húmeda. Los autores revisan desarrollos en granulación húmeda utilizando un extrusor de doble tornillo; exponen los elementos con humectación en esta máquina e introducen una nueva técnica, la granulación espumosa, que utiliza el extrusor de doble tornillo para satisfacer completamente las necesidades únicas de granulación. Michael R. Thompson* es profesor asociado en el Departamento de Ingeniería Química en la Universidad McMaster, Hamilton, Ontario, L8S 4L7, Canadá, Tel: 905.525.9140, [email protected], y Paul J. Sheskey es científico de investigación en Larkin Laboratory, The Dow Chemical Company, Midland, Michigan. *A quien debe dirigirse la correspondencia Sometido: Septiembre 6, 2012. Aceptado: Septiembre 28, 2012. 66 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 66 MAYO / JUNIO 2013 E l extrusor de doble tornillo proporciona granulados altamente consistentes debido a su operación continua y camino del flujo estrechamente confinado, lo que requiere que todas las partículas experimenten una historia de cizallamiento similar. El intenso mezclado del extrusor de doble tornillo permite una concentración de líquidos óptima más baja para la granulación, produciendo al mismo tiempo gránulos más densos para las formulaciones placebo y para los fármacos con dosificación alta en comparación con un mezclador de lotes de alto cizallamiento (1, 2). Como resultado, las operaciones de secado y molido pueden reducirse significativamente con el uso de esta maquinaria en la producción de formas farmacéuticas sólidas orales. El líquido de aglutinación en la granulación húmeda tiene una profunda influencia sobre las propiedades del gránulo del producto (3-5) y afecta la fricción entre los polvos transportados y la pared del barril dentro del extrusor, lo cual afecta el consumo de polvo y la temperatura de salida de los gránulos (2, 6). Existen asuntos cruciales a ser resueltos con respecto a la introducción de líquidos en este tipo de maquinaria para obtener la humectación rápida y uniforme de los excipientes, de manera que el proceso exhiba estabilidad en la operación, los límites se lubriquen inmediatamente para reducir el desgaste del equipo y el calentamiento de los gránulos y para obtener granulados de alta calidad. Función del extrusor de doble tornillo Una variante común del extrusor usado para granulación es el extrusor de doble tornillo co-rotatorio, completamente interengranado (7). Las diferencias entre los proveedores se basan en gran medida en el volumen interno disponible de la máquina (con frecuencia descrito por la relación del diámetro exterior con respecto al diámetro interior de los elementos del tornillo) así como el diámetro del tornillo, pudiendo ambos afectar significativamente las propiedades del granulado tanto en el tamaño del gránulo como en la porosidad intragranular (8). La máquina es altamente modular, haciéndola una plataforma flexible para la manufactura continua de diferentes productos durante su período de vida de servicio a la compañía. La región de inter-engranado entre los dos tornillos crea una acción de auto-barrido que minimiza la acumulación de material dentro de la máquina pero también proporciona un camino complejo del flujo para mezclar y consolidar los polvos. Para la granulación húmeda, el molde final del extrusor está generalmente abierto para colectar gránulos sin consolidación excesiva. La granulación húmeda dentro del extrusor de doble tornillo co-rotatorio es un proceso de alimentación continua, lo que significa que el volumen interno disponible de la máquina nunca está completamente lleno con material durante la operación. Este modus operandi es importante para la extrusión 27/05/13 16:32 porque minimiza la acumulación de caFigura 1: Diseños de tornillo característicos usados en extrusores de doble tornillo para granulación lor disipado en las formulaciones del fárhúmeda. Los tornillos mostrados corresponden a la literatura a que se hace referencia en este maco transportado, ya que limita la comartículo: (a) ref. 11, (b) ref. 4, (c) ref. 6. Los polvos entran en el extremo del lado izquierdo y las presión contra la pared del barril, desflechas indican los puntos de adición del líquido acopla los parámetros de la velocidad de salida y velocidad de tornillo para darle a los formuladores más control sobre su proceso, y permite más rápidamente (a) la adición corriente abajo de materiales (sólidos, líquidos o gases) porque el sistema no está presurizado excepto para (b) regiones de mezclado pequeño. Las zonas de los tornillos que están privadas de material experimentan un flujo de arras(c) tre dominante, en la cual los polvos son empujados corriente abajo mediante los vuelos giratorios de los elementos tipo transmisión. Se ha encontrado que estos (d) elementos del tornillo contribuyen poco al crecimiento del gránulo (5, 9). De heBloque de amasado Elemento de peinado o picado cho, los diseños de tornillo que usan sólo elementos de transmisión muestran muy pobre distribución extrusor. El problema surge debido al espacio estrechamente del líquido aglutinante dentro de los sólidos de salida (10). Es confinado dentro del extrusor, mencionado al inicio, que da raro, sin embargo, que un diseño de tornillo esté comprendido como resultado que el puerto de inyección del líquido esté en completamente de elementos de transmisión o que la longitud inmediata proximidad al flujo de polvo. Este confinamiento completa de la máquina esté siempre completamente privada. evita la atomización de la solución aglutinante en gotas miEl crecimiento significativo de los gránulos requiere la inclu- cro-dimensionadas antes de entrar en contacto con los sólidos sión de zonas de mezclado conducidas con presión, las cuales del polvo, como se hace en las mezcladoras de alto cizallaestán necesariamente completamente llenas conforme los pol- miento. Como resultado, se sobresaturan regiones del polvo vos son exprimidos a través de estas secciones. Los bloques mientras que otras permanecen virtualmente secas. Este prode amasado y los elementos de peine (es decir, picado) son blema fue destacado en el artículo de Shah dirigido al indusejemplos de mezcladores comúnmente usados en números trial, quien reportó una sobretensión del proceso, aunque los moderados a lo largo de la longitud del tornillo para producir eventos de sobrecarga del motor son también comunes (11). el crecimiento del gránulo con menor desgaste (5, 9, 11-13). Shah demostró varias estrategias relacionadas con el diseño La Figura 1 muestra algunos diseños típicos para la granula- del tornillo y la adición secuencial de cantidades de líquido ción. Mantener estos elementos de mezclado más cerca del más pequeñas dentro del proceso como medio para minimizar la presencia de sobretensión. Dichos cambios incrementan en final del extrusor reduce el desgaste (4). La velocidad de flujo del polvo es uno de los parámetros gran medida la complejidad de operación del extrusor y no más significativos que influyen el alcance de crecimiento del eliminan la causa raíz del problema. Alternativamente, una gránulo, con mayores salidas que producen gránulos más nueva solución llamada granulación espumosa utiliza el comgrandes. El efecto es causado por los mayores volúmenes portamiento único de la espuma acuosa para causar la rápida de polvo que se acumulan en frente de las zonas de mez- dispersión del líquido aglutinante sobre una gran área del polclado presurizadas conforme se incrementa la velocidad de vo durante la humectación. flujo, produciendo mayores fuerzas compresivas axiales en las partículas presentes. De hecho, se ha demostrado que la Granulación espumosa dispersión del aglutinante dentro de una masa escasamente El aglutinante espumoso acuoso utilizado en la granulación humectada puede mejorarse para la granulación si el diseño espumosa está compuesto de un alto volumen de gas disperdel tornillo y la velocidad de flujo se ajustan para proporcio- sado dentro de un líquido que contiene excipientes es pumannar fuerzas de compresión apropiadas (6). Sin embargo, la tes, formando así una estructura semirrígida, inestable. Los influencia de la velocidad de flujo sobre el crecimiento del excipientes efectivos para la granulación farmacéutica son gránulo no se ve con frecuencia en los extrusores más peque- especies del éter de celulosa que promueven una alta actiños o en procesos altamente privados (4). El incremento de la vidad espumante y actúan como aglutinantes en el proceso. velocidad del tornillo tiene menos influencia en el tamaño del Muchos excipientes aprobados no iónicos, poliméricos son gránulo, pero generalmente incrementa el número de eventos también agentes espumantes adecuados. El líquido espumoso de picado proporcionados por las zonas de mezclado para re- puede incluir aditivos (p.ej., especies poliméricas para agluducir la ocurrencia de partículas sobredimensionadas (4, 6, 9). tinación o recubrimiento y partículas, como APIs, deslizantes Para una velocidad de flujo fija, el incremento de la velocidad y desintegrantes) en tanto no interfieran con su preparación. del tornillo reducirá el volumen del polvo que llena los ele- Las espumas semirrígidas exhiben característicamente burbumentos del tornillo de transmisión, lo que resulta en menor jas estrechamente empacadas o una morfología polihédrica que depende de la fracción gas-volumen aunque se requiere consumo de polvo por el proceso. Entre los estudios publicados para la granulación húmeda, un mínimo de 64% (v/v) de gas para que la espuma muestre un punto crucial que rara vez se menciona, aunque es am- algún grado de rigidez. La fracción de volumen del gas prepliamente conocido en la industria farmacéutica, es la difi- sente en la espuma se conoce con frecuencia como su calicultad de humectar uniformemente una formulación en un dad espumante (FQ). Para la granulación, FQ generalmente Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 67 MAYO / JUNIO 2013 67 27/05/13 16:32 Granulado con espuma Figura 2: Distribución típica del equipo para la granulación espumosa que muestra: (1) extrusor de doble tornillo, (2) puerto de alimentación del polvo, (3) alimentador gravimétrico para los excipientes en polvo, (4) rellenador lateral, (5) generador de espuma mecánico y (6) tubo de alimentación de espuma. Figura 3: Una vista transversal del extrusor de doble tornillo parcialmente lleno con excipientes e polvo (en azul) muestra las diferencias en configuración usadas para (a) inyectar directamente líquidos contra (b) introducir espuma aglutinante dentro del proceso de granulación. Puerto de inyección (a) Sección transversal principal del extrusor que muestra los elementos de transmisión (b) Rellenador lateral se mantiene en un rango de 75-95%. Las espumas que están demasiado húmedas (<75% de FQ) carecen de la estabilidad adecuada para dispersarse bien y con frecuencia simplemente se colapsan sobre las superficies del equipo de proceso. Las espumas muy secas (>95% de FQ) ocupan volúmenes muy grandes de espacio (lo que complica su adición dentro del proceso confinado); muestran viscosidades inherentes muy altas (tanto como 105 veces la de su líquido contenido) y se colapsan más fácilmente en presencia de cizallamiento que las espumas más húmedas (14). La granulación espumosa fue introducida por primera vez por Keary y Sheskey para el mezclado con alto cizallamiento de ingredientes farmacéuticos (15). Este estudio demostró que se requería menos líquido aglutinante y que la 68 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 68 MAYO / JUNIO 2013 velocidad de adición de la espuma podía ser mucho más alta en comparación con la atomización con rocío. Los menores requerimientos de líquido aglutinante fueron explicados en los estudios de penetración en lecho estático de Tan et al., los cuales analizaron las características de saturación de la espuma contra la humectación por goteo con lactosa y polvos de vidrio Ballotini (16). Estos estudios observaron que más masa aglutinante era absorbida por estos polvos mediante la espuma contrariamente a la adición por goteo en cualquier momento dado, y como resultado, los núcleos de los gránulos eran 40% más grandes. Las espumas de mayor FQ fueron absorbidas más lentamente debido al engrosamiento más lento de la espuma y al drenado más lento de su líquido contenido en el polvo de contacto (14, 17). Se han reportado varios estudios de granulación espumosa para mezcladores de alto cizallamiento (17-21). La granulación espumosa continua con un extrusor de doble tornillo fue introducida en un estudio de caso que comparó la técnica con el método de adición de líquido convencional (6). Una metodología exitosa para medir dicha espuma dentro de la máquina requirió que se reconociera su conducta, similar a la de un sólido, y utilizando esquemas comúnmente empleados para la alimentación de sólidos a granel más que de líquidos. Una unidad auxiliar, conocida como rellenador (stuffer) lateral en la industria de la extrusión, se encontró que era adecuada para la alimentación de la espuma. El rellenador lateral está fácilmente disponible comercialmente, y el arreglo físico y el software de control de la mayoría de los extrusores pueden ser configurados para adaptarse a él. En la Figura 2 se muestra una disposición típica de la extrusión con el rellenador lateral y el generador se espuma. El rellenador lateral es una barrena en miniatura, de doble tornillo que se monta en un lado del extrusor principal y transporta los materiales a una zona especificada del proceso. Debido a la acción de arrastreflujo de los tornillos rotatorios en el alimentador lateral, la espuma se fuerza dentro de la formulación que va pasando dentro del extrusor principal y se colapsa parcialmente con el contacto, mientras que la espuma sobrante forma una capa entre el polvo y el barril del extrusor. La Figura 3 destaca las diferencias conceptuales entre la inyección líquida y la adición de espuma desde una vista perpendicular del extrusor. El mecanismo de humectación con espuma dentro del extrusor está todavía en estudio. Un modelo de dos etapas propuesto en una publicación reciente se basó en la forma en que las espumas preparadas de líquidos de diferentes viscosidades y teniendo diferentes FQs se colapsaban y drenaban bajo diferentes condiciones de cizallamiento, así como la manera en que afectaban las propiedades del gránulo del extrusor (14). Se piensa que ocurre una etapa de humectación dirigida por la presión en el punto de entrada en donde entra la espuma al proceso, con las espumas más rígidas que mostraban mayor resistencia colapsando inmediatamente con el contacto con la formulación no humectada. La espuma sobrante, no colapsada empuja el polvo a un lado para formar una capa arriba. La subsiguiente etapa de humectación conducida por el cizallamiento parece estar gobernada por la respuesta de la espuma al cizallamiento; las capas de espuma más rígida se colapsan más fácilmente bajo cizallamiento mecánico para humectar el polvo debajo, mientras que las espumas más humectadas muestran mayor resistencia al colapso bajo cizallamiento mecánico estableciendo morfologías más estables comprendidas por burbujas más pequeñas. Desde un punto de vista operacional, práctico, el método “Granulación espumosa”continúa en la pág. 70 27/05/13 16:32 CALENDARIO DE EVENTOS Cuando usted contacte a alguno de los organizadores de éstos eventos, por favor mencione que vio su evento en MAYO 3–6 World Biotechnology Congress 2013. Lugar: Boston, USA Contacto / Info: http://www.pharmtech.com/ pharmtech/Events/World-Biotechnology-Congress-2013/ Event/detail/www.worldbiotechcongress.com 8 – 10 BIOtech Japón. Lugar: Tokyo Big Sight. Contacto / Info: [email protected], Teléfonos: 81-3-3349-8518, Página Web: www.bio-t.jp/en 13 – 16 Achemasia 2013. Lugar: Beijing, PRC China National Convention Center. Contacto / Info: wu@dechema. de, Teléfonos: + (49) 6975 64152, Página Web: http:// achema-content.dechema.de/ 14 – 15 Expoplast Toronto 2013. Lugar: Toronto Congress Center, 650 Dixon Road M9W 1J1 Toronto, Canadá. Contacto / Info: [email protected], Teléfonos: + (14) 16245 5000, Página Web: www.expoplast.org JUNIO 4–6 ALIMENTARIA MEXICO 2013. Lugar: Centro Banamex, México DF. Página Web: www.alimentaria-mexico.com/en 14 – 16 XXI COLAMIQC. Lugar: São Paulo – SP BRASIL. Contacto / Info: [email protected]. br, Teléfonos: 55 1150445466, Página Web: www. colamiqc2013.com.br 18 – 21 EXPO PACK MÉXICO 2013. Lugar: Centro de convenciones BANAMEX, Ciudad de México. Contacto / Info: [email protected], Teléfonos: (52) 55 5545 4254, Fax. + 52 (55) 5545-4302, Página Web: www.expopack.com.mx 29 – 30 ENCUENTRO CIENTÍFICO 2013 FEUM – USP. LUGAR: México D.F. Contacto / Info: QFB César Díaz / cdiaz@ farmacopea.org.mx Teléfonos: 5207-8187 y 52076887 Ext. 2822. Fax: ext. 2828. Página Web: www. farmacopea.org.mx 25 – 27 CCPhI China 2013. Lugar: SNIEC, Shanghai, China, Shanghai New International Expo Centre. Contacto / Info: [email protected], Teléfonos: + 86 2128906666, Página Web: www.cphi-china.com promueva su evento aquí contrataciones (55) 5659-8880 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 69 MAYO / JUNIO 2013 69 27/05/13 16:32 Granulado con espuma “Granulación espumosa”continuación de la pág. 68 Tabla 1: Diferencias entre la adición de aglutinante espumoso y líquido en la granulación Adición de aglutinante en espuma Adición de aglutinante líquido Granulación aceptable en concentraciones de aglutinante de 6% y 11% Granulación aceptable sólo con concentración del aglutinante de 11% Baja compresión axial preferida, de otra manera, agregación excesiva observada Temperatura de salida del gránulo insensible en gran medida al proceso (menos de 40°C en todos los casos) Temperaturas del gránulo muy altas (llegando a tanto como 90°C en condiciones de compresión axial alta de granulación húmeda: • Evita sobretensión del proceso en un extrusor de doble tornillo debido a la alta área de cobertura de la espuma sobre el polvo durante la humectación • Simplifica el arranque del proceso porque las velocidades de operación completa pueden alcanzarse inmediatamente, no así con la inyección de líquido, donde el flujo del polvo debe incrementarse lentamente para evitar sobrecarga del motor • Reduce el desgaste de la máquina, indicado por el extrusor que ya no experimenta más los fuertes ruidos de golpes que indican la deflexión del tornillo causada por un flujo de polvo disparejo. Se piensa que estas observaciones están relacionadas con el mecanismo de humectación en dos etapas previamente descrito, el cual causa que el polvo se aísle inmediatamente de la pared del barril por una capa de espuma, al menos hasta que está bien humectado. El polvo en este caso está constantemente saturado con el aglutinante sobre un área mucho más grande de contacto que en la adición directa de líquido, la cual minimiza la concentración local del aglutinante en el material poroso. La característica de lubricación de la granulación espumosa, en la cual la capa de espuma aísla los polvos de la pared del barril hasta que está uniformemente humectado, es un punto importante a ser subrayado para el proceso de extrusión. La lubricidad de los sólidos transportados afecta tanto al consumo de polvo por la maquinaria así como a la temperatura de salida de los gránulos (2). Comparación de granulación húmeda con espuma y convencional Un estudio a velocidades de flujo en escala piloto (20-40 kg/h) comparó la adición del aglutinante espumoso y la inyección directa del líquido en la granulación (6). Se utilizó un aglutinante de metilcelulosa (Dow, Methocel A15 PLV) en dos concentraciones, 6% y 11% (p/p), con relación a polvo de -lactosa monohidratada. Se probaron dos tornillos para producir diferentes características de compresión axial (que fueron mencionadas previamente como un factor importante para el crecimiento del gránulo dentro del extrusor) con velocidad de flujo cambiante: una con un solo par de elementos de mezclado que producen menor compresión axial (LAC) y una segunda con dos pares en serie para proveer una vía de flujo más restrictiva y mayor compresión axial (HAC). En la Tabla 1 se resumen las notables diferencias entre los dos métodos de granulación. Las propiedades del gránulo del estudio mos70 Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 70 traron que se alcanzaron tamaños y porosidad intragranular comparables por cualquiera de los métodos, siempre que se usaran las condiciones apropiadas. El requerimiento reducido de líquido en el proceso fue un hallazgo comparable al que se encuentra con los mezcladores de alto cizallamiento (15). Conclusiones La granulación húmeda en máquinas de extrusión de doble tornillo tiene varias ventajas clave sobre los métodos convencionales, pero para avanzar a la aceptación para la producción GMP, sus operaciones necesitan ser mejor entendidas y necesitan resolverse los desafíos con respecto a la estabilidad del proceso. La granulación espumosa continua es una nueva técnica robusta que resuelve los problemas de sobretensión del proceso que están relacionados con una pobre humectación del polvo mediante los métodos convencionales, de adición de líquido. La alta tendencia a la dispersión de la espuma en la granulación, contra la naturaleza de remojo inmediato de los líquidos, produce polvos humectados más uniformemente e incrementa la lubricidad general del proceso, lo cual beneficia el comportamiento de desgaste de la máquina y minimiza el calentamiento disipativo del producto. Con propiedades de la partícula comprables a las de la granulación húmeda convencional, la granulación espumosa le da a los formuladores mayor flexibilidad en el logro de los objetivos de producción. Referencias 1. E.I. Keleb, A. Vermeire, C. Vervaet, and J.P. Remon, Drug Dev. Ind. Pharm. 30 (6) 679-691 (2004). 2. L. Tan, A.J. Carella, Y. Ren, and J.B. Lo, Pharm. Dev. Tech. 16 (4) 302-315 (2011). 3. E.I. Keleb, A. Vermeire, C. Vervaet, and J.P. Remon, Inter. J. Pharm. 239 (1-2) 69-80 (2002). 4. E.I. Keleb, A. Vermeire, C. Vervaet, and J.P. Remon, Inter. J. Pharm. 273 (1-2) 183-194 (2004). 5. D. Djuric and P. Kleinebudde, J. Pharm. Sci. 97 (11) 4934-4942 (2008). 6. M.R. Thompson, S. Weatherley, R.N. Pukadyil, and P.J. Sheskey, Drug Dev. Ind. Pharm. 38 (7) 771-784 (2012). 7. W. Thiele, “Twin-Screw Extrusion and Screw Design,” in Pharmaceutical Extrusion Technology, I. Ghebre-Sellassie and C. Martin, Eds. (Marcel Dekker, New York, NY, 2003), pp. 69-98. 8. D. Djuric, et al., Eur. J. Pharm. Biopharm. 71 (1) 155-160 (2009). 9. M.R. Thompson and J. Sun, J. Pharm. Sci. 99 (4) 2090-2103 (2010). 10. R.M. Dhenge, et al., Pow. Tech., DOI: 10.1016/j.powtec.2012.05.045, May 29, 2012. 11. U. Shah, Pharm. Tech. 29 (6) 52-66 (2005). 12. B. Van Melkebeke, C. Vervaet, and J.P. Remon, Inter. J. Pharm. 356 (1-2) 224-230 (2008). 13. N.O. Lindberg, C. Tufvesson, P. Holm, and L. Olbjer, Drug Dev. Ind. Pharm. 14 (13) 1791-1798 (1988). 14. M.R. Thompson, B. Mu, and P.J. Sheskey, Pow. Tech., 228, 339348 (2012). 15. C.M. Keary and P.J. Sheskey, Drug Dev. Ind. Pharm., 30 (8) 831845 (2004). 16. M.X.L. Tan, L.S. Wong, K.H. Lum, and K.P. Hapgood, Chem. Eng. Sci., 64 (12) 2826-2836 (2009). 17. M.X.L. Tan and K.P. Hapgood, Pow. Tech., 218, 149-156 (2012). 18. S.L. Cantor, S. Kothari, and O.M.Y. Koo, Pow. Tech., 195, 15-24 (2009). 19. P. Sheskey, C. Keary, D. Clark, and K. Balwinski, Pharm. Tech., 31 (4) 94-108 (2007). 20. M.X.L. Tan and K.P. Hapgood, Chem. Eng. Res. Des. 89 (5) 526536 (2011). 21. M.X.L. Tan and K.P. Hapgood, Chem. Eng. Sci. 66 (21) 5204-5211 (2011). PT MAYO / JUNIO 2013 27/05/13 16:32 Directorio Clasificado INST. Y EQUIPO PARA INSPECCIÓN CONTROL Y MONITOREO DE PROCESOS MAQUINARIA DE ACONDICIONAMIENTO / AGRUPADORAS Y ENVOLVEDORAS MAQUINARIA DE ACONDICIONAMIENTO / BLISTERAS Y ENCARTONADORAS MAQUINARIA DE ACONDICIONAMIENTO / LLENADORAS Y TAPONADORAS MAQUINARIA DE ACONDICIONAMIENTO / LLENADORAS Y TAPONADORAS VARIOS / CHAT MASCOTAS Síguenos en... El lugar para los amantes de sus mascotas desde Recibe consejos e información para el cuidado de tu mascota y Consulta a Expertos que responderán a tus principales inquietudes sobre: • Comportamiento / Entrenamiento • Alimentación • Higiene • Control de plagas • Enfermedades / padecimientos comunes • y más Comparte experiencias con otros dueños de mascotas Conoce a otras mascotas como la tuya Encuentra pareja para tu mascota Compra regalos para tu mascota Encuentra, Participa y Aprende Pharmaceutical Technology en Español PT MAYO / JUNIO.indd 71 MAYO / JUNIO 2013 71 27/05/13 16:32 ÍNDICE DE ANUNCIANTES Maquinaria de Acondicionamiento y embalaje Maquinaria de Acondicionamiento / Soplado , Llenado, Sellado Maquinaria de Acondicionamiento / Llenadoras y Taponadoras Maquinaria de Acondicionamiento / Blisteras y Encartoinadoras Instrumentos y Equipos Analíticos - Biotecnología Inst. y Equipo para Inspección. Control y Monitoreo de Procesos Ingredientes Activos/ Excipientes y Vehículos Ingredientes Activos/ Excipientes y Vehículos Granuladores / Molinos Equipo de Proceso / Tableteadoras y Encapsuladras Equipo de Proceso / Encapsuladoras de Gelatina Blanda Construcción y Sistemas Críticos / Cuartos Ambientales Cápsulas de Gelatina Blanda VEOLIA WATER SYSTEMS MEXICO S.A. DE C.V. MEGA EMPACK PACK FEEDER -PACK & PROCESS WEILER ENGINEERING, INC. ROTA - PACK & PROCESS FABRIMA - PACK0TGM - PACK & PROCESS SARTORIUS OPTREL - PACK & PROCESS MEXALC, S.A. DE C.V. COLORCON FITZ PATRICK - PACK & PROCESS ACG -pam - PACK & PROCESS SKY SOFTGEL CO., LTD - PACK & PROCESS GRUPO IDEA CATALENT 71 15 19 27 69 1 71 71 2a de forros 71 41 37 71 3ra. Forros 71 21 4ta. Forros 18 3 4 6 15 16 9 13 12 5 10 14 8 17 2 11 7 1 facebook Mas Q Perruqueria twitter @MASQUEPERRUQUERIA www.petfacebook.com.mx www.eolis.com.mx y www.comsaemte.com www.purelabflex.com / E-mail: [email protected] www.megaempack.com www.packprocess.com / Email: [email protected] www.weilerengineering.com / e-mail: [email protected] www.packprocess.com / Email: [email protected] www.packprocess.com / Email: [email protected] www.sartorius.com / Email: [email protected] www.packprocess.com / Email: [email protected] www.mexalc.com.mx / Email: [email protected] www.colorcon.com/spanish www.packprocess.com / www.fitzmill.com www.packprocess.com / E-mail: [email protected] www.packprocess.com / Email: [email protected] www.grupoidea.com.mx / e-mail: [email protected] www.catalent.com / Email: [email protected] DIRECCIÓN WEB / CORREO ELECTRÓNICO Materiales de Envase y Empaque EOLIS AMERICA LATINA S.A. DE C.V. 69 NO. PARA TARJETA DE SERVICIO AL LECTOR Materiales y Accesorios para Laboratorio / Purificadores de Agua para Laboratorio PETFACEBOOK No. PÁGINA Sistemas de Aire Acondicionado MAS QUE PERRRUQUERIA EMPRESA Varios / Chat Mascotas PRODUCTO/SERVICIO Varios / Estética para mascotas Cuando usted contacte a alguno de estos anunciantes, por favor mencione que vió su anuncio en 27/05/13 16:32 PT MAYO / JUNIO.indd 72 MAYO / JUNIO 2013 Pharmaceutical Technology en Español 72 Marque en la tarjeta de servicio al lector el No. 1 Portada.indd 4 16/11/12 08:29