reacciones de oxidación – reducción
Anuncio
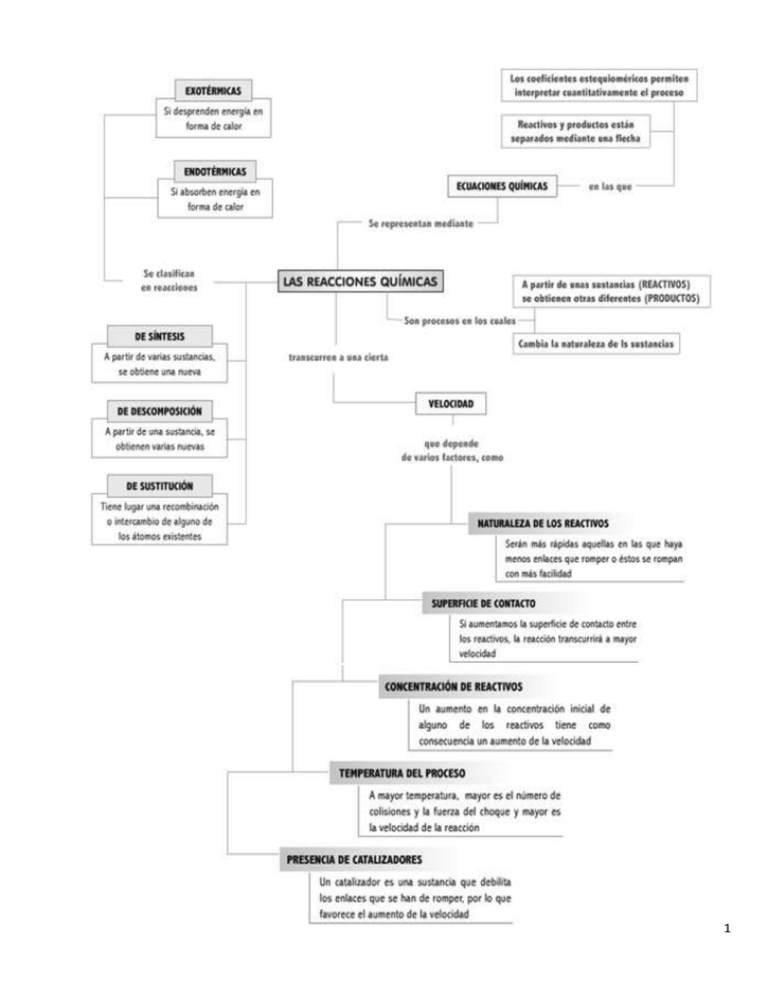
1 LAS REACCIONES QUÍMICAS La materia se caracteriza porque puede transformarse y experimentar cambios estructurales. Estos cambios, muy frecuentes y constantes en la naturaleza, pueden ir desde una alteración física (cambio físico) hasta la transformación en otra sustancia totalmente distinta (cambio químico). Cambio químico En el cambio químico, las sustancias químicas (materia) se transforman en otras sustancias diferentes, debido a que su estructura molecular se altera. Los cambios químicos pueden ser reversibles e irreversibles, y se realizan y desarrollan a través de un proceso conocido como reacción química. Reacción química Una reacción química es un proceso de ruptura y formación de enlaces químicos, que va acompañado de liberación de energía (exergónico) o absorción de energía (endergónico). Al romperse y formarse enlaces químicos, los átomos se reordenan formando sustancias químicas con propiedades y características distintas. Las reacciones químicas pueden ser reversibles o irreversibles, lo que se señala en la ecuación química mediante una flecha. Reactantes y Productos Las sustancias iniciales, y que experimentan el cambio químico, se denominan reactantes. Las sustancias químicas nuevas y finales y, por tanto, resultantes del cambio químico, se conocen como productos. La ecuación química es la representación gráfica de la reacción química, donde se señalan las sustancias participantes del cambio, es decir, reactantes y productos. A veces también se especifica el cambio energético asociado. El cambio químico Ocurre un cambio químico cuando una o más sustancias se transforman para dar origen a otras sustancias diferentes. El cambio químico puede ser reversible o irreversible y está siempre acompañado de un cambio de energía. ¿Qué sucede en un cambio químico? Cuando ocurre un cambio químico, los enlaces de los átomos y moléculas reactantes se rompen y se crean nuevos enlaces, de manera que los átomos se reordenan, formando nuevas moléculas. Manifestaciones de una reacción química: En una reacción química ocurren uno o varios de los siguientes eventos: • Emisión de gases. • Efervescencia. • Cambio de color. • Emisión de luz. • Elevación de la temperatura 2 CLASIFICACIÓN DE LAS REACCIONES QUÍMICAS a. SEGÚN SU NATURALEZA b. SEGÚN LA ENERGÍA ASOCIADA 3 ACTIVIDAD 1 Identificar la clase de reacción: a) b) c) d) e) S + O2 2 HgO CaCO3 Zn + H2SO4 BaCl2 + H2SO4 SO2 2 Hg + O2 CaO + CO2 H2 + ZnSO4 BaSO4 + 2HCl ECUACIÓN QUÍMICA La ecuación química es la representación en forma corta y precisa de un cambio o reacción química. Características de una ecuación 1. Una ecuación química debe indicar el estado físico de los reactivos y de los productos. Para ello se usan los siguientes símbolos: (g) para representar el estado gaseoso. (l) para representar el estado líquido. (s) para representar el estado sólido. (ac) para representar disolución acuosa. Usualmente estos símbolos se omiten y se usan cuando son estrictamente necesarios. 2. En la ecuación deben indicarse los catalizadores, que son sustancias que aceleran o disminuyen la velocidad de una reacción. 3. En toda reacción química hay absorción o desprendimiento de energía, fenómenos que deben indicarse en la ecuación. 4. La ecuación química debe estar balanceada: los mismos átomos de cada elemento han de figurar en el primer miembro. 5. En una ecuación química cada fórmula representa, no una molécula sino un número fijo de ellas que es el número de Avogadro. COEFICIENTES Y NÚMERO DE ÁTOMOS 4 IMPORTANCIA DE LAS REACCIONES QUÍMICAS EN LA NATURALEZA Y LA SOCIEDAD Las reacciones químicas están presentes en todos los ámbitos de la naturaleza. No olvidemos que todo cuerpo, vivo o inerte, está formado por sustancias, las cuales a su vez están compuestas de moléculas o redes cristalinas. Entre las sustancias se dan constantemente reacciones químicas. Por ejemplo: - Fenómenos de oxidación y corrosión. Combustiones. - Acción química del agua: Acción sobre roca caliza También en los seres vivos están presentes las reacciones químicas. La existencia de todo organismo vivo está basada en las reacciones que se producen entre sustancias del propio organismo y/o sustancias del exterior. Detrás de cualquier acto de un ser vivo, hay una o múltiples reacciones químicas. Por poner algunos ejemplos: - Fotosíntesis de las plantas: elaboración de materia orgánica a partir de inorgánica. - Metabolismo de los alimentos: todos los procesos digestivos se basan en reacciones. - Recepción de estímulos: la visión, el olfato, el oído, la respuesta al calor, o al dolor, se deben a impulsos nerviosos. Dichos impulsos se generan a partir de reacciones entre unas sustancias llamadas neurotransmisores. - Crecimiento: Elaboración de proteínas y nuevas células - Mecanismos de defensa a las enfermedades. Inmunidad. - Fermentación y descomposición de materia orgánica, por parte de microorganismos. Importancia en la sociedad: El desarrollo de la civilización va muy unido al descubrimiento y aprovechamiento de las reacciones químicas por parte del género humano. De hecho, la tecnología tuvo un importante desarrollo a partir de la mitad del s XIX, cuando se establecieron las bases de la química moderna. Como muestra: - Obtención de energía: Combustiones, Reacciones ácido-metal: producción de corriente eléctrica. - Metalurgia: obtención de metales a partir de minerales. - Tratamiento del petróleo y sus derivados: Combustibles Plásticos - Elaboración y conservación de alimentos - Elaboración de medicamentos Inconvenientes: El conocimiento de los procesos que rigen las reacciones químicas ha permitido un importante desarrollo, pero no todos son ventajas. Entre los principales inconvenientes: • Contaminación: En toda reacción química se producen sustancias nuevas. Algunas pueden ser útiles o al menos inofensivas, pero otras (la mayoría) son contaminantes. Si la reacción se produce a gran escala (industrias) esto supone un importante problema. Las principales fuentes de contaminación: - Combustiones: producen gases como el CO2 (si está en exceso es responsable del efecto invernadero), compuestos de azufre y nitrógeno SO2, SO3 y NO2 , (responsables de la lluvia ácida). Los plásticos, al arder, producen estas sustancias. Evidentemente son perjudiciales para la salud (problemas respiratorios, alergias ...). También los compuestos conocidos como CFCs, que destruyen la capa de ozono. - Residuos de cianuro y compuestos de metales pesados (Hg, Pb, etc.): Son productos o reactivos de múltiples procesos industriales y metalúrgicos. Contaminan el agua y dañan seriamente el medio ambiente y la salud de las personas (por ej. los metales pesados, cancerígenos, no los elimina el organismo, y se van acumulando). • Incremento de las diferencias entre países ricos y países empobrecidos • Destrucción de espacios naturales para obtención de materias primas BALANCEO DE ECUACIONES Cuando la reacción química se expresa como ecuación, además de escribir correctamente todas las especies participantes (nomenclatura), se debe ajustar el número de átomos de reactivos y productos, colocando un coeficiente a la izquierda de los reactivos o de los productos. El balanceo de ecuaciones busca igualar el de átomos en ambos lados de la ecuación, para mantener la Ley de Lavoisiere propuesta en 1774 que dice "En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma" Por ejemplo, en la siguiente reacción (síntesis de agua), el número de átomos de oxígenos de reactivos, es mayor al de productos. 5 Para igualar los átomos en ambos lados es necesario colocar coeficientes y de esta forma queda una ecuación balanceada. Para balancear una ecuación química, debemos tener en cuenta los siguientes pasos: a) Conocer los símbolos o las fórmulas de los reactantes y de los productos. b) Reconocer que los subíndices no se pueden modificar c) Tener presente que los coeficientes pueden modificarse y que indican el número de moles presentes en la ecuación. d) Para balancear los elementos químicos que participan en una ecuación química, debemos hacerlo en el siguiente orden: primero, los metales; luego, los no metales; después el hidrógeno y, por último, el oxígeno. BALANCEO DE ECUACIONES POR EL MÉTODO DE TANTEO El método de tanteo consiste en observar que en cada miembro de la ecuación se tengan los átomos en la misma cantidad, recordando que en: 2SO4 hay 2 Hidrógenos 1 Azufre y 4 Oxígenos 2SO4 hay 10 Hidrógenos, 5 azufres y 20 Oxígenos Para equilibrar ecuaciones, solo se agregan coeficientes a las fórmulas que lo necesiten, pero no se cambian los subíndices. Ejemplo: Balancear la siguiente ecuación H2O + N2O5 HNO3 2O). Para ello, con solo agregar un 2 al HNO3 queda balanceado el Hidrogeno. H2O + N2O5 2 HNO3 2O5) y dos Nitrógenos en el segundo miembro (2 NHO3) agua (H2O) y 5 Oxígenos en el anhídrido nítrico (N2O5) nos dan un total de seis Oxígenos. Igual que (2 NHO3) Otros ejemplos: Sin balancear HCl + Zn - ZnCl2 + H2 6 Balanceado 2HCl + Zn ---ZnCl2 + H2 Sin balancear Balanceado KClO3 ---- KCl + O2 2 KClO3 -- 2KCl + 3O2 ACTIVIDAD 2 1. 2. 3. 4. ¿Qué relación existe entre las ecuaciones y las reacciones químicas? ¿Cuál es la función de los coeficientes de una ecuación química? ¿Qué significa balancear una ecuación química? Balancear las siguientes ecuaciones: o Mg3 N2 + H2O Mg (OH) 2 + NH3 o Ba Cl2 + (NH4) 2 CO3 Ba CO3 + NH4 Cl o Al (OH) 3 + HCl AlCl3 + H2O o Na + H2O Na OH + H2 o Mg + O2 Mg O BALANCEO DE ECUACIONES POR EL MÉTODO DE OXIDO-REDUCCIÓN (REDOX) Para utilizar éste método es necesario tener en cuenta que sustancia gana electrones y cual los pierde, además se requiere manejar los términos que aparecen en la siguiente tabla: BALANCEO DE ECUACIONES CAMBIO EN ELECTRONES CAMBIO DE NÚMERO DE OXIDACIÓN Oxidación Perdida Aumento Reducción Ganancia Disminución Agente oxidante ( sustancia que se reduce) Gana Disminuye Agente reductor ( sustancia que se oxida) Pierde Aumenta 7 REACCIONES DE OXIDACIÓN – REDUCCIÓN Son reacciones en las que el estado de oxidación de por los menos dos de los elementos en los reactivos y en los productos cambia (aumenta o disminuye), porque se produce una transferencia de electrones de una especie a otra, es decir, uno de los reactantes libera electrones y éstos son tomados por otro de los reactantes. Estas reacciones son conocidas con el nombre de reacciones de oxidación-reducción, óxido-reducción o simplemente redox. Ejemplo: Esta, es una reacción de óxido-reducción porque el estado de oxidación del nitrógeno cambia de +5 a +2 y el estado de oxidación del azufre cambia de -2 a 0 (cero). Esta reacción no es de óxido-reducción porque ninguno de los elementos ha sufrido cambio en el estado de oxidación, por lo tanto, corresponde a una reacción sin transferencia de electrones. La oxidación, es el proceso mediante el cual una especie química libera, pierde o dona electrones, produciendo un aumento en su número de oxidación. La reducción, es el proceso inverso a la oxidación, en el cual una especie química acepta, gana o toma electrones, produciéndose una disminución en el número de oxidación. En toda reacción de óxido-reducción se suceden los dos procesos simultáneamente, porque si hay una especie que libere electrones tiene que haber otra especie que los acepte. Veamos, en el ejemplo 2 ocurre lo siguiente: Método de Oxido-Reducción. En una reacción química, el total de electrones participantes permanece constante. Es decir, en toda reacción REDOX se cumple que: Ejemplo 1: Balancea por óxido-reducción la ecuación: Fe2O3 + CO → Fe + CO2 8 Los pasos a seguir en la solución de este tipo de ejercicios, en su orden, son los siguientes: Primer paso: determinar y asignar el número de oxidación a cada átomo y escribirlo encima del respectivo símbolo. Segundo paso: determinar cuáles átomos cambian su estado de oxidación al pasar de reactivos a productos. Fe: de +3 (reactivo) → 0 (producto) El átomo de Fe toma 3 electrones C: de +2 (reactivo) → +4 (producto) El átomo de C dona 2 electrones Tercer paso: calcular el cambio de electrones por cada átomo y por todos los átomos de la molécula. Estos cambios se simbolizan con fleches: hacia el elemento, cuando los electrones son tomados (recibidos, ganados, aceptados) y hacia afuera del elemento cuando son cedidos (regalados, donados, perdidos). Cada átomo de hierro tomó 3 electrones (su número de oxidación disminuyó de +3 en los reactivos a cero en los productos), como la molécula de Fe2O3 contiene 2 átomos de Fe, entonces la molécula toma 6 electrones en total. Cada átomo de carbono cedió 2 electrones (su número de oxidación aumentó de +2 en los reactivos a +4 en los productos), como la molécula de CO contiene 1 solo átomo en total la molécula cede 2 electrones. Cuarto paso: multiplicar los dígitos así encontrados (6 y 2, que representan el cambio de electrones por molécula), por factores tales que se cumpla que, el número de electrones cedidos sea igual al número de electrones ganados. Generalmente se acostumbra tomar como factores de multiplicación los mismos números calculados y se multiplican en cruz. Los factores de multiplicación son (2) y (6), con lo cual se consigue que 6 x (2) = 12 electrones tomados 2 x (6) = 12 electrones donados: (# de e⁻ tomados es = al # de e⁻ donados) Los factores de multiplicación son (2) y (6), con los cuales conseguimos que: 6 x (2) = 12 electrones tomados y 2 x (6) = 12 electrones donados 12 electrones donados = 12 de electrones tomados Quinto paso: asignar como coeficientes, de las moléculas afectadas, los factores de multiplicación utilizados en el paso anterior. 2Fe2O3 + 6CO → Fe + CO2 Sexto paso: terminar el balanceo por tanteo: 2Fe2O3 + 6CO → 4Fe + 6CO2 9 Séptimo paso: simplificar todos los coeficientes, si es posible: Fe2O3 + 3CO → 2Fe + 3CO2 Paso 4: Si procedemos como en el ejemplo anterior y utilizamos 15 y 3 como factores de multiplicación, y los multiplicamos en cruz quedaría 3 como coeficiente del FeS2 y 3/2 como coeficiente del Fe2(SO4)3, para ajustar el hierro (3 átomos). Para evitar la confusión que ocasiona el trabajo con fraccionarios es aconsejable amplificar los factores determinados, en este caso por 2, para obtener nuevos factores: 3 x 2 = 6 y 15 x2 = 30, que se convierten ahora en. 6 y 30 son ahora los nuevos factores y serán estos los utilizados como coeficientes de las moléculas afectadas. Si se balancea la ecuación empezando por los reactivos como en los ejemplos 1 y 2, el coeficiente que se le asigne al HCl, habría que distribuirlo entre el KCl, el MnCl2 y el Cl2, para poder ajustar así el cloro. El coeficiente del KMnO 4 fijaría el coeficiente del KCl, para balancear potasio, y el coeficiente del MnCl2, para balancear manganeso. Para obviar todos estos inconvenientes se recomienda iniciar el balanceo por los productos: 10 electrones donados = 10 de electrones tomados HCl + KMnO4 16HCl + 2KMnO4 → KCl + 2MnCl2 + 5Cl2 + H2O → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (no es simplificable) 10 ACTIVIDAD 3 1. Cómo se puede definir la reacción de óxido-reducción 2. Define cada uno de los siguientes términos: a) Oxidación b) Reducción c) Agente oxidante d) Agente reductor e) Sustancia oxidada f) Sustancia reducida 3. Equilibra las siguientes ecuaciones de óxido- reducción: a) b) c) d) e) Cr2O3 + KNO3 + Na2CO3 → Na2CrO4 + KNO2 + CO2 HNO3 + H2S → NO + S + H2O MnO2 + HCl → MnCl2 + H2O Cl2 KMnO4 + H2SO4 + H2O2 → MnSO4 + O2 + K2SO4 + H2O HNO3 + P + H2O → H3PO4 + NO 4. Visita las siguientes páginas y desarrolla los ejercicios propuestos http://www.iesaguilarycano.com/dpto/fyq/ajuste.html http://www.lamanzanadenewton.com/materiales/aplicaciones/lrq/lrq_index.html http://www.juntadeandalucia.es/averroes/recursos_informaticos/proyectos2003/quimica/quim_ino.html 11