Sistemas y conversión de unidades
Anuncio

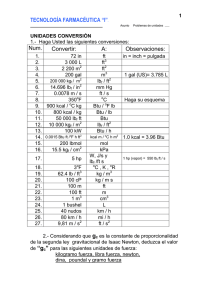
CAPÍTULO 1 Sistemas y Conversión de Unidades Objetivo El alumno, al estudiar este capítulo, conocerá los diferentes sistemas de unidades, con lo cual podrá convertir todo valor de estas unidades de un sistema a otro. Sistemas de Unidades Para realizar mediciones se utilizan unidades, las que a su vez pertenecen a un sistema de unidades. Los sistemas de unidades se dividen en: Sistema Ingenieril, Sistema Absoluto y Sistema Gravitacional. Sistema Ingenieril Se divide en: Sistema Métrico: Unidad de masa: kilogramo−masa, M[kgm] Unidad de longitud: Metro, L[m] Unidad de tiempo: Segundo, [Seg,s] Unidad de fuerza: kilogramo−fuerza, F[kgf] Aceleración de la gravedad: Sistema Inglés: Unidad de masa: libra−masa, M[lbm] Unidad de longitud: Pie, L[pie,ft] Unidad de tiempo: Segundo, [Seg,s] Unidad de fuerza: Libra−fuerza, F[lbf] 1 Aceleración de la gravedad: Sistema Absoluto Se divide en: Sistema Métrico Absoluto, C.G.S.: Unidad de masa: Gramo, M[gr] Unidad de longitud: Centímetro, L[cm] Unidad de tiempo: Segundo, [Seg,s] Unidad de fuerza: Dina, F[dina]; 1 dina = Aceleración de la gravedad: Sistema Métrico Absoluto, M.K.S.: Unidad de masa: Kilogramo, M[kg] Unidad de longitud: Metro, L[m] Unidad de tiempo: Segundo, [Seg,s] Unidad de fuerza: Newton, F[Nw]; 1 Nw = Sistema Inglés Absoluto: Unidad de masa: Libra−masa, M[lbm] Unidad de longitud: Pie, L[pie] Unidad de tiempo: Segundo, [Seg,s] Unidad de fuerza: Poundal, F[Poundal]; 1 Poundal = Sistema Gravitacional Se divide en: 2 Gravitacional Métrico: Unidad de masa: Unidad Técnica, M[Unidad Técnica] Unidad de longitud: Metro, L[m] Unidad de tiempo: Segundo, [Seg,s] Unidad de fuerza: Kilogramo−fuerza, F[Kgf]; 1 Unidad Técnica Aceleración de la gravedad: Gravitacional Inglés: Unidad de masa: Slug, M[Slug] Unidad de longitud: Pie, L[pie] Unidad de tiempo: Segundo, [Seg,s] Unidad de fuerza: Libra−fuerza, F[lbf]; 1 Slug = Aceleración de la gravedad: Conversión de Unidades Cuando se trabaja en la resolución de problemas, frecuentemente surge la necesidad de convertir valores numéricos de un sistema de unidades a otro. Estas conversiones se facilitan con el conocimiento de los diferentes sistemas de unidades y cuando se dispone de todos los factores de conversión de una unidad a otra. El Apéndice 1.1 presenta estos factores de conversión según la variable considerada. La destreza aritmética o algebraica, es indispensable para obtener resultados numéricos correctos en los cálculos. Procedimientos metodológicos para la resolución de problemas de conversión de unidades La manera más simple, que se propone en este libro, para la resolución de problemas de conversión de unidades es multiplicar el valor dado (VD) por los respectivos factores o relaciones de conversión (FC) hasta obtener el valor buscado (VB) en las unidades deseadas. Este procedimiento se resume en la siguiente expresión: VB = VD x FC Problemas resueltos 3 Problema 1.1. La constante universal R de los gases ideales tiene un valor de . Convertir este valor a . Planteamiento: El problema consiste en hallar el nuevo valor de R por el cambio de sus unidades. Procedimiento: Aplicar la expresión VB = VD x FC utilizando los siguientes factores de conversión del Apéndice 1.1. 1 atm.lt = 24,2 Cal 1 BTU = 252 Cal 1 lbmol = 454 gmol 1 °K = (9/5)°R = 1,8 °R (una variación de grados en la escala Kelvin es igual a 1,8 variaciones de grados en la escala Rankin). Cálculos: Resultado: El valor de R en es 1,986 Problema 1.2. La capacidad calorífica se define como la cantidad de calor necesaria para incrementar la temperatura de un cuerpo un grado. Para el amoníaco líquido, , a una temperatura de −40°C esta tiene un valor de . Se desea convertir este valor en unidades de . Planteamiento: Se debe determinar el nuevo valor de cambiando sus unidades. Procedimiento: Se aplica la expresión VB = VD x FC y se utilizan los siguientes factores de conversión del Apéndice 1.1. 1 BTU = 252 Cal 1 lb = 454 gr 1 °F = (5/9)°C = 1/1,8 °C (una variación de grados en la escala Fahrenheit es igual a 5/9 variaciones de grados en la escala Centígrada ó Celsius). 4 Cálculos: Resultado: El valor de en es 1,050, igual al valor en Problema 1.3. ¿Qué volumen en cc, ocupan 125 gr de etanol líquido a 20°C.? Dato: La densidad del etanol a 20°C es 0,789 gr/cc. Planteamiento: El problema plantea calcular el volumen en centímetros cúbicos (cc) del etanol líquido, a partir de una masa de 125 gr de la sustancia a una temperatura de 20°C y con el dato de densidad a esa temperatura. Procedimiento: Se aplica la expresión VB = VD x FC y el dato de densidad. Cálculos: Resultado: 125gr de etanol líquido a 20°C ocupan un volumen de 158,43 cc. La operación en el cálculo, es equivalente al despeje de la variable volumen (V) hecha de la fórmula de la Densidad (D) de una sustancia. Esto es: donde m es la masa de la sustancia. Problema 1.4. Expresar un flujo de líquido (Q) de 60 en . Planteamiento: 5 Se desea determinar el flujo de líquido Q en las nuevas unidades. Procedimiento: Se aplica la expresión VB = VD x FC y se utilizan los siguientes factores de conversión del Apéndice 1.1. 1 m3 = 1000 lts 1 lt = 61,03 pie3 1 hr = 3600 seg Cálculos: Resultado: El valor de en es 1017 Problema 1.5. La cantidad requerida de calor para variar la temperatura de un cuerpo sólido de a viene dada por la ecuación: en donde: cantidad de calor en Kcal masa del cuerpo en kg capacidad calorífica a presión constante en y = temperaturas inicial y final en °C. Cuantas kilocalorías se requieren para calentar 5 kg de un determinado sólido desde 20°C hasta 100°C. El valor de 6 es igual a 0,75 . Planteamiento: El problema plantea, determinar las kilocalorías requeridas para calentar el sólido cuando la temperatura pasa de 20°C a 100°C. Procedimiento: El procedimiento consiste en aplicar la ecuación dada de , utilizando los valores de y . Cálculo: Resultado: Se requieren 300 kcal. para calentar la masa dada del sólido. Si se desea expresar esta cantidad de calor en otras unidades, por ejemplo en BTU o en cal., se procede igual que en los problemas anteriores, aplicando la ecuación y utilizando los factores de conversión respectivos del Apéndice 1.1. Problemas Propuestos Problema 1.6. Expresar las siguientes unidades de peso en gramos y en miligramos: a) 0,020 kg b) 50 dg c) cg Problema 1.7. Expresar en litros los siguientes volúmenes: a) 10 m3 b) 5,9 dm3 c) 20 ml Problema 1.8. Realizar las siguientes conversiones de temperatura: a) 120 °C a °K b) 375 °F a °C c) 279 °R a °F Problema 1.9. 7 Expresar en atmósferas y milímetros de mercurio una presión de trabajo de 35 (psi). Problema 1.10. Expresar en kilovatio−hora (Kw−h) y en BTU una cantidad de calor de 550 calorías (cal). Problema 1.11. Las especificaciones técnicas de un equipo de bombeo, indican que este tiene una potencia de 3 kilovatios (Kw). Expresar esta potencia en caballos de vapor (HP) y en vatios o watt. Problema 1.12. La viscosidad dinámica de un determinado líquido es de 1,5 . Expresar esta viscosidad en poise. APÉNDICE 1.1. Factores de Conversión de Unidades Longitud (L) 1 Pulgada (in) = 2,540 cm = 25,40 mm 1 Pie (ft) = 12 pulg. = 30,48 cm = 0,3048 m 1 Yarda (yd) = 3 pies 1 mm = 0,03937 pulg = 0,00328 pies 1 micra (mi) = 10−6 m 1 Angstrom = 10−10 m Masa (m) 1 Kilogramo (kg) = 2,205 lb (anglosajonas) 1 Libra (lb), (anglosajona) = 16 onzas (oz) = 453,6 gramos (gr) = 7000 granos 1 Tonelada (Ton), (corta o americana) = 2000 lb (anglosajona) 1 Tonelada (Ton), (larga, bruta o inglesa) = 2240 lb (anglosajona) 8 1 Tonelada Métrica (Ton) = 1000 kg = 2204,6 lb (anglosajona) 1 Kilogramo (kg) = 2,2046 lb (anglosajona) 1 Gramo (gr) = 15,43 granos Densidad (D) 1 lb/pulg3 = 27,38 gr/cm3 1 gr/cm3 = 0,03613 lb/pulg3 1 lb/pie3 = 16,0184 kg/m3 1 kg/m3 = 0,06243 lb/pie3 Volumen (V) 1 pulg3 = 16,39 cm3 1 litro = 61,03 pie3 = 1000,028 cm3 1 pie3 = 28,32 litros = 7,481 Gal (americano) 1 m3 = 1,308 yd3 = 1000 litros 1 Galón (Gal), (americano) = 4 cuartos o cuartillos = 3,785 litros = 231 pulg3 1 Galón (Gal), (británico) = 277,42 pulg3 = 1,20094 Gal (americano) Presión (P) 1 lb por pulg2 (psi) = 2,036 pulg de Hg (0°C) = 2,311 pies de agua (70°F) 1 atmósfera (atm) = 14,396 psi = 760 mm de Hg (0°C) = 29,921 pulg de Hg (0°C) 1 atmósfera (atm) = 1,033 kg f/cm2 = 1,01325x106 dinas/cm2 1 micra de Hg = 1x10−3 mm de Hg = 1,933x10−5 lbf/pulg2 Equivalentes de Temperatura (T, T) Grados Fahrenheit (°F) = 1,8 grados centígrados (°C) + 32 Grados Kelvin (°K) = grados centígrados (°C) + 273,16 Grados Rankine (°R) = grados fahrenheit (°F) + 459,69 Grados Rankine (°R) = 1,8 grados Kelvin (°K) 9 °C = °K = variación de temperatura °F = (5/9) °C t = temperatura no absoluta. °R = (5/9) °R T = temperatura absoluta °F = °R Potencia (P) 1 kilovatio (Kw) = 102 kgf−m/s = 44240 lbf−pie/min 1 kilovatio (Kw) = 56,87 BTU/min = 1,341 HP 1 caballo de vapor (HP) = 550 lbf−pie/s = 76,04 kgf−m/s = 33000 lbf−pie/min 1 caballo de vapor (HP) = 42,417 BTU/min = 2 545 BTU/hora. 1 vatio o watt = 44,25 lbf−pie/min = cal/min = 1,341x10−3 HP Calor (Q) 1 BTU = 252 cal = 1,0544x103 joule = 778,26 lbf−pie 1 atm − litro = 24,2 calorías (cal) 1 kilowatio−hora (kw−h) = 860 Kcal = 3412 BTU = 3,67x105 kgf−m 1 HP−h = 641,1 kcal = 2545 BTU = 2,74x105 kgf−m Equivalente Mecánico del calor (J) = 778 lbf−pie/BTU = 426,8 kgf−m/kcal = 4,186 Joule/cal Fuerza (F) 1 libra−fuerza (lbf) = 4,4482 Newton (Nw) 1 Newton (Nw) = 1 Dina = Energía Mecánica (Em) 10 1 Joul = 107 Ergios (erg) = 1 watt−seg 1 Electron−Voltio (ev) = 1,608x10−12 erg = 1,18x10−19 lbf−pie Viscosidad ( ) a) Viscosidad Dinámica o Absoluta 1 Poise = centipoise 1 Poise 1 Poise b) Viscosidad Cinemática 1 Stoke = 1 100 centistokes 1 Stokes Constantes Matemáticas Base de los logaritmos naturales (e) = 2,7183 2,72 Pi ( ) = 3,141592 3,1416 Logaritmo Natural de N = LnN Logaritmo Vulgar de N (Base 10) = LogN LnN = 2,303.LogN Constantes Físicas Constante R de la ecuación de los gases: Valor Numérico: Unidades 1,987 Cal/gmol.°K 11 1,987 BTU/lbmol.°R 82,06 cm3.atm/gmol.°R 0,08205 litros.atm/gmol.°K 10,731 pie3.psi/lbmol.°R 0,7302 pie3.atm/lbmol.°R 8,314 m3.Pa/gmol.°K 8,314 Joul/gmol.°K 847,7 kgf.m/kgmol.°K 1545 lbf.pie/lbmol.°R 1 Pascal (Pa) = Nw/m2 1 Faraday = 96493,1 coulombio absoluto/equivalente−gramo 12