to get the file
Anuncio

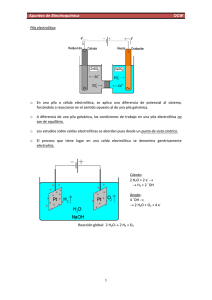
TEMA 8 EQUILIBRIO REDOX ÍNDICE 1. Reacciones oxidación – reducción 2. Número de oxidación 3. Ajuste de reacciones redox 4. Pila galvánica 4.1. Potenciales estándar de electrodo 5. Ecuación de Nernst 6. Espontaneidad y equilibrio 7. Electrolisis 7.1. Leyes de Faraday 1. Reacciones oxidación-reducción Las reacciones que implican transferencia de electrones entre dos especies se denominan reacciones de oxidación-reducción o redox. REDUCCIÓN: Ganancia electrónica y disminución del estado de oxidación • OXIDANTE: Sustancia que capta electrones y se reduce. oxidante1 + n1e- reductor1 OXIDACIÓN: Pérdida de electrones y aumento del estado de oxidación • REDUCTOR: Sustancia que pierde electrones y se oxida. reductor2 – n2e- oxidante2 Reacción de Oxidación-reducción: R. Reducción R. Oxidación n2 (oxidante1 + n1e- reductor1) n1 (reductor2 – n2e- oxidante2) n2 oxidante1 + n1 reductor2 n2 reductor1 + n1 oxidante2 1. Reacciones oxidación-reducción Ejemplo: R. de oxidación Zn(s) R. de reducción Zn2+ (ac) + 2e- 2H+ (ac) + 2e- H2(g) Zn(s) + 2H+ (ac) H2(g) + Zn2+ (ac) reductor + oxidante Zn(s) + 2H+ (ac) H2(g) + Zn2+ (ac) Número de oxidación 0 +1 0 +2 Las dos semirreacciones tienen lugar de forma simultánea, sin que haya cambio neto en el número de electrones. Los electrones perdidos por una especie son ganados por la otra. 2. Número de oxidación El número de oxidación corresponde a un formalismo mediante el que se asigna una carga a cada átomo en un compuesto. Reglas para su asignación: 1. El número de oxidación de todos los elementos puros en cualquier forma alotrópica es 0. 2. El número de oxidación del oxígeno es –2 en todos sus compuestos, excepto cuando se combina con el F que es +2, en los peróxidos que es –1 y en los superóxidos que es -1/2. 3. El número de oxidación del hidrógeno es +1 en todos sus compuestos, excepto en los que forma con metales que es –1. 4. Los restantes números de oxidación se calculan de forma que la suma algebraica de los números de oxidación sea igual cero (molécula) o a la carga neta del ión. Ejemplo: Cálculo del número de oxidación del Cl en el ClONúmero de oxidación de O: -2 Número de oxidación del O + número de oxidación del Cl = -1 -2 + número de oxidación del Cl = -1 Número de oxidación del Cl = -1+2 = +1 3. Ajuste de reacciones redox. Método ion-electrón. Reglas La reacción se divide en dos semirreacciones que nos muestran cómo el agente oxidante pasa a su forma reducida y el agente reductor pasa a su forma oxidada. Si empezamos por el oxidante se escribe su fórmula (como ion si actúa en esta forma) y separado por una flecha la fórmula de su producto de reducción (iónico o molecular). Se ajusta atómicamente, introduciendo los coeficientes mínimos necesarios para que el número de átomos del oxidante sea el mismo a ambos lados de la semirreacción. Los átomos de oxígeno se ajustan añadiendo moléculas de H2O (en disolución ácida) y OH- (en disolución básica) en el término de la semirreacción donde falten átomos de oxígeno. Los átomos de H se ajustan con H+ (en disolución ácida) y H2O (en disolución básica) en el término de la semirreacción donde falten. Seguidamente es necesario igualarla eléctricamente, para ello se añaden al primer miembro los e- necesarios para que la carga eléctrica en los dos miembros sea la misma. Se repiten estos mismos procesos para igualar la semirreacción de oxidación del reductor. Se multiplican las dos semirreacciones por los coeficientes más pequeños necesarios para que el nº de electrones ganados en el proceso de reducción sea igual al número de electrones perdidos en el de oxidación. Se suman las dos semirreacciones cancelándose los electrones y obteniéndose la ecuación iónica neta ajustada. Finalmente, sólo queda obtener la reacción con las fórmulas completas. 3. Ajuste de reacciones redox. Fe2+(ac) + MnO4-(ac) 1) Fe3+(ac) + Mn2+(ac) (en disolución ácida) Dividir la ecuación en dos semirreacciones: Oxidación: Fe2+(ac) Fe3+(ac) Reducción: 2) MnO4-(ac) Se ajusta la primera semirreacción: Fe2+(ac) 3) - e- Fe3+(ac) Se ajusta la segunda semirreacción: MnO4-(ac) + 8 H+(ac) + 5e- 4) Mn2+(ac) Mn2+(ac) + 4H2O(l) Se multiplica la primera por cinco y se suman ambas: 5 (Fe2+(ac) - e- Fe3+(ac) ) MnO4-(ac) + 8 H+(ac) + 5e- Mn2+(ac) + 4H2O(l) MnO4-(ac) + 8 H+(ac) + 5 Fe2+(ac) Mn2+(ac) + 4H2O(l) + 5 Fe3+(ac) 3. Ajuste de reacciones redox. Cl2(g) + Cr(OH)3(s) + NaOH(ac) Cl-(ac) + CrO42-(ac) (en disolución básica) 1) Dividir la ecuación en dos semirreacciones : Reducción: Cl2(g) Cl-(ac) Oxidación: Cr3+(s) CrO42-(ac) 2) Se ajusta la primera semirreacciones : Cl2 (g) 3) + 2e- 2Cl- (ac) Se ajusta la segunda semirreacciones : Cr3+ (s) + 8OH- (ac) - 3e- CrO42- (ac) + 4H2O(l) 4) Se multiplica la primera por tres, la segunda por dos y se suman ambas: 3 ( Cl2 (g) + 2e- 2Cl-(ac) ) 2 (Cr3+ (s) + 8OH- (ac) - 3e- CrO42- (ac) + 4H2O(l)) 3Cl2 (g) + 2Cr3+(s) + 16 OH-(ac) 2CrO42- (ac) + 6Cl-(ac) + 8H2O(l) 3Cl2 (g) + 2Cr(OH)3(s) + 10 NaOH(ac) 2Na2CrO4 (ac) + 6NaCl(ac) + 8H2O(l) 4. Pila Galvánica Reacción redox espontánea Zn(s) +Cu2+ (ac) Zn2+ (ac) + Cu(s) Zn (s) - 2e- Zn2+ (ac) Cu2+ (ac) + 2e- Cu (s) Zn(s)|Zn2+(ac) (1M) || Cu2+(ac) (1M)| Cu(s) Esquema de la pila: Ánodo Oxidación Izquierda Puente salino Cátodo Reducción Derecha 4.1 Potenciales estándar de electrodo Para conocer el potencial estándar de un electrodo, Eº, se toma como referencia, el potencial estándar del electrodo de Hidrógeno (EEH), asignándole el valor de 0,0V. 2 H+ (1M) + 2 e- H2(g, 1 atm) E° = 0,0 V El potencial estándar de reducción, Eº, se refiere al potencial de reducción de un electrodo cuando las especies iónicas tienen concentración 1M y los gases P = 1atm. Dicho potencial se calcula construyendo una pila con el electrodo y el EEH. El potencial estándar de una pila, ΔEopila es la diferencia de potenciales de reducción entre el cátodo y el ánodo + - O2 + 2 H + 2 e H2 O 2 + 0,68 3+ 2+ Fe + e Fe + 0,77 + Ag + e Ag + 0,80 + No3 + 2 H + e NO2 + H2O + 0,80 + NO3 + 4 H + 3 e NO + 2 H2O + 0,96 Br (l) + 2 e 2 Br + 1,06 2 Tabla 1: Potenciales estándar de reducción + 2 IO3 + 12 H + 10 e I2 + 6 H2O + 1,20 + 2+ Reacción de electrodo Eº (voltios) MnO2 + 4 H + 2 e Mn + 2 H2O + 1,21 Li + e Li - 3,05 + K +e K - 2,92 O2 + 4 H + 4 e 2 H2O + 1,23 Ba + 2 e Ba - 2,90 2+ 3+ Cr O + 14 H + 6 e 2 Cr + 7 H O + 1,33 Ca + 2 e Ca - 2,76 2 7 2 Na + e Na - 2,71 Cl2 + 2 e 2 Cl + 1,36 La + 3 e La - 2,37 + Mg + 2 e Mg - 2,37 ClO + 6 H + 6 e Cl + 3 H O + 1,45 3 2 H +2e 2H - 2,23 + Al + 3 e Al - 1,67 ClO + 2 H + 2 e Cl + H2O + 1,49 Mn + 2 e Mn - 1,03 + 2+ MnO4 + 8 H + 5 e Mn + 4 H2O + 1,49 2H O+2e H (g) + 2 OH - 0,83 Zn + 2 e Zn - 0,76 2+ Pt + 2 e Pt + 1,60 Fe + 2 e Fe - 0,41 + Cr + e Cr - 0,41 2 ClO + 4 H + 2 e Cl2 + 2 H2O + 1,63 Cd + 2 e Cd - 0,40 + SO Pb + 2 e SO + Pb - 0,36 Au + e Au + 1,68 Ni + 2 e Ni - 0,23 + Sn + 2 e Sn - 0,14 MnO4 + 4 H + 3 e MnO + 2 H O + 1,68 2 2 Pb + 2 e Pb - 0,13 + 2 PbO2 + 4 H + SO4 + 2 e PbSO4 + 2 H2O + 1,69 2H +2e H 0,00 + H2O2 + 2 H + 2 ede 2 H2es O el más oxidante + 1,78 Cu + e Cu + 0,16 • El electrodo flúor 2+ + SO + 4 H + 2 e H SO + H O +0,20 Ag + e Ag + 1,99 Bi + 3 e Bi + 0,29 (mayor tendencia a reducirse). Cu + 2 e Cu + 0,34 F2 + 2 e 2F + 2,87 O +2H O+4e 4 OH + 0,40 4.1 Potenciales estándar de electrodo + - + - 2+ - 2+ - + - 3+ - 2+ - 2 3+ - 2+ - - - 2 2+ - 2 - 2+ - 3+ 2+ - 2+ - 4 2+ - 2+ - 2+ - + 2- 4 - 2 2+ 2- + 4 - + - 3+ - 2+ - 2 - 2 2 + - Cu + e I2 + 2 e MnO4 + e + O2 + 2 H + 2 e 3+ Fe + e + Ag + e + No3 + 2 H + e + NO3 + 4 H + 3 e Br2 (l) + 2 e + 2 IO3 + 12 H + 10 e + MnO2 + 4 H + 2 e + O2 + 4 H + 4 e 2+ Cr2O7 + 14 H + 6 e Cl2 + 2 e + ClO3 + 6 H + 6 e + ClO + 2 H + 2 e + MnO4 + 8 H + 5 e 2+ Pt + 2 e + 2 ClO + 4 H + 2 e + Au + e + MnO4 + 4 H + 3 e + 2PbO2 + 4 H + SO4 + 2 e + H2 O 2 + 2 H + 2 e 2+ Ag + e F2 + 2 e 3 2 - Cu 2I 2MnO4 H2 O 2 2+ Fe Ag NO2 + H2O NO + 2 H2O 2 Br I2 + 6 H2O 2+ Mn + 2 H2O 2 H2O 3+ 2 Cr + 7 H2O 2 Cl Cl + 3 H2O Cl + H2O 2+ Mn + 4 H2O Pt Cl2 + 2 H2O Au MnO2 + 2 H2O PbSO4 + 2 H2O 2 H2O + Ag 2F + 0,52 + 0,54 + 0,56 + 0,68 + 0,77 + 0,80 + 0,80 + 0,96 + 1,06 + 1,20 + 1,21 + 1,23 + 1,33 + 1,36 + 1,45 + 1,49 + 1,49 + 1,60 + 1,63 + 1,68 + 1,68 + 1,69 + 1,78 + 1,99 + 2,87 • El electrodo de litio es el más reductor (mayor tendencia a oxidarse). • El potencial normal de electrodo no cambia aunque se modifiquen los coeficientes estequiométricos de la semirreacción. Cálculo del potencial de una pila ¿Cuál es el potencial estándar de una pila formada por un electrodo de Cd en una disolución 1,0 M de una sal de Cd(II) y un electrodo de Cr en una disolución 1,0 M de una sal de Cr(III)? Cr3+ (ac) + 3e- Cr (s) Eº = -0,74 V Cd2+ (ac) + 2e- Cd (s) Eº = -0,40 V Ánodo (oxidación): Cátodo (reducción): Cr (s) Cr3+ (1 M) + 3 e- 2 e- + Cd2+ (1 M) 2Cr (s) + 3Cd2+ (1 M) ΔEº pila= Eºcátodo - Eºánodo El Cadmio (II), tiene un potencial mayor que el Cromo (III), por lo que se reducirá Cd (s) x2 x3 3Cd (s) + 2Cr3+ (1 M) ΔEº = -0,40 – (-0,74) = 0,34 V 5. Ecuación de Nernst Se aplica cuando reactivos y/o productos no están en condiciones estándar. Sabemos: aA + bB cC + dD • G = Gº + RT ln Q • G = - n F ΔEpila Q = [productos] / [reactivos] Gº = - n F ΔEºpila Sustituyendo obtenemos la Ec. de Nernst: ΔEpila ΔE o pila RT lnQ nF R 8,314 J ·K 1·mol 1 F 96485 J ·V 1·mol 1 T 298 K o E pila E pila 0,0257 ln Q n o E pila E pila 0,0592 log Q n 6. Espontaneidad y equilibrio Cuando ΔEpila > 0 G < 0 y la reacción es espontánea En el equilibrio: G = 0, ΔE = 0 y Q = K G0 = - n F E0pila = - RT ln K Relación entre ΔEº y K: R 8,314 J ·K 1·mol 1 F 96485 J ·V 1·mol 1 T 298 K ΔE°pila = RT nF ln K o E pila 0,0257 V ln K n o E pila 0,0592 V log K n Cálculo del potencial de una pila en condiciones no estándar ¿Cuál es el potencial de la pila: Cr(s)| Cr3+(0,20 M)||Cd2+(1,0 M)|Cd(s)?. Datos: Eº (Cr3+/Cr) = -0,74 V; Eº (Cd2+/Cr) = -0,40 V Ánodo (oxidación): Cátodo (reducción): [ Cr (s) Cr3+ (0,2 M) + 3 e-x] 2 [ 2 e- + Cd2+ (1 M) 2Cr (s) + 3Cd2+ (1 M) ΔEº pila= Cd (s) ] x 3 3Cd (s) + 2Cr3+ (0,2 M) Eºcátodo - Eºánodo = -0,40 – (-0,74) = 0,34 V E pila E o pila 0,0257 0,0257 [Cr 3 ]2 o ln Q E pila ln n 6 [Cd 2 ]3 0,0257 0,22 E pila 0,34 ln 3 0,354 V 6 1 7. Electrolisis Reacción redox no espontánea Zn2+ (ac) + Cu(s) Zn(s) +Cu2+ (ac) 0 0 ΔEpila = E0cátodo - Eánodo 0 0 2+ ΔEpila = EZn2+/Zn – E0Cu /Cu ΔEpila = -0,763 - 0,340 = -1,103V Ánodo (oxidación): Cu(s) → Cu2+(ac) (1 M) + 2e- Cátodo (reducción): Zn2+(ac) (1 M) → Zn(s) + 2e- Zn2+(ac) + Cu(s) → Zn(s) + Cu2+(ac) 7.1 Leyes de Faraday 1832 Michael Faraday enuncia las leyes: 1. La cantidad de sustancia producida por la electrolisis es proporcional a la cantidad de electricidad empleada. 2. Las masas de distintas sustancias liberadas por una misma cantidad de electricidad son directamente proporcionales a sus equivalentes-gramo. “En un proceso electrolítico, 1 Faraday de electricidad reduce y oxida respectivamente, un peso equivalente de cada uno de los agentes oxidantes y reductores”. 1F = 96485 C =1 mol de e- = NAv·Qe- 1 eq g Mm nº de e Aplicación de las Leyes de Faraday Calcule la cantidad de Cu que se deposita al pasar una corriente de 2,5A durante 50min a través de una disolución de una sal de cobre (II). Cu2+(ac) + 2e- Cu(s) 1F= 96485 C deposita 63,5 1 eq g 31,75 g Cu 2 Q = I·t = 2,5A·(50 min·60 s/min) = 75000 C s 1 mol e 1 mol Cu 63,5g Cu m (Cu depositada) 2,5 A (50 min 60 )· · · 2,47g min 96485 C 2 mol e mol masa de Cu depositada = 2,47g