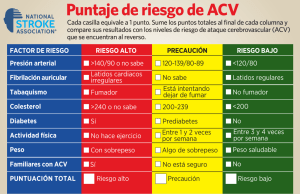
Enfermedad Cerebrovascular
Anuncio

Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Enfermedad Cerebrovascular Profesor Dr. Raúl Carlos Rey Profesor Titular de Neurología. Facultad de Medicina. Universidad de Buenos Aires Jefe de División de Neurología. Hospital Ramos Mejía. Ciudad de Buenos Aires Objetivos • • • • • Conocer los diferentes síndromes de enfermedad cerebrovascular Diagnosticar las lesiones silentes Evaluar los métodos diagnósticos complementarios Establecer la gravedad del daño, el compromiso y el pronóstico del paciente Indicar la terapéutica adecuada Contenidos Introducción ................................................................................................. 2 Epidemiología ............................................................................................... 2 Enfoque del paciente con enfermedad cerebrovascular ........................................... 3 Lesiones silentes en la enfermedad cerebrovascular ............................................... 4 Paciente con stroke ................................................................................................. 4 Ataque isquémico Transitorio ..................................................................................... 6 Infarto cerebral....................................................................................................... 8 Subtipos etiológicos de Stroke isquémico ....................................................................... 9 Arterioesclerosis de grandes arterias .......................................................................... 10 Stroke Isquémico de origen cardioembólico .................................................................. 10 Infartos lacunares ................................................................................................. 11 Otras causas menos frecuentes de stroke isquémico ........................................................ 12 Stroke isquémico de origen indeterminado ................................................................... 13 Hemorragia intracerebral ......................................................................................... 13 Deterioro cognitivo y enfermedad cerebrovascular ............................................... 16 Tratamiento de la enfermedad cerebrovascular ................................................... 17 Conclusiones ............................................................................................... 25 Bibliografía ................................................................................................. 26 Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 2 Introducción La enfermedad cerebrovascular es el resultado de diferentes causas, con un enorme impacto en la salud pública tanto en países desarrollados como en aquellos en vías de serlo. Genera un alto costo en el propio paciente, su familia y el sistema de salud. En occidente es una de las principales causas de discapacidad permanente en los adultos y ocupa el tercer lugar como causa de muerte, siendo la segunda en frecuencia en los mayores de 85 años. Mientras que algunos países del mundo han mostrado una declinación de la mortalidad de causa vascular, la gran mayoría de las muertes ocurren hoy en países con ingresos bajos o medios. El constante aumento de la expectativa de vida permite predecir el progresivo incremento de la frecuencia de este tipo de pacientes. Estos datos constituyen, al decir de algunos, una “amenazadora epidemia que se encuentra hoy sólo en su estadio inicial”. Frente a esta dramática situación, los médicos aún seguimos discutiendo temas secundarios como el de la terminología; en nuestro medio, un término frecuentemente utilizado es el de accidente cerebrovascular, cuyos sinónimos son: ictus, apoplejía, ataque cerebral y stroke. Pensamos que la denominación “accidente cerebrovascular” es incorrecta, pues no nos enfrentamos a un “accidente” o “hecho casual”, sino que el stroke es uno de los “estadios” en la evolución de la “enfermedad cerebrovascular”, existiendo varios estadios que lo preceden; en una historia que habitualmente dura años, el paciente adquiriere primero factores de riesgo para enfermedad vascular, luego lesiones isquémicas silentes y finalmente cuadros clínicos de stroke. Cuando se llega al diagnóstico de stroke, muchas veces ya es tarde, por lo tanto las estrategias terapéuticas deben dirigirse a la prevención de los fenómenos vasculares mediante el control de los factores de riesgo y el tratamiento adecuado del subtipo de enfermedad cerebrovascular. En los últimos años el avance en métodos diagnósticos, la profusión de estudios clínicos y el incremento del conocimiento de la fisiopatología de la enfermedad cerebrovascular han cambiado, en parte, cierto escepticismo que persiste en el tratamiento de la misma. Se ha conseguido disminuir su incidencia en un 10% por año, la tasa de mortalidad en un 50% y las recidivas en un 40% de los casos. En la actualidad disponemos de tratamientos eficaces para el infarto cerebral durante su fase aguda, pero lamentablemente el retraso en la asistencia en las primeras horas del stroke es el elemento de mayor dificultad en el presente, aun en las ciudades con programas bien desarrollados para el manejo de estas enfermedades; sólo menos del 5% de los pacientes accede a terapéuticas que ya han demostrado efectividad para su manejo. El diagnóstico y manejo en las primeras horas de las enfermedades vasculares cerebrales es crítico, y es ahí donde quizás se defina el pronóstico del paciente. Esto ha llevado al desarrollo de "unidades de enfermedades cerebrovasculares", pero las mismas no serán efectivas hasta que campañas de educación en la población concienticen la importancia de la consulta temprana. Epidemiología Varios estudios han evaluado la magnitud y distribución de la enfermedad cerebrovascular en todo el mundo. Sin embargo, los resultados y las conclusiones han sido en ocasiones contradictorias, debido fundamentalmente a diferencias metodológicas. Además, conviene remarcar que las diferentes características étnicas, geográficas y de organización sanitaria dificultan la generalización de las conclusiones de estos estudios y hacen necesarios otros estudios de ámbito más local, evaluando la situación de esta enfermedad en América Latina y particularmente en nuestro medio. En los países occidentales la principal causa de muerte es la enfermedad cardiovascular, en segundo lugar las neoplasias y en tercer lugar la enfermedad cerebrovascular. La incidencia (número de casos nuevos por unidad de tiempo en una población específica) del stroke señalada en diferentes estudios depende de la metodología empleada para la recolección de los datos. Trabajos en los que el diagnóstico se efectúa en base al interrogatorio y al examen clínico son cuestionablemente comparables a otros que sólo lo admiten valorando los hallazgos de la neuroimagen o de la autopsia. Sin embargo puede aceptarse que la incidencia de stroke en el mundo oscila entre 150 a 250 casos por 100.000 habitantes y por año, según el país que se considere. La prevalencia (número de casos, en un lugar y tiempo determinado) varía entre 500 a Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 3 850 casos de stroke por 100.000 habitantes. Estas tasas pueden variar de acuerdo a los grupos de edad (Tabla 1). Tabla 1 Tasas de prevalencia de enfermedad cerebrovascular Edad < 45 años 45 a 65 años > 65 años Prevalencia 40 a 66/100.000 820 a 998/100.000 1800 a 5063/100.000 El stroke ha sido poco estudiado en Latinoamérica y los escasos datos disponibles indican una prevalencia más baja que en países desarrollados, con un porcentaje de stroke hemorrágicos más elevado. Pero, en general estos datos provienen de estudios realizados en áreas rurales o comunidades cerradas. También se ha sugerido que la baja tasa de prevalencia podría estar relacionada con un aumento de la mortalidad durante el período agudo. Datos de Argentina sugieren una prevalencia similar a otros países, 868/100.000 habitantes (Melcon M., ciudad de Junín, Provincia de Buenos Aires, en prensa), con aumento de la frecuencia del stroke hemorrágico (Junín: 20,4% vs Sicilia y Copiah County: 8%), y aparentemente, una mayor frecuencia de la enfermedad entre los 40 y 65 años (Melcon M., en prensa). Algunos resultados obtenidos de bases de datos de poblaciones hospitalarias, sugieren mayor tasa relativa de stroke hemorrágicos y mayor tasa de infartos lacunares dentro de los stroke isquémicos. El infarto cerebral es la causa más frecuente, siendo responsable de alrededor del 70 al 90% de los stroke, aun en los estudios con más baja incidencia alcanza al 58%, y el resto corresponde a stroke hemorrágicos. En las últimas décadas se ha producido un notable aumento de la sobrevida de los pacientes con stroke: mientras en el período 1945 1974 era del 9% a los 30 días y del 5% al año, en el lapso 1975 1979 pasó a ser del 44% y 31%, llegando al período 1980-2000 a un 76% y 57% respectivamente. Dado que alrededor del 40% de los que sobreviven requieren cuidados especiales permanentes, ello promueve un creciente impacto social y económico sobre la comunidad, pues al costo directo inmediato (gastos de internación y tratamiento), habría que sumarle el costo directo a largo plazo (tratamiento y rehabilitación) y los costos indirectos, como el lucro cesante. Enfoque del paciente con enfermedad cerebrovascular Clásicamente la enfermedad cerebrovascular se divide en dos grandes grupos: stroke isquémicos y hemorrágicos. Si bien la forma más conocida de presentación es el stroke, con el inicio abrupto de la signo-sintomatología, existen otras presentaciones de enfermedad cerebrovascular, como las “lesiones silentes” o las manifestaciones clínicas de comienzo lento y gradual (alteraciones en la marcha o déficit cognitivo). La hipertensión arterial (HTA) es el principal factor de riesgo para el stroke isquémico y la hemorragia cerebral, y se vincula con todas las formas de enfermedad cerebrovascular, siendo la enfermedad de pequeños vasos la más estrechamente relacionada. Actividades 1. ¿Cuál de los siguientes es el principal factor de riesgo para stroke isquémico? a. Hipertensión arterial b. Dislipemia c. Diabetes tipo 2 d. Hipertensión arterial diastólica Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 4 En forma arbitraria tomaremos a la enfermedad cerebrovascular como una patología evolutiva en etapas: 1. factores de riesgo 2. aparición de lesiones silentes o sintomáticas 3. aparición de síntomas clínicos abruptos (stroke) 4. aparición gradual de deterioro cognitivo o demencia por sumatoria de lesiones Esta división es frecuentemente ficticia, pues se pueden superponer estadios o “saltar etapas”. Sin embargo nos servirá para ordenar la presentación. El manejo de los distintos factores de riesgo en prevención primaria de la enfermedad cerebrovascular, si bien es el tratamiento más efectivo y debería ser el objetivo fundamental, no será tratado en este capítulo pues excede el diseño del mismo y ha sido tratado en otras unidades temáticas de este Curso. Lesiones silentes en la enfermedad cerebrovascular La presencia de infartos silentes en la tomografía computada (TC) de pacientes con un primer stroke ha sido estudiada ampliamente con objeto de descubrir su significado. Un estudio prospectivo con resonancia magnética nuclear (RM) en adultos sanos concluye que la presencia de lesiones silentes subcorticales constituye un factor de riesgo para el stroke isquémico pero también, aunque en menor medida, para la hemorragia cerebral. Con la introducción de nuevas técnicas de resonancia magnética, como las secuencias de ecogradiente, se ha identificado la presencia de microhemorragias cerebrales sintomáticas en pacientes hipertensos crónicos, sin antecedentes clínicos de lesiones cerebrovasculares. Su implicancia clínica aún es desconocida, pero se ha planteado que su presencia sería un marcador de enfermedad avanzada de pequeños vasos y de un riesgo mayor de hemorragia cerebral y deterioro cognitivo. Al compromiso de la sustancia blanca periventricular que se evidencia como hiperintensidad en la resonancia magnética o hipointensidad en la tomografía computada, se lo conoce como leucoaraiosis. Aún se discute su etiología, valor clínico y pronóstico; se ha sugerido que es consecuencia de arteriosclerosis, hipoperfusión cerebral o isquemia, es frecuentemente detectada en sujetos añosos, se asocia a compromiso de la función cognitiva, tabaquismo e historia de stroke y existe una fuerte asociación entre HTA y la presencia de enfermedad de sustancia blanca. La prevalencia del compromiso de sustancia blanca es variable, en pacientes hipertensos existe mayor proporción de leucoaraiosis, comparado con normotensos, independientemente de la duración o el estado de tratamiento y control de la HTA. Considerando sólo a los pacientes hipertensos, los individuos con mayor duración de niveles tensionales más altos tienen mayor grado de leucoaraiosis, y pacientes hipertensos no tratados o tratados pero no controlados, tienen mayor compromiso que hipertensos tratados y controlados. Estos hallazgos son consistentes con la hipótesis que el control de niveles elevados de presión arterial puede disminuir el riesgo de compromiso de sustancia blanca. Paciente con stroke Sólo se tiene una adecuada comprensión de lo que ocurre en un paciente que presenta un stroke si conocemos el momento evolutivo, si podemos localizar el área afectada e identificamos la etiología y el mecanismo fisiopatológico que han provocado síntomas. La indicación terapéutica es racional cuando estamos en conocimiento de todos estos datos. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 5 Por lo tanto, para el manejo de un paciente con un probable stroke, el médico debe: 1. realizar un examen neurológico con la obtención de los datos mediante la historia clínica y el examen físico, enfatizar en el horario de comienzo de los síntomas y establecer el perfil evolutivo temporal del cuadro clínico 2. conocer los distintos síndromes, para establecer un diagnóstico sindromático y un diagnóstico topográfico 3. evaluar los métodos complementarios que ayuden a realizar los diagnósticos diferenciales y el diagnóstico etiológico 4. evaluar la gravedad del cuadro y el compromiso del paciente, estableciendo un pronóstico del mismo 5. evaluar la terapéutica adecuada Si se cumplen estas cinco metas, ya hemos dado un gran paso en la ayuda del paciente. El concepto de cadena asistencial, donde la unidad de stroke es sólo un eslabón de la cadena, con la organización de la respuesta pre-hospitalaria y hospitalaria, es fundamental en el manejo de los pacientes con stroke agudo, por lo cual los servicios de emergencia deben contar con protocolos escritos para el manejo clínico y de métodos complementarios, con la posibilidad de dar una respuesta adecuada las 24 horas del día, 7 días a la semana, los 365 días del año. Se debe insistir en la correcta metodología de estudio, que deberá ser individualizada de acuerdo con los antecedentes y cuadro clínico del paciente. Los métodos complementarios que nos pueden ayudar en la evaluación de un paciente con stroke, son: 1. laboratorio hematológico y bioquímico 2. imagen cerebral 3. evaluación cardiaca 4. evaluación arterial 5. otros: estudio del líquido céfalo raquídeo, estudio genético, biopsia de cerebro o meninges, etc. En la fase aguda se deberá realizar en todos los pacientes: 1. neuroimagen, ya sea una TC o una RM de cerebro; su uso es indispensable, pues es la única forma segura de descartar otras etiologías distintas de la enfermedad cerebrovascular 2. laboratorio: hemograma, tiempo de protrombina, KPTT, glucemia, urea, creatinina, Na+ y K+, orina completa 3. evaluación por cardiología y ECG 4. evaluación no invasiva del lecho arterial mediante ecotomografía-doppler de vasos de cuello o angiografía por resonancia En algunos centros que dispongan la tecnología necesaria las 24 horas del día, puede plantearse el uso de angiografía por cateterismo o ecocardiografía transtorácica o transesofágica, cuando el paciente lo requiera. La TC inicial permite descartar otras causas de déficit neurológico agudo, pudiendo observarse hemorragias, o en los casos de isquemia, la presencia o no zonas de infarto cerebral según el tiempo de evolución; las hipodensidades de bordes netos representan la presencia de infartos cerebrales. Sabemos que durante la isquemia focal aguda, alrededor de la zona infartada existe un área en "penumbra isquémica", esta zona no funcionante, viable por horas, puede recuperarse o evolucionar al infarto. Lamentablemente no existen marcadores clínicos o tomográficos de extensión o duración de la ¨zona de penumbra isquémica”; es probable que el uso de nuevas técnicas, como la resonancia magnética por difusión y por perfusión, ayuden a distinguir el cerebro isquémico del infartado. Cuando el área de la lesión por perfusión es mayor que el área de lesión por difusión (cerebro infartado), implicaría la existencia de tejido cerebral hipoperfundido y no infartado, “zona de penumbra”, con la posibilidad de ser “rescatado”. En cambio, cuando el área de la lesión por Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 6 perfusión es igual o menor al área de lesión por difusión, no existiría zona de penumbra isquémica (Figura 1). Figura 1 Penumbra isquémica Esquema del modelo de penumbra isquémica. El centro isquémico (4) representa el tejido dañado en forma irreversible; el mismo se encuentra rodeado por el área de penumbra isquémica (3), la cual se encuentra en riesgo de infarto; área de oligohemia benigna (2) que suele sobrevivir al infarto; área no afectada (1). Korean J Radiol 2005;6:64-74 Actividades 2. En la resonancia magnética por difusión y perfusión, la zona de penumbra isquémica se observa como: a. Área de lesión por perfusión igual al área de lesión por difusión b. Área de lesión por perfusión mayor al área de lesión por difusión c. Área de lesión por perfusión menor al área de lesión por difusión d. Área de lesión por difusión mayor al área de lesión por perfusión Por lo tanto, en aquellos pacientes que se presentan dentro de las primeras horas de la iniciación de los síntomas, las nuevas técnicas de diagnóstico podrían utilizarse para determinar las áreas de cerebro isquémico vs. infartado en tiempo real y no en base a ventanas preestablecidas arbitrariamente. Ataque isquémico Transitorio El concepto arbitrario, tomado por convención, de considerar al accidente isquémico transitorio (AIT), como episodios que se resuelven clínicamente dentro de las 24 horas se encuentra en revisión. Definimos al AIT como un trastorno episódico y focal del sistema nervioso central o de la retina, de etiología vascular isquémica, de comienzo generalmente brusco, que determina la aparición de alteraciones neurológicas subjetivas (síntomas) u objetivas (signos) de breve duración, con recuperación completa y sin evidencias de infarto cerebral en los métodos complementarios (en la actualidad: RM con técnica de difusión negativa). Este enfoque ha dejado de lado la definición que utilizaba un corte arbitrario de tiempo (menos de 24 horas de duración o menos de un ahora de duración), para utilizar el criterio de ausencia de daño tisular para diferenciarlo del infarto cerebral. La etiología y mecanismo de producción de los AIT son similares a los del infarto cerebral consolidado. Lo habitual es que los AIT sean de corta duración, el 70% dura entre 2 y 15 minutos; entre el comienzo de las alteraciones y la máxima sintomatología transcurren no más de 5 minutos y usualmente menos de dos. El paciente en general consulta una vez que ha desaparecido la signo-sintomatología. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 7 Actividades 3. La principal diferencia entre el ataque isquémico transitorio y el infarto cerebral es: a. El tiempo de evolución menor de 24 horas b. La ausencia de daño tisular en el ataque isquémico transitorio c. La etiología y el mecanismo de producción d. La máxima sintomatología del ataque isquémico transitorio después de los 15 minutos de producido La completa remisión de los síntomas y signos es la característica fundamental de los AIT. En un porcentaje importante de casos se produce cierto daño estructural de infarto isquémico en el lugar apropiado, demostrable por la observación en la TC o RM; en la actualidad se los define como infartos cerebrales con síntomas transitorios. La presentación de un AIT implica el riesgo incrementado para su recurrencia o la instalación de un infarto cerebral consolidado. Los AIT pueden ser únicos o repetirse hasta varias decenas de veces; hasta el 50% de los stroke isquémicos son precedidos por AIT. Por otra parte, entre el 20 y el 50% de los pacientes que han sufrido un AIT sin tratamiento, padecen un ataque cerebral en los próximos 5 años y un alto porcentaje (hasta un 25% según algunas series) sufre un infarto agudo de miocardio dentro de este período, mostrando al AIT como marcador de riesgo de eventos vasculares en distintos territorios arteriales y no sólo a nivel cerebral. Un grupo de mayor riesgo de recurrencia se encuentra representado por aquellos pacientes con patología arterial con estenosis de alto grado en el territorio vascular involucrado, o aquellos pacientes que presentan AIT a repetición en pocas horas (“AIT in crescendo”). Cuando ocurre un AIT único de una hora o más de duración, debe sospecharse la etiología embólica a punto de partida cardíaco; igual origen debe presumirse cuando los AIT se presentan como múltiples episodios en diferentes localizaciones cerebrales. El cuadro clínico de los AIT depende del territorio vascular afectado. Según la topografía, pueden ser retinianos (amaurosis fugax), o cerebrales de territorio carotídeo o vértebro-basilar; cuando los síntomas producidos no permiten adscribirlo a ninguno de esos dos sistemas, lo calificamos de indefinido. La amaurosis fugax es una pérdida de visión mono ocular, que generalmente dura unos minutos y se asocia a patología de origen carotídeo o cardíaco, clásicamente son de mejor pronóstico que los AIT hemisféricos. No deben • • • • • • • ser considerados síntomas de AIT a los siguientes cuadros: pérdida de visión asociada con alteración de la conciencia pérdida de conciencia sin otros síntomas de déficit circulatorio posterior actividad tónica o clónica escotoma centelleante síntomas focales asociados con migraña progresión de un déficit sensitivo incontinencia vesical o rectal Tampoco ninguno de los siguientes síntomas, cuando ocurren en forma aislada, sin relación espacial o temporal entre ellos: • Vértigo • Mareo • Disfagia • Disartria • Diplopía • Confusión • Amnesia o drop attacks Una vez establecido el diagnóstico de AIT es fundamental el estudio rápido y adecuado de la etiología del mismo, pues el AIT es un marcador de riesgo que nos indica que el paciente está amenazado para padecer un infarto cerebral consolidado, con consecuencias catastróficas. Por este motivo es importante intentar estratificar el riesgo en estos pacientes, identificando a aquellos cuyo riesgo es mayor. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 8 Para la estratificación del riesgo existen diferentes herramientas, entre ellas la Escala Clínica ABCD2, validada y utilizada frecuentemente. Esta escala predice el riesgo para recurrencia de eventos después de un AIT; los niveles más elevados se relacionan con mayor probabilidad de ataques cerebrales recurrentes en tanto que los más bajos presentan tasas de recurrencia menores (Tablas 2 y 3). Estudios recientes han demostrado que el riesgo de stroke a los 90 días de ocurrido un AIT puede disminuirse del 12 al 2% si los pacientes son evaluados correctamente y se inicia un tratamiento de prevención secundaria en las primeras 24 horas. Este hecho demuestra que estos pacientes deben ser abordados como una verdadera emergencia médica. Infarto cerebral El infarto cerebral se produce cuando la caída de flujo focal es lo suficientemente prolongada en el tiempo como para producir un área de necrosis tisular. En la actualidad, con el concepto que el stroke isquémico es una emergencia médica que necesita tan rápida atención como el infarto agudo de miocardio, ya que el diagnóstico temprano y el manejo terapéutico en las primeras horas deciden su pronóstico, el enfoque del paciente durante la etapa aguda debe ir destinado a evaluar si existen áreas de tejido cerebral en riesgo para mayor daño, o tejido cerebral potencialmente salvable (Figura 2). Tabla 2 Escala clínica ABCD2 A Edad B Presión arterial C Presentación clínica D Duración D >60 años Sistólica >140 mmHg Diastólica >90 mmHg 1 1 Debilidad unilateral 2 Dificultad en el habla, sin debilidad 1 >60 minutos 2 10 a 59 minutos 1 <10 minutos 0 Diabetes 1 Tabla 3 Score ABCD2 Score 0-3 (Riesgo bajo) 4-5 (Riesgo moderado) 6-7 (Riesgo alto) a 2 días 1,0% 4,2% 8,1% Riesgo a 7 días 1,2% 5,9% 11,7% a 90 días 3,1% 9,8% 17,8% El área de "penumbra isquémica" permanece viable no más de algunas horas; la frase ¨el tiempo es cerebro¨, toma importancia cuando aplicamos el concepto de “ventana terapéutica”. La duración de la penumbra isquémica en la mayoría de los pacientes varía entre 3 y 6 horas, oscilando entre 1 y 17 horas. En esta variabilidad jugarían distintos factores, como el grado de flujo residual, la irrigación por colaterales, el estado metabólico, la edad del paciente, la localización de la lesión, entre otras condiciones. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 9 Figura 2 Infarto cerebral Desde la perspectiva del tratamiento y ventanas de tiempo, lamentablemente no existen marcadores clínicos o tomográficos de extensión o duración de la “zona de penumbra”, por lo que en la mayoría de los casos aplicamos tiempos arbitrarios para la “ventana terapéutica” (4,5 horas para el uso de trombolíticos endovenosos, 6 horas para el uso de trombolíticos intra-arteriales y entre 3 a 12 horas para neuroprotectores). Pero, seguramente, existen pacientes que ingresan en dichas ventanas y no presentan “tejido cerebral rescatable” y quienes se presentan más allá de esas horas y tienen áreas de penumbra, por lo tanto la pregunta a responder es: ¿Cuánto cerebro está en riesgo para más daño? Lo importante es saberlo en tiempo real en cada paciente y no por definiciones arbitrarias. Es así que, si bien es importante el diagnóstico evolutivo del stroke isquémico, lo fundamental durante la fase aguda es que debemos tratar a los pacientes tan rápidamente como sea posible, eligiendo la terapéutica de acuerdo al momento de evolución, siendo primordial poder determinar en cada paciente en particular si se encuentra o no dentro de la “ventana terapéutica”, es decir, si aún tenemos tejido cerebral potencialmente rescatable. Por lo cual, actualmente en centros que dispongan del uso de técnicas de RM magnética por difusión y perfusión, o en un futuro, con el desarrollo de nuevas técnicas, se deberá manejar a los pacientes con stroke agudo buscando determinar en tiempo real la presencia de tejido cerebral rescatable. Subtipos etiológicos de Stroke isquémico Desde el punto de vista asistencial es preferible presentar una conducta descriptiva de la situación más que encasillar a un paciente en un subtipo etiológico y fisiopatológico determinado, pues en cierta forma, la mayoría de estas divisiones son arbitrarias. Para poder intercambiar información y comparar datos entre diferentes centros es importante “hablar el mismo idioma”, por lo cual se deberían utilizar clasificaciones reconocidas, aceptadas y difundidas internacionalmente. No existe una clasificación de subtipos etiológicos que sea aceptada universalmente, en general la mayoría acepta los mismos grandes grupos etiológicos, variando entre las distintas clasificaciones los criterios utilizados para el diagnóstico de los subtipos. Los cinco grupos considerados en estas clasificaciones son: • arterioesclerosis de grandes arterias • cardioembolismo • infartos lacunares • grupo de otras causas menos frecuentes • grupo que no puede ser asignado a ninguna de estas categorías y se clasifica como infarto de origen indeterminado Los tres primeros grupos representan a la gran mayoría de las etiologías de los stroke isquémicos, con una distribución variable de estos subtipos etiológicos según diversos bancos de datos. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 10 Arterioesclerosis de grandes arterias La arterioesclerosis de grandes arterias intra o extracraneales es una de las causas más frecuentes de stroke isquémico (15 al 40% de los casos según distintas series). Las placas ateromatosas crecen preferentemente en las zonas de bifurcación arterial y producen infartos de topografía cortical o subcortical, de tamaño medio o grande, en pacientes con antecedentes de factores de riesgo vascular. Los mecanismos fisiopatológicos por los cuales una placa aterosclerótica puede provocar un infarto pueden ser varios y habitualmente se superponen entre sí. Los mecanismos involucrados son los siguientes: 1. En una estenosis crítica la placa puede aumentar de tamaño hasta comprometer la luz del vaso sanguíneo con trombosis local, pudiendo propagarse distalmente afectando al origen de vasos distales a la estenosis inicial. 2. Embolismo del trombo superpuesto o de fragmentos de la propia placa (émbolo arteriaarteria). Lesiones características de este mecanismo fisiopatológico son los llamados infartos limítrofes, cuando una arteria severamente estenosada (pero no ocluida) se ve sometida a una hipotensión sistémica importante: ambas condiciones se suman para reducir el flujo cerebral en forma suficiente como para que se instale una lesión isquémica en un territorio de última pradera. 3. Combinación de distintos mecanismos de isquemia: la carótida puede ocluirse y al mismo tiempo desprenderse un trozo de material aterosclerótico que embolice hacia un vaso distal a la oclusión, o bien embolizar y luego ocluirse. La clínica puede mostrar síntomas o signos de compromiso cortical, de tronco, cerebelo o amaurosis fugax. Sin embargo la oclusión carotídea no siempre produce lesiones cerebrales, siendo muchas veces asintomática y constituyendo un hallazgo ecográfico o angiográfico. La presencia de historia clínica de AIT en el mismo territorio, soplo carotídeo o evidencia de patología arterial en otras localizaciones (por ejemplo coronariopatía o enfermedad vascular periférica) aumenta la posibilidad del diagnóstico de este subtipo etiológico. Las neuroimágenes muestran en general infartos mayores a 1,5 cm de diámetro. La evaluación cardiológica es importante, pues uno de los criterios diagnósticos es la exclusión de la fuente cardioembólica. Además se debe evaluar el compromiso coronario concomitante, pues la enfermedad isquémica de miocardio es frecuente en este subtipo etiológico. Stroke Isquémico de origen cardioembólico Los émbolos de origen cardíaco producen alrededor del 15 al 30% de los infartos cerebrales, siendo mayor la proporción en pacientes jóvenes. El tamaño del émbolo es variable y se detiene cuando el diámetro de la arteria es pequeño para permitir su paso, siendo los puntos más frecuentes las bifurcaciones o los focos de ateromas en el trayecto de una arteria. Habitualmente el resultado de una oclusión embólica persistente es un infarto de tamaño medio o grande, con topografía cortical o subcortical. Si establecido el infarto el émbolo se disipa o migra hacia vasos distales más pequeños, se produce una hiperperfusión del tejido isquémico y el desarrollo de infartos hemorrágicos. En la neuroimagen pueden verse infartos con componente hemorrágico, hasta en un tercio de los infartos cardioembólicos. Para el diagnóstico de cardioembolismo es imprescindible la demostración de una cardiopatía embolígena y la ausencia de evidencia de aterotrombosis u otra etiología concomitante que explique el cuadro. Las cardiopatías más frecuentes que pueden producir émbolos son: • la fibrilación auricular no valvular (causa más frecuente de cardioembolismo) • el infarto de miocardio reciente • la miocardiopatía dilatada • las válvulas protésicas • la enfermedad valvular mitral o aórtica • el trombo o tumor cardíaco • la endocarditis • la patología del septum interauricular (foramen oval permeable, aneurisma del septum) Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 11 Las cardiopatías se pueden clasificar en de alto o bajo riesgo de embolización; en los pacientes portadores de cardiopatías de alto riesgo, la presencia de la misma y su relación con el stroke es más frecuentemente causal que incidental, presentando alta tasa de primer evento (más de 5% por año) y de stroke recurrente; por el contrario en pacientes con stroke y cardiopatía de bajo riesgo a menudo la cardiopatía es incidental y en general presenta una baja tasa de primer evento y de recurrencia del stroke. La embolia paradojal es cuando la fuente embólica es una trombosis venosa profunda que a través de un shunt derecha-izquierda accede a la circulación cerebral. Un concepto importante es que, para el diagnóstico de la misma, se debe cumplir con todos los siguientes criterios: • embolia cerebral en ausencia de fuente cardíaca del lado izquierdo • presencia de trombosis venosa o embolismo pulmonar • documentación de shunt cardíaco de derecha a izquierda • presencia de elevación de la presión cardíaca derecha constante (hipertensión pulmonar) o transitoria durante el evento (Valsalva o tos) Actividades 4. ¿Cuál de los siguientes no es un criterio diagnóstico de embolia paradojal? a. presencia de elevación de la presión cardíaca derecha, constante (hipertensión pulmonar) o transitoria durante el evento (Valsalva o tos) b. presencia de trombosis venosa o embolismo pulmonar c. embolia cerebral en presencia de fuente cardíaca del lado izquierdo d. documentación de shunt cardíaco de derecha a izquierda Infartos lacunares Definimos como infarto lacunar a aquel de pequeño tamaño (menos de 15 mm de diámetro), localizado en el territorio de distribución de las arteriolas perforantes. Este subtipo etiológico representa alrededor del 15 al 40% del total de los infartos cerebrales, siendo más frecuente en población hispana, y según bases de datos hospitalarias, es el subtipo más frecuente en nuestro medio (Figura 3). Figura 3 Infarto lacunar El infarto lacunar se asocia estrechamente a la presencia de HTA, diabetes u otros factores de riesgo cerebrovascular. Aunque la enfermedad de pequeño vaso, representada por la arterioloesclerosis con microateromas, y la lipohialinosis del vaso penetrante son las principales causas, existen otras menos frecuentes como cardioembolias, embolias arterio-arteriales, estados protrombóticos, angeítis, etc. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 12 Dada la ubicación y el tamaño del infarto lacunar, nunca produce síntomas corticales como afasia, agnosia, hemianopsia, convulsiones o trastornos de la conciencia, y su instalación no provoca cefalea. Clínicamente se manifiesta por un síndrome lacunar, siendo los clásicos: hemiparesia motora pura, síndrome sensitivo puro, síndrome sensitivo motor hemiparesia-ataxia, o disartriamano torpe. En la actualidad, además de estos síndromes clásicos, se han descripto más de una veintena de síndromes lacunares, como síndrome cerebelo-piramidal, ataxia crural pura, hemicorea, hemibalismo, hemidistonía, síndrome de la encrucijada hipotalámica, hemiataxia aislada, disartria aislada, etc. El mismo síndrome puede resultar de lagunas con diferente ubicación; así la hemiparesia motora pura puede ser secundaria a infartos en la cápsula interna, en la protuberancia o en el bulbo. Cuando provoca déficit motor puede predominar en un segmento, pero necesariamente debe ser hemicorporal, ya que las estratégicas ubicaciones de las lagunas no permiten el compromiso aislado de un miembro. El estado lacunar se produce por la presencia de múltiples infartos lacunares y da lugar a un síndrome pseudobulbar, con compromiso escalonado de la deglución, de la fonación, de la marcha, del equilibrio, pérdida del control de los esfínteres y deterioro de las funciones cognitivas. En las neuroimágenes se observa una lesión menor de 15 mm de diámetro subcortical o de tronco, teniendo mejor poder de definición la RM. El diagnóstico de infarto lacunar por enfermedad de pequeño vaso sólo puede realizarse cuando se han excluido fuentes potenciales de cardioembolias y el examen de vasos de cuello no muestra estenosis significativa ipsilateralmente. Otras causas menos frecuentes de stroke isquémico Este subgrupo etiológico incluye una larga lista de enfermedades que producen stroke isquémico, y que son distintas a los tres grupos anteriores. Su frecuencia varía entre el 5 y el 20% de todos los stroke isquémicos, pero si consideramos las etiologías en el grupo etario de menores de 45 años, su frecuencia puede alcanzar hasta un 40% de las causas. Este hecho es lógico, debido a la menor frecuencia de aterosclerosis y enfermedad de pequeños vasos en pacientes jóvenes. Dentro • • • • • • • • • • • • de las causas podemos mencionar: displasia fibromuscular disección arterial arteritis enfermedad de Moya Moya angiopatía amiloide complicaciones cerebrovasculares de las hemopatías estados protrombóticos infarto de origen migrañoso trombosis venosa cerebral enfermedades sistémicas (colagenopatías) uso de drogas ilícitas CADASIL y otras enfermedades genéticas De todas estas causas podríamos resaltar por importancia y frecuencia a las disecciones arteriales, la trombosis venosa cerebral y los estados protrombóticos. La disección arterial es la causa del 4% de todos los stroke isquémicos, siendo su frecuencia mucho mayor en menores de 45 años (la primer o segunda causa del stroke del joven). La arteria afectada puede ser carótida o vertebral, intra o extracraneal. Pueden existir o no antecedentes de traumatismos cervicales leves, y en un 20% de los casos se asocia a fibrodisplasia muscular. Su cuadro clínico depende de la arteria comprometida y no es específico, pero una constelación de síntomas asociados ayuda. Dos de cada tres pacientes presentan síntomas de isquemia cerebral. El comienzo abrupto de dolor en cuello que irradia a cara y cráneo, acompañando de síntomas cerebrales, es lo más sospechoso. Si bien son múltiples los orígenes que se detectan en el stroke isquémico y se ha llegado a describir más de medio centenar de causas diferentes, la etiología, si se busca con habilidad clínica y con los métodos complementarios adecuados, puede ser hallada en la mayoría de los Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 13 pacientes. Determinar la etiología es muy importante, dado que si la causa es tratable, puede mejorar el pronóstico y puede evitarse la recurrencia. Actividades 5. Señale la opción incorrecta a. El 15 al 40% de los stroke isquémicos se producen por arterioesclerosis de los grandes vasos craneales b. Los émbolos de origen cardíaco producen entre el 15 y el 30% de los infartos cerebrales c. El 15 al 40% de los infartos cerebrales se encuentran representados por los infartos lacunares d. La disección arterial es la causa del 14% de los stroke isquémicos Stroke isquémico de origen indeterminado Según las distintas series la frecuencia estaría entre el 5 y el 40% de los casos. Se incluyen dentro de esta categoría tres tipos de pacientes: • el primero es aquel paciente que tras un correcto estudio diagnóstico, se ha descartado que pertenezca a ninguno de los cuatro grupos anteriores, siendo éste un diagnóstico de exclusión (verdadero infarto de origen indeterminado) • otro tipo sería un paciente en el cual, por diversos motivos, estado general o pronóstico, no se pudieron realizar las exploraciones complementarias oportunas • el último ejemplo de esta categoría son los casos en que coexista más de una posible etiología (como ejemplo asociación de estenosis carotídea y fibrilación auricular) Hemorragia intracerebral Se denomina hemorragia intracerebral o parenquimatosa espontánea (HIC) (Figura 4) a la extravasación de sangre dentro del parénquima cerebral, que puede extenderse hasta los ventrículos y más raramente hacia el espacio subaracnoideo. El 90% de los casos posee como etiología a las alteraciones de las arteriolas cerebrales provocadas por la arterioesclerosis y la HTA. Otras causas menos frecuentes (hemorragias secundarias a malformaciones vasculares, por anticoagulación u otras condiciones) no serán consideradas en este capítulo. La HIC es una entidad asociada a una alta morbimortalidad; su incidencia es dos veces mayor que la de la hemorragia subaracnoidea (HSA) y por sí sola comprende entre el 10 y el 30% de todos los ataques cerebrales, es más frecuente en asiáticos, africanos e hispanoamericanos. Actualmente se observa una tendencia a la disminución en la incidencia de los ataques cerebrales en muchos países occidentales. Sin embargo, se estima que la incidencia de hemorragia intracerebral se duplicará en los próximos 50 años debido al incremento de la edad de la población y a variaciones demográficas y raciales. Figura 4 Hemorragia intracerebral Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 14 Actividades 6. Señale la opción incorrecta con respecto a la hemorragia intracerebral a. Es la extravasación de sangre dentro del parénquima cerebral b. Actualmente se observa una tendencia a una disminución de la incidencia c. El 90% de los casos se produce por alteraciones vasculares secundarias a hipertensión arterial y arterioesclerosis d. Posee una elevada morbimortalidad La HIC presenta una alta tasa de mortalidad en la fase aguda, con supervivencia al año de tan sólo un 38%. La HTA es la causa del 50 al 90% de las HIC espontáneas en mayores de 45 años. Se han descripto dos posibles mecanismos patogénicos: 1. la HTA crónica produce lipohialinosis, que ocasiona dilataciones segmentarias conocidas como aneurismas de Charcot-Bouchard 2. una elevación brusca de la presión arterial podría producir una ruptura arterial en pacientes sin antecedentes de HTA crónica. Esta hipótesis se sustenta en la descripción de HIC en el contexto de HTA por exposición al frío, dolor agudo y endarterectomía carotídea La ruptura del vaso que propicia la hemorragia obedece frecuentemente a cambios vasculares crónicos. La sangre extravasada produce disección del tejido por planos y comprime las estructuras adyacentes. Los eventos fisiopatológicos iniciales determinan el daño cerebral (disrupción del tejido y efecto de masa). Contribuyen al daño la aparición del hematoma y su expansión, así como el surgimiento del edema. Histológicamente, se ha visto que el hematoma puede expandirse entre los tractos de fibras, con un mínimo de destrucción. Hoy se sabe que el hematoma sigue creciendo en el 20-40% de los casos, hasta 36 horas después de iniciada la hemorragia aunque su mayor incidencia es en las primeras 6 horas. La expansión se atribuye al sangrado continuo desde el punto original de ruptura, así como a la ruptura mecánica de otros vasos vecinos. Entre los factores predisponentes se encuentran la HTA sistólica (mayor a 200 mmHg), la diabetes mal controlada y las afecciones hepáticas, entre otros. No se descarta que otros trastornos sistémicos o locales de la coagulación influyan en este proceso. La afectación del parénquima por la hemorragia no se debe exclusivamente al efecto de masa. A los pocos minutos de producirse la hemorragia y durante varios días o semanas, se desarrolla un conjunto de eventos fisiopatológicos que menoscaba aún más la función de estos tejidos. Entre ellos se incluyen el edema, la isquemia y la inflamación, así como la pérdida de neuronas por necrosis y apoptosis. Fórmula para la estimación del volumen del hematoma (Lateral x Anteroposterior x Altura) x π/6 Es una derivación del cálculo del volumen de una esfera para estimar el volumen en cortes axiales de una tomografía computada • Diámetro lateral en cm • Diámetro anteroposterior en cm • Altura (diámetro superoinferior) en cm: debe calcularse contando la cantidad menos 1 corte en que aparece el hematoma si los cortes son cada centímetro, o bien tomando la mitad de los cortes si son cada 0,5 cm • El resultado es en cm3 (equivalente a ml) • Algunos hematomas tienen formas irregulares (por ejemplo piriforme) y el cálculo sobreestima o infraestima el volumen real Las manifestaciones clínicas comienzan bruscamente durante la actividad, con cefalea, náuseas o vómitos, inquietud y rápido compromiso de la conciencia, que alcanza su mayor severidad en minutos u horas. Los hallazgos del examen neurológico dependen del tamaño y de la localización de la hemorragia, que tiende a ocurrir preferentemente en 5 áreas; 3 de ellas supratentoriales: putamen, tálamo y sustancia blanca de los diferentes lóbulos cerebrales y 2 infratentoriales: protuberancia y cerebelo. Los hematomas lobares son menos frecuentes que los Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 15 ubicados en los ganglios de la base y capsulares. En estos casos el papel de la HTA es materia de controversia ya que se la observa sólo en el 33% de los casos de hematomas lobares. Es importante determinar el tamaño de la hemorragia, siendo dos las alternativas: una más simple, donde se mide el diámetro del hematoma en centímetros y otra más eficaz y fiable, donde se estima su volumen. Más de un tercio de los enfermos con hemorragias manifiesta deterioro de su estado clínico inicial en el transcurso de los dos primeros días de su evolución. Como causa principal de este fenómeno durante las tres primeras horas de evolución, se ha implicado a la expansión del hematoma (con o sin extensión intraventricular), en tanto que se responsabiliza del deterioro que sobreviene durante las 24 o 48 horas después de iniciada la hemorragia al incremento del edema. La hidrocefalia obstructiva aguda es otra de las causas del deterioro secundario. Las convulsiones deterioran considerablemente el estado de estos pacientes. Las hemorragias del cerebelo tienen la peculiaridad que muchos de los pacientes se deterioran súbitamente, incluso tras varios días de evolución con un examen neurológico sin modificaciones sustanciales. La presencia de una hemorragia vermiana o de hidrocefalia favorece el deterioro subsiguiente; los mecanismos involucrados en la progresión del deterioro serían la compresión del IV ventrículo, la invasión intraventricular de sangre, la herniación foraminal o la compresión directa del tallo cerebral. Como • • • • • • • actores pronósticos de mortalidad en la fase aguda se citan: valor de la escala de Glasgow (Tabla 4) volumen de la hemorragia extensión intraventricular edad del paciente hidrocefalia presión del pulso presencia de trastornos de la coagulación Los tres factores pronósticos mejor identificados hasta el momento son el nivel de conciencia al momento del ingreso, la hidrocefalia y el volumen del hematoma. Tabla 4 Escala de Glasgow Apertura ocular Respuesta motora Respuesta verbal Espontánea Estímulo verbal Al dolor Ninguna Obedece órdenes Localiza dolor Flexión normal Flexión anormal (decorticación) Extensión (descerebración) Ninguna Orientada Conversación confusa Lenguaje inapropiado Sonidos incomprensibles Ninguna Puntaje 4 3 2 1 6 5 4 3 2 1 5 4 3 2 1 Total: 3 a 15 Hasta ahora no existe ningún tratamiento médico específico para este tipo de stroke. Se ha sugerido la posibilidad que el nivel de ‘agresividad’ en el tratamiento y el nivel de especialización de la atención médica prestada pueden influir en la evolución de estos enfermos. La meta inicial del manejo de los pacientes con HIC se centra en el control de la presión intracraneal, evitar o minimizar la expansión de la hemorragia y prevenir en lo posible el daño secundario. El tratamiento antihipertensivo en estos enfermos consiste en reducir la presión arterial por debajo de un nivel en el que no se produzcan resangrados ni se agrave el edema, pero donde tampoco se afecte la presión de perfusión cerebral. Desafortunadamente, el valor preciso de este nivel es incierto, por lo que, como recurso inicial, se ha adoptado la práctica de mantener una presión arterial sistólica por debajo de 160 mmHg o una presión arterial media (PAM) menor de 110 mmHg en pacientes conscientes y sin antecedentes de HTA. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 16 Cuando existe un historial de HTA crónica, se recomienda establecer un tratamiento antihipertensivo sólo si la PAM es superior a 130 mmHg; ya que en los hipertensos crónicos la curva de la autorregulación está desplazada hacia la derecha; descensos de la presión arterial hacia valores ‘normales’ pueden originar hipoperfusión cerebral en presencia de una presión intracraneal elevada. En general, el tratamiento de estos enfermos consiste fundamentalmente en las medidas de soporte y en la prevención y el tratamiento de las complicaciones. Deterioro cognitivo y enfermedad cerebrovascular El deterioro cognitivo ocurre en todas las edades pero es más frecuente en la población añosa; algún grado significativo de deterioro cognitivo está presente en el 3% de los adultos entre 65 y 74 años y en el 50% de los mayores de 80 años. La demencia vascular es la segunda causa más frecuente de demencia en los mayores tras la Enfermedad de Alzheimer y representa el 10-20% de los casos de demencia. En el desarrollo del deterioro cognitivo asociado a la patología vascular entran en juego distintos mecanismos fisiopatológicos, dependiendo de diferentes variables, como cantidad, volumen, topografía y tipo de lesión vascular, y coexistencia de lesiones de la sustancia blanca e interacción con otras enfermedades concomitantes. Los criterios para el diagnóstico de demencia vascular son los siguientes: • el paciente debe cumplir criterios de demencia • debe existir evidencia de enfermedad cerebrovascular por historia, exploración física y técnicas de neuroimagen • ambos requisitos deben estar razonablemente relacionados La demencia vascular representa uno de los "extremos en la evolución de la enfermedad vascular", comenzado la patología muchos años antes, inicialmente con factores de riesgo, luego con lesiones silentes y, finalmente, con cuadros clínicos de stroke. Este concepto permite comprender porqué la “demencia vascular” es la causa de deterioro cognitivo “más factible de prevenir” y que, cuando se llega al diagnóstico de demencia vascular, ya es tarde. Se han identificado pacientes hipertensos crónicos sin antecedentes clínicos de lesiones cerebrovasculares, pero con evidencia de distintos grados de compromiso cognitivo. El compromiso cognitivo secundario al daño vascular por HTA incluye un compromiso temprano de la atención y de la función ejecutiva (planeamiento, propósito de acción, desempeño), con enlentecimiento de la performance motora y del procesamiento de la información, por lo cual las pruebas que evalúan la atención, la velocidad de procesamiento y la función ejecutiva son, quizás, la mejor manera de determinar el eventual compromiso cognitivo subcortical de origen vascular. En el deterioro cognitivo asociado a la enfermedad cerebrovacular la memoria está relativamente preservada cuando se lo compara con otras causas de deterioro cognitivo. En estudios longitudinales se observa que la presencia de factores de riesgo, como por ejemplo el aumento de la presión arterial en la edad media de la vida, se asocia con alta prevalencia de afectación de la sustancia blanca y declinación cognitiva en edad tardía, pero la disminución de la presión arterial en pacientes añosos también se asocia a pobre función cognitiva. Estos datos sugieren una relación dinámica y compleja entre la presión arterial y la función cognitiva cerebral: las cifras de presión arterial elevadas aceleran inicialmente los cambios arterioscleróticos y comprometen la autorregulación cerebral con efectos adversos sobre la cognición, pero posteriormente cifras más elevadas de presión arterial pueden ser necesarias para mantener una adecuada perfusión cerebral y mejorar el rendimiento cognitivo. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 17 Actividades 7. Marque la definición correcta Tipo de lesiones Ataque isquémico transitorio Infarto cerebral Hemorragia intracerebral Deterioro cognitivo Leucoaraiosis Extravasación de sangre dentro del parénquima cerebral Caída del flujo focal que produce un área de necrosis celular Trastorno focal del sistema nervioso central y de la retina de etiología isquémica, de aparición brusca, de breve duración, con resonancia con técnica de difusión negativa Demencia con evidencia de enfermedad cerebrovascular Compromiso de la sustancia blanca periventricular con hiperintensidad en la resonancia e hipointensidad en la tomografía Tratamiento de la enfermedad cerebrovascular El tratamiento de la enfermedad cerebrovascular debe ir destinado a su prevención, pues es la manera más efectiva, con menos costo y mayor impacto sanitario. Se debería identificar al 30% de la población en el que va a ocurrir más del 90 % de las lesiones cerebrovasculares y realizar un tratamiento preventivo enérgico. Los cambios en los hábitos de vida de una persona pueden tener efectos significativos en la prevención de la enfermedad cerebrovascular. Es necesario el desarrollo de campañas poblacionales para modificar hábitos y educar en la identificación y tratamiento de todos los factores de riesgo. Es muy importante motivar a la familia y no solamente al individuo, ya que esto es probablemente más efectivo. Los factores de riesgo para enfermedad cerebrovascular actúan de manera sinérgica y no solamente de manera aditiva; individuos que se presentan con aumentos moderados en varios factores de riesgo pueden tener mayor riesgo que aquellos con niveles elevados de un solo factor. En consecuencia es muy importante que las intervenciones deban referirse a todos los factores de riesgo. El manejo de todos los factores de riesgo en prevención primaria y el tratamiento de la fase aguda de la enfermedad cerebrovascular no serán tratados en esta unidad temática pues excede el diseño de la misma. La prevención secundaria posterior al evento vascular tiene el objetivo de reducir las probabilidades de otro evento vascular. Es indiscutible la importancia de un estudio cuidadoso del paciente, con la eliminación de los factores de riesgo y del tratamiento específico de las potenciales etiologías cuando resulta posible. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 18 Un concepto importante es que la enfermedad vascular es una enfermedad extensa, progresiva y mortal que afecta la circulación coronaria, cerebral y periférica. Por lo tanto pacientes con enfermedad vascular en un territorio presentan alto riesgo de presentar eventos isquémicos en otros territorios vasculares: los pacientes con enfermedad coronaria tienen alto riesgo de presentar un ataque cerebral y viceversa. Existe una reducción de la incidencia de enfermedad cerebrovascular en la prevención secundaria de la enfermedad cardiovascular, por lo cual es fundamental el control de los factores de riesgo dentro de la estrategia terapéutica. El éxito del tratamiento depende de: • educación de la población • educación médica • enfoque multidisciplinario • terapia combinada • • • • • • • • • • • En cualquier paciente con un evento cerebrovascular se debería recomendar: cambios en los hábitos de vida consumo de fruta fresca y vegetales disminución del consumo de sal evitar el consumo de alcohol cesación del tabaquismo realizar ejercicio físico diario sugerimos considerar los factores de riesgo psicológicos tanto como los factores de riesgo convencionales realizar una exhaustiva evaluación del riesgo vascular en los distintos lechos vasculares (patología coronaria asociada entre otros) mantener una terapia enérgica para todos aquellos pacientes diabéticos prescribir la terapia antihipertensiva correspondiente a los pacientes hipertensos que han tenido un evento vascular realizar un perfil lipídico, con corrección de sus alteraciones Enumerados estos puntos revisaremos algunas de las indicaciones específicas. El ataque isquémico cerebral es un síndrome con diferentes etiologías, por lo que sería imposible que una sola conducta terapéutica sea útil en todos los casos. Sin embargo, aunque varios factores patogénicos actúan en cada etiología, la mayoría confluye en el mecanismo de la trombosis. En consecuencia la terapia antitrombótica es una práctica habitual. Pero es fundamental la investigación del subtipo de ataque cerebral (cardioembólico, enfermedad arterioesclerótica de grandes arterias o de pequeñas arterias, enfermedad arterial no ateromatosa, etc.), pues la identificación de la causa permite establecer una terapia racional. El uso de anticoagulantes en el tratamiento de la patología isquémica cerebral es un tema de amplio debate. El objetivo del tratamiento anticoagulante es prevenir la presentación o recurrencia del embolismo. Las indicaciones están dirigidas fundamentalmente a la prevención primaria y secundaria de las embolias de origen cardiaco, pudiendo ser utilizada en el tratamiento de las trombosis venosas cerebrales, algunos estados protrombóticos y las disecciones arteriales. Se pueden utilizar los anticoagulantes orales (acenocumarol o warfarina), para el tratamiento prolongado. El rango terapéutico óptimo de la terapia anticoagulante es aún incierto. Es claro que el riesgo de complicaciones hemorrágicas es paralelo a la intensidad de la anticoagulación. El nivel de anticoagulación en un rango internacional normatizado (RIN) entre 2 y 3 ha mostrado menores complicaciones hemorrágicas a los rangos habitualmente indicados (RIN entre 3 y 4,5).En la actualidad, después de años de supremacía, el uso de antagonistas de vitamina K (acenocumarol o warfarina) puede ser reemplazado por los nuevos anticoagulantes orales, se incluyen inhibidores directos del factor Xa (apixaban, rivaroxaban, edoxaban) e inhibidores directos de la trombina (dabigatrán). Los estudios RE-LY, ARISTOTLE y ROCKET-AF, han permitido que distintas agencias gubernamentales hayan aceptado, o estén próximas a hacerlo, su uso para la prevención del stroke isquémico y la embolia sistémica en pacientes que presentan fibrilación auricular (FA). Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 19 Las cardiopatías, como potencial fuente embolígena pueden dividirse en: cardiopatías de alto riesgo y cardiopatías de bajo riesgo de embolización. A su vez dentro de cada tipo de cardiopatía se debería individualizar el nivel de riesgo de cada paciente considerando todos los factores. La fibrilación auricular no valvular (FANV) es la causa más frecuente de embolia cerebral de origen cardiaco. Se calcula que el riesgo de ataque cerebral es 5 veces mayor en los pacientes con FANV respecto a la población general, pero dicho riesgo varía dependiendo de otros factores. Varios estudios han mostrado el beneficio del uso de varios anticoagulantes orales en prevención primaria. La indicación es para todos los pacientes con FANV, excepto en pacientes jóvenes (menores de 60 años), con FANV aislada. El uso de anticoagulantes orales es la práctica aceptada en la prevención del stroke cardioembólico. Los antagonistas de la vitamina K (AVK) como la warfarina ocupan un sitio preferencial en el manejo de estos pacientes. A dosis ajustada la warfarina redujo la tasa de stroke en un 62%. Pero, como contrapartida, con niveles convencionales de anticoagulación, (RIN entre 2 y 3), el riesgo de hemorragia cerebral se incrementa 8 veces (cerca del 1% anual), además del 2% anual que experimenta hemorragias severas extracraneales. A esto último, debemos agregar sus limitaciones (estrecho margen terapéutico, necesidad de controles frecuentes, interacción con otras drogas y alimentos). Los estudios RE-LY, ARISTOTLE y ROCKET-AF evaluaron dabigatrán (220 mg/día) y (300 mg/día), apixabán (10 mg/día) o rivaroxaban (20 mg/día), en comparación con warfarina, mostrando que reducen el riesgo para stroke y embolia sistémica en un 9%, 34%, 21% y 12%, respectivamente. En cuanto a la posibilidad de complicaciones hemorrágicas, en comparación con warfarina, dabigatrán a 220 mg/día reduce el riesgo para hemorragia mayor en un 20%, dabigatrán a 300 mg/día en un 7% y apixaban en un 31%. Simultáneamente, el dabigatrán a 300 mg/día reduce el riesgo para stroke hemorrágico en un 74%, dabigatrán 220 mg/día un 69%, apixaban un 49% y el rivaroxaban un 41%, y es éste, a nuestro entender, el punto de mayor impacto de los nuevos agentes: una significativa reducción de la posibilidad de hemorragia intracraneal cuando se los compara con la warfarina. El uso de antiagregantes plaquetarios está ampliamente difundido y son varias las drogas que inhiben la función plaquetaria y la formación de trombos, aunque pocas han comprobado su utilidad clínica: aspirina, ticlopidina, clopidogrel y dipiridamol. Desde la década del setenta el beneficio de la aspirina en la reducción del riesgo de ataques cerebrales isquémicos ha sido reconocido por estudios a gran escala. La aspirina en dosis diarias de 30 a 1500 mg, reduce el riesgo de un nuevo ataque cerebral en un 20 a 25% en pacientes con AIT o infarto cerebral; la dosis más efectiva de aspirina permanece aún discutida, pero los metaanálisis sugieren como dosis ideal de aspirina entre 75 a 150 mg/día. Por otra parte, existen situaciones especiales en las que se discute la utilidad de la aspirina, una cifra aproximada del 25 al 30% de la población tomaba aspirina rutinariamente al momento de un evento vascular, pudiendo interpretarse como un “fracaso de la aspirina”; existen pacientes que tienen “resistencia a la aspirina”. El clopidogrel, la ticlopidina y el dipiridamol son agentes antiagregantes plaquetarios que podrían actuar como inhibidores de la vía de la adenosina difosfato de la agregación plaquetaria, no actuando sobre la ciclooxigenasa (mecanismo de acción de la aspirina). La elección de un antiagregante plaquetario en la prevención secundaria después de un AIT o de stroke isquémico debe ser individualizada de acuerdo al paciente, teniendo en cuenta los factores de riesgo, tolerancia y otras características clínicas. La aspirina (50 a 325 mg/día) reduce en alrededor de un 25% el riesgo de ataque cerebral, infarto agudo de miocardio y muerte vascular en pacientes con ateromatosis sintomática, siendo la droga de primera elección. No hay suficientes datos que avalen una recomendación de elección de otro antiagregante distinto de la aspirina. Las opciones aceptables para la terapia inicial son el clopidogrel y la combinación de aspirina y dipiridamol, con un nivel de evidencia menor. Combinar clopidogrel con aspirina mostró incrementar el riesgo de hemorragia, por lo cual sólo debería utilizarse en casos puntuales. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 20 En Abril del 2011, el NINDS discontinuó el estudio SAMMPRIS, que evaluaba dos estrategias para prevenir el stroke recurrente en pacientes con estenosis arterial intracraneal severa (70%-99%). Esto fue debido a que los stents se asociaron con peor resultado de lo esperado, y el tratamiento médico agresivo, con un número de eventos inferior al calculado. Este último incluía la doble antiagregación (325 mg/día de aspirina y 75 mg/día de clopidogrel durante 90 días), el control intensivo de los factores de riesgo (niveles muy bajos de presión arterial sistólica, importante reducción de niveles de colesterol LDL y modificaciones importantes del estilo de vida). Los autores plantearon que quizás, en la práctica clínica, no es sencillo cumplir con todos los objetivos del régimen médico agresivo, pero los elementos esenciales pueden fácilmente ser adoptados. El SPS3, tuvo como objetivo conocer si la combinación de antiagregantes plaquetarios (ácido acetilsalicílico más clopidogrel) es más eficaz que la antiagregación con aspirina sola; y si, el control intensivo de la presión arterial, en pacientes con infartos lacunares se asocia con menos eventos recurrentes y deterioro cognitivo. En julio de 2011, el Comité de Seguridad recomendó la suspensión de la rama de antiagregación combinada, debido a un aumento en el número de hemorragias sistémicas y el total de muertes, que todos los pacientes siguieran en terapia con aspirina y que se continuara, hasta la finalización del estudio, con la rama que evalúa el tratamiento hipotensor. Habitualmente, desaconsejamos la utilización rutinaria de la doble antiagregación por la posibilidad de hemorragias; pero, indudablemente, además de seleccionar la población en la que la vamos a indicar (subgrupo de pacientes de mayor riesgo que podría verse favorecido con esta conducta) y determinar su duración (periodo inicial post evento, por la mayor tasa de recurrencia); es necesario tener en cuenta cual es el evento hemorrágico en juego: hemorragia cerebral o sistémica. No dudamos del valor predictivo de discapacidad de la hemorragia intracraneal, pero deberíamos discutir con nuestros pacientes cual es el mal menor: si la probabilidad de una hemorragia digestiva o un stroke recurrente. Si bien la aspirina goza de buena salud, pues los distintos estudios demuestran las ventajas de su uso, creemos que deberíamos asumir mayores compromisos en búsqueda de más beneficios. Los subgrupos de alto riesgo justificarían el manejo más agresivo, al menos en los primeros meses post evento: combinación de clopidogrel con aspirina en los primeros 90 días y control enérgico de los factores de riesgo, incluyendo dosis altas de estatinas. Esta sería una conducta válida en pacientes con stroke isquémico y alguna de las siguientes condiciones: a. patología aterotrombótica severa de grandes arterias intracraneales, de vasos de cuello o del arco aórtico b. pacientes que ya estaban antiagregados con aspirina; c. con eventos a repetición a pesar del tratamiento médico estándar El uso de estatinas ha mostrado una disminución del riesgo relativo de stroke isquémico en estudios realizados en pacientes con enfermedad coronaria. La reducción del nivel de colesterol LDL puede no ser la única responsable de la disminución de eventos vasculares, planteándose los efectos no lipídicos de las estatinas, como la protección endotelial. Es discutible si la disminución del nivel de colesterol impacta con mayor beneficio en la patología coronaria que en la cerebrovascular. Es más, se ha planteado a la disminución marcada del nivel de colesterol, como un marcador de riesgo para hemorragia cerebral. El estudio SPARCL, utilizando altas dosis de atorvastatina (80 mg/día), mostró una reducción estadísticamente significativa en prevención secundaria del stroke isquémico con una disminución del riesgo absoluto de 2,2% a 5 años (OR ajustada de 0,84, Intervalo de Confianza del 95% [IC 95%] O,71-0,99; p= 0,03). En base a estas evidencias se recomienda el uso de estatinas para la prevención secundaria de un stroke isquémico, en pacientes preferentemente sin antecedentes de hemorragia cerebral y realizando una evaluación del costo beneficio en cada caso. Se requieren estudios que evalúen la utilidad de las estatinas en subgrupos específicos. El cuidadoso control y tratamiento de la HTA es fundamental en la prevención de la enfermedad cerebrovascular. En general se acepta por consenso que si la presión arterial en un adulto es ≤ 140 mmHg de sistólica y ≤ 90 mmHg de diastólica es “normal” pero no necesariamente “óptima”. En personas hipertensas sin stroke, se ha mostrado de manera consistente que la disminución de 10 mmHg en la presión sistólica se asocia a la reducción del riesgo para stroke de casi un 40%. Un metaanálisis de ensayos randomizados, mostró que en prevención primaria el tratamiento de la HTA produce una reducción del 38% de la incidencia de enfermedad cerebrovascular y una reducción del 16% de enfermedad coronaria. Observaciones epidemiológicas indican que la Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 21 presión arterial sistólica predice el riesgo para stroke de mayor manera que la presión arterial diastólica. En el estudio STOP, el tratamiento de la HTA leve o moderada en un grupo de pacientes con edades entre 70 y 84 años, disminuyó el riesgo de stroke en un 46%, enfatizando la importancia del tratamiento de la HTA en todos los grupos etarios, existiendo evidencias indudables del beneficio de la reducción de la presión arterial en la prevención de eventos vasculares. En prevención secundaria varios estudios (PROGRESS, HOPE, LIFE, SCOPE, MOSES) mostraron la efectividad del uso de hipotensores (inhibidores de la enzima convertidora, diuréticos, antagonistas del receptor de angiotensina), en la prevención del ataque cerebral, logrando una reducción de la incidencia de ataques cerebrales de alrededor de un 30%; este beneficio estaba presente aún en pacientes normotensos. El estudio PROGRESS (Perindopril Protection Against Recurrent Stroke) evaluó los efectos de la reducción de la presión arterial en 6105 pacientes con stroke isquémico y hemorrágico o AIT en los 5 años previos. Es un estudio randomizado, estratificado para el uso único (perindopril) o combinado (perindopril más indapamida) tanto en hipertensos (presión arterial sistólica >160 mmHg o diastólica >90 mmHg) como en pacientes no hipertensos. La combinación de perindopril con indapamida, alcanzando una reducción promedio de la presión arterial 12/5 mmHg, mostró una reducción del riesgo relativo (RRR) de stroke recurrente del 43% (IC95%, 30 a 54) y una RRR en el riesgo de eventos vasculares mayores (enfermedad coronaria) del 40% (IC95%, 29 a 49), con el efecto observable tanto en hipertensos como en normotensos. Un punto controvertido hasta este momento es si el beneficio depende del uso de una determinada droga (perindopril, ramipril, indapamida, candesartán, etc.) o si se relaciona exclusivamente con la disminución de las cifras de presión arterial. El reporte JNC-7 concluyó que "la tasa de stroke recurrente fue disminuida con la combinación de un IECA con un diurético tiazídico", pero existe la tendencia a pensar que la reducción de la incidencia de stroke y de todos los eventos vasculares se relaciona con el grado de disminución de la presión arterial alcanzado, independientemente de la droga utilizada. Una población especial son los pacientes añosos; éstos frecuentemente presentan aumento de la resistencia vascular y compromiso de la autorregulación, es aquí donde la disminución de la presión arterial puede traer una reducción de la perfusión cerebral. Ha sido postulado que existe una relación en forma de “J” entre la presión arterial y el riesgo de stroke, y que los niveles “óptimos” de presión arterial pueden traer un incremento de la frecuencia de stroke e isquemia cardiaca. Algunos estudios demostraron evidencia que la disminución de la presión arterial puede tener un efecto negativo en la función cognitiva, existiendo una relación en forma de U entre los niveles de presión arterial y el compromiso cognitivo; en pacientes con infartos lacunares sintomáticos la reducción de los niveles de presión arterial se asoció a compromiso cognitivo, y en hipertensos añosos el riesgo de compromiso cognitivo disminuía con el aumento de la presión arterial. Pocos estudios informan acerca del efecto del tratamiento hipotensor en la función cognitiva, siendo aún un tema de debate. Dos estudios mostraron resultados favorables (Syst-Eur y PROGRESS). En contraste, 3 estudios randomizados (SHEP, MCR y SCOPE) no mostraron efectos positivos sobre la función cognitiva o la memoria con terapia antihipertensiva. En el estudio SystEur el tratamiento activo con nitrendipina asociado o no a enalapril o hidroclorotiazida redujo la incidencia de demencia en un 50% (de 7.7 a 3.8 casos por 1000 pacientes/año). El tratamiento activo redujo la incidencia de demencia tanto de origen vascular como degenerativo, destacando la importancia de los factores de riesgo vascular también para la enfermedad de Alzheimer. En el estudio PROGRESS el compromiso cognitivo estuvo presente en el 9.1% del grupo tratado con perindopril asociado o no a indapamida, comparado con el 11.0% del grupo placebo (RRR: 19%; p=0.01). En un subestudio recientemente publicado se observó menor progresión del compromiso de sustancia blanca en el grupo tratado. Si bien en el estudio PROGRESS se incluyeron pacientes con antecedentes de stroke, el subtipo etiológico no fue considerado. La cirugía carotídea fue evaluada en distintos estudios controlados, en pacientes sintomáticos o asintomáticos. Los resultados del ensayo quirúrgico carotídeo europeo (ECST) y del norteamericano de endarterectomía de carótidas sintomáticas (NASCET) permiten deducir que en los pacientes con estenosis del 70 al 99% de la luz de la carótida interna extracraneal que han presentado un AIT o stroke menor, la endarterectomía sumada al tratamiento médico es el tratamiento de elección. Por el Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 22 contrario, en pacientes con estenosis menores de un 49%, no hay beneficio con la cirugía, siendo el tratamiento médico el de elección. En cuanto al grupo de pacientes con estenosis entre el 50% y el 69%, los datos obtenidos mostraron beneficio en varones, siendo el beneficio menos claro en mujeres, por lo que su indicación está controvertida. El estudio americano (NASCET) se efectuó en pacientes con lesiones sintomáticas, con AIT o stroke no deshabilitante, dentro de los 6 meses de producido el episodio, siendo mayor el beneficio dentro de las 2 primeras semanas de iniciada la sintomatología, determinando la indicación de cirugía carotídea cuando el riesgo quirúrgico es menor del 6%. Diferentes estudios (VA, ACAS y ACST) evaluaron el beneficio de la cirugía carotídea en pacientes asintomáticos. Estos randomizaron más de 5000 pacientes (3579 hombres y 1644 mujeres) presentando una muy baja tasa de complicaciones perioperatorias (menor de 3%). Los resultados mostraron que la endarterectomía carotídea en estenosis asintomática reduce el riesgo de stroke ipsilateral y de cualquier stroke en aproximadamente un 30%. Sin embargo, la reducción del riesgo absoluto es pequeña (aproximadamente 1% por año durante los primeros años de seguimiento). Por lo tanto, cualquier beneficio sería anulado por una tasa mayor de complicaciones perioperatorias y sólo en centros con tasas de complicación muy bajas se debe contemplar realizar cirugía en los pacientes asintomáticos. Por otro lado, mientras que hay un beneficio claro para los hombres, la cirugía no pareció ayudar a las mujeres. Un tema aún difícil es comparar la utilización de angioplastia transluminal asociada a la colocación de stent con la endarterectomía carotídea. Habitualmente nos encontramos con estudios con marcadas diferencias metodológicas, que han mostrado resultados dispares y sin claras diferencias a largo plazo, en pacientes con alto riesgo quirúrgico, por lo cual cuesta definir una conducta generalizada. Es generalmente aceptada como indicación de angioplastia transluminal asociada a la colocación de stent ante la presencia de “cuello hostil”, o una estenosis recurrente post endarterectomía, o condición médica de muy alto riesgo, o una estenosis quirúrgicamente inaccesible. El estudio CREST mostró que, como complicación, el stroke es más frecuente en pacientes en los que se utilizó angioplastia asociada a stent y las complicaciones coronarias son más frecuentes en pacientes con endarterectomía. El análisis del impacto en calidad de vida al año era peor en aquellos pacientes con stroke respecto al impacto del infarto de miocardio. Independiente de estos resultados, la indicación debe ser realizada en forma individual en cada paciente, y la elección del método de revascularización (endarterectomía, angioplastia), debería realizarse en base a la experiencia propia del centro. En la Tabla 5 se observan las intervenciones y recomendaciones publicadas en la Guía de práctica clínica sobre prevención primaria y secundaria de ictus (Med Clin (Barc) 2009;133:754-762). Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular Tabla 5 Intervenciones sobre los hábitos de vida (pruebas y recomendaciones) Medida Hábitos de vida Resultados (grado de evidencia) La moderación en el consumo de alcohol (2+), el cese del tabaquismo (2++), una dieta equilibrada (1++) y la actividad física regular (2++), reducen el riesgo para padecer un episodio vascular Recomendación (grado de recomendación) Adoptar estrategias orientadas a lograr cambios hacia hábitos de vida más saludables en personas sanas y precozmente en los pacientes que han tenido un ACV (A) Prevención Primaria Hipertensión Dislipemia Diabetes Obesidad Fibrilación auricular Estenosis carotídea asintomática Antiagregación Los diuréticos, IECA, ARA II y los calcioantagonistas reducen el riesgo para ACV y otros episodios vasculares. Los betabloqueantes son inferiores, en especial en ancianos (1++). El control intensivo de la presión arterial es beneficioso tanto en pacientes sin DBT como con DBT (1+) El tratamiento con estatinas disminuye el riesgo para ACV isquémico y otros episodios vasculares (1++) Hay dudas si el tratamiento intensivo de la glucemia disminuye los episodios vasculares mayores (1++). La disminución de la presión arterial y los niveles de colesterol en los pacientes con DBT reduce el riesgo para ACV (1++) Las intervenciones dietéticas y la actividad física en personas con sobrepeso u obesidad, son beneficiosas para reducir el peso y para el control de otros factores de riesgo vascular (1+) El tratamiento farmacológico disminuye el peso corporal y otros factores de riesgo en personas con obesidad en especial cuando se asocian a los cambios de hábitos de vida, aunque presenta efectos adversos frecuentes (1+) La cirugía reduce sustancialmente el peso en pacientes con obesidad mórbida (1+) Iniciar el tratamiento de la HTA con diuréticos tiazídicos, IECA, ARA II o calcioantagonistas, cuando no existan contraindicaciones (A). El tratamiento inicial con betabloqueantes se puede considerar en pacientes jóvenes con HTA no complicada (B). Mantener las cifras de presión arterial <140/90 mmHg (A) y <130/80 mmHg en pacientes con DBT (B) Iniciar tratamiento con estatinas en pacientes sin enfermedad vascular previa si presentan riesgo elevado (A) Mantener la glucemia dentro de parámetros normales (A), la presión arterial <130/80 mmHg y los niveles de colesterol LDL <100 mg/dl (B) Modificar los hábitos de vida como primera medida terapéutica en la obesidad (A) Considerar añadir tratamiento farmacológico durante un período limitado de tiempo (B) En pacientes con obesidad mórbida considerar la cirugía de manera individual (B) Iniciar tratamiento anticoagulante en los pacientes con En la FA no valvular el tratamiento FA no valvular con alto riesgo tromboembólico. En anticoagulante es más eficaz que el aquellos con bajo riesgo se recomienda aspirina (100 a antiagregante en la prevención de ACV, 300 mg/día) y en aquellos con riesgo moderado ambas pero causa más hemorragias graves (1++) estrategias son razonables (A) La TEAC en pacientes con estenosis Indicar TEAC en pacientes con estenosis carotídea significativa reduce el riesgo para ACV asintomática (>70%). Las técnicas endovasculares (1++), habiéndose demostrado pueden considerarse en pacientes con alto riesgo resultados superiores a las quirúrgico, ante dificultades técnicas de la TEAC o en intervenciones endovasculares (1+) el contexto de ensayos clínicos (B) La aspirina disminuye el riesgo para un No se encuentra recomendada la prevención primaria episodio vascular en prevención primaria de episodios vasculares con aspirina en la población (1++), con un aumento del riesgo general (A). Considerar el tratamiento con dosis de 100 hemorrágico relacionado con la dosis mg/día en pacientes con riesgo vascular elevado (1++) (continúa) 23 Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 24 Prevención secundaria Hipertensión El tratamiento antihipertensivo reduce el riesgo para recurrencia y de otros episodios vasculares en pacientes que han padecido ACV o AIT, independientemente de las cifras de presión arterial (1++). El mayor beneficio se obtiene con la combinación de IECA y diuréticos (1++) (Perindopril+indapamida) Iniciar tratamiento con IECA y diuréticos (Perindopril 4 mg/día+indapamida 2,5 mg/día) en pacientes con antecedentes de ACV o de AIT, en pacientes con presión arterial elevada o incluso normal. Dislipemia La atorvastatina en dosis elevadas reduce el riesgo para recurrencias en pacientes con ACV isquémico o AIT (1++), independientemente de los niveles iniciales de colesterol LDL (1++). No hay evidencia acerca de cuáles son los niveles objetivo de colesterol LDL en prevención secundaria Iniciar tratamiento con 80 mg/día de atorvastatina en pacientes con ACV isquémico o AIT aterotrombótico previo, independiente-mente de los niveles basales de colesterol LDL (A). Puede considerarse el tratamiento con otras estatinas (B). Los pacientes con antecedentes vasculares deben mantener niveles de colesterol LDL <100 mg/dl Diabetes Fibrilación auricular Estenosis carotídea sintomática Hay dudas si el tratamiento intensivo de la glucemia evita nuevos episodios vasculares mayores (1++). La disminución de la presión arterial y los niveles de colesterol reducen el riesgo para ACV (1++) En los pacientes con FA paroxística, persistente o permanente y con antecedentes de ACV, el tratamiento anticoagulante es más eficaz que el antiagregante para la prevención de nuevos episodios La TEAC ha demostrado ser beneficiosa en los pacientes con antecedentes de ACV isquémico o AIT y estenosis grave de la arteria carotídea (>50%), en especial cuando se la indica precozmente (1++) Mantener la glucemia dentro de parámetros normales, control estricto de la presión arterial y de los niveles de lípidos (A) Realizar tratamiento indefinido con anticoagulantes en los pacientes con FA paroxística, persistente o permanente que hayan padecido ACV isquémico cardioembólico y sin contraindicaciones formales (A) Realizar TEAC en pacientes con ACV isquémico o con AIT de menos de 6 meses de evolución y con estenosis >70%. Considerar TEAC cuando la estenosis es del 50 al 69%, de acuerdo al género, edad y a la presencia de otras comorbilidades (B). No realizar TEAC en pacientes con estenosis <50% (A). Las técnicas endovasculares pueden considerarse en pacientes con alto riesgo quirúrgico, ante dificultades técnicas de la TEAC o en el contexto de ensayos clínicos (B) Los antiagregantes plaquetarios (aspirina, dipiridamol y trifusal) Iniciar antiagregación plaquetaria con disminuyen el riesgo para episodios 100 a 300 mg/día de aspirina, vasculares en pacientes con alto combinación de aspirina con riesgo (1++). La combinación de dipiridamol de liberación sostenida aspirina y dipiridamol de liberación (50/400 mg/día), o clopidogrel (75 sostenida confiere eficacia adicional mg/día), en pacientes con ACV frente a la aspirina en prevención de Tratamiento antitrombótico isquémico o con AIT de etiología ACV recurrente y episodios vasculares cardioembólica (A) (1++) No se recomienda el tratamiento El tratamiento anticoagulante no ha anticoagulante de forma sistemática demostrado una eficacia superior al para la prevención de recurrencias en antiagregante para disminuir la pacientes con ACV isquémico o con recurrencia de ACV cardioembólico, AIT con mayor riesgo para hemorragias (1++) Modificado de Med Clin (Barc) 2009;133:754-762 ACV: accidente cerebrovascular; IECA: inhibidores de la enzima convertidora; ARA II: inhibidores de los receptores de angiotensina; HTA: hipertensión; DBT: diabetes; FA: fibrilación auricular; TEAC: tromboendarterectomía carotídea; AIT: accidente isquémico transitorio. Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 25 Conclusiones El factor de riesgo es una variable que aumenta la probabilidad para que una determinada enfermedad suceda en una población o en un individuo. Algunos de estos factores son inmodificables, tal es el caso de la edad, el género, la etnia o la herencia. Pero el mayor peso específico en prevención primaria lo constituyen los factores de riesgo modificables, entre los cuales la HTA es el más significativo para la enfermedad cerebrovascular. La importancia del reconocimiento temprano y el tratamiento agresivo de los diferentes factores de riesgo deriva de su alta prevalencia en la población, del grado de riesgo asociado y del relativo bajo costo de su control, cuyo resultado es una reducción importante de la morbimortalidad por enfermedad cerebrovascular. El conocimiento de esta patología permite identificar poblaciones e individuos de alto riesgo para padecer un stroke y, por lo tanto, planificar estrategias preventivas generales, así como medidas de prevención individuales. Con ello se puede lograr disminuir la incidencia, prevalencia y morbimortalidad del stroke. Olvidarse que la enfermedad cerebrovascular es un “accidente” e interpretarla como una “patología evolutiva y prevenible”, llevará a una práctica médica menos costosa y de mayor eficiencia. Actividades. Claves de respuesta 1. 2. 3. 4. 5. 6. 7. a b b c d b Ataque isquémico transitorio Extravasación de sangre parénquima cerebral dentro Infarto cerebral del Demencia con evidencia de enfermedad cerebrovascular Compromiso de la sustancia blanca periventricular con hiperintensidad en la resonancia e hipointensidad en la tomografía Deterioro cognitivo Leucoaraiosis X Caída del flujo focal que produce un área de necrosis celular Trastorno focal del sistema nervioso central y de la retina de etiología isquémica, de aparición brusca, de breve duración, con resonancia con técnica de difusión negativa Hemorragia intracerebral X X X X Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 26 Bibliografía Adams R; Albers G; Alberts M et al. Update to the AHA/ASA recommendations for the prevention of stroke in patients with stroke and transient ischemic attack. Stroke 2008;39:1647 Adams H Jr; Adams R; Brott T et al. Guidelines for the Early Management of Patients With Ischemic Stroke. A Scientific Statement from the Stroke Council of the American Stroke Association. Stroke 2003;34:1056 Adams H; Adams R; Del Zoppo G et al. Guidelines for the early management of patients with ischemic stroke: 2005 guidelines update a scientific statement from the Stroke Council of the American Heart Association/American Stroke Association. Stroke 2005;36(4):916 Adams H; Bendixen B; Kappelle J; Biller J; Lovess Gordon D; Marsh R. TOAST investigator. Classification of subtypes of acute ischemia stroke. Stroke 1993;24:35 Amarenco P; Labreuche J; Lavallee P; Touboul P. Statins in stroke prevention and carotid atherosclerosis: systematic review and up-to-date meta-analysis. Stroke 2004;35:2902 Amarenco P; Bogousslavsky J; Callahan A et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med 2006;355:549 Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002;324:71 Bamford J; Sandercock P; Dennis M et al. Classification and natural history of clinically identificable subtypes of cerebral infarction. Lancet 1991;337:1521 Barsan W; Brott T; Broderick J; Haley E; Levy D; Marler J. Time of hospital presentation in patients with acute stroke. Arch Int med 1993;153:2558 Bennett C; Connors J; Carwile J; Moake J; Bell W; Tarantolo S; McCarthy L; Sarode R; Hatfield A; Feldman M; Davidson C; Tsai H. Thrombotic thrombocytopenic purpura associated with clopidogrel. N Engl J Med 2000;342:1773 Bhatt D; Fox K; Hacke W; Berger P; Black H; Boden W; Cacoub P; Cohen E; Creager M; Easton J; Flather M; Haffner S; Hamm C; Hankey G; Johnston S; Mak K; Mas J; Montalescot G; Pearson T; Steg P; Steinhubl S; Weber M; Brennan D; Fabry-Ribaudo L; Booth J; Topol E; the CHARISMA Investigators. Clopidogrel and Aspirin versus Aspirin Alone for the Prevention of Atherothrombotic Events. N Engl J Med 2006;354:1706 Brott T; Hobson R; Howard G; Roubin G et al for the CREST Investigators. Stenting versus Endarterectomy for Treatment of Carotid-Artery Stenosis. N Engl J Med 2010;363:11 Caplan L; Mohr J; Kistler J et al. Thrombolysis-not a panacea for ischemic stroke. N Engl J Med 1997;337:1309 CAPRIE Steering Committee. A randomized, blinded, trial of Clopidogrel Versus Aspirin in Patients at Risk of Ischemic Events (CAPRIE): CAPRIE Steering Committee. Lancet 1996; 348:1329 Castillo V; Bogousslavsky J. Today classification of stroke. Cerebrovasc Dis 1997; 7 (Suppl): 5 Collins R; Peto R; MacMahon S; Hebert P; Fiebach N; Eberlein K; Godwin J; Oizilbash N; Taylor J; Hennekens C. Blood pressure, stroke and coronary heart disease. Part 2, short-term reduction in blood pressure: overview of randomised drug trials in their epidemiological context. Lancet 1990; 335:827 Chandratheva A, Geraghty O, Luengo-Fernández R, et al. ABCD 2 Score Predicts Severity Rather Than Risk of Early Recurrent Events After Transient Ischemic Attack. Stroke 2010;41:851 Chimowitz, M, Lynn, M, Derdeyn, CP, et al.. Stenting versus Aggressive Medical Therapy for Intracranial Arterial Stenosis. N Engl J Med 2011;365:993-1003 Connolly SJ, Ezekowitz MD, Yusuf S et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361:1139–51 Diener H; Bogousslavsky J; Brass L; Cimminiello C; Csiba L; Kaste M; Leys D; Matias-Guiu J; Rupprecht H for the MATCH Investigators. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebocontrolled trial. Lancet 2004;364:33 Diener HC, Weber R, Lip GYH, Hohnloser SH. Stroke prevention in atrial fibrillation: do we still need warfarin? Curr Opin Neurol 2012, 25:27–35 Firlik A; Kaufmann A; Wechsler L et al. Quantitative cerebral blood flow determinations in acute ischemic ataque cerebral-relationship to computed tomography and angiography. Stroke 1997;28:2208 Fisher M; Prichard J; Warach S. New magnetic resonance techniques for acute ischemic ataque cerebral. JAMA 1995;274:908 Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 27 Giles M, Rothwell P. Risk of stroke early after transient ischemic attack: systematic review and metaanalysis. Lancet Neurology 2007;6:1063 Granger CB, Alexander JH, McMurray JJ et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365:981–92 Guidelines for Prevention of Stroke in Patients with Ischemic Stroke or Transient Ischemic Attack. A Statement for Healthcare Professionals from the American Heart Association/American Stroke Association Council on Stroke: Co-Sponsored by the Council on Cardiovascular Radiology and Intervention: The American Academy of Neurology affirms the value of this guideline. Stroke . 2011;42:227-276 Hakim A. Ischemic penumbra: The therapeutic window. Neurology 1998; 51 (Suppl 3):S44 Hass W; Easton J; Adams H Jr; Pryse-Phillips W; Molony B; Anderson S; Kamm B. A randomized trial comparing ticlopidine hydrochloride with aspirin for the prevention of stroke in high-risk patients: Ticlopidine Aspirin Stroke Study Group. N Engl J Med 1989;321:501 High-Dose Atorvastatin after Stroke or Transient Ischemic Attack. The Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) Investigators. N Engl J Med 2006; 355:549 Luengo-Fernández E, Gray A, Rothwell P. Effect of urgent treatment for transient ischemic attack and minor stroke on disability and hospital costs (EXPRESS study): a prospective population-based sequential comparison. Lancet Neurol 2009;8:235 Lutsep H; Albers G; DeCrespigny A et al. Clinical utility of diffusion-weighted magnetic resonance imaging in the assessment of ischemic stroke. Ann Neurol 1997;41:574 National Institute of Neurological Disorders and Stroke. Classification of cerebrovascular disease III. Stroke 1990; 21: 637 Patel MR, Mahaffey KW, Garg J et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365:883–91 Proceedings of a National Symposium on Rapid Identification and Tratment of Acute Stroke. Editors: Marler, JR. The National Institute of Neurological Disorders and Stroke, National Institutes of Health. Bethesda, Maryland, 1997 PROGRESS Collaborative Group. Randomised trial of a perindopril-based blood pressure-lowering regimen among 6105 individuals with previous stroke or transient ischaemic attack. Lancet 2001;358:1033 Rey RC. Lepera SM. Entre errores y aciertos de los nuevos antitrombóticos. Neurolarg. 2011. 2;4(3):107–111 Ringleb P; Bhatt D; Hirsch A; Topol E; Hacke W for the Clopidogrel Versus Aspirin in Patients at Risk of Ischemic Events Investigators. Benefit of clopidogrel over aspirin is amplified in patients with a history of ischemic events. Stroke 2004;35:528 Rothwell P. External validity of randomised controlled trials: To whom do the results of this trial apply? Lancet 2004;365:82 Rothwell P. Carotid artery disease and risk of ischaemic stroke and coronary events. Atherosclerosis XIII. Elsevier. Volume 1262; 474 Rothwell P. Effective stroke prevention in patients with symptomatic carotid stenosis. Cerebrovascular Diseases 2004; 17(suppl 1):89 Rothwell P; Coull A; GilesM; Howard S; Silver L; Bull L; Gutnikov S; Edwards P; Mant D; Sackley C; Farmer A; Sandercock P; Dennis M; Warlow C; Bamford J; Anslow P. Changes in stroke incidence, mortality, casefatality, severity, and risk factors in Oxfordshire from 1981-2004: the Oxford Vascular Study. Lancet 2004;363:1925 Rothwell P; Eliasziw M; Gutnikov S; Warlow C; Barnett H for the Carotid Endarterectomy Trialists Collaboration. Effect of endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and to the timing of surgery. Lancet 2004;363:915 Rothwell P; Goldstein L. Carotid endarterectomy for asymptomatic stenosis: Asymptomatic Carotid Surgery Trial. Stroke 2004;35;2425 Rothwell P, Giles M, Flossmann E, et al. A simple score (ABCD) to identify individuals at high early risk of stroke after transient ischemic attack. Lancet 2005;366:29 Rothwell P, Giles M, Marquardt L, et al. Effect of urgent treatment of transient ischemic attack and minor stroke on early recurrent stroke (EXPRESS study): a prospective population-based sequential comparison. Lancet 2007;6:953 Saposnik G; Gonzalez L; Lepera S; Luraschi A; Sica R; Caplan L; Rey R. Southern Buenos Aires Stroke project. Acta Neurol Scand 2001:104:130 Curso de Capacitación de Posgrado a Distancia Síndrome Metabólico y Riesgo Vascular – Conjunto ABCBA Abril 2013 – Diciembre 2013 - Enfermedad Cerebrovascular 28 Sarasin F; Gaspoz J; Bounameaux H. Cost-effectiveness of new antiplatelet regimens used as secondary prevention of stroke or transient ischemic attack. Arch Intern Med 2000;160:2773 Taylor T; Davis P; Torner J et al. Lifetime cost of stroke in the United States. Stroke 1996;27:1459 The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC 7). Hypertension 2003;42:1206 Tong D; Yenari M; Albers G et al. Correlation of perfusion-and diffusion-weighted MRI with NIHSS score in acute (<6.5 hour) ischemic stroke. Neurology 1998;50:864 von Kummer R; Bourquain H; Bastianello S; Bozzao L; Manelfe C; Meier D; Hacke W. For the European Cooperative Acute Stroke Study II Group. Early Prediction of Irreversible Brain Damage after Ischemic Stroke at CT1. Radiology 2001;219:95 Secondary Prevention of Small Subcortical Strokes Trial "SPS3". Disponible en www.strokecenter.org/trials/clinicalstudies/secondary-prevention-of-small-subcortical-strokestrial/description. Último acceso 03 de enero 2013 Yusuf S; Zhao F; Mehta S; Chrolavicius S; Tognoni G; Fox K for the Clopidogrel in Unstable Angina to Prevent Recurrent Events Trial Investigators. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med 2001;345:494