Descarga
Anuncio
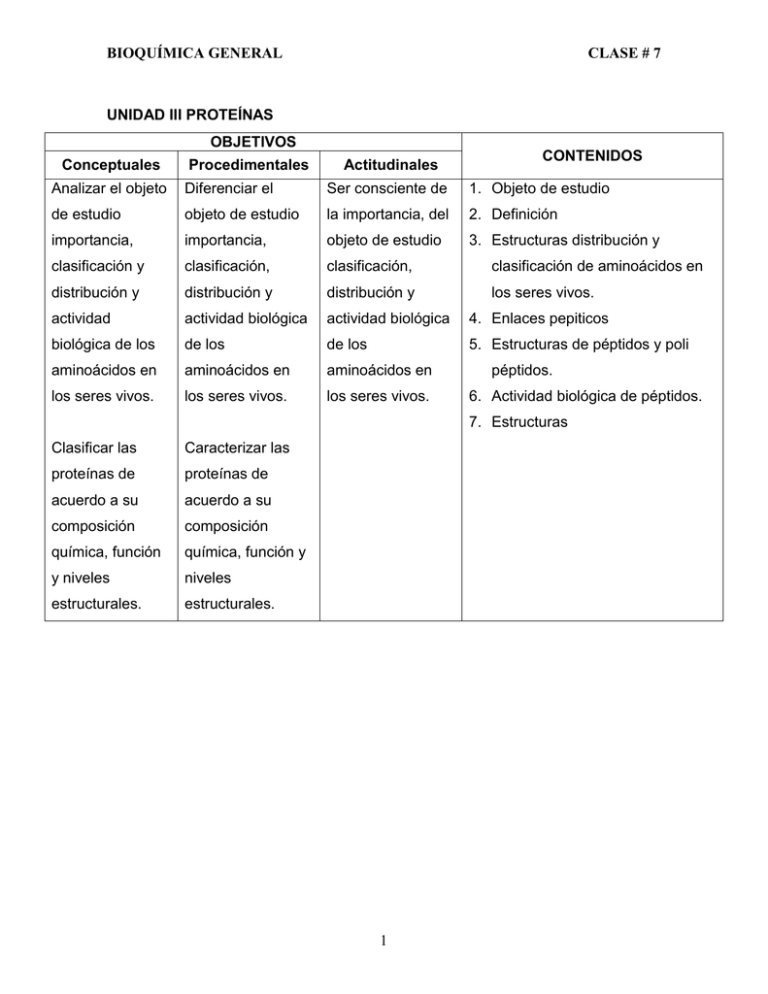
BIOQUÍMICA GENERAL CLASE # 7 UNIDAD III PROTEÍNAS OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto Diferenciar el Ser consciente de 1. Objeto de estudio de estudio objeto de estudio la importancia, del 2. Definición importancia, importancia, objeto de estudio 3. Estructuras distribución y clasificación y clasificación, clasificación, clasificación de aminoácidos en distribución y distribución y distribución y los seres vivos. actividad actividad biológica actividad biológica 4. Enlaces pepiticos biológica de los de los de los 5. Estructuras de péptidos y poli aminoácidos en aminoácidos en aminoácidos en los seres vivos. los seres vivos. los seres vivos. péptidos. 6. Actividad biológica de péptidos. 7. Estructuras Clasificar las Caracterizar las proteínas de proteínas de acuerdo a su acuerdo a su composición composición química, función química, función y y niveles niveles estructurales. estructurales. 1 BIOQUÍMICA GENERAL CLASE # 7 Proteios: significa los primero, este nombre se le dio porque se creía que las proteínas podrían ser lo primero de las células biológicas sin embargo los componentes esenciales de las células son proteínas. Los lípidos y los carbohidratos sirven como fuente de Energía y se almacenan en el cuerpo, las proteínas no se almacenan en cantidades apreciables para el mismo fin. Las proteínas Son los componentes más importantes del tejido animal tal como los carbohidratos lo son para las plantas. Las proteínas son componentes de la piel, uñas, pelo, lana, cuernos, pesuñas, músculos, tendones, tejido conectivo, tejido de sostén (cartílagos). Además interviene en la comunicación nervios, en anticuerpos, regulación metabólica (hormonas) catálisis bioquímica (enzimas) y transporte de oxígeno (hemoglobina) Las proteínas son las moléculas orgánicas que más abundan en los animales. Son polímeros (biopolímeros) naturales formados por unidades de los alfa aminoácidos. Existen muchos tipos y con variadas funciones. Eje. La Queratina: material que forma la estructura de las uñas. La Insulina: regula el metabolismo de la glucosa. Las funciones primordiales son las de desarrollo y mantenimiento del organismo, constituyen los 2/3 del peso seco total de las células, a diferencia de los carbohidratos y los lípidos, las proteínas no se almacenan en el cuerpo en cantidades apreciables. COMPOSICIÓN: Están constituidas fundamentalmente de C, H, O, N, S y P. En la mayor parte de ellas existe azufre, y en algunas fósforo y hierro. AMINOÁCIDOS PROTEICOS: Existen 20 unidades monoméricas de diferentes estructuras conocidos como aminoácidos, los cuales se caracterizan por ser aminoácidos y de la serie L que se encuentran en casi todas las proteínas. 2 BIOQUÍMICA GENERAL CLASE # 7 Actualmente se sabe que ciertas bacterias poseen formas D Eje Estreptococcus faecalis COOH H2NC-H R -aminoácido L-aminoácido AMINOÁCIDOS ESENCIALES Los seres humanos sólo podemos sintetizar aproximadamente la mitad de los aminoácidos que necesitamos para fabricar sus proteínas, los otros que se necesitan se deben obtener de la dieta y es a ellos que se les llama aminoácidos esenciales estos son los diez que aparecen en la tabla siguiente: en el reino vegetal existen más de 200 a.a en la naturaleza pero no son parte de las proteínas. a) b) c) d) e) Arginina (del esparrago) Treonina Lisina Valina Fenilalanina f) g) h) i) j) Triptófano Metionina Histidina Leucina Isoleucina Los alimentos que aportan todos los aminoácidos esenciales en la proporción correcta se llaman proteínas completas eje: carne, pescado, leche, huevos. Los adultos requieren 50 g de proteínas por día. Los alimentos que contienen proteínas y que les falta aminoácidos esenciales se llaman proteínas incompletas eje. Por lo general las proteínas vegetales, trigo (les falta lis) al arroz (le falta tre) maíz (le falta trp), los frijoles chícharos y demás leguminosas contienen las proteínas más completas pero les falta (met). 3 BIOQUÍMICA GENERAL Nombre CLASE # 7 pH abreviatura isoeléctrico tres letras (pH al cual el a.a existe Estructura del a.a. Señalados con asteriscos los esenciales como sal interna) Glicina gli 6.0 Alanina ala 6.0 Valina * val 6.0 Leucina * leu 6.0 Isoleucina * ile 6.0 Fenilalanina fen 5.5 Prolina pro 6.3 En forma de ión dipolar Serina ser 5.7 Treonina * tre 5.6 Tirosina tir 5.7 Asparagina * asn 5.4 4 BIOQUÍMICA GENERAL CLASE # 7 Glutamina gln 5.7 Triptofano * trp 5.9 Cisteína cis 5.0 Metionina * met 5.7 Ácido aspártico asp 2.8 Ácido glutámico glu 3.2 Lisina * lis 9.7 Arginina * arg 10.8 Histidina * his 7.6 5 BIOQUÍMICA GENERAL CLASE # 7 PROPIEDADES DE LOS AMINOÁCIDOS: a) Configuraciones D/L Con excepción de la glicina, los carbonos alfa de los aminoácidos son quirales, por tanto son posibles dos formas enantioméricas, pero la naturaleza solo utiliza el enantiómero (L) para construir las proteínas. D-alanina L-alanina b) Estructura Iónica Dipolar. Son sustancias anfotéricas. Los -aminoácidos contienen grupos ácidos y básicos en la misma molécula, por tanto pueden experimentar una reacción intramolecular ácido base y existir en la forma de un ión dipolar o doble ión. R – CH – COOH H2N R – CH – COO H3N+ Un ion dipolar (sal interna) Su naturaleza dipolar les confiere algunas propiedades como por ejemplo; son sales internas y por tanto presentan propiedades asociadas con las sales inorgánicas. 1. Son solubles en agua e insolubles en hidrocarburos. 2. Son sólidos cristalinos y con puntos de fusión altos 6 BIOQUÍMICA GENERAL CLASE # 7 3. Son incoloros y no volátiles 4. Son anfóteros, es decir pueden reaccionar como base y como ácidos En solución ácida y En solución básica. CAPACIDAD AMORTIGUADORA Las proteínas tienen un comportamiento anfótero y esto las hace capaces de neutralizar las variaciones de pH del medio, ya que pueden comportarse como un ácido o una base y por tanto liberar o retirar protones (H+) del medio donde se encuentran. c) pH isoeléctrico: Un -aminoácido tienen carga negativa en solución básica (pH alto) y una positiva en solución ácida (pH bajo). Debe haber un pH intermedio donde el -aminoácido esté balanceado entre las dos formas, como dipolar con carga cero. A este pH se le llama isoeléctrico o punto isoeléctrico. El pH isoeléctrico es aquel en el cual un aminoácido existe como ión dipolar. R – CH – COOH H3N+ pH bajo Catión (+) R—CH – COO +NH 3 pH isoeléctrico Un ión dipolar (0) 7 R – CH – COO H2N pH alto Un anión (-) BIOQUÍMICA GENERAL CLASE # 7 d) Enlace covalente entre aminoácidos. Los -aminoácidos pueden combinarse con pérdida de agua para producir polipéptidos o proteínas, en los péptidos (proteínas) los -aminoácidos sucesivos están unidos de modo covalente entre sí a través del grupo -carboxilo de un aminoácido y el grupo -amino del siguiente. El enlace amídico resultante se llama enlace peptídico En bioquímica cada posición de un péptido se llama residuo del -aa, cada cadena consta de un número de residuo los cuales van en una secuencia lineal con dos residuos terminales, un residuo terminal tendría un grupo amino libre (N – terminal) y otro tendrá un grupo carboxilo libre (C- terminal). De esta forma se pueden unir un número grande de -aa en una cadena. Un péptido es un polímero de -aa unidos por enlaces amida que se forma entre el grupo amino de cada -aa y el grupo carboxilo de un -aa vecino, por lo general tienen un P.M menor que 5000. Las proteínas contienen número mayor de unidades de -aa y su P.M van desde 6000 hasta 40,000,000 a veces se emplea el término oligopéptidos para péptidos que contienen de 4 a 10 residuos de -aa. Ejemplo. Bradicinina = hormona humana ayuda a controlar la presión sanguínea, está formada por 9 residuos. 8







