Equilibrio Ácido-Base - Departamento de Fisiopatología
Anuncio

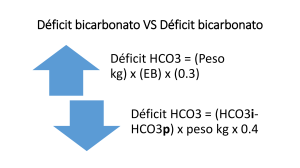
EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H+). HCl H+ + Cl- Base: es toda sustancia capaz de aceptar protones hidrógeno (H+). Concepto de pH: Se define como el logaritmo negativo en base 10 de la concentración de H+ pH = - log10 [H+] 1 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 [H+] M Ácido pH 0 1 2 Básico 3 4 5 6 7 8 9 10 11 12 13 14 CONCENTRACIÓN DE H+ La concentración normal de H+ en el líquido extracelular es de 40nEq/L, lo que corresponde a un pH 7,40. La importancia de la [H] está dada por la alta reactividad de éste con las proteínas, cambiando su función. PRODUCCIÓN DE H+ El principal producto ácido del metabolismo celular es el dióxido de carbono (CO2) 98% de la carga ácida total. Acido potencial su hidratación va a generar H2CO3 y luego la anhidrasa carbónica (A.C.) cataliza la formación de H y HCO3A.C CO2 + H2O H2CO3 H+ + HCO3- Acidos ácidos fijos 1-2% de la carga ácida y cuya principal fuente es el catabolismo oxidativo de los aminoácidos sulfurados de las proteínas. PRODUCCIÓN DE H • Carbohidratos y lípidos : 15.000 mM de CO2 • Aminoácidos: 50 a 100 mEq/día de H+ EQUILIBRIO ÁCIDO-BASE. Se entiende por equilibrio ácidobase el mantenimiento de la concentración de hidrogeniones dentro de parámetros normales, lo que se logra por la existencia de mecanismos de amortiguación SISTEMAS BUFFER. La defensa inmediata frente a los cambios de pH la proporcionan los sistemas buffers. Definición de sustancias buffers: consisten en una solución de un ácido débil y su base conjugada con la capacidad de captar o ceder protones lo que les permiten amortiguar los cambios en el pH. HA H+ + A- La eficiencia de un buffer depende principalmente de su concentración en el medio y de la relación existente entre el pKa de la ecuación y el pH del medio. BUFFER HEMOGLOBINA. BUFFER BICARBONATO/ÁCIDO CARBÓNICO Ventilación CO22 + H2O CO H2CO3 H+ + HCO HCO3-3Riñón • Principal buffers del LEC, comprende a su ácido débil H2 CO3 (ácido carbónico) y su base conjugada HCO3 (bicarbonato) . • La importancia de esta buffers esta dada por la posibilidad de regular de manera independiente las concentraciones de sus componentes; la concentración de CO2 por los pulmones y la de HCO3 por los riñones. ROL DEL PULMÓN. • La concentración de CO2 es inversamente proporcional a la ventilación alveolar. ROL DEL RIÑÓN. VALORES NORMALES. pH = 7,36 – 7,44 PaCO2 = 36 – 44 mm Hg HCO3- = 22 – 26 meq/L NOMENCLATURA. pH < 7,36 Acidemia pH > 7,44 Alcalemia PaCO2 < 36 mm Hg Hipocapnia PaCO2 >44 mm Hg Hipercapnia HCO3- = < 22 meq/L Hipobicarbonatemia HCO3- = > 26 meq/L Hiperbicarbonatemia ACIDOSIS METABÓLICA. La acidosis metabólica se caracteriza por un aumento en la concentración plasmática de H+ (acidemia) que determina una disminución primaria en la concentración de HCO3- Causas: Aumento en la producción de ácido. Disminución en la excreción de ácido, por el riñón. Pérdida de base por el tubo digestivo. AGUJERO ANIONICO. AA = [Na+]p – ( [HCO3-] p + [Cl-]p ) Na+ Na+ Cl- Cl- Valor normal del AA = 12 ± 4 (8-16) HCO3- HCO3HPO4SO42Ac.Org. K+ Ca++ Mg++ Pr- + - AGUJERO ANIÓNICO Respuesta adaptativa a la acidosis metabólica: Buffers Respuesta pulmonar: se inicia en las primeras horas, la acidosis y la caída en la concentración de bicarbonato, genera la estimulación de los quimiorreceptores, aumentando la ventilación Disminución promedio de 1,2 mmHg de PpCO2 por cada mEq/l de HCO3 PaCO2 esperada: 1,5 [ HCO3] + 8. ALCALOSIS METABÓLICA Se caracteriza por un aumento primario en la concentración de bicarbonato ( HCO3) y se acompaña de una disminución en la concentración plasmática de hidrogeniones, y por lo tanto de alcalemia. Causas: Pérdida de ácido por el riñón o por el tubo digestivo. Ganancia neta de bicarbonato por su administración. ALCALOSIS METABÓLICA Clasificación: Sensibles al Cloro. Resistentes al Cloro. Las alcalosis metabólicas se caracterizan por una fase de generación y una fase de mantenimiento, independientemente de su clasificación. Respuesta adaptativa a la alcalosis metabólica: buffer Se genera una hipoventilación por la inhibición del centro respiratorio. Asi se determina un aumento promedio de 0,7 mmHg de PaCO2 por cada mEq/l de aumenta el bicarbonato plasmático. PaCO2 esperada: 0,9[HCO3] + 16 ACIDOSIS RESPIRATORIA La acidosis respiratoria se caracteriza por un aumento primario de la PaCO2 y se acompaña de un aumento en la concentración plasmática de H+, o sea de acidemia. Causas: Hipoventilación. Desigualdad ventilación/ perfusión. Clasificación: Aguda Crónica. Respuesta adaptativa: Buffers. Respuesta renal, la acidosis respiratoria determina, la estimulación de la reabsorción máxima del bicarbonato filtrado, estimula la amoniogénesis y así la regeneración de nuevo bicarbonato. La respuesta de la acidosis respiratoria aguda determina aumento de HCO3 de 1 mEq/L por cada 10 mmHg de PaCO2. La respuesta a la AR crónica determina aumento de 3,5 mEq/L por cada 10mmHg de PaCO2, esta respuesta requiere de 3 a 5 días. ALCALOSIS RESPIRATORIA. Se caracteriza por una disminución primaria de la PaCO2 y se acompaña de una disminución en la concentración plasmática de H+, o sea de alcalemia. Causa Hiperventilación. ALCALOSIS RESPIRATORIA Clasificación: Agudas. Crónicas Respuesta adaptativa: Buffers. Respuesta renal, la cual requiere de 2 a 3 días para completarse, determina una disminución en la secreción de amonio y supresión de la reabsorción de bicarbonato. En agudo, la [HCO3] desciende 2 mEq/L por cada 10mmHg de descenso de la PaCO2. En la ALR crónica, la [HCO3] desciende 4-5 mEq/L por cada 10mmHg de descenso crónico de la PaCO2.