SOLUBILIDAD
Anuncio
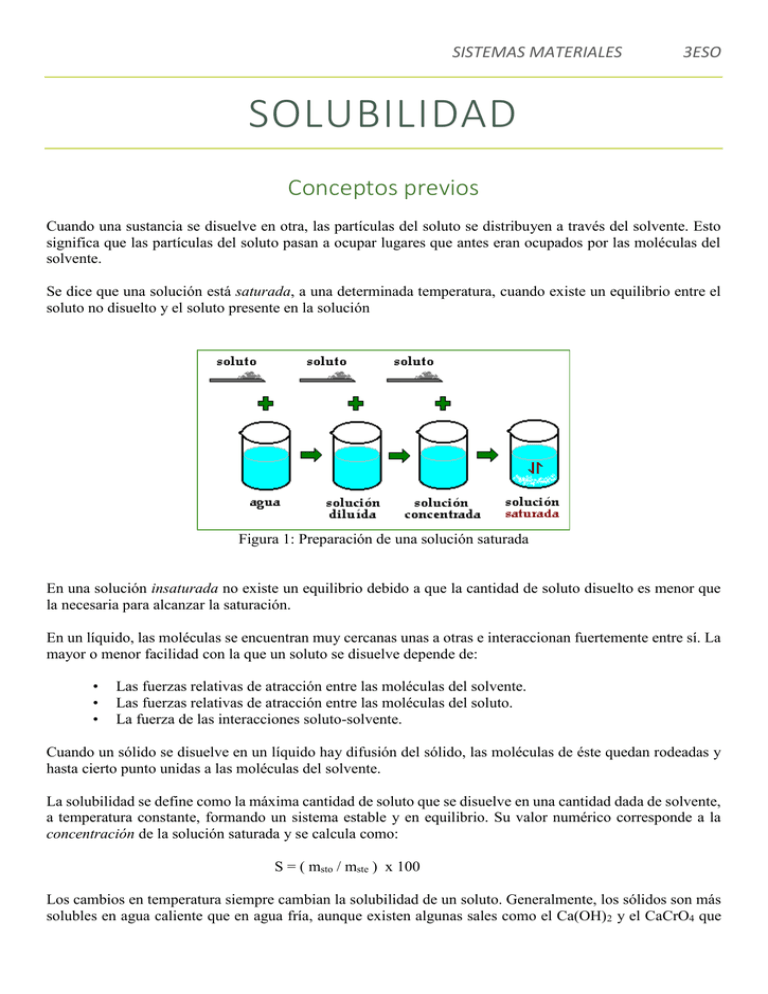
SISTEMAS MATERIALES 3ESO SOLUBILIDAD Conceptos previos Cuando una sustancia se disuelve en otra, las partículas del soluto se distribuyen a través del solvente. Esto significa que las partículas del soluto pasan a ocupar lugares que antes eran ocupados por las moléculas del solvente. Se dice que una solución está saturada, a una determinada temperatura, cuando existe un equilibrio entre el soluto no disuelto y el soluto presente en la solución Figura 1: Preparación de una solución saturada En una solución insaturada no existe un equilibrio debido a que la cantidad de soluto disuelto es menor que la necesaria para alcanzar la saturación. En un líquido, las moléculas se encuentran muy cercanas unas a otras e interaccionan fuertemente entre sí. La mayor o menor facilidad con la que un soluto se disuelve depende de: • • • Las fuerzas relativas de atracción entre las moléculas del solvente. Las fuerzas relativas de atracción entre las moléculas del soluto. La fuerza de las interacciones soluto-solvente. Cuando un sólido se disuelve en un líquido hay difusión del sólido, las moléculas de éste quedan rodeadas y hasta cierto punto unidas a las moléculas del solvente. La solubilidad se define como la máxima cantidad de soluto que se disuelve en una cantidad dada de solvente, a temperatura constante, formando un sistema estable y en equilibrio. Su valor numérico corresponde a la concentración de la solución saturada y se calcula como: S = ( msto / mste ) x 100 Los cambios en temperatura siempre cambian la solubilidad de un soluto. Generalmente, los sólidos son más solubles en agua caliente que en agua fría, aunque existen algunas sales como el Ca(OH)2 y el CaCrO4 que SISTEMAS MATERIALES 3ESO son más solubles en frío que en caliente. Otros compuestos como el NaCl presentan una solubilidad que varía ligeramente con la temperatura. En los compuestos cuya solubilidad aumenta al aume ntar la temperatura el proceso de disolución del soluto es endotérmico. Objetivos • Estudiar cómo varía la solubilidad en agua de un compuesto puro, con la temperatura. • Relacionar la solubilidad con el equilibrio que se establece entre el soluto disuelto y el soluto sin disolver en el momento de la saturación. Materiales y equipo KNO3, KClO3, Tubo de ensayo Termómetro Pinza para tubo Pipeta Aspirador de pipeta Balanza Vidrio de reloj Espátula Papel de filtro KBr, KCl, Pb(NO3)2 Procedimiento 1. Pesar exactamente la cantidad de sal que se especifica en la tabla 1 y colocarla en un tubo de ensayo (figura 2). 2. Añadir el volumen inicial de agua que se especifica en la tabla 1. Mezclar bien disolvente y soluto. 3. Introducir el termómetro. Figura 2 Disolución del soluto en caliente SISTEMAS MATERIALES 3ESO Tabla 1 Masa de soluto a utilizar en el experimento Soluto m (g) Vagua inicial (mL) KNO3 KClO3 KBr KCl Pb(NO3)2 4.00 2.00 5.00 5.00 4.00 3.00 5.00 5.00 10.00 4.00 Incremento (mL) 1.00 1.00 1.00 1.00 1.00 Vagua final (mL) 8.00 8.00 8.00 14.00 7.00 4. El sistema se calienta al baño María hasta que todo el soluto se haya disuelto. En este punto se suspende el calentamiento, se retira el tubo del baño y se agita suavemente con el termómetro hasta que se observe turbia la solución. En este momento la solución está saturada y su concentración corresponde a la solubilidad. Anotar la temperatura. 5. Posteriormente se añade cierto volumen de agua (tabla 1), se calienta nuevamente el sistema al baño María y cuando todo el soluto se ha disuelto se suspende el calentamiento, se retira el tubo del baño y se agita suavemente con el termómetro hasta que se observe turbia la solución. Si es necesario usar un baño con hielo. Anotar de nuevo la temperatura. 6. El proceso se repite hasta obtener un número suficiente de datos para construir un gráfico de solubilidad versus temperatura. Finalmente se procede de manera similar con los otros solutos. Datos y resultados Tabla 2 Solubilidad en agua de algunas sales KNO3 V T (ml) (ºC) S KClO3 V T (ml) (ºC) S KBr V T (ml) (ºC) S Pb(NO3)2 V T S (ml) (ºC) V (ml) KCl T (ºC) S * S se expresa como g sto / 100 g de agua y se calcula mediante la ecuación del apartado conceptos previos * recuerda que la densidad del agua es de 1g/cm3 SISTEMAS MATERIALES 3ESO EVALUACIÓN DEL CRITERIO C: PROCESAMIENTO Y EVALUACIÓN Se evalúan los aspectos i, ii, iv y v PRESENTAR INTERPRETAR Ofrecer para su exposición, observación, examen o consideración Utilizar los conocimientos y la comprensión para reconocer tendencias y extraer conclusiones a partir de determinada información INDICAR Especificar un nombre, un valor o cualquier otro tipo de respuesta corta sin aportar explicaciones ni cálculos EXPLICAR Exponer detalladamente ESBOZAR Exponer a grandes rasgos Presentar una crítica equilibrada y bien fundamentada que incluye una serie de argumentos, factores o DISCUTIR hipótesis. Las opiniones o conclusiones deberán presentarse de forma clara y justificarse mediante pruebas adecuadas DESCRIBIR Exponer detalladamente una situación, evento, patrón o proceso EVALUAR Sopesar las implicaciones y las limitaciones; juzgar las ideas, los trabajos, las soluciones o los métodos en relación con los criterios seleccionados. SISTEMAS MATERIALES 3ESO Discusión y análisis de resultados 1. Rellena la siguiente tabla: Fórmula del reactivo Nombre Aspecto del reactivo Pictograma (explicación y dibujo) KNO3 KClO3 KBr KCl Pb(NO3)2 2. Rellena la siguiente tabla adjuntando todos los cálculos necesarios para calcular la solubilidad para cada temperatura. Calcular la solubilidad de los solutos utilizados expresada como g sto / 100 g H2O y calculada como S = g sto / g H2O * 100. V (ml) KNO3 T (ºC) S V (ml) KClO3 T (ºC) S V (ml) KBr T (ºC) S Pb(NO3)2 V T S (ml) (ºC) V (ml) KCl T (ºC) S 3. Dibujar una gráfica de solubilidad de cada soluto versus temperatura (realiza directamente un gráfico comparativo). Recuerda que debes justificar los ejes y el tipo de gráfico. Analizar la gráfica obtenida. 4. ¿Qué conclusión se deriva de ella? Hallar la relación matemática entre solubilidad y temperatura para el KNO3. ¿Cuál es el reactivo más soluble? ¿Cuál el menos? 5. Utilizando la curva experimental determine qué masa de cada sal precipita si se enfría la solución desde 55 ºC hasta 30 ºC. 6. Calcular hasta qué temperatura debe enfriarse una solución saturada de KNO3 cuya solubilidad es de 60 g/100 g H2O para que ésta se reduzca hasta 30 g/100 g H2O. Tenga en cuenta sus datos experimentales. 7. Determinar si una solución de KNO3 que contiene 4.0 g de soluto en 10.0 g de agua a 40 °C está insaturada o saturada. 8. Se prepararon 335 g de solución saturada de KNO3 en agua a 45 °C. Si se evaporaron 55 g de agua de la solución y al mismo tiempo la temperatura se redujo hasta 25 °C, ¿qué masa de KNO3 recristalizará? 9. Establecer la diferencia entre solución saturada y solución sobresaturada. 10. ¿Qué son aguas duras? ¿En qué consiste el proceso de ablandamiento de dichas aguas?