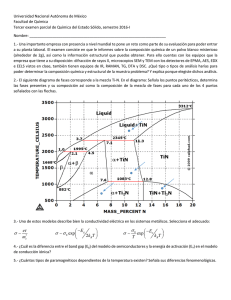
•Fugacidad •Coeficiente de Fugacidad •Corrección de Poynting
Anuncio

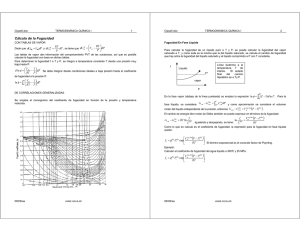
Dpto. Ingeniería Química •Fugacidad •Coeficiente de Fugacidad •Corrección de Poynting Prof.Dr. Juan A. Reyes-Labarta © http://iq.ua.es/~jareyes/ 30 © Fugacidad. Coeficiente de Fugacidad Dada la estrecha relación entre fugacidad y la presión se define el COEFICIENTE DE FUGACIDAD DEL COMPONENTE i EN LA FASE F como la relación entre la fugacidad de ese componente i de la fase F y su presión parcial si la fase F se comportara como un gas ideal ϕiF = fi F Pi ( gas ideal ) fi F = P· xiF f i F = P ⋅ x iF ⋅ ϕ iF Cálculo de la fugacidad de i en una fase real VOLUMEN MOLAR componente i PURO ⎡ 1 f i F = P · x iF exp ⎢ ⎣ RT ∫ P 0 ⎛ F RT ⎞ ⎤ ⎜ vi − ⎟ dP ⎥ P ⎠ ⎦ ⎝ VOLUMEN MOLAR PARCIAL componente i en la fase F ESTADO NORMAL O STANDARD del componente i: i puro a la misma P, T y en el mismo estado de agregación que la fase de que forma parte. Consecuencias: - El estado standard para un mismo componente en fases distintas puede ser distinto. Ejemplo: equilibrio L-V, S-L,.... - El estado standard puede ser hipotético. fi 0F = P·ϕ 0F i ⎡ 1 = P·exp ⎢ ⎣ RT ∫ P 0 ⎛ 0 F RT ⎞ ⎤ ⎜ vi − ⎟ dP ⎥ P ⎠ ⎦ ⎝ 31 © Fugacidad. Coeficiente de Fugacidad Por lo tanto, para relacionar fiF y fioF: f i = P · x ·ϕ F F i fi F i = P·ϕ 0F ⎡ 1 = P · x ·exp ⎢ ⎣ RT ⎡ 1 = P·exp ⎢ ⎣ RT 0F i Si dividimos y despejamos: fi = fi F ∫ F i 0F ⎡ 1 · x ·exp ⎢ ⎣ RT F i ∫ P 0 0 ⎛ F RT ⎞ ⎤ ⎜ vi − ⎟ dP ⎥ P ⎠ ⎦ ⎝ ⎛ 0 F RT ⎞ ⎤ ⎜ vi − ⎟ dP ⎥ P ⎠ ⎦ ⎝ ∫ (v P 0 P i F 0F i −v )dP⎤⎥⎦ Por tanto en mezclas ideales donde: F i v =v 0F i 0F f i = f i ·x F F i Vapor ideal Pi = P· yi Ley de Dalton Líquido 0 P = P · xi i i Ideal a bajas presiones Ley de Raoult 32 Fugacidad. Coeficiente de Fugacidad © Corrección de Poynting (ΨPi): Corrige la fugacidad de un componente i en una fases líquidas teniendo en cuenta la diferencia entre Piº (presión de vapor componente i, estado de referencia habitual de las fases líquidas) y P total del sistema (si ésta es importante). fi fi fi fi 0F 0L 0L 0L = P·ϕ = P·ϕ 0F i 0L i ⎡ 1 = P·exp ⎢ ⎣ RT ⎡ 1 = P·exp ⎢ ⎣ RT ∫ P 0 ∫ P 0 ⎛ 0 F RT ⎞ ⎤ ⎟dP ⎥ ⎜ vi − P ⎠ ⎦ ⎝ ⎛ 0 L RT ⎞ ⎤ ⎜ vi − ⎟dP ⎥ P ⎠ ⎦ ⎝ P ⎛ ⎡ 1 ⎡ Pio ⎛ 0V RT ⎞ ⎤⎤ RT ⎞ 0L = P·exp ⎢ ⎜ vi − ⎟dP + ∫P o ⎜ vi − ⎟dP + ⎥ ⎥ ⎢ ∫ 0 i P ⎠ P ⎠ ⎝ ⎦⎦ ⎣ RT ⎣ ⎝ ⎡ 1 = P·exp ⎢ ⎣ RT ∫ Pio 0 ⎡ 1 ⎛ 0V RT ⎞ ⎤ − ·exp v dP ⎜ i ⎟ ⎥ ⎢ RT P ⎝ ⎠ ⎦ ⎣ ⎛ 0 L RT ⎞ ⎤ ∫Pio ⎜⎝ vi − P ⎟⎠dP ⎥⎦ P 33 © Fugacidad. Coeficiente de Fugacidad Corrección de Poynting (ΨPi) fi 0L fi 0 fi L 0L ⎡ 1 = P·exp ⎢ ⎣ RT ∫ Pio 0 ⎡ 1 ⎛ 0V RT ⎞ ⎤ ⎟dP ⎥·exp ⎢ ⎜ vi − P ⎠ ⎦ ⎝ ⎣ RT 0L ⎡ vi P⎤ 0 V , Sat = P·ϕi ·exp ⎢ ·( P − Pi ) − Ln 0 ⎥ Pi ⎥⎦ ⎢⎣ RT ⎛ 0 L RT ⎞ ⎤ ∫Pio ⎜⎝ vi − P ⎟⎠dP⎥⎦ P Integrando y suponiendo v0Li cte con la presión 0L ⎡ ⎤ vi V , Sat Pi 0 = P·ϕi · ·exp ⎢ ·( P − Pi )⎥ P ⎢⎣ RT ⎥⎦ 0 Corrección de Poynting (ΨPi) fi 0L = P·ϕ 0L i = Pi ·ϕ o V , Sat i ·ψ P i 34 BIBLIOGRAFÍA general © - "Introducción a las operaciones de separación. Cálculo por etapas de equilibrio" A. Marcilla, Publicaciones de la Universidad de Alicante, 1998. (http://publicaciones.ua.es) - "Ingeniería Química 5. Transferencia de materia. 1ª p.". E. Costa Novella. Vol.5, Ed. Alhambra Universidad. 1988. - "Separation Processes". C.J. King. Ed. Mc. Graw Hill, Chemical Engineering Series, 2ª ed. Nueva York, 1988. - "Operaciones de Separación por etapas de equilibrio en Ingeniería Química". E.J. Henley y J.D. Seader. Ed. Reverté, Barcelona, 1998-2000. - "Chemical Engineering. II. V. Unit Operations". J.M. Coulson y J.F. Richardson. Ed. Reverté, Barcelona, 1979-1981. - “Operaciones de separación en Ingeniería Química: métodos de cálculo”. P. Martínez de la Cuesta; E. Rus Martínez. Madrid : Pearson- Prentice Hall, 2004. - “Termodinámica Molecular de los Equilibrios entre Fases”. Prausnitz, Lichtenthaler y Gomes de Azevedo, (2000). -“Introducción a la Termodinámica en Ingeniería Química”. Smith, Van Ness y Abbott, (1997). - “Phase Equilibrium in Process Design”. Null, Harold R. Ed. Wiley Interscience,1970. - “Multicomponent Distillation”. Holland, C.D., Prentice Hall. Englewood Cliff. Nueva Jersey, 1963. - “Distillation”. Van Winkle, Ed. McGraw Hill, Nueva York, 1968. -“Calcul sur Ordinateur des Equilibres Liquide-Vapeur et Liquide-Liquide”. Renon, H., Asselineau, L., Cohen, G. y Rimbault, Technip, Paris, 1971. 35