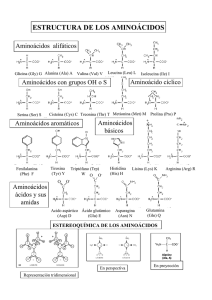
INHIBIDORES DE SERINA-PROTEASA.(ES2241197)
Anuncio

19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS 11 Número de publicación: 2 241 197 51 Int. Cl. : C12N 15/12, C12N 15/11 7 C07K 14/81, C07K 16/38 A61K 31/70, A61K 38/57 A61K 48/00, G01N 33/68 C07H 21/04 ESPAÑA 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 98966667 .2 86 Fecha de presentación : 23.12.1998 87 Número de publicación de la solicitud: 1040190 87 Fecha de publicación de la solicitud: 04.10.2000 54 Título: Inhibidores de serina-proteasa. 30 Prioridad: 23.12.1997 DE 197 57 572 08.01.1998 DE 198 00 363 45 Fecha de publicación de la mención BOPI: 16.10.2005 73 Titular/es: Pharis Biotec GmbH Feodor-Lynen-Strasse 31 30625 Hannover, DE 72 Inventor/es: Forssmann, Wolf-Georg; Mägert, Hans-Jürgen; Ständker, Ludger y Kreutzmann, Peter 45 Fecha de la publicación del folleto de la patente: 74 Agente: Tavira Montes-Jovellar, Antonio ES 2 241 197 T3 16.10.2005 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid ES 2 241 197 T3 DESCRIPCIÓN Inhibidores de serina-proteasa. 5 La invención se refiere a inhibidores de la serin-proteinasa, a ADNc que codifica inhibidores de la serin-proteinasa, a medicamentos que contienen los inhibidores o los ácidos nucleicos que los codifican, a usos de los compuestos según la invención para la fabricación de medicamentos para el tratamiento de diferentes indicaciones, a anticuerpos o fragmentos de anticuerpos contra epítopos de los compuestos según la invención, así como a polinucleótidos u oligonucleótidos que hibridan con genes de los compuestos según la invención. 10 15 20 25 30 35 40 Los procesos proteolíticos juegan en todos los organismos un importante papel fisiológico, debiéndose diferenciar entre reacciones proteolíticas inespecíficas y específicas. A las citadas en primer lugar pertenecen, por ejemplo, la digestión de los alimentos en el tracto digestivo por medio de endopeptidasas, así como la degradación intracelular de sustancias endógenas utilizadas y del material fagocitado, por medio de proteinasas lisosómicas. Las proteólisis específicas sirven, muy a menudo, para la conversión de una pro-enzima en su forma activa, tal como en la conversión de tripsinógeno en tripsina y quimio-tripsinógeno en quimio-tripsina, así como en las cascadas de calicreína-quinina y la cascada de la coagulación de la sangre. Dependiendo de la naturaleza del centro reactivo de las proteinasas que intervienen, éstas se subdividen en las clases de serin-proteinasas (por ejemplo, quimio-tripsina, tripsina, elastasa y catepsina G), las aspartato-proteinasas (por ejemplo, catepsina D, catepsina E y pepsina), las cistein-proteinasas (por ejemplo, catepsina B, catepsina H y catepsina L), y las metalo-proteinasas (por ejemplo, colagenasa y termolisina). Para poder contrarregular los procesos proteolíticos que, a menudo, se desarrollan en forma de cascada, el organismo dispone de una serie de otras proteínas, los inhibidores de proteinasas (véanse Laskowski y Kato, 1980, y Bode y Huber, 1992). De esta forma, los inhibidores de proteinasa plasmática humanos α1 -anti-quimio-tripsina y los inhibidores de la α1 -proteinasa, sintetizados en el hígado, protegen el tejido pulmonar contra ataques inespecíficos causados por las proteinasas catepsina G o elastasa de los linfocitos polimorfonucleados. Cuando existe un desequilibrio entre proteinasas y sus inhibidores específicos, se puede producir la aparición de efectos patológicos. De este modo, por ejemplo, una relación excesiva de elastasas al inhibidor de la α1 -proteinasa incrementa en pacientes con un déficit genéticamente condicionado de este factor el riesgo de formación de un enfisema pulmonar en aproximadamente 20 hasta 30 veces con respecto a la población normal (Carrel y Owen, 1980). En los fumadores, la formación del enfisema se ve favorecida por la oxidación del aminoácido metionina, que se encuentra en el centro reactivo del inhibidor de la α1 -proteinasa, causada por los oxidantes contenidos en el humo de los cigarrillos (Miller y Kuschner, 1969; Ohlsson et al., 1980). También en el caso de la infección por bacterias gram-negativas, sus endotoxinas pueden provocar la desintegración de los fagocitos y, con ella, el vertido de proteinasas lisosómicas. Debido al consumo aumentado de inhibidores de proteinasas, esto puede dar lugar a lesiones tisulares e inflamaciones incontroladas. Por este motivo, determinados inhibidores de proteinasas poseen un elevado potencial terapéutico (véase, por ejemplo, Fritz, 1980). El problema técnico sobre el que se basa la invención consiste en poner a disposición otros inhibidores de serinproteinasas adicionales. Además, se deben poner a disposición los genes o el ADNc que codifican los inhibidores según la invención. Una característica específica de los inhibidores de serin-proteinasas según la invención es que el inhibidor de serienproteinasa tiene un dominio con cuatro cisteínas y la secuencia entre la primera y segunda cisteína se selecciona de 45 50 55 la secuencia entre la segunda y tercera cisteína se selecciona de 60 65 2 ES 2 241 197 T3 y la secuencia entre la tercera y cuarta cisteína se selecciona de AT, AL, AAM, SM o TM. 5 Se prefiere especialmente que el inhibidor de la serin-proteinasa se corresponda con una las fórmulas 10 15 20 25 30 en las que R1 es NH2 , un aminoácido o un péptido con hasta 100 aminoácidos, y R2 es COOH, CONH2 , un aminoácido o un péptido con hasta 100 aminoácidos. 35 40 Representantes preferidos de los inhibidores de serin-proteinasas según la invención son los compuestos HF 6479 y HF 7665, así como fragmentos de las proteínas VAKTI-1 y VAKTI-2, según las Figuras 1 y 2. A partir de las Figuras 1 a 3 es posible obtener, además de la secuencia de aminoácidos de los compuestos preferidos según la invención, también otras informaciones relativas al ADNc que codifica los compuestos según la invención. De forma particular, se indican los puntos de hibridación de los correspondientes motivos y cebadores. El compuesto HF 3479 según la invención tiene una masa de 6.479 Dalton y la de HF 7665 asciende a 7.665 Dalton. Ambos han sido purificados de un hemofiltrado. 45 De acuerdo con la invención, se reivindica también un ADNc que codifica los compuestos según la invención, en especial un ADNc con una secuencia de ácidos nucleicos según las Figuras 1 a 2. Los compuestos según la invención son adecuados como medicamentos. Eventualmente, se administran junto con vehículos farmacéuticamente aceptables. 50 55 Los medicamentos según la invención, que contienen los inhibidores de proteinasa según la invención, se administran, preferentemente, en cantidades de 1 hasta 100 mg/kg de peso corporal del paciente. Como formas de administración, se consideran todas las preparaciones galénicas para principios activos peptídicos. Los medicamentos que contienen ácidos nucleicos, de acuerdo con la invención, se administran, preferentemente, en cantidades de 0,1 hasta 100 mg/kg de peso corporal correspondiente del paciente. En este caso, como formas de administración galénicas se toman en consideración aquéllas que son adecuadas para la administración de ácidos nucleicos, sin que los ácidos nucleicos resulten inactivados antes de alcanzar su objetivo de acción por influencias metabólicas. Como forma de administración galénica se pueden utilizar, por ejemplo, liposomas, en cuyo interior se encuentran los ácidos nucleicos. 60 Los polipéptidos según la invención, en especial VAKTI-1 y VAKTI-2, pueden servir para la fabricación de anticuerpos o fragmentos de anticuerpos. Éstos se preparan, de forma simplificada, por inmunización de mamíferos adecuados. Mediante operaciones en sí conocidas, es posible también humanizar los anticuerpos. 65 Los compuestos según la invención se pueden preparar, de forma sencilla, mediante métodos en sí conocidos de la síntesis de péptidos o nucleótidos. Asimismo, nada se opone a la preparación de los compuestos por tecnología génica. 3 ES 2 241 197 T3 5 10 El experto en la técnica reconoce que en los polipéptidos según la invención también se pueden utilizar fragmentos, con la condición de que conserven las propiedades inhibitorias de los inhibidores de la serin-proteinasa. La detección de estos fragmentos es conocida por el experto en la técnica. De esta forma, por ejemplo, ésta tiene lugar por la separación enzimática dirigida de los compuestos según la invención. También se pueden utilizar aminoácidos modificados en las cadenas laterales. También se toman en consideración polipéptidos modificados en sus extremos terminales N y C. De manera particular, se pueden utilizar polipéptidos fosforilados, glicosilados, metilados, acetilados o modificados de forma similar, con la condición de que éstos no afecten de modo relevante al efecto de los inhibidores de serinproteinasa. En el caso de los ácidos nucleicos según la invención, se toman en consideración los derivados con estructuras de triplete modificadas según el codón de empleo. Adicionalmente, se entienden como ácidos nucleicos según la invención también aquéllos que, con respecto a los compuestos nativos, están menos intensamente degradados por la acción de las nucleasas, por ejemplo, los correspondientes derivados SODN que se utilizan habitualmente en la tecnología anti-sentido para generar estructuras antisentido más estables frente a los ataques enzimáticos. 15 20 25 También con los polipéptidos se toman en consideración estructuras homólogas. Se trata, en especial, de estructuras polipeptídicas en las que los aminoácidos están intercambiados. De este modo, por ejemplo, se pueden considerar las siguientes sustituciones conservadoras de aminoácidos en regiones altamente conservadas: cada aminoácido isoleucina, valina y leucina puede estar intercambiado contra otro de estos aminoácidos; el aspartato puede estar intercambiado contra glutamato y a la inversa, glutamina contra asparagina y a la inversa, serina contra treonina y a la inversa. Las sustituciones conservadoras de aminoácidos en regiones menos altamente conservadas pueden ser las siguientes: cada uno de los aminoácidos isoleucina, valina y leucina contra cada otro aminoácido, aspartato contra glutamato y a la inversa, glutamina contra asparagina y a la inversa, serina contra treonina y a la inversa, glicina contra alanina y a la inversa, alanina contra valina y a la inversa, metionina contra cada uno de los aminoácidos leucina, isoleucina o valina, lisina contra arginina y a la inversa, uno de los aminoácidos aspartato o glutamato contra uno de los aminoácidos arginina o lisina, histidina contra uno de los aminoácidos arginina o lisina, glutamina contra glutamato y a la inversa, y asparagina contra aspartato y a la inversa. El mecanismo de acción de los péptidos según la invención se explica por medio del siguiente Ejemplo. 30 Ejemplo Medición de la inhibición de proteinasa por HF 7665 35 40 Fórmula de medición 84 µl 1 µl 5 µl 10 µl Tampón de medición (HEPES 0,1 M, pH 7,5; NaCl2 0,5 M) Tripsina (1 mg/ml en HCl 1 mM, CaCl2 20 mM) L-BABNA (6 mg/ml de hidrocloruro de Nα-benzoil-L-arginina- p-nitroanilida) Inhibidor de proteinasa (75 µg/ml de HF 7665 ó 10 µM, en H2 O). 45 La reacción se inició mediante la adición del sustrato cromogénico, seguida de la conversión del sustrato mediante el fotómetro a λ = 405 nm. Después de aproximadamente cinco minutos, se agregaron 10 µl de inhibidor de proteinasa o de los correspondientes controles, y se observó la evolución adicional de la extinción. 50 Se pudo demostrar que HF 7665, a una concentración final de aprox. 1 µm ó 7,5 µg/ml posee un efecto inhibitorio sobre la tripsina. Los ensayos de control con cantidades correspondientes de BSA (7,5 µg/ml) y acetonitrilo/TFA (ACN al 0,8%/TFA al 0,001%) no mostraron inhibición alguna de tripsina. Adicionalmente, no se demostró ningún efecto inhibitorio de HF 7665 sobre la quimio-tripsina en un ensayo similar. La Figura 3 muestra que, tras la adición de HF 7665, la conversión del sustrato se reduce en aprox. 30% por la inhibición de tripsina. 55 60 65 4 ES 2 241 197 T3 REIVINDICACIONES 5 1. Inhibidor de la serin-proteinasa, caracterizado porque la secuencia de los dominios entre la primera y segunda cisteína se selecciona de 10 15 20 la secuencia entre la segunda y la tercera cisteína de los dominios se selecciona de 25 30 35 y la secuencia entre la tercera y la cuarta cisteína de los dominios se selecciona de AT, AL, AM, SM o TM. 2. Inhibidor de la serin-proteinasa según la reivindicación 1, con una de las fórmulas 40 45 50 55 60 65 en las que R1 es un aminoácido o un péptido con hasta 1.000 aminoácidos, y R2 es COOH, CONH2 , un aminoácido o un péptido con hasta 1.000 aminoácidos. 5 ES 2 241 197 T3 3. Inhibidor de la serin-proteinasa según al menos una de las reivindicaciones 1 y/ó 2, caracterizado porque se trata de un fragmento de VAKTI-1 (Seq. ID. Nº 1) o VAKTI-2 (Seq. ID. Nº 2). 5 4. Inhibidor de la serin-proteinasa según la reivindicación 3, caracterizado porque se trata de HF 6479 (Seq. ID Nº 3) o HF 7665 (Seq. ID Nº 4). 5. Ácido nucleico, que codifica un inhibidor de la serin-proteinasa según al menos una de las reivindicaciones 1 a 4. 10 15 6. Medicamento que contiene al menos un inhibidor de la serin-proteinasa según al menos una de las reivindicaciones 1 a 4, y/o un ácido nucleico según la reivindicación 5, eventualmente con vehículos farmacéuticos. 7. Medicamento según la reivindicación 6, que contiene 0,01 hasta 1.000 mg/kg de peso corporal del inhibidor de la serin-proteinasa según al menos una de las reivindicaciones 1 a 4, y/o del ácido nucleico según la reivindicación 5. 8. Anticuerpo o fragmento de anticuerpo contra epítopos de los compuestos según una de las reivindicaciones 1 a 4. 20 9. Polinucleótidos u oligonucleótidos que hibridan, bajo condiciones rigurosas, con regiones del ADNc o del correspondiente ARN, e impiden la expresión de regiones codificadoras de los genes que codifican los compuestos según las reivindicaciones 1 a 4 (compuestos antisentido). 10. ADN que codifica los compuestos mencionados en las reivindicaciones 1 a 4. 25 11. ADN según la reivindicación 10, con la Seq. ID Nº 5 o la Seq. ID Nº 6. 30 35 40 45 50 55 60 65 6 ES 2 241 197 T3 7 ES 2 241 197 T3 8 ES 2 241 197 T3 9 ES 2 241 197 T3 10 ES 2 241 197 T3 11 ES 2 241 197 T3 12 ES 2 241 197 T3 LISTA DE SECUENCIAS (1) DATOS GENERALES: 5 (i) SOLICITANTE: (A) NOMBRE: Prof. Dr. Wolf-Georg Forssmann (B) CALLE: Feodor-Lynen, 31 10 (C) CIUDAD: Hannover (D) PAÍS: Alemania (E) CÓDIGO POSTAL: 30625 (ii) DENOMINACIÓN DE LA INVENCIÓN: Inhibidores de serin-proteinasas 15 (iii) NÚMERO DE SECUENCIAS: 34 (iv) EDICIÓN DE LECTURA INFORMATIZADA: (A) SOPORTE DE DATOS: Disquete 20 (B) ORDENADOR: PC IBM-compatible (C) SISTEMA OPERATIVO: PC-DOS/MS-DOS (D) SOFTWARE: PatentIn Release nº 1.0, version nº 1.30 (EPA) 25 (2) DATOS ACERCA DE LA SEQ ID NO: 1: (i) CARACTERÍSTICAS DE LA SECUENCIA: 30 (A) LONGITUD: 177 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 35 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 1: 40 45 50 55 60 65 1 ES 2 241 197 T3 (2) DATOS ACERCA DE LA SEQ ID NO: 2: (i) CARACTERÍSTICAS DE LA SECUENCIA: 5 (A) LONGITUD: 922 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 10 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 2: 15 20 25 30 35 40 45 50 55 60 65 2 ES 2 241 197 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 3 ES 2 241 197 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 4 ES 2 241 197 T3 (2) DATOS ACERCA DE LA SEQ ID NO: 3: (i) CARACTERÍSTICAS DE LA SECUENCIA: 5 (A) LONGITUD: 55 aminoácidos a. TIPO: Aminoácidos b. FORMA DE CADENA: Cadena sencilla c. TOPOLOGÍA: Desconocida 10 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 3: 15 20 25 (2) DATOS ACERCA DE LA SEQ ID NO: 4: (i) CARACTERÍSTICAS DE LA SECUENCIA: 30 (A) LONGITUD: 68 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla 35 (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 4: 40 45 50 55 (2) DATOS ACERCA DE LA SEQ ID NO: 5: (i) CARACTERÍSTICAS DE LA SECUENCIA: 60 (A) LONGITUD: 748 pares de bases (B) TIPO: Nucleótido (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 65 (ii) TIPO DE MOLÉCULA: ADNc (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 5: 5 ES 2 241 197 T3 5 10 15 20 25 (2) DATOS ACERCA DE LA SEQ ID NO: 6: 30 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 3.531 pares de bases (B) TIPO: Nucleótido 35 (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: ADNc 40 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 6: 45 50 55 60 65 6 ES 2 241 197 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 7 ES 2 241 197 T3 5 10 15 20 25 30 (2) DATOS ACERCA DE LA SEQ ID NO: 7: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos 35 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 40 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 7: 45 His Glu Phe Gln Ala Phe Met Lys Asn Gly Lys Leu Phe 1 5 10 (2) DATOS ACERCA DE LA SEQ ID NO: 8: (i) CARACTERÍSTICAS DE LA SECUENCIA: 50 (A) LONGITUD: 13 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla 55 (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 8: 60 Ser Glu Tyr Arg Lys Ser Arg Lys Asn Gly Arg Leu Phe 1 5 10 (2) DATOS ACERCA DE LA SEQ ID NO: 9: 65 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos 8 ES 2 241 197 T3 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 5 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 9: 10 Asp Asp Phe Lys Lys Gly Glu Arg Asp Gly Asp Phe Ile 1 5 10 (2) DATOS ACERCA DE LA SEQ ID NO: 10: 15 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos (B) TIPO: Aminoácidos 20 (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido 25 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 10: Ser Glu Phe Arg Asp Gln Val Arg Asn Gly Thr Leu Ile 1 5 10 30 (2) DATOS ACERCA DE LA SEQ ID NO: 11: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos 35 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 40 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 11: 45 Ser Ala Phe Arg Pro Phe Val Arg Asn Gly Arg Leu Gly 1 5 10 (2) DATOS ACERCA DE LA SEQ ID NO: 12: (i) CARACTERÍSTICAS DE LA SECUENCIA: 50 (A) LONGITUD: 13 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla 55 (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 12: 60 Ser Glu Tyr Arg His Tyr Val Arg Asn Gly Arg Leu Pro 1 5 10 (2) DATOS ACERCA DE LA SEQ ID NO: 13: 65 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos 9 ES 2 241 197 T3 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 5 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 13: 10 Lys Glu Tyr Glu Lys Gln Val Arg Asn Gly Arg Leu Phe 1 5 10 (2) DATOS ACERCA DE LA SEQ ID NO: 14: 15 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos (B) TIPO: Aminoácidos 20 (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 14: 25 Asp Glu Phe Arg Arg Leu Leu Gln Asn Gly Lys Leu Phe 1 5 10 30 (2) DATOS ACERCA DE LA SEQ ID NO: 15: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos 35 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido 40 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 15: Ser Gln Tyr Gln Asn Gln Ala Lys Asn Gly Ile Leu Phe 1 5 10 45 (2) DATOS ACERCA DE LA SEQ ID NO: 16: (i) CARACTERÍSTICAS DE LA SECUENCIA: 50 (A) LONGITUD: 13 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla 55 (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 16: 60 Ala Glu Tyr Arg Glu Gln Met Lys Asn Gly Arg Leu Ser 1 5 10 (2) DATOS ACERCA DE LA SEQ ID NO: 17: 65 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos 10 ES 2 241 197 T3 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 5 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 17: 10 Asn Glu Tyr Arg Lys Leu Val Arg Asn Gly Lys Leu Ala 1 5 10 (2) DATOS ACERCA DE LA SEQ ID NO: 18: 15 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 13 aminoácidos (B) TIPO: Aminoácidos 20 (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido 25 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 18: Asp Glu Phe Arg Ser Gln Met Lys Asn Gly Lys Leu Ile 1 5 10 30 (2) DATOS ACERCA DE LA SEQ ID NO: 19: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos 35 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 40 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 19: 45 Pro Gln Asp Lys Lys Phe Phe Gln Ser Leu Asp Gly Ile Met Phe Ile 1 5 10 15 Asn Lys (2) DATOS ACERCA DE LA SEQ ID NO: 20: 50 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos 55 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido 60 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 20: 65 Thr Arg Glu Asn Asp Pro Ile Gln Gly Pro Asp Gly Lys Met His Gly 1 5 10 15 Asn Thr 11 ES 2 241 197 T3 (2) DATOS ACERCA DE LA SEQ ID NO: 21: (i) CARACTERÍSTICAS DE LA SECUENCIA: 5 (A) LONGITUD: 18 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 10 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 21: 15 20 Thr Arg Glu Asn Asp Pro Val Leu Gly Pro Asp Gly Lys Thr His Gly 1 5 10 15 Asn Lys (2) DATOS ACERCA DE LA SEQ ID NO: 22: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos 25 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 30 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 22: 35 40 Thr Arg Glu His Asn Pro Val Arg Gly Pro Asp Gly Lys Met His Gly 1 5 10 15 Asn Lys (2) DATOS ACERCA DE LA SEQ ID NO: 23: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos 45 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 50 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 23: 55 Thr Arg Glu Ser Asp Pro Val Arg Gly Pro Asp Gly Arg Met His Gly 1 5 10 15 Asn Thr (2) DATOS ACERCA DE LA SEQ ID NO: 24: 60 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos (B) TIPO: Aminoácidos 65 (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 12 ES 2 241 197 T3 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 24: 5 10 Thr Arg Glu Asn Asp Pro Ile Glu Gly Leu Asp Gly Lys Ile His Gly 1 5 10 15 Asn Thr (2) DATOS ACERCA DE LA SEQ ID NO: 25: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos 15 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 20 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 25: 25 30 Thr Arg Glu Asn Asp Pro Ile Arg Gly Pro Asp Gly Lys Met His Gly 1 5 10 15 Asn Leu (2) DATOS ACERCA DE LA SEQ ID NO: 26: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos 35 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 40 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 26: 45 Thr Arg Glu Asn Asp Pro Val Arg Gly Pro Asp Gly Lys Thr His Gly 1 5 10 15 Asn Lys (2) DATOS ACERCA DE LA SEQ ID NO: 27: 50 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos (B) TIPO: Aminoácidos 55 (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido 60 65 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 27: Thr Arg Glu Asn Asp Pro Ile Gln Gly Pro Asp Gly Lys Val His Gly 1 5 10 15 Asn Thr 13 ES 2 241 197 T3 (2) DATOS ACERCA DE LA SEQ ID NO: 28: (i) CARACTERÍSTICAS DE LA SECUENCIA: 5 (A) LONGITUD: 18 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 10 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 28: 15 20 Thr Arg Glu Ser Asp Pro Val Arg Asp Ala Asp Gly Lys Ser Tyr Asn 1 5 10 15 Asn Gln (2) DATOS ACERCA DE LA SEQ ID NO: 29: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 18 aminoácidos 25 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 30 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 29: 35 40 Thr Arg Glu Ser Asp Pro Val Arg Gly Pro Asp Gly Lys Thr His Gly 1 5 10 15 Asn Lys (2) DATOS ACERCA DE LA SEQ ID NO: 30: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 2 aminoácidos 45 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 50 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 30: 55 Ala Thr 1 (2) DATOS ACERCA DE LA SEQ ID NO: 31: (i) CARACTERÍSTICAS DE LA SECUENCIA: 60 (A) LONGITUD: 2 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla 65 (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido 14 ES 2 241 197 T3 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 31: Ala Leu 1 5 (2) DATOS ACERCA DE LA SEQ ID NO: 32: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 2 aminoácidos 10 (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida 15 (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 32: Ala Met 1 20 1 25 (2) DATOS ACERCA DE LA SEQ ID NO: 33: (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 2 aminoácidos (B) TIPO: Aminoácidos 30 (C) FORMA DE CADENA: Cadena sencilla (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido 35 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 33: Ser Met 1 40 (2) DATOS ACERCA DE LA SEQ ID NO: 34: (i) CARACTERÍSTICAS DE LA SECUENCIA: 45 (A) LONGITUD: 2 aminoácidos (B) TIPO: Aminoácidos (C) FORMA DE CADENA: Cadena sencilla 50 (D) TOPOLOGÍA: Desconocida (ii) TIPO DE MOLÉCULA: Péptido (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 34: 55 Thr Met 1 60 65 15