Clopidogrel Arrow 75 mg comprimidos recubiertos con película EFG
Anuncio

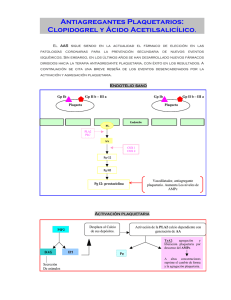
Clopidogrel Arrow 75 mg comprimidos recubiertos con película EFG TÍTULO “Ensayo clínico abierto, cruzado y aleatorizado de bioequivalencia de Clopidogrel Arrow 75 mg comprimidos recubiertos con película y Plavix (medicamento de referencia) tras la administración en dosis única a voluntarios sanos en condiciones de ayuno. OBJETIVO Conocer la biodisponibilidad relativa de la formulación de Clopidogrel sometida a ensayo (Clopidogrel Arrow 75 mg comprimidos recubiertos con película, de Specifar S.A., Grecia; clopidogrel como clopidogrel besilato) con respecto a la formulación comercial tomada como control (Plavix 75 mg de Sanofi-Aventis Deutschland GmbH, Alemania; clopidogrel como clopidogrel hidrogenosulfato) administrados en dosis de 1 comprimido de 75 mg en condiciones de ayuno y, establecer su bioequivalencia con arreglo a los criterios recomendados por las autoridades sanitarias. MATERIAL Y MÉTODOS Clopidogrel Arrow 75 mg comprimidos recubiertos con película es un Medicamento Genérico autorizado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en fecha 11 de diciembre de 2009. El estudio de bioequivalencia se realizó en Anapharm Clinical Research Facility en Québec, Canada. El diseño del estudio fue el siguiente: 74 (45 mujeres y 29 hombres) 2/3 69 unicéntrico, aleatorizado, dosis única, vía oral, abierto, cruzado, dos periodos de tratamiento, dos secuencias Plavix 75 mg de Sanofi-Aventis Deutschland GmbH, Alemania; clopidogrel como clopidogrel hidrogenosulfato Clopidogrel Arrow 75 mg comprimidos recubiertos con película, de Specifar S.A., Grecia; clopidogrel como clopidogrel besilato 75 mg clopidogrel (un comprimido) 7 días Para la determinación de la biodisponibilidad, se determinaron los siguientes parámetros farmacocinéticos: AUC0-∞, Cmax, AUC0-t, Área residual, Tmax, T1/2 el y Kel. Se muestran a continuación los resultados obtenidos: Los intervalos de confianza del 90% calculados fueron para el AUC0-t de 80-125% y para la Cmax de 75-133%. CONCLUSIONES Ambas formulaciones fueron bien toleradas, sin efectos secundarios graves y no se han observado diferencias relevantes en los perfiles de seguridad, especialmente respecto al número de voluntarios que experimentaron acontecimientos adversos. Por tanto, podemos concluir que su perfil de seguridad y tolerabilidad es semejante. En base a los resultados obtenidos, que se encuentran dentro de los rangos establecidos por las autoridades sanitarias, se concluye que se cumple la hipótesis de bioequivalencia entre las dos formulaciones estudiadas en dosis de 75 mg y en condiciones de ayuno.