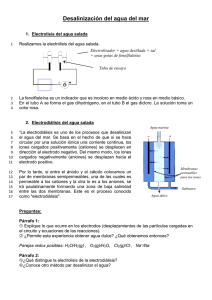
tratamiento de aguas de producción con electrodiálisis
Anuncio

UNIVERSIDAD DE LOS ANDES FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA QUÍMICA TRATAMIENTO DE AGUAS DE PRODUCCIÓN CON ELECTRODIÁLISIS Trabajo de Grado presentado ante la Escuela de Ingeniería Química como requisito parcial para optar al Título de Ingeniero Químico. Trabajo de Grado presentado por: Isrrael F. Medina Roa Profesor Asesor: Dr. Antonio L. Cárdenas R. Mérida, Octubre 2007 UNIVERSIDAD DE LOS ANDES FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA QUÍMICA TRATAMIENTO DE AGUAS DE PRODUCCIÓN CON ELECTRODIÁLISIS Trabajo de Grado presentado ante la Escuela de Ingeniería Química como requisito parcial para optar al Título de Ingeniero Químico. Trabajo de Grado presentado por: Isrrael F. Medina Roa Profesor Asesor: Dr. Antonio L. Cárdenas R. Mérida, Octubre 2007 DERECHO DE AUTOR Otorgo a la Universidad de Los Andes el derecho de reproducir y difundir el presente Trabajo, con las únicas limitaciones que establece la legislación vigente en materia de Derechos de Autor. En la ciudad de Mérida a los ____ Días del mes de Octubre de 2007 Isrrael Fernando Medina Roa C.I 16.420.815 APROBACIÓN Considero que el Trabajo de Grado titulado TRATAMIENTO DE AGUAS DE PRODUCCIÓN CON ELECTRODIÁLISIS Realizado por el Ciudadano ISRRAEL FERNANDO MEDINA ROA Para optar al título de INGENIERO QUÍMICO Reúne los requisitos exigidos por la escuela de Ingeniería Química de la Universidad de Los Andes, y tiene méritos suficientes para ser sometido a la presentación y revisión exhaustiva por parte del Jurado Examinador que se designe. En la ciudad de Mérida, a los ____ días del mes de Octubre de 2007 Dr. Antonio L. Cárdenas R Profesor Asesor ACTA DE VEREDICTO Nosotros, los abajo firmantes, constituidos como Jurado Examinador, y reunidos en Mérida el día______de Octubre de 2007, con el propósito de evaluar el Trabajo de Grado titulado: TRATAMIENTO DE AGUAS DE PRODUCCIÓN CON ELECTRODIÁLISIS Presentado por el ciudadano ISRRAEL FERNANDO MEDINA ROA Como requisito parcial para optar al Título de INGENIERO QUÍMICO Emitimos el siguiente veredicto: APROBADO REPROBADO Nota definitiva: (en letras) ______________________________ ( _____ puntos) OBSERVACIONES: _________________________________________________________________________ ___________________________________________________________________ En la ciudad de Mérida, a los ____ días del mes de Octubre de 2007 ____________________ _____________________ Prof. Antonio L. Cárdenas Prof. Leonardo Rennola ASESOR JURADO _____________________ Prof. María E. Méndez JURADO AGRADECIMIENTOS Quiero agradecer a todas aquellas personas que de una u otra manera colaboraron con la elaboración de este proyecto. Principalmente a Dios todo poderoso, su presencia en todo momento de mi carrera fue vital, todo sucede por su voluntad. Al Prof. Antonio Cardenas por incentivar en mí los valores de iniciativa y esfuerzo propio, además de todo el desarrollo intelectual y profesional adquirido por haberme iniciado en la elaboración de este trabajo. Al ingeniero Franklin Salazar, Julio Hernández, Yajaira Araque y a todo el laboratorio de Membranas, Separación y Síntesis Industrial, por todo el conocimiento teórico y técnico brindado, y por siempre colaborar incondicionalmente conmigo. En especial en las pruebas de adsorción atómica su colaboración fue vital para la culminación de este proyecto. Gracias. Al laboratorio investigación de Alimentos y en especial al Prof. Cesar Izaguirre por toda su colaboración en el inicio del proyecto, de verdad me ayudaron a comprender y comenzar con mucho ánimo toda la investigación. Al CDCHT por la ayuda económica brindada para la elaboración de todo el trabajo. A todos mis compañeros y amigos del Laboratorio de Membranas, que a pesar de que cada uno estaba realizando un proyecto distinto, siempre nos acompañamos unos a otros en todo momento, gracias a ti Armando León, Miguel Acosta, Ana Skieriswiki, Bianca Hernández, Sergio Monsalve, Elio Moreno, Ingrid Hoeguer y Betsabe Aguilera, les auguro todos los éxitos como profesionales, nos vemos en la vida. A Celimar, por estar siempre allí a mi lado, brindándome el apoyo siempre necesario, de verdad que tu presencia ha sido de gran importancia, gracias este trabajo tiene parte de ti. A mi hermana Mafer y mi buena amiga Mine, también hay muchos de ustedes acá. Y por supuesto a mis padres, este trabajo también es por ellos y para ellos, siempre su presencia a pesar de las distancia me mantuvo en el camino hacia esa meta trazada, la inspiración de trabajo duro, constante, ético y dedicado viene total mente de ustedes. A todos Ustedes, Muchísimas Gracias y que Dios los bendiga. Isrrael F. Medina R. RESUMEN. En la explotación de un pozo petrolero, junto con el crudo son extraídas a la superficie grandes cantidades de agua que están en el yacimiento (Aguas de Producción), muchas veces las cantidades de agua obtenidas con la explotación del petróleo superan los ocho barriles por cada barril de petróleo extraído, y dichas aguas pueden en muchos casos tener altas concentraciones de sales, entre ellas los cloruros. Estas aguas para poder ser reutilizadas en la inyección de pozo o devueltas al ambiente como líquido residual industrial deben ser tratadas y su concentración en cloruros llevadas a niveles menores a 1000 ppm si se desechan a cuerpos de agua como lagos, ríos o mares (según decreto 883). El presente trabajo propone usar el proceso de electrodiálisis para disminuir la salinidad de las aguas de producción. Este proceso permite separar iones de corrientes tratadas mediante la aplicación de un campo eléctrico y membranas de intercambio iónico. Se estudió la desalinización de soluciones preparadas llamadas Agua Sintética y Agua Sintética 2, una con baja y la otra con alta concentración de sales, similares a las aguas de producción de los pozos de La Victoria del estado Apure; con un equipo piloto de electrodiálisis modelo CH-O fabricado por Asahi Glass Co. aplicando gradientes de potencial de 30 V. También se realizaron pruebas con una muestra de agua de producción de los pozos de La Victoria. Se constató la disminución de la salinidad de las soluciones logrando concentraciones de hasta 14 ppm de Cl-. También se estudió el efecto de la velocidad del flujo en las aguas tratadas y el efecto de la concentración inicial en esta agua, encontrándose que favorece el aumento de la velocidad en la reducción de las concentraciones de cloruros, de igual manera se evaluó el traspaso de los cationes presentes en solución, observándose que siguen un orden de transferencia (desde el mas rápido al mas lento) K+ > Na+ > Mg2+ > Ca2+ en todos los casos inclusive en las aguas de producción. El consumo de energía para la electrodiálisis de la solución sintética fue calculado, encontrándose que fue de 36 W·h/l aproximadamente para las aguas sintéticas y de 34 W·h/l para el agua de producción. Los porcentajes de reducción logrados fueron en la mayoría de los casos del 99 % para todos los iones. Estos resultados sugieren que la electrodiálisis es un proceso que debe ser considerado en el tratamiento de aguas a las cuáles se les deben disminuir la concentración de iones, en este caso particular, de los cloruros. i ÍNDICE. Pág. i ii iv v 1 3 Resumen Índice Lista de Tablas Lista de Figuras Introducción Objetivos Capitulo I Membranas. 1.1 Membranas Artificiales 1.2 Historia de las Membranas 1.3 Tipos de Membranas 1.3.1 Según su naturaleza química 1.3.2 Según su Forma y su Función 1.3.3 Según el Tipo de Modulo 1.4 Separación con Membranas. 1.4.1 Procesos que Utilizan Gradiente de Presión 1.4.2 Procesos que Utilizan Gradiente de Concentración 1.4.3 Procesos que Utilizan Gradiente de Potencial Eléctrico 4 4 5 7 7 8 11 13 14 17 18 Capitulo II La Electrodiálisis 2.1 Desarrollo Histórico de la Electrodiálisis 2.2 Principios de la Electrodiálisis 2.3 Membranas de Intercambio Iónico 2.3.1 Clasificación de las Membranas de Intercambio Iónico 2.3.1.1 Clasificación según su Estructura Física 2.3.1.2 Clasificación según su Capacidad de Intercambio 2.3.1.3 Clasificación según su Estructura Química 20 20 21 25 28 28 29 29 2.4 Polarización 2.4.1 Determinación de la Corriente Límite 2.5 Componentes Básicos del Módulo de Electrodiálisis 2.5.1 Electrodos 2.5.2 Membranas 2.5.3 Espaciadores 2.5.4 Juntas 32 37 38 39 40 40 41 2.6 Aplicaciones de la Electrodiálisis 2.6.1 Producción de Salmuera 2.6.2 Desalinización de Agua 2.6.3 Desmineralización de Suero Lácteo 2.6.4 Recuperación de Productos Químicos 2.6.5 Separación de Amino Ácidos 2.6.6 Recuperación de Sales Metálicas en Procesos de Recubrimiento Galvánico 2.6.7 Recuperación de ácidos Minerales y Metales Pesados 2.6.8 Electrodiálisis con Membranas Bipolares 42 42 42 43 43 44 44 44 44 ii Capitulo III El Recurso del Agua 3.1 Disponibilidad de Agua en el Planeta 3.2 Las Aguas Residuales 3.2.1 Desechos Líquidos Municipales 3.2.2 Desechos Líquidos Agroindustriales 3.2.3 Desechos Líquidos Industriales 3.3 Características de las Aguas Residuales 3.3.1 Características Físicas 3.3.2 Características Químicas 3.3.3 Características Biológicas 45 46 47 48 48 49 50 50 51 53 3.4 Tratamientos de Aguas Residuales 3.4.1 Pretratamiento 3.4.2 Tratamiento Primario 3.4.3 Tratamiento Secundario 3.4.4 Tratamiento Químico 3.4.5 Tratamientos avanzados de las Aguas Residuales 54 54 54 54 54 55 3.5 Electrodiálisis en el Tratamiento avanzado de Aguas Residuales 3.6 Las Aguas de Producción 3.6.1 El Impacto en el ambiente 56 57 58 3.7 Legislación Ambiental 62 Capitulo IV Antecedentes. 64 Capitulo V Metodología Experimental. 5.1 Materiales y Equipos Usados. 5.2 Reactivos. 5.3 Metodología 5.3.1 Preparación de soluciones de NaCl y de Agua Sintética 5.3.2 Pruebas de desalación de las soluciones de NaCl en el electrodializador 5.3.3 Pruebas de desalación de Aguas sintéticas en el electrodializador 5.3.4 Filtración previa de las Aguas de Producción 5.3.5 Pruebas de desalado de Agua Producción en el Electrodiálizador 5.3.6 Determinación de Cloruros por el método de Mohr 5.3.7 Determinación de metales por Absorción atómica 65 65 69 70 70 73 75 77 78 80 82 Capitulo VI Resultados y discusiones 6.1 Resultados de la primera fase del Proyecto 6.2 Pruebas con Aguas Sintéticas y Agua de Producción 6.3 Consumo de energía 85 85 88 101 Conclusiones Recomendaciones Bibliografía Anexos 105 107 108 110 iii LISTA DE TABLAS Tabla Pág. 2.1 Membranas heterogéneas de electrodiálisis. 30 2.2 Membranas Homogéneas de electrodiálisis. 31 3.1 Datos típicos de aplicación para operaciones y procesos de tratamiento avanzado de aguas residuales 55 3.2 Comparación de los sistemas de Osmosis Inversa y Electrodiálisis 57 5.1 Cantidades para preparar 2 litros de solución sintética de agua de producción “Agua Sintética”. 71 5.2 Cantidades para preparar 2 litros de solución sintética de agua de producción al doble de su concentración “Agua Sintética 2”. 71 5.3 Cantidades para preparar las soluciones madres para los ensayos de Potasio, Magnesio y Calcio por absorción atómica. 72 5.4 Experiencias realizadas en la primera fase del proyecto. 75 5.5 Experiencias realizadas en la segunda fase del proyecto 77 5.6 Experiencias realizadas en la trecera fase del proyecto. 80 6.1 Porcentaje de Reducción en la concentración de cloruros en las pruebas realizadas 90 6.2 Porcentaje de Reducción de cationes en las pruebas realizadas. 98 6.3 Valores de Consumo energético calculado para las distintas corridas 103 iv LISTA DE FIGURAS Figura 1.1 1.2 1.3 1.4 2.1 2.2 2.3 2.4 2.5 2.6 2.7 5.1 5.2 5.3 5.4 5.5 5.6 5.7 5.8 5.9 6.1 6.2 6.3 6.4 6.5 6.6 6.7 6.8 6.9 6.10 6.11 6.12 6.13 6.14 6.15 6.16 6.17 6.18 Membrana porosa y Membrana mixta. Módulo plano Esquema del Módulo Tubular Esquema del Módulo de Fibras Huecas Representación de un proceso de electrodiálisis Esquema de un módulo de Electrodiálisis de celdas de dos compartimientos Esquema de una membrana de intercambio catiónico y de su mecanismo de transporte de los cationes desde la disolución A a la B bajo la acción de un campo eléctrico Gradientes de concentración en la interfase membrana-disolución, bajo el efecto de un campo eléctrico. MA y MC Esquema de un módulo de Electrodiálisis Diferentes tipos de espaciadores Unidad a gran escala para la desalación de agua de mar Buretas usadas Conductimetro Equipo de filtración para aguas de producción Balanza Digital Equipo de Absorción Atómica SpectraAA 55B Imágenes del Electrodiálizador usado para la experiencia. Esquema del los circuitos hidráulicos del electrodiálizador CH-O Equipo de Filtración Filtración del Agua de Producción Conductividad Vs. Tiempo para la solución diluido y concentrado a 30V Conductividad Vs. Tiempo para la solución diluido y concentrado a 15V Conductividad Vs. Tiempo para la solución concentrado (a) y diluido (b) a 30V y 15 V Conductividad Vs. Tiempo para la solución concentrado y Agua Sintética (a) y Agua Sintética 2 (b) Concentración de cloruros vs el tiempo para la prueba de Agua Sintética a 200 l/h Concentración de cloruros vs el tiempo para la prueba de Agua Sintética a diferentes velocidades de flujo Concentración de cloruros vs el tiempo para la prueba de Agua Sintética 2 a diferentes velocidades de flujo Porcentaje de reducción de la concentración de cloruro en las aguas tratadas a 100 l/h Porcentaje de reducción de la concentración de cloruro en las aguas tratadas a 200 l/h Porcentaje de reducción de la concentración de cloruro en las aguas tratadas a 300 l/h Porcentaje de reducción de la concentración de cationes Vs el tiempo para la prueba de Agua Sintética a diferentes velocidades de flujo Porcentaje de reducción de la concentración de cationes Vs el tiempo para la prueba de Agua Sintética 2 a diferentes velocidades de flujo. Porcentaje de reducción de la concentración de cationes Vs el tiempo para cada catión Diferencia apreciable entre la turbidez de un agua sintética de alta concentración de sales antes de ser tratada y luego de ser Concentración de cloruros en la corriente de agua de producción y la corriente Concentrado para la prueba realizada a 200 l/h. Porcentaje de reducción de la concentración de cationes Vs el tiempo para la prueba con Agua de Producción de La Victoria Variación del amperaje a través del tiempo para diferentes velocidades de flujo. Consumo energético de cada una de las pruebas en W·h/l Pág. 10 11 12 13 22 23 27 33 39 41 43 65 66 66 67 67 68 69 78 78 85 86 87 89 89 91 92 93 93 93 94 96 97 98 99 100 102 104 v Introducción. INTRODUCCIÓN. Hasta los años sesenta del siglo XX, la descarga de residuos líquidos en muchos ríos, lagos y mares no modificó irreversiblemente las propiedades naturales del medio ambiente, debido a que la cantidad y concentración de contaminantes en estos desechos líquidos vertidos era inferior a la capacidad natural de autopurificación del medio. Luego como consecuencia de una explosión demográfica e industrial el exceso de material contaminante vertido a la naturaleza ha sobrepasado la capacidad natural de purificación de los cuerpos de agua receptores. La explotación petrolera es una de las actividades que ha incrementado sus operaciones por diferentes partes del mundo, llegando a lugares antes no afectados por el hombre; junto con el crecimiento de esta industria se ha dado el crecimiento de la contaminación de los nuevos lugares de producción petrolera y entre los responsables de dicha contaminación encontramos las Aguas de Producción. Las aguas de producción son aguas asociadas a la extracción petrolera, dichas aguas se encuentran en el mismo yacimiento donde se encuentra el crudo, y son extraídas junto con el, en algunos casos la proporción es de 4 barriles de agua por barril de petróleo, y esto genera un inconveniente ya que la reutilización de estas aguas en la inyección de pozo o la disposición en el ambiente debe realizarse cumpliendo normas ambientales a favor alterar lo menos posible el entorno ambiental de estos pozos. El interés del tratamiento de esta agua sigue creciendo, y más aún en nuestro país, ya que la empresa estatal petrolera (Petróleos de Venezuela) ha demostrado en diversas ocasiones la preocupación por este tema. En la zona de producción Barinas – Apure, estas aguas están constituidas principalmente por sales y metales pesados, en muchos casos los niveles de salinidad superan los 1000 ppm de cloruro que es el nivel máximo permitido por las normas ambiéntales para el vertido de residuos líquidos en cuerpos de agua. La electrodiálisis es un proceso de separación que utiliza membranas selectivas a los iones, lo que hace una excelente técnica para la separación y recuperación de electrolitos. 1 Introducción. Esta técnica tiene múltiples aplicaciones en la industria química, como la desmineralización de agua salada, recuperación de metales de efluentes contaminantes, separación de aminoácidos y recuperación de reactivos, entre otras. En el laboratorio de separación y síntesis industrial (laboratorio de membranas) de la Facultad de Ingeniería de la Universidad de los Andes se ha comprobado la eficacia de este proceso para la desmineralización y la eliminación del ácido lácteo del suero lácteo producido en la elaboración de queso. Para disminuir la salinidad del agua de producción se utilizó un equipo piloto de electrodiálisis. En este caso se estudió también, la cantidad de energía requerida para lograr la separación de cloruros y la concentración de sales a los que se puede llegar en la corriente de concentrado y diluido. También se estudió el efecto de de la velocidad del flujo y de la concentración inicial de sales. Este proyecto permitió conocer la factibilidad de utilizar la electrodiálisis en el tratamiento de aguas de producción de alta salinidad. El presente trabajo esta constituido por una revisión bibliográfica en el capitulo I sobre las membranas, en el capitulo II información acerca del proceso de electrodiálisis, el capitulo III estudia la problemática de los Residuos Líquidos y la importancia del recurso del Agua, la fase experimental llevada a cabo en el proyecto se muestra en el Capitulo IV y el análisis de los resultados obtenidos en el capitulo V, por ultimo están las conclusiones y la referencias que fueron consultadas para la revisión bibliográfica. 2 Objetivos. OBJETIVO GENERAL. Estudiar el proceso de electrodiálisis como método factible para disminuir la salinidad de las aguas de producción. OJETIVOS ESPECÍFICOS. Estudiar la desalación de las aguas sintéticas preparadas en el laboratorio, similares a las encontradas en los pozos de La Victoria Estado Apure. Evaluar el efecto de la velocidad del flujo en el proceso de desalación de las aguas tratadas. Evaluar el efecto de la concentración inicial de las aguas tratadas sobre el proceso de desalación, evaluando aguas sintéticas de baja y alta concentración de sales. Estudiar el comportamiento de los cationes presentes en las soluciones tratadas a las diferentes condiciones de velocidad y concentración, y evaluar el orden de transferencia de estos cationes. Estudiar la desalación con una muestra de Agua de Producción de los pozos de La Victoria, estado Apure. Estimar el consumo energético del proceso a las diferentes condiones. 3 Capitulo I Membranas. CAPITULO I MEMBRANAS. Según el diccionario se define como una membrana a toda piel delgada que sirve de interfase con una permeabilidad selectiva, dichas membranas tienen la función de envolver, aislar o delimitar determinadas estructuras; pero la función que es el caso de estudio, es esa permeabilidad selectiva que limita el transporte de ciertas especies químicas (moleculares o iones) y/o de partículas de forma muy definidas. Antes de continuar con la descripción de las membranas, es importante señalar que existen las membranas naturales, aquellas creadas por la naturaleza y que están operando en procesos biológicos, por ejemplo, las membranas celulares, que son las que delimitan el citoplasma, mantienen el equilibrio hídrico e iónico de la célula y colaboran con sus movimientos para apoderarse de partículas nutritivas (1). Además de las membranas naturales, existen las membranas artificiales, que son todas aquellas a las cuales el hombre les ha dado un tratamiento (ha modificado) y un uso diferente al que tenían al ser creadas por la naturaleza y también todas aquellas membranas que han sido creadas por él, como por ejemplo las membranas sintéticas de polímetros (2). 1.1 Membranas artificiales. Las membranas artificiales son aquellas que fabrica el hombre. La mayoría de las membranas artificiales se producen a partir de polímeros, sin embargo, también existen membranas de materiales inorgánicos, como las metálicas o cerámicas y membranas híbridas, compuestas por materiales orgánicos e inorgánicos. Una membrana es una fase semipermeable, que puede ser de naturaleza polimétrica, inorgánica o mixta, que restringe el paso de ciertas sustancias o especies químicas. Dicha membrana, o barrera, controla la tasa de transporte de varias especies químicas a través de ella y al igual que cualquier proceso de separación, genera un producto con baja concentración de ciertos componentes y un segundo producto enriquecido con dichos componentes. El funcionamiento de una membrana esta determinado por dos parámetros; el flujo y la retención 4 Capitulo I Membranas. o selectividad. El flujo o tasa de permeabilidad, es el flujo volumétrico; másico o molar, del fluido o componentes que pasan a través de la membrana, por unidad de área de la membrana y por unidad de tiempo. La selectividad determina si dicha membrana es permeable a los diferentes componentes que conforman la alimentación. La retención se refiere a la fracción de soluto en la alimentación que es retenido por la membrana (3). Idealmente las membranas deben poseer alta selectividad y flujo, sin embargo, es difícil encontrar membranas que cumplan esto, puesto que en general el aumento de unas variables involucra la reducción de otras (4). 1.2 Historia de las Membranas. El uso de una interfase para separar y mejorar la calidad de mezclas líquidas es muy remoto, los procesos de filtración y tamizado son usados desde hace siglos. Todos los procesos que se realizaron con el fin de separar y mejorar mezclas en la antigüedad, se hicieron de manera empírica. No es hasta el siglo XVIII que Ph. La Hire (1640 – 1718) reporta que la vejiga de cerdo es más permeable al agua que al alcohol. En el siglo XVIII el abad A. Nollet (1700 – 1770) estudió el rol de las membranas en el proceso de la ósmosis. Él dió cuenta de la existencia de una diferencia de presión entre una solución salina y el agua pura al estar separada por una membrana constituida por una vejiga de cerdo, es decir, encontró la presión osmótica. Por esa misma época, el biólogo francés René Dutrochet (1776 – 1847) estudia la influencia de la presión osmótica sobre los procesos biológicos. Las membranas como medio de separación son introducidas por el químico escocés Thomas Grahan (1805 – 1869), cuando en 1854 las utilizó para distinguir a los cristaloides de los coloides. Las primeras membranas sintetizadas por el hombre las hace el físico J. Traube (1826 – 1894) al precipitar ferrocianuro de cobre sobre cerámica. Por la misma época, el médico A. Fick (1829 – 1929) obtiene las primeras membranas de celulosa, que utiliza para estudiar la difusión. 5 Capitulo I Membranas. Los trabajos de L. Pasteur (1822 – 1895), dieron un gran impulso al desarrollo de las membranas, que se empezaron a utilizar para tratar de lograr esterilizar el agua, el aire y algunos líquidos biológicos. En 1890, W. Nerst (1864 – 1941) define lo que es un sistema membranoso y Lhermite demuestra en 1855 que existen dos tipos de membranas; las membranas porosas, en las cuales el efecto capilar es muy importante y las membranas que deben considerarse como un tercer líquido, es decir, donde la solubilidad es muy importante. En 1918 – 1919, R. Zsigmondy (1865 – 1929), estudia la ultrafiltración y coloca las bases de la filtración moderna. En 1911 F. Donan (1870 -1956) estudia los equilibrios y potenciales de membranas; punto de partida para todas las separaciones en los cuales el potencial eléctrico es importante (por ejemplo la Electrodiálisis). En 1923 Loeb y Sourirajan, son los primeros en sintetizar una membrana de acetato de celulosa asimétrica para la desalinización del agua de mar (2). A partir de aquí se puede hablar de cuatro generaciones de membranas, que serian las conocidas como membranas modernas; estas cuatro generaciones de membranas modernas son: 1) Las primeras son las desarrolladas por Loeb y Sourirajan, sintetizadas con acetato de celulosa. 2) Mejoras introducidas al tipo de membranas anteriores, como la resistencia química conforman la segunda generación. 3) En los años 80 aparece una tercera generación con las membranas compuestas inorgánicas, que poseen una gran resistencia química y mecánica. 4) La cuarta generación es la que sigue en desarrollo, son las membranas compuestas (orgánicas – inorgánicas). Se trata de obtener así membranas con las virtudes de los compuestos inorgánicos y orgánicos (2). 6 Capitulo I Membranas. 1.3 Tipos de Membranas. Existen varias formas de clasificar a las membranas sintéticas. La primera clasificación es según su naturaleza química, es decir, si son de origen orgánico, inorgánico y mixto. 1.3.1 Según su naturaleza química. • Membranas orgánicas: Las primeras membranas de este tipo son las derivadas de la celulosa (acetato de celulosa). Debido a la poca resistencia de estas membranas comenzó un gran esfuerzo por mejorar las características de las mismas desarrollándose así derivados de celulosa más resistentes, además de poliamidas, polisulfonas, polímeros acrílicos y polímeros fluorados. Las principales características de este tipo de membranas son: gran variedad en cuanto a la naturaleza química, una gran gama de tamaños de poros, resistencia térmica limitada, resistencia limitada a los solventes y pH externos, vida de corta duración, del orden de algunos meses, poca resistencia a altas presiones. Entre las membranas orgánicas también podemos incluir a las membranas líquidas soportadas o a las emulsiones múltiples, cuando estas membranas son de aceite; aunque su comportamiento es diferente al de las otras membranas mencionadas aquí, solo entran en esta clasificación en virtud de su carácter orgánico (2). • Membranas Inorgánicas: Estas membranas son mucho más recientes. Las primeras membranas cerámicas aparecieron en el mercado al principio de los años 80. Las características mas importante de este tipo de membrana son: una buena resistencia química y térmica, estabilidad frente a las bacterias; son inertes antes los solventes orgánicos y medios corrosivos, se pueden limpiar fácilmente por el contrapresión; buena resistencia mecánica (resisten altas presiones); tienen una vida larga; se pueden esterilizar fácilmente con vapor. Su fabricación es complicada y su precio más elevado que las orgánicas, lo que hace que su uso no sea tan popular como el de las membranas 7 Capitulo I Membranas. orgánicas (2). También existen membranas derivadas del vidrio y de metales con características similares a las señaladas para las membranas cerámicas. • Membranas Mixtas: Estas son membranas de última generación que se utilizan únicamente a nivel del laboratorio, todavía no han alcanzado su desarrollo comercial. Estas membranas consisten normalmente en un esqueleto inorgánico, al cual se le han agregado grupos orgánicos para darle una característica especial (hidrofobismo, lipofobismo, transporte por transportadores anclados, etc.) con este tipo de membranas se trata de obtener las ventajas de las dos anteriores, por lo general lo que se obtiene es un compromiso; por ejemplo se sube la resistencia mecánica con respecto a una membrana orgánica, pero se baja la resistencia térmica con respecto a una membrana inorgánica (2). El otro tipo de clasificación de membranas que encontramos es según su forma y función. 1.3.2 Según su Forma y Función. • Membranas Porosas: Poseen una estructura muy simple y se asemejan mucho a las fibras empleadas en la filtración, en lo que se refiere al modo de separación y transporte. Las membranas porosas consisten en una matriz sólida que posee huecos o poros con diámetros que pueden ser menores a 1μm, mayores a 1 μm e incluso pueden ser mayores a 20μm (Figura 1.1). La separación de los componentes se lleva a cabo estrictamente mediante un mecanismo de tamizado, determinado por el tamaño del poro y de la partícula. Las membranas porosas pueden fabricarse a partir de materiales tales como cerámicas, grafito, metales y óxidos metálicos y polímeros. Su estructura puede ser de dos tipos: simétrica o asimétrica. En las membranas simétricas el diámetro del poro no varía a lo largo de la sección transversal de la membrana y se utilizan en procesos tales como microfiltración, ultrafiltración, nanofiltración o en diálisis, para separar componentes que difieran marcadamente en tamaño y masa molecular (5). 8 Capitulo I Membranas. Las membranas porosas con estructura asimétrica, consisten en una película muy delgada (0,1 - 1μm), colocada sobre una subestructura gruesa (100 - 200μm), altamente porosa. La película delgada constituye la membrana selectiva y sus características de separación vienen determinadas por el material con que este hecha o por el tamaño de poro, sin embargo la tasa de transporte másico esta determinada por el grosor de la película. La subestructura porosa sirve únicamente como soporte a la frágil película delgada, es decir, para la membrana. Estas membranas son usadas en principalmente en procesos que utilizan un gradiente de presión como fuerza impulsora, tales como la osmosis inversa y la ultrafiltración, porque estos necesitan una elevada transferencia de masa y una buena estabilidad mecánica (5). • Membranas Homogéneas: una membrana homogénea es una película densa a través de la cual una mezcla de moléculas es transportada mediante un gradiente de presión, de concentración o de potencial eléctrico. El mecanismo de transporte de las especies dentro de las membranas homogéneas, ocurre estrictamente por difusión y depende de la solubilidad de las mismas dentro de la membrana (Figura 1.1). Gracias a esto, es posible separar eficientemente aquellas especies químicas que posean tamaños y hasta difusividades similares, cuando sus solubilidades dentro de la membrana difieran significativamente. Estas membranas pueden prepararse con polímeros, metales o aleaciones de metales mediante técnicas de formación de películas. Se utilizan para separar componentes que poseen tamaños similares pero que difieren químicamente (5). Entre las membranas homogéneas se encuentran las membranas líquidas, las cuales poseen un mecanismo de separación similar al de la extracción líquido – líquido puesto que se utilizan sistemas de múltiples fases (2 o 3, por lo general). El principio de operación de estas membranas es relativamente simple; dos líquidos homogéneos y miscibles (uno es la alimentación o solución donadora y el otro es la solución receptora), están espacialmente separados por una tercera fase, la membrana. La membrana esta constituida por un solvente el cual es prácticamente inmiscible e 9 Capitulo I Membranas. insoluble con la alimentación y la solución receptora. La separación o transporte del soluto desde la solución donante a la receptora se lleva a cabo gracias a que se produce un gradiente de potencial químico que hace de fuerza impulsora. La termodinámica en la interfase donante – membrana favorece la extracción del soluto a la membrana, simultáneamente la termodinámica en la interfase membrana – receptor favorece el transporte de la membrana al receptor. En la mayoría de los casos las membranas líquidas están formadas por líquidos orgánicos, sin embargo se pueden usar membranas acuosas cuando se desean separar soluciones orgánicas (6). (a) (b) (c) Figura 1.1 Membrana Porosa (a y b) y Membrana Mixta (c) • Membranas Cargadas Eléctricamente: También conocidas como membranas de intercambio iónico. Existen del tipo orgánicas (poliméricas) e inorgánicas. Sin embargo, hoy por hoy las únicas usadas a escala industrial son las primeras (7). Este tipo de membranas poseen carga eléctrica, la separación se basa en la exclusión de las especies químicas de la misma carga que la de las membranas (8), en ellas se centrará un estudio con mayor detalle mas adelante. 10 Capitulo I Membranas. • Membranas Dinámicas: Son aquellas que se forman durante el proceso de filtración, la idea es depositar sobre un soporte una capa de material filtrante antes de comenzar a filtrar. Son como los coadyudantes de la filtración clásica (2). 1.3.3 Según el tipo de Módulo: Las membranas pueden presentarse en diferentes tipos de módulos. La selección de alguno de estos depende del proceso de separación, entre los más utilizados tenemos: • Modulo Plano: Es el modelo más antiguo y sencillo. Se deriva de los modelos de filtro de prensa, la circulación de los líquidos se hace entre las placas, que se encuentran separadas por membranas planas. Pueden tener diversas formas como cuadradas, elipsoidales, circulares, ortogonales; estas membranas se colocan sobre un soporte de la misma forma para que les dé resistencia mecánica (Figura 1.2). Los módulos planos se pueden ensamblar de forma horizontal o vertical, estos módulos planos también se conocen como módulos de placa (2). Este tipo de modulo es el usado en diversos procesos entre ellos la Electrodiálisis. Figura 1.2 Módulo plano • Módulos Tubulares: Este tipo de módulos se encuentra en todos los procesos de separación en fase líquida o gaseosa (Figura 1.3). En estos módulos la membrana filtrante se encuentra en la parte interna o externa en un soporte tubular. Estos módulos se pueden ensamblar en serie y/o paralelo, también se pueden usar tubos con múltiples canales, con los cuales se incrementan la superficie de filtración. El soporte tubular puede ser de cerámica, de metal, de plástico, de fibra, material sobre el cual se deposita 11 Capitulo I Membranas. la membrana que puede ser a su vez fija o dinámica, estos tubos pueden medir desde pocos centímetros a dos metros (2). Figura 1.3 Esquema del Modulo Tubular. • Módulos helicoidales: Es un modelo poco usado y consiste en un tubo flexible enrollado sobre si en forma helicoidal. De esta forma se evitan las perdidas por fricción asociadas a los empates en el caso de los filtros tubulares (2). En general su uso es cada vez menor y actualmente casi no se encuentra este tipo de módulo. • Módulos Espirales: Estos módulos también se conocen como espirales planos, su uso es muy frecuente en ósmosis inversa; el modulo consiste en dos membranas planas entre las cuales se forman un espacio que se mantiene mediante el uso de un soporte. Por la parte externa, se coloca otro soporte con la finalidad de recoger el filtrado. Las membranas y los soportes se encuentran doblados sobre un tubo que se encarga de recolectar el filtrado (2). • Módulos de Fibras Huecas: estos módulos consisten en una gran cantidad de pequeños tubos de algunas decenas de micrómetros de diámetro (Figura 1.4), este tipo de ensamblaje permite obtener superficies de intercambio muy elevadas, del orden de 1200 m2/m3. Los módulos de fibra hueca presentan el inconveniente de que si falla una 12 Capitulo I Membranas. fibra, hay que cambiarlo completo, además, su utilización es casi exclusivamente para el tratamiento de aguas por ósmosis inversa (2). Figura 1.4 Esquema del Modulo de Fibras Huecas. 1.4 Separación con Membranas. En los procesos industriales es de suma importancia la separación, concentración y purificación de especies químicas, la separación abarca desde las realizadas entre partículas sólidas, inmiscibles que se hallan en fases líquidas o gaseosas, hasta la separación de solutos disueltos en fase líquida, pasando por la separación de mezclas de gases. En cualquiera de estos procesos el papel de las membranas es el de actuar como una barrera selectiva, permitiendo el paso de ciertos componentes y reteniendo otros. Cuando una membrana separa dos fases fluidas, varios tipos de fuerzas pueden ser la causa de flujo de moléculas o especies iónicas a través de ellas, a estas fuerzas las llamamos fuerza impulsora, esta fuerza proporciona una amplia clasificación de los procesos con membranas, dependiendo de la forma o mecanismo en que el material es transportado a través de la membrana, así pues las especies pueden ser transportadas bien sea por trabajo mecánico, químico, eléctrico o térmico. Tres son los gradientes más importantes que proporciona esa fuerza impulsora: a. Un gradiente de presión hidrostática entre las dos fases que separa la membrana puede producir un flujo de volumen, y con ello la separación de especies químicas, si la permeabilidad de las membranas es diferente para los distintos compuestos. 13 Capitulo I Membranas. b. Un gradiente de concentración entre las dos fases que separa la membrana puede ocasionar un transporte de materia, y con ello la separación de varias especies químicas, si las difusividades y solubilidades en la membrana son diferentes. c. Un gradiente de potencial eléctrico irá acompañada de una separación, cuando las diferentes especies cargadas presentan distintas movilidades en el interior de las membranas (8). En algunos casos, puede existir la combinación de uno o más gradientes involucrados en la separación, aunque por lo general hay uno que es más importante. 1.4.1 Procesos que Utilizan el Gradiente de Presión. A continuación se describen brevemente los procesos de separación con membranas que utilizan un gradiente de presión. • Microfiltración: Es la técnica de separación con membranas más desarrollada a nivel mundial, al igual que la ultrafiltración. Como su nombre lo indica, la microfiltración es un proceso que se utiliza para separar las partículas sólidas presentes en una corriente líquida o gaseosa mediante el uso de un medio mecánico de tamizado (que en este caso sería la membrana), es decir, la separación ocurre por un efecto tamiz que toma en cuenta las dimensiones relativas de partícula a separar y poro de la membrana. Este proceso se utiliza cuando las partículas poseen diámetros comprendidos entre 0,1 a 10μm, y el solvente o sustancia en la cual están dispersas poseen un peso molecular > (0,1 – 1)x106, es decir que permite filtrar hasta las bacterias más pequeñas. Las membranas usadas en la microfiltración son estructuras macroporosas y en general, simétricas con tallas de poros normalmente entre 0,1 a 10 μm, con diferencia de presión entre las membranas de 0,1 a 2 bar (8). Entre los principales usos de la microfiltración tenemos la filtración de partículas presentes en las corrientes líquidas ó gaseosas utilizadas en la industria química, biológicas, farmacéuticas y de alimentos; la clarificación o filtración estéril de soluciones sensibles al calor y bebidas; producción de agua pura, purificación de productos, tratamientos de aguas residuales; etc. (3). 14 Capitulo I Membranas. • Ultrafiltración: La ultrafiltración es muy similar en operación a la microfiltración con la diferencia que utiliza membranas asimétricas con tamaño de poro menor y que permiten el filtrado de partículas mucho mas pequeñas; es una técnica que permite la separación de moléculas disueltas en función de su tamaño, al hacer pasar una solución bajo presión a través de una membrana, el tamaño de poro de la primera capa de la membrana está entre 0,1μm y 1 nm. Retiene a las moléculas de proteínas y a los virus pero sin embargo deja pasar iones (sales disociadas). Al ser las membranas asimétricas, presentan una capa muy delgada que reduce la resistencia de la misma. Las presiones utilizadas van desde 1 a 5 bar y es un proceso simple y de bajo costo de operación (8). La ultrafiltración puede ser utilizada para recuperar el fluido que pasa a través del filtro o para recolectar el material que es retenido en el mismo, por ello su gran cantidad de aplicaciones en la industria como: la recuperación de pintura de carrocería de automóviles; la concentración de la leche y los jugos de fruta; el aislamiento y concentración de enzimas, virus y ácidos nucleicos en la industria farmacéutica; el tratamiento de efluentes sobre todo en la industria papelera, etc. (5). • Nanofiltración: La nanofiltración es muy similar a la ósmosis inversa y cubre un rango de separación comprendido entre las capacidades de separación de las membranas de ósmosis inversa y las de ultrafiltración (el tamaño de poro esta alrededor de 1 nm). Las membranas que se utilizan se forman mediante una polimerización interfacial (por ejemplo de la polisulfona o la polietersulfona), en un sustrato poroso. Separa partículas entre 200 y 1000 daltons y sales minerales a bajas concentraciones; con gradientes de presión de 10 a 40 bar. Estas membranas presentan una estructura asimétrica a tres niveles (8). ̇ Un soporte macroporoso que ofrece una buena resistencia mecánica con flujos de solventes elevados. ̇ Una capa intermedia mesoporosa que asegura la unión entre el soporte y la capa activa. 15 Capitulo I Membranas. ̇ Una capa activa que esta constituida de material orgánico o inorgánico que presentan una estructura microporosa con diámetros de poros en el orden de nanómetros. • Ósmosis Inversa: La ósmosis inversa, también conocida como hiperfiltración, es un proceso utilizado para remover solutos de bajo peso molecular tales como sales inorgánicas (por ejemplo, NaCl) y moléculas orgánicas pequeñas (glucosa por ejemplo), de un solvente que por lo general es agua. Consiste en aplicar una presión (superior a la presión osmótica del sistema) en la solución con mayor contenido de sal, la cual se pone en contacto con una membrana semipermeable, esto produce la migración del agua desde el lado concentrado al lado diluido, reteniendo así la sal en la solución concentrada. El método utilizado para la remoción de sales es diferente al de la microfiltración, puesto que el mecanismo de separación entre las especies no se basa en las diferencias de tamaño entre el soluto y el solvente, sino en la solubilidad y difusividad del solvente en la membrana, es decir, las membranas utilizadas en este proceso son densas (3). Este proceso es muy utilizado para la producción de agua potable a partir del agua de mar, compite con la destilación y la electrodiálisis, cuando la producción de agua se desea hacer a gran escala; la escogencia de uno u otro proceso depende de las condiciones existentes en el sitio en el sitio en donde se desea obtener el agua potable. La presión de operación está entre los 25 y 35 bar, cuando la salinidad es de 4,5% y la temperatura es de 30 ºC. Además de la producción de agua potable a partir de agua de mar (o de aguas salobres) la ósmosis inversa se usa para: la fabricación de soluciones inyectables, la separación de virus y bacterias, la producción de agua ultra pura para diálisis renal, entre otras aplicaciones (2). • Separación de Gases: La separación de mezclas gaseosas, también es posible gracias a las membranas, para ello se puede utilizar membranas porosas o membranas no porosas (densas u homogéneas). Con las membranas porosas la separación se hace por difusión a través de los poros (flujo de Knudsen). Un proceso muy conocido que utiliza membranas cerámicas porosas, es la separación de los isótopos de uranio, a partir del 16 Capitulo I Membranas. hexafluoruro de uranio (UF6). Con las membranas densas los gases se separan debido a la diferencia de solubilidad que existe entre los diferentes componentes del gas en las membranas, un ejemplo de esto es la separación del oxígeno del aire. Entre las aplicaciones de esta técnica tenemos: la recuperación de hidrógeno del gas de purga de las plantas de amoníaco, la recuperación de hidrógeno de las corrientes gaseosas de refinería y la deshidratación del aire (2). 1.4.2 • Procesos que Utilizan el Gradiente de Concentración. Diálisis: En un proceso de diálisis uno o más solutos son transferidos desde una solución (la alimentación) hasta la otra solución (el dializado), a través de una membrana gracias a la existencia de un gradiente de concentración a ambos lados de dicha membrana (5), que produce un flujo de soluto que tiende a igualar las concentraciones. La aplicación más conocida es la diálisis sanguínea, en donde el riñón es sustituido por unas membranas artificiales. La idea es separar los productos tóxicos producidos por el organismo como la urea o la creatinina. Las membranas de diálisis del riñón representan aproximadamente el 80% del mercado mundial de membranas. Este proceso también es muy utilizado en la industria farmacéutica, cosmética y de perfumes para desmineralizar el agua usada o para extraer compuestos importantes. Se puede también asociar la diálisis con la fermentación, con el objeto de extraer los compuestos que pueden ser tóxicos para los microorganismos encargados de la fermentación y por lo tanto mejorar la producción (2). • Pervaporación: En la pervaporación son removidos los componentes orgánicos volátiles que se encuentran en una mezcla líquida, a través de una membrana semipermeable, que posteriormente los conduce hacia una fase gaseosa y se utilizan membranas similares a la de la diálisis. La separación de los componentes de una mezcla líquida es determinada por la diferencia de las presiones de vapor y también por las tasas de permeabilidad a través de la membrana. En la pervaporación se utilizan membranas densas, que basan su selectividad en la solubilidad del componente que 17 Capitulo I Membranas. van a separar en la misma. La fuerza impulsora del proceso es la diferencia de potencial químico de los componentes entre las dos fases separadas por la membrana, la cual es generada por un gradiente de concentración dentro de la interfase de la membrana, este gradiente de potencial químico, por lo general es inducido al aplicar una presión de vacío en el lado de la fase gaseosa (5). Entre las aplicaciones de la pervaporación encontramos: la producción de alcohol puro, técnica que compite con la destilación azeotrópica, en la deshidratación de solventes orgánicos, en la desalcoholización de la cerveza y del vino, en la concentración del jugo de fruta (2). 1.4.3 Procesos que Utilizan el Gradiente de Potencial Eléctrico. Todas estas técnicas tienen en común la aplicación de un campo eléctrico y la utilización de membranas cargadas eléctricamente para separar iones esencialmente. Se usan tres tipos de membranas para estos procesos, las de intercambio aniónico, que deja pasar solo los aniones; las membranas catiónicas que sólo deja pasar cationes y las bipolares que son permeables por una cara para los cationes y por la otra para los aniones. En el capitulo II se tratará más a fondo sobre estos tipos de membranas. • Electro – Electrodiálisis (Proceso Cloro soda): Un ejemplo, consiste en la producción de cloro y soda cáustica (NaOH) utilizando para la separación una membrana catiónica, en uno de los compartimientos va el ánodo y una solución de cloruro de sodio, y en el otro compartimiento el cátodo y agua. Al aplicar una diferencia de potencial eléctrico entre los dos electrodos, los iones sodio, que están cargados positivamente, emigran a través de la membrana hacia el agua, y así contrarresta la producción de iones hidroxilo, producto de la reacción catódica, la cual además produce hidrógeno, los iones cloro cargados negativamente se mueven hacia el ánodo y se oxidan produciendo cloro. La membrana catiónica previene la migración de los iones hidroxilos al compartimiento catiónico ya que ella solo es permeable para los cationes (5). La función y los tipos de membranas cargada eléctricamente se explicará con más detalle en el siguiente capitulo. 18 Capitulo I Membranas. • La Electrodiálisis con membranas bipolares: La configuración de este proceso es similar a la de la Electrodiálisis que se explicará mas adelante, pero a diferencia de este se usa una membrana bipolar. Esta membrana bipolar permite la hidrólisis del agua y posibilita la producción de ácidos y bases. Actualmente este proceso se usa para la regeneración de los efluentes de decapado del acero inoxidable y recuperar el HF, el HNO3 y el KOH (2). • La Electrodiálisis: Este proceso es el objeto de estudio del trabajo y se explicará con detalle en el capitulo II. 19 Capitulo II La Electrodiálisis. CAPITULO II LA ELECTRODIÁLISIS. La Electrodiálisis es una tecnología de membranas que permite, bajo la influencia de un campo eléctrico continuo, extraer sustancias orgánicas e inorgánicas ionizadas disueltas en una disolución acuosa, a través de membranas selectivas de intercambio iónico (7). La Electrodiálisis, al igual que todos los procesos de separación por membranas mencionadas en el capitulo anterior, se basan en la transferencia de masa a través de una membrana, con la particularidad de que en este caso se trasportan especies iónicas de bajo peso molecular de una solución a otra a través de membranas selectivas a los iones. La Electrodiálisis puede definirse también como un método de separación electroquímico en el que la transferencia de iones se logra por la aplicación de un campo eléctrico sin que se lleve a cabo ninguna reacción química (9). La Electrodiálisis puede remover sales de alimentos, de lácteos, de corrientes de desecho y otras soluciones y al mismo tiempo se usa para concentrar sales, ácidos o bases. El sistema es muy útil para remover el contenido total de sales disueltas indeseadas en corrientes de desechos industriales como lo son las aguas de producción de un pozo petrolero. 2.1 Desarrollo Histórico de la Electrodiálisis. Los primeros usos de la electrodiálisis se remontan a principios del siglo XIX cuando Schwein utilizó esta técnica para purificar extractos azucareros; no obstante, su invención se atribuye a Morse y Pierce quienes, en el año 1903 introdujeron un par de electrodos en los compartimentos de una celda de diálisis para acelerar el proceso de separación de electrolitos de una solución de gelatina. No fue hasta 1940, cuando Meyer y Strauss propusieron la utilización de membranas selectivas eléctricamente cargadas para separar aniones y cationes. Las membranas se sitúan alternativamente entre un par de electrodos, separadas entre si 1 mm o menos. Con el desarrollo, a finales de los años cuarenta, de membranas más selectivas y con una baja 20 Capitulo II La Electrodiálisis. resistencia eléctrica, este tipo de dializador se convirtió en una opción valida para realizar operaciones de dilución y concentración de disoluciones de electrolitos. Una ventaja de esta disposición es que sólo utiliza dos electrodos para un número muy elevado de membranas y, por lo tanto, las reacciones irreversibles que se producen en los electrodos se distribuyen en muchos compartimientos de concentrados y diluidos, con lo que se minimizan sus efectos. Además los problemas que pueden ocasionar el manejo de los productos formados en los electrodos son asimismo minimizados (10). 2.2 Principios de La Electrodiálisis. Cuando se establece un campo eléctrico en un electrodializador, los iones migran hacia el ánodo o el cátodo, según el signo de su carga. Debido a la disposición de las membranas, aparecen compartimientos donde las disolución del electrolito se empobrece en éste y otros, donde el electrolito se concentra. Los cationes que están en un compartimiento de diluidos migran por efecto del campo eléctrico hacia el cátodo, encontrándose en primer lugar una membrana catiónica, que permite el transporte, pasando al compartimiento adyacente donde, en su camino, se encuentran con una membrana aniónica que no pueden atravesar, quedando retenidos en este compartimiento. Los aniones migran hacia el ánodo, encontrándose una membrana aniónica que pueden atravesar para entrar en un compartimiento de concentrados, donde en su trayectoria se encuentran con una membrana catiónica que no permite su transporte, quedando retenidos en este compartimiento (10). Para que ocurra un funcionamiento como el descrito anteriormente el modulo de electrodiálisis debe estar formado por dos electrodos metálicos que establecen el campo eléctrico, cátodo y ánodo, entre los cuales están colocadas las membranas como se muestran en la figura 2.1. 21 Capitulo II La Electrodiálisis. Figura 2.1 Representación de un proceso de electrodiálisis (20) Como se dijo las membranas deben ser de dos tipos, una selectiva a los cationes como calcio, sodio, potasio, amonio etc. que comúnmente son llamadas Catiónicas; el otro tipo de membranas es selectiva a los aniones como el cloruro, hidróxido, nitrato, acetato, etc. y se conocen como Aniónicas. Las membranas deben ir de forma alternada, es decir, una membrana catiónica luego una aniónica, nuevamente una catiónica y así sucesivamente formando lo que se conoce como el modulo de Electrodiálisis. Entre cada par de membranas se coloca un separador que consiste de una malla plástica que proporciona canales de flujo a través de los cuales fluyen las soluciones, creando turbulencia lo que mejora la transferencia de iones, y además sirve de soporte a las membranas (11). En la figura 2.2 se esquematiza una unidad de Electrodiálisis de dos compartimientos con objeto de ilustrar el funcionamiento del proceso. Como se dijo consta de un conjunto de membranas de intercambio iónico dispuestas alternativamente entre dos electrodos, de tal forma que dan lugar a dos compartimientos. Por el compartimiento diluido (D) circula la disolución cuyos iones se desean extraer, y por el concentrado (C), la disolución en la que dichos iones se van a concentrar. 22 Capitulo II La Electrodiálisis. Figura 2.2 Esquema de un módulo de Electrodiálisis de celdas de dos compartimientos Al aplicar una diferencia de potencial entre los electrodos, los aniones migran a través de las membranas de intercambio aniónico desde los compartimientos D a los C, donde quedan atrapados, pues en su camino se interpone la barrera iónica constituida por membranas de intercambio catiónico. Análogamente los cationes migran, a través de las membranas de intercambio catiónico, desde los compartimientos D a los C, donde se concentran al impedirles las membranas aniónicas su migración hacia el cátodo. Las reacciones electródicas sólo se utilizan a efectos de proporcionar el campo eléctrico necesario para que se produzca el proceso (7). Se denomina celda a la unidad básica formada, para el caso de la electrodiálisis de dos compartimientos, por una membrana catiónica, una membrana aniónica y dos espaciadores. Al conjunto de celdas se le llama módulo de electrodiálisis. En un módulo como el esquematizado en la figura 2.2 pueden haber hasta 500 celdas de dos compartimientos. La configuración de dos compartimientos no es la única que puede ser posible, hay módulos conformados por tres y cuatros compartimientos (7). 23 Capitulo II La Electrodiálisis. La distancia entre membranas existente en los equipos industriales está comprendida entre 0,4 y 2 mm. Está definida por la presencia entre cada par de membranas de una junta y de un espaciador. La función de este último es además proporcionar una distribución de flujo uniforme dentro de cada compartimiento (7). Generalmente sólo una pequeña cantidad de agua atraviesa la membrana, esencialmente sólo el agua de hidratación de los iones transferidos. En el caso de desionización de una solución concentrada, el transporte de esta agua de hidratación puede ser útil para concentrar la solución tratada en materiales no ionizados. El trasporte de iones generalmente no es acompañado de materiales no ionizados cuyo peso molecular sea mayor a 200, aunque existen membranas que permiten que materiales no ionizados de peso molecular mayor a 500 sean transportados con el agua de hidratación (12). La electrodiálisis es un proceso termodinámicamente reversible, de manera que la dirección del flujo de materia y carga puede ser invertida simplemente invirtiendo la polaridad del sistema. Esta característica diferencia de la diálisis por difusión que es un proceso prácticamente irreversible (9). Otra característica importante es que la electrodiálisis, en contraste con la ultrafiltración, diafiltración, diálisis e intercambio iónico, permite recuperar el ión removido en una solución más concentrada que aquella de la que fue eliminado y libre de iones extraños. Muchas veces esta alta concentración permite reutilizar los electrolitos recuperados. Otra ventaja es que no se requieren regeneradores químicos, como en el caso de la desionización por intercambio iónico, gracias a que no ocurre una reacción química (12). Podemos conseguir equipos de electrodiálisis en diferentes configuraciones dependiendo de los requerimientos de la separación que se desea realizar, la operación puede realizarse de forma continua, discontinua (por lotes) o semicontinua (7). La operación por lotes tiene la ventaja que permite un producto de concentración definida, es posible alcanzar una relación de concentraciones entre el diluido y concentrado que puede llegar hasta 1/150, 24 Capitulo II La Electrodiálisis. sin embargo, resulta inadecuada para grandes instalaciones debido al tamaño de los recipientes de almacenaje (11). La configuración en continuo permite manejar grandes cantidades del fluido a tratar. En este tipo de proceso se hace necesario colocar varios módulos de electrodiálisis en serie (electrodiálisis multietapa) o ser recirculado una segunda vez (doble paso). Otra modalidad consiste en recircular el concentrado, con lo que se obtiene ventajas adicionales: se aumenta el porcentaje de recuperación, se disminuye el consumo de hidráulico y la cantidad de concentrados a evacuar. Sin embargo, concentraciones muy elevadas de la solución a tratar disminuyen la selectividad de las membranas y aumenta el trasporte de agua a través de las mismas (11). El modo semicontinuo o Feed and Bleed en la terminología anglosajona es una combinación de los otros dos (discontinuo y continuo). Se utiliza cuando las condiciones de proceso son las adecuadas para operar en discontinuo y la densidad de corriente límite no es muy baja. De esta forma se combinan las ventajas del discontinuo, lográndose elevados grados de desalación, y las del continuo, aparte del periodo de puesta en marcha del equipo, el sistema opera de voltaje y densidad de corriente constante en el tiempo, lo que simplifica el control de la operación e incide positivamente en la estabilidad de las membranas, que no se ven sometidas con tanta frecuencia a los cambios bruscos de concentración típicos del proceso discontinuo (7). 2.3 Membranas de Intercambio Iónico. Existen muchos tipos de membranas con funciones y propiedades muy particulares. En el caso de la electrodiálisis se usan membranas cargadas eléctricamente o mejor conocidas como, membranas de intercambio iónico. Las características principales de este tipo de membranas son su alta selectividad hacia especies iónicas, poseen una resistencia eléctrica baja (entre 0,3 y 2 mili-ohms/m2), buena resistencia mecánica y gran estabilidad química y biológica. Químicamente estas membranas 25 Capitulo II La Electrodiálisis. son resinas de intercambio iónico de forma de láminas cuyo espesor está entre 0,15 y 0,6 mm (12). Existen membranas de intercambio iónico orgánicas (poliméricas) e inorgánicas. Sin embargo, hoy por hoy las únicas utilizadas a escala industrial son las primeras (7), por ello el estudio de este tipo de membranas se centrará exclusivamente en las mismas. Básicamente una membrana de intercambio iónico consta de una estructura polimérica entre cruzada, que tienen fijo una gran concentración de grupos funcionales cargados, negativamente en las membranas de intercambio catiónico y positivamente en las de intercambio aniónico. El entrecruzamiento es necesario para evitar que los polímeros que portan los grupos intercambiadores se disuelvan en agua. Además, el grado de entrecruzamiento es importante pues afecta a las propiedades de la membrana. Uno de los agentes de entrecruzamiento más utilizados es el divinilbenceno (DVB), en concreto con el vinilpoliestireno y la vinilpiridina (7). Las membranas aniónicas contienen grupos positivos fijos en la red polimérica que están neutralizados eléctricamente por grupos aniónicos móviles que están en los intersticios de la red débilmente asociados a los grupos catiónicos fijos. Las membranas catiónicas poseen grupos negativos fijos en la red polimérica y cationes móviles en los intersticios. La cantidad de cargas fijas de una membrana constituye su capacidad de intercambio, y se expresa en equivalentes-gramo por kilogramo de masa de membrana. Las membranas comerciales tienen una capacidad de intercambio comprendida entre 0,5 y 3 eq-g/kg (11). Los grupos intercambiadores más usuales en las membranas comerciales son: • Sulfonato, -SO-3, y carboxilato, -COO- en las membranas de intercambio catiónico. • Amonio cuaternario, -NR3+, o amina terciaria, -NR2, en las membranas de intercambio aniónico. La química relacionada con su preparación es similar a la utilizada para fabricar las bien conocidas resinas de intercambio iónico. De hecho, una membrana de intercambio iónico 26 Capitulo II La Electrodiálisis. puede considerarse como una resina de intercambio iónico en forma de lámina, con la salvedad de que no es necesario regenerarlas (7). Para que una membrana pueda cumplir correctamente su función de intercambio, los intersticios de la red polimérica deben estar embebidos en el disolvente, que casi siempre es agua. Es decir, la membrana se presenta como un gel hinchado por el disolvente (7). En la figura 2.3 se presenta esquemáticamente una sección transversal de una membrana de intercambio catiónico separando dos disoluciones, así como su mecanismo de acción. Las cargas negativas fijas a la estructura polimérica son neutralizadas gracias a los iones de carga contraria, llamados contraiones (en este caso los cationes). Figura 2.3 Esquema de una membrana de intercambio catiónico y de su mecanismo de transporte de los cationes desde la disolución A a la B bajo la acción de un campo eléctrico (7) Bajo la acción de un campo eléctrico los cationes se mueven desde la disolución A a la B a través de los canales formados por los intersticios de la matriz polimérica que constituye a la membrana. Por el contrario, los aniones, llamados coiones, son rechazados puesto que tienen la misma carga eléctrica que los iones unidos a la membrana. Este ultimo fenómeno es conocido como exclusión Donan (7). Como consecuencia, desde un punto de vista teórico, los 27 Capitulo II La Electrodiálisis. cationes transportan prácticamente la totalidad de la corriente eléctrica a través de la membrana. En el caso de las membranas aniónicas, son los aniones quienes trasportan la corriente eléctrica. De acuerdo a su fabricación, las membranas de intercambio iónico pueden clasificarse en homogéneas y heterogéneas. 2.3.1 Clasificación de las Membranas de intercambio Iónico. 2.3.1.1 Clasificación según su estructura Física • Membranas Homogéneas: Las membranas homogéneas tienen propiedades uniformes en todos los puntos. Se obtienen por una reacción de condensación de polifenoles o poliaminas, el producto de la reacción es impregnado sobre un tejido sintético formando una película delgada de material intercambiador. También pueden fabricarse por fijación de un grupo funcional fijo sobre un soporte inerte (cloruro de polivinilo, polietileno, teflón), o por inmovilización de un electrolito como en el caso del poliestireno sulfónico (13). • Membranas Heterogéneas: Estas están constituidas por dos fases poliméricas diferentes. Sus principales desventajas son; canales de flujo excesivamente grandes, alta resistencia eléctrica en disoluciones salinas diluidas, baja resistencia mecánica en su estado altamente hinchado. El excesivo tamaño en sus canales de flujo origina una elevada transferencia de agua por eléctro-ósmosis y una excesiva difusión de moléculas neutras entre las disoluciones separadas por la membrana (7). 28 Capitulo II La Electrodiálisis. 2.3.1.2 Clasificación según su capacidad de intercambio. Desde el punto de vista de su capacidad de intercambio se clasifican en: • Catiónicas, solo permeables a los cationes. • Aniónicas, sólo permeables a los aniones. Teóricamente las primeras son selectivas a los cationes, mientras que las segundas lo son exclusivamente a los aniones. A su vez cada una de ellas e clasifican en: • Débiles. • Fuertes. Las débiles son aquellas cuyos grupos intercambiadores de iones se disocian parcialmente en medio acuoso. Pertenecen a este grupo los grupos carboxilato –COO- en el caso de las catiónicas y los grupos amonio primario –NH3+en el caso de las aniónicas. Así el grupo – COO- se encuentra prácticamente en su forma no disociada, -COOH, por debajo de pH 6, su capacidad de intercambio es en consecuencia muy reducida por debajo de tal pH. En el caso de la aniónicas sucede lo contrario. Los grupos –NH3+ se encuentran en su forma no disociada, NH2, por encima de pH 7. Las fuertes son aquellas cuyos grupos intercambiadores de iones se encuentran disociados completamente en todo el intervalo de pH. Por ejemplo, el grupo sulfonato, -SO3-, en las catiónicas y el amonio cuaternario en las aniónicas. 2.3.1.3 Clasificación según su estructura química. Desde el punto de vista de sus estructuras química se clasifican en: Perfluoradas y no perfluoradas. Las primeras fueron inicialmente desarrolladas a principios de los años sesenta, encontrando desde entonces un amplio abanico de aplicaciones debido a su gran resistencia química y mecánica (7). Ellas fueron desarrolladas primordialmente para superar las limitaciones que poseen las membranas basadas en hidrocarburos, al ser sometidas a medios oxidantes o degradantes. Su uso principal se encuentra en las celdas de electrodiálisis, en las cuales muestra excelente estabilidad térmica y química. Las membranas fabricadas por DuPont se comercializan bajo el nombre de Nafión, y su estructura química se basa en un 29 Capitulo II La Electrodiálisis. copolímero de tetrafluoroetileno y un éter vinilico perfluorado que porta un grupo terminal sulfónico. Existen asimismo membranas perfluoradas, por ejemplo las Flemion de Asahi Glass, con grupos intercambiadores de iones débiles, en las que el grupo sulfónico se ha sustituido por un carboxilato, -COONa (7). Las membranas no perfluoradas se encuentran fácilmente disponibles tanto en forma catiónica como aniónica, son las mas usadas en electrodiálisis por ser las más económicas. Tabla 2.1 Membranas heterogéneas de electrodiálisis. Nombre lonac Fabricante lonac Chemical Co. Tipo de membrana Codificación lonac Amberplex Ionac Rohm & Haas Chemical Co. Nepton Neosepta Ionics Inc. Tokuyama Soda Ltd. Permaplex Permutit Permutit Permutit Co. Co. (Zerolit (Zerolit Ltd.) Ltd.) C A C A C A C A C A C A C A MC3142 MA3148 MC3470 MA3475 C1 A1 CR61 AR111 CL25T AV4T C10 A10 C1373 A1374 0,15 0,17 0,3 0,4 0,7 0,7 0,6 0,6 0,17 0,15 0,5 0,5 0,2 0,2 305 305 305 127 127 102 102 102 102 102 0,04 0,04 0,03 0,04 0,05 0,05 0,02 0,02 0,05 0,5 0,03 0,03 1,05 1,13 2 1 3,0 1,6 1,8 2,0 2,0 1,3 96,2 99,0 90,0 86,8 98,0 96,0 90,0 82,0 9,6 10,5 6,0 12,0 3,2 4,7 25,0 60,0 8,0 8,0 13,3 14,0 7,9 8,6 4,0 7,0 Espesor del espaciador (mm) Longitud de La Membrana (cm) 305 Ancho de la membrana (cm) 102 Espesor de la membrana (cm) 0,02 0,02 cambio (meq/gr) 0,95 0,60 Selectividad (%) 94,1 90,0 9,1 10,1 13,0 13,3 Capacidad de Resistencia z eléctrica (W*cm ) 40,0 60,0 Presión de ruptura (bar) (C) membrana catiónica; (A) membrana aniónica. P. Sucial, J. C. González-Bauza, Dimensionado y diseño de la electrodiálisis, enero 2001 30 Capitulo II La Electrodiálisis. Tabla 2.2 Membranas Homogénea s de electrodiálisis. Nombre A.M.F. A.M.F. Fabricante American Machine and Foundry American Machine and Foundry Nepton Ionics Inc. Selemion Selemion Asahi Glass Asahi Glass Co. Ltd. Co. Ltd. Acipex Acipex Asahi Chemical Asahi Chemical Industry Industry Co. Ltd. Co. Ltd. Tipo de membrana C A C A C A C A C A C A C A C60 A60 C100 A100 AZL183 BZL183 CMV AMV CMR ASR CK1 CA1 DK1 DA1 0,30 0,30 0,15 0,18 0,60 0,60 0,56 0,56 1,5 1,5 0,23 0,21 0,23 0,21 102 102 230 230 230 230 112 112 112 112 46 46 100 100 100 100 112 112 112 112 Codificación Espesor del espaciador (mm) Longitud de La Membrana (cm) Ancho de la membrana (cm) Espesor de la membrana (cm) 0,03 0,03 1,5 1,6 80,0 82,0 5,0 6,0 3,0 3,0 0,02 0,02 0,06 0,06 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 1,3 1,5 2,7 1,8 4,0 3,0 4,0 3,0 2,8 1,9 2,6 1,5 93,0 92,0 91,0 96,0 92,0 94,0 92,0 95,0 85,0 92,0 85,0 92,0 7,0 9,0 11,0 11,0 3,5 3,0 3,5 4,0 1,4 2,1 1,8 3,5 4,0 3,5 8,0 9,0 5,0 5,0 5,0 5,0 2,0 2,0 2,0 2,0 Capacidad de cambio (meq/gr) Selectividad (%) Resistencia eléctrica z (W*cm ) Presión de ruptura (bar) (C) membrana catiónica; (A) membrana aniónica. P. Sucial, J. C. González-Bauza, Dimensionado y diseño de la electrodiálisis, enero 2001 31 Capitulo II La Electrodiálisis. 2.4 Polarización. La polarización de concentración es un fenómeno que se produce en todos los procesos de separación con membranas. Sin embargo las características de la polarización en cada una de estas operaciones resulta ser muy diferente. En ultrafiltración y ósmosis inversa se produce por la acumulación, sobre la cara activa de la membrana, de solutos que no pueden atravesar la misma, con la formación de perfiles de concentración que actúan como una nueva barrera que dificulta la transferencia de materia del soluto y de disolvente transferible a través de la membrana (14). En los procesos de electro-membranas la densidad de trabajo máxima viene determinada por el fenómeno de polarización de la membrana que se produce cuando la concentración de la especie iónica a transportar disminuye por debajo de un nivel crítico, de tal forma que no es posible mantener la velocidad de transporte impuesta por la intensidad de la corriente (7). En electrodiálisis es de la misma manera, y el fenómeno tiene lugar cuando un ion se transfiere o descarga sobre la superficie de una interfase sólida, encontrándose sujeto a un valor límite en su transferencia de materia a través de dicha interfase. El fenómeno que afecta negativamente a la estabilidad de las membranas se ilustra en la figura 2.4, donde se representa el perfil de concentración en las interfases disoluciónmembranas en una celda de electrodiálisis de tres compartimentos formada por un ánodo, un cátodo, una membrana de intercambio aniónico y una de intercambio catiónico. 32 Capitulo II La Electrodiálisis. Figura 2.4 Gradientes de concentración en la interfase membrana-disolución, bajo el efecto de un campo eléctrico. MA y MC: membranas de intercambio aniónico y catiónico. X-: anión. M+: catión. A: anolito. C: catolito. B: disolución acuosa de una sal XM. Por el compartimiento B se alimenta una disolución acuosa de una sal XM. En la zona central de este compartimiento la mezcla de la disolución es completa, homogénea. Sin embargo, conforme las líneas de flujo se aproximan a las interfases disolución-membrana la velocidad lineal de la disolución disminuye, de tal forma que en las proximidades de las membranas existen zonas en las que no hay mezcla (zona estática, capa límite). Por razones idénticas estas zonas existen en las interfases disolución-membrana de los compartimientos A y C, correspondientes respectivamente al analito y al catolito. Al aplicar una diferencia de potencial entre los electrodos, los aniones X- migran desde B hacia el anolito A a través de la membrana de intercambio aniónico MA, mientras que los cationes M+ migran hacia el catolito C a través de la membrana de intercambio catiónico MC. 33 Capitulo II La Electrodiálisis. Como consecuencia, en las zonas estáticas del compartimento central disminuye la concentración del ion que es transportado con respecto a la de la disolución que alimenta dicho compartimiento: • El anión X- en la interfase membrana aniónica-disolución. • El catión M+ en la interfase membrana catiónica-disolución. Para compensar tal disminución, los iones de la zona de la mezcla homogénea del compartimiento central B migran hacia las zonas estáticas por difusión. En tanto y cuanto la velocidad de difusión sea igual a la de migración de los iones a través de la membrana, impuesta por la corriente eléctrica, se alcanzará una situación de equilibrio. Sin embargo, si la velocidad de migración a través de las membranas, determinada por la densidad de corriente aplicada, excede a la difusión, la concentración de iones en las zonas estáticas comenzará a disminuir hasta aproximarse a cero. En este momento se produce la polarización por concentración de la membrana. La densidad de la corriente a la que se inicia se denomina densidad de corriente limitante (o corriente límite). Por encima de ella se produce la electrohidrólisis del agua, transportándose H+ a través de la membrana de intercambio catiónico y OH- a través de la membrana de intercambio aniónico. El resultado neto de la polarización por concentración es: • Disminución de la concentración de iones en las interfases membrana-disolución de los compartimientos diluidos (compartimiento central B en la figura anterior) • Aumento de las concentraciones de iones en las interfases membrana-disolución de los compartimientos concentrados (compartimientos anódicos A y catódicos C en la misma figura). Las consecuencias de la polarización por concentración de trabajar por encima de la densidad de corriente limitante, son: • Incremento brusco de la resistencia eléctrica de la celda. • Disminución de la eficacia de la corriente. 34 Capitulo II La Electrodiálisis. • Disminución del pH en el compartimiento diluido y aumento en el compartimiento concentrado. El aumento de la resistencia eléctrica da lugar a un incremento en el consumo específico de energía del proceso. La disminución de la eficacia de la corriente origina: • Un mayor consumo específico de energía. • Una mayor área de membrana para una producción determinada. En definitiva, mayores costes fijos y variables. El aumento del pH en el compartimiento concentrado y la disminución en el diluido surge como consecuencia de que una vez producida la electrohidrólisis del agua, los iones OHson transferidos a través de la membrana aniónica al compartimiento concentrado, pero no así los iones H+ a través de la membrana catiónica. Este último comportamiento es anómalo y se desconoce la causa (7). El aumento del pH en el compartimiento concentrado puede dar lugar a la precipitación de hidróxidos insolubles, tales como los de calcio y magnesio. El fenómeno conocido en la literatura anglosajona como scaling conduce, tanto a un incremento adicional del consumo específico de energía, como a una disminución de la vida media de las membranas. En el mejor de los casos evitar este fenómeno exige añadir acido para neutralizar el exceso de iones OH-, lo que supone, tanto un coste adicional como un aumento de la complejidad del proceso. Para evitar tales problemas es importante que la densidad de corriente limitante sea lo más elevada posible para cada proceso. La densidad de corriente limitante, Ilim(A.cm-2), viene dada por la siguiente expresión: ( I lim / C d ) = DF /[δ (t m − t d )] (2.1) Donde: • Cd es la concentración de la sal en la disolución de alimentación. equivalente.cm-3. • D es el coeficiente de difusión de la sal, medido en cm2.s-1. 35 Capitulo II La Electrodiálisis. • F, el equivalente electroquímico. 96.500 culombios.equivalente-1. • δ es el espesor de la interfase membrana disolución, en cm. • tm es el número de transporte del ion en la membrana. • td es el número de transporte del ion en la disolución. Dependiendo del electrolito que se tenga, td puede aproximarse a 0,5 (la mitad de la corriente eléctrica en la disolución es transportada por los aniones y la otra mitad por los cationes). Si se supone que la selectividad de las membranas es del 100% tm será igual a 1 por lo tanto, la ecuación anterior se transforma en: ( I lim / C d ) = D.F /(0,5.δ ) (2.2) De donde se deduce que el aumento de la densidad de corriente limitante requiere: • disminuir el espesor de la interfase membrana-disolución (zonas estáticas) mediante el aumento de la velocidad de alimentación de la disolución. • Aumentar la concentración de la disolución de alimentación. Además de la polarización por concentración existen dos fenómenos también importantes por sus efectos negativos sobre la eficacia de un proceso de electromembranas: el envenenamiento y la formación de incrustaciones (fouling). El envenenamiento de las membranas se debe a la unión extremadamente fuerte de ciertos iones por parte de los grupos intercambiadores de iones. Por ejemplo, el Mn+2 en el caso de las membranas de intercambio catiónico. La única forma de evitar este inconveniente es eliminar el ión causante del problema de la disolución mediante un tratamiento previo que puede incluir resinas de intercambio iónico o precipitación en forma de hidróxidos. La formación de incrustaciones está relacionada con la oclusión de los poros de la membrana por parte de sustancias de gran tamaño que afecta fundamentalmente a las membranas de intercambio aniónico, en disoluciones que contengan tensoactivos, proteínas, ácidos húmicos, etc. En el caso de las catiónicas pueden producirse por precipitación interior 36 Capitulo II La Electrodiálisis. de la matriz polimérica de óxidos metálicos hidratados. Al igual que los otros dos tipos de polarización estudiadas con anterioridad esta conduce a un incremento del consumo específico de energía, una disminución de la eficacia de la corriente (aumento de la resistencia de la membrana) y una disminución de la vida media de las membranas. En general, la formación de incrustaciones se puede evitar o minimizar: • Eliminando la materia orgánica de alto peso molecular en un tratamiento previo. • Incrementando el tamaño del poro de las membranas. • Disminuyendo la rugosidad de la superficie de las membranas. • Trabajando en condiciones que minimicen la polarización por concentración. Por ejemplo, a altas velocidades de alimentación. • Limpieza con compuestos químicos. Disoluciones diluidas de ácidos, bases o agentes complejantes (EDTA que disuelve los óxidos de hierro hidratados incrustados en las membranas catiónicas). • Invirtiendo periódicamente la polaridad de la celda. 2.4.1 Determinación de la corriente Límite. Partiendo de la ecuación 2.2 que expresa matemáticamente el proceso de polarización se puede calcular la corriente limite como se mencionó anteriormente. Pero surge un problema y es que el espesor de la capa limite no puede ser medido directamente, por lo tanto, es necesario estimar experimentalmente el valor de la corriente límite. Se ha encontrado que este parámetro depende de la velocidad de flujo, y se han desarrollado ecuaciones empíricas que las relacionan: (i / C ) lim = α . Re β (2.3) Donde el coeficiente Re es el número de Reynolds, β está próximo a 1/3 y α oscila entre 0,6 y 1 (14). Una ecuación comúnmente aceptada como primera aproximación para cualquier tipo de membrana, y rigurosa para membranas Nepton (marca comercial de membranas), a una temperatura de 20 ºC es la siguiente: 37 Capitulo II La Electrodiálisis. J lim = 145.C.u 0, 6 (2.4) Jlim: Densidad de corriente límite en mA/cm2 C: concentración del circuito diluido en eq/L U: velocidad de flujo en cm/s. (13) El método más utilizado para determinar la corriente límite consiste en elaborar una curva de polarización, para lo cual se gráfica la diferencia de potencial aplicada a los electrodos en función de la intensidad de la corriente, bajo condiciones de concentración y temperatura constante. La curva presenta un cambio de pendiente brusco debido al aumento de la resistencia cuando se alcanza el valor máximo de corriente que la solución puede transportar, el punto donde se observe esta inflexión en la curva corresponde a la corriente límite (15). Para obtener un cambio de pendiente mas marcado, se puede graficar la resistencia aparente del conjunto de membranas, que corresponde a la diferencia de potencial entre la intensidad de corriente (V/I), frente al inverso de la intensidad de corriente (1/I) (11). 2.5 Componentes Básicos de un Módulo de Electrodiálisis. Para el caso en el que los compartimientos electródicos comparten un electrolito común. Básicamente consta de los siguientes sistemas: • Hidráulico. • Eléctrico A su vez, el sistema hidráulico consta de los sistemas de: • Alimentación de los compartimientos diluidos. • Alimentación de los compartimientos concentrados • Alimentación de los compartimientos electródicos. El sistema eléctrico lo constituye un par de eléctrodos de polaridad opuestas que permiten aplicar diferencias de potencial y densidades de corrientes diferentes según sea las necesidades del proceso. La corriente fluye en serie entre los dos electrodos a través de las 38 Capitulo II La Electrodiálisis. diferentes celdas que componen el módulo. El consumo energético por lo general es bajo y viene expresado por la suma de la energía eléctrica necesaria para transferir los iones a través de las membranas y la energía eléctrica necesaria para bombear las disoluciones a través de los compartimientos del módulo. Cuando la concentración de los iones en la alimentación es elevada, predomina el primer término, que depende de la resistencia de los diferentes componentes del módulo de electrodiálisis (7). Una vez especificados los sistemas que contribuyen a un módulo de electrodiálisis, se puede comenzar a hablar de sus componentes básicos (ver figura 2.5). Los cuales son: • Electrodos. • Membranas. • Espaciadores. • Juntas. Espaciadores (3 y 5) Figura 2.5 Esquema de un módulo de Electrodiálisis 2.5.1 Electrodos: Los eléctrodos son materiales conductores de la electricidad, a través de los cuales se verifica la transferencia electrónica con la disolución en la que se encuentran las sustancias cuya transformación se desea. En electrodiálisis únicamente cumplen la función de proporcionar el campo eléctrico necesario para que se produzca el proceso. Por lo tanto son DSAs (ánodos dimensionalmente estables como los elaborados con óxidos metálicos por ejemplo los de dióxido de estaño) ó Pt/Ti (platino soportado sobre titanio) como ánodos, y acero inoxidable como cátodo. 39 Capitulo II La Electrodiálisis. Otro factor a tomar en cuenta es la ocurrencia de reacciones en la superficie de los electrodos. Para minimizar este factor se deben emplear soluciones de lavado con electrolitos, como el sulfato de sodio, que no se electrolicen en las condiciones de trabajo. Con frecuencia las soluciones de lavado de ambos electrodos se mantienen separadas, pero por lo general estas dos corrientes se mezclan para compensar la diferencia de pH generada por las reacciones electródicas, del mismo modo, se le adiciona ácido a dicha solución para evitar la precipitación de calcio y magnesio. En las instalaciones industriales, en donde se manejen grandes cargas de alimentación, es de gran importancia mantener separados los gases generados en ambas reacciones (la anódica y la catódica), ya que en el ánodo se forma oxígeno con algo de cloro y en el cátodo se forma hidrógeno, los cuales al mezclarse pueden originar una combustión incontrolada del hidrógeno (7). 2.5.2 Membranas: Basta recordar que en electrodiálisis los criterios más importantes que se toman en cuenta para seleccionar las membranas de intercambio iónico, son los de alta permselectividad y baja resistencia eléctrica. La única excepción la constituyen las dos membranas que delimitan los compartimientos electródicos (de las soluciones de lavado). Éstas últimas deberían ser perfluoradas, de alta resistencia química, ya que se enfrentan a un ambiente químico mucho más agresivo que el resto de las membranas del módulo (oxidante en el ánodo y valores extremos de pH, ácido en el ánodo y básico en el cátodo) (7). 2.5.3 Espaciadores: Los espaciadores son materiales plásticos (polietileno, poliéster) en forma de malla que se colocan entre cada par de membranas. Sus funciones son las siguientes: • Proporcionar los canales de flujo a través de los cuales fluyen las disoluciones. • Actuar como promotores de turbulencia y controlar la distribución de flujo. • Sellar las celdas. • Soportar las membranas. Actualmente existen dos tipos básicos de espaciadores (ver figura 2.6) que se diferencian por el recorrido que la disolución realiza por el interior de los compartimientos del módulo: • De flujo tortuoso (tortuous path). 40 Capitulo II La Electrodiálisis. • De flujo laminar (sheet flow). Figura 2.6 Diferentes tipos de espaciadores: a) de flujo tortuoso; b) de flujo laminar. A: entrada de la disolución de alimentación. B: camino del flujo. E: malla espaciadora de plástico. P: promotores de turbulencia. S: salida de la disolución del producto. 2.5.4 Juntas: Su objetivo es doble: Evitar fugas de electrolito en la celda, ya que es fuente importante de problemas tales como cortos circuitos; y evitar la mezcla de las corrientes que fluyen por los compartimientos concentrados y diluidos. Deben poseer alta estabilidad química y resistencia mecánica. Es de gran interés que ambas propiedades se satisfagan con el menor espesor posible, pues de esta forma se minimizará las distancia intermembránica y por lo tanto el consumo específico de energía (3). 41 Capitulo II La Electrodiálisis. 2.6 Aplicaciones de la Electrodiálisis. La electrodiálisis es un proceso único, ya que permite separar especies iónicas que muchas veces no pueden ser separados por otros métodos. Además, tienen la ventaja de que es adaptable tanto a procesos continuos como a procesos por etapas. Por estas razones tiene muchas aplicaciones industriales, algunas de las cuales se mencionaran a continuación. 2.6.1 Producción de Salmuera. Es la aplicación más importante en términos de la capacidad mundial instalada. Permite la concentración de agua de mar produciendo una salmuera de la que finalmente se obtendrá sal sólida. De esta forma se reducen los costos, ya que la cantidad de agua que se debe evaporar para obtener los cristales de sal será mucho menor, lo que implica un menor gasto de energía (12). Por estas consideraciones y otras locales la sal de mesa se fabrica en Japón por electrodiálisis. La producción anual estimada es superior a las 350.000 toneladas, que exigen más de 500.000 m2 de área de membrana. Los lideres en este campo son obviamente las empresas japonesas TOKUYAMA SODA, ASAHI GLASS y ASAHI CHEMICAL (7). 2.6.2 Desalinización de Agua. Con este método puede producirse agua para la industria petroquímica, refinerías, agua para caldera y generadores de vapor, agua para refrigeración, e incluso agua potable (Figura 2.7). Este proceso resulta adecuado para obtener agua potable a partir del agua de mar en aquellos lugares donde las fuentes de agua son escasas, la mayor parte de las plantas potabilizadoras de agua salada se encuentran en Oriente Medio y en el Norte de África (10). 42 Capitulo II La Electrodiálisis. Figura 2.7 Unidad a gran escala para la desalación de agua de mar 2.6.3 Desmineralización del Suero Lácteo. Es la tercera aplicación en cuanto a capacidad mundial instalada. El lactosuero como efluente es muy contaminante por su alta demanda bioquímica de oxígeno y su alta demanda química de oxígeno. En algunos países industrializados, este suero es recuperado por diversas técnicas, ya que contienen una cantidad no despreciable de proteínas, lactosa y calcio que lo hacen atractivo para la elaboración de productos lácteos. Para mejorar el lactosuero se debe disminuir o eliminar el contenido de sal y en algunos casos disminuir su acidez. La electrodiálisis permite separar la sal del suero salado sin eliminar los compuestos orgánicos, como proteínas y lactosa, presentes en el suero gracias a la selectividad de las membranas utilizadas. Por medio de electrodiálisis también es posible separar ácido láctico formado por fermentación de la lactosa presente en el suero lácteo (16). 2.6.4 Recuperación de Productos Químicos. Se puede utilizar para recuperar los reactivos en procesos de neutralización ácido base en los que se obtiene una sal de poco valor. Por ejemplo, en la industria papelera se producen grandes cantidades de sulfato de sodio, este producto puede convertirse de nuevo en ácido sulfúrico y sosa por medio de una electrodiálisis (10). 43 Capitulo II La Electrodiálisis. 2.6.5 Separación de Aminoácidos. Los aminoácidos tienen la propiedad de que pueden ser protonados a valores de pH que dependen de su punto isoeléctrico. Aprovechando esto, puede llevarse a cabo una separación por electrodiálisis a diferentes pH para cada aminoácidos (10). 2.6.6 Recuperación de sales metálicas en Procesos de Recubrimiento Galvánicos. Mediante electrodiálisis se logra concentrar las aguas de lavado de los recubrimientos y recircularlas al proceso, con lo que se logra una recuperación superior al 90 %, no sólo de los metales contenidos en la disolución de lavado, sino también de otros compuestos como ácido bórico y cianuros. Además se minimiza el problema medioambiental que implica desechar esta agua de lavado. Ejemplos de esta aplicación son la recuperación de níquel y sales de cobre, entre otros (16). 2.6.7 Recuperación de ácidos Minerales y Metales Pesados. Por medio de procesos de electrodiálisis con membranas muy especializadas, es posible obtener concentraciones de ácidos comprendidas entre 12 y 22 %, partiendo de disoluciones 100 veces más diluidas, lo que facilita el reciclado de dichos ácidos. En el caso de efluentes que contienen metales pesados y otros residuos tóxicos es posible eliminarlos, siempre y cuando estén ionizados, y concentrarlos para, mediante un tratamiento posterior recuperarlos o depositarlos en vertederos controlados (16). 2.6.8 Electrodiálisis con Membranas Bipolares. Las membranas bipolares tienen la propiedad de comportarse como aniónicas por una cara y catiónicas por otra. La aplicación más importante de este proceso es la regeneración de baños de decapado de acero. Las aguas residuales del proceso de decapado contienen hidróxidos metálicos, ácido fluorhídrico (HF) y ácido de nítrico (HNO3). Para su recuperación se precipitan los hidróxidos metálicos añadiendo hidróxido de potasio (KOH), y la solución resultante es sometida a una electrodiálisis con membranas bipolares con lo cual se regenera el KOH por un lado y por el otro se tiene una mezcla de HF y HNO3 que es recirculada al proceso de decapado (16). 44 Capitulo III El Recurso del Agua CAPITULO III El Recurso del Agua. El agua, junto con el aire, la tierra y la energía, constituyen los cuatro principales recursos naturales básicos para la existencia y desarrollo del hombre. Los antiguos filósofos griegos consideraban al agua como uno de los cuatros elementos junto con el aire, el fuego y la tierra Los científicos no descartaron esta idea hasta la última mitad del siglo XVIII. Desde épocas anteriores, el hombre utiliza el recurso agua como elemento necesario para lograr mejores niveles de desarrollo. Es así, como el aprovechamiento de este recurso natural le facilitó al hombre primitivo, hace aproximadamente 8.000 años, emprender el camino de la segunda revolución tecnológica humana conocida como la revolución agrícola social. Las principales culturas que surgieron en la antigüedad se desarrollaron en las riveras de grandes ríos; este es el caso de Mesopotámica desarrollada en las riveras de los ríos Tigris y Eufrates, la India en el Indo, la Egipcia en las márgenes del río Nilo y la China junto al río Amarillo. Como consecuencia de la revolución industrial, se produce un crecimiento exponencial de la población humana y la expansión industrial por todo el planeta agravándose en la segunda parte del siglo XX; situación que ha demandado grandes volúmenes de agua, y que podría ser insostenible en nuestro siglo XXI, como consecuencia de esta demanda y el modelo de gestión seguido por el hombre para satisfacerla ha ocurrido el agotamiento progresivo de las fuentes naturales de estos recursos (17). El agua es el componente químico más abundante en la biosfera y quizás el más importante. Es también el mayor constituyente de los seres vivos; casi toda la vida en la tierra, incluida la humana, utiliza agua como la sustancia indispensable para los procesos metabólicos. El agua en el ambiente no es químicamente pura, ya que en su ciclo hidrológico, absorbe, arrastra y disuelve gases, minerales, compuestos vegetales y microorganismos que le dan características muy especiales. 45 Capitulo III El Recurso del Agua 3.1 Disponibilidad del agua en el Planeta. A pesar de que el volumen total del agua en el planeta es de 1,386·1018 m3, la cantidad de agua dulce disponible es de aproximadamente sólo el 0,008%, es decir, 5,544·1015 m3. Esta cantidad representa para una población mundial de 6 mil millones de personas un volumen promedio de aproximadamente 9,24·105 m3 por persona. La velocidad a la cual se puede utilizar esta aparente abundancia de agua está limitada por la rapidez con la cual el agua se desplaza en el ciclo hidrológico. Como el tiempo de reposición, puede variar desde unos días hasta 30.000 años, es difícil estimar una dotación per cápita continua (17). Como una referencia más práctica para estimar la disponibilidad de agua, Kiely (18) considera utilizar el balance hidrológico anual en el planeta que determina una precipitación anual sobre la tierra de 119 mil km3; considera, además, que sólo puede estar disponible el 30%. Basado en esta información, la dotación por persona al día es aproximadamente 16,3·103 l/hab·día (17). Esta disponibilidad diaria de 16 mil litros por persona no se corresponde con el déficit de agua que tiene varias regiones del planeta. Actualmente, la escasez de agua potable en estas regiones se debe a la distribución no uniforme de las fuentes de agua en la tierra, a la ubicación de muchas ciudades lejos de estas fuentes, al aumento de la demanda de agua potable y a la contaminación de las aguas superficiales y subterráneas. La combinación de estos factores nos demuestra por qué el consumo promedio diario de agua en el mundo es de 35 litros por persona. Como la Organización Mundial de la Salud (OMS) recomienda un consumo por habitante de 250 litros, es evidente la escasez de agua en muchas regiones del planeta. El agua para abastecimiento público corresponde al agua de determinada calidad física, química y biológica utilizada en hogares, escuelas, hospitales, comercios, limpieza de calles y protección contra incendios. La calidad del agua de abastecimiento utilizada para consumo humano tiene un impacto significativo en la salud y bienestar de la población. 46 Capitulo III El Recurso del Agua El agua para la industria se utiliza como materia prima (por ejemplo en la industria de refrescos y bebidas), en el control de procesos (como la refrigeración o la generación de vapor) y en las operaciones de limpieza (lavado de equipos). El agua para irrigación permite el desarrollo de la agricultura en regiones secas o cuando los períodos de lluvia y verano son de baja pluviosidad. El agua como vía de transporte la utiliza el hombre desde tiempos remotos con el fin de facilitar la comunicación y el intercambio entre pueblos. El agua como medio de recreación es fundamental para la salud física y mental de las personas; este es el caso del uso de las playas y balnearios en ríos (17). Todos estos usos que corresponden a la cotidianidad de la civilización generan consumos, que a medida en que aumenta el grado de contaminación de las fuentes, son menos satisfechas, y es así como se genera la necesidad de preservar las fuentes naturales, y la reutilización de las aguas ya usadas, ya sea para tratarlas completamente para su regreso inmediato al servicio, o ayudar al ambiente tratándolas parcialmente (lo mínimo necesario) para que la madre tierra haga el resto y así contar con mas tiempo de este vital recurso. 3.2 Las Aguas Residuales. Hasta los años sesenta del siglo XX, la descarga de residuos líquidos en muchos ríos, lagos o estuarios no modificó irreversiblemente sus propiedades naturales debido a que la carga contaminante vertida era inferior a la capacidad de autopurificación de estos ecosistemas acuáticos. Posteriormente, como consecuencia de la explosión demográfica e industrial el exceso de materia contaminante vertido ha sobrepasado, en muchos casos, la capacidad natural de purificación de las masas de agua receptoras, transformándolas en focos permanentes de contaminación. Las masas de agua receptoras al perder las propiedades físicas, químicas y biológicas necesarias para mantener el equilibrio del ecosistema, pierden también sus condiciones naturales para ser utilizadas como fuentes de abastecimiento de agua para uso doméstico e industrial, para uso recreativo, como vías de transporte o como fuente de energía. 47 Capitulo III El Recurso del Agua La perdida cada vez mayor de la calidad de las aguas naturales, aunado a las escasas reservas de agua dulce en el planeta, llevó al hombre a plantearse la necesidad de revisar el modelo actual de gestión de los residuos líquidos y estudiar su incidencia en la disponibilidad de agua potable para las futuras generaciones (17). Las aguas residuales son todos aquellos residuos líquidos resultantes de las diferentes actividades del hombre, cuya calidad desde el punto de vista físico, químico o microbiológico se considera no apta para el consumo humano. Se pueden clasificar en aguas domésticas, aguas industriales y aguas municipales o negras (17). El origen de los desechos es un determinante de las características de cada desecho. Se distinguen tres tipos de desechos. 3.2.1 Desechos Líquidos Municipales. Se originan principalmente en las viviendas y en el comercio, son las aguas residuales de centros urbanos, la composición cambia de un lugar a otro, en función de las condiciones socioeconómicas de la población, el clima y otros factores típicos de cada localidad. Debido a los diferentes usos que se le han impartido, en las aguas residuales hay más cloruros, sulfatos, nitrógeno, fósforo, sólidos y materia orgánica que en el agua de consumo. Las concentraciones de oxigeno disuelto son muy bajas, ya que la materia orgánica se descompone u oxida por la acción de microorganismos en el agua consumiendo el oxigeno disuelto (19). Las labores domésticas contaminan el agua, sobre todo, con residuos fecales y detergentes. 3.2.2 Desechos líquidos Agroindustriales. Se produce en explotaciones pecuarias y en el procesado de cosechas de alimentos. Aportan cantidades apreciables de materia orgánica biodegradable, materia en suspensión, nitrógeno, fósforo, etc. (19). Los trabajos agrícolas y ganaderos pueden producir una contaminación muy grave de las aguas de los ríos y los acuíferos, debido sobre todo a los vertidos de aguas cargadas de residuos orgánicos, procedentes de las labores de transformación de productos vegetales, o de los excrementos de los animales. 48 Capitulo III El Recurso del Agua 3.2.3 Desechos Líquidos Industriales. Las aguas industriales son generadas en las diferentes actividades industriales, por tanto, pueden ser un residuo acuoso proveniente del proceso, el agua resultante de las actividades de lavado o el agua utilizada como refrigerante. El volumen de agua residual producida depende principalmente del tipo y tamaño del complejo industrial y del porcentaje de agua reutilizada. Los residuos industriales, a diferencia de los municipales, son de composición muy variada y sus características físicas, químicas y biológicas son específicas para cada industria; por ejemplo, los residuos procedentes de la industria láctea son muy biodegradables, en cambio los derivados de la industria de la galvanotecnia son inorgánicos y tóxicos (17). Entre los principales contaminantes e industrias que los generan están las siguientes (19). Materia orgánica biodegradable: Esta procede de mataderos, curtiembres, centrales azucareros, fábricas de cerveza, destilados, alimentos enlatados, pasta alimenticia. Materia en suspensión: Se originan en fábricas de jabones, aceites y grasa, cerveza, hilados y laboratorios de productos farmacéuticos. Compuestos orgánicos: Fenoles, orgánicos sintéticos, proceden de refinerías y producción de petróleo, plantas de coque y productos sintéticos. Agentes reductores inorgánicos: sulfitos, sulfatos y sales ferrosas, provienen de la industria de la pulpa y papel y la minería. Grasas, aceites, combustibles y materia flotante: se originan en fábricas de grasas, aceites vegetales, jabones, productos lácteos y estaciones de servicio automotor. Nitrógeno y fósforo: provienen de fábricas de fertilizantes, productos alimenticios ricos en proteínas y operaciones pecuarias. Color y turbidez: afectan la estética del agua, provienen de plantas de pulpa y papel, industria textil, productos químicos, farmacéuticos, alimentos y limpieza de metales. Calor: provienen de sistemas de enfriamiento, plantas termoeléctricas, calderas de vapor y reactores nucleares, en este caso el agua residual, que no presenta contaminantes orgánicos o inorgánicos, tiene una temperatura mucho más elevada que 49 Capitulo III El Recurso del Agua la de los cauces a los que va a parar, ocasionando graves trastornos en los ecosistemas acuáticos. En el caso de la producción petrolera encontramos como principales residuos líquidos, las aguas de producción y lodos perforación, los contaminantes principales de estos dos residuos son: sales, aceites, gases, DBO, Olor, Fenoles y compuestos sulfurosos y aceites En definitiva, la consecuencia de la producción de todos estos contaminantes es el vertido de aguas residuales cargadas de materia orgánica, metales, aceites industriales e incluso radiactividad. Para evitar los problemas que pueden causar los contaminantes de las aguas residuales existen sistemas de depuración que sirven para devolverles las características físicas y químicas originales. 3.3 Características de las aguas residuales. El grado de contaminación que produce un agua residual se puede determinar por medio de sus características físicas, químicas o biológicas. Es importante considerar que los parámetros que determinan las características físicas, químicas y biológicas del agua no son independientes entre si; este es el caso de la temperatura (parámetro físico) que afecta en el agua la concentración de los gases disueltos (parámetro químicos) o la actividad biológica de los microorganismos (parámetro biológico) (17). 3.3.1 Características Físicas. Temperatura: Varía de un lugar a otro y durante las horas del día y épocas del año. En el trópico puede variar entre 15 y 26 ºC para desechos domésticos. El aumento de temperatura acelera la descomposición de la materia orgánica, aumenta el consumo de oxigeno para la oxidación y disminuye la solubilidad del oxígeno y otros gases. La densidad, viscosidad y tensión superficial disminuyen al aumentar la temperatura, estos cambios modifican la velocidad de sedimentación de partículas en suspensión y la transferencia de oxigeno en procesos biológicos de tratamiento (19). 50 Capitulo III El Recurso del Agua Sólidos: Se encuentran en suspensión, coloidales y disueltos, en los análisis de laboratorio sólo se hace la distinción entre sólidos en suspensión que retiene el papel de filtro #40 y disueltos. Además se determinan los sólidos totales por evaporación (19). La Turbidez: Es una medida de la capacidad de un agua residual para transmitir o en su defecto absorber la luz, debido a la cantidad de materia en suspensión y coloidal presente en el agua como arcilla, limo, materia orgánica o microorganismos. El agua turbia restringe la profundidad visual y refleja condiciones antiestéticas y no adecuadas para su uso (17). El Color: Es la respuesta visual a la presencia de sustancias orgánicas e inorgánicas en el agua como taninos, ácidos húmico, óxidos de hierro o manganeso y residuos industriales procedentes de procesos de pulpa y papel, textileras, colorantes, agroindustriales, mataderos, etc. El color puede reflejar la edad del agua residual, por ejemplo, el agua residual municipal recién producida es generalmente gris; sin embargo, a medida que avanza el proceso de descomposición el color del agua cambia a gris oscuro para finalmente tornarse negra (17). El Olor: Es la respuesta fisiológica del sentido del olfato a la presencia en el agua residual de sustancias volátiles, tanto orgánicas (fenoles, etc.) como inorgánicas (amoníaco, cloro, sulfuro de hidrógeno, etc.). En el caso de las aguas residuales domésticas, el olor se debe principalmente a los gases producidos durante la descomposición de la materia orgánica (17). 3.3.2 Características Químicas. Los Ácidos y Bases: Aportan cantidades de iones hidronio u oxidrilos suficientes para producir variaciones en el pH natural de los ecosistemas acuáticos. El intervalo de pH apropiado para el desarrollo de la vida está comprendido entre 6,5 y 7,5. 51 Capitulo III El Recurso del Agua Los Cloruros: Son aniones que se encuentran en el agua residual proveniente, en la mayoría de los casos, de una de las sales más utilizadas en la alimentación humana como es el cloruro de sodio. Se estima que el hombre expulsa a través de la orina y las heces aproximadamente 6 gramos de cloruros por persona al día, en consecuencia, la presencia de este ión en el agua residual podría indicar la posible contaminación de origen fecal (17). Los Nutrientes: El nitrógeno agregado en las proteínas principalmente y el fósforo en compuestos orgánicos y los detergentes son nutrientes que promueven el crecimiento de organismos productores autótrofos en aguas receptoras de desechos (19). Tóxicos: Afectan a los microorganismos y a los procesos de tratamiento y provienen de productos farmacéuticos, químicos y biocida. Algunos tóxicos comunes son: plomo, cromo, zinc, mercurio, cianuro, ácidos, bases fuertes, derivados del petróleo y biocidas (19). Gases disueltos: En aguas residuales los gases son productos de la descomposición biológica de la materia orgánica y de la transferencia desde la atmósfera. Los principales gases disueltos en las aguas residuales son Oxigeno (O2), dióxido de carbono (CO2), sulfuro de hidrógeno (H2S), amoníaco (NH3) y metano (CH4). El oxigeno es uno de los componentes más importantes de las aguas naturales, de su presencia depende la vida de los organismos aerobios y, como consecuencia, el equilibrio natural de los ecosistemas acuáticos. Por esta razón el oxigeno disuelto es un indicador importante de la calidad de las aguas (17). Demanda bioquímica de oxigeno (DBO): El DBO u oxigeno consumible, es el requerido para oxidar o consumir la materia orgánica como fuente de alimento por microorganismos aerobios. También se le conoce como la DBO requerida por las bacterias durante el proceso de estabilización de la materia orgánica 52 Capitulo III El Recurso del Agua susceptible de descomposición por acción bacteriana sirve como alimento para dichos microorganismos, liberándose al mismo tiempo energía en el proceso de oxidación. Mientras mayor es la DBO, mayor es la concentración de compuestos orgánicos en el agua y se necesitaría mayor oxigeno disuelto para poder consumir en su totalidad la materia orgánica. La DBO se expresa como mg de O2/l durante un periodo de 5 días a 20 ºC (19). Demanda química de oxigeno (DQO): La DQO se basa en que todos los compuestos orgánicos, pueden ser oxidados por la acción de oxidantes fuertes como el dicromato de potasio, en medio ácido o sea la DQO permite determinar en su totalidad la materia orgánica expresada en oxígeno necesario para oxidación a CO2 y H2O. (19). La Materia Orgánica: La materia orgánica esta constituida principalmente por carbono, hidrógeno, oxigeno y, en menor proporción, nitrógeno, azufre y fósforo. Las diferentes composiciones de estos elementos químicos forman diversos grupos de compuestos; en el caso del agua residual los compuestos más importantes son las proteínas, los carbohidratos, los aceites, las grasas, la urea, los agentes tensoactivos y los pesticidas. Una característica importante de la materia orgánica es que puede ser descompuesta por bacterias y hongos; pero durante el proceso de descomposición se consume parcial o totalmente el oxigeno disuelto en el agua (17). 3.3.3 Características Biológicas. En aguas residuales se encuentran microorganismos saprofitos que degradan la materia orgánica en compuestos simples utilizando o no oxigeno disuelto, y microorganismos patógenos agregados a las aguas que mueren rápidamente al encontrarse en un medio o hábitat extraño. Los patógenos, sin embargo, sobreviven un tiempo suficientemente prolongado para infectar a otros usuarios del agua (19). 53 Capitulo III El Recurso del Agua 3.4 Tratamiento de aguas residuales. Los tratamientos para aguas residuales se encuentran estandarizados en todo el mundo, y de acuerdo a la complejidad del efluente se aplican en mayor o menor grado. Generalmente el proceso de purificación de las aguas siguen los siguientes pasos: 3.4.1 Pretratamiento: involucra principalmente unidades de proceso físicas y/o químicas. “En aguas residuales urbanas esto significa la separación de materia flotante, arena y manchas de aceite; el pretratamiento se aplica antes de someter el afluente a otro tipo de proceso de separación de contaminantes y consiste en separar las partículas de gran tamaño y uniformizar el caudal del afluente que entra a la planta purificadora. Los equipos más comunes que se emplean en el pretratamiento son: rejillas de desbaste, canales de desarenado, unidades de flotación y homogenización. 3.4.2 Tratamiento primario: tiene como objetivo clarificar el efluente líquido residual sedimentando la materia orgánica flotante en reposo. Para mejorar el rendimiento de este proceso se añaden agentes químicos como sales de hierro, cal ó aluminio que favorecen la coagulación. 3.4.3 Tratamiento secundario: también denominado biológico, consiste en degradar vía biológica la materia orgánica presente en el efluente residual en compuestos no contaminantes como H20, CO2 y lodos. Los principales sistemas de tratamiento secundario son: lodos activados, filtros percoladores, biotorres, biodiscos, eliminación biológica de nitrógeno y fósforo y sistemas combinados de nitrificación-desnitrificación. 3.4.4 Tratamiento Químico: es el proceso terminal en la purificación de efluentes residuales urbanos e industriales donde se emplean agentes químicos con el objeto de eliminar los microorganismos patógenos contenidos en el agua (17,19). 54 Capitulo III El Recurso del Agua 3.4.5 Tratamientos avanzados de las aguas residuales: dependiendo de las metas de calidad del agua para el tratamiento de aguas residuales, puede ser necesario algún proceso adicional. Este tratamiento avanzado de aguas residuales generalmente implica coagulación y floculación química, seguidas por algún aparato especializado de clarificación. Como alternativa, algunos métodos de filtración del agua residual o el procesamiento con membranas podría satisfacer las metas de calidad del agua. Otra opción para el tratamiento avanzado (terciario) del agua residual es la oxidación química de los componentes contaminantes de dicha agua y la adsorción de los contaminantes usando carbón activado. Los procesos de tratamientos secundarios generalmente eliminan más del 85% de DBO, sólidos en suspensión y casi todos los elementos patógenos. En algunas circunstancias los contaminantes restantes en el efluente secundario constituyen un problema grave. Los procesos capaces de eliminar contaminantes que no fueron eliminados en el tratamiento secundario se llama procesos de tratamiento avanzado de aguas residuales. Los procesos avanzados se muestran en la tabla 3.1. Tabla 3.1 Datos típicos de aplicación para operaciones y procesos de tratamiento avanzado de aguas residuales (20). Descripción Tipo de agua residual tratada SS DBO Eficiencia de la eliminación, % N NH3 NO3 org. DQO PO4 TSD Desecho Final Operaciones físicas de la unidad Remoción de amoniaco con aire Filtración Multimedio Lecho de diatomeas Microfiltros Destilación Flotación Aplicación en tierra Osmosis inversa Adsorción de carbono Precipitación química Precipitación química en: Lodo activado Intercambio iónico Electrodiálisis Oxidación (Cloro) Reducción ETB --- ---- --- 85-98 --- --- --- --- Ninguno ETB ETB ETB ETB nitrificado ** Filtración ETP, ETB ETP, ETB ETB **, Filtración ETP, ETB ETB 80-90 95-99 50-90 50-70 ----- 40-60 ----- ------- 20-40 --20-30 ------- ------- ------- Liquido y Lodo Liquido Lodo 99 60-90 95-98 95-98 80-90 80-90 98-99 --90-95 95-99 70-90 70-90 96-98 --80-90 90-95 60-75 60-70 ----60-80 95-99 --5-15 90-98 20-30 80-95 95-99 50-90 30-50 99 --5-15 95-99 ----- 99 --60-90 95-99 --90-95 95-99 ----95-99 --20 Liquido Lodo Ninguno Liquido Liquido Lodo ETP ETB**, filtración ETB**, filtración** Adsorción de carbono ETB ETB 80-95 --- 90-95 40-60 85-90 30-50 30-40 85-98 30-40 80-95 30-40 80-90 30-40 85-98 30-40 --- Lodo Liquido ------- --80-90 --- --65-70 --- 30-50 50-90 --- ------- 30-50 --NO3 30-50 --NH3 40 ----- Liquido Ninguno --- Procesos de unidad biológica Asimilación bacteriana Desnitrificación Recolección de algas Nitrificacióndesnitrificación ETP Aguas de retorno Agrícola ETB ETP,ETB 80-96 75-95 60-80 30-40 30-40 30-40 10-20 --- Lodo ----- --50-75 --40-60 --50-90 --50-90 60-95 50-90 --50 ----- Ninguno Algas --- --- --- --- --- 60-95 --- --- Ninguno *ETP es el afluente del tratamiento primario, ETB es el afluente del tratamiento biológico **Varía con el tipo de resina 55 Capitulo III El Recurso del Agua 3.5 Electrodiálisis en el tratamiento avanzado de aguas residuales. La electrodiálisis es usada como un proceso de desalinización con membranas. Como se explico en el capitulo anterior utiliza un campo eléctrico para extraer iones del agua efluente. El efluente se desaliniza gradualmente hasta el punto de ser considerado agua producto. No existe una división o separación física del efluente. El producto es esa agua sin iones. El proceso de electrodiálisis, tanto el normal como el que incluye inversión de la polaridad, se usan en todo el mundo para desalinizar aguas salobres. Usando este proceso, se puede producir agua potable (con menos de 500 mg/l de soluto) a partir de un efluente con hasta 3000 mg/l de soluto. La electrodiálisis con inversión de polaridad no requiere pretratamiento químico para prevenir las incrustaciones de carbonato o sulfato, aunque requiera tratamiento químico para la limpieza periódica. El proceso de electrodiálisis no elimina materia orgánica, bacterias ni sílice soluble. Por lo tanto, el agua producida contiene las mismas cantidades de estos materiales que existían en el agua efluente. Los costos de capital y operación alimentan significativamente al aumentar la salinidad del efluente (20). A medida que la tecnología de membranas se ha perfeccionado en los campos de la ósmosis inversa y la nanofiltración, las aplicaciones de electrodiálisis resultan menos económicas. Sin embargo, en ciertos casos, cuando la separación de los iones del agua es el único requisito, los dos procesos de electrodiálisis todavía tienen algunos usos. En la tabla 3.2 se comparan los procesos de electrodiálisis y ósmosis inversa. 56 Capitulo III El Recurso del Agua Tabla 3.2 Comparación de los sistemas de Osmosis Inversa y Electrodiálisis (20). 3.6 Las Aguas de Producción. Se pronostica el incremento de los volúmenes de aguas de producción de petróleo (aguas de capas) que se generan en forma de aguas residuales provenientes del proceso de separación del agua del petróleo. Estas aguas, de características salinas y alcalinas, con notable presencia de sulfuros, sólidos suspendidos y petróleo (flotable y emulsionado), son dispuestas por medio de la inyección profunda, y ocasionalmente vertidas superficialmente en afluentes naturales. Ambas 57 Capitulo III El Recurso del Agua alternativas (la inyección de pozo o el vertido en la superficie) necesitan el tratamiento de estas aguas para mejorar su calidad (21). 3.6.1 El impacto en el Ambiente. En el ámbito de la industria de los hidrocarburos, la introducción de contaminantes a los cuerpos de agua suele suceder en las distintas actividades necesarias de la industria. Desde la etapa inicial de exploración donde el resultado final es la producción del crudo a gran escala, se manejan una cantidad importante de materiales potencialmente contaminantes del entorno geográfico. Uno de ellos son las aguas de producción. A continuación se muestran diferentes casos en los que las aguas de producción son el problema a tratar, ya sea por la contaminación del ambiente circunvecino a los pozos petroleros, o bien sea el evitar esa contaminación y como retornar esas aguas al ambiente sin generar impacto en el ambiente. Así como el hecho de la alta producción de este subproducto en la industria petrolera. Gran Producción de Agua asociada se registra en pozos venezolanos. Fuente: EL UNIVERSAL 25 de Julio de 2004. “Más agua que crudo: eso es lo que está saliendo de los pozos operados directamente por PDVSA. Si antes del paro la proporción era de medio barril de agua por cada uno de petróleo, dos años más tarde se habla de cuatro por uno. Cuatro, por supuesto, son de agua”. “Estas cifras y otras consideraciones que explican el camino al colapso que ha venido transitando desde entonces la industria que sostiene la economía del país son producto de un análisis y monitoreo continuo que un grupo de expertos en el tema (dentro y fuera de PDVSA) han venido haciendo desde hace al menos dos años desde un bajo perfil que prefieren mantener aun hoy en día pero que no les impidió, en 2003, alertar a PDVSA: había que implementar una buena gerencia de explotación de yacimientos”. “En los yacimientos de hidrocarburos conviven (en distintas combinaciones) agua, crudo y gas, por lo que la extracción de petróleo viene asociada a estos fluidos. Esa convivencia bajo tierra se hace en condiciones que generan un nivel de presión que se 58 Capitulo III El Recurso del Agua aprovecha para obtener el petróleo por "recuperación primaria", por sus condiciones naturales. Esa presión disminuye con el tiempo y para asegurar que el yacimiento siga siendo productivo se aplican métodos de "recuperación secundaria" que sostengan e incrementen el índice de presión”. “En el yacimiento el agua siempre está por debajo del crudo y lo empuja hacia arriba, de manera que uno de los métodos fundamentales de recuperación secundaria es reinyectar el agua asociada a la extracción para acentuar esa presión desde abajo. El otro sistema es inyectar parte del gas que no se procesa para comercializarlo para que presione desde arriba y mantenga al crudo en una suerte de sándwich” (22). Inaugurado Primer Foro Nacional de Aguas de Producción Petrolera Fuente: PDVSA.COM Noviembre de 2005 01-11-2005 Rumbo a la Corporación verde Inaugurado Primer Foro Nacional de Aguas de Producción Petrolera Barinas.- Bajo el eslogan "Del Oro Negro al Oro Blanco", el vicepresidente de Exploración y Producción de PDVSA, Luis Vierma, inauguró este lunes en Barinas el “I Foro Nacional de Control, ”, cita que permitirá el intercambio de experiencias Manejo y Disposición de las Aguas de la Industria Petrolera entre especialistas nacionales e internacionales, y contribuirá a conocer y optimizar aún más los procesos en materia acuífera petrolera. En la apertura del encuentro Vierma destacó que el agua generada en la producción de petróleo no debe ser vista como un problema pues puede ser aprovechada, con un manejo más eficiente, como indicador para la comprensión de las cuencas sedimentarias: “el agua es el primer componente, es el libro donde está escrita la historia de nuestras cuencas sedimentarias, es una molécula mágica”, expresó el vicepresidente de Exploración y Producción de PDVSA. Por otra parte, Vierma señaló que “nuestras aguas de desechos podrán ser empleadas para el riego y poder así apalancar la actividad agrícola, ese es el gran reto para agregar valor a las aguas de producción, aprovechar la energía térmica”. 59 Capitulo III El Recurso del Agua Igualmente, Vierma hizo una exhortación a “retornar a la tecnología de recuperación secundaria con el uso del agua, ya que en muy corto plazo PDVSA se va a convertir en una corporación verde”. Dentro de los objetivos establecidos para el foro que se lleva a cabo en Barinas, está visualizar y asegurar la sinergia del subsuelo para el manejo efectivo del agua de producción, compartir los diferentes sistemas de tecnologías que reducen la producción de agua en los pozos y difundir caos de estudios sobre los temas relacionados al foro. De esta manera Petróleos de Venezuela fomenta la actualización de tecnologías e ideas capaces de elevar los niveles de calidad y seguridad en el manejo de aguas de producción petrolera, iniciativa que está enmarcada dentro de los planes de Siembra Petrolera que la Corporación y el Gobierno Bolivariano ejecutan con el propósito de impulsar al desarrollo del país (23). En la última nota se resalta el interés de la industria petrolera nacional por el estudio sobre el manejo de las aguas de producción. Perú: Petrolera podría ser demandada por contaminación Fuente: IPS (ipsnoticias.net) Agosto del Presente año. ¡Arankartuktaram!, ¡Respétennos!, exclaman en su lengua las comunidades indígenas achuar desde el corazón de la Amazonia de Perú. El grito va dirigido al Estado y a las empresas multinacionales de exploración y explotación de hidrocarburos. Luego de más de 30 años de sufrir contaminación ambiental, el pueblo achuar de la cuenca del río Corrientes, en la selva peruana, evalúa iniciar acciones legales contra las compañías responsables de los daños. Este sería el primer caso llevado a las instancias judiciales por los pueblos indígenas en este país. 60 Capitulo III El Recurso del Agua Las actividades de explotación petrolera en territorios indígenas comenzaron con la presencia de la estadounidense Occidental Petroleum Corporation (Oxy) en los años 70. A partir de 1996, la compañía de capitales argentinos Pluspetrol Norte opera en las cuencas altas de los ríos Pastaza, Corrientes y Tigre, y desde el año 2000, ha extendido su área de intervención. La investigación gubernamental "Visita de reconocimiento para la evaluación de la calidad sanitaria de los recursos hídricos y muestreo biológico en las comunidades de la cuenca del río Corrientes", publicado en mayo de 2006, contiene un informe científico sobre la presencia de metales pesados en la población indígena, el cual fue elaborado como respuesta a un petitorio de la Federación de Comunidades Nativas del rió Corrientes (Feconaco). La ONG asegura que además hay contaminación en las lagunas y los lagos, donde se abastecían de pescado las comunidades, y que se han alejado los animales del monte, que eran alimento de los pobladores. Se trata, dice un documento de Racimos de Ungurahui, de una cadena de daños originada por la actividad petrolera que se convierte "en un instrumento de violación de uno de los derechos fundamentales de los pobladores: la alimentación". Robert Guimaraes, vicepresidente de la Asociación Interétnica de Desarrollo de la Selva Peruana (Aidesep), manifestó en nombre de las comunidades afectadas que urgía la reinyección y el tratamiento de las aguas de producción, atender los pasivos ambientales y evitar las actividades de nuevas petroleras en territorio achuar. Al respecto, el ministro de Energía y Minas, el arquitecto Juan Valdivia Romero, dijo a IPS que funcionarios de su despacho mantienen reuniones con los directivos de Pluspetrol Norte, para que se aceleren las labores de reinyección de las aguas residuales de producción en el subsuelo, como método de disposición ambiental aceptable. Sobre el conjunto de los daños ambientales producidos por las empresas petroleras, Valdivia Romero afirmó que "reconocemos la importancia que tiene para las comunidades la pronta disminución de los pasivos ambientales. Nosotros, desde la dirección de fiscalización, le exigimos a la empresa el estricto cumplimiento de las normas sobre el manejo de las aguas asociadas a la extracción del petróleo" (24). 61 Capitulo III El Recurso del Agua En este caso muy especial se da de manifiesto como el vertido de las aguas de producción a los afluentes naturales no afecta solo al medio ambiente, si es responsable del deterioro de la calidad de vida de la comunidad indígena, el problema no solo es de la madre tierra, también afecta significativa mente al ser humano. 3.7 Legislación Ambiental. En nuestro país existen normas y leyes para la protección del ambiente así como un organismo que vela por el cumplimiento de ellas, este organismo es el Ministerio del Ambiente y Los Recursos Naturales. Entre las principales normas que rigen el control de la calidad de los cuerpos de agua y los vertidos líquidos es el conocido como “Decreto 883” publicado en Gaceta Oficial de la Republica de Venezuela Nº 5.021 el 11 de octubre de 1995, el cual dicta las Normas para la Clasificación y el Control de la Calidad de los Cuerpos de Agua y Vertidos o Efluentes Líquidos. (25). En este decreto el estado venezolano reconoce la obligación de proteger las cuencas hidrográficas, la clasificación y control de la calidad de los cuerpos de agua y el control de los efluentes líquidos susceptibles a degradar el medio acuático y alterar los niveles de calidad para preservar y mejorar el medio ambiente. En el Capitulo III (del control de vertidos líquidos) en el articulo 7 (la sección I de este decreto) se habla de las actividades que están sujetas a control por este decreto, de acuerdo a la Clasificación Industrial Internacional Uniforme de las Naciones Unidas, la lista de actividades industriales es grande pero resalta la de La Producción de Petróleo y Gas Natural, la cual esta clasificada como división 22, agrupación 220 grupo 2200 (25). Además toda actividad que genere vertidos líquidos que no estén incluidas en el artículo 7 son controladas por este decreto, es así como en el artículo 8 señala que serán controladas: a) Actividades cuyos vertidos contengan elementos tóxicos o nocivos indicados en el artículo 9, grupo I ver anexos. b) Actividades cuyos vertidos superan una población equivalente de 1000 PE en términos de demanda bioquímica de oxigeno (DBO5,20), con sólidos suspendidos por encima de 62 Capitulo III El Recurso del Agua 90g/had/día o DBO mayor de 54 g/had/día o que afecten desde el punto de vista sanitario áreas recreacionales o cuerpos de agua. c) Las aguas servidas que en su conjunto, tenga descargas que excedan el límite de 1000 PE, en términos de DBO5,20. Otro artículo a resaltar en este resumen del decreto 883, es el articulo 9, y destacar que en el grupo II de los constituyentes de vertidos líquidos, se habla de sustancias que aún cuando no se conozca de su efecto tóxico, agudo o crónico, genera condiciones en el cuerpo receptor que afecta la biota o perjudican cualquier uso potencial de las aguas. Es en este grupo que encontramos entre muchos otros constituyentes de la contaminación a los cloruros. Y a más allá en el artículo 10 se establecen los rangos y límites máximos de calidad de vertidos líquidos a ríos, estuarios, lagos y embalses. Encontramos que para cloruros el límite máximo es de 1000 mg/l. Hemos visto parte de las normas que controlan el vertido de los residuos líquidos, y se han resaltado los que hablan sobre la concentración de cloruros ya que es lo que se busca controlar con el proceso de electrodiálisis. Las empresas productoras de petróleo están en la obligación de cumplir estas normas y de allí la inquietud sobre el tratamiento de las aguas asociadas a la extracción del hidrocarburo. 63 Capitulo IV Antecedentes CAPITULO IV Antecedentes. La base fundamental para la elaboración de un proyecto, constituye la evolución de una idea propia o ajena, de alguna inquietud que se tiene para resolver un problema. En vista de ello es necesario realizar la investigación de trabajos similares acerca del proyecto. A continuación se presenta un antecedente (el único a nuestro conocimiento) donde se estudió la desalación de aguas de producción con el uso de la electrodiálisis. SIRIVEDHIM, T; Mc CUE, J; DALLBAUMAN, L; Reclaiming produced water for beneficial use: salt removal by electrodialysis. Se utilizó la Electrodiálisis para remover sales de cinco tipos aguas de producción sintéticas que simulaban a diferentes pozos productores de los Estados Unidos, tres de esas aguas fueron de baja concentración de sales y las otras dos de alta concentración. Se evaluaron el efecto de aplicar tres diferentes caídas de potencial (3,0, 6,5 y 9,8V), y el efecto de las diferentes concentraciones, el orden de transferencia de los cationes también fue estudiado y se encontró el orden (del mas rápido al mas lento) Mg2+ ≈ Ca2+ > K+ > Na+. También se encontró que a mayor voltaje es menor el tiempo de tratamiento y que para soluciones de alta concentración de sales se requirió más tiempo de proceso. (27). 64 Capitulo V Metodología Experimental CAPITULO V METODOLOGÍA EXPERIMENTAL Para alcanzar los objetivos propuestos fue necesario hacer diversas pruebas experimentales; para ello se utilizaron materiales y equipos, además de una metodología para los diferentes ensayos y pruebas realizadas en el laboratorio. 5.1 Materiales y Equipos Usados. Entre los materiales usados en las pruebas realizadas en el proyecto se encuentran: Material de vidrio de laboratorio: como buretas, fiolas, agitadores, embudos, matraces, vasos precipitados, pipetas, cilindros graduados, balones aforados de 25 ml, 50 ml, 100 ml, 500 ml, 1000 ml y 2000 ml. Figura 5.1 Buretas usadas. Soporte universal. Cronómetro. Desecadora con Silica Gel. Para medir la conductividad de las soluciones se utilizó un conductímetro de OAKTON modelo CON510 TDS, y una celda de conductividad modelo WD-35608-50 con sensor de temperatura, cuyas características son: Intervalo para la constante de celda: 0,75 – 0,95 cm-1. Rango de Conductividad: < 100 mS/cm. Rango de temperatura: 0 – 100 ºC. 65 Capitulo V Metodología Experimental Cuerpo de Epoxi. Electrodos de Acero inoxidable de constante K=1,0. Figura 5.2 Conductimetro Equipo de filtración para separar los sólidos suspendidos, dicho equipo constaba de: Papel de filtro Whatman® de N# 2 Cat Nº 1002150 de 15,0 cm de diámetro 40 ashless, hecho de celulosa. Bomba de vacío. Matraz Kitasato. Embudo buncher. a b c d Figura 5.3 Equipo de filtración para aguas de producción. (a)Papel de filtro, (b) embudo, (c) kitasato y (d) equipo completo con la bomba de vacío. 66 Capitulo V Metodología Experimental Balanza analítica digital Denver Instruments. Figura 5.4 Balanza Digital Equipo de Absorción Atómica: para la determinación de los iones disueltos en las aguas tratadas, específicamente sodio, potasio, calcio y magnesio, se utilizó un espectrofotómetro de absorción atómica Marca Varian modelo SpectrAA 55B. Figura 5.5 Equipo de Absorción Atómica SpectraAA 55B El equipo utilizado para la desmineralización de las soluciones de cloruro de sodio y la solución sintética, es un electrodiálizador modelo CH-O, fabricado por la empresa japonesa Asahi Glass Co. (ver figura 5.6). Este modelo de electrodiálizador, es un equipo comercial a escala piloto para uso experimental, el cual proporciona los mismos resultados que un equipo industrial. El diagrama del equipo y sus circuitos hidráulicos se muestran en la figura 5.7. Las especificaciones del electrodiálizador son las siguientes: Modelo: CH-O. Número de pares de membranas: 10 Membrana aniónica: AMV (estándar) Membrana catiónica: CMV (estándar) Membrana del ánodo: CMV (estándar) Membrana del cátodo: CMV (estándar) Dimensiones de las membranas: 160mm ancho x 240mm largo. Área efectiva de las membranas: 0,021 m2. Espesor del espaciador: 0,75 mm. 67 Capitulo V Metodología Experimental Material del ánodo: Pt - Ti. Material del cátodo: SUS316. Material del sistema de tubería: U-PVC. Tanques de almacenamiento: el electrodiálizador posee tres tanques rectangulares de PVC de 3,5 litros de capacidad cada uno, para almacenar las soluciones diluida, concentrada y de lavado, que serán alimentadas al equipo. Rotámetros: cada circuito de flujo posee un rotámetro de área, elaborado de PVC y acrílico, con rango de trabajo de 0 – 300 l/h. Bombas: tres bombas centrifugas fabricadas por Iñaki Pumps, con una descarga máxima de 16 – 19 l/min y una cabeza máxima de 2,7 – 4,2 m de agua (50 – 60 Hz). Para el suministro de corriente se utilizó una fuente de poder fabricada por Kikusi modelo 350 W–PAN35-10A, cuyas especificaciones son: Voltaje y frecuencia de entrada: 120 V, CA monofásica, 50/60 Hz. Voltaje variable entre 0 – 35V. Corriente variable entre 0 – 10A. a d c b e Figura 5.6 Imágenes del Electrodiálizador usado para la experiencia. (a) Electrodializador, (b) paquete con membranas, (c) electrodializador, (d) bombas, (e) fuente de poder. 68 Capitulo V Metodología Experimental Figura 5.7 Esquema del los circuitos hidráulicos del electrodiálizador CH-O El circuito representado por el color verde en la figura 5.7 muestra la trayectoria de la solución de lavado de electrolitos, la cual sale del tanque TE pasa por una bomba, luego por un rotámetro y al final se divide en dos corrientes que se dirige a cada uno de los compartimientos de los electrodos (cátodo EK y ánodo EA); igualmente la línea azul representa el circuito de solución diluida (solución de la que queremos eliminar los iones), dicha solución parte del tanque TD, pasa por la bomba, un rotámetro y una válvula que regula su flujo, pasa por el compartimiento D (diluido) y al final terminan en el tanque TD; por ultimo el circuito de color rojo representa el ciclo de la solución concentrada que lleva una trayectoria similar al anterior. 5.2 Reactivos. Cloruro de sodio (NaCl, Riedel de Haën, extrapure). Sulfato de sodio (Na2SO4, Riedel de Haën, grado analítico). Acido sulfúrico (Fluka, 95-97%, H2SO4). Cloruro de potasio (Riedel de Haen, pro analisi, KCl). 69 Capitulo V Metodología Experimental Bicarbonato de sodio (Reactivos S.A., USP, NaHCO3). Sulfato de magnesio (Riedel de Haen, pro analisi, MgSO4). Cloruro de calcio (Merck, pro analisi, CaCl2) Nitrato de Plata (AgNO3 al 99,8% de pureza). Cromato de Potasio (K2CrO4). Agua Destilada. 5.3 Metodología. Los pasos realizados en las pruebas y ensayos para cumplir a cabalidad cada uno de los objetivos propuestos se describen a continuación. 5.3.1 Preparación de soluciones de NaCl y de Agua sintética para las corrientes de concentrado y diluido en el equipo de electrodiálisis y otras soluciones necesaria para los ensayos. Se prepararon inicialmente soluciones de NaCl de 1000 y 2500 ppm para la primera fase del proyecto, la primera se utilizó como solución en donde se concentró la sal, y la segunda como solución a diluir. Para cada corrida se prepararon dos litros de cada una de las soluciones. En la segunda fase del proyecto se utilizó una solución de 500 ppm de NaCl como la solución de concentración. Además de las soluciones anteriores se prepararon dos litros de una solución de Na2SO4 al 3% peso, y se acidificó con H2SO4 para mantener la solución en un pH entre 3 y 2. Esta solución es usada como solución de lavado de los electrodos. También se prepararon soluciones de NaCl de 50 y 10 ppm, y se midieron sus conductividades para tener una referencia al momento de realizar las pruebas con el electrodiálizador. La solución utilizada como solución a diluir en la segunda fase del proyecto fue un “Agua Sintética” con la que se buscaba simular las aguas de producción obtenidas del pozo La Victoria del estado Apure, el contenido de esta Agua Sintética se muestra en la siguiente tabla. 70 Capitulo V Metodología Experimental Tabla 5.1 Cantidades para preparar 2 litros de solución sintética de agua de producción “Agua Sintética”. Compuesto mmoles mg para 2 litros NaHCO3 38 3192,38 Na2SO4 0,2 28,4 NaCl 116,8 6825,8 MgSO4·6H2O 7,8 1781,3 KCl 1,54 114,8 CaCl2 2,8 310,8 Buscando estudiar el efecto en la concentración de la corriente a diluir, se preparó otro tipo de Agua Sintética similar a la anterior pero al doble de la concentración en todos los compuestos que la componen, quedando de la siguiente manera (Tabla 5.2). Tabla 5.2 Cantidades para preparar 2 litros de solución sintética de agua de producción al doble de su concentración “Agua Sintética 2”. Compuesto mmoles mg para 2 litros NaHCO3 76 6384,76 Na2SO4 0,4 56,8 NaCl 233,6 13651,6 MgSO4·6H2O 15,6 3562,6 KCl 3,08 229,6 CaCl2 5,6 621,6 Las soluciones empleadas para determinar la concentración de cloruros por el método de Mohr fueron nitrato de plata como titulante y como indicador cromato de potasio. Dichas soluciones fueron de 0,02 N de AgNO3, y 0,01 M de K2CrO4. Para la preparación de dos litros de solución de nitrato de plata fue necesario pesar 6,8084 g de dicho compuesto al 99,8%, luego de preparada la solución fue necesario valorarlo para determinar su concentración exacta, ya que es la solución titulante y es necesario saber el valor exacto de su concentración, para ello se prepara una solución de NaCl a 0,02M, con una sal previamente desecada en la campana desecadora con silica gel, y con esta solución conocida se procede a aplicar el método de Mohr para determinar la concentración del nitrato de plata. En los ensayos de Absorción Atómica realizados para determinar metales en las muestras se prepararon diferentes soluciones para cada uno de los ensayos realizados. Para analizar el 71 Capitulo V Metodología Experimental sodio por emisión de llama se preparó una solución de KCl a 2000 ppm para realizar las disoluciones necesarias de las muestras durante el ensayo ya que en la prueba no se puede diluir con agua destilada, requiriéndose alrededor de 6 litros para todo el ensayo, además se pesó 0,6355 g de NaCl desecada para preparar 250 ml de NaCl a 1000 ppm Na+ (diluyendo con KCl), esto con el fin de utilizarla como solución madre para realizar las diluciones de dicha solución a 60, 40, 20, 10 y 5 ppm de Na+ y con ello realizar la curva de calibración de la absorción atómica (siempre diluyendo con la solución KCl preparada anteriormente). Las diluciones de NaCl se obtienen a partir de alícuotas provenientes de la solución madre. El volumen necesario de la alícuota para preparar una solución de NaCl de concentración CNaCl, se obtiene mediante: Vsol .madre = Vsol ·C NaCl C sol .madre Ec. 4.1 Donde: Vsol.: Volumen de la Solución a preparar Vsolmadre: Volumen de la Solución madre de NaCl a añadir CNaCl: Concentración de NaCl de la solución a diluir Csol.madre Concentración de NaCl de la solución madre Para los ensayos de determinación de K+, Mg2+ y Ca2+ se procedió de la misma manera, pero esta vez las preparaciones y diluciones se realizaron con agua destilada en el caso del ensayo de potasio, y con agua regia para los ensayos de magnesio y calcio. Las soluciones madres preparadas para realizar la curva de cada uno de los análisis son como los indica el manual del equipo de absorción atómica, dichas soluciones están conformadas como se muestra en al tabla 5.3. Tabla 5.3 Cantidades para preparar las soluciones madres para los ensayos de Potasio, Magnesio y Calcio por absorción atómica. Ensayo g por litro Concentración en ppm K+ 1,907 de KCl seco 1000 Mg2+ 1,000 sal de magnesio seco 1000 Ca2+ 2,497 de CaCO3 seco 1000 Las soluciones de Mg2+ y Ca2+ se prepararon en agua regia. 72 Capitulo V Metodología Experimental 5.3.2 Pruebas de desalación de las soluciones de NaCl en el electrodializador. En la primera fase del proyecto de grado se realizaron pruebas preliminares de desalación con soluciones de NaCl para demostrar la transferencia de los iones desde la corriente que queremos diluir (que se llamará desde ahora “Diluido”) hasta la corriente en la que queremos concentrar (que se llamará desde ahora “Concentrado”). La primera prueba con NaCl se realizó a un voltaje fijo de 30 V, y luego una segunda prueba a un voltaje fijo de 15 V, esto con el fin de determinar a que voltaje es más conveniente trabajar. El procedimiento empleado para la desalación realizada con el electrodiálizador fue el siguiente: 1. Se prepararon dos litros de una solución de NaCl de 1000 ppm y otros dos litros de una solución de NaCl de 2500 ppm, la primera se agrega en el recipiente de concentrado y la segunda en el recipiente de diluido, se miden las conductividades iniciales de cada solución. 2. Se prepararon dos litros de solución de Na2SO4 al 3 % y se ajusta el pH a 2 con ácido sulfúrico. Luego se introduce en el tanque de la solución de lavado. 3. Se encienden las bombas, verificando primero que las válvulas de salida de las bombas estén cerradas. 4. Por medio de los rotámetros, se fijó el flujo de cada circuito, se utilizó el mismo flujo para cada circuito, este flujo fue de 200 l/h. 5. Antes de continuar hay que cerciorarse de que no hay fugas (goteos) en las membranas. 6. Se encendió la fuente de poder y se fijó el voltaje con el cual se desea trabajar. Para la primera corrida se fijó en 30 V. Luego se oprime el botón de salida de la fuente y se 73 Capitulo V Metodología Experimental verifica que esté encendida la señal de corriente constante (CC), al mismo tiempo se pone en marcha el cronómetro. 7. Se toman muestras de las corrientes diluido y concentrado continuamente a medida que el amperaje varía en el tiempo, y medir su conductividad para llevar un control de la desalación, temperatura, y anotar el tiempo en el que fue tomada la muestra y el voltaje y amperaje para ese momento (se puede leer en la fuente de poder). 8. Cuando la corriente alcance valores de conductividad entre los medidos para las soluciones de 50 y 10 ppm (0,10 y 0,02 mS/cm respectivamente a 19,6 ºC ) o cuando los valores de amperaje no varían se detiene la prueba; primero se detiene el paso de corriente de la fuente a los electrodos y luego se apagan las bombas. 9. Se cierran las válvulas de salida de las bombas. 10. Luego se vacían los tanques de almacenamiento. Una vez completado el procedimiento de desalación, se procede al lavado del electrodiálizador, para ello se llenaron los tanques con agua destilada y se hizo recircular por unos 10 a 15 min. Luego al medir conductividad y ser parecida al del agua limpia se detiene la circulación de agua y se vacían los tanques. La segunda corrida siguió el mismo procedimiento pero esta vez el voltaje se fijo en 15 V para realizar las comparaciones. En esta fase se realizaron dos repeticiones por prueba, la tabla 5.5 muestra un resumen de los experimentos en esta fase. 74 Capitulo V Metodología Experimental Tabla 5.4 Experiencias realizadas en la primera fase del proyecto. Experiencia Tipo de Prueba Voltaje: 30 V 0:1 Flujo: 200 l/h Concentración inicial de diluido (2500 ppm) Voltaje: 30 V 0:2 Flujo: 200 l/h Concentración inicial de diluido (2500 ppm) Voltaje: 15 V 1:1 Flujo: 200 l/h Concentración inicial de diluido (2500 ppm) Voltaje: 15 V 1:2 Flujo: 200 l/h Concentración inicial de diluido (2500 ppm) 5.3.3 Pruebas de desalación de Aguas sintéticas en el electrodializador. En esta segunda fase del proyecto se estudió el efecto de la variación del caudal de las corrientes, y la variación de la concentración del agua sintética en el proceso. El procedimiento empleado para estas pruebas fue el siguiente: 1. Se prepararon dos litros de una solución de NaCl de 500 ppm y otros dos litros de agua sintética (ver punto 5.3.1 de este capítulo), la primera se agrega en el recipiente de concentrado y la segunda en el recipiente de diluido, se miden las conductividades iniciales de cada solución y se guardan para determinar cloruros y los otros metales. 2. Se prepararon dos litros de solución de Na2SO4 al 3 % y se ajustó el pH a 2 con ácido sulfúrico. Luego se introduce en el tanque de la solución de lavado. 3. Se encienden las bombas, verificando primero que las válvulas de salida de las bombas estén cerradas. 4. Por medio de los rotámetros, se fijó el flujo de cada circuito, se utilizó el mismo flujo para cada circuito, este flujo fue de 200 l/h. 5. Antes de continuar se corrobora de que no hay fugas (goteos) en las membranas. 6. Se encendió la fuente de poder y se fijó el voltaje a la que se desea trabajar, en 30 V, ya que con 15 V el proceso dura mucho más tiempo y las corrientes se calientan considerablemente, debido al calor generado por las bombas, lo que afecta la lectura del conductimetro. Luego se oprime el botón de salida de la fuente y se verificó que 75 Capitulo V Metodología Experimental esté encendida la señal de corriente constante (CC) al mismo tiempo se pone en marcha el cronómetro. 7. Se toman muestras de las corrientes diluido y concentrado continuamente a medida que el amperaje varía en el tiempo, esto se hizo cada 3 min aproximadamente (se deben guardar al menos 5 muestras en beakers para los análisis posteriores), y de cada muestra se debe medir la conductividad para llevar un control de la desalación, temperatura, y anotar el tiempo en el que fue tomada la muestra, el voltaje y el amperaje para ese momento (se puede leer en la fuente de poder). 8. Cuando la corriente alcanzó valores de conductividad entre los medidos para las soluciones de 50 y 10 ppm de NaCl (0,10 y 0,02 mS/cm respectivamente a 19,6 ºC ) o cuando los valores del amperaje no varían se detuvo la prueba, primero se detuvo el paso de corriente de la fuente a los electrodos, se detuvo el cronómetro y luego se apagaron las bombas. La operación finalizó cuando la conductividad de la solución sintética fue equivalente a la conductividad de una solución entre 10 y 50 ppm de NaCl. 9. Se cerraron las válvulas de salida de las bombas. 10. Luego se vaciaron los tanques de almacenamiento. 11. Se identificaron los recipientes de las muestras guardadas, para poder saber a que experimento y a cual corriente y tiempo en dicho experimento pertenece. Una vez completado el procedimiento de desalación, se procedió al lavado del electrodiálizador, para ello se llenan los tanques con agua destilada y se hacen recircular por unos 10 a 15 min. Luego al medir conductividad y ser parecida al del agua limpia se detiene la circulación de agua y se vacia los tanques. Para cada prueba se repitió el esquema anterior, pero modificando los caudales a 300 y 100 l/h, también se utilizo “Agua Sintética 2” (al doble de la concentración) en otras experiencias con las mismas variantes. Cada experimento se hizo por duplicado y la tabla 5.6 muestra un resumen de los experimentos en esta segunda fase. 76 Capitulo V Metodología Experimental Tabla 5.5 Experiencias realizadas en la segunda fase del proyecto. Experiencia Tipo de Prueba Voltaje: 30 V 2:1 Flujo: 200 l/h Corriente diluido: Agua Sintética Voltaje: 30 V 2:2 Flujo: 200 l/h Corriente diluido: Agua Sintética Voltaje: 30 V 3:1 Flujo: 300 l/h Corriente diluido: Agua Sintética Voltaje: 30 V 3:2 Flujo: 300 l/h Corriente diluido: Agua Sintética Voltaje: 30 V 4:1 Flujo: 100 l/h Corriente diluido: Agua Sintética Voltaje: 30 V 4:2 Flujo: 100 l/h Corriente diluido: Agua Sintética Voltaje: 30 V 5:1 Flujo: 200 l/h Corriente diluido: “Agua Sintética 2” Voltaje: 30 V 5:2 Flujo: 200 l/h Corriente diluido: “Agua Sintética 2” Voltaje: 30 V 6:1 Flujo: 300 l/h Corriente diluido: “Agua Sintética 2” Voltaje: 30 V 6:2 Flujo: 300 l/h Corriente diluido: “Agua Sintética 2” Voltaje: 30 V 7:1 Flujo: 100 l/h Corriente diluido: “Agua Sintética 2” Voltaje: 30 V 7:2 Flujo: 100 l/h Corriente diluido: “Agua Sintética 2” 5.3.4 Filtración previa de las Aguas de Producción. Con la finalidad de eliminar los sólidos suspendidos con los que vienen las aguas de producción desde el pozo (en nuestro caso de La Victoria estado Apure), entre ellos restos de tierra y lodo que pueden afectar la integridad de las membranas y el resto del equipo, así como el desarrollo de la prueba; se practicó una filtración antes de tratar dichas aguas en el electrodializador, y así preservar el buen estado de las membranas y demás componentes del equipo. 77 Capitulo V Metodología Experimental El procedimiento es el siguiente: 1. Se arma el equipo de filtración descrito en la parte 5.1 como se muestra en la figura 5.9 2. Se enciende la bomba de vacío y se abren las válvulas del Figura 5.8 Equipo de filtración sistema. 3. Luego se revisa para que no haya escape de vacío por las conexiones y se coloca el papel de filtro ( Whatman N° 2). 4. Se agrega el agua de producción en el embudo poco a poco y se espera a que pase hacia el kitasato, se debe tener cuidado de que el vacío no arrastre agua de producción para evitar perdidas. Figura 5.9 Filtración del agua de producción 5. Hay que vigilar el estado del papel de filtro y cambiarlo cuando se note que esta muy cargado de sólidos. 6. Detener la bomba en cuanto el kitasato se llene y transvasar el filtrado a un envase previamente lavado. 7. Repetir el proceso cuantas veces sea necesario. 5.3.5 Pruebas de desalado de Agua Producción en el Electrodiálizador. Con la finalidad de evaluar el desempeño de la desalación en el electrodializador se realizó una prueba con agua de producción autentica procedente de La Victoria estado Apure, de composición similar al de las aguas sintéticas tratadas anteriormente. La idea de esta prueba era comprobar a las condiciones de una de las pruebas anteriores, la desalación de unas aguas reales de pozo y determinar el consumo energético del proceso. Debido a que fue muy difícil obtener una muestra suficiente de esta agua sólo se realizó una prueba a 200 l/h con una repetición, y no a diferentes velocidades de flujo ya que no se contaba con suficiente muestra de agua. El procedimiento empleado para estas pruebas fue el siguiente: 78 Capitulo V Metodología Experimental 1. Se prepararon dos litros de una solución de NaCl de 500 ppm, se agregaron en el recipiente de concentrado, se midieron las conductividades iniciales de cada solución y se guardaron para determinar cloruros y los otros metales. 2. Se filtró la muestra de agua de producción de La Victoria como se explica en el punto 5.3.4, luego se midieron dos litros de filtrado y se agregaron en el recipiente de diluido. Se midieron las conductividades iniciales de cada solución y se guardaron para determinar cloruros y los otros metales. 3. Se prepararon dos litros de solución de Na2SO4 al 3 % y se ajustó el pH a 2 con ácido sulfúrico. Luego se introduce en el tanque de la solución de lavado. 4. Se encendieron las bombas, verificando primero que las válvulas de salida de las bombas estaban cerradas. 5. Por medio de los rotámetros, se fijó el flujo de cada circuito, se utilizó el mismo flujo para cada circuito, este flujo fue de 200 l/h. 6. Antes de continuar se corrobora de que no hay fugas (goteos) en las membranas. 7. Se encendió la fuente de poder y se fijó el voltaje con el cual se desea trabajar, este fue de 30 V. Luego se oprime el botón de salida de la fuente y se verifica que esté encendida la señal de corriente constante (CC), al mismo tiempo se da marcha al cronómetro. 8. Se toman muestras de las corrientes diluido y concentrado continuamente a medida que el amperaje varia en el tiempo, esto se hace cada 3 min aproximadamente (se deben guardar al menos 5 muestras en beakers para los análisis posteriores), y de cada muestra se debe medir la conductividad para llevar un control de la desalación, temperatura, y anotar el tiempo en el que fue tomada la muestra, el voltaje y el amperaje para ese momento (se puede leer en la fuente de poder). 79 Capitulo V Metodología Experimental 9. Cuando la corriente alcanzó valores de conductividad entre los medidos para las soluciones de 50 y 10 ppm, equivalente de NaCl (0,10 y 0,02 mS/cm respectivamente a 19,6 ºC ) o cuando los valores del amperaje no variaron finaliza la prueba, primero se detuvo el paso de corriente de la fuente a los electrodos, se detuvo el cronómetro y luego se apagaron las bombas. 10. Se cerraron las válvulas de salida de las bombas. 11. Luego se vaciaron los tanques de almacenamiento. 12. Se identificaron los recipientes de las muestras guardadas, para poder saber a que experimento, a cual corriente y tiempo en dicho experimento pertenece. Una vez completado el procedimiento de desalación, se procedió al lavado del electrodiálizador, para ello se llenaron los tanques con agua destilada y se hizo recircular por unos 10 a 15 min. Luego al medir conductividad y ser parecida al del agua limpia se detuvo la circulación de agua y se vaciaron los tanques. Para cada prueba se repitió el esquema anterior, la tabla 5.7 muestra un resumen de los experimentos en esta segunda fase. Tabla 5.6 Experiencias realizadas en la tercera fase del proyecto. Experiencia Tipo de Prueba Voltaje: 30 V 8:1 Flujo: 200 l/h Corriente diluido: Agua de Producción (La Victoria) Voltaje: 30 V 8:2 Flujo: 200 l/h Corriente diluido: Agua de Producción (La Victoria) 5.3.6 Determinación de Cloruros por el método de Mohr. Los cloruros son constituyentes mayoritarios del agua de producción estudiada. Estos le dan un sabor desagradable a altas concentraciones (aprox por encima de 1000 ppm) y sobre todo cuando se encuentran en forma de NaCl, KCl ó CaCl2. El problema principal del que parte este proyecto de grado es la alta concentración de cloruros en las aguas de producción de los pozos de La Victoria del estado Apure, por encima de los 1000 ppm que exige la norma en 80 Capitulo V Metodología Experimental el decreto 883 para disposición en cuerpos de agua, por ello se propone la electrodiálisis como un proceso para tratar estas elevadas concentraciones y obtener un agua diluida en cloruros y otros iones. Para ello es necesario implementar una metodología adecuada para la determinación de los cloruros. La metodología escogida para la evaluación de este parámetro es el establecido en el método 4500-Cl- B del Standard Methods for Examinatión of Waters and Wastewater (26). Dicho procedimiento es una técnica argentométrico, concretamente el método de Mohr. Consiste en añadir a la muestra problema (cuyo pH=7-10), disolución AgNO3 valorante, y disolución indicadora K2CrO4. El Cl- precipita con el ion Ag+ formando un compuesto muy insoluble, de color blanco. Cuando todo el producto ha precipitado, se forma el cromato de plata, de color rojo ladrillo, que es menos insoluble que el anterior y nos señala el fin de la valoración. Reacción de valoración: ClNa + NO3Ag $ ClAg + NO3Na Ec. 4.2 Reacción indicadora: 2NO3Ag (exc.) + CrO4K2 $ CrO4Ag2 + 2NO3K Ec. 4.3 Procedimiento y Cálculo. 1.-Estandarización de la disolución de AgNO3. En un erlenmeyer de 250 ml, se añaden 10 ml (medidos con pipeta) de la disolución de NaCl patrón (preparado como se explica en la parte 5.3.1), se adicionan 20 ml (medidos con pipeta) de agua destilada y 1 ml (medidos con pipeta) de la disolución de K2CrO4. Se adiciona el AgNO3 desde la bureta hasta viraje del indicador de amarillo (turbio) a pardo-amarillento (turbio). Cálculos: VNaCl * NNaCl = VAg NO3 * NAg NO3 EC. 4.4 NAg NO3 = ( 50* 0.01) / (VAgNO3) 2.-Determinación de cloruros en el agua problema. En un erlenmeyer de 250 ml, se añaden 10 ml de agua problema (agua de las muestras tomadas durante el proceso de electrodiálisis), se diluye con 20 ml de agua destilada y se 81 Capitulo V Metodología Experimental agrega 1 ml (medidos con pipeta) de la disolución de K2CrO4 como indicador. Se adiciona AgNO3 desde la bureta hasta viraje del indicador de amarillo (turbio) a pardo-amarillento (turbio). meq Cl- = meq Ag NO3 EC. 4.5 (mg Cl-) / (Peq) = VAg NO3 * NAgNO3 Si lo que queremos son los mg/l de cloruros: ppm Cl- = (VAg NO3)*N*35.45) / Vmuestra) * 1000 EC. 4.6 5.3.7 Determinación de metales por Absorción atómica. La absorción de la luz por medio de átomos brinda una herramienta analítica poderosa para los análisis cuantitativos y cualitativos. La espectroscopia de absorción atómica (AAS) se basa en el principio que los átomos libres en estado fundamental pueden absorber la luz a una cierta longitud de onda. La absorción es específica, por lo que cada elemento absorbe a longitudes de ondas únicas. AAS es una técnica analítica aplicable al análisis de trazas de elementos metálicos en minerales, muestras biológicas, metalúrgicas, farmacéuticas, aguas, alimentos y de medio ambiente. Es por ello que se ha escogido esta técnica para determinar las concentraciones de Na+, K+, Ca2+ y Mg2+ en las muestras obtenidas en el transcurso de las pruebas realizadas, con la finalidad de evaluar la distribución de dichos iones entre las corrientes de diluido y concentrado en el transcurso de la electrodiálisis. 5.3.7.1 Determinación de Na+. Para determinar la cantidad de sodio presente en la muestra de la corriente tratada en la electrodiálisis, sea de la corriente concentrado o diluido, se midió el espectro de absorción en la llama, utilizando para ello el espectrofotómetro de absorción atómica y el procedimiento 3111B de Standard Methods for Examination of Water and Wastewater (26) y como lo indica el manual del equipo. Para ello se seleccionó el modo de emisión y se especificó el tipo de catión y la longitud de onda (589nm). El procedimiento seguido fue el siguiente: Preparar soluciones patrones de NaCl a 60, 40, 20, 10 y 5 ppm en KCl (ver punto 5.3.1 de este capitulo) y medirle la absorbancia, programando el equipo en calibración para grabar la curva de calibración obtenida. 82 Capitulo V Metodología Experimental Diluir en balones de 50 ml con KCl 0,5 ml de muestra y medir la absorbancia, de estar muy diluida la muestra no será detectada por el equipo, en este caso se hace nueva diluciones de 5 ml de muestra en 50ml, 2 ml en 25ml o tomar una alícuota sin diluir de ser necesario. Con las concentraciones de las diluciones determinadas por el equipo se calcula las concentraciones de las muestras con las relaciones de dilución. 5.3.7.2 Determinación de K+. Al igual que con el sodio, el potasio se determinó midiendo la emisión de la llama, utilizando para ello el espectrofotómetro de absorción atómica en el modo de emisión a una longitud de onda de 766,5 nm. El procedimiento seguido fue similar al explicado anteriormente para el sodio, con la diferencia que las soluciones patrones preparadas eran hidróxido de potasio, en este caso las soluciones preparadas y las diluciones si se realizaban con agua destilada. 5.3.7.3 Determinación de Ca2+. Siguiendo el método indicado en la norma 3111 A del Standard Method for Examination of Water and Wastewater (26) por espectrometría de absorción atómica se determinaron las concentraciones de calcio de las muestras. Para ello se seleccionó el modo de espectrometría de absorción atómica y se especificó el tipo de catión, se instaló y aseguró la lámpara catódica correspondiente y se especificó la longitud de onda (422,7nm). El procedimiento seguido fue el siguiente: Ajustar la mezcla aire – acetileno para formar una llama de combustión completa. Las muestras que poseen precipitados se deben acidificar con agua regia para eliminar los precipitados. Preparar soluciones patrones de CaCO3 a 60, 40, 20, 10 y 5 ppm con agua regia se hacen las diluciones. (ver punto 5.3.1 de este capítulo) y medirle la absorbancia, programando el equipo en calibración para grabar la curva de calibración obtenida. Diluir en balones de 50 ml con agua regia 0,5 ml de muestra y medir la absorbancia, de estar muy diluida la muestra no será detectada por el equipo, en este caso se hace 83 Capitulo V Metodología Experimental nueva diluciones de 5 ml de muestra en 50ml, 2 ml en 25ml o tomar una alícuota sin diluir de ser necesario. Con las concentraciones de las diluciones determinadas por el equipo se calcula las concentraciones de las muestras con la curva de calibración y las relaciones de dilución. 5.3.7.3 Determinación de Mg2+. Al igual que con el calcio, el magnesio se determinó midiendo la absorción atómica directa con una llama de aire y acetileno, utilizando para ello el espectrofotómetro de absorción atómica a una longitud de onda de 285,2 nm (con la lámpara correspondiente). El procedimiento seguido fue similar al explicado anteriormente para el calcio, con la diferencia que las soluciones patrones preparadas son con magnesio metálico y agua regia (ver punto 5.3.1), en este caso las soluciones preparadas y las diluciones se realizaban todas con agua regia. 84 Capitulo VI Resultados y Discusiones CAPITULO VI RESULTADOS Y DISCUSIONES. 6.1 Resultados de la primera fase del Proyecto (pruebas preliminares de desalación). Tal como se señaló en la metodología, se realizaron dos pruebas de desalación con soluciones de NaCl, en la primera se usó en la corriente “Diluido” una solución con una concentración inicial de 2500 ppm de NaCl, en la corriente “Concentrado” una solución con una concentración inicial de 1000 ppm. Para esta primera corrida se fijó un voltaje de 30V y el amperaje varía en el transcurso de la electrodiálisis, también se fijó un flujo de 200 l/h. Los resultados obtenidos durante la desalación de la solución de 2500 ppm con un voltaje de 30 V se muestran en la tabla A.1 (ver anexo). En ella se puede notar que la conductividad de la solución diluida es menor al final del proceso, mientras que la del concentrado ha aumentado, esto evidencia el paso de iones desde la corriente del diluido (solución a 2500 ppm inicialmente) al concentrado (solución de 1000 ppm inicialmente). En la figura 6.1 se muestra la variación de la conductividad durante el transcurso de la operación de desalación. 8 Concentrado 7 Diluido L (mS/cm) 6 5 4 3 2 1 0 0 0,72 3,45 6,56 9,39 13,2 16,7 19,5 22,1 25 29,4 t (min) Figura 6.1 Conductividad Vs. Tiempo para la solución diluido y concentrado a 30V Se observa claramente la reducción de la conductividad de la corriente de diluido y el aumento de dicha variable en el concentrado. También se observa que ambas corrientes varían muy poco su conductividad después de los 16,7 min aproximadamente, esto se debe a que el flujo de corriente a través de las celdas es menor ya que la concentración de iones en la celda de diluido es muy pequeña, y si no hay flujo de corriente el traspaso de iones de diluido a 85 Capitulo VI Resultados y Discusiones concentrado no se produce. De ahí que se puede observar un tiempo óptimo para el proceso, ya que a mayor tiempo la eficiencia de separación es muy baja. Para el caso de la segunda corrida las condiciones de operación son similares, excepto que la caída de potencial fijada es de 15V, los resultados se muestran en la tabla A.2 (Ver anexo) y en la figura 6.2. De igual manera se observa que la conductividad de la corriente de diluido es menor y la conductividad de la corriente de concentrado es mayor al final del proceso, es decir, se evidencia al igual de la primera corrida el paso de iones de una solución a otra. Pero a diferencia de la primera corrida esta necesitó más tiempo para lograr valores de transferencia de iones similares, esto se debe a que el flujo de corriente es mayor para un voltaje mayor suponiendo que la resistencia es la misma para las dos corrientes, es decir, que mayor flujo de corriente es mayor la velocidad de transferencia de iones y esto es lógico. Si se evalúa la ley de Ohm I·R=V para una resistencia similar para un voltaje mayor el flujo de corriente debe aumentar para cumplir la ley, y para valores de voltaje menor el flujo de corriente debe ser menor, esto explica el fenómeno observado. 7 Concentrado L (mS/cm) 6 Diluido 5 4 3 2 1 0 0 0,76 3,16 5,93 9,67 12,1 15,1 17,1 20,4 23,3 25,9 29,4 32,8 t (min) Figura 6.2 Conductividad Vs. Tiempo para la solución diluido y concentrado a 15V De igual manera que para la primera corrida, en la figura 6.2 se nota la reducción de la conductividad en la corriente de diluido y el aumento de dicha variable en la corriente de concentrado a través del tiempo transcurrido en el proceso. Igual se observa un tiempo máximo 86 Capitulo VI Resultados y Discusiones después del cual la conductividad de las dos corrientes varía muy poco, este tiempo es cerca de los 20,4 min, tiempo mayor que para la primera corrida debido al menor voltaje aplicado. 4,5 7 4 6 3,5 5 L (mS/cm) L (mS/cm) 8 4 3 Diluido a 30 V Diluido a 15 V 3 2,5 2 1,5 2 Concentrado a 30 V 1 Concentrado a 15 V 0 1 0,5 0 0 0,76 3,16 5,93 9,67 12,1 15,1 17,1 20,4 23,3 25,9 29,4 32,8 0 0,76 3,16 5,93 9,67 12,1 15,1 17,1 20,4 23,3 25,9 29,4 32,8 t (min) (a) t (min) (b) Figura 6.3 Conductividad Vs. Tiempo para la solución concentrado (a) y diluido (b) a 30V y 15 V En las figuras 6.3 a y b se percibe mas fácilmente la diferencia de una corrida a 30V y 15V, para el caso de la figura 6.3(a) se nota como la corriente de concentrado tratado con 30V llega a valores mayores de conductividad en un tiempo menor, de igual manera en la figura 6.3(b) la corriente de diluido a 30V alcanza valores menores de conductividad en menor tiempo. Es importante señalar que la migración de iones a mayor diferencia de potencial eléctrico es de esperarse, ya que la migración de los iones viene dada por la ecuación de NerstPlanck: Ji = -DCi(dlnai/dx + (ZiF/RT)dE/dx) Ec 6.1 Donde Ji es el flujo de iones, D es la constante de difusión, Ci es la concentración del ión i, ai es la actividad del ión i, x el espesor de la membrana, E el campo eléctrico, Zi la carga del ión, F la constante de Faraday, R la constante universal de los gases, T la temperatura absoluta. Como se puede observar, al aumentar la diferencia de potencial eléctrico, aumenta el flujo de iones (aumenta el valor dE/dx en la ecuación) (28). En las dos corridas se observa un ligero aumento de la temperatura para todas las corrientes, ello es debido principalmente a la recirculación de los fluidos a través de las bombas centrífugas que se calientan por la fricción de los “impelers”. Esto es un factor a considerar en la próxima fase del proyecto ya que un aumento de temperatura genera un aumento de los valores 87 Capitulo VI Resultados y Discusiones de conductividad. También se evidencia en ambas pruebas la disminución del amperaje en el transcurso del proceso, el cual se produce por el aumento de la resistencia en las celdas a medida que la concentración de iones disminuye en la corriente del diluido, y para mantener el voltaje fijo y cumplir con la ley de Ohm el amperaje debe disminuir. Con estos resultados se pudo establecer el voltaje en 30 Voltios para realizar las pruebas de la siguiente fase del proyecto, la idea de usar un voltaje de 30V y no de 15V es que con 30V tenemos pruebas que se realizaran en menor tiempo, disminuyendo de esta manera el calentamiento de las aguas por el paso a través de las bombas por la fricción de los “impelers”. Obtener grandes variaciones de temperatura en el transcurso del proceso no es favorable ya que las mediciones de conductividad utilizadas para el seguimiento de la desalación pueden verse afectadas y arrojar desviaciones que hagan difíciles la interpretación de los resultados. 6.2 Pruebas con Aguas Sintéticas y Agua de Producción. En esta fase del proyecto se usaron las aguas sintéticas preparadas según la metodología expuesta en el capítulo anterior, la finalidad de usar “Agua Sintética” y “Agua Sintética 2” (de doble concentración en sus elementos) es evaluar el efecto de la concentración inicial en el agua a tratar. Otra variable estudiada en esta fase es el efecto de la velocidad del flujo a través del equipo de electrodiálisis, también se determinó el efecto de estas variables en el trasporte de los diferentes iones que conforman esta agua como Na+, K+, Ca2+ y Mg2+. Al igual que con las pruebas preliminares de desalación para comprobar que efectivamente con la electrodiálisis podemos separar los iones de una corriente a tratar, se llevó el control del proceso con la medida de la conductividad, en las figuras 6.4 se puede observar como efectivamente la corriente de Agua Sintética muestra medidas de conductividad menores a medida que avanza el proceso, y la corriente concentrado progresivamente, las medidas de conductividad son mayores, demostrando esto que tanto la corriente de Agua Sintética va disminuyendo su concentración en iones como que la corriente de concentrado aumenta su concentración en estos iones. 88 9 16 8 14 7 12 6 5 L (mS/cm) L (m S /c m ) Capitulo VI Resultados y Discusiones Concentrado 4 Agua Sintética 3 10 4 1 2 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00 Agua Sintética 2 6 2 0 0,00 Concentrado 8 0 0,00 5,00 10,00 t (min) 15,00 20,00 25,00 30,00 35,00 t (min) (a) ( b) Figura 6.4 Conductividad Vs. Tiempo para la solución concentrado y Agua Sintética (a) y Agua Sintética 2 (b) , para las corridas a concentración sencilla y doble concentración. Resultados de las pruebas 2.1,2.2 (a) y 5.1,5.2 (b) Este comportamiento se puede observar en todas las pruebas realizadas a diferentes flujos de aguas sintéticas de baja y alta concentración (ver anexo A.3). De cada prueba realizada se obtuvieron 5 muestras de cada corriente, extraídas a diferentes instantes de tiempo con el fin de estudiar el proceso a través del tiempo como se explicó anteriormente en la metodología. A cada muestra se determinó la concentración de cloruros con el método de Mohr con la finalidad de estudiar el comportamiento de dicho anión en la solución tratada y la solución de concentrado. 2500 [Cl] ppm 2000 1500 Agua Sintètica Concentrado 1000 500 0 0,00 5,00 10,00 15,00 20,00 t (min) 25,00 30,00 35,00 40,00 Figura 6.5 Concentración de cloruros Vs tiempo para la prueba de Agua Sintética a 200 l/h En la figura 6.5 se muestra como efectivamente la concentración de cloruros en el Agua Sintética (a baja concentración) progresivamente va en descenso y como va en aumento dicho parámetro en la corriente de concentrado. Observamos como efectivamente podemos llevar una corriente con un concentración superior a los 2000 ppm de cloruro a niveles tan bajos cercanos a los 20 ppm, lo que significa una reducción del 98,76 % para esta prueba realizada al Agua 89 Capitulo VI Resultados y Discusiones Sintética de baja concentración a 200 l/h de flujo. En el caso de la corriente de concentrado va de una concentración de 250 ppm aproximadamente a niveles de 2600 ppm, lo que representa un aumento del 919,0 % aproximadamente para la prueba estudiada en este gráfico. Cabe destacar que estos valores indican que efectivamente hay una transferencia de iones desde la corriente de Agua Sintética a la corriente de Concentrado, y que esta transferencia es en contra al gradiente de concentración, gracias a la presencia del campo eléctrico que atrae los cationes hacia el cátodo del equipo y los aniones hacia el ánodo del equipo, y que debido a la disposición adecuada de membranas catiónicas y aniónicas en el equipo se concentran los iones en la corriente Concentrado, dicho comportamiento se observa en todos los casos (Ver anexo A.4). Al igual que en las pruebas preliminares con soluciones de NaCl observamos que existe un momento en el proceso donde la transferencia de iones se hace poco efectiva (a partir de los 15 min aproximadamente) en donde la transferencia ha sido casi total y la variación de las concentraciones a partir de entonces es casi nula, esto se debe a que si tenemos una de las dos soluciones con bajas concentraciones de iones, como es el caso ya a esta altura del proceso, la resistencia en dicha solución será mayor y el paso de corriente será menor afectando así la transferencia de iones, esto nos indica la existencia de un tiempo optimo en el proceso en donde a partir de el ya no es eficaz y debería detenerse. Inclusive al continuarse existe la probabilidad de provocar la electrolisis del agua en la cercanía de los electrodos. En la tabla 6.1 se observa el porcentaje de reducción de la concentración de cloruros de las pruebas realizadas, en dicho cuadro observamos como en todos los casos que los porcentajes superan los 98,5 % de reducción de cloruros, ello muestra la efectividad del proceso, que logra obtener aguas tratadas con concentraciones muy bajas en cloruros, concentraciones que cumplirían con el decreto 883 (25), en el caso de ser un agua tratada para la reinyección o disposición en cuerpos de agua. Tabla 6.1 Porcentaje de Reducción en la concentración de cloruros en las pruebas realizadas. Agua Sintética (Baja Concentración) Agua Sintética 2 (Alta Concentración) Flujo (l/h) % Reducción de cloruros 100 99,18 Tiempo (min)* 32,2 32,6 200 99,35 27,2 25,6 300 99,51 27,1 Flujo (l/h) % Reducción de cloruros 100 98,63 Tiempo (min)* 36,3 200 98,76 300 99,15 * Tiempo que duro la operación a dichas condiciones, promedio de las dos repeticiones. 90 Capitulo VI Resultados y Discusiones La influencia de la velocidad en el flujo del agua tratada fue estudiada, la figura 6.6 (y la tabla 6.1) muestra concentración de cloruros en el transcurso de la prueba en el Agua Sintética tratada a diferentes caudales, se observa claramente como para la prueba realizada a 300 l/h de flujo, la reducción en cloruros se produce a mayor velocidad que en las pruebas realizadas a 100 y 200 l/h en donde su comportamiento es muy similar. La razón por la que la desalación ocurre mas rápido a mayores velocidades de flujo se debe a que a mayor velocidad la capa límite se reduce y por ende la polarización de concentración, que en los procesos con membranas afectan significativamente la transferencia de masa, lo que implica que a mayor velocidad de flujo, mayor transferencia de masa. También, se mejora el mezclado con mayor turbulencia. El hecho de que no se aprecie una diferencia entre las pruebas realizadas a 100 y 200 l/h podría deberse a que esa diferencia en la velocidad del flujo no implica un aumento sustancial en la turbulencia, como si ocurre cuando ya pasamos a 300 l/h. Sin embargo, las diferencias no son sustanciales entre los tres flujos estudiados, por lo que aparentemente hay un gran grado de turbulencia en los tres casos, y las pequeñas diferencias se deban a errores experimentales. 2500 ppm Cl 2000 1500 200 l/h 300 l/h 1000 100 l/h 500 0 0,00 5,00 10,00 15,00 20,00 t (min) 25,00 30,00 35,00 40,00 Figura 6.6 Concentración de cloruros vs tiempo para la prueba de Agua Sintética a diferentes velocidades de flujo. De igual manera la desalación obtenida en los tres casos cumple con lo esperado, si observamos la tabla 6.1 a mayor velocidad el porcentaje de desalado es mayor, lo que resulta razonable con lo explicado en el párrafo anterior. En la figura 6.7 vemos el caso para las pruebas con Agua Sintética 2 (agua de alta concentración). 91 Capitulo VI Resultados y Discusiones 4500 4000 3500 ppm Cl 3000 200 l/h 2500 300 l/h 2000 100 l/h 1500 1000 500 0 0,00 5,00 10,00 15,00 20,00 t (min) 25,00 30,00 35,00 Figura 6.7 Concentración de cloruros vs tiempo para la prueba de Agua Sintética 2 a diferentes velocidades de flujo. Al igual que para las aguas de baja concentración la desalación ocurre mas rápido para elevadas velocidades de flujo, podemos observa como para las pruebas a 300 l/h se alcanza niveles bajos de concentración en menores tiempos, pero a diferencia de las pruebas con aguas de baja concentración, con esta Agua Sintética 2 se observa una diferencia notable entre las pruebas a 200 l/h y 100 l/h, aquí ya el factor velocidad es mas importante entre estos dos caudales, ya que inclusive la diferencia entre las pruebas a 200 l/h y 300 l/h es muy pequeña, lo que sugiere que existe una relación entre la velocidad y la concentración de las sales, y que hay un punto crítico en la velocidad que favorece a la desalación que depende también de la concentración del agua tratada, podemos deducir que dicho punto se encuentra a mayores velocidades para concentraciones menores y se desplaza a menores velocidades para mayores concentraciones, aunque para afirmar esto es necesario muchos mas estudios y mas pruebas a diferentes velocidades y concentraciones. El efecto de la concentración fue estudiado para la desalación de estas aguas sintéticas. Para ello se repitieron las pruebas a bajas concentraciones esta vez a altas concentraciones de sales disueltas, lo que denominamos Agua Sintética y Agua sintética 2 respectivamente como fue indicado en la metodología. En las figuras 6.8, 6.9 y 6.10 podemos observar el porcentaje de reducción de concentración de cloruros a través del tiempo para las pruebas realizadas a 100, 200 y 300 l/h. La razón de expresar este comportamiento en porcentaje de reducción es para poder realizar una comparación entre aguas con una diferencia en concentración inicial aproximadamente del doble. La tendencia a seguir en las tres gráficas es el aumento del 92 Capitulo VI Resultados y Discusiones porcentaje de reducción de cloruros, este 120,00 porcentaje fue calculado con respecto a las alcanzan porcentajes de reducción mayores en menos tiempo para Agua Sintética, lo que indica que la disminución de concentración % R e d u c c ió n d e C l concentraciones iniciales. En la figura 6.8 se 100,00 de cloruros en las aguas tratadas de menor 80,00 Agua Sintética 60,00 Agua Sintética 2 40,00 20,00 concentración inicial se produce levemente 0,00 0,00 mas rápido que en el caso de las aguas tratadas con cloruros, altas esto concentraciones a 100 l/h. 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00 45,00 t (min) de Figura Nº 6.8 Porcentaje de reducción de la concentración de cloruro en las aguas tratadas a 100 l/h Este comportamiento indica que para iguales velocidades de flujo las 120,00 diferentes 100,00 influencia muy notable, y simplemente se desconcentra en menos tiempo las aguas que tienen menos iones inicialmente. % R ed u cció n d e C l concentraciones iniciales no ejercen una 80,00 60,00 Agua Sintética 40,00 Agua Sintética 2 20,00 Observando las figuras 6.9 y 6.10 el 0,00 0,00 comportamiento es similar al descrito 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00 t (min) anteriormente, en el caso de las pruebas a Figura Nº 6.9 Porcentaje de reducción de la concentración de cloruro en las aguas tratadas a 200 l/h 200 l/h no hay una diferencia tan marcada entre la velocidad de desalación, ello puede 120,00 deberse a algún error experimental, en el notamos una diferencia mas marcada en los dos comportamientos, observándose que con aguas de menor concentración inicial se alcanzan altos porcentajes de reducción en menos tiempo que con las aguas de alta 100,00 % R e d u c c ió n d e C l caso de las pruebas realizadas a 300 l/h si 80,00 Agua Sintética Agua Sintética 2 60,00 40,00 20,00 0,00 0,00 5,00 10,00 15,00 20,00 25,00 30,00 t (min) concentración inicial. Figura Nº 6.10 Porcentaje de reducción de la concentración de cloruro en las aguas tratadas a 300 l/h 93 Capitulo VI Resultados y Discusiones Estos comportamientos indican que en un proceso de electrodiálisis el cambio de la concentración inicial de las aguas a ser tratadas no ejerce una influencia importante en el proceso, demostrando que la electrodiálisis es un método de tratamiento muy flexible y que se adapta a aguas de diferentes concentraciones. Para el caso del tratamiento de aguas de producción de diferentes pozos es muy importante ya que las concentraciones de las sales no siempre son las mismas y con este proceso pueden ser tratadas de igual manera, llegando siempre a los mismos niveles de concentración finales, siendo las variables a controlar el flujo y la caída de potencial. Es necesario realizar más pruebas a diferentes concentraciones para asegurar estas afirmaciones. En la tabla 6.1 observamos como son mayores los porcentajes finales de reducción para aguas de mayor concentración, ello es lógico si observamos que las concentraciones finales de cloruros alcanzadas son muy similares en todos los casos. 120,00 120,00 100,00 100,00 % Reducción CALCIO MAGNESIO 60,00 SODIO 40,00 80,00 POTASIO CALCIO 60,00 MAGNESIO SODIO 40,00 100 l/h 200 l/h 20,00 0,00 0,00 20,00 10,00 20,00 30,00 40,00 50,00 0,00 0,00 5,00 10,00 15,00 t (min) 20,00 25,00 30,00 35,00 40,00 t (min) 120,00 100,00 POTASIO % Reducción % R e d u c c ió n POTASIO 80,00 CALCIO 80,00 MAGNESIO SODIO 60,00 40,00 300 l/h 20,00 0,00 0,00 5,00 10,00 15,00 t (min) 20,00 25,00 30,00 Figura 6.11 Porcentaje de reducción de la concentración de cationes vs tiempo para la prueba de Agua Sintética a diferentes velocidades de flujo. 94 Capitulo VI Resultados y Discusiones El comportamiento de los cationes fué estudiado en estas pruebas. La figura 6.11 muestra el porcentaje de reducción de los cationes a 100, 200 y 300 l/h para aguas a baja concentración inicial de sales (Agua Sintética). Observamos como en todos los iones efectivamente se logra reducir más del 99% de las concentraciones, esto para todos los flujos probados. Se observa como en todos los casos el catión K+ logra altos porcentajes de reducción en menor tiempo indicando una mayor velocidad de transferencia de este catión desde la corriente de Agua Sintética a la corriente de Concentrado. Observando el comportamiento de los otros cationes encontramos que el segundo catión en lograr altos porcentajes de reducción en menor tiempo es el Mg2+ y por ultimo el Ca2+. En la figura 6.12 de igual manera vemos el comportamiento de los cationes en desalación de Agua Sintética 2 (aguas de alta concentración), en este caso vemos un comportamiento similar donde la transferencia de los cationes va en el orden (del más rápido al mas lento) K+ > Mg2+ > Ca2+, en el caso del comportamiento del Na+ ya es más estable y podríamos decir que sería el segundo catión en trasferirse más rápido (después del K+) pero sería recomendable realizar mas estudios para afirmar este comportamiento, ya que se observa un comportamiento irregular para este ion que se atribuyen a errores en la medición de las concentraciones en las muestras (por el método de emisión de llama). A diferencia de las pruebas realizadas con aguas de baja concentración el porcentaje de reducción alcanzado para el Ca2+ es mucho menor (alrededor del 90 %), dicho comportamiento podría deberse a una saturación de las membranas debido a la presencia de una cantidad mayor de dicho catión, lo que muestra en este caso una influencia en la concentración de iones en el agua a tratar sobre el proceso. 95 Capitulo VI Resultados y Discusiones 120,00 120,00 100,00 % Reducción 80,00 POTASIO CALCIO 60,00 MAGNESIO SODIO 40,00 100 l/h 20,00 0,00 0,00 5,00 10,00 15,00 20,00 t (min) 80,00 POTASIO 60,00 CALCIO MAGNESIO SODIO 40,00 200 l/h 20,00 25,00 30,00 35,00 0,00 0,00 5,00 10,00 15,00 20,00 t (min) 25,00 30,00 120,00 100,00 % Reducción % Reducción 100,00 80,00 POTASIO 60,00 CALCIO MAGNESIO 300 l/h 40,00 SODIO 20,00 0,00 0,00 5,00 10,00 15,00 20,00 t (min) 25,00 30,00 35,00 Figura 6.12 Porcentaje de reducción de la concentración de cationes vs tiempo para la prueba de Agua Sintética 2 a diferentes velocidades de flujo. Este orden en la transferencia no se ajusta a lo encontrado en las pruebas realizadas por T. Sirivedhin (27) en donde el orden de transferencia va (desde el más rápido al más lento) Mg2+ ≈ Ca2+ > K+ > Na+, ello es probable a que para dichos estudios se usó una membrana diferente y que la selectividad de estas membranas era tal que favorecía la transferencia del Mg2+ y Ca2+, el orden conseguido en la transferencia de cationes con este trabajo indica una mayor afinidad de las membrana por los cationes monovalentes como el potasio, en el caso de los cationes bivalentes observamos que el magnesio tiene mayor velocidad de transferencia, ello podría deberse a que dicho catión tiene menor peso molecular que el Ca2+, favoreciendo esto el desplazamiento de este catión y su paso por la membrana. 96 35,00 Capitulo VI Resultados y Discusiones 120,00 120,00 100,00 100 l/h AS 80,00 200 l/h AS 300 l/h AS 60,00 100 l/h AS2 40,00 200 L/h AS2 K 20,00 0,00 0,00 + 300 l/h AS2 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00 45,00 % R e d u c c ió n % R e d u c c ió n 100,00 100 l/h AS 80,00 200 l/h AS 60,00 300 l/h AS 100 l/h AS2 40,00 200 L/h AS2 Na 20,00 0,00 0,00 5,00 10,00 15,00 20,00 300 l/h AS2 25,00 30,00 35,00 40,00 45,00 t (min) t (min) 120,00 120,00 100 l/h AS 80,00 200 l/h AS 60,00 300 l/h AS 100 l/h AS2 40,00 200 L/h AS2 Ca 20,00 0,00 0,00 5,00 10,00 15,00 2+ 20,00 300 l/h AS2 25,00 30,00 35,00 40,00 45,00 % R e d u c c ió n 100,00 100,00 % R e d u c c ió n + 100 l/h AS 80,00 200 l/h AS 300 l/h AS 60,00 100 l/h AS2 40,00 200 L/h AS2 2+ Mg 20,00 0,00 0,00 5,00 10,00 t (min) 15,00 300 l/h AS2 20,00 25,00 30,00 35,00 40,00 t (min) Figura 6.13 Porcentaje de reducción de la concentración de cationes vs tiempo para cada catión, en diferentes condiciones de flujo y concentración inicial de iones. En la figura 6.13 puede observarse el porcentaje de reducción de la concentración de cada uno de los cationes en las aguas tratadas para diferentes velocidades de flujo y en las pruebas a diferentes concentraciones iniciales para diferentes instantes de tiempo del proceso. Encontramos en estas gráficas que no existen mayores diferencias en el comportamiento de los cationes, indicando esto poca influencia en la transferencia de cationes, modificaciones de la velocidad del flujo y la concentración inicial de las aguas a tratar, solo se observa una pequeña desviación en la transferencia de Ca2+, donde se observa que se alcanzan porcentajes altos de reducción en menor tiempo para la prueba realizada a 300 l/h a Agua Sintética. Otra observación que podemos hacer con respecto a este catión es que a menores concentraciones iniciales observamos mayores porcentajes de reducción, lo que ya se ha discutido. En la tabla 6.2 se observan los porcentajes de reducción finales de los distintos cationes a diferentes 97 45,00 Capitulo VI Resultados y Discusiones pruebas, podemos observar como en la mayoría de los casos los porcentajes superan el 98 %, llegando algunos hasta un 100 %. Catión Flujo 100 200 300 Tabla 6.2 Porcentaje de Reducción de cationes en las pruebas realizadas. Na+ Mg2+ Ca2+ K+ A.S 2 A.S 2 A.S 2 A.S 2 A.S A.S A.S A.S 99,45 99,87 99,84 99,60 99,58 100,00 97,23 92,95 100,00 99,41 99,90 100,00 99,56 98,03 94,91 85,15 99,03 99,85 99,58 100,00 100,00 98,86 99,71 89,73 En las pruebas se observó un cambio en la turbidez de las aguas tratadas, siendo más evidente para las aguas sintéticas de alta concentración, en la figura 6.14 se puede apreciar el cambio de tonalidad entre el agua sintética de alta concentración antes y luego de ser tratada en el equipo de electrodiálisis. La turbidez del Agua sintética de alta concentración se debe a la presencia de precipitados de calcio y magnesio (CaCO3 y MgCO3), que a las concentraciones alcanzadas a pH básico – neutro a la que se encontraba la solución llegaba a formar algún precipitado; pero luego de ser tratado en el electrodializador, los precipitados se van disolviendo progresivamente en la solución a medida que la concentración de este ion va disminuyendo, hasta desaparecer. Figura 6.14 Diferencia apreciable entre la turbidez de un agua sintética de alta concentración de sales antes de ser tratada y luego de ser tratada (izquierda y derecha respectivamente). Con respecto a las pruebas realizadas a las aguas de producción de La Victoria estado Apure se logró la reducción de la concentración de cloruro en la prueba realizada a 200 l/h. Previamente se realizó una filtración para eliminar todo tipo de sólidos en suspensión y otras 98 Capitulo VI Resultados y Discusiones partículas, como fué ya explicado en la metodología. Luego de ello se procedió a tratar esta agua en el equipo de electrodiálisis de la misma manera que las aguas sintéticas estudiadas. 4000 3500 [Cl] ppm 3000 Concentrado 2500 Agua de Producción (La Victoria) 2000 1500 1000 500 0 0,00 5,00 10,00 15,00 t (min) 20,00 25,00 30,00 Figura 6.15 Concentración de cloruros en la corriente de agua de producción y la corriente Concentrado para la prueba realizada a 200 l/h. En la figura 6.15 podemos apreciar como efectivamente se logra la reducción de cloruros en el agua de producción tratada, y como se concentran en la corriente Concentrado, el comportamiento que observamos en la figura es muy similar a observado con las Aguas Sintéticas a las mismas condiciones (200 l/h y 30 V). Este hecho nos indica que los estudios realizados con las aguas sintéticas son confiables y de igual manera encontramos que efectivamente si hubo una transferencia de los cloruros desde el agua de producción a la corriente concentrado: Se encontró que con este proceso se lograron concentraciones por debajo de los 26 ppm de cloruros, muy por debajo de lo exigido en el decreto 883 (1000 ppm) (25) lo que lleva a considerar este proceso como un tratamiento efectivo para este tipo de efluentes, donde se obtuvo un porcentaje de reducción del 99,31 %, al igual que las otras pruebas realizadas se encontró un tiempo óptimo en donde la transferencia se hace mínima (alrededor de los 20 min), ello por lo explicado anteriormente. En la corriente de concentrado se logran concentraciones hasta más de 3700 ppm de cloruros. Al igual que las otras pruebas se observa como es el potasio el catión con mayor velocidad en la transferencia de una corriente a otra como podemos ver en la figura 6.16, en la misma figura observamos como el K+ es seguido por el Na+, Mg2+ y luego el Ca2+ en cuanto a las velocidades de transferencia. La explicación a este orden de velocidades podría ser que el sodio (peso atómico 23) tiene una densidad de carga mayor que el potasio (peso atómico 39,1) 99 Capitulo VI Resultados y Discusiones lo que implica una mayor densidad de carga para el primero y por ende una esfera de hidratación mayor lo que le disminuye su movilidad. Para el sodio la movilidad es de 5,19*10-8 m2/s.V y la del potasio de 7,62*10-8 m2/s.V en solución acuosa a 298,15 K (28) y se espera que en la membrana, la movilidad del sodio sea más reducida que la del potasio, por las restricciones de espacio. En cuanto al calcio y al magnesio, ambos tienen densidades de carga mayores que el sodio y potasio, por lo que se espera que su velocidad sea menos en fase acuosa libre. Pero en este caso, hay bicarbonatos en el medio y carbonatos, por lo que es posible que se formen carbonatos de calcio y magnesio, pero el Kps del carbonato de calcio (Kps= 4,8*10-9) es mucho menor que el del carbonato de magnesio (Kps = 1*10-5), lo que sugiere que el calcio, aún en menores concentraciones tiene más posibilidades de precipitar y esto hace que su transferencia sea menor. Esto y la permeabilidad de la membrana son una posible explicación al orden de transferencia de los cationes medidos en este trabajo. 120,00 % Reducción 100,00 80,00 POTASIO CALCIO 60,00 MAGNESIO SODIO 40,00 20,00 0,00 0,00 5,00 10,00 15,00 t (min) 20,00 25,00 30,00 Figura 6.16 Porcentaje de reducción de la concentración de cationes vs tiempo para la prueba con Agua de Producción de La Victoria. 100 Capitulo VI Resultados y Discusiones 6.3 Consumo de energía. Para hacer una estimación aproximada del consumo de energía del proceso de desalación de las soluciones tratadas por electrodiálisis, se tomaron en cuenta los requerimientos de energía eléctrica necesarios para la separación y el bombeo de los fluidos. El cálculo del consumo de energía se realizo con base en el tiempo y la energía consumida en las corridas realizadas con un caudal de 100, 200 y 300 l/h. En las corridas señaladas anteriormente se invertían aproximadamente 30min en promedio para la desalación de dos litros de solución, y cerca de 15min para el lavado del equipo, con esto podemos calcular el consumo de energía eléctrica para la electrodiálisis. Para ello se graficó para cada corrida la variación del amperaje versus el tiempo y se determinó el área bajo la curva obtenida. Al multiplicar este valor por la diferencia de potencial usada durante la operación, que fue de 30V, se obtiene el consumo de energía en W·min. Como se ve en la figura 6.17. En las gráficas podemos observar como el amperaje va disminuyendo a medida que se va logrando la desalación de las aguas tratadas, esta disminución de iones hace que la resistencia de la celda vaya en aumento, como el voltaje se mantiene constante y la resistencia va aumentando a través del proceso, la intensidad de la corriente debe disminuir para cumplir la ley Ohm, es por ello que se observa este comportamiento en todos los casos. Se puede observar que los valores de intensidad para las aguas de alta concentración de sales son mayores que para el otro caso, ello es gracias a que hay mayor cantidad de iones en solución lo que genera menor resistencia y ello proporciona un mayor paso de corriente a través de la celda, obteniendo así mayores valores de amperaje. 101 Capitulo VI Resultados y Discusiones 6 4 3,5 5 3 4 100 l/h 2 Am p Amp 2,5 100 l/h 1,5 2 1 1 0,5 0 0,00 3 10,00 20,00 30,00 40,00 0 0,00 50,00 t (min) 5,00 10,00 15,00 20,00 25,00 30,00 35,00 t (min) 3,5 7 3 6 2,5 5 200 l/h Amp amp 200 l/h 2 1,5 3 1 2 0,5 1 0 0,00 10,00 20,00 t (min) 30,00 0 0,00 40,00 10,00 15,00 20,00 25,00 30,00 35,00 7 4 6 3,5 300 l/h 300 l/h 3 5 Am p 2,5 2 1,5 4 3 1 2 0,5 1 0 0,00 5,00 t (min) 4,5 Am p 4 5,00 10,00 15,00 t (min) 20,00 25,00 30,00 0 0,00 5,00 10,00 15,00 t (min) 20,00 25,00 30,00 Figura 6.17 Variación del amperaje a través del tiempo para diferentes velocidades de flujo, lado izquierdo agua sintética de baja concentración de sales, lado derecho aguas sintética de alta concentración de sales. 102 Capitulo VI Resultados y Discusiones Luego de escoger las curvas que se ajustaran mejor al comportamiento de cada una de las gráficas, se calculó el área bajo la curva de las gráficas de la figura 6.17 (amperaje Vs tiempo) y multiplicando esta área por el voltaje que es fijo en 30 V se obtienen los consumos eléctricos de la electrodiálisis en W.min. Para el costo de la energía eléctrica utilizada para el funcionamiento de las tres bombas con una potencia de 80W, que funcionan por 30 min aprox. y 15 min para el lavado del equipo se calcula de la siguiente manera: consumo = 80W ⋅ 45 min⋅1h / 60 min = 30W ⋅ h / litro 2litros agua _ tratada Ec 6.2 Sumando este valor al obtenido por el consumo energético de la electrodiálisis obtenemos el consumo energético total por litro. Tabla 6.3 Valores de Consumo energético calculado para las distintas corridas. Corrida Concentración de sales 2.1 y 2.2 Flujo (l/h) Área bajo la curva Consumo total área ·V 60 min/ h W.h/l con Bombas (W.h/l) 200 66,97 33,48 8,37 38,37 300 24,41 12,21 3,05 33,05 4.1 y 4.2 100 88,8 44,4 22,2 52,2 5.1 y 5.2 200 68,43 34,22 17,11 47,11 300 58,13 29,07 14,53 44,53 100 90,6 45,3 22,65 52,65 3.1 y 3.2 6.1 y 6.2 7.1 y 7.2 Baja Alta 103 Capitulo VI Resultados y Discusiones 60,00 100 l/h AS 50,00 200 l/h AS 300 l/h AS W·h/l 40,00 100 l/h AS 2 30,00 200 l/h AS 2 300 l/h AS 2 20,00 Agua de Producción 200 l/h 10,00 0,00 1 Pruebas Figura 6.18 Consumo energético de cada una de las pruebas en W·h/l. En la figura 6.18 podemos ver una comparación entre los consumos totales obtenidos en las distintas pruebas, el valor de los consumos de las pruebas a 100 l/h son mayores a las otras, ello pudo deberse a la duración que tuvo estas pruebas, en el resto de las pruebas se observa un consumo muy similar en cada una de ellas, se observa que para aguas sintéticas de baja concentración hay una pequeña diferencia, mostrándose un consumo algo menor, en este caso de las aguas sintéticas de alta concentración observamos que la prueba a 200 y 300 l/h genera un consumo algo mayor, debido a que a mayores presencia de iones la transferencia de corriente es mayor, ya que tenemos menos resistencia, pero la diferencia no grandes, sólo que el consumo gira alrededor de los 30 a 40 W·h/l para todos los casos a 200 y 300 l/h, incluyendo para las aguas de producción que muestran el mismo comportamiento. Podemos observar que el proceso no requiere un consumo muy grande de energía por litro de agua tratado, la mayor cantidad de energía es la requerida por las bombas y el costo de esta operación disminuirá al manejar mayores cantidades como sucede a escala industrial. 104 Conclusiones CONCLUSIONES. El trabajo realizado permite obtener las conclusiones siguientes: La desalación por electrodiálisis es una posibilidad entre los métodos de separación por membranas para el tratamiento de aguas de producción con alto contenido de cloruros, ya que con dicho proceso pueden llegarse a concentraciones de cloruros muy por debajo de los 1000 mg/l que exige la ley (Decreto 883). La Electrodiálisis demostró ser un proceso que se adecua perfectamente para aguas de producción de baja y alta concentración, cambios en la concentración de iones de las aguas a tratar no generan grandes cambios en el proceso, y los resultados obtenidos son muy similares. La velocidad del flujo de las aguas tratadas en el equipo afectan al proceso, se observó que a mayores flujos la velocidad de desalación es mayor, tanto en aguas de baja como aguas de alta concentración de sales. El transporte de los cationes en las aguas sintéticas y en el agua de producción sigue el orden de K+ > Na+ > Mg2+ > Ca2+ (del mas rápido al mas lento), ello es debido probablemente a mayor afinidad de la membrana a cationes monovalentes y en otros casos el transporte es más fácil para iones de menor peso molecular. En la mayoría de los casos el porcentaje de reducción tanto para los cationes como para el cloruro es superior al 99 %, consiguiéndose concentraciones en las aguas tratadas de hasta 14 ppm de cloruros en uno de los casos de las aguas sintéticas, y para aguas de producción una concentración de 20 ppm. Se realizaron experimentos de desalación para soluciones de NaCl de 2500 ppm, los resultados indican la factibilidad técnica de usar este método para disminuir la concentración de iones en aguas sintéticas parecidas a las aguas de producción. 105 Conclusiones El proceso de electrodiálisis es más eficiente a mayor caída de potencial, ya que se logra la separación de iones en menos tiempo. El consumo de energía para una operación de desalación de un agua sintética es alrededor de los 36 W·h/l en promedio. Y para las aguas de producción tratadas el consumo es alrededor de los 34 W·h/l. La mayor cantidad del consumo de energía es por el uso de las bombas, y seguramente los gastos disminuirán al llevar el proceso a escala industrial donde se manejan mayores cantidades de agua a tratar. Los resultados de las pruebas realizadas indica que no hay un efecto importante de la concentración inicial de la solución tratada sobre el proceso. 106 Recomendaciones. RECOMENDACIONES. Se recomienda hacer el estudio mas detallado a diferentes concentraciones de iones y a una misma velocidad de flujo, para observar como varía la velocidad de flujo a varias concentraciones. Es recomendable realizar ahora mas pruebas con aguas de producción reales, y evaluar aguas de diferentes orígenes para evaluar así la flexibilidad del proceso. En el cálculo de la velocidad de transferencia de Na+ hay una desviación en una de las pruebas que pueden deberse a errores en la medición de este ion, es recomendable realizar más pruebas. Estudiar alternativas de disposición del concentrado. Se recomienda la limpieza del equipo luego de cada corrida, y el pretratamiento de las aguas ya que si contienen sólidos precipitados y suspendidos, lodos u otros contaminantes, podrían afectar el funcionamiento de las membranas. 107 Bibliografía. Bibliografía. [1] NAUTA MAIOR, Diccionario Enciclopédico, Ediciones Nauta, Barcelona 1995. [2] CARDENAS, A. Membranas Generalidades. Cuaderno FIRP #340, Universidad de los Andes, Facultad de Ingeniería, Escuela de Ingeniería Química. Mérida, 2002. [3] GORROCHOTEGUI, E. Ácido ,Láctico del Lactosuero Mediante un Piloto de Electrodiálisis. Tesis de Pregrado. Universidad de los Andes, Mérida, Venezuela. 2004. [4] SCOTT, K. Handbook of Industrial Membranes (2da Edición). Elsevier Advanced Technology. Oxford, 1998. [5] ELVERS, B; HAWKINS, S. Ullmann’s Encyclopedia of Industrial Chemistry (5ta Edición), Vol A-16. Wiley – VCH Verlag GmbH & Co KGaA. Weinheim, Alemania, 1990. [6] MEARES J.P. Membranes Separation Processes. Elsevier Scientific, Amsterdan, 1976. [7] OCHOA, J. Electrosíntesis y Electrodiálisis (Fundamentos, aplicaciones tecnológicas y tendencias), McGraw-Hill. Madrid, 1996. [8] BULLON, J. Membranas Usos Industriales, Universidad de los Andes, Facultad de Ingeniería, Escuela de Ingeniería Química. Mérida, 1996. [9] CONTRERAS, C. Estudio del Efecto de la Hidrodinámica sobre la Transferencia de masa en la Separación del Ácido Láctico por Electrodiálisis. Tesis de Pregrado. Universidad de los Andes. Mérida, 2001. [10] ANDRES, L; RODRIGUEZ, A; ALVAREZ, R. COCA, J. Electrodiálisis Principios y Aplicaciones. Ingeniería Química. Nº 226. Pag 235 – 243, 1991. [11] MACHADO, A. Desalinización del Suero Lácteo por Electrodiálisis utilizando un Equipo Piloto de Asahi Glass, Co. Tesis de Pregrado. Universidad de los Andes. Mérida, 2002. [12] MCRAE, W. Electrodiálisis in Separations of Chemicals. In: Europe-Japan Congress on Membrane and Membrane Processes. Eds Drioli E. y Nakagaki M. Plenum Press. New York, 1986. [13] SUSIAL, P; GONZÁLEZ, J; CABRERA, I; FERNÁNDEZ, F. Dimensionamiento y Diseño de la Electrodiálisis (I) Membranas y Módulos. Ingeniería Química. Nº 375. Pág. 291 – 298. 2001. 108 Bibliografía. [14] ANDREZ, L; PEREZ, A; ALVAREZ, R. COCA, J. Polarización de Concentración en los Procesos con Membranas: Aplicación a la Electrodiálisis, Ingeniería Química. Nº 274. Pág. 241- 245. 1992. [15] IGUAL, A; GARCÍA, J; GUIÑÓN, J; PÉREZ, V. Planta piloto de Electrodiálisis: Aplicación a la Desalación de un Agua Salobre Ingeniería Química. Nº 361. Pág. 390394. 1999. [16] OCHOA, J.R. Técnicas Electroquímicas para el Tratamiento de Efluentes industriales. Ingeniería Química. Nº 312. Pág. 125-131. 1995. [17] ROA, J. Fundamentos Básicos de los procesos Ambientales para Ingenieros (2da Edición). FEUNET. San Cristóbal, 2005. [18] KIELY, G. Ingeniería Ambiental: Fundamentos, Entornos, Tecnologías y Sistemas de Gestión. Volúmenes I y II. McGraw Hill. Madrid, 1999. [19] MONTOYA R., Contaminación de Aguas, Universidad de Los Andes. Facultad de Ingeniería, Escuela de Ingeniería Química. Mérida, 2000. [20] Contaminación del Agua http:// www.tecnun.es / Asignaturas / Ecologia/ Hipertexto/ 11CAgu/ 100CoAcu.htm, 30/08/2006 [21] GUTIERREZ, J. La Habana, Presencia de Aguas de producción en ríos de sur de Cuba . http://bases.bireme.br/cgi-bin/wxislind.exe. 24/07/2006 [22] OSCAR, M. Gran Producción de Agua asociada se registra en pozos venezolanos. www.eluniversal.com, 2004. 24/27/2006. [23] PDVSA.COM, Inaugurado Primer Foro Nacional de Aguas de Producción Petrolera , 2005. 25/07/2006 http://www.Pdvsa.com [24] SALAZAR, M. Petrolera podría , 20/08/2006. ser demandada por contaminación, http://www.ipsnoticias.net/nota.asp [25] Decreto Nº 883, Gaceta Oficial Nº 5.021 del 18/12/1995. [26] Standard Methods for Examination of Water and Wastewater 20th edition. [27] SIRIVEDHIM, T; Mc CUE, J; DALLBAUMAN, L; Reclaiming produced water for beneficial use: salt removal by electrodialysis. Journal of Membrane Science, Nº 243, Pág 335 – 343. 2004. [28] Moore, W, Química Física, Ed URMO SA, Bilbao, 1977. 109 Anexos Anexos Anexo A.1 Resultados de la desalación de una solución de NaCl a 2500ppm con una corriente de 30 V fijo. Inicial Final 30 V t (min) 0 0,72 3,45 6,563 9,385 13,206 16,668 19,536 22,119 25,049 29,382 AMP 0 2,35 1,6 0,9 0,49 0,23 0,14 0,1 0,08 0,06 0,05 CONCENTRADO Conductividad (mS/cm) Temperatura (ºC) 20,7 1,9 2,97 21,1 4,59 21,3 5,59 21,5 6,27 21,9 6,47 22,1 6,59 22,3 6,63 22,4 6,69 22,4 6,79 22,7 23,2 6,84 DILUIDO Conductividad (mS/cm) Temperatura (ºC) 20,7 4,14 3,36 21,1 1,724 21,3 0,945 21,5 0,523 21,9 0,209 22,1 0,0831 22,2 0,051 22,2 0,0347 22,6 0,01673 22,8 22,8 0,00583 Anexo A.2 Resultados de la desalación de una solución de NaCl a 2500ppm con una corriente de 15 V fijo. Inicial Final 15 V t (min) 0 0,757 3,16 5,925 9,665 12,055 15,134 17,0685 20,361 23,314 25,93 29,441 32,817 AMP 0 1,66 1,32 0,91 0,57 0,36 0,23 0,15 0,11 0,08 0,06 0,04 0,03 CONCENTRADO Conductividad (mS) Temperatura (ºC) 21,8 2,19 2,98 21,9 4,26 22,6 4,76 22,8 5,46 23,1 5,75 23,1 5,89 23,3 6,03 23,8 6,09 23,7 6,21 23,9 6,19 24,4 6,41 24,6 24,8 6,45 DILUIDO Conductividad (mS) Temperatura (ºC) 22,1 4,23 3,41 22,3 2,23 22,6 1,478 22,8 0,851 23,1 0,535 23,3 0,322 23,3 0,211 23,5 0,142 23,7 0,0815 23,8 0,0715 24,6 0,0493 24,6 24,8 0,0252 111 Anexos Anexo A.3 Datos Experimentales de las corridas realizadas Primera tanda: caída de potencial de 30 V Concentración del agua Sintética sencilla. Corrida 2.1 Flujo 200 l/h t (min) 0 0,81 3,13 5,39 7,74 10,29 13,37 16,38 20,38 23,89 27,86 31,37 AMP 0 3,19 2,8 2,05 1,32 0,73 0,41 0,23 0,12 0,08 0,06 0,05 Corrida 2.2 Flujo 200 l/h t (min) 0,00 0,93 3,99 7,12 10,30 11,48 14,27 17,83 18,69 22,00 24,92 26,38 30,17 33,83 AMP 0 2,95 2,1 1,3 0,75 0,59 0,33 0,2 0,17 0,11 0,09 0,08 0,07 0,06 Agua Sintética Concentrado Temperatura Conductividad (mS) Conductividad (ºC) Temperatura (ºC) (mS) 21,1 9,67 21,1 0,69 22,8 5,57 22,8 3,17 23,2 3,54 23,2 4,98 23,6 2,28 23,6 6,24 23,6 1,335 23,6 6,81 24 0,567 23,8 7,32 23,9 0,348 24,3 7,73 24,6 0,1783 24,3 7,82 24,6 0,0727 24,5 7,97 24,9 0,066 24,7 8,04 25 0,0592 24,9 8,06 24,8 0,0303 25,1 8,07 Agua Sintética Temperatura Conductividad (ºC) (mS) 21,1 9,32 22,8 5,11 23,8 2,75 24,4 1,566 24 0,894 24,3 0,606 24,4 0,347 24,5 0,217 24,7 0,127 25,1 0,0764 25,3 0,0597 25,2 0,0263 25,2 0,0261 26 0,01739 Concentrado Temperatura Conductividad (ºC) (mS) 21,1 0,624 23,2 3,57 23,8 5,25 24,4 6,54 28,2 7,07 24,6 7,23 24,3 7,26 24,5 7,32 25,1 7,44 25,1 7,52 26,6 7,54 25,2 7,83 25,4 7,85 26,8 7,88 112 Muestra * * * * * Muestra * * * * * Anexos Corrida 3.1 Flujo 300 l/h t (min) 0 1,51 3,62 5,68 8,12 11,03 12,93 13,93 17,95 21,08 24,91 AMP 0 3,8 2,82 1,56 0,72 0,28 0,19 0,14 0,1 0,09 0,08 Corrida 3.2 Flujo 300 l/h t (min) 0 0,66 2,79 5,70 9,46 12,45 16,13 19,75 23,10 26,19 AMP 0 3,87 3,47 1,98 0,47 0,19 0,09 0,08 0,07 0,06 Agua Sintética Temperatura Conductividad (ºC) (mS) 21,1 7,04 22,4 4,11 22,9 2,1 23,5 1,083 23,6 0,5 23,7 0,201 24,1 0,1161 22,8 0,0801 23,9 0,0348 24,8 0,0242 25 0,01604 Concentrado Temperatura Conductividad (ºC) (mS) 21,3 1,613 22,9 4,77 23,2 6,56 23,6 7,55 23,8 7,85 23,8 8,02 24,3 8,04 23,8 8,07 24,3 8,25 24,8 8,31 25 8,31 Agua Sintética Concentrado Temperatura Conductividad Temperatura Conductividad (ºC) (mS) (ºC) (mS) 23,7 7,04 23,5 1,519 23,4 6,02 23,9 2,18 24,9 3,89 24,8 4,86 25,7 1,406 25,6 7,23 25,7 0,29 25,5 7,73 25,9 0,0997 25,9 8,05 25,9 0,0318 26,1 8,08 26,1 0,0201 26,3 8,14 26,2 0,01891 26,4 8,14 27,3 0,01595 26,6 8,14 113 Muestra * * * * * Muestra * * * * * Anexos Corrida 4.1 Flujo 100 l/h t (min) 0 0,48 3,35 5,88 9,48 12,73 16,00 20,23 24,59 27,98 30,94 34,25 38,41 AMP 0 3,44 2,67 1,86 1,04 0,61 0,37 0,2 0,14 0,1 0,08 0,08 0,08 Corrida 4.2 Flujo 100 l/h t (min) 0 1,01 4,00 7,35 10,82 14,37 16,76 19,93 23,14 27,03 30,62 34,12 AMP 0 3,36 2,64 1,6 0,86 0,47 0,33 0,2 0,13 0,09 0,07 0,07 Agua Sintética Temperatura Conductividad (ºC) (mS) 21,1 7 21,6 5,41 22,2 3,5 22,7 2,32 22,8 1,218 23,1 0,702 23,4 0,412 24 0,18 23,8 0,0923 24,3 0,0428 24,5 0,0381 24,9 0,028 24,8 0,0213 Concentrado Temperatura Conductividad (ºC) (mS) 21,1 1,557 21,8 3,84 22,3 5,83 22,8 6,66 23,1 7,62 23,1 8,05 23,9 8,27 23,8 8,43 24,2 8,43 24,3 8,56 24,4 8,64 24,7 8,65 25,2 8,66 Agua Sintética Temperatura Conductividad (ºC) (mS) 20,6 7,43 21,7 4,55 23,1 3,05 24,1 1,59 24,1 0,804 24,5 0,604 24,8 0,407 24,8 0,1374 25,3 0,0703 25,4 0,0309 26 0,02 25,2 0,015 Concentrado Temperatura Conductividad (ºC) (mS) 20,5 0,867 22,6 4,2 23,2 5,92 24,2 6,96 24,1 7,37 24,3 7,62 24,4 7,93 24,6 8,06 25 8,23 25 8,23 25,3 8,25 25,3 8,25 114 Muestra * * * * * Muestra * * * * * Anexos Segunda tanda: caída de potencial de 30 V Concentración del agua Sintética al doble Corrida 5.1 t (min) 0 0,57 5,44 8,52 11,24 14,03 16,55 19,51 22,94 25,49 Corrida 5.2 t (min) 0 1,11 3,82 6,45 9,05 11,87 14,94 17,22 20,01 23,26 25,34 28,84 Flujo 200 l/h AMP 0 6,38 5,55 2,5 1,2 0,35 0,16 0,11 0,1 0,09 Agua Sintética Temperatura Conductividad (ºC) (mS) 22,1 13,23 22,2 12,12 22,4 6,81 24,2 2,08 24,4 0,705 24,6 0,235 25 0,089 24,8 0,043 25,3 0.0298 25,3 0,0242 Concentrado Temperatura Conductividad (ºC) (mS) 21,3 0,868 23 2,24 23,7 7,2 24 10,1 24,4 11,74 24,7 12,1 24,6 12,19 25,6 12,21 25,1 12,24 25,4 12,24 Agua Sintética Temperatura Conductividad (ºC) (mS) 20,4 14,35 21,5 11,61 22,4 7,77 23,3 4,16 23,7 1,82 23,8 0,864 23,8 0,293 24,3 0,1405 24 0,0909 24,5 0,0492 24,6 0,0343 25,2 0,0308 Concentrado Temperatura Conductividad (ºC) (mS) 20,8 0,943 20,6 2,67 22,2 7,3 23,1 10,52 23,6 12,2 24 13,13 24 13,4 24 13,75 24,4 13,75 24,6 13,77 24,8 13,76 25 13,8 Muestra * * * * * Flujo 200 l/h AMP 0 6,38 6,55 4,4 2,4 1,11 0,55 0,27 0,15 0,12 0,11 0,11 115 Muestra * * * * * Anexos Corrida 6.1 t (min) 0 0,84 4,90 7,44 10,70 13,63 16,47 19,00 21,99 24,51 28,23 Corrida 6.2 t (min) 0 0,99 4,39 7,39 9,79 12,48 15,35 17,71 20,42 23,73 25,91 28,39 Flujo 300 l/h AMP 0 6,5 5,44 2,91 1,04 0,43 0,18 0,13 0,11 0,11 0,1 Agua Sintética Temperatura Conductividad (ºC) (mS) 22,1 14,35 23,2 12,41 24,5 5,93 25,2 2,56 25,3 0,763 26,1 0,233 25,8 0,0771 25,9 0,0573 26,1 0,0415 26,3 0,0399 26,4 0,0359 Concentrado Temperatura Conductividad (ºC) (mS) 22,6 0,943 22,6 2,23 24,4 10 25,3 12,79 25,5 14,43 25,8 14,58 25,8 14,76 26,1 14,76 25,7 14,83 26,1 14,76 26,6 14,75 Agua Sintética Temperatura Conductividad (ºC) (mS) 21,6 15,47 23,2 12,54 24,3 6,8 25,2 2,84 25,9 1,216 26,2 0,383 26 0,1337 25,9 0,0955 26,3 0,0583 26 0,0377 26,2 0,0233 26,8 0,0231 Concentrado Temperatura Conductividad (ºC) (mS) 21,9 0,982 23 3,46 24,2 9,6 25,1 12,7 25,7 14,06 25,8 14,39 25,9 14,67 26 14,67 26,1 14,76 26,1 14,8 26,2 14,81 26,3 14,8 Muestra * * * * * Flujo 300 l/h AMP 0 6,27 6 2,63 1,28 0,66 0,3 0,16 0,13 0,11 0,11 0,11 116 Muestra * * * * * Anexos Corrida 7.1 Flujo 100 l/h t (min) 0 2,02 4,75 7,10 9,74 12,58 14,97 17,51 19,83 22,24 24,63 27,53 29,77 32,05 AMP 0 5,24 4,79 3,7 2,53 1,85 1,17 0,72 0,49 0,31 0,21 0,16 0,12 0,11 Corrida 7.2 Flujo 100 l/h t (min) 0 1,52 4,06 6,97 9,58 12,09 14,89 18,36 22,24 24,77 27,32 30,28 32,25 AMP 0 5,31 5,21 4,44 2,56 1,48 0,8 0,38 0,2 0,15 0,12 0,11 0,1 Agua Sintética Temperatura Conductividad (ºC) (mS) 19,9 15,49 21,3 11,04 22,2 7,72 22,7 5,4 22,9 3,54 23,6 2,24 23,7 1,282 23,4 0,742 23,9 0,454 24,1 0,331 24,1 0,1792 24,6 0,1029 24,6 0,0898 24,8 0,0686 Concentrado Temperatura Conductividad (ºC) (mS) 19,8 0,963 20,9 5,04 22,1 8,48 22,7 10,65 22,9 12,32 23,2 13,45 23,4 13,77 23,2 14,53 23,6 14,56 23,9 14,88 24,2 14,78 24,7 14,86 24,3 14,94 24,9 14,93 Agua Sintética Temperatura Conductividad (ºC) (mS) 21,1 15,49 23,3 11,45 24,4 7,74 24,8 5 25,1 2,79 25,8 1,463 25,9 0,752 25,9 0,326 26,2 0,1298 26,6 0,1074 26,3 0,0593 26,4 0,0295 26,8 0,0275 Concentrado Temperatura Conductividad (ºC) (mS) 21,5 0,97 22,9 4,26 24,3 8,15 25,1 11,26 25,1 12,87 25,9 13,87 25,9 14,09 26 14,61 26,1 14,77 26,7 14,56 26,6 14,69 26,7 14,84 26,7 14,8 117 Muestra * * * * * Muestra * * * * * Anexos Tercera tanda: caída de potencial de 30 V Agua de Producción de La Victoria. Corrida 8.1 Flujo 200 l/h t (min) 0 2,32 4,28 5,92 7,77 9,71 11,57 13,53 16,04 18,42 20,86 22,74 24,89 AMP 0 5,83 3,94 2,23 1,15 0,6 0,37 0,23 0,15 0,11 0,09 0,08 0,08 Corrida 8.2 Flujo 200 l/h t (min) 0 2,72 4,83 6,26 8,02 10,18 11,72 13,70 15,35 17,05 19,18 21,07 23,15 AMP 0 5,38 3,72 2,69 1,61 0,91 0,6 0,38 0,28 0,2 0,16 0,12 0,11 Agua Sintética Temperatura Conductividad (ºC) (mS) 20,4 10,22 21,8 5,84 22,5 3,29 22,7 2,22 23 1,084 23,1 0,67 23,3 0,382 23,3 0,214 23,6 0,0992 23,6 0,0468 23,7 0,0307 24,2 0,0204 24,4 0,0156 Concentrado Temperatura Conductividad (ºC) (mS) 21 0,99 21 4,38 22,2 6,96 22,9 8,61 22,9 9,3 23,1 9,68 23,2 9,87 23,4 9,96 23,5 10,01 23,9 10,08 23,9 10,13 24 10,14 24,4 10,15 Agua Sintética Temperatura Conductividad (ºC) (mS) 21,4 9,6 23,3 5,51 24 4,03 23,9 2,55 24,3 1,47 24,7 0,925 24,7 0,595 24,1 0,368 24,9 0,23 25,2 0,1453 25,1 0,0962 25 0,0613 25,4 0,0595 Concentrado Temperatura Conductividad (ºC) (mS) 21,7 0,995 23,3 5,31 23,6 7,14 24,1 8,81 24,4 9,57 24,4 10,13 24,8 10,27 24,6 10,39 25 10,52 24 10,68 25 10,75 25 10,86 25 10,79 118 Muestra * * * * * Muestra * * * * * Anexos Anexo A.4 Comportamiento de las concentraciones de cloruros a diferentes velocidades de flujo. Corrida 2.1 y 2.2 ( 200 l/h a 30 V) concentración de Agua Sintética normal 2500 [Cl] ppm 2000 1500 Agua Sintètica Concentrado 1000 500 0 0,00 5,00 10,00 15,00 20,00 t (min) 25,00 30,00 35,00 40,00 Corrida 3.1 y 3.2 ( 300 l/h a 30 V) concentración de Agua Sintética normal 3000 2500 Agua Sintètica [Cl] ppm 2000 Concentrado 1500 1000 500 0 0,00 5,00 10,00 15,00 20,00 25,00 30,00 t (min) Corrida 4.1 y 4.2 ( 100 l/h a 30 V) concentración de Agua Sintética normal 2500 Concentrado Agua Sintética [Cl] ppm 2000 1500 1000 500 0 0,00 5,00 10,00 15,00 20,00 25,00 t (min) 30,00 35,00 40,00 45,00 119 Anexos Corrida 5.1 y 5.2 ( 200 l/h a 30 V) concentración de Agua Sintética al doble 4500 4000 [Cl] ppm 3500 Concentrado 3000 Agua Sintética 2500 2000 1500 1000 500 0 0,00 5,00 10,00 15,00 20,00 t (min) 25,00 30,00 35,00 Corrida 6.1 y 6.2 ( 300 l/h a 30 V) concentración de Agua Sintética al doble 4500 4000 [Cl] ppm 3500 Concentrado 3000 Agua Sintética 2500 2000 1500 1000 500 0 0,00 5,00 10,00 15,00 t (min) 20,00 25,00 30,00 Corrida 7.1 y 7.2 ( 100 l/h a 30 V) concentración de Agua Sintética al doble 4500 4000 3500 Concentración [Cl] ppm 3000 Agua Sintética 2500 2000 1500 1000 500 0 0,00 5,00 10,00 15,00 20,00 25,00 30,00 35,00 t (min) 120