reacciones quimicas 3
Anuncio

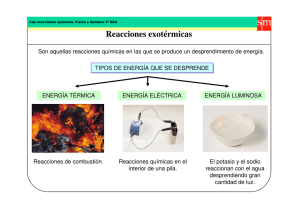
REACCIONES QUÍMICAS 4º E.S.O. 2.3. REACCIONES QUÍMICAS. 2.3.1. CALOR Y CAMBIO. Cuando se produce una reacción química, los enlaces que unen los átomos deben romperse y formarse otros nuevos. Las moléculas se rompen y se forman moléculas nuevas, diferentes de las que había anteriormente. Para poder romper los enlaces existentes, es necesario suministrar una energía, la energía de activación, que permite que la transformación química comience. Si los productos de la reacción tienen menos energía que los reactivos, ?E < 0, la propia reacción producirá energía y continuará por sí sola: es una reacción exotérmica. Pero para iniciarla seguirá siendo necesario suministrar la energía de activación. Así, para encender una cerilla, basta frotarla con el rascador. Una vez iniciada la combustión, ésta continuará, pero se necesita frotar para que la cerilla encienda. Si los productos tienen más energía que los reactivos, ?E > 0, la reacción no produce energía, sino que la consume y es necesario suministrar energía constantemente para que la reacción tenga lugar, en caso contrario, se detiene: es una reacción endotérmica. Por eso, al cocinar, se debe mantener los alimentos sobre el fuego, en el momento en que dejan de calentarse, la reacción se detiene y los alimentos quedan crudos. PROYECTO ANTONIO DE ULLOA 47 REACCIONES QUÍMICAS 4º E.S.O. 2.3.2. REACCIONES EXOTÉRMICAS. Al reaccionar el butano, C4H10, con oxígeno, O2, se produce agua, H2O, dióxido de carbono, CO2, y calor, tanto calor que se esa reacción se emplea para calentar agua o cocinar. Se ha producido la combustión del butano, llamada así por la aparición de llamas: 2·C4H10 + 13·O2 8·CO2 + 10·H2O Lo mismo ocurre cuando se quema madera, carbón o gasolina. Se trata de reacciones químicas en las que se desprende gran cantidad de calor. Otras reacciones no desprenden tanta cantidad de calor, pero sí liberan calor. Por ejemplo, al disolver sal en agua o cuando el hierro se oxida, se produce una reacción que también libera calor, aunque En una reacción exotérmica la variación de energía es negativa, los productos tienen menos energía que los reactivos: ∆E < 0 no aparece llama. Si en una reacción química se desprende calor, se dice que es exotérmica. La mayoría de las reacciones químicas son exotérmicas, aunque las más conocidas son aquellas que liberan, a su vez, llamas. No todas las reacciones exotérmicas van acompañadas de llamas, pero todas las reacciones que desprenden llamas son exotérmicas. 48 PROYECTO ANTONIO DE ULLOA REACCIONES QUÍMICAS 4º E.S.O. 2.3.3. REACCIONES ENDOTÉRMICAS Si algunas reacciones, al producirse, liberan calor, hay reacciones que, al contrario, consumen calor y enfrían el entorno en el que se producen. Así, cuando se disuelve cloruro de amonio, NH4Cl, se nota claramente como se enfría el vaso en el que se ha disuelto e, incluso, condensan pequeñas gotas de agua en él. Otro tanto ocurre en la reacción entre el nitrógeno y el oxígeno para formar óxido de nitrógeno(II), el ambiente en que se produce la reacción se enfría porque la reacción absorbe calor. N2 + O2 2·NO La obtención de metales, como aluminio o hierro, son procesos endotérmicos que requieren un aporte continuo de energía En los hornos de reducción, suministrando calor al oligisto se transforma en hierro Fe2O3 + 3·CO 2·Fe + 3·CO2 En los hornos electroquímicos, con electricidad, de la bauxita se obtiene aluminio 2·Al2O3 4·Al + 3·O2 Si en una reacción química se absorbe calor, se dice que es endotérmica. PROYECTO ANTONIO DE ULLOA 49 REACCIONES QUÍMICAS 4º E.S.O. En las reacciones endotérmicas, la energía de los reactivos es menor que la energía de los productos, DE es positiva. Por eso, para poder pasar de los primeros a los segundos se necesita un suministro continuo de energía. Cuando se deja de dar energía, la reacción se En una reacción endotérmica la variación de energía es positiva, los productos tienen más energía que los reactivos: ∆E > 0 detiene. 50 PROYECTO ANTONIO DE ULLOA