Reacciones Químicas
Anuncio

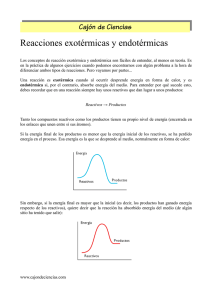
Reacciones Químicas Consisten en una transformación de las sustancias iniciales (REACTIVOS) para obtener unas determinadas sustancias finales (PRODUCTOS). Desde el punto de vista atómico se pueden interpretar las reacciones químicas como una ruptura en los enlaces entre los átomos, y un reordenamiento de los mismos para formar sustancias nuevas. Las R.Q. se representan de forma abreviada mediante una ecuación química: CH4 + O2 CO2 + H2O A veces se debe indicar con letras entre paréntesis el estado de las sustancias: • Sólido (S) • Liquido (L) • Gaseoso (G) En todas las Ecuaciones químicas se debe cumplir la ley de la conservación de la masa. Lo que significa que debe haber el mismo número de átomos en los reactivos como en los productos. Para esto se utilizan unos números delante de cada sustancia en la ecuación para así ajustarla y que se mantenga la proporción que deben mantener dichas sustancias al reaccionar. Ejemplo: CH4 + 2O2 CO2 + 2H2O Las reacciones químicas ajustadas nos suministran cierta información: • Cualitativas: Indica cuales son las sustancias reaccionantes • Cuantitativas: Nos indica la relación existente entre las cantidades de reactivos y productos Energía De Las Reacciones Químicas Debido a que la energía de los productos es distinta a la energía de los reactivos, en las R.Q. se producen ciertas transferencias de energía: • exotérmica: es cuando la energía de los reactivos es mayor que la de los productos, esto quiere decir que durante el transcurso de la R.Q. se produce un desprendimiento de energía, ya sea en forma de luz, calor, etc. Este desprendimiento de energía se produce de diversas formas: • Mediante un intercambio de calor (combustión de butano) • Mediante la producción de energía eléctrica • Mediante la producción de luz y sonido (dinamita) • Endotérmica: Se produce cuando la energía de los reactivos es menor a la de los productos, entonces se produce una absorción de energía (aportada) durante el proceso de la reacción química. 1 Este aporte de energía se realiza por: • Un suministro de calor • Un suministro de energía eléctrica • Aporte de luz (Fotosíntesis) En las R.Q. se produce siempre un desprendimiento o absorción de energía debido a los cambios de energía interna que experimentan las sustancias de una R.Q. A la energía desprendida o absorbida en una R.Q. debido a una diferencia de temperatura le llamamos Calor de reacción. En una R.Q. exotérmica el calor de reacción es negativo, mientras que en una R.Q. endotérmica es positivo Para calcular el calor absorbido o el calor desprendido se utilizan las ecuaciones termoquímicas, en las cuales se indica al final de la reacción el valor numérico del calor de reacción. Ejemplos: C + O2 CO2 + 393,5 KJ EXOTÉRMICA ("H = −393,5 KJ) N2 + O2 2NO − 180,7 KJ ENDOTÉRMICA ("H = 180,7 KJ) Reacciones de Combustión Son aquellas R.Q. en las que actua una sustancia llamada Combustible que reacciona con el Comburente produciendoce en la gran mayoria de los casos CO2 y H2O. En estas reacciones se produce siempre un gran desprendimiento de energicen forma de radiación termica y/o luminosa Tipos de R.Q. • Síntesis o combinación (A + B AB) Dos o mas sustancias reaccionan para dar lugar a una mas compleja • Descomposición (AB A + B) Una sustancia se descompone para dar lugar a dos o mas sustancias simples • Desplazamiento o sustitución (AB + C AC + B) al combinarse dos o mas sustancias estas se reagrupan formando sustancias nuevas Reactivo Limitante Las reacciones químicas nos indican la proporción en que las sustancias reaccionan, pero estas sustancias pueden encontrarse en cualquier proporción, por tanto la reacción dependera de una sustancia, la cual se encuentra en cierta proporción, y cuando esta sustancia se agote, finalizara la reacción. A dicha sustancia la llamamos Reactivo Limitante, y que normalmente es la que se encuentra en menor proporción. De esta forma la ecuación se encuentra en una correcta proporción gracias a los números en ROJO 2