DIAGRAMAS DE FASE
Anuncio

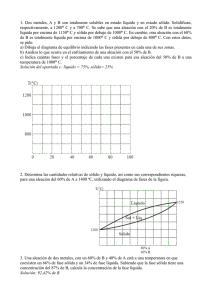
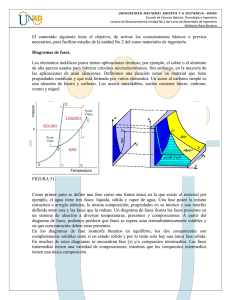
DIAGRAMAS DE FASE Diagramas de Equilibrio Definiciones básicas • ¿Qué es una fase? Una fase es una parte homogénea de un sistema, que aunque está en contacto con otras partes del sistema, está separado por un límite bien definido. Es una región del material con propiedades físicas y químicas homogéneas. Es una región que difiere en su microestructura y/o composición, de otra región. Definiciones básicas • Aleaciones DEFINICION: Una aleación metálica es una mezcla de un metal con otro(s) metal(es) o no metal(es). Los cerámicos también pueden mezclarse para formar aleaciones.( la mezcla puede resultar en solución, compuesto o simplemente mezcla) • Cobre (Cu) y Zinc (Zn), cuando se mezclan, forman la aleación latón. • El óxido de Mg (MgO) y la alúmina (Al2O3), cuando se mezclan en proporciones iguales forman un espinel. • Hierro (Fe) y Carbón ( C ) se mezclan para formar acero. Definiciones básicas • Componentes Las aleaciones se fabrican usualmente fundiendo juntos los componentes y mezclándolos. DEFINICION: Los componentes son los elementos químicos que conforman la aleación. En el latón los componentes son el Cu y el Zn, En el acero al Carbón, los componentes son Fe y C. En el espinel son Mg Al y O. DEFINICION:Una aleación binaria contiene dos componentes. Una ternaria, tres, una cuaternaria, 4, etc. • Concentración. Una aleación se describe especificando sus componentes y sus concentraciones. DEFINICIÓN: • El porcentaje en peso del componente en A se obtiene así: • % A = (peso del componente en A/∑del peso de todos los componentes)x100. • De aquí en adelante % A será la notación para % en peso • El porcentaje atómico (o en mol) del componente A se obtiene así: • %at A =( número de átomos o de moles del componente A/∑número de átomos o de moles de los componentes) x 100. • De aquí en adelante %atA será la notación para % atómico • Peso en g /peso átomico o molecular ( g/mol)= número de átomos o moles. • Número de átomos (o moles) x peso átomico o molecular (g/mol) = peso en g. Análisis térmico en sustancias puras temp vs tiempo Solución sólida • Una solución sólida es una combinación atómica homogénea en estado sólido entre dos o más elementos en un tipo de red espacial. Diagrama Isomorfo Solubilidad total en estado líquido y sólido Isomorfos soluciones sólidas totales Propiedades y diagrama Diagrama Dureza y resistemcia Conductividad Obtención mediante análisis térmico Estructura típica de solución sólida Isotermas ó lineas de union o de repart0 Composiciones durante la solidificación Regla de la palanca en la isoterma Deducción y uso • Se basa en que en todo momento la fracción líquida y la fracción sólida deben sumar 1 • Xlíquida + X sólida = 1, de donde • Xsol = 1 –Xliq • X liq = l – Xsol, • Fracción en peso: . en la isoterma: OL/ LS x 100 = % líquido OS/LS x 100 = % Sólido • Fracción en peso, de la figura: wo = Xl wl + Xs ws, como Xs = 1 –Xl wo = Xlwl + ws ( 1 – XL) wo = Xlwl +ws –ws Xl wo –ws = X l ( wl-ws) Xl = wo-ws/wl-ws igualmente Xs = wo-wl/wl-ws En la isoterma, en composiciones: = OS/ LS x 100 = % líquido OL/LS x 100 = % Sólido Respuestas Reglas de Hume-Rothery • Estructura del Cristal: Elementos con el mismo tipo de estructura reticular cristalina. • Tamaño atómico relativo: Es favorable para formar una solución sólida sustitucional, cuando la diferencia entre los radios atómicos es < 15%. • Afinidad Química: A mayor afinidad química entre los 2 metales, más restringida será su solubilidad y mayor la tendencia a formar compuestos. • Valencia relativa: El metal de menor valencia tiende a disolver más a un metal de mayor valencia (solubilidad parcial). Tamaños de radio atómico EJERCICIO SOLIDUS LIQUIDUS 800 750 700 TEM P ºC 650 600 550 500 450 400 350 300 0 10 20 30 40 50 %B 60 70 80 90 100 Algo de Termodinámica • Regla de las fases: V = C +2 –F • C= componentes on los elementos o compuestos químicos cuya presencia es necesari y suficiente para construr el sistema • F = Fase es una parte homogénea de un sistema, que aunque está en contacto con otras partes del sistema, está separado por un límite bien definid. • V= variables o grados de libetad de un sistema ( temperatura, presión, concentración )que pueden alterare si que esaperezca una dase ni se forme una nueva. Regla de la fases en metalurgia • Como en los procesos metalúrgicos se opera a presión constante, se reduce una unidad y queda: V = C +1 –F Apicando a un sistema isomorfo: 1 .En región líquida ( Monofasica) C = 2; F = 1 por lo que V = 2 +1-1 = 2 ( podemos variar temperatura y concentración Regla de las fases en isomorfo • 2.En línea líquidus: C = 2; F = 2; V = 2 +1 -2 = 1 Si variamos la temperatura, la concentración adquiere valores fijos y si viceversa • 3.- En región bifásica: C=2: F = 2; V = 2+1-2 = 1 Como en el caso anterior Diagramas Δ G vs Composición