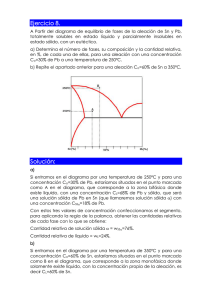
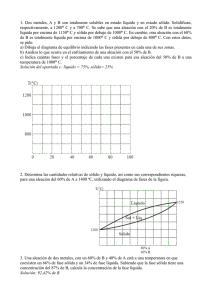
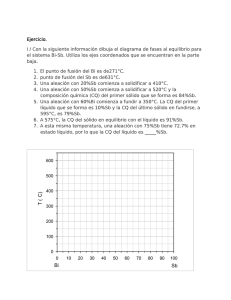
El contenido siguiente tiene el objetivo, de activar los
Anuncio

U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara El contenido siguiente tiene el objetivo, de activar los conocimientos básicos o previos necesarios, para facilitar estudio de la unidad No 2 del curso materiales de ingeniería. Diagramas de fases. Los elementos metálicos puros tienen aplicaciones técnicas, por ejemplo, el cobre o el aluminio de alta pureza usados para fabricar circuitos microelectrónicos. Sin embargo, en la mayoría de las aplicaciones de usan aleaciones. Definimos una aleación como un material que tiene propiedades metálicas y que está formado por varios elementos. Un acero al carbono simple es una aleación de hierro y carbono. Los aceros inoxidables, suelen contener hierro, carbono, cromo y níquel. FIGURA 51. Como primer paso se define una fase como una forma única en la que existe el material por ejemplo, el agua tiene tres fases: liquida, sólida y vapor de agua. Una fase posee la misma estructura o arreglo atómico, la misma composición, propiedades en su interior y una interfaz definida entre esta y las fases que la rodean. Un diagrama de fases ilustra las fases presentes en un sistema de aleación a diversas temperaturas, presiones y composiciones. A partir del diagrama de fases, podemos predecir que fases se espera sean termodinámicamente estables y en que concentración deben estar presentes. En los diagramas de fase isomorfa binarios en equilibrio, los dos componentes son completamente solubles entre sí en estado sólido y por lo tanto solo hay una única fase sólida. En muchos de estos diagramas se encuentran fase (s) y/o compuestos intermedios. Las fases intermedias tienen una variedad de composiciones, mientras que los compuestos intermedios tienen una única composición. U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara DIAGRAMA DE UNA SUSTANCIA PURA 2.5.2 DIAGRAMA DE UNA SUSTANCIA PURA Este es uno de los diagramas mas sencillo (generalmente es presión vs temperatura), tal como se muestra en la figura 51. En la mencionada figura se puede apreciar que el agua posee tres fases: Sólida, liquida y gaseosa o vapor. Se observa también un punto denominado punto triple en el cual pueden coexistir los estados sólido, líquido y gaseoso. Adicionalmente se encuentran dos líneas: la línea de vaporización y la línea de solidificación para las cuales los pares (presión, temperatura) corresponden a una transición de fase entre una fase sólida y una fase líquida; y entre una fase sólida y una fase vapor respectivamente. Figura 51 Diagrama de fase del agua [Adaptado de: Wikipedia, 2008] Ahora se aplicara la regla de fase de Gibbs al diagrama del agua en diferentes puntos como se muestra en la figura 51: • En el Punto triple: Fases presentes = 3, Numero de componentes =1, por lo tanto, P+F=C+2, luego 3+F=1+2 entonces F=0. El hecho que el grado de libertad o varianza sea F=0, quiere decir que Como ninguna de las variables (presión, temperatura o composición) se pueden cambiar manteniendo las tres fases de coexistencia, el punto triple es un punto invariante. U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara • En un Punto sobre la línea de solidificación: Fases presentes = 2, Numero de componentes =1, por lo tanto, P+F=C+2, luego 2+F=1+2 entonces F=0. El hecho que el grado de libertad o varianza sea F=1, quiere decir que Una variable (Temperatura o Presión) se puede cambiar manteniendo aún un sistema con dos fases que coexisten, es decir, si se especifica una presión determinada, sólo hay una temperatura en la que las fases sólida y líquida coexisten. • En un Punto dentro de una fase única (Zona liquido): Fases presentes = 1, Numero de componentes =1, por lo tanto, P+F=C+2, luego 1+F=1+2 entonces F=2. El hecho que el grado de libertad o varianza sea F=2, quiere decir que dos variables (Temperatura o Presión) se pueden cambiar independientemente y el sistema permanece con una única fase. ALEACIONES FERROSAS Y NO FERROSAS Se definen como metales, las sustancias que poseen propiedades como buena conductividad térmica y eléctrica, son dúctiles o deformables y son sólidos a temperatura normal excepto el mercurio que es líquido. Las aleaciones de ingeniería pueden dividirse en dos tipos: ferrosas y no ferrosas. Las aleaciones ferrosas tienen al hierro como su principal metal de aleación, mientras que las aleaciones no ferrosas tienen un metal distinto del hierro. Los aceros que son aleaciones ferrosas, son las más importantes. las propiedades mecánicas de los aceros al carbono pueden variar considerablemente por trabajo en frío y recocido. Cuando el contenido de carbono de los aceros se incrementa por encima de 0.3% , pueden ser tratados térmicamente por temple y revenido para conseguir resistencia con una razonable ductilidad. Los elementos de aleación tales como el níquel, cromo y molibdeno se añaden a los aceros al carbono para producir aceros de baja aleación. Los aceros de baja aleación presentan buena combinación de alta resistencia y tenacidad, y son de aplicación común en la industria de automóviles para usos como engranajes y ejes. Las aleaciones de aluminio son las más importantes entre las no ferrosas principalmente por su ligereza, endurecibilidad por deformación, resistencia a la corrosión y su precio relativamente bajo. El cobre no aleado se usa en abundancia por su conductividad eléctrica, resistencia a la corrosión, buen procesado y costo relativamente bajo, el cobre se alea con el cinc para formar unas serie de latones que tienen mayor resistencia que el cobre sin alear. U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara Los aceros inoxidables son las aleaciones ferrosas más importantes a causa de su alta resistencia a la corrosión en medios oxidantes, para ser un acero inoxidable debe contener al menos 12% de cromo. TRANSFORMACIONES DE LOS MATERIALES Y DIAGRAMAS DE FASES Existen muchas aplicaciones de los materiales en el campo de la ingeniería; por lo general los materiales no se usan puros como se menciono anteriormente, sino que se usan como aleaciones en la gran mayoría de los casos. Estas aleaciones también poseen diferentes estructuras y por ende propiedades a diferentes temperaturas y/o presiones, lo que hace adquirir importancia el conocimiento de los diagramas de fases. Se puede definir una fase como cada una de las porciones homogéneas físicamente separables en un sistema formado por uno o varios componentes. Por ejemplo, el agua tiene tres fases: liquida, sólida y gaseosa (vapor). Una fase posee ciertas características a saber: • Posee la misma estructura • Posee el mismo arreglo atómico • Posee la misma composición química generalmente • Posee las mismas propiedades Los diagramas de fase se definen como representaciones graficas de las fases presentes en un sistema de uno, dos o tres materiales bajo las variables de temperatura, composición y/o presión. Un componente de una mezcla es una sustancia químicamente independiente de la cual esta compuesta una la fase. 2.5.3 DIAGRAMAS BINARIOS Estos diagramas contrario a los de las sustancias puras, se realizan entre temperatura y composición, dejando la presión constante, es decir la regla de gibbs para estos será P+F=C+1. La característica de un sistema binario es que muestra las fases formadas para diferentes muestras de dos elementos o dos compuestos en un rango de temperaturas. A. Diagrama de solubilidad total Este diagrama recibe el también el nombre de sistemas isomorfos debido a que los componentes del diagrama son totalmente solubles a altas y bajas temperaturas. Para que un sistema sea completamente soluble debe cumplir ciertas condiciones: •Estructura Cristalina: La estructura cristalina debe ser la misma •Tamaño: Los atomos o iones que constituyen el sistema deben tener una diferencia de radios atómicos que no debe ser mayor del 15%, para minimizar la deformación de la red. U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara •Electronegatividad: No debe haber diferencias significativas en los valores de electronegatividad, debido a que si existen se formaran compuestos y no soluciones., por ejemplo Na +Cl = NaCl •Valencia: No debe existir diferencia significativa de valencias, debe ser la misma. Estos diagramas presentan únicamente la línea de líquidus, la cual se define como la temperatura arriba de la cual un material es totalmente líquido y la línea de sólidus, que se define como la temperatura por debajo de la cual esa aleación es totalmente sólida (figura 52). La diferencia de temperaturas entre la línea de liquido y la de solido es el intervalo de solidificación de la aleación, dentro de este intervalo de temperaturas se puede encontrar islas de solido en fase liquida. Ejemplo de aleaciones con este tipo de diagrama de solubilidad total son: Cu-Ni, NiOMgO,Tl-Pb entre otros. Figura 52. Diagrama isomorfo o de solubilidad total Para ubicar un punto (a) en este diagrama se requiere de un porcentaje de composición y una temperatura. Por ejemplo, la aleación entre Cu-Ni de la figura 53, muestra que la aleación que pasa por el punto (a) de la figura tiene una composición de 80% de Ni +20% Cu, para un total de 100% de la aleación. Para una aleación de 40%Cu y 60% Ni, según el diagrama de la figura 53, por encima de los 1280ºC la aleación es totalmente liquida, debido a que este es el límite o linea de liquidus. Por debajo de los 1240 ºC, la aleación es totalmente sólida y en el rango de 1280ºC – 1240ºC, se pueden encontrar las dos fases (solido y liquido), es decir en estos 40ºC de diferencia es donde la aleación empieza a solidificarse hasta llegar a la línea de solidus. U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara Figura 53.Diagrams Cu-Ni B. Regla de la palanca La regla de la palanca, es un método que permite conocer la composición química de las fases y las cantidades relativas de cada una de ellas. Para determinar la composición química de las fases primero se debe trazar una línea de enlace o isoterma, la cual es una línea horizontal en una región de dos fases como se muestra en la figura 54, esta línea une dos puntos de la línea de liquidus y solidus en este caso. Los extremos de esta línea representan las composiciones de las dos fases. A continuación prolongar los puntos hasta tocar la línea de composición en los puntos Ca y Cl. El punto Ca quiere decir que la aleación consideradaa la temperatura (T) contiene líquido de una composición química de % del elemento B y el restante del elemento A. El punto Cl quiere decir que la aleación considerada contiene sólido de una composición química de % del elemento B y el restante del elemento A. U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara Figura 54. Regla de la palanca Por ultimo para determinar las cantidades relativas de cada una de las fases presentes (liquida y sólida en este caso), se procede a usar la regla de la palanca. Esta se puede escribir de la siguiente forma: El porcentaje de fase = (Brazo opuesto de la palanca / Longitud local de la isoterma)* 100% Se puede utilizar la regla de la palanca en cualquier región bifásica de un diagrama de fases binario. En regiones de una fase no se usa el cálculo de la regla de la palanca puesto que la respuesta es obvia (existe un 100% de dicha fase presente). De esta manera la fracción o porcentaje de fase sólida será: % de fase solida = (Cl - Cm / Cl - Ca)* 100 Y la fracción o porcentaje de fase liquida será: % de fase liquida = (Cl - Ca / Cl - Cm)* 100 U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara Hay que tener cuidado al seleccionar el brazo de la palanca para el numerador de la formula, ya siempre es el lado opuesto a la fase que se calcula. Ejemplo: Una aleación de cobre – níquel contiene 47% en peso de Cu y 53% de Ni y está a 1.300 °C. (a)¿Cuál es el porcentaje en peso de cobre y níquel en las fases sólida y líquida a esta temperatura? (b)¿Qué porcentaje en peso de la aleación es líquida, y qué porcentaje es sólida? SOLUCION: a) Para desarrollar el ejercicio se debe usar el diagrama de la figura 55y trazar la línea correspondiente a la aleación47% en peso de Cu y 53% de Ni, y la correspondiente isoterma a 1.300 °C., es posible determinar el porcentaje en peso de cobre y níquel en las fases sólida y líquida a esta temperatura. % Cu en fase líquida: 55% Cu aprox. + 45 % Ni aprox. % Cu en fase sólida: 4O% Cu aprox. + 60 % Ni aprox. U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara Figura 55. Diagrama Cu-Ni para el ejemplo En el campo de la ingeniería, una de las aleaciones metálicas más importante es el acero. Esta es una aleación producto de la unión del hierro, quien junto con una pequeña proporción de carbono, proporcionan al acero diversas propiedades especiales tales como dureza, resistencia y ductilidad entre otras. El hierro es un metal alotrópico, quiere decir que posee diferentes estructuras reticulares dependiendo de la temperatura a la que sea sometido. Técnicamente se considera hierro puro a aquel material con menos de 0.008% de carbono, este es un metal blanco azulado, dúctil y maleable que permite ser forjado y moldeado. El diagrama hierro-carbono o como es comúnmente llamado hierro - Fe3C, debido a que esta parte del diagrama (entre 0 y 6.67%C), es la que reviste gran importancia tecnológica ya que en esta porción se pueden encontrar los diferentes aceros y fundiciones. El extremo que no se muestra en le diagrama rico en carbono no es estudiado debido a que un material rico en carbono es muy duro, pero extremadamente frágil. Ver el Diagrama Fe-Fe3C U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara En este diagrama las aleaciones que contienen hasta un 2% de carbono constituyen los aceros y las aleaciones que contienen mayor porcentaje de carbono se denominan fundiciones. El carbono puede presentarse en este diagrama en tres formas distintas a saber: • Como una solución sólida intersticial (explicado anteriormente) • Combinado con el hierro para formar un compuesto ínter metálico denominado cementita Fe3C • Como carbono libre o grafito En el diagrama hierro – Fe3C, se puede apreciar las diferentes transformaciones alotrópicas del hierro: Figura 55. Diagrama Cu-Ni para el ejemplo b) Para determinar que porcentaje en peso de la aleación es líquida, y que porcentaje es sólida se realiza la regla de la palanca usando los resultados anteriores. U N I V E R S I D A D N AC I O N AL AB I E R T A Y A D I S T AN C I A - U N AD Escuela de Ciencias Básicas, Tecnología-e Ingeniería Lectura de Reconocimiento Unidad No 2 del curso de Materiales de Ingeniería Walberto Roca Bechara % de fase liquida = (Cl - Ca / Cl - Cm)* 100 % de fase liquida = (60 -53) / 60 – 45) * 100 = 46,66% El porcentaje en peso de la aleación es líquida es del 46, 66% % de fase solida = (Cl - Cm / Cl - Ca)* 100 % de fase solida = (53 – 45 / 60 – 45)* 100 = 53, 33% El porcentaje en peso de la aleación que es solida es del 53, 33%