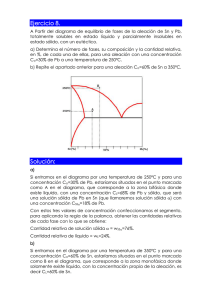
• Un diagrama de fases es una representación gráfica de las
Anuncio

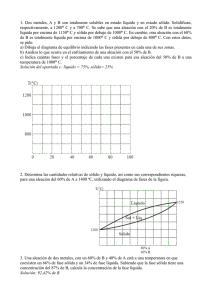
7.7 EL DIAGRAMA EQUILIBRIO DE FASES 7.7.1 CÓMO CONSTRUIR UN DIAGRAMA DE FASES • Un diagrama de fases es una representación gráfica de las variables del sistema. • Diagrama de fases binario: 2 componentes (r=2). • Diagrama de fases ternario: 3 componentes (r=3). • Composición: • va desde 100% del elemento A a la izquierda hasta 100% del elemento B a la derecha pasa por todas las composiciones intermedias • Notación: • • • A-x% B. (Ejemplo: Cu-20% Al) • ¿x% de qué? • • Porcentaje en peso: Cu-20 wt.% Al Porcentaje atómico: Cu-20 at.% Al • Los elementos puros solidifican a una temperatura específica. • Las aleaciones (mezclas de A y B) tienden a solidificar en un rango amplio de temperaturas. • Por lo tanto existe un punto de solidificación para cada composición de A y B. • Punto eutéctico: punto en el cual una composición dada de A y B solidifica como un elemento puro. • Algunos diagramas binarios simples NO poseen punto eutéctico. Punto de fusión de A Punto de fusión de B • Al enfriar una aleación desde el estado líquido, se puede registrar la temperatura a la cual comienza a solidificar ⇒ graficar. • Al hacer esto para todo el rango de composiciones se obtiene la curva de líquidus: curva de inicio de la solidificación Diagramas binarios simples: • No poseen eutéctico • Normalmente ocurren al mezclar (alear) dos elementos muy similares. • De la misma forma que el azúcar se disuelve en té caliente (solución líquida), es posible que un elemento (A o B) se disuelva en el otro mientras ambos se encuentran en estado sólido: solubilidad sólida. • La solubilidad sólida varía con la temperatura: • La solución sólida de B en A: α • La solución sólida de A en B: β • Algunos elementos no son solubles en otros. • • Ejemplo: aleaciones Al-Si (el aluminio no es soluble en el silicio. Si la composición de la aleación no está dentro de los rangos de solubilidad sólida ⇒ solidifica a la temperatura eutéctica. • Aquí se produce una mezcla sólida de las fases α y β. • Tanto α como β tendrán una composición específica de A y B. • RESUMEN: • Un diagrama de fases es un mapa de temperatura-composición. • Indica las fases de equilibrio presentes a una temperatura y composión dadas • Se obtiene experimentalmente. • Se utiliza para entender y predecir la microestructura de una aleación a una composición dada. 7.7.2 LA REGLA DE LA PALANCA • Al enfriar un líquido de composición dada, a cada temperatura, ¿cuál es la composición de las fases que se obtienen? • En cada temperatura de la aleación (composición conocida) se dibuja una isoterma que intersecte a las curvas de solubilidad adyacentes. • Los extremos indican las composiciones de las 2 fases que existen en equilibrio a dicha Tº. • Del diagrama se desprende que: • Composición fase α: 5,2% B • Composición fase líquida: 34,5% B • Recordar: composición global (α+L) no ha cambiado. • Así, al enfriar desde una composición Co y una temperatura Tx, se pueden contestar las siguientes preguntas: • • • ¿qué fases están presentes? ¿cuál es su composición? si se reduce Tx, ¿cómo variará la composición de las 2 fases? • ¿Fases presentes? • Isoterma a Tx se intersecta con β + líquido. • ¿Su composición? • Se dibuja línea horizontal hasta intersectar. • Composición de L: y wt% B • Composición de β: x wt% B • ¿Y si Tx se reduce? • Idem., se dibuja isoterma hasta intersectar fases a nueva temperatura. • Composición de L: y' wt% B • Composición de β: x' wt% B • NB: Tanto L como β se enriquecieron en A. • Otra pregunta, ¿cuánto hay de cada fase? • Respuesta la da la regla de la palanca. • Esta regla utiliza la conservación de la masa. • En esencia se tiene una composición Co (i.e., cantidad determinada de átomos de A y de B) que se distribuyen en las 2 fases de distinta composición: Co = fα Cα + f Líq C Líq y f Líq = 1 − f α Ordenando: C o + C Líq = fα (Cα − C Líq ) lo cual resulta finalmente: fα = • C o − C Líq Cα − C Líq Regla de la palanca Básicamente, las proporciones de las fases presentes están dadas por las longitudes relativas de la isoterma. • Proporciones de cada fase están dadas por: Y X +Y X = X +Y fα = f Líq • A medida que el líquido es enfriado y cruza la línea de liquidus, la proporción de Y1 es pequeña c/r a X1 • Línea derecha: α • Línea izquierda: líquido • Línea más alejada es la que corresponde a la fase. 34,5 − 23,7 = 0,367 = 36,7% 34,5 − 5,2 = 1 − fα = 1 − 36,7% = 63,3% fα = f Líq 7.7.3 MICROESTRUCTURA DE ALEACIONES 7.7.3.1 ALEACIÓN EUTÉCTICA • Al enfriar un líquido de composición dada, a cada temperatura, ¿cuál es la composición de las fases que se obtienen? • En cada temperatura de la aleación (composición conocida) se dibuja una isoterma que intersecte a las curvas de solubilidad adyacentes.