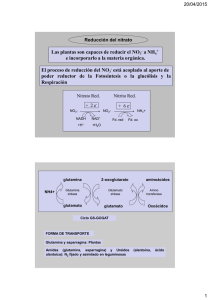
Revisión de Literatura Glutamina (Gln) y Glutamato (Glu)
Anuncio

Revisión de Literatura Glutamina (Gln) y Glutamato (Glu) Disponible e n nuestro site: www.lysine.com G. F. Yi e G. L. Allee ASRC 111, University of Missouri-Columbia, MO, EUA 65211 Efectos de la Glutamina (Gln) y Glutamato (Glu) La glutamina (Gln) tiene funciones metabólicas específicas y importantes, y es considerada un aminoácido condicionalmente esencial en algunas especies, cuando hay condiciones inflamatorias, como infecciones o heridas (Newsholme, 2001) o en el caso de cuadros de enfermedad con catabolismo (Smith y Wilmore, 1990). Es el aminoácido libre más abundante en la circulación y en los espacios intracelulares, además de ser precursor de la síntesis de aminoácidos, nucleótidos, ácidos nucleicos, azúcares aminados, proteínas y muchas otras moléculas biológicamente importantes (Smith, 1990). La división bioquímica del metabolismo de la glutamina refleja una compartimentación intracelular, pues la síntesis de purina, pirimidina y de azúcares aminados ocurre en el citoplasma, mientras el metabolismo del esqueleto de carbono de la glutamina se inicia por su desaminación por la glutaminasa dependiente de fosfato en la mitocondria (Curthoys y Watford, 1995). La glutamina es importante en la gluconeogenesis síntesis de urea, homeostasis del pH, neurotransmisión y diferenciación y crecimiento celular. La glutamina es el principal sustrato energético de células de proliferación rápida, como enterocitos intestinales y linfocitos activados (Cynober, 1999), aumenta la respuesta linfocítica a la estimulación de mitógenos (Taudou et al., 1983) y alivia la bacteremia y la endotoxemia (O’Dwyer et al., 1987). Los aminoácidos dietéticos son los principales combustibles de la mucosa del intestino delgado y son precursores esenciales de la síntesis intestinal de glutationa, óxido nítrico, poliaminas, nucleótidos purina , pirimidina y aminoácidos (alanina, citrulina y prolina). Esos aminoácidos también son obligatorios para el mantenimiento de la integridad de la mucosa intestinal y de la masa de la mucosa intestinal (Wu, 1998). Las células de la mucosa del tracto digestivo, así como otras células de proliferación rápida, tienen un requerimiento obligatorio de glutamina, que puede involucrar el rol de la glutamina como proveedora de la mitad del requerimiento de N para la síntesis de purina y pirimidina vía acción de la carbamoil-fosfato sintetasa II del citosol ( Lobley et al., 2001). Además, la glutamina es un precursor en potencial de la síntesis de N-acetil-glicosamina y Nacetil-galactosamina, que pueden tener un papel crítico en la síntesis intestinal de mucina y, por lo tanto, en el mantenimiento de la barrera pasiva a la invasión bacteriana (Khan et al., 1999). También puede actuar como señal o regulador de demandas metabólicas, aumentando la síntesis de proteína y disminuyendo la degradación de proteína en el músculo esquelético y estimulando la síntesis de glicógeno en el hígado (Hausinger et al., 1994; Smith, 1990). Se cree que el glutamato (Glu) y la glutamina tienen una vía metabólica común en el enterocito. Wu et al. (1995) reportan que, en el intestino delgado, la Gln es metabolizada principalmente vía hidrólisis de la Gln en Glu más amonio por la glutaminasa y la degradación subsiguiente del glutamato vía transaminación. El glutamato, especialmente el derivado de la dieta, puede fácilmente sustituir la glutamina en diversos de sus roles metabólicos, incluyendo la generación de energía y la síntesis de aminoácidos. Desde el punto de vista estrictamente metabólico, la glutamina y el glutamato son intercambiables como importante sustrato para el sistema celular de la mucosa (Reeds y Burrin, 2001). Sin embargo, se observó recientemente que las células de la mucosa intestinal de las criptas y de las vellosidades sintetizan simultáneamente glutamina, sugiriendo que esta puede no tener un papel estrictamente metabólico en el intestino (Reeds y Burrin, 2001). Esa observación y otras líneas de evidencia indican que la glutamina tiene un papel más regulador que metabólico al activar una serie de genes asociados con el ciclo de progresión de las células en la mucosa y que la inhibición de la síntesis de glutamina inhibe tanto la proliferación, como la diferenciación de culturas de células de la mucosa (Rhoad et al., 1997; Blikslager et al., 1999; Reeds y Burrin, 2001). Además, hay dos hechos que no pueden ser ignorados. En primero lugar, el metabolismo del glutamato en el lumen es mayor que el de la glutamina en la sangre arterial y, en segundo lugar, la presencia de altas concentraciones de glutamato en el lumen intestinal tiene poco efecto (~25%) sobre la utilización intestinal de glutamina. Eso indica que el glutamato dietético tiene roles funcionales importantes en el intestino que, aparentemente, son diferentes de los de la glutamina arterial (Reeds et al., 2000). El intestino delgado tiene un rol i m portante en el catabolismo de la glutamina arterial circulante y de los aminoácidos dietéticos, y la mayor parte de la glutamina (dos tercios) y casi todo el glutamato de la dieta son catabolizados por la mucosa del intestino delgado (Wu, 1998). En estado post-prandial, la absorción de glutamina por el intestino ocurre a partir del lumen, a través de la membrana borde de cepillo del enterocito. Cuanto mayor la concentración de glutamina en el lumen, más será esta transportada por el sistema transportador de N dependiente de sodio y liberada en la sangre del sistema porta (Souba et al., 1990). Todo el tracto gastrointestinal extrae alrededor del 20% de la glutamina circulante en estado post-absorción, y más del 90% de la extracción de glutamina por el intes tino delgado ocurre en las células de la mucosa (Souba et al., 1990). Reeds y Burrin (2001) informaron que el intestino remueve hasta el 25% del flujo sistémico de glutamina y que la glutamina tiene un rol importante en la sustentación de la función del sistema de la mucosa intestinal. Windmueller (1982) demostró que, en el intestino delgado de ratas, hay mucho catabolismo y utilización de glutamina, glutamato y aspartato del lumen y de la sangre arterial. En condiciones similares a una comida, la oxidación de glutamina arterial, de glutamina luminal más glutamato y aspartato y de glucosa luminal son responsables del 38%, del 39% y del 6% del CO2 producido por el intestino delgado de la rata, respectivamente. No obstante, el catabolismo intestinal de la glutamina y del glutamato puede ser altamente compartimentado. El suministro oral de dieta enriquecida con glutamina aumenta la extracción de glutamina por el intestino, estimula la actividad de glutaminasa y aumenta la actividad de transporte de la membrana borde de cepillo. La cantidad de glutamina que llega a la sangre portal depende de la concentración de glutamina en el lumen intestinal (Souba, 1990). Bajo condiciones de alimentación, el glutamato dietético es un sustrato oxidativo mucho más importante que la glucosa dietética o que la glutamina arterial (Reeds et al., 2000). El glutamato (y el aspartato) entérico es casi totalmente (95%) metabolizado en el primer pasaje por la mucosa intestinal de lechones de 24 días de edad, de los cuales el 50% fue metabolizado a CO2, mientras la oxidación de glucosa en el primer pasaje por la mucosa fue muy limitada (Reeds et al., 1996). La síntesis de los nucleótidos purina y pirimidina y de la glutationa representan vías fisiológicamente importantes para la utilización de glutamina y de glutamato, respectivamente (Wu, 1998). El glutamato dietético parece ser un precursor específico de la biosíntesis de glutationa, arginina y prolina en la mucosa del intestino delgado de lechones de 24 días de edad, mientras la glutamina arterial es un sustrato pobre para esos tres productos finales (Reeds et al., 2000). Reeds et al. (1997) reportaron que el glutamato entérico, y no el glutamato derivado de la glutamina, es la fuente preferencial de síntesis de glutationa de la mucosa de lechones de 2 semanas de edad. Adams y Frank (1980) sugirieron que, en mamíferos, la prolina es 1 sintetizada primariamente a partir del glutamato a través del semi-aldehído-γ-glutámico o del ∆ pyrrolina –5-carboxilato. Murphy et al. (1996) reportaron que la infusión intra-gástrica de glutamato es el principal precursor de la síntesis de prolina en el tracto gastrointestinal, siendo responsable de aproximadamente el 40% de la acumulación diaria de prolina corporal en lechones de 11 a 12 días de edad. Wu et al. (1994) observaron que la glutamina es capaz de producir y liberar prolina en el intestino delgado de lechones destetados (21 a 58 días de edad), pero en lechones en el pre-destete, con 14 a 21 días de edad, mediciones similares no revelaron la conversión de glutamina en prolina. Condiciones Normales El principal desafío del tracto digestivo – y las demandas por glutamina – surge en el inicio del período de amamantación, en la transición al destete, y en respuesta a daño intestinal (Lobley et al., 2 001). En lechones de 3 días de edad suplementados con 10 g de glutamina por 100 kg de aminoácidos parenterales, el peso corporal tendió a aumentar, pero el contenido corporal de proteína, grasa y cenizas no se alteraron (House et al., 1994) . Sin embargo, se alteró el espacio del cloro, indicando aumento de la retención extracelular de agua. Se informó que el 4,5% de la suplementación de glutamina en piensos completos aumentó la altura de las vellosidades y el área del yeyuno, mas no alteró la proteína o la masa de DNA de lechones de 4 días de edad (Burrin et al., 2000). Lackeyram et al. (2001) reportaron que la suplementación del 0,8% de Gln en dietas en base de maíz y harina de soja fue eficaz para aumentar la ganancia de peso corporal, del intestino delgado y el crecimiento de otros órganos viscerales en lechones sometidos a destete precoz a los10 días de edad en un estudio de 12 días. Wu et al. (1996) verificaron que una dieta para destetados suplementada con el 1% de Gln evitó la atrofia de las vellosidades del yeyuno, pero no del duodeno, 7 días después del destete y mejoró la conversión alimenticia durante la segunda semana post-destete. Kitt et al. (2001) reportaron que la suplementación de la dieta con el 1% de Gln mejoró el desempeño zootécnico de lechones destetados, pero no influenció la altura de las vellosidades en los primeros cuatro días después del destete. Además, la eficiencia alimenticia del día 14 al 21 después del destete mejoró con la adición de Gln. Liu y Jian (1999) constaron que tanto la suplementación de Gln como la de Glu mejoraron el desempeño zootécnico de lechones destetados. Ewtushik et al. (2000) reportaron que una dieta suplementada con Glu evitó la atrofia de las vellosidades inducida por el destete en el duodeno de lechones sometidos al destete precoz en comparación con una dieta típica o con una dieta con poli -amina, pero el nivel de inclusión de Glu (6,51%) fue mucho más alto de lo que se utiliza normalmente. Liu et al. (2002) verificaron que, en comparación a una dieta control de maíz-soya-suero de leche, el aporte de dietas suplementadas con el 1% de Gln o 1% de Glu a lechones destetados de 28 días de edad evitó la atrofia del yeyuno en la primera semana post-destete y mejoró la capacidad de absorción de D-xylosa por el intestino delgado en los días 7 y 14 después del destete. En comparación con los lechones alimentados con la dieta control o con el 1% de Gln, el aporte del 1% Glu resultó en mayor altura de las vellosidades en el final del yeyuno del día 14 después del destete y mayor concentración de RNA en el músculo esquelético en el día 7 después del destete. Los enterocitos son las principales células responsables de la utilización de Gln en el intestino delgado. Se observó que Gln más glucosa estimularon el metabolism o oxidativo y la absorción de NaCl en el yeyuno de lechones (Rhoads et al., 1992) y que GLN más asparagina estimularon el cambio Na+/H + en el enterocito del yeyuno de cerdos (Rhoads et al., 1994). Wu et al. (1995) estudiaron el metabolismo de la Gln y de la glucosa en el enterocito del yeyuno de lechones de 0 a 21 días y verificaron que la Gln fue metabolizada en amonio, glutamato, alanina, aspartato, CO2, ornitina y prolina, mientras la glucosa se convirtió en lactato, piruvato y CO2. La síntesis de arginina y citrulina a partir de Gln ocurrió en la primera semana después del nacimiento, pero no en lechones de 14 a 21 días de edad. En la primera semana post-natal, la glucosa no tuvo efecto en la utilización o la oxidación de glutamina o en la producción de glutamato o arginina; sin embargo, la Gln inhibió la glucólisis y la oxidación de la glucosa de los enterocitos del yeyuno. Esos resultados indicaron que la Gln es el combustible metabólico preferencial en los enterocitos de lechones recién nacidos en comparación con la glucosa y que la síntesis de arginina a partir de Gln en esas células tiene como significado fisiológico aportar arginina para el uso de lechones recién nacidos (Wu et al., 1995). Blachier et al. (1993) también reportaron que los enterocitos de lechones recién nacidos pueden sintetizar arginina a partir de la glutamina y que eso puede tener un rol anabólico importante. En lechones en desarrollo (después el nacimiento hasta el pre-destete), la glutamina es un precursor de la síntesis de arginina y de prolina en el tracto digestivo, lo que puede auxiliar el aporte de aminoácidos dietéticos y ayudar a evitar la limitación del crecimiento (Wu et al., 1994; Blachier et al., 1993). En un estudio de desempeño de 7 semanas con pollos de engorde, Moran y Stillborn (1994) reportaron que la suplementación de glutamato mejoró el peso corporal final, pero no tuvo efecto sobre la eficiencia alimenticia acumulada o sobre la mortalidad. Leclerq et al. (1994) observaron que la adición de glutamato y aspartato a dietas de baja proteína suplementadas con aminoácidos tuvo apenas un leve aumento en la tasa de crecimiento de pollos machos de los 30 a los 44 días de edad y no tuvo efecto en la eficiencia alimenticia. En un estudio con pollos, en comparación con la dieta de maíz y soya, aportar a una dieta el 1% de Gln tendió a disminuir la profundidad de la cripta en el duodeno y en el yeyuno a los 3 días después de la eclosión y a mejorar la relación vellosidad:cripta en el yeyuno a los 14 días después de la eclosión (Yi et al., 2001a). En estudio con pavos, el aporte del 1% de Gln a la dieta aumentó la tasa de crecimiento en la primera semana y la eficiencia alimenticia durante las tres primeras semanas después de la eclosión, pero no afectó la altura de las vellosidades o la relación vellosidad:cripta en el duodeno y en el yeyuno en comparación a una dieta control de maíz y soya (Yi et al., 2001 b). En un estudio con modelo ayuno/alimentación con pollos de engorde de 7 días de edad, se observó tanto en el duodeno, como en el yeyuno, que el aporte de dieta con 1% de Gln por 48 horas resultó en recuperación completa y maximizada de la morfología intestinal en pollos sometidos a ayuno en las 48 horas anteriores a la morfología presente antes del ayuno; el aporte del 1% de MSG o del 0,8% de NUC restauró parcialmente la integridad en 48 horas de re-alimentación; mientras el suministro de las dietas control o con el 1% de Glu no recuperó la morfología intestinal a los niveles anteriores al ayuno en 48 horas (Yi et al., observación nopublicada de nuestro laboratorio). Situaciones de Estrés El tracto gastrointestinal es el principal órgano de consumo y de utilización de glutamina. La mucosa intestinal contiene células secretorias, inmunes y neuroendocrinas, además de incontables enterocitos absortivos. Por lo tanto, el intestino percibe el ambiente nutricional y antigénico y actúa en la investigación y en la defensa inmunes, y también genera respuestas endocrinas en el ambiente del lumen (Burrin et al., 2000). La capacidad de la mucosa intestinal de metabolizar glutamina puede ser aún más importante durante estados de enfermedad catabólicos, cuando la depleción de glutamina puede ser más grave y la nutrición oral puede estar interrumpida debido a la gravedad de la enfe rmedad (Souba et al., 1990). Durante estrés o injuria, la glutamina puede ser un componente dietético esencial para el mantenimiento del metabolismo, de la estructura y de la función intestinal (Fox et al., 1988) . La glutamina es utilizada en altas tasas por células aisladas del sistema inmune, como linfocitos, macrófagos y neutrófilos, y también es importante para la proliferación de linfocitos y la producción de citoquinas, actividades de fagocitosis y secreción de los macrófagos y muerte bacteriana por los neutrófilos (Newsholme, 2001). Calder y Yaqoob (1999) informaron que la Gln es utilizada en altas tasas por células del sistema inmune en cultura y que es necesaria para sostener la proliferación óptima de los linfocitos y la producción de citoquinas por linfocitos y macrófagos. Se observó que la activación in vitro de macrófagos vía exposición a lipopolisacáridos (LPS) lleva a un aumento significativo de la utilización de glutamina (Newsholme, 2001). Una posibilidad de aumentar la tasa de utilización de glutamina es proveer las grandes demandas de arginina por el macrófago activado. La arginina es el precursor inmediato de la síntesis de óxido nítrico catalizada por la enzima inducible óxido nítrico sintetasa (iNOS) en el macrófago. TNF-α, IL-1β y IL-6 son, cuantitativamente, las citoquinas más importantes producidas por los macrófagos activados por los LPS. El macrófago de ratas estimulado por LPS aumentó la producción de IL -1β (Wallace y Keast, 1992) y la secreción de TNF-α y IL -6 (Murphy y Newsholme, 1999), que dependen de la disponibilidad extracelular de glutamina. Se demostró que la TNF-α induce a la expresión del gene de la glutamina sintetasa en cultura de músculo esquelético, lo que indica la ligación de la actividad del macrófago con la utilización de glutamina en locales de infección y inflamación (Chakrabarti, 1998). Bajo condiciones de elevada degradación de proteína, la glutamina puede actuar como un regulador metabólico para aumentar la síntesis de proteína y reducir el catabolismo proteico. Esas circunstancias pueden incluir infección, inflamación, inicio de la lactación o desnutrición (Lobley et al., 2001) . Después del estrés de una laparotomía patrón, el consumo de glutamina por el tracto intestinal in vivo aumentó 75% (Souba y Wilmore, 1983), y la absorción acelerada de glutamina intestinal disminuye la utilización de la glucosa circulante. Se reportó que la dexametasona aumentó la actividad específica de la glutaminasa mitrocondrial en enterocitos intestinales (Fox et al., 1988) , y glucocorticoides disminuyeron drásticamente la actividad de transporte de la glutamina en la membrana borde en cepillo (Souba et al., 1990). La utilización acelerada post-operatoria de glutamina circulante puede tener como objetivo suplir los requerimientos de energía y de nitrógeno del intestino cuando el consumo de alimento es interrumpido. La liberación de glutamina excede su síntesis en el músculo esquelético cuando hay estrés, resultando en reducción de la concentración intracelular de glutamina y llevan do a tasas crecientes de degradación de proteína (Newsholme, 2001). Yoo et al. (1997) reportaron que cuando se expusieron lechones al destete a una infección moderada por Escherichia coli (desafío de E coli viva intraperitoneal, 0,5 × 108 UFC/kg de peso corporal, serotipo 078), la suplementación con el 4% de Gln tuvo como efectos benéficos el mantenimiento de la concentración intracelular de glutamina normal en el músculo, la población de leucocitos y la función de los linfocitos. Dugan y McBurney (1995) verificaron que la perfusión de glutamina en el lumen alivió los efectos deletéreos de la endotoxina sobre la permeabilidad del tracto digestivo de lechones. Se reportó que la Gln estimula la absorción de sodio y de cloruro en el yeyuno de cerdos con enteritis por rotavirus (Rhoads et al., 1991). Brooks et al. (1997) también observaron que la administración de glutamina aumenta el transporte de Na+ tanto en la extremidad de las vellosidades, como en las células de la cripta en terneros desafiados con Escherichia coli K99 +. No obstante, también se observó que la glutamina no pudo mejorar la ganancia de peso o la retención de N en ovinos infestados por parásitos o reducir la duración de la diarrea causada por infección por rotavirus en lechones (Lobley et al., 2 001). En diversos estados de estrés (choque, septicemia, trauma) asociados con translocación bacteriana, el aporte de dietas enterales o parenterales ricas en glutamina puede reducir la incidencia de translocación de bacterias por disminuir la adhesión de las bacterias al enterocito y por normalizar los niveles de IgA (Souba, 1990). En un estudio con ratas sometidas a ayuno, Salloum et al. (1989) reportaron que la dieta suplementada con Gln y con Glu aumentó la altura de las vellosidades en comparación a una dieta control, pero la Gln fue mejor que el Glu para sostener el metabolismo intestinal, estimulando la actividad de la glutaminasa y evitando la translocación bacteriana. Se demostró que una caída marcada en la actividad de la glutaminasa intestinal en ratas con tumores está asociada a una degradación de la barrera mucosa del intestino y a la translocación de bacterias entéricas para la corriente sanguínea. La regulación enzimática modulada de la utilización de la glutamina de la mucosa puede perjudicar el metabolismo, la estructura y la función de barrera del intestino (Souba, 1990). Baskerville et al. (1980) infundieron glutaminasa para disminuir los niveles sanguíneos de glutamina y observaron diarrea, atrofia leve de las vellosidades, ulceraciones de la mucosa y necrosis intestinal en diversas especies animales, lo que indica que el mantenimiento del nivel sanguíneo normal de glutamina es esencial. Se afirmó que la Gln aumenta la altura de las vellosidades de ratas y evita la translocación bacteriana, como indicado por la presencia de Staphylococcus aureus en la sangre (Salloum et al., 1989). Se reportó que dietas suplementadas con Gln aumentaron la regeneración de la mucosa intestinal después de ayuno (Salloum et al., 1989). Fórmulas parenterales suplementadas con Gln para humanos disminuyeron la atrofia de la mucosa intestinal y de las células exocrinas del páncreas, y la Gln endovenosa y enteral promueven la regeneración del tejido gastrointestinal después injuria tóxica (Smith y Wilmore, 1990). A Gln fue usada en nutrición parenteral para mantener el balance de nitrógeno, la masa muscular, la función inmune y la integridad gastrointestinal de gran parte de los pacientes que sufrieron septicemia, heridas, quemaduras y cirugía (Calder y Yaqoob, 1999 ). La glutamina o la alanil-glutamina suministradas parenteralmente mantuvieron la producción de linfocitos por las placas de Peyer y la integridad intestinal en ratones inoculados con el virus de la influenza (Li et al., 1998) . Se reportó que la nutrición TPN enriquecida con glutamina o la suplementación dietética con 2 y 4% de Gln disminuyeron la mortalidad de ratas desafiadas intraperitonealmente con Escherichia coli viva (Inoue et al., 1993) y de ratones infectados endovenosamente con Staphylococcus au reus vivo (Suzuki et al., 1993), respectivamente. Hwang et al. (1987) observaron que la suplementación de glutamina de soluciones parenterales de nutrición completa disminuyó significativamente la atrofia de las vellosidades asociada a las fórmulas -patrón sin glutamina para pacientes humanos. Hay situaciones en que la suplementación de glutamina ayuda la función del tracto digestivo y el metabolismo, especialmente en situaciones de desafío (Lobley et al., 2001) , pero algunos de los beneficios de la glutamina pueden ser realizados por terapias alternativas. En cuadros inflamatorios o enfermedad con catabolismo, se espera que la glutamina y el glutamato tengan roles más importantes, por aumentar a respuesta inmune, mantener la integridad del intestino, aumentar la síntesis proteica y reducir el catabolismo proteico, reducir la mortalidad y la morbidad, así como el impacto general sobre el desempeño de lechones o aves jóvenes. Las cuestiones que todavía necesitan ser contestadas son: - ¿la glutamina y el glutamato (o glutamato monosódico) son metabolizados de forma diferente cuando estan presentes en la mucosa intestinal vía dieta o vía circulación? - ¿En que extensión son metabolizados de forma diferente? - ¿Cómo pueden ser aplicados en la producción animal moderna de forma práctica y económica? Esos puntos de interrogantes necesitan de más investigaciones en el futuro próximo, especialmente para definir las condiciones en que esos aminoácidos son esenciales. Literatura Citada Adams, E., and L. Frank, 1980. Metabolism of proline and hydroxyproline. Int. Rev.Connect. Tissue Res.5:1-91. Baskerville, A., P. Hambleton, E.Benbough, 1980. Pathologic features of glutaminase toxicity. Br.J.Exp. Pathol 61:132. Blachier, F., H. M’Rabet- Touil, L.Poshoo, B.Darcy-Vrillon , and P.H.Duee, 1993. Intestinal arginine metabolism during development: evidence for de novo synthesis of L-arginine in newborn pig enterocyte. Eur. J.Biochem. 216:109 -117. Blikslager, A.T., J.M.Rhoads, D.G.,Bristol, M.C.Roberts, and R.A. Argenzio, 1999. Glutamine and transforming growth factor-alpha stimulate extracellular regulated protein kinase and enhance recovery of villous surface area in porcine ischemic-injured intestine. Surgery 125:186-194. Brooks, H.W., D.G. White, and A.J.Wagstaff, 1997. Evaluation of a glutamine-containing oral rehydration solution for the treatment of calf diarrhea using an Escherichia coli model. Br. Vet. J. 153;163-170. Burrin, D.G.,B.Stoll, R.Jiang, X.Chang, B.Hartmann, J.J.Holst, G.H.Greeley, and P.J.Reeds, 2000. Minimal enteral nutrient requirements for intestinal growth in neonatal pigs:how much is enough? Am.J.Clin.Nutr.71:1603-1610. Calder, P.C., and P. Yaqoob,1999. Glutamine and the immune system. Amino acids 17:227241. Chakrabarti, R., 1998. Transcriptional regulation of the rat glutamine synthetase gene by tumor necrosis factor alpha. Euro. J. Biochem. 254:70 -74. Curthoys, N.P., and M.Watford, 1995. Regulation of glutaminase activity and glutamine metabolism. Annu. Rev. Nutr. 15:133-159. Cynober, L. A., 1999. Glutamine metabolism in stressed patients (abstract). Proceedings of international Congress on amino acids(Germany). pp 5. Dugan, M.E.R., and M.I.McBurney, 1995. Luminal glutamine perfusion alters endotoxinrelatred changes in ileal permeability of the piglet. J.Parenteral. Enteral. Nutr. 19:83-87. Ewtushik, A. L., R. F. P. Bertolo, and R. O. Ball, 2000. Intestinal development of early-weaned piglets receiving diets supplemented with selected amino acids or polyamines. Can. J. Anim. Sci.80:653-662. Fox, A.D., S.A.Kripke, J.M. Berman, 1988. Dexamethasone administration induces increased glutamine specific activity in the jejunum and colon. J.Surg. Res 44:391 -396, 1988. Halpern, B. P., 2000. Glutamate and the flavor of foods. J. Nutr. 130:910S -914S. Haussinger, D., F.Lang, and W.Gerok, 1994. Regulation of cell function by cellular hydration state. Am.J.Physiol.267: E343-E355. House, J.D., P.B.Pencharz, and R.O.Ball, 1994. Glutamine supplementation to total parenteral nutrition promotes extracellular fluid expansion in piglets. J.Nutr. 124:396-405. Hwang, T.L., S.T.O’Dwyer, and R.J.Smith, 1987. Preservation of small bowel mucosa using glutamine-enriched parenteral nutrition. Surg.Forum 38:56. Inoue, Y., J.P.Grant and P.J.Snyder, 1993. Effect of glutamine-supplemented intravenous nutrition on survival after Escherichia coli-induced peritonitis. J.Parenter. Enter. Nutr. 17:41-46. Khan, J., Y.Liboshi, L.Cui, M.Wasa, K.Sando, Y.Takagi, and A.Okada, 1999. Alanyl -glutaminesupplemented parenteral nutrition increase luminal mucus gel and decreases permeability in the rat small intestine. J.Parenter. Enteral. Nutr. 23:24-31. Kitt, S. J., P. S. Miller, A.J. Lewis, and R. L. Fischer, 2001. Effects of diet and crystalline glutamine supplementation of growth performance and small intestine morphology of weanling pigs . J. Anim. Sci . Vol 79, Suppl 1(Abstr.). Lackeyram, D., X. Yue, and M. Z. Fan, 2001. Effects of dietary supplementation of crystalline L-glutamine on the gastrointestinal tract and whole body growth in early-weaned piglets fed corn and soybean meal –based diets. J. Anim. Sci. Vol. 79, Suppl.1 (Abstr.) Leclercq, B., A.M.Chagneau, T.Cochard, and J.Khoury, 1994. Comparative responses of genetically lean and fat chickens to lysine, arginine, and non-essential amiono acid supply. I.Growth and body composition. Bri. Poul. Sci. 35:687-696. Li, J., B.K.King, P.G.Janu, K.B.Renegar, and K.A.Kudsk, 1998. Glycyl-L-glutamine enriched parenteral nutrtition maintains small intestine gut-associated lymphoid tissue and upper respiratory tract immunity. J.Parenter. Enter. Nutr. 22:31-36. Liu, T., and P. Jian, 1999. Effects of glutamine and glutamate on the perfoemance of earlyweaned piglets. Journal of Huazhong Agricultural University(P.R.China), 18(5):457 -460. Liu, T., P. Jian, Y.Z.Xiong, S.Q.Zhou, and X.H., Cheng. 2002. Effects of dietary glutamine and glutamate supplementation on small intestinal structure, active absorption and DNA, RNA concentration in skeletal muscle tissue of weaned piglets during d 28 to 42 of age. AsianAust. J. Anim. Sci. 15(2):238-242. Lobley, G.E., S.O.Hoskin, and C.J.McNeil, 2001. Glutamine in animal science and production. J.Nutr. 131:255S-2531S. Moran, Jr., E.T., and H.L.Stillborn, 1994. Responses of broilers to glutamic acid when given rduced CP feeds high and low in potassium. Poultry Sci. 73(Suppl. 1): 74. Murphy, J.M., and P. Newsholme, 1999.Macrophage-activated lysis of a β-cell line, TNF-alpha release from BCG-activated murine macrophages and IL-8 release from human monocyte are dependent on extracellular glutamine concentration and glutamine metabolism. Cli. Sci.(Lond)96:89-97. Murphy, J.M., S.J.Murch and R.O.Ball, 1996. Proline is synthesized from glutamate during intragastric infusion but not during intravenous infusion in neonatal piglets. J.Nutr. 126:878-886. Newsholme,P., 2001. Why is L-glutamine metabolism important to cells of the immune system in health, postinjury, surgery or infection? J.Nutr. 131:2515S-2522S. O’ Dwyer, S. T., T. Scott, and R. J. Smith, 1987. 5-Fl uorouracil toxicity on small intestine mucosa but not while blood cells is decreased by glutamine. Clin. Res. 387a:10-16. Reeds, P.J., and D.G.Burrin, 2001.Glutamine and the bowel. J.Nutr. 131:2505S -2508S. Reeds, P.J., D.G.Burrin, B.Stoll, and F.Jahoor, 2000. Intestinal glutamate metabolism. J.Nutr. 130:978S -982S. Reeds, P.J., D.G.Burrin, B.Stoll, F.Jahoor, L.Wykes, J.Henry, and M.E.Frazer, 1997. Enteral glutamate is the preferential source for mucosal glutathione synthesis in fed piglets. Am. J.Physiol . 273:E408-E415. Reeds, P.J., D.G.Burrin, F.Jahoor, L.Wykes, J.Henry, and M.E.Frazer, 1996. Enteral glutamate is almost completely metabolized in first pass by the gastrointestinal tract of infant pigs. Am.J.Physiol. 270:E413-E418. Rhoads, J.M., E.O.Ketu, J.Qujnn, J.Woosely and J.G.Leece, 1991. L-Glutamine stimulates jejunal sodium and chloride absorption in pig rotavirus enteritis. Gastroenterology 100:683-691. Rhoads, J.M., E.O. Keku, and J.P.Wooddrad, 1992. L-glutamine and D-glucose stimulate oxidati ve metabolism and NaCl absorption in piglet jejunum. Am.J.Physiol. 263:G960G966. Rhoads, J.M., R.A.Argenzio, W.Chen, R.A. Rippe, J.K.Westwick, A.D.Cox, H.M.Berschneider, and D.A.Brenner, 1997. L-glutamine stimulates intestinal cell proliferation and acti vates motogen-activated protein kinase. Am.J.Physiol. 272:G943-G953. Rhoads, J.M., W.Chen, D.Chu, H.M.Berschncider, R.A.Argenzio, and A.M.Parodiso, 1994. L+ + glutamine and L-asparagine stimulate Na /H exchange in porcine jejunal enterocytes. Am. J. Physiol. 266: G828 -838. Salloum, R. M., W. W. Souba, V. S. Klimberg, D. A. Plumley, D. J. Dolson, K. I. Bland and E. M. Copeland, 1989. Glutamine is superior to glutamate in supporting gut metabolism, stimulating glutaminase activity, and preventing bacterial translocation. Surg. Forum. 40: 6-8. Smith, R.J, 1990. Glutamine metabolism and its physiologic importance. J. Parent. Enter. Nutr. 14: 40S-44S. Smith, R.J, and D.W.Wilmore, 1990. Glutamine nutrition and requirements. J. Parent. Enter. Nutr. 14:94S -99S. Souba, W. W., 1993. Intestinal glutamine metabolism and nutrition. J. Nutr. Biochem. 4:2-9. Souba, W.W., and D.W. Wilmore, 1983. Postoperative alteration of arteriovenous exchange of amino acids across the gastrointestinal tract. Surgery 94:342 -350. Souba, W.W., K.Herskowitz, R.M.Salloum, M.K.Chen, and T.R.Austgen, 1990. Gut glutamine metabolism. Journal of parenteral and enteral nutrition, 14(4 suppl.):45S -50S. Suzuki, Z., Y. Matsumoto, A.A.Adjei, L.Osato, S.Shinjo, and S.Yamamoto, 1993. Effect of a glutamine-supplemented diet in response to methicellin-resistant staphylococcus aureus infection in mice. J.Nutr.Sci. Vitaminol. 39:405-410. Taudou, G., J. Wiart, and J. Piaijel , 1983. Influence of amino acid deficiency and tRNA aminoacylation on DNA synthesis and DNA polymerase activity during secondary immune response in vitro. Mol. Immunol . 20:255. Tsai, P. J., and P.C.Huang, 2000. Circadian variations in plasma and erythrocyte glutamate concentrations in adult men consuming a diet with and without added monosodium glutamate. J.Nutr. 130:1002S-1004S. Wallace, C., and D. Keast, 1992. Glutamine and macrophage function. Med. Clin. Exp. 41: 1016-1020. Windmueller, H.G., 19 82 . Glutamine utilization by the small intestine. Adv. Enzymol. 53:201237. Wu, G., 1998. Intestinal mucosal amino acid catabolism. J.Nutr. 128:1249-1252. Wu, G., A.G. Borbolla, and D.A.Knabe, 1994. The uptake of glutamine and release of arginine, citrulline, and proline by the small intestine of developing pigs.J.Nutr. 124:2437-2444. Wu, G., D.A.Knabe, W.Yan, and N.E.Flynn, 1995. Glutamine and glucose metabolism in enterocytes of the neonatal pig. Am. J. Physiol.37:R334-R342. Wu, G., S. B. Meier, and D.A. Knabe, 1996. Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs. J. Nutr. 126:2578 -2584. Yi, G. F., G. L. Allee, J. W. Frank, J. D. Spencer, and K. J. Touchette, 2001a. Impact of glutamine, menhaden fish meal and spray-dried plasma on the growth and intestinal morphology of broilers. Poultry. Sci. Vol. 80, Suppl. 1(Abstr.). Yi, G. F., G. L. Allee, H. J. Liu, J. W. Frank, and J. D. Spencer. 2001b. Apparent ileal digestibility of amino acids in soybean meal, menhaden fish meal, catfish meal and spraydried plasma in young broilers. Poultry. Sci. Vol. 80, Suppl. 1(Abstr.). Yoo, S. S., C. J. Field, and M. I. McBurney, 1997. Glutamine supplementation maintains intramuscular glutamine concentration and normalize lymphocyte function in infected early weaned pigs. J. Nutr. 127: 2253-2259.