mga 0261. desintegración - Farmacopea de los Estados Unidos
Anuncio

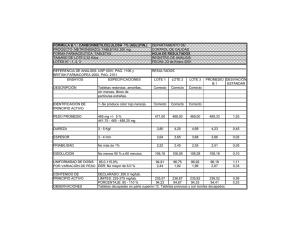
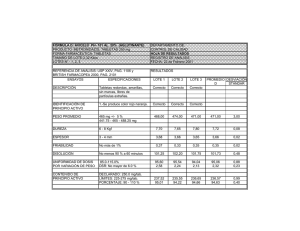
EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de febrero y hasta el 31 de marzo de 2016, lo analicen, evalúen y envíen sus observaciones o comentarios en idioma español y con el sustento técnico suficiente ante la CPFEUM, sito en Río Rhin número 57, colonia Cuauhtémoc, código postal 06500, México, D.F. Fax: 5207 6890 Correo electrónico: [email protected]. MGA 0261. DESINTEGRACIÓN Este método se basa en el tiempo requerido por una forma farmacéutica sólida para desintegrarse en un fluido de prueba, en un tiempo determinado y bajo condiciones de operación preestablecidas. Este ensayo aplica a cápsulas y tabletas con o sin recubrimiento, así como a granulados efervescentes y tabletas eferverscentes. No se lleva a cabo en tabletas o granulados que requieren el cumplimiento del MGA 0291 Disolución, ni en tabletas masticables, trociscos y tabletas de liberación controlada (MGA 0521, Liberación controlada). Tampoco es aplicable a tabletas con dimensiones mayores que 20.0 mm. La desintegración no implica la solubilización total de la gelatina o del contenido de la cápsula, ni de la tableta. La desintegración completa se define como la condición en la que sólo quedan sobre la malla del aparato, fragmentos insolubles de la tableta, residuos del recubrimiento de ésta o de gelatina de la cápsula o bien una masa suave sin núcleo palpable; pudiendo observarse eventualmente residuos insolubles adheridos a la cara inferior del disco en caso de utilizar éste. La prueba de desintegración se efectúa empleando el aparato y los aditamentos (discos auxiliares), que se describen a continuación, según se indique en la monografía respectiva. APARATO En la figura 0261.1 se describen las características y dimensiones de la canastilla utilizada en la prueba, la cual se habrá de introducir en un vaso de fondo plano que contendrá el fluido de prueba. El vaso debe tener de 138 a 155 mm de altura y un diámetro interior de 97 a 110 mm. La canastilla (figura 0261.1) es la parte principal del aparato y está constituida por un ensamblaje rígido que soporta 6 tubos cilíndricos de vidrio. Cada tubo tiene una longitud de 77.5 ± 2.5 mm y un diámetro interior de 21.5 mm; la pared tiene un espesor de 2 mm, aproximadamente. Los tubos se mantienen verticales mediante su acoplamiento a dos placas, separadas y superpuestas, de material plástico transparente, de 88 a 92 mm de diámetro y de 5 a 7 8 mm de espesor, atravesadas cada una por seis orificios que darán soporte a igual número de tubos. Los orificios son equidistantes del centro de la placa e igualmente espaciados entre ellos. En cada +52 55 5207 8187 +52 55 5207 6887 www.farmacopea.org.mx [email protected] uno de los seis orificios de la placa inferior (rejilla), se fija un tamiz de acero inoxidable con hilo de diámetro de 0.600 a 0.655 mm y de malla número 10 (con una apertura de malla de 1.8 a 2.2 mm). Para que los tubos de vidrio estén en posición vertical, las placas de plástico se mantienen en posición paralela por medio de un eje central de acero inoxidable de cerca de 180 mm de largo, cuyo extremo superior termina en una ranura que permite ensamblar la canastilla a un dispositivo mecánico, destinado a asegurar un movimiento vertical alternativo y regular sin desviación horizontal apreciable, cuya amplitud es de 53 a 57 mm. El número de desplazamientos completos de la canastilla, de descenso y ascenso, es de 28 a 32 ciclos por minuto. El volumen de líquido que se vierte en el vaso debe ser tal que, cuando la canastilla está en la posición más elevada, la rejilla se encuentra por lo menos a 25 mm por debajo de la superficie del líquido, y cuando está en la posición más baja, la rejilla está por lo menos a 25 mm del fondo del recipiente, manteniendo los extremos superiores de los tubos abiertos por debajo de la superficie del líquido. Por otra parte, un dispositivo adecuado mantiene la temperatura del sistema que contiene el fluido de prueba, entre 35 y 39 ºC. Los elementos metálicos y plásticos descritos pueden presentar modificaciones de detalle, pero las dimensiones de los tubos y de la tela metálica de la rejilla de la canastilla deben estar conforme a las indicaciones descritas anteriormente. De conformidad a lo indicado en la monografía respectiva, se utilizará un disco auxiliar (figura 0261.2), el cual se introducirá en cada uno de los 6 tubos de la canastilla. Disco auxiliar (figura 0261.2). Cada disco consiste en un cilindro hecho de material plástico transparente de una densidad relativa de 1.18 a 1.20 a una temperatura de 37 2 C. El disco tiene un diámetro 20.7 ± 0.15 mm y un espesor de 9.5 ± 0.15 mm. Cada disco está atravesado de parte a parte por 5 orificios de 2 ± 0.1 mm de diámetro: un orificio central y otros cuatro equidistantes entre ellos a una distancia radial de 6 ± 0.2 mm; la cara lateral del disco está provista de cuatro muescas, equidistantes entre ellas, de 9.4 ± 0.2 mm de longitud en la parte superior y de 1.6 ± 0.1 mm en la parte inferior. PROCEDIMIENTO Tabletas. En cada uno de los seis tubos de la canastilla, depositar una tableta. Colocar en cada tubo un disco (omitir el uso de disco en caso de que la monografía individual así lo indique). Poner el aparato en operación utilizando como líquido de inmersión agua a 37 ± 2 ºC, o bien, el líquido de inmersión especificado en la monografía respectiva. Cuando haya transcurrido el tiempo indicado, elevar la canastilla para separarla del líquido de inmersión y observar las tabletas. CONSULTA A USUARIOS DE LA FEUM 2016-1 Métodos Generales de Análisis 1 Río Rhin 57 col. Cuauhtémoc 06500, del. Cuauhtémoc México D. F., México. Figura 0261.1. Aparato de desintegración. Figura 0261.2. Aparato de desintegración. +52 55 5207 8187 +52 55 5207 6887 www.farmacopea.org.mx [email protected] CONSULTA A USUARIOS DE LA FEUM 2016-1 Métodos Generales de Análisis 2 Río Rhin 57 col. Cuauhtémoc 06500, del. Cuauhtémoc México D. F., México. Tabletas con capa ácido resistente. En cada uno de los seis tubos de la canastilla colocar una tableta. Si las tabletas están cubiertas con una capa de sustancias solubles, sumergir la canastilla en agua a temperatura ambiente, durante 5 min. Poner en movimiento el aparato sin discos, usando como líquido de inmersión, SR fluido gástrico simulado a 37 ± 2 °C. Transcurrida 1 h, elevar la canastilla para separarla del líquido de inmersión y observar las tabletas. No debe haber evidencia alguna de desintegración, rompimiento o ablandamiento. Enseguida, poner el aparato en movimiento, usando SR fluido intestinal simulado a 37 ± 2 °C, durante el tiempo especificado en la monografía. Elevar la canastilla para separarla del líquido de inmersión y observar las tabletas. Pastillas o tabletas bucales. Proceder como se indica para tabletas omitiendo usar los discos. Transcurridas cuatro horas elevar la canastilla para separarla del líquido de inmersión y observar las pastillas. Tabletas sublinguales. Proceder como se indica para tabletas omitiendo el uso de discos. Transcurrido el tiempo límite especificado en la monografía respectiva, elevar la canastilla para separarla del líquido de inmersión y observar las tabletas sublinguales. Cápsulas de gelatina dura o blanda. Proceder como se indica para tabletas omitiendo usar los discos. Colocar un tamiz de alambre removible (malla n.o 10) en la parte superior de la canastilla. Observar las cápsulas cuando ha transcurrido el tiempo especificado en la monografía respectiva. Granulados y tabletas efervescentes. Colocar una tableta o una unidad de dosis de granulado efervescente en un vaso de precipitados que contenga 200 mL de agua a temperatura ambiente. La tableta o el granulado se desintegran cuando cesa la emisión de burbujas alrededor de los fragmentos de muestra. Repetir la operación con otras cinco unidades de dosificación. La muestra satisface la prueba si cada uno de los seis ensayos se desintegra de la manera descrita dentro de un tiempo de 5 min. INTERPRETACIÓN. Transcurrido el tiempo especificado en la monografía del producto, todas las unidades dosis deben haberse desintegrado completamente. Si no ha sucedido así con una o dos unidades, repetir la prueba con otras 12; de un total de 18 unidades ensayadas, cuando menos 16 deben desintegrarse completamente. +52 55 5207 8187 +52 55 5207 6887 www.farmacopea.org.mx [email protected] CONSULTA A USUARIOS DE LA FEUM 2016-1 Métodos Generales de Análisis 3 Río Rhin 57 col. Cuauhtémoc 06500, del. Cuauhtémoc México D. F., México.