Electrólisis de solución acuosa
Anuncio

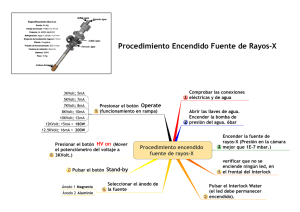
Electrólisis de una solución acuosa de ácido sulfúrico En este caso se obtiene gas hidrógeno en el cátodo y oxigeno gaseoso en el ánodo. Si tomamos en cuenta el razonamiento que se utilizó en el caso anterior, tendremos solo cationes H+ , provenientes en su mayor parte de la disociación del ácido y, en menor medida, producidos por el agua. Estos iones hidrógeno se descargan y reducen, produciendo gas hidrógeno. 2H+ + 2e− H2 Hay en la solución dos tipos de aniones, OH− y SO42−. Estos últimos son los más abundantes y, al moverse hacia el ánodo, transportan la corriente eléctrica a través de la solución. Sin embargo son los OH− , que tienen el potencial de oxidación más positivo (potencial de reducción menos negativo), los que se descargan, oxidándose y desprendiendo oxígeno en el ánodo. De manera que, también en este caso, las reacciones que ocurren son: 2H2O 2H+ + 2HO− Cátodo: 2H+ + 2e− H2 (reducción) Ánodo: 2OH− ½ O2 + H2O + 2e− (oxidación) Sumando y simplificando: H2O H2 + ½ O2 Esto ocurre en la mayoría de la electrólisis de soluciones diluidas de electrolitos, en las que el desprendimiento de hidrógeno y oxigeno corresponde a la electrólisis del agua. 1