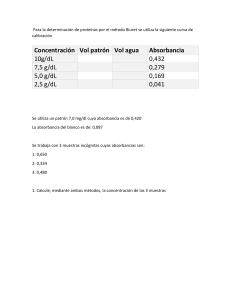
BENEMERITA UNIVERSIDAD AUTONOMA DE PUEBLA. LABORATORIO DE FISICOQUIMICA PRACTICA NO. 4 CINÉTICA POR ESPECTROFOTOMETRÍA MIERCOLES, 2 PM A 4 PM EQUIPO NO. 1 FECHA DE REALIZACIÓN: 18/09/2024 FECHA DE ENTREGA: 25/09/2024 INTEGRANTES DEL EQUIPO ABDIEL ROSALES NABOR GIBRAN SALAS MORELOS JUAN PABLO SÁNCHEZ BÁEZ GABRIEL SÁNCHEZ GONZÁLEZ INTRODUCCIÓN La espectrofotometría es una técnica que mide la cantidad de luz absorbida por una muestra a diferentes longitudes de onda. La ley de Beer-Lambert es fundamental en esta técnica, ya que relaciona la absorbancia con la concentración de la sustancia absorbente. La cinética química se refiere al estudio de las tasas de las reacciones químicas y los factores que las afectan. Las reacciones pueden ser de primer orden, segundo orden, entre otros, dependiendo de cómo la velocidad de reacción depende de las concentraciones de los reactivos. La rapidez de reacción es el número de moles por unidad de volumen de una sustancia que reaccionan en una unidad de tiempo, o sea, el cambio de concentración con el tiempo. La rapidez de descomposición es la disminución de la concentración de una especie reactiva en el tiempo, este decremento se indica por el signo negativo en la ecuación (1) que se manifiesta como una pendiente negativa en la gráfica de C vs t. Hay otro concepto importante que es el de mecanismo de reacción. Es una descripción detallada del conjunto de etapas o reacciones elementales que dan lugar a los productos de reacción. En el caso de un mecanismo de una sola etapa, representa la trayectoria estereoquímica La velocidad de una reacción química puede medirse como la velocidad de formación de uno o más de sus productos o bien la velocidad de utilización de sus reactivos. Podemos suponer que al aumentar la concentración de los reactivos la probabilidad de interacción de estos aumenta conjuntamente con la velocidad que procede tal reacción. OBJETIVO Determinar la constante de velocidad de una reacción química mediante el uso de espectrofotometría, midiendo la absorbancia de la solución a lo largo del tiempo y analizando cómo varía la concentración de los reactivos o productos en función del tiempo. HIPÓTESIS La velocidad de reacción de un sistema químico se puede determinar mediante mediciones espectrofotométricas de absorbancia, y se espera que la relación entre la absorbancia y el tiempo siga un comportamiento predecible que permita establecer el orden de la reacción y calcular la constante de velocidad. MATERIAL Y REACTIVOS Material • • • • • • • Espectrofotómetro 3 vasos de precipitado 2 celdas Pipeta Perilla Cleanex Cronometro Reactivos • • • Yoduro de potasio 0.1 M Persulfato de potasio 0.0065 M Agua destilada Fichas de seguridad Agua destilada Yoduro de potasio Persulfato de potasio METODO DE TRABAJO 1. Conectar el espectrofotómetro y dejar calentar durante 30 min. Para que se auto verifique, regule y estabilice apuntando a 465 nm. 2. La tapa de la porta celdas debe estar siempre cerrada. 3. Tomar una alícuota de 5 ml de solución de yoduro de potasio y agregarla en una primera celda hasta la marca indicada, la cual servirá de blanco. 4. Introducir la celda en la dirección correcta indicada en la porta celdas y cerrar y calibrar el aparato a cero de absorbancia. 5. Mezclar 5 ml de la solución de yoduro de potasio con 5 ml de solución de persulfato de potasio, agitar e iniciar simultáneamente el tiempo de reacción, tomar la temperatura de la mezcla de reacción. 6. Tomar una alícuota de la mezcla de la reacción y agregarla en una segunda celda hasta la marca. 7. Cambiar la celda del blanco por la de reacción, cerrar y tomar valores de absorbancia cada 3 minutos hasta completar 10 lecturas. 8. Sacar la celda, limpiarla con agua y apagar el equipo. DESARROLLO EXPERIMENTAL 1. Se conectará el espectrofotómetro durante media hora para calentar, después se ajustará a 465 nm 2. Se preparan 250 ml de persulfato de potasio 0.0065 M y yoduro de potasio 0.1 M y se vierten 5 ml de cada uno en un vaso de precipitado diferentes 3. En una de las celdas sin tocar la parte lisa se llenará con yoduro de potasio hasta el límite para introducirlo y ajustar el espectrofotómetro 4. Las soluciones previamente vertidas en los vasos de precipitado se mezclarán en un nuevo vaso para que empiece a ocurrir la reacción, en la 2da celda se vertiera hasta el límite de esta nueva solución y se introducirá en el espectrofotómetro 5. Se dejan pasar 3 minutos desde que se introdujo la celda y cada minuto a partir de estos 3 minutos se hará lectura de lo que arroja la máquina, esto se repetirá en total 35 veces 6. Sacar la celda pasado este tiempo y se lavara y limpiara de manera cuidadosa, esto igual a la primera celda ocupada antes Resultados Tabla 1. Valores de absorbancia de la solución donde se llevó a cabo la reacción química entre el persulfato de potasio y yoduro de potasio # de medición 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Tiempo de la reacción (min) 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 Valor de la absorbancia 0.131 0.155 0.180 0.205 0.230 0.254 0.279 0.302 0.326 0.348 0.371 0.394 0.416 0.438 0.460 0.482 0.503 0.524 0.546 0.566 0.587 0.608 0.628 0.648 0.668 0.688 0.708 0.727 0.747 0.766 31 32 33 34 35 36 33 34 35 36 37 38 0.785 0.804 0.822 0.840 0.859 0.876 1. Aplicando las ecuaciones cinéticas para orden cero, uno y dos determine el orden de reacción con respecto al persulfato de potasio y 2. Determine las contantes de velocidad para cada orden. Orden cero Partiendo del hecho de que 𝐴 = 𝜀𝑏𝑐, donde A es la absorbancia, ε es la absortividad molar de la especie absorbente, yodo molecular, b es la longitud del recorrido, espesor de la celda, y c es la concentración de la especie absorbente. Para nuestra experimentación se cumple que: 𝜀 = 47.5 𝐿𝑚𝑜𝑙 −1 𝑐𝑚−1 y 𝑏 = 1 𝑐𝑚, entonces las concentraciones del persulfato de potasio se calculan como sigue para los distintos 𝐴 tiempos t: 0.065 𝑀 − ( 1 ) × ( 1 𝑀×1 𝑐𝑚 47.5 1 ) × (1 𝑐𝑚), puesto que por cada mol de K2S2O8 consumido, se produce 1 mol de I2, teniendo que la concentración inicial de K2S2O8 era de 0.065 M, y que la absorbancia medida es la correspondiente a la del I 2. # de medición 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Tiempo de la reacción (min) 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 [K2S2O8] (M) 0.06224211 0.06173684 0.06121053 0.06068421 0.06015789 0.05965263 0.05912632 0.05864211 0.05813684 0.05767368 0.05718947 0.05670526 0.05624211 0.05577895 0.05531579 0.05485263 0.05441053 0.05396842 0.05350526 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 0.05308421 0.05264211 0.0522 0.05177895 0.05135789 0.05093684 0.05051579 0.05009474 0.04969474 0.04927368 0.04887368 0.04847368 0.04807368 0.04769474 0.04731579 0.04691579 0.04655789 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 Gráfica 1. [K2S2O8] en función del tiempo de reacción entre el K2S2O8 y el KI y = -0.0004x + 0.0631 0.07 [K2S2O8] (M) 0.06 0.05 0.04 0.03 0.02 0.01 0 0 5 10 15 20 25 30 35 40 Tiempo de la reacción (min) Partiendo del hecho de que cuando el orden de reacción es igual a 0, [𝐾2 𝑆2 𝑂8 ] = [𝐾2 𝑆2 𝑂8 ]0 − 𝐾𝑡, encontramos que para el orden de reacción cero con respecto al persulfato de potasio, la constante de velocidad, k, tiene un valor de 0.0004 𝑚𝑜𝑙𝐿−1 𝑚𝑖𝑛−1 = 0.024 𝑚𝑜𝑙𝐿−1 𝑠 −1. Esto se calculó al saber que la ecuación de la gráfica en el orden de reacción cero era 𝑦 = −0.0004𝑥 + 0.0631, donde y sería[𝐾2 𝑆2 𝑂8 ], x sería el tiempo t, -0.0004 sería la pendiente de la recta producida por el ajuste lineal, o sea -k, y 0.0631 sería la ordenada al origen. Orden uno Tiempo de la reacción (min) 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 ln(Af/Af-At) 0.161981873 0.194726954 0.230016431 0.266596954 0.304566587 0.342425998 0.383448978 0.422736695 0.465447813 0.506269807 0.550807662 0.597421977 0.644139601 0.693147181 0.744680831 0.799015182 0.853787671 0.911734915 0.976273436 1.038793793 1.108939403 1.18437911 1.261937345 1.346020462 1.437828011 1.538924128 1.651402112 1.771419785 1.915553687 2.074885725 2.264506584 2.498699972 2.786382044 3.191847152 3.942152747 ln(Af/Af-At) Gráfica 2. Absorbancia del I2 en función del tiempo de la reacción entre el K2S2O8 y elR²KI= 0.9819 y = 0.0514x - 0.0735 4.5 4 3.5 3 2.5 2 1.5 1 0.5 0 0 5 10 15 20 25 30 35 40 Tiempo de la reacción (min) 𝐴 𝑓 Partiendo del hecho de que ln 𝐴 −𝐴 = 𝑘𝑡, encontramos que para el orden de reacción 𝑓 𝑡 uno con respecto al persulfato de potasio, la constante de velocidad, k, tiene un valor de 0.0514 𝑚𝑖𝑛−1 = 3.084 𝑠 −1 . Esto se calculó al saber que la ecuación de la gráfica en 𝐴 𝑓 el orden de reacción uno era 𝑦 = 0.0514𝑥 − 0.0735, donde y sería ln 𝐴 −𝐴 , x sería el 𝑓 𝑡 tiempo t, 0.0514 sería la pendiente de la recta producida por el ajuste lineal, o sea k, y -0.0735 sería la ordenada al origen. Orden dos Tiempo de la reacción (min) 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1/[K2S2O8] 16.06629461 16.19778346 16.33705933 16.47875108 16.62292213 16.76371978 16.91294285 17.05259379 17.20079667 17.33893046 17.48573532 17.63504734 17.78027325 17.92791093 18.07802093 18.2306659 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 18.37879667 18.5293544 18.68975015 18.83799326 18.99620076 19.15708812 19.31286847 19.47120312 19.6321554 19.79579079 19.96217693 20.12285533 20.2948088 20.4609089 20.62975027 20.80140136 20.96667402 21.13459399 21.31478573 21.47863441 Gráfica 3.1/[K2S2O8] en función del tiempo de reacción entre el K2S2O8 y el yKI= 0.1546x + 15.5 R² = 0.999 25 1/[K2S2O8] 20 15 10 5 0 0 5 10 15 20 25 30 35 40 Tiempo de la reacción (min) 1 1 2 2 8 2 2 8 0 Partiendo del hecho de que [𝐾 𝑆 𝑂 ] = [𝐾 𝑆 𝑂 ] + 𝑘𝑡, encontramos que para el orden de reacción dos con respecto al persulfato de potasio, la constante de velocidad, k, tiene un valor de 0.1546 𝐿𝑚𝑜𝑙 −1 𝑚𝑖𝑛−1 = 9.276𝐿𝑚𝑜𝑙 −1 𝑠 −1. Esto se calculó al saber que la ecuación de la gráfica en el orden de reacción dos era 𝑦 = 0.1546𝑥 + 15.5, 1 donde y sería [𝐾 𝑆 𝑂 ], x sería el tiempo t, 0.1546 sería la pendiente de la recta 2 2 8 producida por el ajuste lineal, o sea k, y 15.5 sería la ordenada al origen. Análisis y discusión de resultados Se probaron diferentes órdenes de reacción (0, 1 y 2), ajustando los datos experimentales a los modelos cinéticos correspondientes. Para orden 0, la constante de velocidad fue de 0.024 mol L-1 s-, en la gráfica 1 se observa una disminución lineal de la concentración a lo largo del tiempo, esto indica que el reactivo se consume a una tasa fija durante la reacción, lo que se refleja en la línea recta en la gráfica y sigue un comportamiento de orden cero. En el caso del orden de reacción 1, se obtuvo un valor de la constante de velocidad de 3.084s-1, esto se obtuvo al graficar el logaritmo natural de la absorbancia en función del tiempo y se obtiene la línea recta con un coeficiente de correlación de 0.98. Para este gráfico solo se analizó la parte de la recta que se comporta de manera lineal, buscando un coeficiente correlación cercano a 1. Finalmente, al hacer el gráfico de segundo orden, obtuvimos una recta al graficar el inverso de la concentración del persulfato de potasio vs tiempo. Este gráfico es consistente con la literatura ya que, en las reacciones de segundo orden, se debe obtener una línea recta y esto se puede observar una la gráfica 3 mostrando un coeficiente de correlación de 0.9, un valor muy cercano a 1. En la cinética de segundo orden, la pendiente de la gráfica contra el tiempo corresponde a la constante de velocidad (k), así entonces el valor de k=9.276 Lmol-1s-1, el valor elevado de k podría indicar una mayor sensibilidad a las variaciones en las concentraciones de los reactivos. Conclusiones La práctica de laboratorio confirmó que la reacción entre K2S2O8 y KI sigue una cinética de orden 0, 1 y 2 dependiendo de las condiciones, con un ajuste muy cercano a 1. Se calcularon las constantes de velocidad para cada orden, observándose una mayor dependencia de la concentración de reactivos en la reacción de orden 2. La espectrofotometría permitió monitorear con precisión la disminución de K2S2O8 y la formación de I2. Referencias Atkins, P., & de Paula, J. (2010). Physical Chemistry (9th ed.). Oxford University Press Laidler, K. J. (1987). Chemical Kinetics (3rd ed.). Harper & Row House, J. E. (2007). Principles of Chemical Kinetics (2nd ed.). Academic Press Universidad Nacional Autónoma de México. (n.d.). Present P7. https://amyd.quimica.unam.mx/pluginfile.php/13188/mod_resource/content/1/Prese nt%20P7.pdf