- Ninguna Categoria
Procesos de Hidrometalurgia: Lixiviación y Purificación
Anuncio
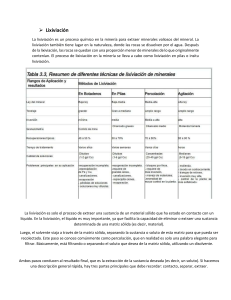
1 ESCUELA SUPERIOR POLITECNICA DE CHIMBORAZO FACULTAD DE RECURSOS NATURALES RESUMEN DE TRABAJO INVESTIGATIVO NOMBRE Mayly Nayely Katan Chinkim Paula Josselin Hidalgo Agila CURSO Pao 8 minas DOCENTE: Ing. Gregory Guillermo Cuesta Andrade CATEDRA: Metalurgia Extractiva MACAS-ECUADOR 2023-2024 2 1. Resumen completo de los procesos Hidrometalúrgicos La hidrometalurgia, comprende una de las operaciones de la metalurgia extractiva, que involucra procesamiento de minerales con valioso contenido metálico, donde el uso de agua es fundamental, en medios ácidos, alcalino o neutra, para una disolución de mayor selectividad posible; uno de los procesos representativos de la hidrometalurgia es la lixiviación. El nombre de hidrometalurgia se refiere al empleo generalizado de soluciones acuosas como agente de disolución(IQUIAPAZA, 2018). La hidrometalurgia se subdivide en tres ramas importantes, las cuales son: a.- Lixiviación b.- Concentración y Purificación c.- Precipitación. Ilustración 1 Procesamiento de los Minerales Metálicos 1.1. Origen de la Hidrometalurgia • La pirometalurgia data de los 3000 a 4000 arios AC, probablemente se origina en la antigua Mesopotamia. 3 • La primera aplicación de la hidrometalurgia se registra en China 117 a 122 AC, la transformación del hierro en cobre al poner en contacto con sulfato de cobre natural o chalcantita. • La lixiviación para obtener cobre metálico como precipitado con hierro se aplica en los siglos VII y VIII, mediante vertientes de aguas ácidas en China. • El descubrimiento de agua regia, siglo VIII Jabir Ibn Hayan, el solvente que disuelve oro, marca el inicio de la Hidrometalurgia como ciencia, su alta capacidad disolvente se basa en cloro libre: 3HC1+ HNO3 — C12 + NOC1+2H20 • Este método fue usado para la extracción de oro hasta la década de 1890. El desarrollo de la hidrometalurgia como ciencia comienza en el siglo XIX: • Con la cianuración de minerales de oro John Stewart y otros, disolución de minerales de bajo contenido metálico, seguida de la precipitación con zinc. • La producción de un precipitado cristalino y puro de Al(OH)3K.J. Bayer, mediante la lixiviación alcalina en caliente de la bauxita, lo que cohduce a la producción de aluminio por electrolisis sales fundidas de A1203 puro. 2. Fundamentos Termodinámicos Los procesos metalúrgicos se basan en los fundamentos fisicoquímicos. La termodinámica metalúrgica tiene que ver con los estados de equilibrio disponibles en los sistemas y con los efectos que sobre ellos tienen las influencias externas. El estado termodinámico de un sistema se define en términos de las variables de estado, las que pueden ser intensivas o extensivas. En gran medida los parámetros termodinámicos; energía libre de Gibbs, entropía, entalpia, energía interna, constante de equilibrio y 4 potencial rigen todos los procesos. La entalpia es uno de estos parámetros termodinámicos, el cual podríamos decir que es el contenido calorífico de cualquier material y la cantidad de energía absorbida o emitida luego de una reacción química.(D. Fernández et al., 2017) En distintos casos termodinámico y cinético el resultado observable y medible es una determinada tasa de transformación en el tiempo. Al analizar termodinámicamente el problema de la disolución de un sólido en general se tiene que: • Romperse su estructura cristalina, para lo cual se requiere aportar una cierta cantidad de energía U. • Ya separado los iones, estos se hidratan y pasan a formar parte de la solución, o electrolito. El fenómeno de disolución de un sólido en la mayoría de los casos es de tipo endotérmico, eso quiere decir, que el sólido absorbe calor al disolverse(Ferras Guillermo, 1967). 𝐴+𝐵(𝑠𝑜𝑙𝑖𝑑𝑜)− → 𝐴+(𝑠𝑜𝑙𝑖𝑑𝑜) + 𝐵−(𝑠𝑜𝑙𝑖𝑑𝑜) → 𝐴+(𝑎𝑐𝑢𝑜𝑠𝑜) + 𝐵− (𝑎𝑐𝑢𝑜𝑠𝑜) Los respectivos niveles de energía, propios de cada uno de estos estados se muestra en la siguiente figura. Ilustración 2 Distintos niveles de energía 5 Fuente: 2.1.Diagramas EH-PH Los equilibrios químicos y electroquímicos se resumen normalmente en los diagramas de Pourbaix, los cuales son diagramas potencial-pH. Los diagramas de Pourbaix son “una representación gráfica que muestra las regiones de estabilidad termodinámica de las especies en los sistemas metal-electrolito acuoso”. De este modo, los diagramas indican en qué condiciones de potencial y pH el metal es estable termodinámicamente (o inmune a la corrosión) y bajo qué condiciones puede causar su disolución para formar iones (corrosión) o su transformación en óxidos, hidróxidos, hidruros o sales metálicas que pueden producir pasivación. (Arango et al., 2023) Puesto que se está considerando el equilibrio termodinámico de especies en solución acuosa, es relevante incluir en los diagramas Eh - pH los límites de estabilidad del agua. Las semi reacciones a considerar son: Para calcular un diagrama de Pourbaix, se utilizan las ecuaciones de las reacciones en medio ácido, las cuales están directamente relacionadas con la concentración en iones H+ y el pH. • Oxidación 2 H2O <=> O2 + 4 H+ + 4e- E° = 1.23 V 6 • Reducción 2 H+ +2e- <=> H2 E° = 0.0 V Donde: • PH2 = 1 atm • PO2 = 1 atm Las ecuaciones se simplifican a: Oxidación: Reducción: 2.1.1. Calculo e Interpretación de Diagrama Pourbaix Estas se leen en los ejes de X y Y: • En Y, se encuentra el potencial, el cual calculamos con la ecuación de Nernst, h = hidrogeno. • En X, se encuentra el pH con la función de -log del H+ concentración de iones Un diagrama de Pourbaix sencillo nos indica: • Regiones de inmunidad • Corrosión • Pasividad del material 7 3. Generalidades del Proceso de Lixiviación La Lixiviación es la operación unitaria fundamental de la hidrometalurgia y su objetivo es disolver en forma parcial o total un sólido con el fin de recuperar algunas especies metálicas contenidas en él (Uceda Herrera, 2016). Algunos Lixiviantes Comunes Ácido sulfúrico para cobre, zinc y otros metales base, Cianuro de sodio para la plata y el oro, ácido clorhídrico / cloro para los metales del grupo del platino, Hidróxido de sodio para la bauxita (óxido de aluminio). 3.1.Técnicas de Lixiviación 3.1.1. Lixiviación In-Situ El proceso a realizar es en el mismo lugar de yacimiento sin someterlos a labores de extracción minera, esta técnica es utilizada para minerales de baja ley. En minerales de cobre y uranio. Ilustración 3 Lixiviación In Situ 3.1.2. Lixiviación en Botaderos Se caracteriza por lixiviar minerales de muy baja ley e involucra el acopio del mineral de la mina sin chancado o procesamiento previo. 8 Ilustración 4 Lixiviación en botaderos 3.1.3. Lixiviación en Pilas La lixiviación en pilas se practica con minerales de oro, cobre y uranio. Se realiza depositando y distribuyendo ordenadamente el material de chancado formando un montículo continuo de 6 a 8 m de altura, sobre esta pila se instala un sistema de riego por goteo y aspersores que van cubriendo toda el área expuesta, bajo las pilas del material a lixiviar se instala previamente una membrana impermeable sobre la cual se dispone un sistema de drenes que permiten recoger las soluciones que se infiltran a través del material (Muñoz, 2016). Ilustración 5 Lixiviación en Pilas 3.1.4. Lixiviación por Agitación Lixiviación de mineral molido en tanques agitados, donde el mineral está en suspensión usado en minerales de relativa alta ley para compensar los costos de molienda y agitación. Se usa industrialmente para lixiviar minerales de oro, cobre y aluminio. 9 Ilustración 6 Lixiviación por Agitación 3.2.Separación Sólido-Liquido En esta ocasión la separación se da por tres mecanismos importantes que es el contacto, separación y extracción. Si hacemos una descripción general rápida hay tres conceptos que debemos recordar. Contacto: dejar que el disolvente entre en contacto con la matriz sólida, Separar: las sustancias desde la matriz solida con el disolvente, Extraer: la sustancia deseada para su recolección. La extracción solido-liquido es una operación unitaria que consiste en la disolución: separación de uno o mas componentes que forman parte de un sólido empleando un disolvente adecuado en el que es insoluble el resto del sólido. La separación sólido-líquido es diferente según sea la técnica de lixiviación empleada. se clasifican en dos categorías principales: Lixiviación por Percolación Son aquellos donde existe un flujo a través de los porros de una capa permeable. Lixiviación por Inmersión: Son aquellos en las que las partículas sólidas se dispersan en un líquido y posteriormente se separan de el. 10 Ilustración 3 extracción por percolación e inmersión 3.3.Purificación y concentración de la solución Esta técnica se emplea en metalurgia con tres fines fundamentales: concentrar, purificar y separar los elementos o metales disueltos. Las soluciones de lixiviación contienen componentes no deseados que deben ser removidos antes del procesamiento posterior para la recuperación de los metales. En contraste las soluciones de lixiviación pueden tener las siguientes características: (1) ser muy diluidas en el metal primario, (2) contener dos o más metales de interés, (3) contener dos metales químicamente muy similares, y (4) estar muy contaminadas con impurezas (J. C. Fernández, 2013). 3.3.1. Absorción en Carbón Activado Cinco tanques de adsorción con capacidad nominal de 4 – 4.5 ton de carbón agitado activado cada uno. El carbón agitado cargado, a contracorriente, pasa a la torre de lavado, para después pasar al tanque de Despojamiento presurizado, donde se trata con una solución caliente de NaOH y esta nueva solución enriquecida va a las Celdas Electrolíticas. 3.3.2. Resinas de intercambio iónico Mezcla de parafina y resina. La resina atrapa los iones del mineral de interés(mena) en forma selectiva. obteniendo por un lado el mineral de interés y por otro lado una solución empobrecida que se denomina refino la cual es reutilizada en el proceso de lixiviación. 11 3.3.3. Proceso Merril-Crowe (cementación) Es necesario eliminar el aire dentro del reactor de cementación mediante la aplicación de vacío para luego ser bañado con el polvo de zinc metálico (oro y plata) pasa un filtro prensa y del mismo se obtiene un queque que es llevado al horno para sacar la barra fina del material de interés ya sea oro y plata. 4. Cianuración y Biolixiviación La cianuración y la biolixiviación son dos técnicas fundamentales dentro de la industria minera los cuales se enfocan en la extracción de metales preciosos como es el caso del oro, plata entre otros. Estos procesos se han vuelto revolucionarios debido a la forma en que se obtienen los metales antes mencionados de minerales de baja ley o minerales refractarios (IQUIAPAZA, 2018). 4.1.Cianuración La cianuración es un concepto amplio que engloba a un conjunto de sustancias que contienen carbono o nitrógeno. Los compuestos de cianuro son sustancias químicas, algunas de origen natural y otras de origen humano. 4.1.1. Principios de cianuración • Química del Proceso El oro y la plata se disuelven en una solución de cianuro en presencia de oxígeno, formando complejos solubles de cianuro. La reacción para la plata es similar: 12 • Etapas del Proceso: 1. Trituración y Molienda: El mineral se tritura y muele para aumentar el área superficial. 2. Lixiviación: El mineral molido se mezcla con una solución de cianuro. El tiempo de lixiviación puede variar dependiendo de la mineralogía del oro. 3. Recuperación de Oro: El oro disuelto en la solución se recupera mediante adsorción con carbón activado o por electrodeposición. 4. Desorción: El oro adsorbido en el carbón se desorbe utilizando una solución de cianuro y soda cáustica, luego se recupera mediante electroobtención. 5. Refinación: El oro recuperado se funde para obtener lingotes de alta pureza. 4.2.Biolixiviación La biolixiviación es un proceso biotecnológico que utiliza microorganismos para extraer metales de sus minerales. Este método es especialmente útil para minerales refractarios y de baja ley que son difíciles de tratar con métodos convencionales. Las bacterias que actúan en el proceso de biolixiviación en general son autótrofas, aeróbicas, y quimio sintética esta última permite que ellas sean capaces de oxidar minerales de tal manera que producen Ion Férrico y Ácido Sulfúrico que son indispensables para las reacciones de biolixiviación.(Ferras Guillermo, 1967) 4.2.1. ¿Cómo se realiza este proceso? Estos microorganismos se alimentan principalmente de dos elementos que se encuentran presentes en los sulfuros, como es el azufre y hierro, por lo que naturalmente separan las partículas de metal de estas impurezas. Para la extracción de estas sustancias, las bacterias 13 lo que hacen es disolver las rocas, es decir, las convierten en una solución. De ahí que el nombre del proceso sea Biolixiviación o Lixiviación biológica. 4.2.2. Comparación y Aplicaciones Cianuración: Más adecuado para minerales ricos en oro y plata, con instalaciones disponibles para manejo seguro de cianuro. Utilizado principalmente en la minería de oro. Biolixiviación: Preferido para minerales sulfurados de baja ley y refractarios, así como en contextos donde la sostenibilidad ambiental es una prioridad. Utilizado en la extracción de cobre, oro y otros metales base. Ilustración 4 Mecanismos de Biolixiviación 5. Hidrometalurgia de Minerales Auríferos e Hidrometalurgia de Minerales Cúpricos. La hidrometalurgia dentro de la industria minera es considerada como un conjunto de técnicas, la cual consiste en extraer metales separándolos de sus fases minerales mediante medios acuosos y a abajas temperaturas(IQUIAPAZA, 2018). Permiten procesar minerales de baja ley, reducir el consumo de energía, minimizar las emisiones de gases y residuos sólidos, y obtener productos de mayor pureza. Por lo que nos basaremos en los principios y las aplicaciones de los procesos hidrometalúrgicos para el oro y el cobre. 14 La lixiviación trata de la química de disoluciones de sustancias sólidas, este proceso se realiza en medio ácido o alcalino, lo que depende de la naturaleza de sustancia a lixiviar o el grado de oxidación que presentan éstas, como el óxido de cobre. Es posible realizar este proceso con sustancias metálicas, bajo ciertas condiciones especiales de presión, temperatura y con la intervención de otros elementos como el oxígeno, lo que indica que la solubilidad del oxígeno en la solución es relevante para una operación óptima, un Caso típico es la lixiviación alcalina del oro metálico((Sanchez Y Torres, 2021). 5.1.Fundamentos de lixiviación de oro 5.1.1. Mineralogía del oro En la naturaleza el oro se presenta asociado en diferentes formas con otros minerales y en algunos casos como oro libre, dependiendo de su procedencia y formación geológica. En los minerales el oro generalmente se encuentra como oro libre (nativo) o como aleaciones de oro-plata, teluros o diseminados como una solución sólida en sulfuros; en la mayoría de los casos estas fases pueden existir como inclusiones en minerales tales como: piritas auríferas, arsenopiritas, calcopirita, estibina. El oro en estado nativo mayormente es de procedencia aluvial o llamados placeres, como en el Perú en los ríos de Madre de Dios se encuentran en forma de "charpas ". 5.1.2. Comportamiento químico de oro en medio acuoso El oro no se oxida a temperatura de ambiente, es insoluble en ácidos sulfúrico, nítrico, clorhídrico, pero solUble en agua regia, soluciones que contienen bromo, soluciones de tiocianato (SCN-), tiourea [SC(NH2)21 y tiosulfato (.52 03-2). El cianuro de sodio, potasio y calcio disuelven el oro en presencia del oxígeno, formando complejos de cianuro aúrico KAu(CN)2, es ésta en la que se basa la cianuración de oro, así mismo el tiourea disuelve 15 el oro en medio ácido; también es recuperable el oro en contacto con mercurio formando amalgama. La oxidación de oro en medio acuoso para pasar a un complejó auroso y aúrico en presencia de un ligante, depende de la fuerza del agente oxidante y de los valores relativos de potenciales para valencia I y III. La estabilidad de los complejos Au+1 y Au+3 tiende a disminuir la electronegatividad del ligante que está cediendo electrones. Así mismo estos iones forman compuestos estables en el orden: NH3> SCN- > I- > Br- > CLLa recuperación de soluciones cianuradas de oro se realiza normalmente por precipitación con zinc metálico previa desaireación proceso "Merrill-Crowe". La velocidad de la disolución del oro aumenta con la temperatura, hasta la temperatura de tn,5-kgv 85°C, a condiciones estándar, esto depende de la solubilidad del oxígeno en la fase líquida, luego comienza a decrecer, lo que ocurre a una concentración constante cianuro. Otro de los factores que influye en la disolución del oro es el tiempo, pero también depende mucho de la naturaleza de la ganga, tamaño de partícula del mineral, cuya recuperación máxima está limitado a otros factores ya mencionados (IQUIAPAZA, 2018). 5.1.3. Formas de cianuración de oro. La aplicación de un método o forma de procesamiento depende del tipo de mineral: porosidad, mineralogía, dureza, impurezas que lo acompañan, el contenido de oro que tiene el mineral (ley de oro), entre estas formas: Cianuración en PADS: el mineral chancado se acumula en depósitos previamente preparadas con geomembranas (polietileno HD) en grandes cantidades, instalando 16 goteaderos (para que cada gota atrape al oxígeno del aire) en áreas iguales, el tiempo de operación puede ser horas, días o meses dependiendo de la porosidad del mineral. En pilas o montones trapezoidales rectangulares: para partículas gruesas-finas, el cianuro riega por aspersión con inyección de aire, tiempo horas. Cianuración por agitación: se aplica a partículas finas con leyes de oro que justifique la operación o se aplica a relaves (desechos de flotación de sulfuros metálicos), que tiene contenido de oro metálico, tiempo 6 a 12 horas, donde simultáneamente se adsorbe con carbón activado. Vat leaching o tanques de percolación: para partículas intermedias, con circulación de la solución de cianuro con inyección de aire al tanque, la operación puede durar 48 a 72 horas. Operaciones combinadas: gravimétrico-flotación-cianuración, cianuración Pads, agitación, etc. 5.2.Fundamentos de Lixiviación de cobre El proceso de extracción por solventes, conocido en la hidrometalurgia del cobre también como SX (del inglés Solvent Extracction), consiste en la extracción selectiva del cobre contenido en las soluciones de lixiviación mediante un solvente orgánico, para luego transferirlo a una solición de sulfato de cobre pura y concentrada, denominada electrolito rico. 5.2.1. Descripción general La planta SX recibe la solución rica generada en la etapa de lixiviación en pilas de minerales de cobre. Esta solución se caracteriza por tener una baja concentración de cobre disuelto, junto con impurezas como el Fe, Cl, Al, Mn, Mg, Na y otros disueltos durante el 17 proceso. El objetivo del proceso SX es extraer selectivamente el cobre contenido en esta solución rica impura, mediante intercambio iónico entre la fase acuosa (solución rica) y el reactivo orgánico. Este reactivo (solvente orgánico) es capaz de descargar el cobre en una etapa posterior del proceso a una solución de alta pureza y concentración de cobre y ácido, formando un electrolito apto para ser electrodepositado en el sector EW (IQUIAPAZA, 2018). 5.2.2. Extracción La solución rica proveniente de las pilas es mezclada con la fase orgánica (orgánico descargado), para extraer SELECTIVAMENTE el cobre obteniendo una solución pobre en cobre, llamada refino, que es reciclada a la etapa de lixiviación en pilas. Se obtiene en esta etapa una fase orgánica cargada, que es avanzada a la siguiente etapa. 5.2.3. Re extracción (Stripping). El orgánico cargado se pone en contacto con electrolito pobre proveniente del proceso de electro obtención, de alta acidez (150-200 g/I H2SO4). El cobre pasa de la fase orgánica a la fase acuosa, obteniéndose una fase orgánica descargada que se recicla a la etapa de extracción y un electrolito rico que avanza hacia el electro obtención. 5.3.Mecanismo de la transferencia de cobre El proceso SX se basa, en la siguiente reacción reversible de intercambio iónico: Cu+2 (ac) + 2RH(org) 4-> R2Cu(org)+ 21H+(ac). En la cual el sentido de reacción está controlado por la acidez o pH de la solución acuosa. En la etapa de extracción el reactivo orgánico se contacta con la solución acuosa impura de lixiviación y extrae selectivamente desde la fase acuosa los iones de cobre, incorporándolos en la fase orgánica El ion cúprico reacciona con el extractante formando 18 un compuesto organometálico insoluble en agua, totalmente soluble en el solvente orgánico (Kerosene), con la cual se produce la extracción del cobre desde la fase acuosa a la orgánica. Mediante este mecanismo, cada ion de cobre se intercambió con dos iones de hidrogeno que pasan a la fase acuosa donde se regenera ácido sulfúrico en una proporción de 1.54 (kg de ácido / kg de cobre) (IQUIAPAZA, 2018). 6. Fuente Bibliográfica (Sanchez Y Torres, 2021). (2021). Universidad Nacional Del Altiplano Universidad Nacional Del Altiplano. Tesis, 1–168. Arango, F. O. D., Gutiérrez, L. F. M., & Zapata, Á. M. O. (2023). Lixiviación. Evaluación de La Lixiviación de La Bebida Del Café Utilizando Diferentes Métodos de Preparación, 39–60. https://doi.org/10.2307/jj.7471121.5 Fernández, D., Sánchez, Y., Lasserra, A., & Arias, T. (2017). Influencia de la lixiviación en la recuperación de oro en la Mina Oro-Barita de Santiago de Cuba. Tecnología Química, XXXVII(3), 500–517. Fernández, J. C. (2013). Proposición de un sistema de lixiviación in situ. 1–94. Ferras Guillermo. (1967). Departamento de Ingeniería Metalúrgica – Universidad de Santiago de Chile. 5–12. IQUIAPAZA, P. A. S. (2018). “INTRODUCCIÓN A LA HIDROMETALURGIA.” Muñoz, M. (2016). Extracción de metales por hidrometalurgia: Procesamiento de Cobre y Cinc. Escuela Técnica Superior de Ingenieros Industriales, 2, 1–9. https://riunet.upv.es/handle/10251/68321%0Ahttps://riunet.upv.es/bitstream/handle/10251/6 8321/Muñoz - Extracción de metales por hidrometalurgia%3A Procesamiento de cobre y cinc.pdf?sequence=1#:~:text=El proceso hidrometalúrgico de extracción,realiza media 19 Uceda Herrera, D. A. (2016). Hidrometalurgia-Química e Ingeniería. Hidrometalurgia-Química E Ingeniería Hidrometalurgia Química E Ingeniería, 1–647.
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados