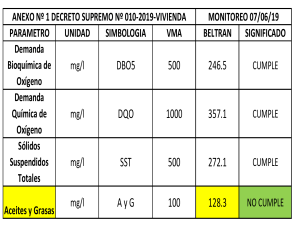
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS (Universidad del Perú, DECANA DE AMÉRICA) PRIMER EXAMEN CIENCIAS DE LA NATURALEZA – I Nombres y apellidos Elvis Anthony Rosas Reyes Sección: 2 1.La Química es una ciencia que estudia la composición, estructura y propiedades de la materia, se divide en varias ramas defina: a) Química Médica: tiene como finalidad el diseño y preparación de nuevos compuestos para su evaluación biológica, con la finalidad última de establecer relaciones entre la estructura química y la actividad biológica que contribuyan al desarrollo de nuevos fármacos b) Química Orgánica: estudia las propiedades de los elementos del carbono c) Química Analítica cuantitativa: estudia los componentes de los compuestos en general d) Fisicoquímica: estudia todos los cambios físicos y químicos que le suceden a la materia, basándose en los principios de la química. 2.Las vitaminas y los oligoelementos son componentes indispensables en la alimentación del ser humano y sólo se necesitan cantidades pequeñas de estas sustancias para llevar a cabo reacciones bioquímicas esenciales. Sin embargo, pueden aparecer deficiencias de múltiples nutrientes por exceso o deficiencia. Relacione deficiencia y/o exceso de metales y enfermedad. a) Kashin-Beck ( d ) Pb b) Acrodermatitis enteropática (a) Se c) Minamata (b) Zn d) Mano péndula (c) Hg 3.La fuerza con que el núcleo de un átomo retiene sus electrones periféricos se denomina carga nuclear efectiva. Utilizando las reglas de Slater calcular Z* para el nivel 4, del elemento 48 Cd (cadmio) 4.Se denomina “Gap” a la diferencia de energía entre la parte superior de la banda de valencia y la parte inferior de la banda de conducción. La conductividad eléctrica de un semiconductor depende en gran medida de la anchura del gap. Explique o esquematice cómo ocurre este proceso en los superconductores 5. Una de las teorías de enlace que explica la Geometría y estructura de los compuestos químicos es la teoría de repulsión de los pares electrónicos de la capa de valencia, aplicar dicha teoría para dibujar la geometría y estructura del Ar O2Cl2 6. En el siguiente diagrama ubicar los electrones de la molécula de fluor, hallar su orden de enlace σ 2p* π 2p* 2p 2p π 2p σ 2p σ 2s* 2s 2S σ 2s σ 1s* 1S 1S σ 1s Orden de enlace 1 7. Completar referente al oxígeno a) El oxígeno para tratar hipoxia debe tener un grado de pureza de 99.5 b) La toxicidad del oxígeno puede verse aumentada si se usa al mismo tiempo que otros medicamentos que también pueden tener efecto sobre los pulmones: tales como: cloroquina, thioridazina, menadion, etc c) En el embarazo se puede usar oxígeno en ciertas condiciones, tales como; oxígeno a presión normal (oxigenoterapia normobárica). d)Si no se aplica la adecuada concentración de oxígeno en recién nacidos puede provocar: un daño ocular (fibroplasia retrolental) 8. Los Free radicals son átomos o moléculas que presentan electrones desapareados, escriba la configuración de los electrones de los siguientes radicales liberados del oxigeno en el orbital π 2p* a) Peroxido de hidrógeno b) Radical oxonio c) Oxigeno singlett sigma d) Oxigeno triplete 9.Un compuesto coordinado o complejo es la combinación entre un ácido de Lewis (MT) y una base Lewis o ligando , cuando el ligando es polidentado origina quelatos tales como hemoglobina, clorofila, cianocobalamina, ATP, entre otros. El ácido de Lewis y la base Lewis en los quelatos clorofilina y hemoglobina son respectivamente a) Porfina- Mg y Porfina- Fe b)Porfirina- Mg y Porfirina – Fe c)Porfina- CO y Porfina – Fe d)Porfina –Co y Porfina – Fe. 10. Según el diagrama de TOM de moléculas heteronucleares como NO,CO, permiten demostrar el orden de enlace y su comportamiento como bases de Lewis: complete el diagrama con los electrones del CN y dibujar el orden de enlace σ 2p* π 2p* 2p 2p σ 2s* π 2p σ 2p 2s 2S σ 2s Orden de enlace es 2.5 11.En el ciclo del nitrógeno se cumplen los procesos de nitrificación, amonificación, asimilación y desnitrificación, fijación e inmovilización, cuando los óxidos de nitrógeno salen al aire originan una reacción química llamada lluvia ácida, la ecuación que demuestra esta reacción es: La ecuación que demuestra la relación es: NO + 2H2O HNO3 + 3H 12. Escriba el nombre del siguiente complejo: CaK[Co NO2 NO Br (SCN)2 I ] Bromuronitritonitrosiloditiocianatoyodurocobalto(II) de calcio y potasio. 13.Una solución compuesta por los siguientes sustancias: 1.2 g NaCl ,glucosa al 5%, 1.4 g de lactato de calcio, 1.5 g de KCl .Calcular la osmolaridad de un litro de solución. 105.68 osmoles 14. En un litro de MgCl2 al 0.9 % y a 37 °C. Calcular la presión osmótica expresada en atm y mmHg , considerando un coeficiente osmótico de 85% PO=609.6 atm 462.621 mmhg 15. Calcular el pH,de las siguientes soluciones a) HClO4 1.5 x 10-11 M pH=6.99 b) H2SO4 al 5 % disueltos en 500 mL de H2O destilada. pH=2.69 c)12 de H2CO3 disueltos en 500 ml de agua. Si presenta K1 = 4.35 x 10-7 K2 = 4.69 x 10-11 pH=3.387 d) 12 g NH3 disueltos en 500 mL de agua destilada Kb = 1.76 x 10-5 pH=11.7 17. Calcular la cantidad de ácido y base conjugada Na2HPO4 . 2H2O / NaH2PO4 .5 H2O necesarios para preparar 100 mL de una solución tampón 0.5 M .pH 6.8 y PKa 7.0 mácido=0.36g msal=0.27 g 18.Calcular el pH y el efecto amortiguador cuando se mezclan 4.5 mL de NaH2PO4 0.3 M y 3.6 mL de Na2HPO4 0.2 M, luego completar a un volumen de 100 mL con agua destilada. Hallar el PH inicial considerando Ka2 del fosfato (pKa =7.2) b) Hallar el efecto tampón cuando se añade a las soluciones 1.2 mL de HCl 0.1 M y 1.2 mL de NaOH 0.2 M. hacer las reacciones correspondientes