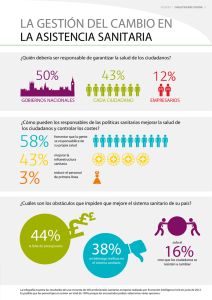
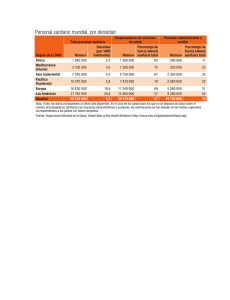
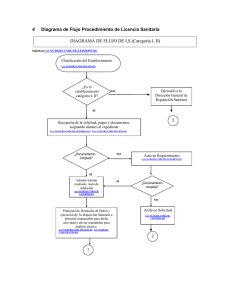
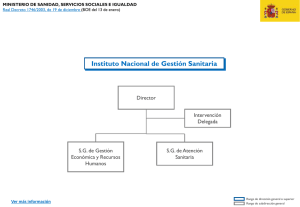
MINISTERIO DE SALUD PÚBLICA Y ASISTENCIA SOCIAL DIRECCIÓN DE REGULACIÓN, VIGILANCIA Y CONTROL DE LA SALUD DEPARTAMENTO DE REGULACIÓN Y CONTROL DE ALIMENTOS SOLICITUD DE REGISTRO SANITARIO DE REFERENCIA (A4 REGISTRO SANITARIO DE ALIMENTOS (NUEVO/RENOVACIÓN)) FS-DRCA-04 VER. 3 / 260423 Página 1 de 3 Llenar hasta la sección 6: LLENARLO A MÁQUINA O EN FORMA ELECTRÓNICA SIN TACHONES NI CORRECCIONES 1. TIPIFICACIÓN DE TRAMITE 1.1 FECHA DE PRESENTACIÓN : 1.2 ORIGEN: 1.3 TIPO DE REGISTRO No. EXPEDIENTE (USO OFICIAL) NACIONAL NUEVO IMPORTADO RENOVACIÓN 1.4 NO. DE REGISTRO SANITARIO: (SOLO PARA TRAMITES DE RENOVACIÓN) UNIÓN EUROPEA 2. IDENTIDAD ADMINISTRATIVA 2.1 TITULAR DEL REGISTRO (LLENADO OBLIGATORIO) 2.1.1 NOMBRE: 2.1.2 NIT: 2.1.3 DIRECCIÓN DEL TITULAR PARA NOTIFICAR: 2.1.4 CORREO ELECTRÓNICO: 2.1.6 TELÉFONO: 2.2 REPRESENTANTE LEGAL DEL TITULAR DEL REGISTRO (PARA PERSONAS JURÍDICAS) 2.2.1 APELLIDOS Y NOMBRES: 2.2.2 TIPO DE DOCUMENTO DE IDENTIFICACIÓN: DPI PASAPORTE 2.2.3 No. DE DOCUMENTO: 2.2.4 TELÉFONO: 2.2.5 CORREO ELECTRÓNICO: 2.2.6 DIRECCIÓN EN GUATEMALA PARA NOTIFICAR: 2.3 EMPRESA FABRICANTE (CAMPOS DE LLENADO OBLIGATORIO) 2.3.1 NOMBRE (TEXTUAL AL CONSIGNADO EN LA LICENCIA SANITARIA): 2.3.3 PAÍS DE FABRICACIÓN 2.3.4 TELEFONO: 2.3.2 NIT: 2.3.5 CORREO ELECTRÓNICO 2.3.6 NO. LICENCIA SANITARIA 2.3.7 DIRECCIÓN EXACTA (TEXTUAL A LA CONSIGNADA EN LA LICENCIA SANITARIA): 2.3.8 FECHA DE VENCIMIENTO 2.4 BODEGA O DISTRIBUIDORA (CAMPOS DE LLENADO OBLIGATORIO) 2.4.1 NOMBRE (TEXTUAL AL CONSIGNADO EN LA LICENCIA SANITARIA): 2.4.3 TELÉFONO: 2.4.2 NIT: 2.4.4 CORREO ELECTRÓNICO: 2.4.5 No. LICENCIA SANITARIA: 2.4.6 FECHA DE VENCIMIENTO: 2.4.7 DIRECCIÓN EXACTA (TEXTUAL A LA CONSIGNADA EN LA LICENCIA SANITARIA): 3. INFORMACIÓN DEL PRODUCTO 3.1 NOMBRE COMERCIAL DEL PRODUCTO (TAL COMO SE DECLARA EN ETIQUETA): 3.2 MARCA DEL PRODUCTO (TAL COMO SE DECLARA EN ETIQUETA): 3.3 TIPO DE PRODUCTO (DESCRIPCIÓN DE LA NATURALEZA DEL PRODUCTO): 3.4 CLASIFICACIÓN (NÚMERO Y NOMBRE), DE LA SUBCATEGORÍA DE ADITIVOS SEGÚN LA NORMA CODEX STAND 192-1995 " NORMA GENERAL PARA LOS ADITIVOS ALIMENTARIOS": 3.5 PAÍS DE PROCEDENCIA: 4. OBSERVACIONES DEL USUARIO 4.1 OBSERVACIONES VARIAS: 4.2 SINÓNIMOS DE ADITIVOS: 5. RESPONSABLE DE CONFORMIDAD CON EL ARTICULO 3 NUMERAL 5 DEL DECRETO 5-2021 DEL CONGRESO DE LA REPÚBLICA LOS DATOS, DECLARACIONES Y DOCUMENTOS PROPORCIONADOS SON AUTÉNTICOS, SUJETÁNDOSE A RESPONSABILIDADES ADMINISTRATIVAS, CIVILES Y PENALES QUE PUEDAN GENERARSE POR FALTA DE VERACIDAD EN LO DECLARADO, PRESENTADO O INFORMADO. 5.1 FIRMA DEL RESPONSABLE DEL PRODUCTO: MINISTERIO DE SALUD PÚBLICA Y ASISTENCIA SOCIAL DIRECCIÓN DE REGULACIÓN, VIGILANCIA Y CONTROL DE LA SALUD DEPARTAMENTO DE REGULACIÓN Y CONTROL DE ALIMENTOS SOLICITUD DE REGISTRO SANITARIO DE REFERENCIA (A4 REGISTRO SANITARIO DE ALIMENTOS (NUEVO/RENOVACIÓN)) FS-DRCA-04 VER.3 / 260423 Página 2 de 3 LLENAR HASTA LA SECCIÓN 6: LLENARLO A MÁQUINA O EN FORMA ELECTRÓNICA SIN TACHONES NI CORRECCIONES 6. DOCUMENTOS QUE ACOMPAÑAN LA SOLICITUD (LOS FOLIOS SON DE LLENADO OBLIGATORIO) 6.1 PARA REGISTRO NUEVO 6.2 PARA RENOVACIÓN DE REGISTRO DOCUMENTACIÓN OBLIGATORIA A PRESENTAR Folio DOCUMENTACIÓN OBLIGATORIA A PRESENTAR Folio A. GENERALES A.1. COMPROBANTE DE PAGO (COPIA RECIBO 63-A2) A.1. COMPROBANTE DE PAGO (COPIA RECIBO 63-A2) A.2. FORMULARIO FS-DRCA-04 EN SU VERSIÓN VIGENTE, DEBIDAMENTE LLENADO FIRMADO. A.2. FORMULARIO FS-DRCA-04 EN SU VERSIÓN VIGENTE, DEBIDAMENTE LLENADO FIRMADO. A.3. ETIQUETA ORIGINAL DEL PRODUCTO: A. PRODUCTOS NACIONALES: EN EL CASO DE PRODUCTOS NUEVOS, PODRÁ PRESENTAR PROYECTO DE ETIQUETA. B. PRODUCTOS IMPORTADOS: PRESENTAR ADEMÁS DE LA ETIQUETA ORIGINAL, EL PROYECTO DE ETIQUETA COMPLEMENTARIA, SI LA ETIQUETA ESTÁ EN IDIOMA DISTINTO AL ESPAÑOL PRESENTAR TRADUCCIÓN AL ESPAÑOL, CUMPLIENDO CON LA NORMA DE ETIQUETADO VIGENTE. LA ETIQUETA DEL PRODUCTO DEBERÁ CUMPLIR CON LOS REGLAMENTOS TÉCNICOS CENTROAMERICANOS Y DEMÁS NORMATIVAS VIGENTES QUE LE APLIQUEN A LA NATURALEZA DEL PRODUCTO. A.3. ETIQUETA ORIGINAL DEL PRODUCTO: A. PRODUCTOS NACIONALES: EN EL CASO DE PRODUCTOS NUEVOS, PODRÁ PRESENTAR PROYECTO DE ETIQUETA. B. PRODUCTOS IMPORTADOS: PRESENTAR ADEMÁS DE LA ETIQUETA ORIGINAL, EL PROYECTO DE ETIQUETA COMPLEMENTARIA, SI LA ETIQUETA ESTÁ EN IDIOMA DISTINTO AL ESPAÑOL PRESENTAR TRADUCCIÓN AL ESPAÑOL, CUMPLIENDO CON LA NORMA DE ETIQUETADO VIGENTE. LA ETIQUETA DEL PRODUCTO DEBERÁ CUMPLIR CON LOS REGLAMENTOS TÉCNICOS CENTROAMERICANOS Y DEMÁS NORMATIVAS VIGENTES QUE LE APLIQUEN A LA NATURALEZA DEL PRODUCTO. B. PARA PRODUCTOS DE FABRICACIÓN NACIONAL B.1. FOTOCOPIA SIMPLE DE LA LICENCIA SANITARIA DE FABRICANTE. (REQUISITO DE B.1. FOTOCOPIA SIMPLE DE LA LICENCIA SANITARIA DE FABRICANTE. (REQUISITO DE PRESENTACIÓN VOLUNTARIA, EL PRESENTAR ESTE REQUISITO REDUCIRA EL TIEMPO EN PRESENTACIÓN VOLUNTARIA, EL PRESENTAR ESTE REQUISITO REDUCIRA EL TIEMPO EN LA LA DURACIÓN TOTAL DEL TRÁMITE). DURACIÓN TOTAL DEL TRÁMITE). C. PARA PRODUCTOS DE FABRICACIÓN EXTRANJERA C.1. FOTOCOPIA SIMPLE DE LICENCIA SANITARIA DE LA BODEGA (DISTRIBUIDOR) OTORGADA POR LA DIRECCIÓN GENERAL DEL SIAS. C.1. FOTOCOPIA SIMPLE DE LICENCIA SANITARIA DE LA BODEGA (DISTRIBUIDOR) OTORGADA POR LA DIRECCIÓN GENERAL DEL SIAS. C.2. ORIGINAL DE CERTIFICADO DE LIBRE VENTA (CLV) [O BIEN, FOTOCOPIA C.2. ORIGINAL DE CERTIFICADO DE LIBRE VENTA (CLV) [O BIEN, FOTOCOPIA AUTENTICADA EN AUTENTICADA EN ORIGINAL (FIRMAS, SELLOS Y TIMBRES ORIGINALES] CON PASES DE ORIGINAL (FIRMAS, SELLOS Y TIMBRES ORIGINALES] CON PASES DE LEY O APOSTILLA LEY O APOSTILLA SEGÚN CORRESPONDA. SI EL CLV AMPARA MAS DE UN PRODUCTO, SE SEGÚN CORRESPONDA. SI EL CLV AMPARA MAS DE UN PRODUCTO, SE PUEDE INGRESAR EL PUEDE INGRESAR EL DOCUMENTO ORIGINAL EN UN EXPEDIENTE Y EN LOS OTROS DOCUMENTO ORIGINAL EN UN EXPEDIENTE Y EN LOS OTROS EXPEDIENTES PRESENTAR EXPEDIENTES PRESENTAR COPIA SIMPLE. COPIA SIMPLE. D. SI LA CLASIFICACIÓN DEL PRODUCTO ES ALTO RIESGO (SEGÚN NORMA TÉCNICA 003-2020, DISPONIBLE EN EL SITIO WEB DEL MSPAS) D.1. PARA PRODUCTOS DE ALTO RIESGO PRESENTAR MUESTRA DEL PRODUCTO PARA ANALISIS ANTE LA DIRECCIÓN DEL LABORATORIO NACIONAL DE SALUD, PARA LA CLASIFICACIÓN DEL PRODUCTO DEBE REVISAR LA NORMA TÉCNICA 003-2020 “NORMA PARA LA CLASIFICACIÓN DE LOS ALIMENTOS PROCESADOS EN ALTO, MEDIANO Y BAJO RIESGO, EL NÚMERO DE MUESTRA A PRESENTAR ESTARÁ ESTABLECIDO POR LA DIRECCIÓN DEL LABORATORIO NACIONAL DE SALUD. NO APLICA PARA RENOVACIÓN DE REGISTROS E. REQUISITOS ADICIONALES (SOLO PARA SUPLEMENTOS Y COMPLEMENTOS) E.1. FÓRMULA CUALITATIVA Y CUANTITATIVA DEL PRODUCTO, EXPRESADA EN UNIDADES E.1. FÓRMULA CUALITATIVA Y CUANTITATIVA DEL PRODUCTO, EXPRESADA EN UNIDADES CONFORME AL SISTEMA INTERNACIONAL DE MEDIDAS, DICHA FÓRMULA DEBE ESTAR CONFORME AL SISTEMA INTERNACIONAL DE MEDIDAS, DICHA FÓRMULA DEBE ESTAR IMPRESA EN HOJA DEBIDAMENTE MEMBRETADA FIRMADA Y SELLADA POR EL IMPRESA EN HOJA DEBIDAMENTE MEMBRETADA FIRMADA Y SELLADA POR EL FABRICANTE. FABRICANTE. E.2.FICHA TÉCNICA DEL PRODUCTO. DICHA FICHA TÉCNICA, COMO MÍNIMO DEBE CONTENER LO SIGUIENTE: 1. NOMBRE DEL PRODUCTO, 2. CONTENIDO NETO, 3. LISTADO DE INGREDIENTES, 4. USO ESPERADO DEL PRODUCTO, 5. CARACTERÍSTICAS NUTRICIONALES, 6. VIDA ÚTIL, 7. CONDICIONES DE ALMACENAMIENTO. E.2.FICHA TÉCNICA DEL PRODUCTO. DICHA FICHA TÉCNICA, COMO MÍNIMO DEBE CONTENER LO SIGUIENTE: 1. NOMBRE DEL PRODUCTO, 2. CONTENIDO NETO, 3. LISTADO DE INGREDIENTES, 4. USO ESPERADO DEL PRODUCTO, 5. CARACTERÍSTICAS NUTRICIONALES, 6. VIDA ÚTIL, 7. CONDICIONES DE ALMACENAMIENTO. 7. PARA ACREDITAR AL REPRESENTANTE LEGAL 7.1. FOTOCOPIA SIMPLE DE DPI O PASAPORTE, SEGÚN CORRESPONDA. 7.1. FOTOCOPIA SIMPLE DE DPI O PASAPORTE, SEGÚN CORRESPONDA. 7.2. DOCUMENTO QUE ACREDITE LA REPRESENTACIÓN LEGAL Y SU INSCRIPCIÓN SEGÚN CORRESPONDA. 7.2. DOCUMENTO QUE ACREDITE LA REPRESENTACIÓN LEGAL Y SU INSCRIPCIÓN SEGÚN CORRESPONDA. PRESENTAR LA PAPELERÍA EN EL ORDEN ESTABLECIDO, EN HOJAS Y FOLDER TAMAÑO OFICIO COLOR MANILA CON GANCHO Y DEBIDAMENTE FOLIADO 8. IDENTIDAD TÉCNICA (EXCLUSIVO USO OFICIAL NO LLENAR) 8.1 NATURALEZA DE PRODUCTO SEGÚN RIESGO (NORMA TÉCNICA 003-2020) ALTO RIESGO MEDIANO RIESGO 8.2. GENÉRICO ASIGNADO. BAJO RIESGO SECCIÓN 9: DICTAMEN FINAL DE APROBACIÓN (EXCLUSIVO USO OFICIAL NO LLENAR) PARA MAYOR INFORMACIÓN ACCEDA Y CONSULTE LOS REGLAMENTOS, FORMULARIOS Y BOLETAS Código de Salud Decreto 90-97 Boleta de pago DRCA Aranceles por servicios técnicos Ac. Gub. 53-2022 Reglamento para la Inocuidad de los Alimentos Ac. Gub. 969-99 PROCEDIMIENTO PARA OTORGAR EL REGISTRO SANITARIO Y LA INSCRIPCIÓN SANITARIA RTCA 67.01.31:07 ETIQUETADO GENERAL DE LOS ALIMENTOS PREVIAMENTE ENVASADOS RTCA 67.01.07:10 ETIQUETADO NUTRICIONAL DE PRODUCTOS ALIMENTICIOS PREENVASADOS PARA CONSUMO HUMANO PARA LA POBLACIÓN A PARTIR DE 3 AÑOS DE EDAD RTCA 67.01.60:10 CRITERIOS MICROBIOLÓGICOS PARA INOCUIDAD DE LOS ALIMENTOS RTCA 67.04.50:17 ADITIVOS ALIMENTARIOS RTCA 67.04.54:18 Registro Sanitario para suplementos alimenticios Norma Técnica No. 01-2022 Portal de la Dirección del Laboratorio Nacional de Salud Otros RTCAs especificos aplicables según la categoría del alimento Ley de comercialización de leche materna Decreto 66-83 Boleta de pago Dirección del Laboratorio Nacional de Salud Normativa Alimentos Fortificados Portal del Departamento de Regulación y Control de Alimentos Presentación de Muestras para productos de ALTO Riesgo Clasificación alimentos ALTO, MEDIANO Y BAJO riesgo Norma Técnica No. 03-2020 DEBE DE TOMA EN CUENTA QUE ESTOS NO SON LOS ÚNICOS REGLAMENTOS, DEBE REVISAR TAMBIÉN NORMAS COGUANOR Y CODEX QUE APLIQUEN SEGÚN LA NATURALEZA DE SU PRODUCTO, ASIMISMO DEBE REVISAR QUE LOS RTCAs QUE ESTÉ UTILIZANDO SEAN LAS VERSIONES ACTUALIZADAS. MINISTERIO DE SALUD PÚBLICA Y ASISTENCIA SOCIAL DIRECCIÓN DE REGULACIÓN, VIGILANCIA Y CONTROL DE LA SALUD DEPARTAMENTO DE REGULACIÓN Y CONTROL DE ALIMENTOS FS-DRCA-04 VER.3 / 260423 SOLICITUD DE REGISTRO SANITARIO DE REFERENCIA (A4 REGISTRO SANITARIO DE ALIMENTOS (NUEVO/RENOVACIÓN)) Página 3 de 3 1. TIPIFICACIÓN DE TRÁMITE 1.1 FECHA DE PRESENTACIÓN DECLARAR FECHA EN QUE SE ESTÁ PRESENTANDO LA SOLICITUD, EN EL FORMATO DÍA / MES / AÑO. 1.2 ORIGEN MARCAR EN LA CASILLA CORRESPONDIENTE EL ORIGEN DEL PRODUCTO QUE SE DESEA INSCRIBIR, YA SEA NACIONAL (HECHO EN GUATEMALA), EXTRANJERO (HECHO EN OTRO PAÍS DISTINTO A LA UNIÓN EUROPEA) Y UNIÓN EUROPEA (HECHO EN ALGUNO DE LOS PAÍSES QUE CONFORMAN LA UNIÓN EUROPEA). 1.3 TIPO DE REGISTRO MARCAR EN LA CASILLA CORRESPONDIENTE SEGÚN SEA EL CASO, SI ES UN REGISTRO NUEVO (PRIMER INGRESO ANTE EL DEPARTAMENTO DE REGULACIÓN Y CONTROL DE ALIMENTOS) O RENOVACIÓN (PRODUCTO QUE YA SE LE HA ASIGNADO UN REGISTRO SANITARIO ANTERIORMENTE Y QUE NO HA CAMBIADO DE FORMULACIÓN). 1.4 No. DE REGISTRO SANITARIO LLENAR ESTA CASILLA SOLO SI ES RENOVACIÓN DEL REGISTRO SANITARIO. COLOCAR NÚMERO DE REGISTRO SANITARIO OTORGADO POR EL DEPARTAMENTO DE REGULACIÓN Y CONTROL DE ALIMENTOS DEL MINISTERIO DE SALUD QUE SE DESEA RENOVAR. 2. IDENTIDAD ADMINISTRATIVA 2.1. TITULAR DEL REGISTRO 2.1.1. NOMBRE NOMBRE DE LA PERSONA INDIVIDUAL O JURÍDICA QUE TENDRÁ LA RESPONSABILIDAD Y REPRESENTACIÓN LEGAL DE LOS DERECHOS Y OBLIGACIONES QUE EL REGISTRO SANITARIO REPRESENTA. 2.1.2. NIT DECLARAR NÚMERO DE IDENTIFICACIÓN TRIBUTARIA DEL REPRESENTE LEGAL. 2.1.3. DIRECCIÓN DEL TITULAR PARA NOTIFICAR DIRECCIÓN COMPLETA PARA RECIBIR NOTIFICACIONES. 2.1.4. CORREO ELECTRÓNICO DIRECCIÓN DE CORREO ELECTRÓNICO DE LA PERSONA ENCARGADA DEL TRÁMITE, PARA NOTIFICAR. 2.1.6 TELÉFONO NÚMERO DE TELÉFONO DE LA PERSONA ENCARGADA DEL TRÁMITE, PARA NOTIFICAR. 2.2. REPRESENTANTE LEGAL (SOLO PARA PERSONAS JURÍDICAS) 2.2.1. APELLIDOS Y NOMBRES DEBERÁ DE INDICAR EL NOMBRE COMPLETO DEL REPRESENTANTE LEGAL DE LA EMPRESA, A QUIEN SE LE OTORGÓ EL MANDATO LEGAL DE REPRESENTACIÓN, DATOS QUE DEBEN COINCIDIR CON EL DOCUMENTO QUE ACREDITE LA REPRESENTACIÓN LEGAL, PRESENTADO EN ESTE EXPEDIENTE. 2.2.2. TIPO DE DOCUMENTO DE IDENTIFICACIÓN SELECCIONAR EL TIPO DE DOCUMENTO DE IDENTIFICACIÓN DEL REPRESENTANTE LEGAL DE LA EMPRESA, MISMO QUE DEBE COINCIDIR CON LA COPIA PRESENTADA EN ESTE EXPEDIENTE. 2.2.3. No. DOCUMENTO INDICARSE EL NÚMERO DE DOCUMENTO DE IDENTIFICACIÓN, MISMO QUE DEBE DE COINCIDIR CON LA COPIA PRESENTADA EN ESTE EXPEDIENTE. 2.2.4. TELÉFONO NÚMERO DE TELÉFONO DEL REPRESENTANTE LEGAL DE LA EMPRESA. 2.2.5. EMAIL DIRECCIÓN DE CORREO ELECTRÓNICO DEL REPRESENTANTE LEGAL DE LA EMPRESA. 2.2.6 DIRECCIÓN EXACTA DIRECCIÓN COMPLETA UBICADA EN GUATEMALA DEL REPRESENTANTE LEGAL DE LA EMPRESA TITULAR, PARA RECIBIR NOTIFICACIONES. 2.3. EMPRESA FABRICANTE 2.3.1. NOMBRE (TEXTUAL AL CONSIGNADO EN LA LICENCIA SANITARIA) PARA PRODUCTOS NACIONALES DEBERÁ ANOTARSE EL NOMBRE DE LA PERSONA INDIVIDUAL O JURÍDICA QUE ELABORA EL ALIMENTO QUE DEBE ESTAR TEXTUAL AL CONSIGNADO EN LA LICENCIA SANITARIA EMITIDA POR EL DRCA. PARA PRODUCTOS IMPORTADOS DEBERÁ INDICARSE EL NOMBRE DEL FABRICANTE EN EL PAÍS DE ORIGEN QUE COINCIDA CON CLV, ETIQUETA O FICHA TÉCNICA. 2.3.2. NIT PARA PRODUCTOS NACIONALES COLOCAR EL NÚMERO DE IDENTIFICACIÓN TRIBUTARIA DE LA FÁBRICA. PARA PRODUCTOS IMPORTADOS COLOCAR N/A O NO APLICA. 2.3.3. PAÍS DE FABRICACIÓN COLOCAR EL NOMBRE DEL PAÍS EN EL QUE EL PRODUCTO FUE PRODUCIDO. 2.3.4. TELÉFONO COLOCAR EL NÚMERO DE TELÉFONO DE LA FABRICA. 2.3.5. CORREO ELECTRÓNICO COLOCAR LA DIRECCIÓN DE CORREO ELECTRÓNICO DE LA FABRICA . 2.3.6. No. DE LICENCIA SANITARIA PARA PRODUCTOS NACIONALES COLOCAR EL NÚMERO DE LICENCIA SANITARA DE FABRICANTE, QUE DEBE ESTAR TEXTUAL AL CONSIGNADO EN LA LICENCIA EMITIDA POR EL DRCA, PARA PRODUCTOS IMPORTADOS COLOCAR N/A O NO APLICA. PARA PRODUCTOS IMPORTADOS CONSIGNAR NO APLICA N/A. 2.3.7. DIRECCIÓN EXACTA (TEXTUAL AL CONSIGNADO EN LA LICENCIA SANITARIA) DIRECCIÓN COMPLETA DE LA FÁBRICA, EN EL CASO DE PRODUCTOS NACIONALES ESTA INFORMACIÓN DEBE SER TEXTUAL A LA CONSIGNADA EN LA LICENCIA SANITARIA EMITIDA POR EL DRCA. PARA PRODUCTOS IMPORTADOS CONSIGNAR NO APLICA N/A. 2.3.8. FECHA DE VENCIMIENTO FECHA EN LA QUE VENCE LA LICENCIA SANITARIA MENCIONADA EN EL INCISO 2.3.6, ESTA INFORMACIÓN DEBE SER TEXTUAL A LA CONSIGNADA EN LA LICENCIA SANITARIA. PARA PRODUCTOS IMPORTADOS CONSIGNAR NO APLICA N/A. 2.4. BODEGA O DISTRIBUIDORA 2.4.1. NOMBRE RAZÓN SOCIAL DEL DISTRIBUIDOR DEL PRODUCTO, DEBE ESTAR TEXTUAL AL CONSIGNADO EN LA LICENCIA SANITARIA EMITIDA POR EL SIAS. 2.4.2. NIT COLOCAR EL NÚMERO DE IDENTIFICACIÓN TRIBUTARIA DEL DISTRIBUIDOR. 2.4.3. TELÉFONO COLOCAR EL NÚMERO DE TELÉFONO DEL DISTRIBUIDOR. 2.4.4. CORREO ELECTRÓNICO COLOCAR LA DIRECCIÓN DE CORREO ELECTRÓNICO DEL DISTRIBUIDOR. 2.4.5. No. DE LICENCIA SANITARIA COLOCAR EL NÚMERO DE LA LICENCIA SANITARIA, INFORMACIÓN QUE DEBE ESTAR TEXTUAL A LA CONSIGNADA EN LA LICENCIA SANITARIA OTORGADA POR EL SIAS. 2.4.6. FECHA DE VENCIMIENTO FECHA EN LA QUE VENCE LA LICENCIA SANITARIA MENCIONADA EN EL INCISO 2.4.5. DIRECCIÓN COMPLETA DE LA BODEGA, EN EL CASO DE PRODUCTOS NACIONALES ESTA INFORMACIÓN DEBE SER TEXTUAL A LA CONSIGNADA EN LA LICENCIA SANITARIA EMITIDA POR EL SIAS. 2.4.7. DIRECCIÓN EXACTA 3. INFORMACIÓN DEL PRODUCTO 3.1. NOMBRE COMERCIAL DEL PRODUCTO COLOCAR EL NOMBRE COMERCIAL DEL PRODUCTO (NOMBRE CON EL QUE SE CONOCERÁ EN EL MERCADO) MISMO QUE DEBERÁ COINCIDIR CON LA ETIQUETA ORIGINAL Y/O DOCUMENTOS PRESENTADOS. SI EL NOMBRE DE UN PRODUCTO IMPORTADO ESTÁ EN OTRO IDIOMA DISTINTO AL ESPAÑOL, DEBERÁ COLOCAR EL NOMBRE TAL CUAL ESTÁ EN LA ETIQUETA ORIGINAL Y OPCIONALMENTE ENTRE PARÉNTESIS, LA TRADUCCIÓN AL ESPAÑOL. 3.2. MARCA DEL PRODUCTO COLOCAR LA MARCA COMERCIAL DEL PRODUCTO, MISMA QUE DEBE COINCIDIR CON LA DECLARADA EN LA ETIQUETA ORIGINAL O NO APLICA N/A SI EL PRODUCTO NO CUENTA CON MARCA. 3.3. TIPO DE PRODUCTO DESCRIBIR LA VERDADERA NATURALEZA DEL PRODUCTO. DEBE TOMAR EN CUENTA QUE ESTE INCISO NO SE REFIERE CON NATURALEZA A REALIZAR UN LISTADO DE INGREDIENTES O DESCRIPCIÓN DE MATERIAL DE EMPAQUE. 3.4. CLASIFICACIÓN (NÚMERO Y NOMBRE), DE LA SUBCATEGORÍA DE ADITIVOS COLOCAR EL NÚMERO Y NOMBRE DE LA SUBCATEGORÍA DEL ALIMENTO EN LA CUAL SE CLASIFICA EL PRODUCTO DE ACUERDO A LO ESTABLECIDO EN EL ANEXO B SISTEMA DE CLASIFICACIÓN DE LOS ALIMENTOS DE LA NORMA CODEX STAND 192-1995 " NORMA GENERAL PARA LOS ADITIVOS ALIMENTARIOS", EN SU VERSIÓN VIGENTE. 3.5. PAÍS DE PROCEDENCIA DECLARAR EL PAÍS DE DONDE PROVIENE EL PRODUCTO. EN EL CASO DE PRODUCTOS IMPORTADOS, EL PAÍS DE PROCEDENCIA PUEDE SER DISTINTO AL PAÍS DE FABRICACIÓN. 4. OBSERVACIONES DEL USUARIO 4.1. OBSERVACIONES VARIAS EN ESTA SECCIÓN PUEDE COLOCAR CUALQUIER COMENTARIO ADICIONAL REFERENTE AL PRODUCTO QUE SE DESEA INSCRIBIR, Y QUE CREA NECESARIO QUE EL EVALUADOR CONOZCA Y PUEDA TOMAR EN CUENTA AL MOMENTO DE REVISAR SU EXPEDIENTE. SI NO HAY OBSERVACIONES COLOCAR N/A (NO APLICA). 4.2. SINÓNIMOS DE ADITIVOS EN EL CASO QUE EL PRODUCTO CONTENGA ADITIVOS DECLARADOS EN ETIQUETA CON UN NOMBRE DISTINTO AL QUE APARECE EN LA NORMA CODEX STAND 192-1995 “NORMA GENERAL PARA LOS ADITIVOS ALIMENTARIOS” O EN EL RTCA 67.04.54:18 "ALIMENTOS Y BEBIDAS PROCESADAS. ADITIVOS ALIMENTARIOS. ESPECIFICACIONES" PODRÁ DECLARARLOS DE ESTA MANERA, SIEMPRE Y CUANDO EN EL INCISO 4.2, INDIQUE EL NOMBRE SINÓNIMO CON EL QUE EL ADITIVO APARECE EN LAS NORMAS CODEX STAND 192-1995 Y RTCA 67.04.54:18. 5. ACEPTACIÓN DEL TITULAR (REPRESENTANTE LEGAL) DE LA EMPRESA SOLICITANTE 5.1 FIRMA DEL RESPONSABLE DEL PRODUCTO FIRMA DEL PROPIETARIO (SI ES PERSONA INDIVIDUAL) O REPRESENTANTE LEGAL (SI ES PERSONA JURÍDICA) DE LA EMPRESA DE CUYO NOMBRE SE SOLICITA EL REGISTRO. 6. DOCUMENTOS QUE ACOMPAÑAN LA SOLICITUD 6.1 PARA NUEVO REGISTRO SI SU TRÁMITE ES DE REGISTRO NUEVO EN LA SECCIÓN 6.1 EN LOS ESPACIOS DE FOLIO, DEBE COLOCAR EL NÚMERO DE FOLIO EN EL QUE SE ENCUENTRA CADA DOCUMENTO, DEBE TOMAR EN CUENTA QUE LOS DOCUMENTOS DEBEN PRESENTARSE EN EL MISMO ORDEN ESTABLECIDO EN ESTE INCISO, TODO DOCUMENTO ADICIONAL QUE ANEXE, DEBERÁ ENCONTRASE SEGUIDO DE LOS REQUISITOS OBLIGATORIOS. 6.2 PARA RENOVACIÓN DE REGISTRO SI SU TRÁMITE ES DE RENOVACIÓN DE REGISTRO EN LA SECCIÓN 6.2 EN LOS ESPACIOS DE FOLIO, DEBE DE COLOCAR EL NÚMERO DE FOLIO EN EL QUE SE ENCUENTRA CADA DOCUMENTO, DEBE DE TOMAR EN CUENTA QUE LOS DOCUMENTOS DEBEN DE PRESENTARSE EN EL MISMO ORDEN ESTABLECIDO EN ESTE INCISO, TODO DOCUMENTO ADICIONAL QUE ANEXE, DEBERÁ DE ENCONTRASE SEGUIDO DE LOS REQUISITOS OBLIGATORIOS. 7. PARA ACREDITAR AL REPRESENTANTE LEGAL 7.1. FOTOCOPIA SIMPLE DE DPI O PASAPORTE, SEGÚN CORRESPONDA 7.2 DOCUMENTO QUE ACREDITE LA REPRESENTACIÓN LEGAL COPIA DEL DPI VIGENTE DEL REPRESENTANTE LEGAL DE LA EMPRESA. DOCUMENTO VIGENTE QUE ACREDITA LA REPRESENTACIÓN LEGAL DE LA PERSONA. 8. IDENTIDAD TÉCNICA 8.1 NATURALEZA DEL PRODUCTO POR RIESGO ESTE INCISO ES DE PARA USO OFICIAL DE LA SECCIÓN DE EVALUACIÓN DEL DRCA DEBE DEJARLO EN BLANCO. 8.2 NATURALEZA DEL PRODUCTO POR RIESGO ESTE INCISO ES DE PARA USO OFICIAL DE LA SECCIÓN DE EVALUACIÓN DEL DRCA DEBE DEJARLO EN BLANCO. 9. DICTAMEN FINAL DE APROBACIÓN (EXCLUSIVO USO OFICIAL NO LLENAR) 9.1. SELLO DE APROBADO ESTE INCISO ES DE PARA USO OFICIAL DE LA SECCIÓN DE EVALUACIÓN DEL DRCA DEBE DEJARLO EN BLANCO.